DISTRIBUSI SEL INSULIN PANKREAS
PADA TIKUS HIPERGLIKEMIA
YANG DIBERI DIET TEMPE
EKA DENIK INDAH FUSPITA RUNIANA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi Distribusi Sel Insulin Pankreas pada Tikus Hiperglikemia yang Diberi Diet Tempe adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2009
EKA DENIK INDAH FUSPITA RUNIANA. Distribution of Pancreatic Endokrine Cells on Hypperglychaemic Rat After Treatment of Tempe Diet. Under direction of EKOWATI HANDHARYANI and ADI WINARTO
The objective of this research is to understand the curative potential of tempe diet on distribution of pancreatic endocrine cells on hypperglichaemic rat after of streptozotocin (STZ). There were 12 male Sprague-Dawley rats which were used in this study. The rats were divided into 4 groups that K1 (control group); K2 (untreated diabetic group); T1 (diabetic tempe 1 treated group); T2 (diabetic tempe 2 treated group). On the day 7 after inducing STZ, tempe diet were given to the treated diabetic groups up to day 21st. At the end of this research all rats were sacrificed and pancreatic tissues were histopathologically processed. In this research Hematoxylin and Eosin staining was used to evaluate the pancreatic endocrine cell change and insulin cell population was studied by immunostaining using antibody anti insulin. The results indicate that the pancreatic endocrine cell degeneration and insulin cell population of tempe treated groups were improved after tempe consumption.
EKA DENIK INDAH FUSPITA RUNIANA. Distribusi Sel Insulin Pankreas pada Tikus Hiperglikemia yang Diberi Diet Tempe. Dibimbing oleh EKOWATI HANDHARYANI and ADI WINARTO
Menurut data World Health Organization (WHO), Indonesia menempati urutan ke-4 terbesar dalam jumlah penderita diabetes melitus di dunia. Pada tahun 2000 terdapat sekitar 5.6 juta penduduk Indonesia yang mengidap diabetes. Namun pada tahun 2006 diperkirakan jumlah penderita diabetes di Indonesia meningkat tajam menjadi 14 juta orang, dimana baru 50% yang sadar mengidapnya dan di antara mereka baru sekitar 30% yang datang berobat teratur. Komplikasi diabetes melitus terjadi pada semua organ dalam tubuh yang dialiri pembuluh darah kecil dan besar dengan penyebab kematian 50% akibat penyakit jantung koroner dan 30% akibat gagal ginjal. Selain kematian, diabetes melitus juga menyebabkan kecacatan. Sebanyak 30% penderita diabetes melitus mengalami kebutaan akibat komplikasi retinopati dan 10% harus menjalani amputasi tungkai kaki.
Pola hidup yang sehat dengan makanan yang terkontrol dapat menekan munculnya penyakit diabetes melitus. Selain sayuran dan buah, tempe juga merupakan makanan sumber protein nabati yang memiliki komposisi asam amino yang tinggi. Badan kesehatan dunia (WHO) bahkan mengakui bahwa tempe sebagai makanan berkhasiat yang dapat mencegah dan mengatasi berbagai penyakit. Hal inilah yang menjadi dasar peneliti untuk mengetahui tentang pengaruh diet tempe terhadap distribusi sel insulin pankreas pada tikus yang menderita diabetes melitus setelah diinduksi dengan steptozotocin (STZ).
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian diet tempe terhadap distribusi sel insulin pankreas pada keadaan hiperglikemia dari tikus model diabetes dengan induksi streptozotocin (STZ). Sebanyak 12 ekor tikus jantan (Rattus norvegicus) galur Sprague-Dawley berumur 8 minggu digunakan pada penelitian ini. Tikus dibagi menjadi 4 kelompok, yaitu K1 (kontrol), K2 (diinduksi STZ), T1 (diinduksi STZ dan diberi diet tempe mengandung arginin 1.4%) dan T2 (diinduksi STZ dan diberi diet tempe mengandung arginin 1.6%). Pada hari ke-7 pasca induksi STZ dilakukan pemberian diet tempe setiap hari sampai hari ke-21. Pada hari ke 21 pasca pemberian STZ dilakukan nekropsi, dilanjutkan dengan pembuatan preparat histopatatologi.
Evaluasi histopatologi dilakukan terhadap perubahan dan populasi sel endokrin pankreas di dalam pulau Langerhans menggunakan pewarnaan hematoksilin dan eosin (HE) serta pewarnaan imunohistokimia dengan antibodi anti insulin. Hasil pengamatan histopatologis pada K1 terlihat adanya keteraturan susunan sel endokrin yang menyebar memenuhi pulau Langerhans dengan ukuran sel yang seragam dan bentuk sitoplasma terlihat proporsional terhadap besar inti serta tidak mengalami perubahan (normal). Sedangkan pada K2 menunjukkan adanya lesio pada pulau Langerhans berupa degenerasi sel-sel endokrin, dan beberapa sel menunjukkan nekrosa.
endokrin khususnya sel beta akibat induksi STZ, sehingga sekresi insulin dapat ditingkatkan.
Pengamatan dengan imunohistokimia dilakukan secara deskriptif dengan melihat populasi dan tampilan kadar reaksi Ag dan Ab sel beta yang mengalami perubahan. Reaksi positif keberadaan insulin pada sel-sel beta ditunjukkan dengan perubahan yang berwarna coklat pada sel-sel tersebut. Distribusi sel beta pada K2 lebih sedikit jika dibandingkan dengan K1, sesuai dengan hasil pewarnaan HE bahwa sebagian besar sel-sel beta mengalami degenerasi-nekrosa setelah pemberian STZ. Perusakan STZ terhadap sel beta mengakibatkan sel mengalami apoptosis bahkan sampai nekrosis, sehingga proses biosintesis dan sekresi insulin terhambat.
Pemberian diet tempe T1 mampu meningkatkan persentase distribusi sel beta yang aktif menghasilkan insulin. Jumlah sel beta yang menunjukkan reaksi positif merupakan indikasi aktifitas sekresi insulin yang dihasilkan. Sekresi insulin pada T1 meningkat mendekati K1, sedangkan pada T2 meningkat mendekati K2. Penurunan jumlah sekresi insulin oleh sel beta bisa disebabkan oleh degenerasi sel beta sehingga mengakibatkan penurunan fungsi dari sel beta yang akan mempengaruhi produksi sekresi insulin.
Hasil penelitian menunjukkan bahwa pemberian diet tempe dapat memperbaiki degenerasi dan nekrosa sel endokrin pankreas yang terjadi pada tikus model diabetes. Evaluasi dengan metode imunohistokimia menunjukkan bahwa pemberian diet tempe dapat meningkatkan populasi sel insulin pankreas.
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
YANG DIBERI DIET TEMPE
EKA DENIK INDAH FUSPITA RUNIANA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Nama : Eka Denik Indah Fuspita Runiana
NRP : B04052558
Disetujui Komisi Pembimbing
Pembimbing I Pembimbing II
Dr. drh. Ekowati Handharyani, MS. Dr. drh. Adi Winarto NIP. 19591217 198601 2001 NIP. 19580516 198601 1001
Diketahui
Wakil Dekan Fakultas Kedokteran Hewan
Dr. Nastiti Kusumorini 19621205 1987032 001
Tidak ada kata yang terucap selain alhamdulillahhirobbil’alamin atas segala petunjuk dan kemudahan-Nya sehingga karya ilmiah ini dapat penulis selesaikan dengan baik. Puji syukur ke hadirat Allah SWT yang telah memberikan lindungan, bimbingan, dan kasih sayang serta limpahan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penyusunan skripsi ini yang berjudul ”Distribusi Sel Insulin Pankreas pada Tikus Hiperglikemia yang Diberi diet Tempe” yang disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Melalui kesempatan ini penulis ingin mengucapkan terima kasih yang sebesar-besarnya dan penghargaan yang setinggi-tingginya kepada: 1. Bapak dan Ibu tercinta Kasruni, SP dan Hartatik yang selalu
memberikan doa, semangat dan kasih sayangnya kepada penulis. 2. Dr. drh. Ekowati Handharyani, MS. dan Dr. drh. Adi Winarto sebagai
dosen pembimbing yang telah dengan sabar meluangkan waktu memberikan bimbingan, didikan dan perhatian kepada penulis hingga terselesainya skripsi ini.
3. Dr. drh. Denny Widaya Lukman, MSc. sebagai dosen penguji yang bersedia meluangkan waktu untuk menilai dan memberikan masukan dalam skripsi ini.
4. Dr. drh. Dewi Ratih Agungpriyono sebagai dosen pembimbing akademik yang telah memberikan semangat, motivasi dan nasehat selama penulis kuliah.
5. Pak Soleh, Pak Kasnadi, dan Pak Endang selaku staf di Laboratorium Patologi yang telah banyak membantu selama penulis melakukan penelitian.
Agus sebagai keluarga penulis yang sangat mendukung dan memberikan semangat dan doanya.
8. Sabto Agung Kurniawan, S.KH atas iringan doa, bimbingan, motivasi dan bantuannya baik secara moral maupun material.
9. Keluarga Cempaka 29 Rista, A’Tedi, Teh Fini, A’Keke, Ria dan Excel.
10. Teman-teman Goblet 42, Ornith, IMPATA dan pihak-pihak yang sudah banyak membantu penulis.
Penulis menyadari adanya kekurangan-kekurangan dalam tulisan ini, oleh karena itu kritik dan saran yang membangun sangat penulis harapkan. Semoga karya ilmiah ini dapat bermanfaat bagi semua pihak yang membutuhkan.
Bogor, Agustus 2009
Penulis dilahirkan di Magetan pada tanggal 29 Mei 1986. Penulis adalah putri pertama dari empat bersaudara pasangan Bapak Kasruni, SP dan Ibu Hartatik. Penulis menyelesaikan pendidikan dasar di Sekolah Dasar Negeri Krowe 1 Lembeyan pada tahun 1993, kemudian melanjutkan pendidikan di SLTP Negeri 1 Magetan dan lulus pada tahun 2002. Pada tahun 2005 penulis menyelesaikan studi dari SMU Negeri 1 Magetan, dan pada tahun yang sama penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI). Setelah lulus Tahap Persiapan Bersama (TPB) penulis masuk ke Fakultas Kedokteran Hewan Institut Pertanian Bogor dengan pilihan pertama.
Selama studi di IPB penulis aktif mengikuti beberapa organisasi intra dan ekstra kampus antara lain: anggota Divisi Pendidikan Himpunan Profesi Ornithologi dan Unggas tahun 2006-2007, Ketua Himpunan Profesi Ornithologi dan Unggas periode 2007-2008, Forum Mahasiswa Indonesia Tanggap Flu Burung (FMITFB) sebagai duta profesi, dan dalam Organisasi Mahasiswa Daerah (OMDA) IMPATA (Ikatan Mahasiswa, Pelajar dan Alumni Magetan) sebagai Bendahara.
x
Penyebab Diabetes Melitus ... 4
Macam Diabetes Melitus ...4
Gejala Klinis Diabetes Melitus ...6
Diagnosa Diabetikum ... 6
Komplikasi Diabetes Melitus ... 7
Pengobatan Diabetes Melitus ... 9
Kelenjar Pankreas ...11
Anatomi Fisiologis Kelenjar Pankreas ...11
Macam Sel Pulau Langerhans Pankreas ...12
Insulin ...13
Streptozotosin (STZ) ...15
Tempe ...16
Kandungan pada Tempe ...17
Khasiat dan Manfaat Mengkonsumsi Tempe ...19
III. MATERI DAN METODOLOGI Waktu dan Tempat Penelitian ...21
Hewan Penelitian ...21
Materi Penelitian ... 21
Metode Penelitian ...22
Pembuatan Tempe...22
Tikus Model Diabetes...22
Metode Penelitian ...23
Pengukuran Kadar Gula Darah ...………...24
Pengambilan Organ Pankreas ………...24
Pembuatan Preparat Histopatologi ………...25
Pewarnaan Hematoksilin Eosin (HE) ………...25
Pewarnaan Imunohistokimia ………...26
xi
Kadar Gula Darah ...29
Pengamatan Organ Pankreas dengan Pewarnaan Hematoksilin Eosin ...31
Pengamatan Insulin dengan Pewarnaan Imonohistokimia ...35
V. KESIMPULAN DAN SARAN Kesimpulan ... 38
Saran ...38
DAFTAR PUSTAKA ... 39
xii Halaman
1 Kriteria diagnostik gula darah pada manusia ... 7
2 Tipe sel pada pulau Langerhans ………..………..12
3 Komposisi zat gizi kedelai dan tempe dalam 100 g bahan segar dan 100 g bahan kering ... 18
4 Kelompok perlakuan tikus ... 23
5 Tingkat keberhasilan pembuatan model diabetes ... 28
6 Rataan kadar gula darah pada kelompok tikus ... 29
xiii Halaman
1 Penyuntikan STZ di peritoneum ...23
2 Tikus dalam kandang metabolisme ... ... 24
3 Rataan kadar gula darah pada hari ke-7 dan 21 pascainduksi STZ ... 30
4 Gambaran histopatologi pankreas ...32
5 Gambaran histopatologi pankreas ... 33
6 Gambaran histopatologi pankreas ...35
xiv Halaman
1 Skema prosedur pembuatan tempe ...42
2 Proses preparasi jaringan .. ... 43
3 Proses pewarnaan hematoksilin-eosin (HE) ...44
4 Pewarnaan imunohistokimia ...45
PENDAHULUAN
1.1 Latar Belakang
Banyak orang yang masih mengganggap penyakit diabetes merupakan penyakit orang tua atau penyakit yang hanya timbul karena faktor keturunan. Padahal setiap orang dapat mengidap diabetes, baik tua maupun muda. Menurut data World Health Organization (WHO), Indonesia menempati urutan ke-4 terbesar dalam jumlah penderita diabetes melitus di dunia. Pada tahun 2000 terdapat sekitar 5.6 juta penduduk Indonesia yang mengidap diabetes. Namun pada tahun 2006 diperkirakan jumlah penderita diabetes di Indonesia meningkat tajam menjadi 14 juta orang, dimana baru 50% yang sadar mengidapnya dan di antara mereka baru sekitar 30% yang datang berobat teratur (Soegondo 2006).
Pada saat ini banyak penderita diabetes melitus yang tidak menyadari dirinya mengidap penyakit yang lebih sering disebut penyakit gula atau kencing manis. Hal ini mungkin disebabkan minimnya informasi di masyarakat tentang diabetes melitus terutama gejala-gejalanya. Mereka yang memiliki resiko tinggi terkena diabetes adalah yang memiliki riwayat keluarga mengidap diabetes melitus, memasuki usia di atas 40 tahun, kegemukan, tekanan darah tinggi, selain tentu saja pola makan yang salah. Umumnya penderita diabetes melitus mengetahui dirinya mengidap diabetes setelah terjadi komplikasi.
Pada saat ini diabetes melitus merupakan masalah kesehatan dunia yang menghinggapi hampir seluruh lapisan masyarakat dunia. Menurut Renold (1982) tidak kurang dari 30 juta penduduk dunia mengidap penyakit ini dan makin bertambah sesuai bertambahnya panjang harapan hidup. Di negara maju diabetes melitus merupakan problem utama. Penyakit ini seperti rayap, bekerja diam-diam merusak organ di dalam tubuh sehingga sering disebut sebagai “The Silent Killer”. Gejala diabetes melitus tidak menakutkan, seperti banyak makan (polifagi), banyak minum (polidipsi), dan kencing banyak (poliuri) sehingga dengan gejala seperti itu orang tidak pergi ke dokter. Sebaliknya jika tidak mau makan dan susah kencing, baru orang pergi ke dokter.
Pola hidup yang sehat dengan makanan yang terkontrol dapat menekan munculnya penyakit diabetes melitus. Selain sayur-sayuran dan buah-buahan, tempe juga merupakan makanan sumber protein nabati yang memiliki komposisi asam amino yang tinggi. Bahkan World Health Organization (WHO) mengakui bahwa tempe sebagai makanan berkhasiat yang dapat mencegah dan mengatasi berbagai penyakit (Avidra 2008).
1.2 Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian diet tempe terhadap distribusi sel insulin pankreas pada tikus hiperglikemia setelah diinduksi dengan streptozotocin (STZ).
1.3 Manfaat
T
I
NJAUAN PUSTAKA
2.4 Diabetes Melitus
Diabetes melitus berasal dari kata Yunani diabainein, "tembus" atau "pancuran air", dan kata Latin mellitus, "rasa manis" yang umum dikenal sebagai kencing manis adalah penyakit yang ditandai dengan hiperglisemia (peningkatan kadar gula darah) yang terus-menerus dan bervariasi, terutama setelah makan (Anonim2007). Menurut Tim FKUI (1999) menyebutkan bahwa yang dimaksud dengan diabetes melitus adalah keadaan hiperglikemia kronik disertai berbagai kelainan metabolik akibat gangguan hormonal yang menimbulkan berbagai komplikasi kronik pada mata, ginjal, dan pembuluh darah, disertai lesi pada membran basalis dalam pemeriksaan dengan mikroskop elektron.
Diabetes melitus terjadi jika tubuh tidak menghasilkan insulin yang cukup untuk mempertahankan kadar gula darah yang normal atau jika sel tidak memberikan respon yang tepat terhadap insulin (Soegondo 2006; Irianto 2004). Diabetes melitus yaitu keadaan hiperglikemia menahun yang akan mengenai seluruh sistem, dan merupakan hasil interaksi antara lingkungan dan benih. Keadaan ini disebabkan adanya faktor yang menghambat kerja insulin atau jumlah insulin menurun.
2.4.4 Penyebab Diabetes Melitus
Diabetes melitus disebabkan oleh gangguan metabolisme yang menghambat aktivitas insulin, antara lain pada kasus peningkatan aktivitas glukagon atau produksi insulin yang kurang. Kekurangan insulin disebabkan oleh perubahan degeneratif dari sel-sel beta, penurunan efektifitas hormon dan tumor endokrin yang menyebabkan penurunan sekresi hormon. Perubahan degeneratif dari sel beta pankreas sering merupakan akibat sekunder adanya peradangan pada bagian eksokrin. Lesio degeneratif seperti vakuolisasi sitoplasma akibat akumulasi glikogen dalam sel, sering ditemukan pada kasus resistensi insulin.
Menurut Misnadiarty (2006) berpendapat bahwa dengan meningkatnya umur, maka intoleransi terhadap glukosa juga meningkat. Intoleransi glukosa pada usia lanjut berkaitan dengan obesitas, aktivitas fisik yang kurang, berkurangnya massa otot, penyakit penyerta dan penggunaan obat-obatan sehingga terjadi penurunan sekresi insulin dan resistensi insulin. Penyebab diabetes lainnya adalah: kadar kortikosteroid yang tinggi, kehamilan (diabetes gestasional) yang akan hilang setelah melahirkan, obat-obatan yang dapat merusak pankreas dan racun yang mempengaruhi pembentukan atau efek dari insulin (Anonim 2007).
2.4.2 Macam Diabetes Melitus
Menurut Misnadiarty (2006), diabetes melitus diklasifikasikan menjadi dua tipe yaitu diabetes tipe 1 dan diabetes melitus tipe 2. Diabetes melitus tipe 1 disebut dengan insulin-dependent diabetes (IDDM, "diabetes yang bergantung pada insulin"), atau diabetes anak-anak dimana penderita menghasilkan insulin sedikit atau sama sekali tidak menghasilkan insulin. Hal ini dicirikan dengan hilangnya sel beta penghasil insulin pada pulau-pulau Langerhans pankreas sehingga terjadi kekurangan insulin pada tubuh. Diabetes tipe 1 memiliki karakteristik mudah terjadi ketoasidosis, pengobatanya harus dengan insulin, onset kuat, penderita biasanya kurus, terjadi pada umur muda, didapat antibodi sel insulin, 10% ada riwayat diabetes pada keluarga, 30-50% terjadi pada kembar identik.
autoimunitas tersebut dapat dipicu oleh adanya infeksi pada tubuh. Hampir 90% sel penghasil insulin atau sel beta mengalami kerusakan permanen. Akibatnya terjadi kekurangan insulin yang berat dan penderita harus mendapatkan suntikan insulin secara teratur. Diabetes melitus Tipe 1 umumnya terjadi sebelum usia 30 tahun, yaitu anak-anak dan remaja. Para ilmuwan percaya bahwa faktor lingkungan (berupa infeksi virus atau faktor gizi pada masa kanak-kanak atau dewasa awal) menyebabkan sistem kekebalan menghancurkan sel penghasil insulin di pankreas. Untuk terjadinya hal ini diperlukan kecenderungan genetik dan keluarga (Anonim 2007).
Diabetes melitus tipe 2 disebut non-insulin-dependent diabetes melitus (NIDDM, "diabetes yang tidak bergantung pada insulin") terjadi karena kombinasi dari kecacatan dalam produksi insulin dan resistensi terhadap insulin atau berkurangnya sensitifitas terhadap insulin (adanya defek respon jaringan terhadap insulin) yang melibatkan gangguan reseptor insulin di membran sel, maka transpor glukosa ke dalam sel terganggu. Akibatnya kadar gula darah akan terus meningkat, keadaan ini yang disebut resisten terhadap insulin (Dalimunthe 2004).
Diabetes melitus tipe 2 bisa terjadi pada anak-anak dan dewasa, tetapi biasanya terjadi setelah usia 30 tahun. Faktor risiko untuk diabetes tipe 2 adalah obesitas dimana sekitar 80-90% penderita mengalami obesitas. Diabetes melitus tipe 2 juga cenderung diturunkan secara genetik dalam keluarga. Karakteristik dari diabetes melitus tipe 2 yaitu sukar terjadi ketoasidosis, pengobatan tidak harus menggunakan insulin, onsetnya lambat, penderita gemuk atau tidak gemuk, biasanya terjadi pada umur tua, tidak ada antibodi sel insulin.
Organisasi Kesehatan Dunia (WHO) mengakui tiga bentuk diabetes melitus, yaitu tipe 1, tipe 2, dan diabetes gestasional yang terjadi selama kehamilan. Pembentukan diabetes melitus yang penting adalah dikarenakan kurangnya produksi insulin (diabetes melitus tipe 1, yang pertama dikenal), atau kurang sensitifnya jaringan tubuh terhadap insulin (diabetes melitus tipe 2, bentuk yang lebih umum).
terjadi selama kehamilan karena asupan makanan yang masuk bertambah dan akhirnya menjadi gemuk. Pada suatu saat tentu tubuh tidak mampu lagi mengolah glukosa yang beredar dan menyebabkan munculnya diabetes melitus (Ranakusuma 1992). Diabetes melitus pada kehamilan umumnya sembuh dengan sendirinya setelah persalinan. Tetapi tetap diperlukan pengawasan medis secara hati-hati sepanjang kehamilan.
2.4.3 Gejala Klinis Diabetes Melitus
Gejala klinis dari penderita diabetes melitus adalah poliuri, polidipsi, polifagi, badan lemas, mata kabur, kesemutan dan gangren (Ranakusuma 1992). Jika bagian tubuh luar terluka membutuhkan waktu penyembuhan yang cukup lama karena efek dari penyakit gulanya. Jika sudah parah penglihatan menjadi terganggu (Soenarto 2005). Ketika kadar glukosa meninggi ke tingkat pada saat jumlah glukosa yang difiltrasi melebihi kapasitas sel-sel tubulus melakukan reabsorbsi, glukosa akan timbul di urin sehingga terjadi glukosuri (Sherwood 2001).
Menurut Guyton (1994) gejala poliuri disebabkan oleh efek diuresis osmotik dari glukosa dalam tubulus ginjal. Sebaliknya gejala polidipsi disebabkan oleh keadaan dehidrasi akibat dari gejala poliuri. Gagalnya pemakaian glukosa dan protein oleh tubuh menyebabkan berkurangnya berat badan dan timbul gejala polipagi. Gejala astenia (kurang energi) disebabkan oleh hilangnya protein tubuh.
Gejala awal diabetes melitus berhubungan dengan efek langsung dari kadar gula darah yang tinggi. Jika kadar gula darah sampai di atas 160-180 mg/dL, maka glukosa akan dikeluarkan melalui urin. Gejala-gejala kronik yang sering terjadi misalnya lemah badan, anoreksia, kesemutan, mata kabur, mialgria, artralgia, kemampuan seksual berkurang dan lain-lain (Sherwood 2001).
2.4.4 Diagnosa Diabetikum
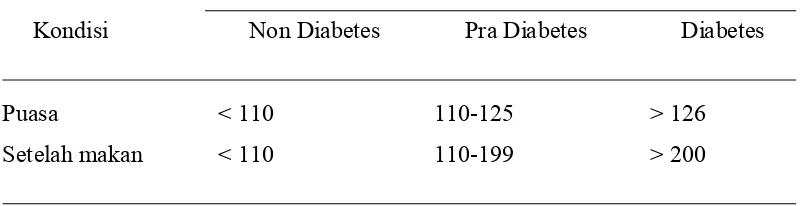
diambil 8 jam sesudah makan yang terakhir. Kriteria mendiagnosis gula darah dapat dilihat pada Tabel 1, menjelaskan bahwa kadar gula darah pada saat puasa normalnya < 110 mg/dL, terkena penyakit diabetes kurang lebih kadar gula darah > 126 mg/dL. Sedangkan kadar gula darah setelah makan normalnya < 110 mg/dL dan kisaran terkena diabetes > 200 mg/dL (Anonim 2007).
Tabel 1 Kriteria Diagnostik Gula Darah pada Manusia (Anonim 2007)
Kriteria Diagnostik Gula darah (mg/dL)
Kondisi Non Diabetes Pra Diabetes Diabetes
Puasa < 110 110-125 > 126
Setelah makan < 110 110-199 > 200
Selain itu menurut Guyton (1997) cara yang umum digunakan untuk mendiagnosa penyakit diabetes didasarkan pada berbagai uji kimiawi terhadap urin dan darah. Pemeriksaan glukosa urin melalui uji sederhana atau uji kuantitatif laboratorium yang lebih rumit yang mungkin dapat digunakan untuk menentukan jumlah glukosa yang hilang dalam urin. Pada umumnya jumlah glukosa yang dikeluarkan dalam urin orang normal sukar dihitung, sedangkan pada kasus diabetes, glukosa yang dilepaskan jumlahnya dapat sedikit sampai banyak sekali sesuai dengan berat penyakitnya atau asupan karbohidrat.
Pemeriksaan darah lainnya yang bisa dilakukan adalah uji toleransi glukosa. Dilakukan dengan percobaan bila orang normal yang puasa memakan 1 gram gula darahnya akan meningkat dari kadar kira-kira 90 mg/dL menjadi 120 mg/dL sampai 140 mg/dL dan dalam waktu kira-kira dua jam kadar ini akan menurun lagi kembali ke nilai normal lagi.
2.4.5 Komplikasi Diabetes Melitus
sehingga berakibat rusaknya pembuluh darah, syaraf dan struktur internal lainnya. Menurut Anderson (1994) komplikasi dari penyakit diabetes melitus dapat dibedakan menjadi komplikasi akut, komplikasi jangka pendek, dan komplikasi jangka panjang. Komplikasi akut meliputi ketoasidosis diabetika, koma, hiperglikemia, dan hipoglikemia; komplikasi jangka pendek meliputi disfungsi syaraf dan lensa mata, aterosklerosis, dan perubahan pada dinding pembulu darah; sedangkan komplikasi jangka panjang adalah retinopati, nefropati, dan neuropati.
Efek jangka panjang diabetes melitus melibatkan gangguan-gangguan degeneratif pada sistem vaskuler dan syaraf. Lesi kardiovaskuler merupakan penyebab terserang kematian pada pengidap diabetes. Kejadian penyakit jantung dan stroke pada pengidap diabetes lebih tinggi daripada kasus serupa pada pasien nondiabetes. Lesio vaskuler juga sering timbul di ginjal menyebabkan gagal ginjal dan retina mata menyebabkan kebutaan. Ekstremitas juga dapat mengalami gangren akibat gangguan penyaluran darah ke jaringan tersebut, sehingga kadang-kadang jari kaki atau bahkan tungkai keseluruhan harus diamputasi. Selain masalah yang berkaitan dengan sistem sirkulasi, lesi-lesi degeneratif di syaraf menyebabkan neuropati multipel yang menimbulkan disfungsi otak, korda spinalis, dan syaraf perifer (Sherwood 2001).
Menurut Ganong (1995) komplikasi diabetes melitus mencakup proliferatif retina (retinopati diabetes), penyakit ginjal (nefropati diabetes), kehilangan fungsi syaraf, khususnya dalam susunan syaraf otonom (neuropati diabetes) dan aterosklerosis dipercepat. Aterosklerosis menyebabkan insufisiensi sirkulasi pada tungkai dengan ulserasi menahun dan gangren serta menyebabkan peningkatan kajadian stroke dan infark miokardium.
Penderita diabetes bisa mengalami berbagai komplikasi jangka panjang jika diabetesnya tidak dikelola dengan baik. Komplikasi yang lebih sering terjadi dan mematikan adalah serangan jantung dan stroke (Anonim 2007). Menurut Spector (1993) penderita diabetes juga memiliki peningkatan risiko infeksi terutama dari tuberculosis atau saluran kencing serta mengalami degenerasi non-ateromatosa pada arteriol dan kapiler, terutama di ginjal dan retina yang mengarah pada kegagalan ginjal dan kebutaan.
2.4.6 Pengobatan Diabetes Melitus
Pengobatan diabetes bergantung pada penyuntikan insulin, penataan makanan, kontrol berat badan, dan olah raga (Sherwood 2001). Jika pengendalian berat badan dan berolahraga tidak berhasil maka dokter kemudian memberikan obat yang dapat diminum (obat hipoglikemik oral) atau menggunakan insulin dengan terapi sulih insulin. Diabetes tipe 1 hanya bisa diobati dengan insulin tetapi tipe 2 dapat diobati dengan obat oral (Anonim 2007).
Obat yang ditujukan untuk mendapatkan efek hipoglikemik per oral (Laurence 1992) yaitu obat hipoglikemik oral (OHO) terbagi menjadi dua kelompok yaitu pada kelompok pertama adalah obat yang memperbaiki kerja insulin (seperti metformin, glitazone, dan akarbose), obat ini bekerja pada tempat dimana terdapat insulin yang mengatur gula darah seperti di hati, usus, otot dan jaringan lemak. Obat metformin tidak mempengaruhi pelepasan insulin tetapi meningkatkan respon tubuh terhadap insulinnya sendiri. Sedangkan akarbose bekerja dengan cara menunda penyerapan glukosa di dalam usus.
Menurut Guyton (1994) secara teoritis pengobatan diabetes melitus dengan memberikan insulin secukupnya sehingga metabolisme karbohidrat, lemak, dan protein pada penderita mendekati metabolisme normal. Insulin sering digunakan oleh penderita diabetes tipe 1, sedangkan pada penderita diabetes tipe 2 digunakan apabila pemberian obat sudah tidak efektif (Ganiswarna 1995). Pada diabetes tipe 1, pankreas tidak dapat menghasilkan insulin sehingga harus diberikan insulin pengganti. Pemberian insulin hanya dapat dilakukan melalui suntikan karena insulin dihancurkan di dalam lambung sehingga tidak dapat diberikan per-oral (ditelan). Insulin disuntikkan di bawah kulit ke dalam lapisan lemak, biasanya di lengan, paha atau dinding perut (Anonim 2007).
Menurut Ranakusuma (1992) ditinjau dari cara kerja insulin, terdapat 3 jenis insulin, masing-masing memiliki kecepatan dan lama kerja yang berbeda yaitu insulin kerja cepat, insulin kerja sedang, dan insulin kerja lambat. Contoh insulin kerja cepat adalah insulin reguler yang bekerja paling cepat dan paling sebentar dengan lama durasi kerja 3-8 jam (Guyton 1994). Insulin ini seringkali mulai menurunkan kadar gula dalam waktu 20 menit, mencapai puncaknya dalam waktu 2-4 jam dan bekerja selama 6-8 jam (Ranakusuma 1992). Insulin kerja cepat seringkali digunakan oleh penderita yang menjalani beberapa kali suntikan setiap harinya dan disutikkan 15-20 menit sebelum makan.
Contoh insulin kerja sedang adalah insulin suspensi seng atau suspensi insulin isofan yang diabsorpsi secara lambat dari tempat injeksinya (Guyton 1994). Mulai bekerja dalam waktu 1-3 jam, mencapai puncak maksimun dalam waktu 6-10 jam dan bekerja selama 18-26 jam (Ranakusuma 1992). Insulin ini bisa disuntikkan pada pagi hari untuk memenuhi kebutuhan selama sehari dan dapat disuntikkan pada malam hari untuk memenuhi kebutuhan sepanjang malam. Sedangkan contoh insulin kerja lambat adalah insulin suspensi seng yang telah dikembangkan. Masa kerja insulin 18-24 jam. Efeknya baru timbul setelah 6 jam dan bekerja selama 28-36 jam (Ranakusuma 1992).
meningkatkan dosisnya. Selain itu, pengaturan diet sangat penting. Biasanya penderita tidak boleh terlalu banyak makan makanan manis dan harus makan dalam jadwal yang teratur.
Penderita diabetes cenderung memiliki kadar kolesterol yang tinggi, karena itu dianjurkan untuk membatasi jumlah lemak jenuh dalam makanannya. Tetapi cara terbaik untuk menurunkan kadar kolesterol adalah mengontrol kadar gula darah dan berat badan (Anonim 2007).
2.2 Kelenjar Pankreas
2.2.4 Anatomi Fisiologis Kelenjar Pankreas
Menurut Sherwood (2001) pankreas adalah suatu organ yang terdiri dari jaringan eksokrin dan endokrin. Bagian eksokrin pankreas mengeluarkan larutan basa encer dan enzim-enzim pencernaan melalui duktus pankreatikus ke dalam lumen saluran pencernaan. Diantara sel-sel eksokrin pankreas tersebar kelompok-kelompok, atau ”pulau”, sel endokrin yang juga dikenal sebagai pulau-pulau Langerhans.
Pankreas manusia secara anatomi letaknya menempel pada duodenum dan terdapat kurang lebih 200000-1800000 pulau Langerhans (Braunstern 1987). Dalam pulau Langerhans normal manusia dewasa, jumlah sel beta berkisar antara 75%-80% dari populasi sel pulau Lagerhans (Pebroot 1979). Pankreas terdiri dari dua jenis jaringan utama, yakni: asini yang mensekresikan getah pencernaan ke dalam duodenum, dan pulau Langerhans yang tidak mengeluarkan getahnya ke luar namun mensekresikan insulin dan glukagon langsung ke dalam darah (Guyton 1994).
2.2.2 Macam Sel Pulau Langerhans Pankreas
Pulau Langerhans mempunyai 4 macam sel yaitu: sel alfa yang mensekresi glukagon, sel beta yang mensekresi hormon insulin, sel delta yang mensekresi somatostatin untuk menghambat sekresi insulin dan glukagon dan sel pankreatik polipeptida yang fungsinya belum diketahui secara pasti (Underwood 1992). Jenis sel endokrin pankreas paling banyak dijumpai adalah sel beta (Sherwood 2001).
Tabel 2 Tipe sel pada pulau Langerhans (Underwood 1992)
Tipe sel Hormon yang dihasilkan Rata-tata (%)
Beta Insulin 70
Alfa Glukagon 20 Delta Somatostatin 8 PP Pankreatik polipeptida 2
Hubungan yang erat antara berbagai jenis sel yang terdapat dalam pulau Langerhans menyebabkan timbulnya pengaturan secara langsung sekresi berbagai jenis hormon oleh hormon lain (Guyton 1994). Terdapat hubungan umpan balik negatif langsung antara konsentrasi gula darah dan kecepatan sekresi sel alfa, tetapi hubungan tersebut berlawanan arah dengan efek gula darah pada sel beta. Peningkatan kadar gula darah menghambat sekresi glukagon tetapi merangsang sekresi insulin, sedangkan penurunan gula darah menyebabkan peningkatan sekresi glukagon dan penurunan sekresi insulin (Sherwood 2001).
2.2.3 Insulin
Insulin (bahasa Latin insula, "pulau", karena diproduksi di pulau-pulau Langerhans di pankreas) adalah sebuah hormon polipeptida yang mengatur metabolisme karbohidrat. Insulin merupakan komponen protein yang struktur molekulnya terdiri dari 2 rantai polipeptida, yaitu rantai A (acidic) yang mengandung 21 asam amino dengan glysine sebagai N-terminal dan sebuah rantai B (bacic) yang mengandung 30 asam amino dengan phenylalanine sebagai N terminal asam amino. Dua rantai dihubungkan oleh ikatan disulfida pada posisi 7 dan 20 di rantai A dan posisi 7 dan 19 di rantai B (Turner et al. 1969; Turner 1960).
Pelepasan insulin oleh sel beta distimulasi oleh tingginya kadar glukosa disertai sejumlah kecil ion kalsium. Stimulasi sel beta oleh glukosa menghasilkan pengikatan bentuk proinsulin ke dalam retikulum endoplasma. Bentuk terbaru proinsulin ditranspor oleh mekanisme kebutuhan energi ke badan Golgi. Dalam kantung Golgi granul yang pucat dapat diobservasi sebagai beta granul yang belum matang. Beta granul dikemas dalam badan Golgi dan dibebaskan ke dalam sitoplasma, kemudian zink ditranspor ke dalam beta granul. Insulin dalam beta granul ditranspor ke dalam bentuk kristal dan menjadi bentuk beta granul yang matang.
Proses sederhana dari pelepasan beta granul disebut emiocytosis (Pebroot 1979). Insulin dilepaskan ketika kadar gula darah tinggi sehingga dapat meningkatkan rata-rata pemasukan glukosa dan metabolisme oleh sel tubuh. Hiposekresi insulin akan menghasilkan diabetes melitus yang secara umum dapat mengganggu metabolisme tubuh (Marieb 1988).
(Sherwood 2001). Insulin mempunyai sel target yang luas meliputi banyak sel dan jaringan seperti otot skelet, otot jantung, lemak, fibroblast, sel hati, leukosit, kelenjar mamari, tulang, tulang rawan, kulit, aorta, kelenjar hipofise, dan syaraf perifer. Tetapi sel target yang paling utama adalah hati, sel lemak, dan otot.
Menurut Sherwood (2001) berdasarkan efek insulin pada karbohidrat, insulin memiliki empat efek yang dapat menurunkan kadar gula darah dan meningkatkan penyimpanan karbohidrat sebagai berikut: insulin mempermudah masuknya glukosa ke dalam sebagian besar sel, karena molekul glukosa tidak mudah menembus membran sel tanpa adanya insulin. Beberapa jaringan tidak tergantung pada insulin untuk menyerap glukosa yaitu otak, otot yang aktif, dan hati.
Insulin merangsang glikogenesis, pembentukan glikogen dari glukosa, baik di otot maupun hati. Insulin menghambat glikogenolisis atau menghambat perubahan glikogen menjadi glukosa. Dengan menghambat penguraian glikogen, insulin meningkatkan penyimpanan karbohidrat dan menurunkan pengeluaran glukosa oleh hati. Insulin menurunkan pengeluaran glukosa oleh hati dengan menghambat glukoneogenesis, juga menghambat perubahan asam amino menjadi glukosa di hati.
Berdasarkan efek insulin pada lemak, insulin memiliki banyak efek untuk menurunkan kadar asam lemak darah dan mendorong pembentukan simpanan trigliserida sebagai berikut: insulin meningkatkan transportasi glukosa ke dalam sel jaringan adiposa, seperti yang dilakukannya pada kebanyakan sel tubuh. Insulin mengaktifkan enzim-enzim yang mengkatalisasi pembentukan asam lemak dari turunan glukosa, insulin meningkatkan pemasukan asam-asam lemak dari darah ke dalam sel jaringan adiposa, insulin menghambat lipolisis (penguraian lemak), sehingga terjadi penurunan pengeluaran asam lemak dari jaringan adiposa ke dalam darah.
menghambat penguraian protein. Akibat kolektif efek ini adalah efek anabolik protein. Karena itu, insulin esensial bagi pertumbuhan normal.
Dalam sel hati, insulin meningkatkan perubahan glukosa ke dalam glikogen dan lemak karena glukosa penting sebagai prekursor asam lemak Insulin melawan pemecahan glikogen dan pelepasan glukosa dari sel hati ke darah (Spince et al. 1987). Insulin memudahkan lipogenesis melalui peningkatan pemasukan dan penggunaan metabolik glukosa oleh sel adiposa dan juga mengurangi perombakan dan mobilitas penyimpanan lemak (antilipolisis) (Turner et al. 1969).
Faktor utama yang mengatur sekresi glukagon adalah efek langsung kosentrasi gula darah pada pankreas endokrin. Dalam hal ini, sel-sel alfa pankreas meningkatkan sekresi glukagon sebagai respon terhadap penurunan gula darah. Glukagon akan mengaktifkan tempat-tempat penyimpanan energi dengan melakukan proses glikogenolisis, glukoneogenesis dan lipolisis, sehingga akan meningkatkan kadar gula darah. Stimulasi terjadi di hati untuk melepaskan glukosa (Marieb 1988).
Efek hiperglikemia hormon ini cenderung memulihkan kosentrasi glukosa ke normal. Sebaliknya, peningkatan kosentrasi gula darah, seperti yang terjadi setelah makan, menghambat sekresi glukagon, yang juga cenderung memulihkan kadar gula darah ke normal. Dengan demikian, terdapat hubungan umpan balik negatif langsung antara kosentrasi gula darah dan kecepatan sekreesi sel alfa, tetapi hubungan tersebut berlawanan arah dengan efek gula darah pada sel beta. Dengan kata lain, peningkatan kadar gula darah menghambat sekresi glukagon tetapi merangsang sekresi insulin, sedangkan penurunan gula darah menyebabkan peningkatan sekresi glukagon dan penurunan sekresi insulin.
Menurut Sherwood (2001) karena glukagon meningkatkan gula darah dan insulin menurunkan gula darah, perubahan sekresi hormon-hormon pankreas sebagai respon terhadap penyimpanan glukosa ini bekerja sama secara homeostasis untuk memulihkan kadar gula darah ke normal.
2.3 Streptozotosin (STZ)
spektrum luas, antitumor, bahan karsinogenik dan secara selektif menghancurkan sel beta pada pulau Langerhans (Cooperstein 1981). Pada hewan diabetes melitus dapat ditimbulkan oleh pankreatektomi oleh pemberian aloksan, streptozosin atau toksin lain yang dalam dosis tepat menyebabkan perusakan selektif sel beta pulau Langerhans pankreas, oleh bahan yang menghambat sekresi insulin dan oleh pemberian antibodi anti-insulin (Ganong 1995).
Menurut Gordon (1991), tikus yang diberi STZ akan mengalami kerusakan pada sel beta pankreas yang menyebabkan perubahan yang nyata dalam metabolisme hati. Pemberian STZ 50 mg/kg BB secara intra peritoneal pada tikus dapat meningkatkan kadar gula darah sampai sekitar 270 mg/dL setelah 2 minggu (Szkuldeski 2001). STZ dapat menghambat siklus Krebs dan akibatnya konsumsi oksigen berkurang. Hal ini menyebabkan pembatasan produk ATP dalam mitokondria yang menyebabkan deplesi nukleotida dalam sel beta pankreas. Penggunaan STZ dapat menimbulkan efek samping, diantaranya yaitu anorexia, nausea, vomit, pembengkakan pada kaki dan alopesia. Selain itu STZ juga dapat menimbulkan kerusakan pada ginjal, hati, sel darah putih, keping-keping darah
dan sel penghasil insulin (Anonim 2006).
2.4 Tempe
Tempe adalah hasil fermentasi kacang kedelai dengan kapang Rhizopus atau biasa dikenal sebagai ragi tempe, yaitu kapang yang dapat menguraikan protein di dalam kacang kedelai menjadi asam amino, sehingga lebih mudah dicerna tubuh. Artinya, kandungan protein tempe berbeda dengan kandungan protein dalam kacang kedelai (sumber bahan bakunya), terutama dalam proses penyerapan. Tempe terbukti mempunyai nilai gizi tinggi dan dapat digunakan sebagai sumber protein yang murah (Syafrina et al. 1997).
Tempe telah melalui proses fermentasi (oleh jamur Rhizopus oligosporus) sehingga protein yang terkandung di dalamnya telah mengalami proses degradasi oleh kapang hingga memudahkan penyerapannya di dalam tubuh. (Anonim 2008a). Jenis lain dari kapang Rhizopus yang digunakan sebagai sediaan fermentasi, seperti Rhizopus oryzae yang memproduksi enzim amilase, dan Rhizopus. stolonifer (kapang roti), atau Rhizopus Arrhizu yang memproduksi enzim pektinase (Yee et al. 1999).
2.4.4 Kandungan pada Tempe
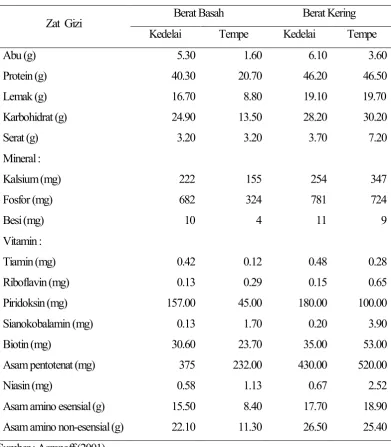
Menurut Avidra (2008) tempe seberat hanya kira-kira 100 g mampu mencukupi kebutuhan harian protein dan asam amino sebesar 37%. Jenis protein dan asam amino yang terkandung dalam tempe sangat lengkap. Kandungan asam amino terbanyak secara berurutan adalah glutamic acid, aspartic acid, leucine, arginine, proline, serine, alanine, valine, lysine, phenylalanine, isoleucine, threonine, gycine dan tyrosine. Pada proses fermentasi tempe terjadi peningkatan level ketidakjenuhan lemak sehingga kandungan asam lemak tak jenuh (PUFA) dalam tempe cukup baik. Bahkan 100 g tempe mengandung 220 mg asam lemak Omega 3 dan 3590 mg asam lemak Omega 6.
Tabel 3 Komposisi zat gizi kedelai dan tempe dalam 100 g bahan segar dan 100 g bahan kering
Sumber : Agranoff (2001)
Yee et al. (1999) menyebutkan bahwa kenaikan kadar vitamin B12 paling mencolok pada pembuatan tempe. Aktivitas vitamin B12 meningkat sampai 33 kali selama fermentasi dari kedelai, riboflavin naik sekitar 8-47 kali, piridoksin 4-14 kali, niasin 2-5 kali, biotin 2-3 kali, asam folat 4-5 kali, dan asam pantotenat 2 kali lipat. Vitamin ini tidak diproduksi oleh kapang tempe, tetapi oleh bakteri kontaminan seperti Klebsiella pneumoniae dan Citrobacter freundii. Selain itu tempe juga mengandung mineral makro dan mikro dalam jumlah yang cukup.
Zat Gizi Berat Basah Berat Kering
Jumlah mineral besi, tembaga, dan zink berturut-turut adalah 9.39, 2.87, dan 8.05 mg setiap 100 g tempe.
2.4.2 Khasiat dan Manfaat Mengonsumsi Tempe
Menurut Sugano (2005) kedelai mengandung tiga jenis isoflavon, yaitu daidzein, glisitein, dan genistein. Pada tempe juga ditemukan suatu zat antioksidan dalam bentuk isoflavon. Seperti halnya vitamin C, E, dan karotenoid, isoflavon juga merupakan antioksidan yang sangat dibutuhkan tubuh untuk menghentikan reaksi pembentukan radikal bebas.
Tempe berpotensi untuk digunakan melawan radikal bebas, sehingga dapat menghambat proses penuaan dan mencegah terjadinya penyakit degeneratif (aterosklerosis, jantung koroner, diabetes melitus, kanker, dan lain-lain). Selain itu tempe juga mengandung zat antibakteri penyebab diare, penurun kolesterol darah, pencegah penyakit jantung, hipertensi, dan lain-lain (Anonim 2008c). Menurut Alberts (2000) konsumsi tempe dapat menurunkan pertumbuhan sel-sel kanker dan sangat efektif dalam menurunkan kadar kolesterol dalam darah, juga menurunkan resiko keropos tulang atau yang disebut sebagai osteoporosis dan osteoarthritis.
Kedelai mengandung dua asam amino yang bersifat menjaga keseimbangan hormon insulin, yakni asam amino glisin dan asam amino arginin. Dengan melimpahnya jumlah insulin dalam darah, bukan hanya penyakit kencing manis (diabetes melitus) bahkan penyakit jantung pun dapat diatasi (Apriadji 2009). Kedelai merupakan sumber protein, lemak, vitamin, mineral, dan serat paling baik. Kandungan protein dan lemak nabati berperan dalam menghambat pembentukan kolesterol. Kedelai juga mampu membantu menjaga kesehatan ginjal, jantung, diabetes, rematik, anemia, hipertensi, diare, dan hepatitis.
konsumsi protein yang tinggi akan mengakibatkan hiperfiltrasi dan hipertensi glomerulus.
Isoflavon dalam tempe memiliki efek antidiabetik. Lu et al. (2007) menyatakan bahwa pemberian diet tinggi isoflavon protein kedelai (genestein equivalen 0.222 g/100 g diet) secara signifikan menurunkan kadar glukosa serum, meningkatkan kadar serum insulin pada tikus diabetes sedang. Selain itu, isoflavon juga terbukti melindungi sisa-sisa sel beta pankreas dari efek toksik STZ. Pemberian diet genestein dan isolat protein kedelai masing-masing 0.06 g dan 20 g/100 g diet menunjukkan adanya peningkatan aktivitas enzim glukokinase yang dihubungkan dengan penurunan kadar gula darah dalam keadaan diabetes.
MATERI DAN METODOLOGI
3.1 Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan April 2008 sampai dengan Mei 2009. Pembuatan diet tempe dilakukan di Departemen Gizi Masyarakat dan Kesehatan Konsumen (GMSK) Fakultas Ekologi Manusia, pemeliharaan dan perlakuan hewan coba dilakukan di Laboratorium Hewan SEAFAST center. Sedangkan pembuatan dan pengamatan preparat histopatologi dilakukan di Bagian Patologi Departemen Klinik, Reproduksi dan Patologi Fakultas Kedokteran Hewan Institut Pertanian Bogor.
3.2 Hewan Penelitian
Penelitian untuk melihat populasi sel beta menggunakan 12 ekor tikus jantan dengan galur Sprague-Dawley (Rattus norvegicus) yang berumur 8 minggu dengan kisaran berat badan 200±10 g.
3.3 Materi Penelitian
Peralatan yang digunakan dalam penelitian ini antara lain spoit, kandang metabolik tikus, peralatan bedah, tissue cassette, inkubator, tissue processor, mikrotom, object glass, cover glass, digital blood glucose meter dan mikroskop.
3.4 Metode Penelitian 3.4.1 Pembuatan Tempe
Kedelai yang digunakan dalam pembuatan tempe berasal dari 3 varietas berbeda yaitu Americana, Baluran dan Cikuray (kedelai hitam). Masing-masing kedelai tersebut ditimbang, lalu dicuci dan direbus selama 30 menit pada suhu 99.5 0C. Setelah masak, kedelai direndam selama 28 jam menggunakan air bekas perebusannya. Kemudian dilakukan pembersihan kedelai dari kulitnya sebanyak 2 kali, pencucian pertama menggunakan air bekas rendaman dan pencucian kedua menggunakan air bersih. Setelah bersih, kedelai ditiriskan dan diberi inokulum Rhizopus oligosporus strain ITBCC L-46 (CC: Collection Cultur ITB, L: Lapuk / fungi, 46: daftar koleksi) sebesar 0.3 gram/100 gram kedelai yang telah direbus. Selanjutnya kedelai tersebut dibungkus dan dilakukan fermentasi selama 48 jam (Lampiran 1).
Sebagai hasil fermentasi, tempe kemudian dikeringbekukan (freeze drying). Pengeringan beku dilakukan dengan cara tempe dibekukan terlebih dahulu, kemudian es dikeluarkan melalui proses sublimisasi pada kondisi vakum pada suhu dibawah 0 0C dengan tekanan 10-3 sampai 10-6 atm selama 48 jam hingga 50 jam. Pembuatan tempe dilakukan di Departemen Gizi Masyarakat oleh Dian Setian Ghozali.
3.4.2 Tikus Model Diabetes
Gambar 1 Penyuntikan STZ di peritoneum (Dokumentasi pribadi 2008).
3.4.3 Metode Penelitan
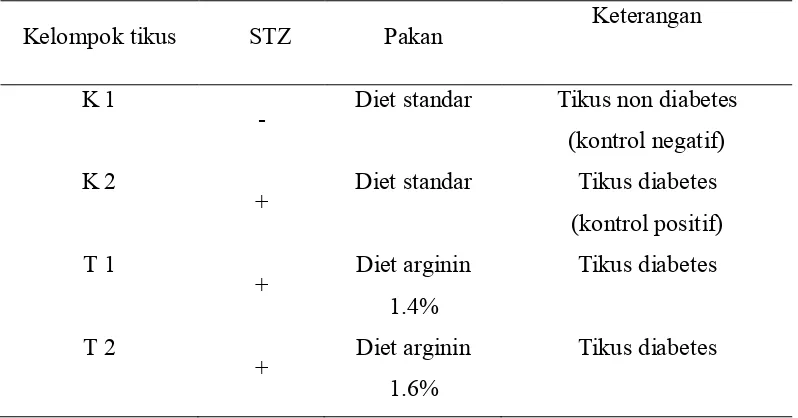
Sejumlah 12 ekor tikus jantan diletakkan di kandang metabolisme (stainless steel) dan dikelompokkan menjadi 4 kelompok perlakuan dengan masing-masing kelompok perlakuan diwakili oleh 3 ekor tikus. Semua tikus diadaptasikan selama 1 minggu dengan diberi diet standar sebelum dilakukan penelitian. Kelompok perlakuan tikus lebih rinci dapat dilihat pada Tabel 4.
Tabel 4 Kelompok Perlakuan Tikus
Kelompok tikus STZ Pakan Keterangan
K 1
- Diet standar Tikus non diabetes (kontrol negatif) K 2
+ Diet standar Tikus diabetes
(kontrol positif) T 1
+ Diet arginin
1.4%
Tikus diabetes
T 2
+ Diet arginin
1.6%
Tikus diabetes
bentuk bubuk yang berasal dari tempe freeze dry. Diet tempe pada T1 dan T2 didasarkan pada AIN 93M (American Institute of Nutrition) yang dibuat mendekati isokalori, sedangkan pada K1 dan K2 diberi diet standar sesuai dengan komposisi pakan AIN-93M.
Gambar 2 Tikus dalam kandang metabolisme (Dokumentasi pribadi 2008).
3.4.4 Pengukuran Kadar Gula Darah
Pengukuran kadar gula darah dengan menggunakan glukometer (accu check) dilakukan pada hari ke-7 dan ke-21 pascainduksi STZ. Pengukuran dilakukan pada pagi hari sebelum pemberian pakan, sampel darah didapat dari ujung ekor. Pengukuran gula darah dilakukan pada semua tikus dari setiap kelompok. Hasil yang didapat dirata-ratakan untuk menggambarkan nilai kadar gula darah kelompok dengan satuan mg/dL.
3.4.5 Pengambilan Organ Pankreas
3.4.6 Pembuatan Preparat Histopatologi
Pembuatan preparat histopatologi pada organ pankreas dilakukan dengan prosedur sebagai berikut (Lampiran 2):
Fiksasi
Sediaan organ pankreas direndam dalam larutan buffer neutral formalin (BNF) 10%. Kemudian dilakukan pemotongan (trimming) dengan ketebalan ± 3 mm dan dimasukkan ke dalam kaset.
Dehidrasi
Jaringan yang berada di dalam kaset dimasukkan ke dalam tissue processor untuk dilakukan dehidrasi. Proses dehidrasi dilakukan menggunakan alkohol dengan konsentrasi bertingkat yang terdiri dari alkohol 70%, 80%, 90%, 95%, alkohol absolut I, alkohol absolut II dan alkohol absolut III. Selanjutnya dijernihkan (clearing) dengan memasukkan sediaan ke dalam xylol I, xylol II dan xylol III.
Perendaman (Embedding) dan Pencetakan (Blocking)
Sediaan yang telah didehidrasi ditanam dalam cetakan yang telah diisi parafin cair setengah-setengah dari volumenya dan sebelum membeku ditambahkan lagi dengan parafin cair sampai penuh lalu didinginkan pada cold plate. Hasil cetakan yang sudah mengeras dikeluarkan dari cetakan dan blok yang diperoleh dapat disimpan dalam refrigerator sampai siap untuk dipotong dengan mikrotom.
Pemotongan
Sediaan dalam blok parafin dipotong menggunakan mikrotom dengan ketebalan 5 μm hingga berbentuk seperti pita dan diletakkan di atas permukaan air hangat untuk mencegah terjadinya lipatan pada pita. Sediaan selanjutnya diletakkan di atas gelas objek dan dikeringkan pada suhu ruang. Sediaan kemudian diwarnai dengan hematoksilin-eosin (HE) dan imunohistokimia.
3.4.7 Pewarnaan Hematoksilin Eosin (HE)
yang digunakan satu bersifat asam dan yang lain bersifat basa. Paduan sifat tersebut menyebabkan bagian-bagian yang bersifat asidofilik dan basofilik dapat ditonjolkan sehingga terjadi kekontrasan dan pengenalan bagian tertentu dapat lebih cepat dan lebih jelas terlihat.
Tahapan yang dilakukan dalam pewarnaan HE dimulai dengan proses deparafinisasi, yaitu penghilangan parafin dengan memasukkan preparat ke dalam seri larutan xylol III, xylol II, dan xylol I. Kemudian dilanjutkan dengan proses rehidrasi, yaitu dengan memasukkan preparat ke dalam seri larutan alkohol absolut sampai alkohol 70% secara berurutan. Preparat direndam dalam air kran, kemudian dalam aquadest. Preparat diwarnai dengan pewarna hematoksilin dilanjutkan dengan perendaman dalam aquadest. Setelah itu preparat diwarnai menggunakan eosin dan diikuti perendaman kembali dalam aquadest. Kemudian dilakukan proses dehidrasi dengan alkohol bertingkat serta penjernihan (clearing) dengan menggunakan xylol. Sediaan ditutup dengan cover glass (mounting) dan siap untuk dilakukan pengamatan di bawah mikroskop (Lampiran 3).
3.4.8 Pewarnaan Imunohistokimia
Pewarnaan imunohistokimia dilakukan untuk mengamati sebaran sel beta penghasil insulin pada pulau Langerhans pankreas. Langkah awal pewarnaan ini adalah deparafinisasi dan rehidrasi selama 30 menit. Preparat dicelupkan ke larutan xylol I, II, III, absolut I, II, III, dan alkohol 95%, 90%, 80%, 70%. Kemudian preparat dicuci dengan destilted water (DW) dan dibilas dengan larutan phosphat buffer saline (PBS) sebanyak 3 kali serta diberi pembatas dengan dakopen marker.
3.5 Parameter Pengamatan
HASIL DAN PEMBAHASAN
4.1 Tingkat Keberhasilan Pembuatan Model Diabetes
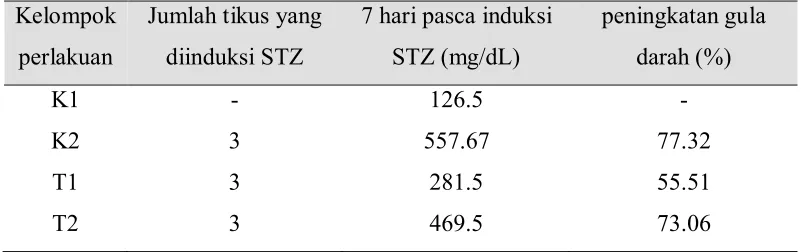
Hasil pemberian streptozotocin (STZ) dengan dosis tunggal sebanyak 40 mg/kg BB secara intraperitoneal pada tikus menunjukkan bahwa STZ mampu meningkatkan kadar gula darah. Hasil pengukuran gula darah pada hari ke-7 setelah pemberian STZ menunjukkan peningkatan yang sangat bermakna dibandingkan dengan kelompok kontrol. Semua tikus yang diinduksi dengan STZ mengalami peningkatan kadar gula darah hingga di atas 250 mg/dl (Tabel 5). Tikus dinyatakan hiperglikemia dengan kadar gula darah > 250 mg/dL (Doxey et al. 1995). Data ini mengindikasikan bahwa pembuatan hewan model diabetes dengan menggunakan STZ yang memiliki efek diabetogenik telah berhasil membuat tikus mengalami hiperglikemia.
Pemberian STZ dapat merusak sel beta pankreas (Gordon 1991), sehingga menghambat sekresi insulin dalam pembuluh darah (Cooperstein 1981). Melalui aktivitas alkalisasi DNA pankreas, STZ akan merusak DNA yang mengakibatkan penurunan fungsi ATP (adenosin trifosfat) sebagai energi sel. STZ akan menghambat siklus Krebs yang dapat mengurangi konsumsi oksigen dan membatasi produksi ATP dalam mitokondria yang menyebabkan deplesi nukleotida dalam sel beta pankreas. Kerusakan tersebut akan menghambat biosintesis dan sekresi insulin (Elsner 2000). Kekurangan insulin akan menurunkan glukoneogenesis (Murray et al 2000) dan menyebabkan keadaan hiperglikemia.
Tabel 5 Tingkat keberhasilan pembuatan model diabetes
✁2 Kadar Gula Darah
Pengukuran kadar gula darah dilakukan pada hari ke-7 dan 21 pasca induksi STZ. Hasil pengukuran gula darah secara rinci dapat dilihat pada tabel di bawah (Tabel 6).
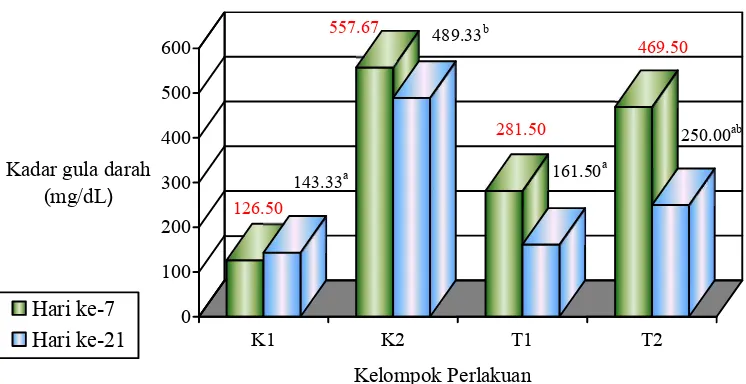
Tabel 6 Rataan kadar gula darah pada kelompok tikus (Pratidina 2009) Kelompok
perlakuan
7 hari pasca induksi STZ (mg/dL)
21 hari pasca induksi STZ (mg/dL)
Penurunan gula darah (%)
K1 126.5 143.33a -
K2 557.67 489.33b 12.25
T1 281.5 161.5a 42.63
T2 469.5 250ab 46.75
Huruf superscript yang berbeda menunjukkan perbedaan nyata pada taraf 5% dengan uji BNJ (Tukey test).
126.50
Gambar 3 Rataan kadar gula darah pada hari ke 7 dan 21 pasca induksi STZ. Keterangan : K1 (kontrol negatif)= tidak diinduksi STZ dan tidak diberi tempe, K2 (kontrol
positif)= diinduksi STZ dan tidak diberi tempe, T1= diinduksi STZ dan diberi tempe mengandung arginin 1.4%, T2= diinduksi STZ dan diberi tempe mengandung arginin 1.6%.
Huruf superscript yang berbeda menunjukkan perbedaan nyata pada taraf 5% dengan uji BNJ (Tukey test).
Pengukuran kadar gula darah pada hari ke-21 pascainduksi STZ (hari ke-14 pascapemberian diet tempe) terjadi penurunan kadar gula darah yang sangat besar yaitu menjadi 161.5 mg/dL pada T1 dan 250 mg/dL pada T2 dengan persentase penurunan kadar gula darah sebesar 43% untuk T1 dan 47% untuk T2.
Uji Tukey menunjukkan bahwa nilai kadar gula darah pada T1 dan T2 tidak berbeda nyata dengan K1. Perbedaan yang nyata terjadi pada T1 terhadap K2, sedangkan T2 tidak berbeda nyata dengan K2 tetapi persentase penurunan kadar gula darah pada T2 lebih besar daripada K2. Hal ini menunjukkan bahwa pemberian diet tempe pada kelompok tikus yang diinduksi STZ berpengaruh terhadap penurunan kadar gula darah pada penderita hiperglikemia. Penurunan kadar gula darah ini antara lain terjadi karena pengaruh kandungan isoflavon dalam tempe.
Lu et al. (2007) menyatakan bahwa pemberian diet tinggi isoflavon protein kedelai (genestein equivalen 0.222 g/100 g diet) secara signifikan menurunkan kadar gula serum, meningkatkan kadar serum insulin pada tikus diabetes. Kandungan asam amino bebas tempe lebih tinggi 24 kali lipat. Nilai serat, vitamin B kompleks, efisiensi protein, dan nilai asam lemak bebasnya juga lebih baik sehingga dapat membantu mencegah terjadinya diabetes dengan cara meningkatkan kerja hormon insulin dalam mengatur gula darah di dalam tubuh. Kandungan tinggi seratnya berfungsi mengendalikan kadar gula darah. Hal ini yang menyebabkan tempe berperan sebagai sumber protein sempurna bagi penderita diabetes (Alexis 2007).
✂✄3 Pengamatan Organ Pankreas dengan Pewarnaan Hematoksilin Eosin
Hasil pewarnaan hematoksilin-eosin (HE) pada potongan jaringan pankreas semua kelompok diamati terhadap morfologi sel-sel jaringan pankreas. Pada pewarnaan HE bagian endokrin (pulau Langerhans) mengambil warna lebih muda (merah muda) daripada bagian eksokrin dan di dalamnya ditemukan pembuluh-pembuluh darah kapier (Wheater 1979). Pengamatan histopatologi pankreas dilakukan dengan mengamati bentuk morfologi struktur jaringan pankreas tikus yang diwarnai dengan pewarnaan hematoksilin-eosin (HE).
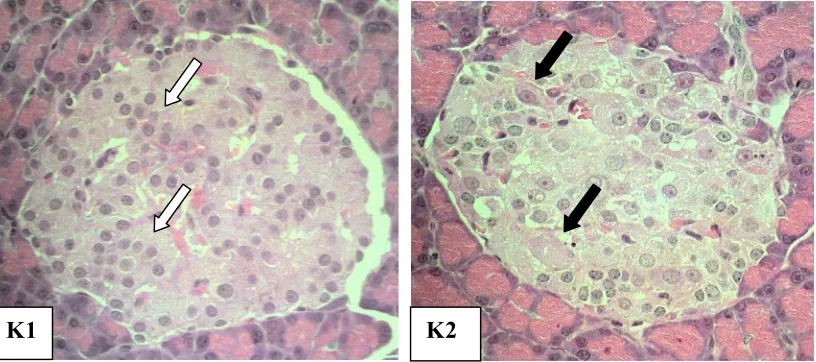
Hasil pengamaan histopatologis disajikan pada Gambar 4. Gambar 4 menunjukkan bahwa pada K1 terlihat adanya keteraturan susunan sel endokrin yang menyebar di pulau Langerhans dengan bentuk sel yang seragam dan ukuran sitoplasma terlihat proporsional terhadap besar inti serta tidak mengalami perubahan (normal), sedangkan pada K2 menunjukkan adanya lesio pada jaringan pankreas berupa degenerasi sel endokrin yang menuju nekrosa sel, degenerasi protein dan lemak.
Gambar 4 Gambaran histopatologi pankreas.
Keterangan: K1 (kontrol negatif)= tidak diinduksi STZ dan tidak diberi tempe, K2 (kontrol positif)= diinduksi STZ dan tidak diberi tempe, ( ) menunjukkan distribusi sel beta menyebar di sentral pulau Langerhans dengan ukuran sel yang sama besar, ( ) menunjukkan perubahan bentuk inti sel beta akibat degenerasi sel beta. (Pewarnaan HE, Perbesaran objektif 40x)
Perubahan terlihat pada K2 yang diinduksi dengan STZ yaitu adanya degenerasi sel endokrin. Degenerasi sel endokrin terlihat pada intinya yang berubah bentuk menjadi polimorf (tidak seragam). Perubahan yang terjadi digambarkan dalam bentuk perubahan inti sel endokrin menjadi lebih kecil (piknosis) bahkan mulai menghilang hanya terlihat sitoplasma yang kosong berisi deposit glikogen dan membesar tanpa inti serta bentuk sitoplasma yang mengalami hiperkromatik. Selain itu juga terlihat adanya sitoplasma yang menggumpal menunjukkan adanya denaturasi protein. Hal ini menjelaskan bahwa pemberian STZ dapat merusak sel endokrin pankreas khususnya sel beta sehingga sekresi insulin ke dalam pembuluh darah menurun.
Pada diabetes muda, umumnya beberapa sel beta menunjukkan degranulasi lengkap dan sitoplasma yang kosong (Cooperstein 1981). Diantara sitoplasma sel-sel beta yang kosong ditemukan adanya vakuola yang berisi deposit glikogen. Perubahan vakuolar dalam sel beta dapat berasal dari deposit glikogen dalam sitoplasma atau lesio degeneratif sebenarnya (ballooning degeneration) (Goren et a.l 1988). Menurut Ressang (1963) perubahan-perubahan pada sel-sel yang ditimbulkan oleh zat-zat yang mempunyai efek sitotoksik yakni pengecilan pulau-pulau pankreas, pengurangan jumlah sel beta dan degranulasi, vakuolisasi daripada sel-sel tersebut.
`
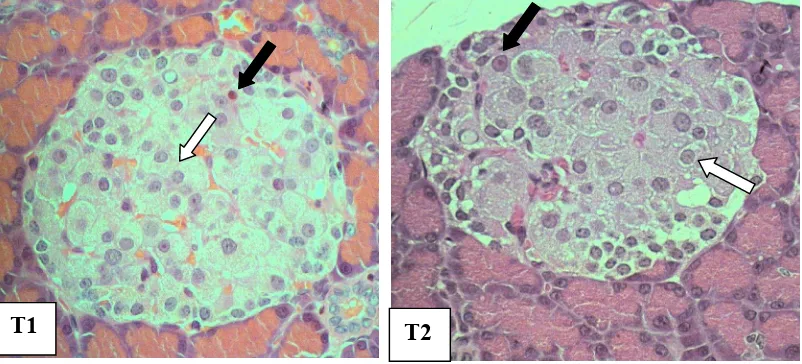
Gambar 5 Gambaran histopatologi pankreas.
Keterangan: T1= diinduksi STZ dan diberi tempe mengandung arginin 1.4%, T2= diinduksi STZ dan diberi tempe mengandung arginin 1.6%, ( ) menunjukkan distribusi sel beta mulai menyebar di sentral pulau Langerhans dengan ukuran sel hampir sama besar, ( ) menunjukkan perubahan bentuk inti sel beta akibat degenerasi sel beta masih terjadi. (Pewarnaan HE, Perbesaran objektif 40x)
Pengamatan dengan teknik pewarnaan HE pada T1 dapat menunjukkan adanya perubahan pada sel-sel pankreasnya (Gambar 5). Perubahan-perubahan tersebut meliputi sel endokrin yang mulai melakukan regenerasi menuju bentuk normal, walaupun masih ditemukan beberapa sel endokrin yang mengalami degenerasi tetapi jumlahnya tidak lebih banyak dari T2. Gambar 5 menunjukkan bahwa pada T2 memperlihatkan adanya proses regenerasi dari sejumlah sel endokrin tetapi jumlahnya tidak lebih banyak dari T1. Sejumlah besar sel endokrin pada T2 masih mengalami degenerasi yang hampir mendekati K2.
Gambaran histopatologi menunjukkan perubahan struktur morfologi pankreas pada T1 yang tidak berbeda nyata dengan K1. Perbedaan yang nyata terjadi pada T1 terhadap K2 dan T2 terhadap K1, tetapi T2 tidak berbeda nyata terhadap K2. Hal ini menunjukkan bahwa pemberian diet tempe mampu memperbaiki lesio sel endokrin akibat induksi STZ sehingga sekresi insulin dapat ditingkatkan. Tempe merupakan sumber protein kedelai dan isoflavon (genestain dan daidzein), sehingga peran isoflavon genestain dan daidzein dalam pengaturan gula darah antara lain dengan meningkatkan sekresi insulin oleh pulau Langerhans pankreas (Jonas 1995).
Tabel 7 Pengamatan hematoksilin-eosin (HE) dan imunohistokimia Kelompok Hematoksilin-eosin Imunohistokimia
K1
proporsional terhadap besar inti sel.
Tidak ditemukan adanya perubahan (lesio) pada sel endokrin.
Populasi sel beta pada pulau Langerhans menunjukkan reaksi positif Ag terhadap Ab insulin pada sel beta yang berwarna coklat dengan persentase
Terjadi degenerasi dan nekrosa sel endokrin sehingga jumlah sel endokrin yang normal adalah 20-30%.
Ditemukan lesio pada sel endokrin yang ditunjukkan pada sel yang berukuran besar dan ukuran sitoplasma yang tidak beraturan.
Populasi sel beta yang menghasilkan insulin sangat sedikit sekitar 20-30%, dengan intensitas warna coklat ringan. pada pulau Langerhans yang normal berkisar 70-80%.
Ditemukan degenerasi sel endokrin dalam jumlah sedikit.
Sel-sel beta yang menunjukkan reaksi positif Ag terhadap Ab insulin sel beta menghasilkan insulin berjumlah 60-70% dari normal pada pulau Langerhans sebesar 30-40%.
Terjadi degenerasi- nekrosa sel endokrin dalam jumlah yang cukup besar.
Distribusi populasi sel beta pada pulau Langerhans yang
menghasilkan insulin adalah sebesar 30-40%
Perbedaan hasil persentase distribusi sel endokrin pada T1 dan T2 sangat mungkin terkait dengan perbedaan tingkat keparahan hiperglikemia yang dialami kedua kelompok tersebut yang pada awalnya kadar gula darah T2 lebih tinggi daripada T1.
☎ ✆☎ ✆2 Pengamatan Insulin dengan Pewarnaan Imunohistokimia
Pengamatan terhadap potongan jaringan pankreas khususnya pada sel beta yang diwarnai dengan imunohistokimia dilakukan secara deskriptif dengan melihat populasi dan tampilan kadar reaksi Ag dan Ab sel beta yang mengalami perubahan. Pengamatan dengan teknik pewarnaan imunohistokimia dapat terlihat distribusi dari sel beta yang menghasilkan insulin dalam pulau Langerhans yang ditunjukkan dengan sel yang berwarna coklat. Pulau Langerhans didominasi oleh sel beta.
Gambar 6 Gambaran histopatologi pankreas.
Keterangan: K1 (kontrol negatif)= tidak diinduksi STZ dan tidak diberi tempe, K2 (kontrol positif)= diinduksi STZ dan tidak diberi tempe, ( ) menunjukkan reaksi positif Ag terhadap Ab insulin pada sel beta yang berwarna coklat. (Pewarnaan Imunohistokimia, Perbesaran objektif 40x)
Gambaran histopatologi dengan pewarnaan imunohistokimia terlihat pada Gambar 6 yaitu pada K1 menunjukkan bahwa distribusi sel beta lebih mendominasi dibandingkan K2. Pada K2 terlihat distribusi sel beta dalam pulau Langerhans lebih sedikit sehingga jumlah hormon insulin yang dihasilkannya juga lebih sedikit.
Kekurangan insulin pada anjing disebabkan oleh kekurangan pulau-pulau Langerhans atau oleh struktur anormal daripada pulau ini (atrofi, degenerasi hidropik, hialinisasi dan fibrosis pulau) (Ressang 1963). Hampir seluruh kasus penderita diabetes melitus disebabkan oleh berkurangnya kecepatan sekresi insulin oleh sel-sel beta pulau Langerhans (Guyton 1994).
Gambar 7 Gambaran histopatologi pankreas.
Keterangan : T1= diinduksi STZ dan diberi tempe mengandung arginin 1.4%, T2= diinduksi STZ dan diberi tempe mengandung arginin 1.6%, ( ) menunjukkan reaksi positif Ag terhadap Ab insulin pada sel beta yang berwarna coklat. (Pewarnaan Imunohistokimia, Perbesaran objektif 40x)
Gambaran histopatologi dengan teknik pewarnaan imunohistokimia pada T1 dan T2 disajikan pada Gambar 7. Gambar 7 menunjukkan bahwa pada T1 dan T2 mulai mengalami pertambahan distribusi jumlah sel beta yang ditampilkan pada sel yang berwarna coklat. Pertambahan jumlah sel beta pada T1 sangat signifikan jika dibandingkan dengan T2.
Tampilan kadar reaksi positif Ag terhadap Ab insulin pada sel beta diindikasikan pada sel yang berwarna coklat. Kadar reaksi positif dapat ditunjukkan melalui nilai persentase distribusi populasi sel beta pada pulau Langerhans. Nilai persentase distribusi populasi sel beta pada pulau Langerhans disajikan pada Tabel 7. Distribusi sel beta pada K2 lebih sedikit jika dibandingkan dengan K1. Hal ini disebabkan oleh pemberian STZ pada kelompok diabetes yang dapat merusak sel beta sehingga menurunkan sekresi insulin ke dalam pembuluh darah.
Persentase distribusi sel beta pada T1 meningkat yaitu 60-70% mendekati nilai K1 yaitu 90-100%, sedangkan persentase distribusi pada T2 meningkat sedikit yaitu 30-40% tetapi masih mendekati nilai K2 yaitu 20-30%. Nilai distribusi sel beta akan berdampak pada sekresi insulin yang dihasilkan oleh sel beta. Sekresi insulin pada T1 meningkat mendekati K1, sedangkan pada T2 meningkat mendekati K2. Peningkatan sekresi insulin mengindikasikan bahwa pemberian diet tempe dapat memperbaiki distribusi sel beta penghasil insulin pada pulau Langerhans.
Hasil pengamatan hematoksilin-eosin (HE) dan imunohistokimia menunjukkan bahwa pemberian diet tempe dapat memperbaiki gambaran distribusi sel endokrin dan sel beta penghasil insulin pankreas pulau Langerhans pada tikus model diabetes melitus. Kelompok T1 merupakan kelompok tikus diabetes yang diberi diet tempe dengan kandungan arginin 1.4% menunjukkan hasil yang lebih bagus jika dibandingkan dengan T2 yaitu kelompok tikus diabetes yang diberi diet tempe dengan kandungan arginin 1.6%.
Perbedaan hasil ini dipengaruhi oleh banyak faktor, diantaranya perbedaan tingkat keparahan hiperglikemia yang dialami kedua kelompok tersebut yang pada awalnya kadar gula darah T2 lebih tinggi daripada T1, kemudian adanya hukum Hormesis dimana dalam obat herbal (dalam hal ini tempe) dengan pemberian dosis yang ditingkatkan belum tentu menghasilkan hasil yang lebih baik. Terkadang dengan dosis yang lebih sedikit dapat memberikan dampak yang lebih baik.
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Merujuk pada hasil penelitian yang diperoleh, maka dapat disimpulkan bahwa:
1. Pemberian diet tempe terbukti dapat menurunkan kadar gula darah pada tikus model diabetes melitus.
2. Secara histopatologi pemberian diet tempe dapat memperbaiki gambaran distribusi sel endokrin pankreas pulau Langerhans pada tikus model diabetes melitus.
3. Pemberian diet tempe dapat memperbaiki distribusi sel beta penghasil insulin pulau Langerhans pada tikus model diabetes melitus.
5.2 Saran