IDENTIFIKASI DAN EKSPRESI GEN PROTEIN SELUBUNG
Pepper vein yellows virus PADA Escherichia coli
RITA KURNIA APINDIATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Identifikasi dan Ekspresi Gen Protein Selubung Pepper vein yellows virus pada Escherichia coli adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
Rita Kurnia Apindiati
RINGKASAN
RITA KURNIA APINDIATI. Identifikasi dan Ekspresi Gen Protein Selubung
Pepper vein yellows virus pada Escherichia coli. Dibimbing oleh GEDE SUASTIKA dan KIKIN HAMZAH MUTAQIN.
Penyakit klorosis pada tanaman cabai yang disebabkan oleh Pepper vein yellows virus (PeVYV) anggota dari genus Polerovirus (famili Luteoviridae) telah ditemukan di Indonesia. Berdasarkan hasil survei yang dilakukan pada pertanaman cabai di Desa Kertha, Kecamatan Payangan, Kabupaten Gianyar, Provinsi Bali, tanaman cabai bergejala klorosis banyak ditemukan dalam intensitas tinggi. Tanaman sakit menunjukkan gejala kuning pada lamina, tetapi tulang daun tetap berwarna hijau. Sejauh ini belum tersedia secara komersial antiserum spesifik PeVYV untuk kepentingan deteksi, sehingga upaya membuat antiserum perlu dilakukan. Salah satu teknik terbaru dalam menyediakan sumber antigen untuk pembuatan antiserum ialah melalui teknik molekuler ekspresi gen protein selubung virus pada bakteri kompeten yang sesuai. Penelitian ini bertujuan untuk mengidentifikasi Pepper vein yellows virus (PeVYV) berdasarkan sifat penularan virus menggunakan Aphis nasturtii, bentuk dan ukuran partikel virus, deteksi RNA total dengan reverse transcription-polymerase chain reaction (RT-PCR), perunutan sekuen nukleotida, dan ekspresi gen protein selubung PeVYV pada bakteri ekspresi Escherichia coli.
PeVYV dapat ditularkan dari tanaman cabai sakit ke tanaman cabai sehat oleh serangga A. nasturtii (Homoptera: Aphididae). Partikel PeVYV berbentuk heksagonal dengan diameter ~30 nm. RT-PCR menggunakan primer spesifik
forward BamHI dan reverse PstI berhasil mengamplifikasi target gen protein selubung PeVYV berukuran ~650 pb. Sekuen gen protein selubung PeVYV isolat Bali, Indonesia memiliki homologi sebesar 99% dengan PeVYV isolat Jepang dan Taiwan. PeVYV berhasil dibuktikan sebagai penyebab penyakit klorosis pada tanaman cabai asal Bali, Indonesia. DNA CP-PeVYV dikloning pada vektor ekspresi pQE30 (Qiagen) pada situs enzim restriksi BamHI dan PstI untuk membentuk plasmid rekombinan pQE30-CP-PeVYV dengan fusi protein putatif. Optimasi ekspresi rekombinan CP-PeVYV dilakukan pada beberapa suhu inkubasi yang berbeda (25, 28, 30, dan 37 oC), konsentrasi akhir Isoprophyl-β -D-thiogalactoside (IPTG) (0.25, 0.5, dan 1 mM) dan waktu panen setelah diinduksi IPTG (3, 6, 9, 12, dan 15 jam).
Gen protein selubung PeVYV berukuran ~650 pb diamplifikasi dengan primer spesifik, dikloning pada vektor ekspresi pQE30, ditransformasi, dan dikayakan ekspresi gen tersebut (overexpression) pada bakteri ekspresi E. coli
Penyediaan protein selubung PeVYV murni dapat digunakan sebagai imunogen pada tubuh mamalia (kelinci). Antibodi PeVYV yang terbentuk dapat digunakan sebagai bahan deteksi virus yang bersangkutan.
SUMMARY
RITA KURNIA APINDIATI. Identification and expression of Pepper vein yellows virus coat protein gene in Escherichia coli. Under supervision of GEDE SUASTIKA and KIKIN HAMZAH MUTAQIN.
Based on a survey conducted at chili pepper growing area in Kertha village, Payangan subdistrict, Gianyar district, Bali province, it has been found that chili pepper plants with chlorosis symptoms caused by the virus were at high incidence. Infected plants showed leaf yellow symptom, but the veins remain green. A specific antiserum for PeVYV has not been available commercially. An advance techniques in providing antigen for antiserum production is through molecular approach by overexpressed the coat protein gene in a suitable competent bacteria. This research was aimed to carry out identification of the
Pepper vein yellows virus (PeVYV) from Kertha village, Payangan, Gianyar, Bali Province based on its transmission property by Aphis nasturtii, the morphology of virus particles, detection of total RNA by reverse transcription-polymerase chain reaction (RT-PCR), sequencing of nucleotide and expression the coat protein gene of PeVYV in Escherichia coli.
The results showed that PeVYV can be transmitted from infected plant to healthy plant by A. nasturtii (Homoptera: Aphididae). PeVYV particles are hexagonal with the diameter of ~30 nm. RT-PCR of total RNA from chlorotic plants, using specific BamHI and PstI primer pair for coat protein gene of
Polerovirus genus, were successful to amplify a DNA target sized ~650 bp. Coat protein gene sequence of PeVYV isolates from Bali, Indonesia has 99% homology over PeVYV isolates from Jepang and Taiwan. PeVYV has been proven as the cause of chlorosis in chilipepper plants in Bali, Indonesia. Furthermore, CP-PeVYV DNA was cloned into the expression vector pQE30 (Qiagen) at the same restriction enzyme BamHI and PstI sites to form the recombinant plasmid pQE30-CP-PeVYV a fusion putative protein. Optimization of the expression of recombinant CP-PeVYV performed at different incubation temperatures (25, 28, 30, and 37 ºC), final concentration of isoprophyl-β -D-thiogalactoside (IPTG) (0.25, 0.5, and 1 mM ) and the time of harvesting after IPTG induction (3, 6, 9, 12, and 15 hours).
A ~650 bp gene of PeVYV coat protein was amplified using specific primers, then was cloned into pQE30 expression vector. The recombinant CP gene was over expressed in E. coli strain M15[pREP4]. SDS-PAGE analysis showed that the recombinant coat protein gene PeVYV was expressed into a putative protein band with size about ~25 kDa at 6 hours after induction by 0.5 mM IPTG on 37 °C, but needs to be optimized to result in higher expression. Further purification of PeVYV CP is necessary to provide immunogen for production of its antibody within suitable mammals.
Keywords: Aphis nasturtii, chili pepper, coat protein, expression, Indonesia,
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
IDENTIFIKASI DAN EKSPRESI GEN PROTEIN SELUBUNG
Pepper vein yellows virus PADA Escherichia coli
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga tesis dengan judul “Identifikasi dan Ekspresi Gen Protein Selubung Pepper vein yellows virus pada Escherichia coli” ini dapat diselesaikan.
Terima kasih penulis ucapkan kepada Dr Ir Gede Suastika, MSc sebagai Ketua Komisi Pembimbing dan Dr Ir Kikin Hamzah Mutaqin, MSi sebagai Anggota Komisi Pembimbing yang telah banyak memberikan arahan, bimbingan, saran, dan motivasi selama penelitian dan penulisan tesis ini. Dr Ir Tri Asmira Damayanti, MAgr sebagai Dosen Penguji Luar Komisi dan Prof Dr Ir Sri Hendrastuti Hidayat, MSc sebagai Ketua Program Pascasarjana Fitopatologi terima kasih atas masukan dan sarannya. Penulis juga mengucapkan terima kasih kepada Fitrianingrum Kurniawati, SP MSi yang telah memberikan pengayaan ilmu, Muhammad Rizal, SP MSi, Lutfi Afifah, SP MSi dan Ida Parida, SP MSi,
rekan-rekan mahasiswa PS Fitopatologi angkatan 2012, rekan-rekan di Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman IPB atas
bantuan dan kebersamaannya.
Penulis menyampaikan rasa hormat dan terima kasih teruntuk Ayahanda Sodikin, SSos, Ibunda Jumirah, SPdSD, Amin Nur Hidayat, Arina Nur Khotimah atas segala doa, curahan kasih sayangnya, dan dukungannya kepada penulis selama ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2016
DAFTAR ISI
Pepper vein yellows virus (PeVYV) 4
Metode Deteksi Virus pada Tanaman Cabai 6
Mikroskop Elektron 6
Teknik Serologi 7
Reverse Transcription Polymerase Chain Reaction (RT-PCR) 8
Kloning Fragmen DNA 8
Vektor pQE-30 dalam Sistem Ekspresi Protein 9
3 METODE 10
Tempat dan Waktu 10
Penyiapan Isolat PeVYV 10
Mikroskopi Elektron pada Tanaman Cabai 10
Penularan Polerovirus dengan Kutudaun 10
Isolasi RNA Total dari Tanaman Sakit 10
RT-PCR 11
Sintesis cDNA 11
Amplifikasi DNA 11
Visualisasi DNA 11
Analisis Sekuen Nukleotida 11
Kloning Gen Protein Selubung PeVYV 12
Desain Primer 12
Elusi Produk PCR 12
Restriksi Plasmid pQE30 dan Gen CP PeVYV 12
Konstruksi Vektor Ekspresi 12
Persiapan Kompeten Sel E. coli strain M15[pREP4] 13
Ligasi Plasmid pQE30 dan Gen CP PeVYV 13
Transformasi 13
Konfirmasi Transforman dan PCR Koloni 14
Optimasi Ekspresi Protein CP-PeVYV 14
Analisis Protein dengan SDS-PAGE 15
4 HASIL DAN PEMBAHASAN 16
Isolat PeVYV 16
Mikroskopi Elektron pada Tanaman Cabai 16
Penularan Polerovirus dengan Kutudaun 17
Amplifikasi DNA 18
Perunutan Sekuen Nukleotida 19
Kloning Gen Protein Selubung PeVYV 21
Ekspresi Gen Protein Selubung PeVYVpada E. coli M15[pREP4] 22
5 SIMPULAN DAN SARAN 25
Simpulan 25
Saran 25
DAFTAR PUSTAKA 26
LAMPIRAN 29
RIWAYAT HIDUP 31
DAFTAR TABEL
1 Tingkat kesamaan sekuen nukleotida sebagian gen protein selubung (CP) PeVYV isolat Payangan, Bali, Indonesia dengan isolat lainnya 20 2 Ekspresi Gen Protein Selubung PeVYV pada E. coli M15[pREP4]
berdasarkan optimasi suhu, konsentrasi IPTG, dan waktu setelah
pemberian IPTG dengan analisis SDS-PAGE 23
DAFTAR GAMBAR
1 Diagram organisasi genom PLRV (Polerovirus) Genomic RNA 5 2 Vektor pQE30 dalam Sistem Ekspresi Protein (Qiagen 2008) 9 3 Vektor pQE30 dalam Sistem Ekspresi Protein CP-PeVYV 13 4 Gejala klorosis pada tanaman cabai di daerah Payangan, Gianyar, Bali 16
5 Mikrograf elektron partikel virus 17
9 Filogenetika kekerabatan PeVYV isolat cabai Bali, Indonesia 20 10 Hasil transformasi (A) kontrol negatif tanpa diberi plasmid (K-); (B)
koloni E. coli strain M15[pREP4] 21
11 Hasil PCR terhadap koloni tunggal E. coli rekombinan yang membawa
plasmid pQE30-CP-PeVYV 22
12 (a) Representasi skematik konstruksi CP-PeVYV pada vektor ekspresi pQE30 dengan enzim restriksi BamHI dan PstI, (B) Ekspresi gen
CP-PeVYV pada E.coli 24
DAFTAR LAMPIRAN
1
1
PENDAHULUAN
Latar Belakang
Cabai (Capsicum annum L.) merupakan salah satu komoditas hortikultura yang memiliki nilai ekonomi penting di Indonesia. Produktivitas cabai besar dari tahun 2010 sampai 2014 secara berfluktuasi berturut-turut yaitu 6.58, 7.34, 7.93, 8.16, dan 8.35 ton per ha sedangkan produktivitas cabai rawit dari tahun 2010 sampai 2014 secara berfluktuasi berturut-turut yaitu 4.58, 5.01, 5.75, 5.70, dan 5.93 ton per ha (BPS 2015). Hal tersebut dikarenakan oleh adanya faktor-faktor pembatas produksi yaitu lingkungan abiotik, teknik budidaya yang kurang optimum serta masalah hama dan penyakit tanaman. Penyakit yang termasuk penting pada tanaman cabai di Indonesia adalah yang disebabkan oleh beberapa virus antara lain Geminivirus, Cucumber mosaic virus (CMV), Chili veinal mottle virus (ChiVMV), Tobacco mosaic virus (TMV), serta Pepper vein yellows virus
(PeVYV).
PeVYV (Luteoviridae; Polerovirus) dilaporkan sebagai penyebab penyakit klorosis. Gejala infeksi virus yang khas yaitu menguning namun tulang daun tetap hijau sehingga tampak menyirip. Gejala ini ditemukan pada tanaman cabai di Desa Kertha, Kecamatan Payangan, Kabupaten Gianyar, Provinsi Bali (Suastika
et al. 2012). Pada tahun 1981, tanaman paprika menunjukkan gejala klorosis dengan tulang daun menguning dan daun menggulung di beberapa daerah di Kitanakagusuku, Okinawa, Ishigaki, dan Miyako, Jepang. Gejala ini awalnya diduga disebabkan oleh defisiensi magnesium. Namun, Yonaha et al. (1995) menduga penyakit ini disebabkan oleh infeksi virus. Berdasarkan pengamatan partikel virus yang diisolasi dari tanaman, partikel virus menyerupai Luteovirus, virus bereplikasi di jaringan floem, serta dapat ditularkan melalui penyambungan dan vektor Aphis gossypii Glover (Gray & Gildow 2003; Murakami et al. 2011). Buah sakit menunjukkan gejala berwarna tidak seragam dan berubah warna (diskolorisasi) pada tanaman paprika di Spanyol (Villanueva et al. 2013). Identifikasi virus sebagai penyebab penyakit merupakan salah satu faktor kunci yang menentukan keberhasilan pengendalian di lapangan. Oleh karena itu, konfirmasi virus penyebab gejala klorosis ini perlu dilakukan melalui diagnosis baik secara biologi dan molekuler.
2
seperti amplifikasi DNA, kloning, dan ekpresi gen pada bakteri ekspresi memungkinkan didapatkan sumber imunogen yang melimpah (Fajardo et al. 2007).
Keterbatasan penyediaan antiserum PeVYV menjadi kendala dalam metode deteksi sampel secara serologi. Metode serologi dijadikan pilihan untuk mendeteksi sampel dalam jumlah besar, contohnya enzyme linked immunosorbent assay (ELISA). Produksi antiserum dalam jumlah yang cukup dapat mendukung metode serologi yang digunakan sebagai metode deteksi. Perkembangan teknik biologi molekuler, kloning, dan ekpresi gen virus dapat menjadi strategi penting untuk mendapatkan antigen dalam jumlah besar dengan konsentrasi seragam dan stabil (Fajardo et al. 2007). Produksi antiserum dalam skala besar bisa dilakukan dengan pembuatan protein rekombinan dari patogen target. Teknik produksi antigen (imunogen) melalui cara ini sangat sesuai bagi produksi antiserum pada virus dengan konsentrasi rendah dan distribusinya dalam jaringan floem tanaman (phloem limited). Hal ini karena sulit mendapatkan virus murni dengan jumlah yang cukup sebagai imunogen dalam produksi antiserum.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengidentifikasi PeVYV didasarkan pada sifat penularan virus menggunakan A. nasturtii, bentuk dan ukuran partikel virus, deteksi RNA total dengan reverse transcription-polymerase chain reaction (RT-PCR), dan perunutan sekuen nukleotida, serta mengekspresikan gen protein selubung PeVYV pada bakteri ekspresi Escherichia coli.
Manfaat Penelitian
3
2
TINJAUAN PUSTAKA
Karakteristik Tanaman Cabai
Tanaman cabai adalah tanaman perdu dengan rasa buah pedas yang
disebabkan oleh kandungan kapsaisin. Cabai besar atau cabai merah (Capsicum
annuum L.) dan cabai rawit (C. frutescens L.) termasuk anggota famili Solanaceae yang diketahui dibudidayakan secara luas di Indonesia. Secara umum cabai memiliki banyak kandungan gizi dan vitamin, diantaranya kalori, protein, lemak,
kabohidarat, kalsium, vitamin A, B1, dan C (Piay et al. 2010). Tanaman cabai
telah digunakan sebagai perasa pedas, aroma, dan bahan pengawet. Selain penggunaannya sebagai bahan masakan, cabai telah dieksplorasi sebagai antimikroba dan antijamur (Omolo et al 2014). Tanaman cabai mampu hidup pada dataran rendah maupun dataran tinggi sampai dengan ketinggian 1400 m di atas permukaan laut. Suhu udara yang baik untuk pertumbuhan tanaman cabai merah adalah 25 – 27 ºC pada siang hari dan 18 – 20 ºC pada malam hari. Lahan yang paling cocok untuk tanaman cabai merah di Indonesia yaitu jenis tanah mediteran dan aluvial dengan tipe iklim D3/E3, yaitu 0 – 5 bulan basah dan 4 – 6 bulan kering. Tanaman cabai mempunyai toleransi sedang terhadap kemasaman tanah dan dapat tumbuh baik pada kisaran pH 5.5 – 6.8. Tanaman cabai merah dapat mengalami gejala klorosis dan kerdil yang disebabkan oleh kekurangan Ca, Mg, dan P atau keracunan Al dan Mn. Cabai merah termasuk tanaman yang tidak tahan terhadap kekeringan, tetapi juga tidak tahan terhadap genangan air. Syarat-syarat tumbuh tanaman cabai harus dipenuhi agar diperoleh pertumbuhan tanaman yang baik dan optimum sehingga memperoleh hasil yang tinggi (Sumarni & Muharam 2005).
Penyakit-Penyakit Virus pada Tanaman Cabai
Jenis-jenis virus penting yang menginfeksi tanaman cabai di Indonesia awalnya meliputi Geminivirus, Cucumber mosaic virus (CMV), Chili veinal mottle virus (ChiVMV), dan Tobacco mosaic virus (TMV) (Duriat et al. 2007). Virus-virus tersebut diketahui menyebabkan penurunan produksi secara kualitatif dan kuantitatif (Sulandari 2004). Geminivirus dari genus Begomovirus biasa dikenal dengan penyakit daun keriting kuning pada tanaman cabai dengan gejala berupa bercak kuning di sekitar tulang daun, tampak vein clearing yang berkembang jelas, dengan tulang daun menebal dan dan daun menggulung ke atas (cupping). Tanaman cabai yang mengalami infeksi lanjut menunjukkan gejala daun mengecil dan berwarna kuning terang, tanaman kerdil, dan produksi buah menurun atau tidak berbuah. Virus ini tidak dapat ditularkan melalui benih, tetapi dapat ditularkan melalui serangga vektor kutu kebul dan grafting
(penyambungan). Kutu kebul dapat menularkan Geminivirus secara persisten (Fauquet et al. 2003; Sulandari et al. 2006). CMV termasuk dalam kelompok
4
mengalami nekrosis. Virus ini tidak dapat ditularkan melalui benih, tetapi dapat ditularkan melalui serangga vektor kutudaun. Tanaman paprika dapat ditularkan oleh Myzus persicae yang merupakan vektor yang paling efisien di iklim dingin, sedangkan A. gossypii merupakan vektor utama untuk iklim hangat secara nonpersisten (Green & Kim 1991). Tanaman cabai yang terinfeksi ChiVMV menujukkan gejala mosaik dengan daun belang dan berwarna hijau gelap. Gejala yang paling jelas terdapat pada daun muda dan pertumbuhannya akan terhambat serta memiliki garis-garis hijau gelap pada batang dan cabang. Selain itu, buah akan menunjukkan gejala mosaik belang. Hal ini akan berdampak pada kehilangan hasil secara signifikan. Penularan virus ini dilakukan secara non persisten melalui kutudaun seperti: M. persicae, A. gossypii, A .craccivora, A.
spiraecola, dan Hysteroneura setariae (Cerkaukas 2004). Selain virus-virus tersebut
di atas, di Indonesia dilaporkan Pepper vein yellows virus (PeVYV) dapat menyebabkan penyakit klorosis pada tanaman cabai (Suastika et al. 2012).
Pepper vein yellows virus (PeVYV)
PeVYV pada awalnya diklasifikasikan sebagai spesies dari genus
Luteovirus, kemudian oleh Murakami et al. (2011) sebagai spesies baru dari genus
Polerovirus anggotafamili Luteoviridae berdasarkan analisis urutan genom secara lengkap. PeVYV pertama kali dilaporkan pada tahun 1981, tanaman paprika menunjukkan gejala klorosis dengan tulang daun menguning dan daun menggulung di Kitanakagusuku, Okinawa, Jepang. Gejala yang sama ditemukan pada area yang berbeda yaitu di Okinawa, Ishigaki, dan Kepulauan Miyako yang diduga disebabkan oleh infeksi virus (Yonaha et al. 1995). Gejala ini awalnya diduga disebabkan oleh defisiensi magnesium. PeVYV tersebut diketahui menginfeksi beberapa Solanaceae seperti Capsicum spp., terbukti dari gejala khas yang dihasilkan setelah infeksi yaitu tulang daun menguning (Rast 1992). Selain itu, tipikal gejala pada daun tanaman inang yaitu kerdil, kemerahan atau menguning maupun deformasi daun (Brault et al. 2001). Gejala ini biasanya disertai dengan bentuk buah yang mengalami malformasi (Yonaha et al. 1995). Villanueva et al. (2013) menyatakan bahwa gejala pada buah paprika berupa buah berwarna tidak seragam dan berubah warna (diskolorisasi). Berdasarkan pengamatan partikel virus yang diisolasi dari tanaman menyerupai Luteovirus
menunjukkan bahwa PeVYV bereplikasi di jaringan floem, serta dapat ditularkan melalui grafting (penyambungan) dan vektor A. gossypii Glover (Murakami et al.
2011).
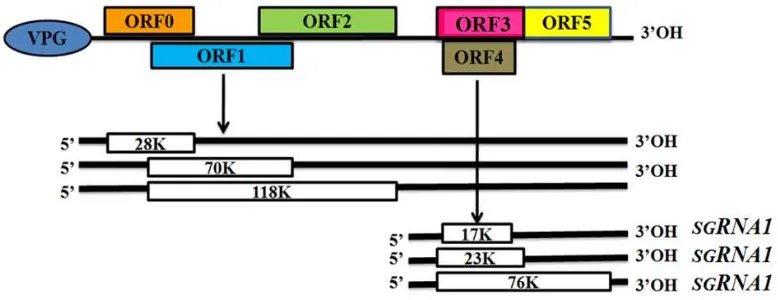
5 merupakan coat protein (CP: protein selubung) yang berperan dalam kemampuan virus untuk menginfeksi tanaman apabila CP tersebut diekspresikan, selanjutnya ditransfer oleh movement protein (MP) dari satu sel ke sel lainnya yang merupakan ORF4 yang mengkode protein 4 (P4) terdiri atas 156 asam amino yang merupakan protein VPg genome linked, dan ORF5 mengkode protein 5 (P5) yang terdiri atas 736 asam amino dan memiliki read-through domain (RTD) yang merupakan perpanjangan CP (ORF3) (NCBI 2013). PeVYV (Polerovirus) mempunyai non coding region (NCR) intergenik pada nt 199 antara ORF2 dan ORF3, sedangkan Luteovirus dan Enamovirus mempunyai sebuah NCR intergenik sekitar nt 100. Selain itu, Polerovirus ini terdiri atas utas tunggal RNA yang bersifat infeksius, linear, dan positive sense ssRNA (Regenmortel et al.
2000).
Gambar 1 Diagram organisasi genom Polerovirus pada famili Luteoviridae (Regenmortel et al. 2000).
Penularan PeVYV (Polerovirus) tidak dapat dilakukan secara inokulasi mekanis menggunakan daun dari tanaman sakit. Namun, dapat dilakukan menggunakan penyambungan (grafting) dan vektor kutudaun. Inokulasi menggunakan kutudaun dan teknik penyambungan (grafting) dapat digunakan untuk menentukan kisaran inang dari PeVYV. Yonaha et al. (1995) menyebutkan bahwa C. annuum L. var. grossum Sendt. dan C. annuum L. var. longum Sendt. dapat diinfeksi oleh PeVYV melalui teknik penyambungan (grafting). Sedangkan
C. frustescens L., Nicotiana tabacum L., N. glutinosa L., N. rustica L., dan
Solanum melongena L. tidak dapat diinfeksi oleh PeVYV melalui teknik penyambungan (grafting) tersebut.
6
yang memisahkan epidermis dan mesofil sel. Setelah stilet mencapai jaringan floem, stilet tersebut didorong melalui dinding sel ke dalam sitoplasma. Periode makan sekitar 15 - 30 menit kemudian konsumsi virus terjadi dalam 1 - 5 menit pada floem. Konsumsi virus ini bersifat spesifik dan apabila virus tersebut tidak spesifik maka akan keluar bersama madu di dalam kotoran. Periode akuisisi terjadi ketika virus diangkut melalui jaringan epitel usus aphid dan dilepaskan ke dalam haemocoel sekitar 12 - 16 jam. Virus bertahan di haemolimf selama beberapa minggu dan secara pasif diangkut ke kelenjar ludah dan masuk ke jaringan floem tanaman inang. Periode laten secara sirkulatif terjadi antara periode waktu kutudaun berhasil saat transmisi dan konsumsi virus. Secara umum, periode laten minimum untuk transmisi yang efisien sedikitnya 24 jam dan dapat diperpanjang 3 - 4 hari. Panjang periode laten dipengaruhi oleh genetik, konsentrasi virus di jaringan tanaman, dan faktor lingkungan misalnya suhu (Gray & Gildow 2003).
Metode Deteksi Virus pada Tanaman Cabai
Deteksi tanaman cabai yang terinfeksi oleh virus secara umum dapat dilakukan secara konvensional maupun molekuler. Teknik deteksi secara konvensional dilakukan dengan cara melihat perkembangan gejala pada tanaman yang terinfeksi, penggunaan tanaman indikator, sifat fisik virus, mikroskopi elektron. Teknik deteksi secara molekuler dilakukan dengan uji serologi, RT-PCR, dan kloning DNA virus. Teknik deteksi secara konvensional relatif mudah dan murah untuk diaplikasikan, tetapi teknik ini hanya dapat dilakukan pada virus-virus yang telah dilaporkan dan tidak dapat memberikan informasi spesies virus yang menginfeksi. Sebagai contoh, deteksi dan identifikasi Begomovirus
dengan metode konvensional sering tidak mungkin dilakukan karena tidak semua anggota genus Begomovirus dapat ditularkan secara mekanis dengan cairan perasan tanaman terinfeksi (Aidawati 2006). Oleh karena itu, teknik deteksi secara molekuler hingga kini dianggap teknik yang paling akurat, cepat, dan dapat memberikan informasi yang komprehensif mengenai penyebab penyakit tanaman cabai yang disebabkan oleh virus.
Mikroskopi Elektron
7 serta analisa elemental skalananometer. Namun, berbeda halnya dengan SEM yang diketahui memfokuskan sinar elektron di permukaan obyek dan mengambil gambarnya dengan mendeteksi elektron yang muncul dari permukaan objek, biasanya digunakan untuk studi arsitektur jasad renik secara tiga dimensi. Perbedaan mendasar dari TEM dan SEM adalah cara elektron yang ditembakkan oleh pistol elektron mengenai sampel. Pada TEM, menggunakan sampel yang sangat tipis sehingga dapat ditembus oleh elektron kemudian hasilnya diolah menjadi gambar. Berbeda halnya pada SEM, sampel tidak ditembus oleh elektron sehingga hanya pendaran hasil dari tumbukan elektron dengan sampel yang ditangkap oleh detektor. TEM memiliki resolusi superior 0.1 - 0.2 nm lebih besar dari SEM, mampu mendapatkan informasi komposisi dan kristalografi dari bahan uji dengan resolusi tinggi, serta memungkinkan mendapatkan berbagai signal utama dari satu lokasi yang sama (Williams & Carter 2009).
Terdapat dua teknik yang dikembangkan dengan mikroskop elektron, yaitu bayangan logam (metal shadowing atau shadow casting) dan pewarnaan negatif (negative staining). Teknik bayangan logam merupakan teknik SEM yang digunakan untuk memberikan gambar tiga dimensi yang biasanya untuk mempelajari bentuk virus dan bakteri kemudian dilapisi logam berat seperti emas atau palladium sehingga menciptakan bayangan spesimen. Teknik pewarnaan negatif merupakan teknik TEM yaitu metode yang digunakan untuk mengiris sel-sel mikroba menjadi irisan tipis mikroskopis mengunakan metal berat seperti timah atau uranil asetat sehinggga terlihat jelas adanya struktur dan ukuran virus dari latar belakang yang gelap (Noordam 1973).
Teknik Serologi
Uji serologi merupakan upaya pengembangan dari teknik diagnosis secara konvensional. Prinsip utama uji serologi adalah mereaksikan antibodi dengan antigen yang sesuai. Sifat khas antobodi dan antigen dimanfaatkan sebagai alat identifikasi patogen dan diagnosis penyakit virus pada tanaman. Antibodi adalah zat kekebalan yang dilepaskan oleh sel darah putih untuk mengenali serta menetralisir antigen yang masuk ke dalam tubuh. Antigen adalah senyawa yang mampu mengimbas tanggap imun apabila diinjeksikan ke dalam hewan berdarah panas. Ketersediaan antiserum dengan kualitas baik memiliki peran penting dalam menentukan keberhasilan dan ketelitian diagnosis virus (Kumari et al. 2006).
Beberapa teknik deteksi virus yang berbasis serologi antara lain teknik difusi agar, dotblotimmunoblotting assay (DBIA), tissue-blotimmunoblotting assay (TBIA), Western blotting, agarose gel precipitation test (AGPT), dan
8
digunakan untuk mengamplifikasi reaksi antigen dan antibodi. Teknik ELISA terbagi menjadi double antibody sandwich ELISA (DAS-ELISA) dan indirect
ELISA (I-ELISA). Perbedaan utama DAS ELISA dan I-ELISA terletak pada urutan peletakan antigen (sampel virus) (Hampton et al. 1990).
Reverse Transcription Polymerase Chain Reaction (RT-PCR)
Deteksi PeVYV pada cabai sangat diperlukan dalam strategi pengendalian. Teknik RT-PCR ini sangat berguna untuk mendeteksi ekspresi gen, amplifikasi RNA sebelum dilakukan kloning dan analisis, maupun diagnosis agensia infektif maupun penyakit genetik. RT-PCR merupakan teknik PCR yang dapat menggandakan RNA menjadi DNA. Teknik RT-PCR terdiri atas dua reaksi yaitu reaksi transkripsi balik (reverse transcription) yang menggunakan genom RNA virus sebagai cetakan dan menghasilkan cDNA primer (untai tunggal) serta reaksi penggandaan PCR. Reaksi PCR sangat sensitif sehingga dapat melipatgandakan satu molekul DNA dan memisahkan gen-gen tunggal dari sekelompok sekuen genom. Primer yang digunakan sesuai dengan virus yang akan dideteksi. PCR merupakan teknik yang relatif sederhana dan merupakan teknik penggandaan (amplifikasi) dengan menggunakan DNA primer yang memiliki runutan nukleotida khas untuk molekul asam nukleat yang akan dideteksi. Primer merupakan molekul oligonukleotida yang disintesis in vitro dan runutan nukleotidanya disesuaikan dengan genom virus yang akan dideteksi. PCR hanya akan menggandakan asam nukleat yang sesuai dengan primer (Yuwono 2006).
Berdasarkan Murakami et al. (2011) telah dilakukan deteksi RT-PCR menggunakan beberapa primer dari PeVYV dari tanaman terinfeksi dengan ukuran produk RT-PCR dari 300 sampai 800 bp yang diperoleh sesuai dengan metode Ryabov dan diklon ke pGEM-T Easy Vector (Promega). RT-PCR dilakukan dengan menggunakan sampel dari tanaman terinfeksi, membenarkan bahwa urutan sekuen merupakan urutan PeVYV.
Kloning Fragmen DNA
Kloning, disebut juga teknologi DNA rekombinan, merupakan suatu metode untuk menggandakan sebuah gen yang meliputi serangkaian proses isolasi fragmen DNA spesifik dari genom suatu organisme, penentuan sekuen atau fragmen DNA, pembentukan molekul DNA rekombinan, dan ekpresi gen target dalam sel inang. DNA rekombinan merupakan gabungan antara DNA vektor yang merupakan molekul DNA yang dapat mereplikasi diri dan DNA asing yang berupa gen target suatu mahluk hidup (Sambrook et al. 2001).
9 resisten terhadap antibiotik, dan memiliki beberapa situs restriksi yang unik (Sambrook et al. 2001; Paolella 1998).
Vektor pQE-30 dalam Sistem Ekspresi Protein
Ekspresi gen adalah proses regulasi gen dari organisasi genom makhluk hidup. Ekspresi gen pada prokariot dikenal dengan istilah sistem operon berupa sekelompok gen struktural yang ekspresinya dikendalikan oleh satu promoter yang sama. Salah satu organisme prokariot yang memiliki sistem operon yaitu
E. coli. E.coli mampu melakukan metabolisme laktosa karena memiliki sistem operon yang disebut operon lac yaitu satu gen regulator (gen lac I) dan tiga struktural yaitu gen lacZ, lacy, dan lacA. Gen lacZ mengkode β-galaktosidase
yang berfungsi menghidrolisis laktosa menjadi monosakarida yaitu galaktosa dan glukosa; gen lacY mengkode enzim permease yang berfungsi meningkatkan permeabilitas sel sehingga laktosa dapat diangkut dari luar sel ke dalam sel; dan gen lacA mengkode trans-asetilase (Robert 2006).
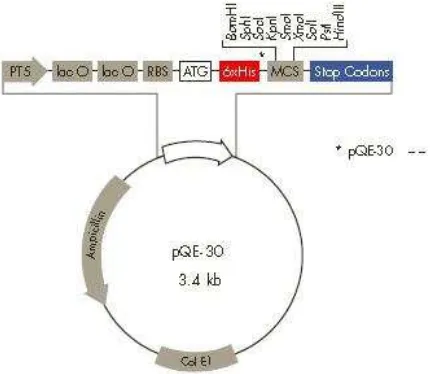
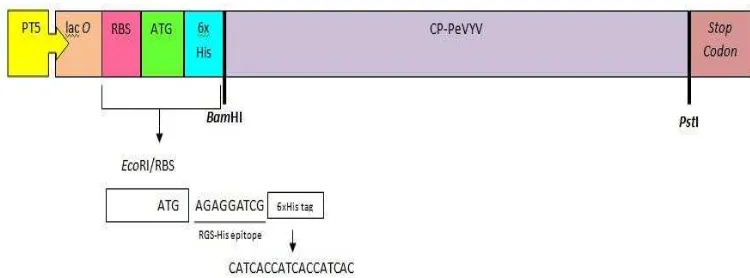
Vektor ekspresi merupakan mediator yang digunakan untuk mengekspresikan gen asing sehingga dapat dikenali oleh sel inang, contohnya plasmid. Penggunaan primer pQE-30 Sequencing-Primer Set dapat digunakan untuk penyisipan runutan pada vektor pQE-30. Primer yang dimasukkan dalam reaksi PCR mengandung vektor untuk disekuen, dNTPs, DNA polymerase, dan rantai fluorescens mengakhiri analog nukleotida (dye terminators). E. coli strain M15[pREP4] dan SG13009[Prep4] membawa plasmid pREP4 yang konstitutif sehingga memungkinkan ekspresi antar protein sebelum induksi IPTG serta diseleksi melalui antibiotik kanamisin. Plasmid pQE-30 (Gambar 2) berukuran sekitar 3.4 kb yang memiliki promoter T5, lacO, synthetic ribosome-binding site
(RBSII), ATG (start codon), sekuen 6xHis tag, multicloning site (MCS) dan stop codons (Qiagen 2008). Ekspresi protein diinduksi dengan penambahan isopropyl– thio-D-galactose (IPTG).
Gambar 2 Vektor pQE30 dalam Sistem Ekspresi Protein. PT5: promoter T5, lac O: operator lac, RBS: ribosome binding site, ATG: start kodon, 6xHis: sekuen His tag, MCS: multiple cloning site, stop codons: kodon stop pada reading frame ketiga, Col EI: Col EI origin of replication,
10
3
METODE
Tempat dan Waktu
Penelitian ini dilaksanakan pada bulan September 2012 sampai dengan Desember 2014 di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Penyiapan Isolat PeVYV
Sampel tanaman cabai yang bergejala klorosis berasal dari Desa Kertha, Kecamatan Payangan, Kabupaten Gianyar, Provinsi Bali. Sampel tersebut merupakan koleksi hidup yang dipelihara di Laboratorium Virologi Tumbuhan, Departeman Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor yang digunakan sebagai sumber inokulum virus PeVYV.
Mikroskopi Elektron Partikel Polerovirus
Daun cabai bergejala dicacah halus kemudian sap yang diperoleh diteteskan ke grid secara negative staining menggunakan Glutaraldehyde dengan 25% Aqueous Solution (0.1 M Cacodylate Buffer pH 7.4 ditambah 3% Sukrosa). Spesimen tersebut diwarnai uranyl acetate dan lead citrate dan diamati menggunakan mikroskop elektron (JEOL JEM 1010, 80 kV) di Lembaga Biologi Molekuler Eijkman Jakarta.
Penularan Polerovirus dengan Kutudaun
Penularan Polerovirus dilakukan menggunakan serangga kutudaun Aphis
11 0.5 volume (~225 µL) dari supernatan, kemudian dipindahkan ke dalam tabung XPLR mini column dan disentrifugasi 13 000 rpm selama 1 menit, kemudian dicuci menggunakan 500 µL wash buffer 1 dan 750 µL wash buffer 2, selanjutnya disentrifugasi 13 000 rpm selama 1 menit, kemudian dibuang dan ditambahkan 50 µL Rnase-freewater sehingga diperoleh RNA total.
RT-PCR ScientificTM, US), 0.35 µL MMuLV reverse transcriptase (Revertaid-Thermo ScientificTM, US), 2.2 µL air bebas nuklease sampai volume total (Thermo ScientificTM, US). Reaksi RT dilakukan pada suhu 42 °C selama 60 menit dan dilanjutkan inaktivasi enzim RT pada suhu 95 °C selama 5 menit.
Amplifikasi DNA
Reaktan PCR dilakukan dengan volume total 25 µL, terdiri atas cDNA 3 µL, Go Tag Green Master Mix 2x 12.5 µL (Promega®, US), air bebas nuklease 7.5 µL, amplifikasi protein selubung dilakukan dengan menggunakan sepasang primer spesifik CP PeVYV. Primer forward F-BamHI (5’-AATTAA
GGATCCCAATACGGGAGGGGTTAGGAGAAAT-3’) dan primer reverse R-PstI (3’-AATTAACTGCAGTTTCGGGTTGTGCAATTGCACAGTA-5’) (Suastika et al. 2012) masing-masing 1 µL. Reaksi PCR dilakukan dengan Perkin Elmer 480 Thermocycler (Applied Biosystem®, US). Program PCR yang digunakan yaitu denaturasi inisiasi pada 94 °C selama 5 menit, kemudian dilanjutkan 35 siklus yang terdiri atas denaturasi 94 °C selama 30 detik, penempelan primer (annealing) pada suhu 50 °C selama 1 menit, pemanjangan pada suhu 72 °C selama 1 menit, dan diikuti pemanjangan akhir pada suhu 72 °C selama 10 menit.
Visualisasi DNA
Visualisasi fragmen DNA hasil amplifikasi PCR dielektroforesis menggunakan gel agarosa 1% dalam bufer Tris-borate EDTA (TBE) 0.5X dengan tegangan 100 volt DC selama 30 menit. Pengamatan dilakukan dengan UV
transiluminator setelah direndam dalam larutan ethidium bromide 2% selama 15 menit.
Analisis Sekuen Nukleotida
12
Polerovirus lainnya yang terdeposit dalam Genbank dianalisis dengan program
ClustalW BioEdit. Pohon filogenetik berdasarkan runutan nukleotida gen CP dibuat menggunakan program perangkat lunak Molecular Evolutionary Genetic Analysis (MEGA 5.1) menggunakan neighbour joining dengan bootstrap
sebanyak 1000 kali.
Kloning Gen Protein Selubung PeVYV
Desain Primer
Desain primer gen CP PeVYV diperoleh dari sekuen gen protein selubung dari GenBank dan sekuen nukleotida PeVYV hasil sekuensing. Primer forward
didesain mulai dari ujung 5’ berupa start codon yang tidak diikutkan dalam frame gen CP dan digantikan oleh start codon yang ada pada vektor ekspresi pQE30 kemudian ditambahkan sekuen tambahan AATTAA dan enzim restriksi BamHI (GGATCC). Primer reverse diakhiri stop codon dari ORF gen CP PeVYV dan ditambahkan sekuen tambahan AATTAA dan ditambahkan sekuen dari enzim restriksi PstI (CTGCAG) pada ujung 3’ (Suastika et al. 2012).
Elusi Produk PCR
Produk PCR dari hasil RT-PCR dielektroforesis dalam gel agarose 1%. Produk PCR dan marker DNA 1 Kpb (Thermo ScientificTM, US), masing-masing 10 µL dan 5 µL dimasukkan ke dalam sumuran yang telah disiapkan pada gel agarose. Elektroforesis dilakukan selama 30 menit pada 100 volt. DNA yang telah dielektroforesis kemudian divisualisasi dengan UV transiluminator. Pengamatan dilakukan dengan UV transiluminator setelah direndam dalam larutan ethidium bromide 2% selama 15 menit. Bagian gel tepat pada produk PCR dipotong dan dimasukkan ke tabung yang sudah ditambahkan 500 µL Bufer DF (Hi Yield®, China), kemudian divortex dan diinkubasi pada suhu 55 °C sampai gel cair. Siapan kemudian dimasukkan ke DF column dan disentrifugasi dengan kecepatan 8000 rpm selama 1 menit. Selanjutnya, 500 µL wash buffer (Hi Yield®, China) dimasukkan dalam DF column dan disentrifugasi pada kecepatan 8000 rpm selama 1 menit. Sebanyak 20 µL Bufer Elusi (Hi Yield®, China) dimasukkan dalam DF column dan disentrifugasi pada kecepatan 8000 rpm selama 1 menit. Hasil elusi (yang merupakan gen CP PeVYV) disimpan pada suhu -20 °C.
Restriksi Plasmid pQE30 dan Gen CP PeVYV
Plasmid pQE30 dan gen CP PeVYV (hasil PCR) direstriksi dengan enzim
BamHI dan PstI. Reaktan untuk masing-masing restriksi yang dilakukan dengan total volume 20 µL memiliki komponen: 1 µL plasmid pQE30, 1 µL enzim
BamHI, 1 µL enzim PstI, 2 µL medium bufer, dan 15 µL ddH2O. Reaksi restriksi dinkubasi pada suhu 37 °C selama semalam.
Konstruksi Vektor Ekspresi
13 pemotongan BamHI/PstI. Selain itu, terdapat promoter T5 atau operon lac
sebelum start codon, protein His tag, dan stop codon pada ujung belakang dari pQE30 sehingga terbentuk pQE30 CP-PeVYV (Gambar 3).
Gambar 3 Vektor pQE30 dalam Sistem Ekspresi Protein CP-PeVYV. Persiapan Kompeten Sel E. coli strain M15[pREP4]
Stok E. coli strain M15[pREP4] dalam gliserol digoreskan pada media agar LB yang mengandung ampisilin 50 µg/mL dan kanamisin 25 µg/mL, kemudian diinkubasi semalam pada suhu 37 °C. Biakan E. coli strain M15[pREP4] tersebut dipindahkan ke dalam 5 mL LB broth yang mengandung antibiotik kemudian diinkubasi semalam pada suhu 37 °C, kemudian biakan bakteri tersebut dipindahkan ke dalam 50 mL media A (LB, MgSO47H2O 10 mM, glukosa 0.2%) dan diinkubasi selama 2 jam, kemudian dipindahkan ke tabung Falcon steril dan diinkubasi dalam es selama 10 menit kemudian disetrifugasi dengan kecepatan 4000 rpm, selama 15 menit pada suhu 4 °C. Supernatan dibuang dan diambil peletnya. Pelet diresuspensi dengan 2.5 mL media B (LB, gliserol 36%, PEG 7000 12%, dan MgSO47H2O 12 mM). Siapan bakteri tersebut kemudian dipindahpisahkan masing-masing 100 µL ke tabung eppendorf 1.5 mL dan disimpan di freezer -80 °C sampai digunakan untuk transformasi (Nishimura
et al. 2003).
Ligasi Plasmid dan Gen CP PeVYV
Gen CP PeVYV disisipkan ke dalam plasmid pQE30 melalui reaksi ligasi mengikuti prosedur yang dibuat produsen plasmid (Qiagen®, US). Ligation mix
dengan total volume 10 µL terdiri atas 2 µL plasmid pQE30, 2 µL gen CP PeVYV, 1 µL enzim T4 DNA ligase 10X, 1 µL bufer ligasi, dan 4 µL ddH2O. Reaksi ligasi dilakukan pada suhu 4 °C selama 16 jam. Hasil ligasi akan menghasilkan plasmid pQE30 yang mempunyai insert gen CP PeVYV, yang untuk selanjutnya disebut plasmid pQE30-CP PeVYV.
Transformasi
14
12 000 rpm 1 menit dan supernatan dibuang. Pelet dan LB yang masih tersisa sampai 100 µL dihomogenasi, dan terakhir ditumbuhkan dalam media LB agar mengandung ampisilin 50 µg/mL dan kanamisin 25 µg/mL (Sambrook & Russel 2001).
Konfirmasi Transforman dan PCR Koloni
Transforman ditumbuhkan pada media LB cair yang mengandung ampisilin 50 µg/mL dan kanamisin 25 µg/mL. Sel dari biakan yang berumur 18 jam dipanen dan diisolasi plasmidnya dengan metode lisis alkalin (Sambrook & Russel 2001). Konfirmasi transfroman dilakukan dengan klon rekombinan yang dicek menggunakan koloni PCR.
Satu tusuk gigi klon transforman dimasukkan ke tabung eppendorf berisi ddH2O 10 µL dan diinkubasi pada suhu 95 °C selama 10 menit disiapkan sebagai template PCR sebanyak 1 µL. Reaktan PCR dilakukan dengan volume total 20 µL, primer PeVYV forward F-BamHI dan primer reverse R-PstI masing-masing 1 µL. Reaksi PCR dilakukan dengan Perkin Elmer 480 Thermocycler (Applied Biosystem®, US). Program PCR yang digunakan yaitu denaturasi inisiasi pada 94 °C selama 5 menit, kemudian dilanjutkan 35 siklus yang terdiri atas denaturasi 94 °C selama 30 detik, penempelan primer (annealing) pada suhu 50 °C selama 1 menit, pemanjangan pada suhu 72 °C selama 1 menit, dan diikuti pemanjangan akhir pada suhu 72 °C selama 10 menit. Hasil amplifikasi PCR plasmid tersebut dengan dielektroforesis menggunakan gel agarosa 1% dalam buffer Tris-borate (TBE) 0.5X pada tegangan 100 volt selama 30 menit. Pengamatan dilakukan dengan UV transluminator setelah direndam dalam larutan ethidium bromide 2% selama 15 menit.
Ekspresi Gen Protein Selubung PeVYV pada E. coli M15[pREP4]
Optimasi Ekspresi Protein CP-PeVYV
E.coli strain M15[pREP4] yang membawa plasmid rekombinan pQE30-CP-PeVYV diinokulasi ke dalam 10 mL media LB yang mengandung ampisilin 50 g/mL dan kanamisin 25 g/mL. Biakan diinkubasi di dalam orbital shaker
15 Analisis Protein dengan SDS-PAGE
Separating gel 12.5% 0.375 M tris pH 8.8 dibuat dengan mencampur 12 mL akuades, 9 mL (tris HCl 1.5 M pH 8.8 dan SDS 10% ), 15 mL
acrylamide/bis, 0.17 mL amonium persulfat (APS) 10%, dan 0.02 mL TEMED (Merck©), kemudian dipipet pada cetakan gel dan dibiarkan hingga membeku.
Stacking gel 4% 0.125 M tris pH 6.8 dibuat dengan mencampur 7.2 mL akuades, 3 mL (tris HCl 0.5 M pH 6.8 dan SDS 10%), 1.8 mL acrylamide/bis, 0.045 mL APS 10%, dan 0.02 mL TEMED (Merck©), kemudian dipipet dan diletakkan diatas separating gel yang sudah membeku dan stacking gel ditunggu sampai membeku. Setelah stacking gel membeku, dipindahkan ke dalam alat elektroforesis. Sebanyak 50 µL marker protein (BioradTM) dan 50 µL insoluble (1 mL protein hasil ekspresi yang ditambahkan 50 µL loading buffer (BioradTM) didenaturasi pada suhu 95 oC selama 10 menit, kemudian dipipet dan dimasukkan ke dalam gel yang diletakkan pada alat elektroforesis. Elektroforesis dilakukan dengan Biorad power pac 300 selama 210 menit dengan tegangan 150 volt DC. Gel hasil elektroforesis dilepas dari cetakannya dan dimasukkan ke dalam larutan
4
HASIL DAN PEMBAHASAN
Isolat PeVYV
Penyakit klorosis pada ketiga isolat tanaman cabai menunjukkan variasi gejala yaitu gejala ringan, sedang, dan berat. Gejala ringan berupa klorosis pada daun cabai (Gambar 4A). Gejala sedang berupa klorosis dengan menguningnya lamina daun (Gambar 4B). Sedangkan gejala berat berupa klorosis dengan menguningnya lamina daun disertai dengan penebalan daun (Gambar 4C). Penyakit klorosis dengan menguningnya tulang daun yang ditemukan pada daun cabai di Bali, Indonesia tersebut seperti halnya dengan yang dilaporkan oleh Suastika et al. (2012) yang disebabkan oleh Polerovirus. Namun, gejala yang ditemukan pada daun cabai di Bali, Indonesia tersebut tidak memperlihatkan pemendekan internoda atau daun yang menggulung. Yonaha et al. (1995) melaporkan bahwa tanaman cabai yang diinokulasi mekanis menggunakan sap dari daun tanaman cabai sakit tidak menunjukkan gejala klorosis. Namun, setelah dilakukan grafting (penyambungan) dan vektor kutudaun terjadi gejala klorosis dengan menguningnya tulang daun secara jelas pada bagian atas daun dan setelah itu semua daun berkembang menjadi menggulung dan menguning. Gejala ini biasanya disertai dengan bentuk buah mengalami malformasi. Berdasarkan gejala tersebut, terdapat kemiripan dengan penyakit yang diinduksi oleh PeVYV yang telah dilaporkan di beberapa negara lain (Yonaha 1995; Murakami et al. 2011).
Gambar 4 Gejala Polerovirus pada daun cabai asal Payangan, Bali, Indonesia,
diklasifikasikan menjadi tiga gejala: (A) ringan, (B) sedang, dan (C) berat.
Mikroskopi Elektron Partikel Polerovirus
17
Gambar 5 Mikrograf elektron partikel virus berbentuk heksagonal berukuran diameter ~30 nm yang terdapat pada sap tanaman cabai bergejala klorosis. Skala menunjukkan ~100 nm.
Penularan Polerovirus dengan Kutudaun
Hasil penularan virus menggunakan kutudaun Aphis sp. yang ditunjukkan dalam Gambar 6. A. nasturtii berhasil menularkan Polerovirus yang menyebabkan gejala klorosis pada semua tanaman cabai uji. Periode inkubasi untuk penularan 5 ekor kutudaun pada kesepuluh cabai besar dan kesepuluh cabai rawit yaitu 7 sampai 14 hari. Kejadian penyakit dan tipe gejala pada penularan melalui
A. nasturtii dapat mencapai 100% dengan tipe gejala klorosis disertai penebalan daun.
Gambar 6 (A) Daun cabai sakit sebagai inokulum; (B) Daun tanaman cabai sakit hasil penularan vektor kutudaun; dan (C) kutudaun A. nasturtii
sebagai vektor PeVYV pada tanaman cabai: (1) terminal proses, (2)
antena tubercle, (3) striduratory apparatus tidak ada, (4) cauda, (5) sifunkuli, dan (6) femur.
Gambar 6A menunjukkan daun cabai sakit bergejala klorosis yang digunakan sebagai inokulum. Berdasarkan hasil penularan menggunakan vektor kutudaun A. nasturtii berhasil menunjukkan gejala klorosis disertai dengan malformasi daun (Gambar 6B). Hal ini sesuai dengan pernyataan Yonaha et al.
(1995) bahwa tanaman cabai yang hanya dapat ditularkan menggunakan vektor kutudaun serta grafting (penyambungan) dan tidak dapat diinokulasi secara
18
mekanis menggunakan sap dari daun tanaman cabai sakit. Penularan ini dilakukan secara persisten sirkulatif oleh kutudaun. Seperti halnya yang dikemukakan oleh Gray dan Gildow (2003) yang menyatakan bahwa virus terbawa dan bergerak dalam saluran makanan melalui foregut dan terakumulasi dalam midgut atau
hindgut kemudian virus terakumulasi dalam haemocoel selama satu sampai dua minggu. Penularan virus kemudian diinjeksikan ke dalam tanaman melalui saluran air liur ketika kutudaun tersebut makan pada tanaman.
Hasil identifikasi menunjukkan bahwa spesies kutudaun yang mampu menularkan virus Polerovirus adalah A. nasturtii. Hal ini berbeda dengan yang telah dilaporkan oleh Yonaha et al. (1995) yang menyebutkan bahwa A. gosypii
dan M. persicae yang mampu menularkan virus Polerovirus. Gambar 6C menunjukkan ciri-ciri A. nasturtii sebagai berikut: (1) terminal proses pada antena
lebih panjang dari pada base, (2) antena tubercle tidak berkembang, (3) striduratory apparatus tidak ada, (4) cauda berbentuk lidah (tongue) dan
berwarna pucat, (5) sifunkuli berwarna pucat dan ujungnya berwarna gelap, dan (6) Rambut pada femur panjang. Ciri morfologi secara makroskopis antara
A. nasturtii dan A. gosypii adalah sangat mirip, tetapi ketika diidentifikasi secara mikroskopis menunjukkan adanya perbedaan pada A. nasturtii yaitu sifunkuli berwarna pucat dengan ujung yang berwarna gelap.
Amplifikasi DNA
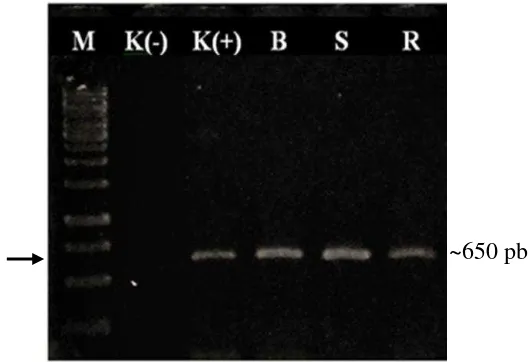
Teknik RT-PCR menggunakan primer spesifik CP-PeVYV berhasil mengamplifikasi fragmen DNA ~650 pb pada sampel yang menunjukkan gejala positif seperti halnya pada kontrol positif dari daun tanaman cabai asal Payangan, Bali, Indonesia (Gambar 7). Berdasarkan hasil amplifikasi tersebut, isolat bergejala berat digunakan dalam analisis perunutan sekuen nukleotida dan digunakan sebagai insert kloning.
Gambar 7 Hasil amplifikasi DNA sampel daun tanaman cabai bergejala klorosis berat (B), sedang (S), dan ringan (R), K(-), kontrol sehat dan K(+), kontrol positif dari tanaman sakit. M adalah marker 1 Kpb DNA ladder (Thermo Scientific, US).
19 Keberhasilan penularan virus menggunakan vektor kutudaun A. nasturtii
dikonfirmasi dengan RT-PCR yang menunjukkan Polerovirus positif teramplifikasi DNA berukuran ~650 pb pada semua tanaman uji hasil penularan (Gambar 8). Penularan ini dilakukan secara sirkulatif oleh kutudaun (Gray & Gildow 2003).
Gambar 8 Hasil amplifikasi DNA sebanyak sepuluh sampel daun tanaman
cabai bergejala klorosis dari hasil penularan menggunakan
A. nasturtii, K(-), kontrol sehat dan K(+), kontrol positif dari tanaman sakit, 1 - 10: sampel tanaman uji hasil penularan. M adalah marker 1 Kpb DNA ladder (Thermo Scientific, US).
Perunutan Sekuen Nukleotida
Sekuen gen CP PeVYV isolat Payangan, Bali memiliki kekerabatan yang sangat dekat dengan PeVYV isolat Jepang dan Taiwan hampir 99% (Tabel 1). Menurut King et al. (2012) jika terdapat persamaan sekuen nukleotida dari gen protein selubung antara satu virus dengan virus yang lain dengan nilai lebih dari 90%, maka virus-virus tersebut merupakan spesies virus yang sama. Analisis filogenetika pada kladogram menunjukkan hubungan kekerabatan Polerovirus
(Luteoviridae) (Gambar 9). Polerovirus isolat Bali, Indonesia baik yang bergejala klorosis termasuk ke dalam spesies Pepper vein yellow virus (PeVYV) serta memiliki kekerabatan yang dekat dengan PYLCV asal Israel dan TVDV asal Cina, tetapi berada paling jauh kekerabatannya dengan CABYV asal Jepang dan PABYV asal Mali. PeVYV sangat mirip dengan PYLCV isolat Israel seperti yang dikemukakan oleh Dombrovsky et al. (2013). Perbedaan hubungan kekerabatan tersebut kemungkinan berkorelasi dengan perbedaan inang dari masing-masing virus dari genus Polerovirus, family Luteoviridae tersebut. Barley yellow dwarf virus (BYDV) asal Turki digunakan sebagai outgrup dalam analisis ini. BYDV asal Turki ini dilaporkan juga merupakan anggota genus Luteovirus dari famili Luteoviridae. Pensejajaran sekuen nukleotida dengan Clustal W menunjukkan bahwa gen CP-PeVYV virus tanaman cabai asal Bali memiliki homologi dengan virus-virus tersebut dan beberapa perbedaan nukleotida pada beberapa lokasi.
20
Tabel 1 Tingkat kesamaan sekuen nukleotida sebagian gen protein selubung (CP) PeVYV isolat cabai Payangan, Bali, Indonesia dengan isolat lainnya yang telah dilaporkan menggunakan program Bioedit V.7.0.5
Keterangan: PeVYV: Pepper vein yellow virus; CABYV: Cucurbit aphid borne yellow; PABYV:
Pepo aphid borne yellows virus; PYLCV: Pepper yellow leaf curl virus; TVDV:
Tobacco vein distorting virus; Barley yellow dwarf virus (BYDV)
Gambar 9 Filogenetika kekerabatan Polerovirus isolat cabai Bali, Indonesia berdasarkan sikuen nukleotida sebagian gen coat protein (CP) menggunakan metode neighbour joining tree pada program MEGA 5.1dengan bootstrap 1000.
PeVYV_Jepang
PeVYV_Taiwan
PeVYV_Bali_Indonesia
PeVYV_Filipina
PeVYV_Mali
PeVYV_Thailand
PeVYV_India
PeVYV_Turki
PYLCV_Israel
TVDV_Cina
CABYV_Jepang
PABYV_Mali
21 Kloning Gen Protein Selubung PeVYV
Keberhasilan proses ligasi ditunjukkan oleh plasmid pQE30 yang digunakan sebagai vektor dengan fragmen DNA dari gen CP-PeVYV yang diintroduksi ke dalam E. coli strain M15[pREP4]. Proses transformasi selanjutnya menggunakan bakteri E. coli kompeten. Hasil transformasi ditunjukkan oleh kemampuan tetap tumbuhnya E. coli berupa koloni berwarna putih pada media yang mengandung ampisilin (Gambar 10).
Gambar 10 Hasil transformasi (A) kontrol negatif tanpa diberi plasmid (K-); (B) koloni E. coli strain M15[pREP4] yang membawa plasmid rekombinan pQE30-CP-PeVYV yang tumbuh pada media LB yang
mengandung antibiotik ampisilin 50 g/mL dan kanamisin 25 g/mL.
22
Gambar 11 Hasil PCR terhadap koloni tunggal E. coli rekombinan yang membawa plasmid pQE30-CP-PeVYV dengan primer spesifik genus
Polerovirus F-BamHI dan R-PstI (1, 2, 3, 4, 5, dan 6); M adalah marker 1 Kpb DNA ladder (Thermo Scientific, US).
Ekspresi Gen Protein Selubung PeVYVpada E. coli M15[pREP4]
Plasmid rekombinan pQE30-CP yang membawa gen CP-PeVYV berhasil dikonstruksi dengan menyisipkan gen tersebut pada situs pemotongan BamHI/
PstI. Klon E. coli strain M15[pREP4] (Qiagen) yang positif membawa plasmid rekombinan telah berhasil diseleksi dengan PCR berukuran ~650 pb. Optimasi ekspresi rekombinan CP-PeVYV dilakukan pada beberapa suhu inkubasi yang berbeda (25 oC, 28 oC, 30 oC, dan 37 oC), konsentrasi Isoprophyl-β -D-thiogalactoside (IPTG) final (0.25, 0.5, dan 1 mM) dan waktu panen setelah diinduksi IPTG (3, 6, 9, 12, dan 15 jam) pada Tabel 2. Hasil analisis dengan SDS-PAGE menunjukkan plasmid rekombinan pQE30-CP-PeVYV dengan fusi protein berukuran ~25 kDa yang diduga sebagai CP PeVYV terdeteksi pada klon yang diinduksi dengan IPTG dibanding klon yang tidak diinduksi. Hal ini menunjukkan bahwa gen CP PeVYV telah berhasil diekspresikan dalam pQE30 dengan E. coli
strain M15[pREP4] (Qiagen).
PeVYV memiliki kesamaan dengan Pepper yellow leaf curl virus
(PYLCV) yang termasuk dalam genus Polerovirus. Gejala dari PYLCV meliputi pemendekan ruas batang, menguningnya tulang daun, keriting, kecil, dan buah berubah warna. Analisis sekuen genom PYLCV berukuran 6 028 pb yang terdiri atas enam open reading frames (ORFs). ORF0 mengkode 28.14 kDa protein 0 (P0), ORF1 mengkode 72.12 kDa protein 1 (P1), ORF2 mengkode 65.58 kDa protein 2 (P2) yang diduga berperan sebagai RNA-dependent RNA polymerase
(RdRp), ORF3 mengkode 22.51 coat protein (CP: protein selubung), dan sejajar ORF4 yang mengkode movement protein (MP), ORF5 memiliki read-through domain (RTD) menghasilkan sebuah protein gabungan 77.94 kDa yang terdiri atas produk ORF3 (CP) dan berdekatan dengan ORF5 (Dombrovsky et al. 2013).
23 Tabel 2 Ekspresi gen protein selubung PeVYV pada E. coli M15[pREP4] berdasarkan optimasi suhu, konsentrasi IPTG, dan waktu setelah pemberian IPTG dengan analisis SDS-PAGE
Suhu Ekspresi gen pada kombinasi konsentrasi IPTG dan waktu
0.25 mM IPTG 0.50 mM IPTG 1.0 mM IPTG Keterangan: +: pita protein tipis; ++: pita protein tebal; -: tidak terekspresi
Hasil optimasi ekpresi rekombinan CP-PeVYV pada suhu 25 oC, 28 oC, dan 30 oC dengan konsentrasi IPTG yang digunakan menunjukkan protein rekombinan CP-PeVYV tidak berhasil terekspresi; pita protein target tidak terbentuk (data tidak ditampilkan). Namun, inkubasi pada suhu 37 oC protein rekombinan CP menunjukkan terekspresi dengan pita protein yang diduga berukuran ~25 kDa setelah dianalsis menggunakan ProtParam tool (ExPaSy Bioinformatics Resource Portal) (Gambar 12A). Di antara konsentrasi IPTG yang digunakan, ekspresi protein rekombinan CP terekspresi pada konsentrasi 0.5 mM dan waktu panen bakteri pada saat 6 jam setelah diinduksi IPTG (Gambar 12B). IPTG mempengaruhi gen-gen lain di bakteri sehingga muncul protein baru. Sehingga perlu dilakukan metode deteksi Western bloth untuk lebih meyakinkan bahwa pita protein yang diperoleh merupakan protein target. Namun, antiserum PeVYV belum tersedia secara komersiil.
Bakteri E. coli memiliki berbagai keunggulan, antara lain adalah kemampuannya untuk tumbuh dengan cepat, densitas sel yang tinggi, media pertumbuhan yang murah, karakteristik genetik yang jelas, serta ketersediaan strain mutan dengan yang sesuai berbagai pasangan vektor kloning. Meskipun tidak selalu ada jaminan bahwa protein heterologus akan dihasilkan oleh E. coli
24
perlu dilakukan optimasi lebih lanjut ketika subkloning menggunakan TA kloning.
a.
b.
Gambar 12 (A) Representasi skematik konstruksi CP-PeVYV pada vektor ekspresi pQE30 dengan enzim restriksi BamHI dan PstI menunjukkan 0.84 kDa 6xHistag Protein dan 24.05 kDa fragmen yang terekspresi dari CP-PeVYV. (B) Ekspresi gen CP-PeVYV pada
E.coli suhu 37 °C selama 6 jam. Lajur 1: pQE30 tanpa insert; lajur 2:
recombinant CP uninduced; induced IPTG 0.25 mM (lajur 3), 0.5 mM (lajur 4), dan 1 mM (lajur 5); MW : berat molekul protein (kDa). Penanda protein; SDS-PAGE Low Range (Biorad).
5
SIMPULAN DAN SARAN
Simpulan
Penyakit virus pada tanaman cabai asal Bali, Indonesia dengan gejala klorosis menguning pada lamina daun, tetapi tulang daun masih tetap berwarna hijau berasosiasi dengan kolompok Polerovirus dengan ciri partikel berbentuk heksagonal dengan diameter berukuran ~30 nm melalui mikroskopi elektron. RT-PCR menggunakan primer spesifik forward BamHI dan reverse PstI untuk mengamplifikasi gen protein selubung viru berukuran ~650 pb menguatkan bahwa virus penyebab adalah PeVYV. Sekuen gen protein selubung PeVYV isolat Bali, Indonesia memiliki homologi sebesar 99% dengan PeVYV isolat Jepang dan Taiwan. PeVYV berhasil dibuktikan sebagai penyebab penyakit klorosis pada tanaman cabai asal Bali, Indonesia yang merupakan anggota genus Polerovirus.
Gen CP-PeVYV berhasil diekspresikan pada E. coli strain M15[pREP4] setelah diinduksi menggunakan IPTG 0.5 mM selama 6 jam pada suhu 37 °C menunjukkan pita protein putatif berukuran ~25 kDa.
Saran
6 DAFTAR PUSTAKA
Aidawati, N. 2006. Keanekaragaman Begomovirus pada tomat dan serangga vektornya, Bemisia tabaci Gennadius (Hemiptera: Aleyrodidae), serta pengujian ketahanan genotipe tomat terhadap strain Begomovirus
[disertasi]. Bogor(ID):Institut Pertanian Bogor.
Agrios GN. 2005. Plant Pathology. Ed. ke-5. New York [US]: Academic Press. Blackman RL, Eastop VF. 2000. Aphids on the World's Crops. Euro (EUR): John
Wiley and Sons.
[BPS] Badan Pusat Statistik. 2015. Produksi cabai besar, cabai rawit, dan bawang merah tahun 2014. Jakarta (ID): Berita resmi statistik BPS [diunduh 2016 Januari 31]. Tersedia pada: http://www.bps.go.id/website/brs_ind/brsInd-20150803115537.pdf.
Baneyx F. 1999. Recombinant protein expression in Escherichia coli. Curr opinion Biotech. 10: 411-421.
Brault V, Graff VZ, Richards KE. 2001. Viral determinants involved in
Luteovirus-Aphid Interactions. Di dalam: Harris KF et al., editor. Virus-Insect-Plant Interactions. London(UK): Academis Press. hlm 207-232. Cerkauskas R. 2004. Chili veinal mottle virus: aphid-transmitted Potyvirus.
[diunduh 2016 Februari 18]. Tersedia pada: http://203.64.245.61/web_crops/pepper/chivmv.pdf.
Dombrovsky A, Glanz E, Lachman O, Sela N, Doron-Faigenboim A, Antignus Y. 2013. The complete genomic sequence of Pepper yellow leaf curl virus
Fajardo TVM, Barros DR, Nickel O, Kuhn GB, Zerbini FM. 2007.Expression of
Grapevine leafroll-associated virus 3 coat protein gene in Escherichia coli
and production of polyclonal antibodies. Fitopatol Brasil. 32:496-500. Fauquet CM, Bisaro DM, Briddon RW, Brown JK, Harrison BD, Rybicki EP,
Stenger DC, Stanley J. 2003. Revision of taxonomic criteria for demarcation in the family Geminiviridae, and an updated list of
Begomovirus species. Arch Virol. 148:405-421.
Gray S, Gildow FE. 2003. Luteovirus-aphid interactions. Annu Rev Phytopathol.
41:539–66. DOI: 10.1146/annurev.phyto.41.012203.105815.
27 Hampton, R., E. Ball, and S. de Boer. 1990. Serological methods for detection and identification of viral and bacterial plant pathogens. A Laboratory Manual. USA: APS Pr.
King AMQ, Adams MJ, Carstens EB, Lefkowitz EJ. 2012. Virus taxonomy, Ninth Report of The International Committee of Taxonomy of Viruses. San Diego (CA): Academic Pr. genus Polerovirus). Arch Virol. 156:921–923. DOI: 10.1007/s00705-011-0956-5.
[NCBI] National Center for Biotechnology Information. 2013.
Pepper vein yellows virus genomic RNA, complete genome. Bethesda MD (USA): Nucleotide [diunduh 2015 Juli 5]. Tersedia pada: http://www.ncbi.nlm.nih.gov/nuccore/AB594828.1.
Nishimura M, Park G, Xu JR. 2003. The G-beta subunit MGB1 is involved in regulating multiple steps of infection-related morphogenesis in Magnaporthe grisea. Mol Microbiol.50:231-243.
Noordam D. 1973. Identification of Plant Viruses Methods and Experiments. Wageningen(NL): Center for Agricultural Pub and doc.
Omolo MA, Wong ZZ, Mergen AK, Hastings JC, Le NC, Reiland HA, Case KA, Baumler DJ. 2014. Antimicrobial properties of chili peppers. J Infect Dis Ther. 2(4):145. DOI:10.4172/2332-0877.1000145.
Paolella P. 1998. Introduction to molecular biology. Boston(US): McGraw-Hill Companies Inc.
Piay SS, Tyasdjaja A, Ermawati Y, Hantoro FRP. 2010. Budidaya dan Pascapanen Cabai Merah (Capsicum annuum L.). Ungaran(ID): BPTP Jawa Tengah.
Qiagen. 2008. The Qiaexpressionist: A Handbook for High Level Expression and Purification of 6xHis-tagged Protein. Valencia(ES): Qiagen Inc.
Qiagen. 2013. Growth of Bacterial Cultures. [diunduh 2015 Juli 5]. Tersedia pada: https://www.qiagen.com/id/resources/technologies/plasmid-resource -center/ growth%20of%20bacterial%20cultures/.
Rast ATB. 1992. Host range comparison of the casual agents of Pepper yellow vein and lettuce big vein [komunikasi singkat]. Neth J Pl Path. 98:325-328.
28
Robert KJ. 2006. Regulation. [diunduh pada 2016 Januari 15]. Tersedia pada: http//academic.pgcc.edu/~kroberts/Lecture/Chapter%207/regulation.html. Sambrook J, Russel DW. 2001. Molecular Cloning: A Laboratory Manual. New
York(US): Cold Spring Harbor Laboratory Press.
Suastika G, Hartono S, Nyana IDN, Natsuaki T. 2012. Laporan pertama tentang infeksi Polerovirus pada tanaman cabai di daerah Bali, Indonesia. J Fitopatol Indones. 8(5): 151-154.
Sulandari S. 2004. Karakterisasi biologi, serologi, dan analisis sidik jari DNA virus penyebab penyakit daun keriting kuning cabai [disertasi]. Bogor(ID):Institut Pertanian Bogor.
Sulandari S, Suseno R, Hidayat SH, Harjosudarmo J, Sosromarsono S. 2006. Deteksi dan kajian kisaran inang virus penyebab penyakit daun keriting kuning cabai. Hayati. 13(1):1-6.
Sumarni N, Muharam A. 2005. Budidaya Tanaman Cabai Merah. Bandung: Balitsa.
Villanueva F, Castillo P, Font MI, Fernandez AA, Moriones E, Castillo JN. 2013. First Report of Pepper vein yellows virus Infecting Sweet Pepper in Spain.
American Phytopathol Soc. 97(9):1261. DOI: http://dx.doi.org/10.1094 /PDIS-04-13-0369-PDN.
Williams DB, Carter CB. 2009. Transmission electron microscopy: a textbook for materials science. New York(US): Springer US. DOI: 10.1007/978-0-387-76501-3.
Wilson CR. 2014. Applied Plant Virology. Oxforshife: CAB International.
Yonaha T, Toyosato T, Kawano S, Osaki T. 1995. Pepper vein yellows virus, a Novel Luteovirus from Bell Pepper Plants in Japan. Ann Phytopathol Soc Jpn. 61: 178-184.
30
RIWAYAT HIDUP
Penulis dilahirkan di Kebumen pada tanggal 1 Juli 1989 dari pasangan Sodikin, SSos dan Jumirah, SPdSD. Penulis merupakan anak pertama dari tiga bersaudara.
Penulis menyelesaikan pendidikan menengah umum di SMA Negeri 2 Kebumen pada tahun 2007. Pada tahun yang sama penulis diterima sebagai mahasiswa program studi Departemen Proteksi Tanaman Fakultas Pertanian Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB pada kurikulum berbasis mayor-minor. Penulis berkesempatan langsung melanjutkan pendidikan ke Sekolah Pascasarjana IPB program magister mata kuliah Fitopatologi pada tahun 2012. Penulis terpilih sebagai delegasi dalam