RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
KELAS EKSPERIMEN
PERTEMUAN KE-1
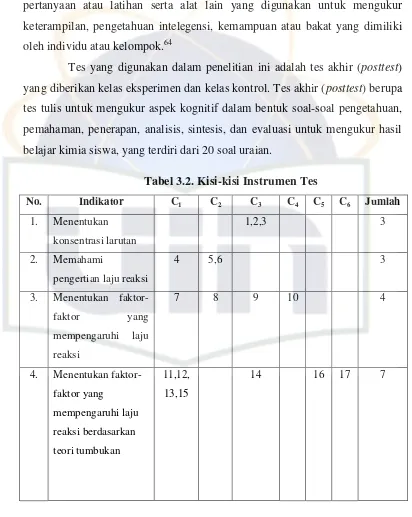
Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia
Kelas/ Semester : XI/ I Tahun Pelajaran : 2010/2011 Pokok Bahasan : Laju Reaksi Alokasi Waktu : 90 menit
Standar Kompetensi : 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta
penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi Dasar : 3.1 Mendeskripsikan pengertian laju reaksi dengan
melakukan percobaan tentang faktor-faktor yang mempengaruhi laju reaksi.
Indikator : 1. Menentukan konsentrasi larutan. 2. Memahami pengertian laju reaksi.
3. Menentukan laju reaksi berdasarkan persamaan reaksi.
I. Tujuan Pembelajaran
1. Siswa dapat menentukan konsentrasi larutan. 2. Siswa dapat memahami pengertian laju reaksi.
3. Siswa dapat menentukan laju reaksi berdasarkan persamaan reaksi.
II.Materi Ajar
1. Kemolaran (M)
a. Pengertian Kemolaran
Kemolaran adalah satuan konsentrasi larutan yang menyatakan jumlah mol zat terlarut dalam 1 liter larutan. Kemolaran sama dengan jumlah mol (n) zat terlarut dibagi dengan volume (v) larutan.
M =
mL 1000 x M r
g M atau v
n
Keterangan:
M = molaritas (mol⁄Latau mmol mL⁄ ) n = mol zat terlarut (mol atau mmol) V = volume larutan (L atau mL) g = massa zat terlarut (gram)
b. Pengenceran
Pengenceran adalah menurunkan atau memperkecil konsentrasi larutan dengan menambahkan pelarut. Dalam hal ini konsentrasi yang digunakan adalah molaritas (M). Pada proses pengenceran volume dan molaritas berubah, sedangkan jumlah molnya tetap.
V1M1 = V2M2 Keterangan:
V1 = volume larutan sebelum diencerkan (L atau mL) M1 = molaritas larutan sebelum diencerkan
V2 = volume larutan setelah diencerkan (L atau mL) M2 = molaritas larutan setelah diencerkan
c. Pencampuran
Pencampuran adalah campuran dari dua atau lebih zat yang jenisnya sama, tetapi konsentrasi berbeda. Dalam hal ini konsentrasi yang digunakan adalah molaritas (M).
Pada proses pencampuran beberapa zat yang sejenis berlaku rumus:
V1M1V+ V2M2+ V3M3+ …
Untuk pencampuran 2 jenis zat yang sejenis berlaku rumus:
V1MV1+ V2M2
1+ V2 Keterangan:
Mc = molaritas larutan setelah dicampurkan
V1 = volume larutan pertama yang dicampurkan (L atau mL) M1 = molaritas larutan pertama
V2 = volume larutan kedua yang dicampurkan (L atau mL) M2 = molaritas larutan kedua
2. Laju reaksi
Suatu reaksi kimia ada yang berlangsung cepat, ada pula yang berlangsung lambat. Ledakan bom berlangsung cepat, sedangkan proses besi berkarat berlangsung lambat. Cepat lambatnya suatu reaksi kimia dinyatakan sebagai laju reaksi. Apakah laju reaksi itu?
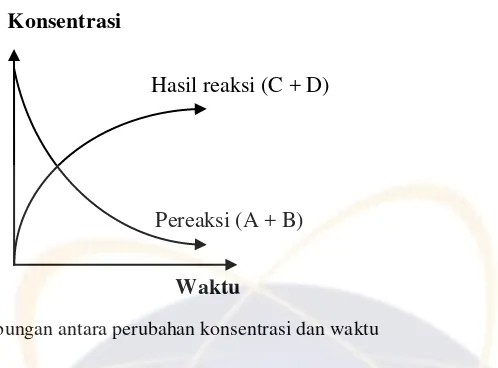
Laju reaksi menyatakan laju perubahan konsentrasi zat yang terlibat dalam reaksi setiap satuan waktu. Perhatikan grafik berikut.
Pada grafik di atas menunjukkan bahwa konsentrasi pereaksi dalam suatu reaksi kimia semakin lama semakin berkurang, sedangkan hasil reaksi semakin lama akan semakin bertambah.
N2(g) + 3 H2(g) 2 NH3(g) Pada reaksi diatas dapat dinyatakan: - Laju penambahan konsentrasi NH3 - Laju pengurangan konsentrasi N2 dan H2
Konsentrasi
Waktu
Hasil reaksi (C + D)
[image:3.595.98.506.120.581.2]Pereaksi (A + B)
Dengan demikian, laju reaksi dapat dinyatakan sebagai pengurangan konsentrasi pereaksi per satuan waktu, atau penambahan konsentrasi hasil reaksi per satuan waktu.
Laju Reaksi (v) =
t) ( waktu Perubahan
C) ( i konsentras Perubahan
Laju reaksi memiliki satuan Ms-1 (M = molar dan s = sekon = detik)
III.Pendekatan Pembelajaran Pendekatan Konsep
IV.Metode Pembelajaran
Diskusi kelompok, tanya jawab V. Langkah Kegiatan Pembelajaran
Kegiatan Aktivitas Guru Aktivitas Siswa
Awal (Apersepsi dan
Motivasi) 15 menit
Menciptakan lingkungan belajar, seperti berdoa dan salam.
Menyiapkan sumber belajar.
Menjelaskan tujuan pembelajaran yang akan dicapai dari materi yang akan dibahas.
Memotivasi dan menggali pengetahuan siswa dengan memberikan pertanyaan. Suatu reaksi kimia ada yang berlangsung cepat, ada pula yang berlangsung lambat. Ledakan bom berlangsung cepat, sedangkan proses besi berkarat berlangsung lambat. Cepat lambatnya suatu reaksi kimia dinyatakan sebagai suatu laju reaksi. Apakah laju reaksi itu?
Berdoa dan menyiapkan alat dan bahan pelajaran.
Menyimak penjelasan guru.
Inti 60 menit (eksplorasi diskusi, penjelasan konsep)
Mengajak siswa untuk membentuk 4 kelompok. Kemudian guru membagikan lembar kegiatan siswa sebagai bahan diskusi.
Meminta siswa mengadakan diskusi kelompok untuk memahami tentang konsep kemolaran dan laju reaksi.
Membimbing siswa pada tiap-tiap kelompok dalam mengerjakan soal-soal pada lembar kegiatan siswa.
Mengajak siswa membahas hasil diskusi dengan meminta perwakilan siswa dari tiap kelompok untuk membacakan hasil diskusi. Kelompok lainnya memberikan pendapat/ komentar/ saran.
Membahas hasil diskusi dan menjelaskan kembali tentang kemolaran dan konsep laju reaksi.
Meminta siswa maju ke depan untuk mengerjakan soal latihan pada lembar kegiatan siswa.
Secara berkelompok siswa mempelajari Lembar Kegiatan Siswa (LKS) dan bahan bacaan untuk berdiskusi memahami kemolaran dan konsep laju reaksi.
Berperan aktif dalam diskusi dan menjawab soal-soal yang terdapat dalam lembar kegiatan siswa.
Perwakilan siswa dari tiap kelompok menjelaskan hasil diskusi tentang kemolaran dan laju reaksi.
Menyimak penjelasan guru dan memahami pembahasan hasil diskusi
Bertanya sesuai konsep yang dijelaskan.
Maju ke depan untuk menuliskan jawabannya di papan tulis dan menjelaskan langkah-langkah pengerjaan soalnya kepada teman-teman yang lain.
Akhir 15 menit (Pengemban gan dan aplikasi)
Membimbing siswa menyimpulkan materi yang telah dipelajari dan melakukan tanya jawab tentang materi yang belum dipahami.
Memberikan tugas individu yang terdapat pada buku pelajaran kimia SMA Kelas XI
VI. Sumber dan Alat/ Media Pembelajaran 1. Sumber
Buku kimia SMA kelas XI (Yudhistira)
Buku kimia SMA kelas XI (Yrama widya)
Buku kimia SMA kelas XI (Grafindo)
Lembar Kegiatan Siswa 2. Alat/media
Media pembelajaran yang digunakan adalah papan tulis dan spidol.
VII. Penilaian
Penilaian pada soal-soal uraian yang terdapat pada lembar kegiatan siswa dan Penilaian performance dilakukan melalui pengamatan pada saat siswa melakukan kegiatan pembelajaran.
Guru Kimia Peneliti
Dra. Wara Gawatiningsiah Nur Cholifah NIP: 19651111 200701 2 017 NIM: 106016200624
Mengetahui,
Kepala SMAN 3 Tangerang Selatan
Lembar Kegiatan Siswa (LKS) Kelas Eksperimen
Kelompok : Nama : 1.
2. 3. 4.
5.
A. Materi
1. Kemolaran (M)
Untuk menyatakan kadar zat terlarut dalam larutan dinyatakan dengan konsentrasi larutan.
a. Pengertian Kemolaran
Kemolaran adalah satuan konsentrasi larutan yang menyatakan jumlah mol zat terlarut dalam 1 liter larutan. Kemolaran sama dengan jumlah mol (n) zat terlarut dibagi dengan volume (v) larutan.
M=Vn atau M= Mrg 1000mL
Keterangan:
M = molaritas (mol⁄Latau mmol mL⁄ ) n = mol zat terlarut (mol atau mmol)
V = volume larutan (L atau mL) g = massa zat terlarut (gram)
Contoh soal:
10 gram NaOH (Mr = 40) dilarutkan ke dalam air sehingga volume larutan 2 liter. Tentukanlah molaritas larutan NaOH tersebut!
Zat terlarut NaOH 10 gram = 40 10
mol = 0,25 volume larutan = 2 liter
[NaOH] = v n = 2 25 , 0
M = 0,125 M
b. Pengenceran
Pengenceran adalah menurunkan atau memperkecil konsentrasi larutan dengan menambahkan pelarut. Dalam hal ini konsentrasi yang digunakan adalah molaritas (M). Pada proses pengenceran volume dan molaritas berubah, sedangkan jumlah molnya tetap.
V1M1 = V2M2 Keterangan:
V1 = volume larutan sebelum diencerkan (L atau mL) M1 = molaritas larutan sebelum diencerkan
V2 = volume larutan setelah diencerkan (L atau mL) M2 = molaritas larutan setelah diencerkan
Contoh Soal:
250 mL larutan CaCl2 0,15 M diencerkansampai memperoleh konsentrasi ion Cl- 0,1 M. Berapakah volume larutan CaCl2 sekarang?
Jawab:
V1M1n = V2M2n 250 x 0,15 x 2 = V2 x 0,1 x 1
V2 = 750 mL c. Pencampuran
Pencampuran adalah campuran dari dua atau lebih zat yang jenisnya sama, tetapi konsentrasi berbeda. Dalam hal ini konsentrasi yang digunakan adalah molaritas (M).
Untuk pencampuran 2 jenis zat yang sejenis berlaku rumus: Mc = 2 1 2 2 1 1 V V ... M V M V Keterangan:
Mc = molaritas larutan setelah dicampurkan
V1 = volume larutan pertama yang dicampurkan (L atau mL) M1 = molaritas larutan pertama
V2 = volume larutan kedua yang dicampurkan (L atau mL) M2 = molaritas larutan kedua
Contoh soal:
100 mL larutan HCl 0,1 M dicampurkan dengan 150 mL larutan HCl 0,2 M. Hitunglah konsentrasi larutan setelah dicampurkan!
Jawab:
Rumus percampuran
Mc =
2 1 2 2 1 1 V V ... M V M V = 150 100 0,2) x (150 0,1) x 10 ( = 250 40 = 0,16
2. Laju reaksi
Suatu reaksi kimia ada yang berlangsung cepat, ada pula yang berlangsung lambat. Ledakan bom berlangsung cepat, sedangkan proses besi berkarat berlangsung lambat. Cepat lambatnya suatu reaksi kimia dinyatakan sebagai laju reaksi. Apakah laju reaksi itu?
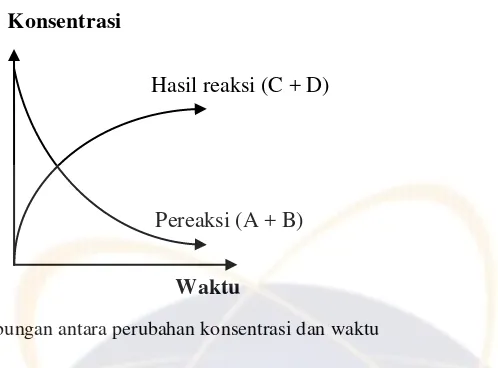
Pada grafik di atas menunjukkan bahwa konsentrasi pereaksi dalam suatu reaksi kimia semakin lama semakin berkurang, sedangkan hasil reaksi semakin lama akan semakin bertambah.
N2(g) + 3 H2(g) 2 NH3(g) Pada reaksi diatas dapat dinyatakan:
- Laju penambahan konsentrasi NH3 - Laju pengurangan konsentrasi N2 dan H2
Dengan demikian, laju reaksi dapat dinyatakan sebagai pengurangan konsentrasi pereaksi per satuan waktu, atau penambahan konsentrasi hasil reaksi per satuan waktu.
Laju Reaksi (v) =
t) ( waktu Perubahan
C) ( i konsentras Perubahan
Laju reaksi memiliki satuan Ms-1 (M = molar dan s = sekon = detik) B. Soal
Jawablah pertanyaan-pertanyaan di bawah ini dengan benar!
1. Sejumlah asam sulfat dilarutkan ke dalam air sehingga volume larutan 500 mL dan konsentrasinya 0,1 M. Tentukanlah berapa gram asam sulfat yang dilarutkan (Mr H2SO4 = 98) ?
Jawab: ……….. ………..
Konsentrasi
Waktu
Hasil reaksi (C + D)
[image:10.595.154.403.85.269.2]Pereaksi (A + B)
2. Sebanyak 2 gram NaOH (Mr = 40) dilarutkan ke dalam air hingga volume larutan 200 mL. Tentukanlah molaritas larutan NaOH tersebut!
Jawab: ……….. ………..
3. Diketahui 500 mL larutan HCl 0,1 M. Tentukan berapa mol dan berapa gram HCl terdapat dalam larutan tersebut! Ar H = 1; Cl = 35,5
Jawab: ……….. ………..
4. 100 mL larutan H2SO4 0,1 M diencerkan sehingga konsentrasinya menjadi 0,01 M. Hitunglah volume larutan setelah pengenceran dan volume pelarut yang ditambahkan!
Jawab: ……….. ………..
5. Jika 100 mL larutan HBr 0,8 M dicampurkan dengan 100 mL larutan HBr 0,2 M, tentukanlah molaritas larutan setelah percampuran!
Jawab: ……….. ………..
6. Tentukan reaksi pembentukan gas ammonia sesuai reaksi, N2(g) + 3H2(g) → 2NH3(g)
a. Tentukan laju reaksi masing-masing zat!
b. Bagaimanakah hubungan antara , ?
Jawab: ……….. ………..
7. Jelaskan yang dimaksud dengan laju reaksi!
Jawab: ………..
……….. 8. Zat X bereaksi dengan zat Y menurut persamaan kimia:
X + Y → Z. Jika konsentrasi awal Y = 0,5 M dan setelah bereaksi dengan zat X selama satu menit konsentrasinya menjadi 0,2 M; maka tentukan laju reaksi tersebut terhadap Y!
9. Ke dalam suatu ruangan 1 liter dicampurkan x mol gas P dan y mol gas Q. Selang waktu t detik sebagian dari gas-gas tersebut telah membentuk a mol gas R sesuai persamaan reaksi: 2P(g) + 3Q(g) → R(g). Nyatakan laju reaksi gas P, Q, dan R tersebut.
Jawab: ……….. ………..
10. Laju reaksi dapat diartikan sebagai perubahan konsentrasi tiap satuan waktu. Bagaimana pengaruh konsentrasi terhadap laju reaksi?
RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
KELAS EKSPERIMEN
PERTEMUAN KE-2
Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia
Kelas/ Semester : XI/ I Tahun Pelajaran : 2010/2011 Pokok Bahasan : Laju Reaksi Alokasi Waktu : 90 menit
Standar Kompetensi : 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta
penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi Dasar : 3.1 Mendeskripsikan pengertian laju reaksi dengan
melakukan percobaan tentang faktor-faktor yang mempengaruhi laju reaksi.
Indikator : Menentukan faktor-faktor yang mempengaruhi laju reaksi dengan melakukan percobaan.
I. Tujuan Pembelajaran
Siswa dapat menentukan faktor-faktor yang mempengaruhi laju reaksi dengan melakukan percobaan.
II.Materi Ajar
Faktor-faktor yang mempengaruhi laju reaksi 1. Pengaruh konsentrasi terhadap laju reaksi
2. Pengaruh luas permukaan
Makin luas permukaan sentuhan semakin banyak kemungkinan terjadinya tumbukan antarpartikel pereaksi sehingga makin cepat reaksinya. Zat padat bentuk serbuk memiliki luas permukaan lebih besar daripada bentuk kepingan, sehingga zat padat bentuk serbuk bereaksi lebih cepat daripada bentuk kepingan. 3. Pengaruh suhu
Pada umumnya reaksi makin cepat bila suhu dinaikkan, makin tinggi cepat gerak partikel-partikel pereaksi dan makin besar pula energi kinetiknya. Sehingga banyak partikel-partikel pereaksi yang memiliki energi yang mencapai energi pengaktifan akibatnya reaksi makin cepat.
4. Pengaruh katalis
Katalis adalah zat yang dapat mempercepat reaksi di mana pada akhir reaksi terbentuk kembali dengan jumlah yang tetap. Katalis mempercepat reaksi dengan jalan menurunkan energi aktivasi yaitu energi minimum yang harus dimiliki agar reaksi dapat berlangsung.
III.Pendekatan Pembelajaran Pendekatan Konsep
IV.Metode Pembelajaran
Eksperimen, diskusi kelompok, dan tanya jawab. V. Langkah Kegiatan Pembelajaran
Kegiatan Aktivitas Guru Aktivitas Siswa
Awal (Apersepsi dan
Motivasi) 15 menit
Menciptakan lingkungan belajar, seperti berdoa dan salam.
Menyiapkan sumber belajar dan alat dan bahan untuk melakukan
percobaan.
Menjelaskan tujuan pembelajaran yang akan dicapai dari materi yang akan dibahas.
Berdoa dan menyiapkan alat dan bahan pelajaran
Memotivasi dan menggali pengetahuan siswa dengan memberikan pertanyaan
Mengapa wortel yang dipotong kecil-kecil jika direbus lebih cepat matang dari pada wortel yang tidak dipotong-potong ?
Siswa menyimak pertanyaan guru dan menjawab? Inti 60 menit (eksplorasi diskusi, penjelasan konsep)
Mengajak siswa untuk membentuk 4 kelompok (kelompok yang telah dibentuk pada pertemuan pertama). Kemudian guru membagikan alat dan bahan percobaan serta Lembar Kerja Siswa (LKS).
Memperhatikan cara kerja pada tiap-tiap kelompok dalam melakukan percobaan untuk mengetahui faktor-faktor yang mempengaruhi laju reaksi.
Meminta siswa mendiskusikan hasil percobaan dan menghubungkannya dengan teori laju reaksi berdasarkan fakta-fakta yang mereka temukan dari hasil percobaan.
Secara berkelompok siswa menyiapkan alat dan bahan untuk melakukan percobaan.
Secara berkelompok siswa melakukan percobaan untuk mengetahui faktor-faktor yang mempengaruhi laju reaksi.
Menemukan konsep atau prinsip berdasarkan data-data yang diperoleh dari hasil percobaan serta mendiskusikannya.
Berperan aktif dalam diskusi. Akhir
15 menit (Pengemban gan dan aplikasi)
Membimbing siswa menyimpulkan materi yang telah dipelajari dan melakukan tanya jawab tentang materi yang belum dipahami.
VI. Sumber dan Alat/ Media Pembelajaran 1. Sumber
Buku kimia SMA kelas XI (Grafindo)
Buku kimia SMA kelas XI (Yrama Widya)
Buku kimia SMA kelas XI (Yudhistira)
Lembar Kerja Siswa 2. Alat/media
Media pembelajaran yang digunakan adalah papan tulis, spidol, alat dan bahan percobaan.
VII. Penilaian
Penilaian pada soal-soal uraian yang terdapat pada lembar kerja siswa dan Penilaian performance dilakukan melalui pengamatan pada saat siswa melakukan kegiatan pembelajaran.
Guru Kimia Peneliti
Dra. Wara Gawatiningsiah Nur Cholifah NIP: 19651111 200701 2 017 NIM: 106016200624
Mengetahui,
Kepala SMAN 3 Tangerang Selatan
Lembar Kerja Siswa (LKS) Kelas Eksperimen Kelompok : 1.
2.
3.
4.
5.
A. Molaritas larutan
Tujuan: Untuk menentukan molaritas dari suatu larutan
Alat dan Bahan:
- Gelas kimia 100 mL
- - 5 gram NaCl (Ar: Na=23, Cl=35,5) - Spatula
- - aquades Langkah Kerja:
1. Siapkan satu buah gelas kimia.
2. Masukkan 100 mL aquades ke dalam gelas kimia. 3. Masukkan 5 gram NaCl, aduk hingga larut. Pertanyaan:
Hitung molaritas dari larutan NaCl tersebut?
B. Pengaruh konsentrasi terhadap laju reaksi
Tujuan: Untuk mengetahui pengaruh konsentrasi terhadap laju reaksi Alat dan Bahan:
1. Gelas kimia 100 mL 2. Gelas ukur
3. Labu ukur 50 mL
4. Kertas putih ukuran 15 15 cm yang diberi tanda “X” hitam
5. Stopwatch 6. Larutan HCl 2 M 7. Larutan Na2S2O3 1 M
Langkah kerja:
1. Encerkan larutan Na2S2O3 1 M menjadi Na2S2O3 0,5 M; 0,15 M; 0,10 M; 0,05 M masing-masing 50 mL.
2. Masukkan 5 mL larutan HCl 2 M ke dalam gelas kimia.
3. Simpan gelas kimia di atas kertas putih bertanda”X”.
4. Tambahkan 25 mL larutan Na2S2O3 0,05 M ke dalam gelas kimia.
5. Catat waktu yang diperlukan sejak penambahan Na2S2O3 sampai tanda ”X” tidak terlihat lagi.
6. Ulangi langkah 1–5 dengan konsentrasi Na2S2O3 0,10 M; 0,50 M
Data Pengamatan
V Na2S2O3 1 M yang dipipet
M Na2S2O3 Sebelum Pengenceran
V Na2S2O3 Setelah Pengenceran
M Na2S2O3 Setelah Pengenceran
… mL 1 M 50 mL 0,05 M
… mL 1 M 50 mL 0,10 M
… mL 1 M 50 mL 0,50 M
Gelas [HCl] [Na2S2O3] Waktu (s) Laju Reaksi (s-1)
1 2 M 0,05 M … …
2 2 M 0,10 M … …
Pertanyaan:
1. Gelas manakah yang lebih cepat menghilangkan tanda “X”?
... ... ... 2. Berdasarkan data hasil pengamatan, bagaimana pengaruh konsentrasi terhadap
laju reaksi?
... ... ...
C. Pengaruh suhu terhadap laju reaksi
Tujuan: Untuk mengetahui pengaruh suhu terhadap laju reaksi. Alat dan bahan:
1. Gelas kimia 100 mL 5. Stopwatch
2. Termometer 6. Logam seng 3. Penangas air 7. Larutan HCl 1 M 4. Es batu
Langkah kerja
1. Siapkan gelas kimia sebanyak tiga buah yang telah diberi label 1, 2 dan 3. 2. Tuangkan sekitar 50 mL HCl 1 M ke dalam setiap gelas kimia.
3. Simpan gelas 1 di atas es batu, ukurlah suhunya. 4. Simpan gelas 2 pada suhu kamar.
5. Panaskan gelas 3 pada penangas air. Ukur sampai suhu konstan.
6. Masukkan ke dalam setiap gelas, logam seng dalam berat yang sama (1 g). 7. Catat hasil pengamatan hingga semua logam seng bereaksi.
Data Pengamatan
Gelas Waktu (s) Laju Reaksi (s-1)
1 … …
2 … …
Pertanyaan:
1. Gelas manakah yang lebih cepat membuat logam seng bereaksi?
... ... ... 2. Berdasarkan data hasil pengamatan, bagaimana pengaruh suhu terhadap laju
reaksi?
... ... ...
D. Pengaruh luas permukaan terhadap laju reaksi
Tujuan: Untuk mengetahui pengaruh luas permukaan terhadap laju reaksi.
(Percobaan I) (Percobaan II) (Percobaan III) Alat dan Bahan:
- Gelas kimia - garam halus - Spatula - garam kristal
- Stopwatch - garam balok
- Aquades Langkah kerja:
1. Siapkan gelas kimia sebanyak tiga buah dan diberi label 1, 2 dan 3. 2. Tuangkan sekitar 100 mL air ke dalam setiap gelas kimia.
3. Masukkan sekitar 3 gram garam halus ke dalam gelas kimia 1. 4. Masukkan sekitar 3 gram garam kristal ke dalam gelas kimia 2. 5. Masukkan sekitar 3 gram garam balok ke dalam gelas kimia 3.
Data Pengamatan
Gelas Bentuk Garam Waktu (s)
1 Garam halus
2 Garam kristal
3 Garam balok
Pertanyaan:
1. Manakah garam yang memiliki luas permukaan yang paling besar?
... ... ... 2. Berdasarkan data hasil pengamatan, bagaimana pengaruh luas permukaan
terhadap laju reaksi?
... ... ... E. Pengaruh katalis terhadap laju reaksi
Tujuan: Untuk mengetahui pengaruh katalis terhadap laju reaksi.
(Percobaan I) (Percobaan II) Alat dan Bahan:
- Alas logam - gula
- Korek api - abu rokok
Langkah kerja:
1. Siapkan alas yang terbuat dari logam.
Data Pengamatan
Bahan yang digunakan Pengamatan Percobaan I
Percobaan II
Pertanyaan:
1. Pada percobaan I, apa yang terjadi pada saat gula dibakar?
... ... ... 2. Pada percobaan II, apa yang terjadi pada gula yang telah diberikan abu rokok di
salah satu sudutnya pada saat dibakar?
... ... ... 3. Pada percobaan II, apakah yang akan terjadi pada abu rokok setelah proses
pembakaran selesai?
... ... ... 4. Apakah fungsi abu rokok pada proses pembakaran tersebut?
... ... ... 5. Bagaimana pengaruh katalis terhadap laju reaksi?
... ... ...
Kesimpulan:
Berdasarkan kegiatan yang telah dilakukan, jelaskan kembali apa yang dimaksud dengan molaritas, laju reaksi serta faktor-faktor apa saja yang dapat mempengaruhi laju reaksi dan bagaimana hubungan antara faktor-faktor yang mempengaruhi laju reaksi berdasarkan teori tumbukan!
RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
KELAS EKSPERIMEN
PERTEMUAN KE-3
Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia
Kelas/ Semester : XI/ I Tahun Pelajaran : 2010/2011 Pokok Bahasan : Laju Reaksi Alokasi Waktu : 90 menit
Standar Kompetensi : 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta
penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi Dasar : 3.1 Mendeskripsikan pengertian laju reaksi dengan
melakukan percobaan tentang faktor-faktor yang mempengaruhi laju reaksi.
Indikator : Menjelaskan pengaruh konsentrasi, luas permukaan, suhu dan katalis terhadap laju reaksi berdasarkan teori
tumbukan. I. Tujuan Pembelajaran
Siswa dapat menjelaskan pengaruh konsentrasi, luas permukaan, suhu dan katalis terhadap laju reaksi berdasarkan teori tumbukan.
II. Materi Ajar
Teori Tumbukan dan Energi Aktivasi
Reaksi kimia terjadi karena tumbukan antara partikel-partikel zat yang bereaksi. Namun tidak semua tumbukan antarmolekul pereaksi akan menghasilkan zat hasil reaksi. Hanya tumbukan efektif yang akan menghasilkan zat hasil reaksi. Keefektifan suatu tumbukan bergantung pada posisi molekul dan energi kinetik yang dimilikinya.
Teori tumbukan dan energi aktivasi berguna untuk menjelaskan faktor-faktor yang mempengaruhi laju reaksi. Laju suatu reaksi kimia dapat dipercepat dengan cara memperbesar harga energi kinetik molekul atau menurunkan harga energi aktivasi.
1. Pengaruh konsentrasi terhadap laju reaksi
Semakin besar konsentrasi semakin cepat reaksi berlangsung (kecepatan reaksi makin besar). Hal ini disebabkan semakin besar konsentrasi berarti jarak antarmolekul rapat/padat, sehingga semakin banyak/mudah terjadi tumbukan yang menghasilkan reaksi, akibatnya menjadi lebih cepat.
2. Pengaruh luas permukaan
Makin luas permukaan sentuhan semakin banyak kemungkinan terjadinya tumbukan antarpartikel pereaksi sehingga makin cepat reaksinya. Zat padat bentuk serbuk memiliki luas permukaan lebih besar daripada bentuk kepingan, sehingga zat padat bentuk serbuk bereaksi lebih cepat daripada bentuk kepingan. 3. Pengaruh suhu
Pada umumnya reaksi makin cepat bila suhu dinaikkan, makin tinggi cepat gerak partikel-partikel pereaksi dan makin besar pula energi kinetiknya. Sehingga banyak partikel-partikel pereaksi yang memiliki energi yang mencapai energi pengaktifan akibatnya reaksi makin cepat.
4. Pengaruh katalis
Katalis adalah zat yang dapat mempercepat reaksi di mana pada akhir reaksi terbentuk kembali dengan jumlah yang tetap. Katalis mempercepat reaksi dengan jalan menurunkan energi aktivasi yaitu energi minimum yang harus dimiliki agar reaksi dapat berlangsung.
III. Pendekatan Pembelajaran Pendekatan Konsep
IV. Metode Pembelajaran
V. Langkah Kegiatan Pembelajaran
Kegiatan Aktivitas Guru Aktivitas Siswa
Awal (Apersepsi dan
Motivasi) 15 menit
Menciptakan lingkungan belajar, seperti berdoa dan salam.
Menyiapkan sumber belajar.
Menjelaskan tujuan pembelajaran yang akan dicapai dari materi yang akan dibahas.
Memotivasi dan menggali pengetahuan siswa dengan memberikan pertanyaan Mengapa ketika kertas dibakar, dalam beberapa saat kertas tersebut akan berubah menjadi abu, tetapi lain halnya ketika sebatang kayu dibakar. Batang kayu akan terbakar lebih lambat dibandingkan kertas yang dibakar. Mengapa demikian?
Berdoa dan menyiapkan alat dan bahan pelajaran
Menyimak penjelasan guru
Siswa menyimak pertanyaan guru dan menjawab. Inti 60 menit (eksplorasi diskusi, penjelasan konsep)
Mengajak siswa untuk membentuk 4 kelompok (kelompok yang telah dibentuk pada pertemuan pertama). Kemudian guru membagikan lembar kegiatan siswa sebagai bahan diskusi.
Membimbing siswa pada tiap-tiap kelompok dalam mengerjakan soal-soal pada lembar kegiatan siswa.
Mengajak siswa membahas hasil diskusi dengan meminta siswa dari tiap kelompok untuk menjelaskan
Secara berkelompok siswa mempelajari Lembar Kegiatan Siswa (LKS) dan bahan bacaan untuk berdiskusi memahami faktor-faktor yang mempengaruhi laju reaksi berdasarkan teori tumbukan.
Berperan aktif dalam diskusi dan menjawab soal-soal yang terdapat dalam lembar kegiatan siswa.
hasil diskusi yang diperoleh dari hasil percobaan yang dilakukan pada pertemuan sebelumnya dan membimbing siswa untuk merumuskan dan menemukan sendiri teori berdasarkan fakta-fakta yang mereka temukan dari hasil percobaan. Kelompok lainnya memberikan pendapat/ komentar/ saran.
Membahas hasil diskusi dan menjelaskan kembali tentang faktor-faktor yang mempengaruhi laju reaksi berdasarkan teori tumbukan.
Memperlihatkan media flash dan memberikan penjelasan bahwa dijalan raya yang ramai kemungkinan terjadi tabrakan akan lebih besar dibandingkan di jalan yang sepi.
Meminta siswa maju ke depan untuk mengerjakan soal latihan pada lembar kegiatan siswa.
berdasarkan data percobaan dan menjelaskan pengaruh konsentrasi, luas permukaan, suhu dan katalis terhadap laju reaksi berdasarkan teori tumbukan.
Menyimak penjelasan guru dan memahami pembahasan hasil diskusi
Bertanya sesuai konsep yang dijelaskan.
Siswa memperhatikan media flash yang diperlihatkan guru dan menyimak penjelasan guru.
Maju ke depan untuk menuliskan jawabannya di papan tulis dan menjelaskannya kepada teman-teman yang lain.
Akhir 15 menit (Pengemban gan dan aplikasi)
Membimbing siswa menyimpulkan materi yang telah dipelajari dan melakukan tanya jawab tentang materi yang belum dipahami.
Meminta siswa belajar di rumah tentang materi orde reaksi untuk pertemuan selanjutnya.
VI. Sumber dan Alat/ Media Pembelajaran 1. Sumber
Buku kimia SMA kelas XI (Bumi Aksara)
Buku kimia SMA kelas XI (Yrama Widya)
Buku kimia SMA kelas XI (Yudhistira)
Lembar Kegiatan Siswa 2. Alat/media
Media pembelajaran yang digunakan adalah papan tulis, spidol, dan media flash.
VII. Penilaian
Penilaian untuk mengevaluasi hasil belajar siswa adalah tes uraian yang terdapat pada lembar kegiatan siswa dan Penilaian performance dilakukan melalui pengamatan pada saat siswa melakukan kegiatan pembelajaran.
Guru Kimia Peneliti
Dra. Wara Gawatiningsiah Nur Cholifah NIP: 19651111 200701 2 017 NIM: 106016200624
Mengetahui,
Kepala SMAN 3 Tangerang Selatan
Lembar Kegiatan Siswa (LKS) Kelas Eksperimen
Kelompok : Nama : 1.
2. 3. 4. 5. A. Materi
Faktor-faktor yang Mempengaruhi Laju Reaksi
Laju reaksi dipengaruhi oleh beberapa faktor antara lain konsentrasi pereaksi, luas permukaan, suhu, katalis. Hal ini diterangkan dengan teori tumbukan.
Reaksi kimia terjadi karena tumbukan antara partikel-partikel zat yang bereaksi. Namun tidak semua tumbukan antarmolekul pereaksi akan menghasilkan zat hasil reaksi. Hanya tumbukan efektif yang akan menghasilkan zat hasil reaksi. Keefektifan suatu tumbukan bergantung pada posisi molekul dan energi kinetik yang dimilikinya.
Dalam reaksi kimia dikenal istilah energi aktivasi (energi pengaktifan) yaitu energi kinetik minimum yang harus dimiliki molekul-molekul pereaksi agar tumbukan antarmolekul menghasilkan zat hasil reaksi.
Teori tumbukan dan energi aktivasi berguna untuk menjelaskan faktor-faktor yang mempengaruhi laju reaksi. Laju suatu reaksi kimia dapat dipercepat dengan cara memperbesar harga energi kinetik molekul atau menurunkan harga energi aktivasi. 1. Pengaruh konsentrasi terhadap laju reaksi
2. Pengaruh luas permukaan
Makin luas permukaan sentuhan semakin banyak kemungkinan terjadinya tumbukan antarpartikel pereaksi sehingga makin cepat reaksinya. Zat padat bentuk serbuk memiliki luas permukaan lebih besar daripada bentuk kepingan, sehingga zat padat bentuk serbuk bereaksi lebih cepat daripada bentuk kepingan. 3. Pengaruh suhu
Pada umumnya reaksi makin cepat bila suhu dinaikkan, makin tinggi cepat gerak partikel-partikel pereaksi dan makin besar pula energi kinetiknya. Sehingga banyak partikel-partikel pereaksi yang memiliki energi yang mencapai energi pengaktifan akibatnya reaksi makin cepat. Menaikkan suhu berarti menambahkan energi, sehingga energi kinetik molekul bertambah akibatnya molekul-molekul lebih aktif bergerak sehingga lebih banyak terjadi tumbukan dan menghasilkan reaksi, akibatnya reaksi menjadi lebih cepat. Pada umumnya setiap kenaikkan suhu 10⁰C reaksi menjadi 2 kali lebih cepat, sehingga dapat dirumuskan:
vt = 2n x v0 dengan n = 10
t t 0
Contoh soal:
Setiap kenaikkan suhu 10⁰C laju reaksi menjadi 2 kali lebih cepat. Suatu reaksi yang berlangsung pada suhu 30⁰C lajunya adalah x, tentukanlah laju reaksi pada suhu 100⁰C!
Jawab:
Suhu acuan t0 = 30⁰C mempunyai v0 = x. Setiap kenaikkan suhu 10⁰C, laju reaksi menjadi 2 kali lebih cepat. Rumus: vt = 2n x v0, di mana n =
10 t t 0
v100 → n = 10
30 -100
4. Pengaruh katalis
Katalis adalah zat yang dapat mempercepat reaksi di mana pada akhir reaksi terbentuk kembali dengan jumlah yang tetap. Katalis mempercepat reaksi dengan jalan menurunkan energi aktivasi yaitu energi minimum yang harus dimiliki agar reaksi dapat berlangsung. Katalis yang dapat mempercepat reaksi disebut katalisator, sedangkan katalis yang dapat memperlambat laju reaksi disebut inhibitor.
Penentuan Laju Reaksi dari Mekanisme Reaksi
Telah dijelaskan bahwa reaksi terjadi akibat tumbukan antarpartikel atom unsur atau partikel molekul senyawa zat yang bereaksi. Banyak reaksi yang terjadi melalui tahapan reaksi (mekanisme reaksi). Misalnya jika kita mereaksikan zat A dan zat B
menghasilkan zat C sebagai berikut: 2A + B → C. Reaksi yang berlangsung bukan 2
mol zat A bereaksi langsung dengan 1 nol zat B, melainkan berlangsung melalui dua tahap, yaitu sebagai berikut:
Tahap 1 : A + B → C (berlangsung lambat) Tahap 2 : A + AB → C (berlangsung cepat)
Dari kedua tahap reaksi tersebut dapat dilihat bahwa reaksi tahap-1 berlangsung lebih lambat dibandingkan dengan reaksi tahap-2. Untuk menentukan laju reaksi dari tahapan reaksi tersebut, ditentukan dari tahap reaksi paling lambat. dari reaksi di atas, tahap reaksi yang paling lambat adalah
A + B → AB
Persamaan laju reaksinya adalah v = k[A][B]
B. Soal
Jawablah Pertanyaan-pertanyaan di bawah ini dengan benar!
1. Sebutkan faktor-faktor yang mempengaruhi laju reaksi?
Jawab: ………
………
3. Apakah yang dimaksud dengan energi pengaktifan? Jelaskan dengan singkat hubungan energi pengaktifan dengan laju reaksi!
Jawab: ……… ……… 4. Suatu reaksi berlangsung dua kali lebih cepat bila suhu dinaikkan 10ºC. Pada suhu
kamar (25ºC) reaksi kamar dapat berlangsung dengan laju 0,01 M/det. Berapa laju reaksinya bila dilakukan pada suhu 65ºC?
Jawab: ……… ……… 5. Jelaskan fungsi katalisator dalam laju reaksi?
Jawab: ……… ……… 6. Perhatikan data berikut.
No. Zn Larutan HCl Suhu 1 Serbuk 0,2 M 30 ºC 2 Keping 0,2 M 30 ºC 3 Serbuk 0,5 M 50 ºC 4 Keping 0,2 M 50 ºC 5 Serbuk 0,2 M 50 ºC
Reaksi nomor berapakah yang diharapkan berlangsung paling cepat? Jelaskan dengan singkat!
Jawab: ………
……… 7. Perhatikanlah diagram perubahan energi dari reaksi berikut!
E (kJ) 100
2HI 75
50
H2 + I2 25
Jawab: ……… ……… 8. Diketahui reaksi: 2NO + Br2 → 2NOBr mempunyai tahap reaksi sebagai berikut.
NO + Br2 → NOBr2 (lambat)
NOBr2 + NO → 2NOBr (cepat)
Tentukan persamaan laju reaksinya!
RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
KELAS EKSPERIMEN
PERTEMUAN KE-4
Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia
Kelas/ Semester : XI/ I Tahun Pelajaran : 2010/2011 Pokok Bahasan : Laju Reaksi Alokasi Waktu : 90 menit
Standar Kompetensi : 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta
penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi Dasar : 3.1 Mendeskripsikan pengertian laju reaksi dengan
melakukan percobaan tentang faktor-faktor yang mempengaruhi laju reaksi.
Indikator : Menentukan persamaan laju reaksi dan orde reaksi
I. Tujuan Pembelajaran
1. Siswa dapat menentukan persamaan laju reaksi dan orde reaksi 2. Siswa dapat menghitung laju reaksi
II. Materi Ajar
Laju reaksi berbanding lurus dengan konsentrasi zat-zat yang bereaksi dipangkatkan orde reaksi (tingkat reaksi). Secara umum pada reaksi Aa + bB → cC +
dD. Laju reaksi dirumuskan dengan:
v = k[A]m[B]n Ket:
v = laju reaksi m = orde reaksi terhadap A [A] = konsentrasi A (M) n = orde reaksi terhadap B [B] = konsentrasi B (M) m + n = orde reaksi
III. Pendekatan Pembelajaran Pendekatan Konsep
IV. Metode Pembelajaran
Diskusi kelompok, tanya jawab V. Langkah Kegiatan Pembelajaran
Kegiatan Aktivitas Guru Aktivitas Siswa
Awal (Apersepsi dan
Motivasi) 15 menit
Menciptakan lingkungan belajar, seperti berdoa dan salam.
Menyiapkan sumber belajar.
Menjelaskan tujuan pembelajaran yang akan dicapai dari materi yang akan dibahas.
Memotivasi dan menggali pengetahuan siswa dengan memberikan pertanyaan untuk mengingat kembali materi tentang laju reaksi dan faktor-faktor yang mempengaruhi laju reaksi. Sebutkan faktor-faktor yang mempengaruhi laju reaksi?
Berdoa dan menyiapkan alat dan bahan pelajaran.
Menyimak penjelasan guru.
Siswa menyimak pertanyaan guru dan menjawab.
Faktor-faktor yang mempengaruhi laju reaksi
1. Konsentrasi 2. Luas permukaan 3. Suhu 4. Katalis Inti 60 menit (eksplorasi diskusi, penjelasan konsep)
Mengajak siswa untuk membentuk 4 kelompok (Kelompok yang telah dibentuk pada pertemuan pertama). Kemudian guru membagikan lembar kegiatan siswa sebagai bahan diskusi.
Meminta siswa untuk mengadakan diskusi kelompok untuk memahami tentang cara menentukan persamaan laju reaksi dan orde reaksi.
Secara berkelompok siswa mempelajari Lembar Kegiatan Siswa (LKS) dan bahan bacaan untuk memahami cara menentukan persamaan laju reaksi dan orde reaksi.
Membimbing siswa pada tiap-tiap kelompok dalam mengerjakan soal pada lembar kegiatan siswa.
Mengajak siswa membahas hasil diskusi dengan meminta perwakilan salah satu siswa pada tiap kelompok untuk membacakan hasil diskusi. Kelompok lainnya memberikan pendapat/ komentar/ saran.
Membahas hasil diskusi dan menjelaskan kembali tentang persamaan laju reaksi dan orde reaksi.
Meminta siswa maju ke depan untuk mengerjakan soal latihan pada lembar kegiatan siswa.
Perwakilan siswa dari tiap kelompok menjelaskan hasil diskusi tentang persamaan laju reaksi dan orde reaksi
Menyimak penjelasan guru dan memahami pembahasan hasil diskusi
Bertanya sesuai konsep yang dijelaskan.
Maju ke depan untuk menuliskan jawabannya di papan tulis dan menjelaskan langkah-langkah pengerjaan soalnya kepada teman-teman yang lain.
Akhir 15 menit (Pengemban gan dan aplikasi)
Membimbing siswa menyimpulkan materi yang telah dipelajari dan melakukan tanya jawab tentang materi yang belum dipahami.
Memberikan tugas individu yang terdapat pada buku pelajaran kimia SMA Kelas XI
Salah seorang siswa menyimpulkan tentang persamaan laju reaksi dan orde reaksi.
VI. Sumber dan Alat/ Media Pembelajaran 1. Sumber
Buku kimia SMA kelas XI (Bumi Aksara)
Buku kimia SMA kelas XI (Yudhistira)
Lembar Kegiatan Siswa 2. Alat/media
Media pembelajaran yang digunakan adalah papan tulis dan spidol.
VII. Penilaian
Penilaian untuk mengevaluasi hasil belajar siswa adalah tes uraian yang terdapat pada lembar kerja siswa dan Penilaian performance dilakukan melalui pengamatan pada saat siswa melakukan kegiatan pembelajaran.
Guru Kimia Peneliti
Dra. Wara Gawatiningsiah Nur Cholifah NIP: 19651111 200701 2 017 NIM: 106016200624
Mengetahui,
Kepala SMAN 3 Tangerang Selatan
Lembar Kegiatan Siswa (LKS) Kelas Eksperimen
Kelompok : Nama : 1.
2. 3. 4.
5.
Menentukan Persamaan Laju Reaksi dan Orde Reaksi
Laju reaksi berbanding lurus dengan konsentrasi zat-zat yang bereaksi dipangkatkan orde reaksi (tingkat reaksi). Secara umum pada reaksi Aa + bB → cC + dD. Laju reaksi dirumuskan dengan:
Ket:
v = k[A]m[B]n v = laju reaksi m = orde reaksi terhadap A [A] = konsentrasi A (M) n = orde reaksi terhadap B
[B] = konsentrasi B (M) m + n = orde reaksi k = ketetapan laju reaksi
Jawablah Pertanyaan-pertanyaan di bawah ini dengan benar!
1. Data percobaan suatu reaksi 2A + B2→ 2AB adalah sebagai berikut. No [A] M [B2] M V (M/s)
1 0,50 0,50 1,6x10-4 2 0,50 1,00 3,2x10-4 3 1,00 1,00 3,2x10-4 Tentukan:
a. Orde reaksi terhadap A c. Orde reaksi total b. Orde reaksi terhadap B2 d. Persamaan laju reaksi
2. Diketahui reaksi:
2NO + 2H2→ N2 + 2H2O
Berlangsung melalui tahap-tahap yang teramati sebagai berikut: 2NO + H2→ N2O+ H2O (lambat)
N2O + H2→ N2 + H2O (cepat) Tentukan:
a. Orde reaksi terhadap NO c. Orde reaksi total b. Orde reaksi terhadap H2 d. Persamaan laju reaksi
Jawab: ……… ……… 3. Dalam suatu percobaan untuk mengamati reaksi A(g) + B(g) → C(g) diperoleh data
sebagai berikut.
No [A] M [B] M V (M/s)
1 0,1 0,1 2
2 0,1 0,2 8
3 0,2 0,2 16
Tentukan:
a. Orde reaksi terhadap A c. Orde reaksi total b. Orde reaksi terhadap B d. Persamaan Laju Reaksi
Jawab: ……… ……… 4. Dari suatu reaksi : 2H2 + 2NO → 2H2O + N2 diperoleh data sebagai berikut:
No [H2] M [NO] M V (M/s)
1 0,1 0,1 0,03
2 0,5 0,1 0,15
3 0,1 0,3 0,27
Tentukan:
a. Orde reaksi terhadap H2 dan NO b. Persamaan laju reaksi
c. Harga k
d. Laju reaksi jika [H2] = 0,2 M dan [NO] = 0,2 M
5. Dari suatu reaksi : A+ B → Cdiperoleh data sebagai berikut: No [A] M [B] M t (det)
1 0,1 0,1 80
2 0,2 0,1 40
3 0,2 0,2 10
Tentukan:
a. Orde reaksi terhadap A dan B b. Persamaan laju reaksi
c. Orde reaksi total
RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
KELAS KONTROL
PERTEMUAN KE-1
Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia
Kelas/ Semester : XI/ I Tahun Pelajaran : 2010/2011 Pokok Bahasan : Laju Reaksi Alokasi Waktu : 90 menit
Standar Kompetensi : 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta
penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi Dasar : 3.1 Mendeskripsikan pengertian laju reaksi dengan
melakukan percobaan tentang faktor-faktor yang mempengaruhi laju reaksi.
Indikator : 1. Menentukan konsentrasi larutan. 4. Memahami pengertian laju reaksi.
5. Menentukan laju reaksi berdasarkan persamaan reaksi.
I. Tujuan Pembelajaran
1. Siswa dapat menentukan konsentrasi larutan. 2. Siswa dapat memahami pengertian laju reaksi.
3. Siswa dapat menentukan laju reaksi berdasarkan persamaan reaksi.
II. Materi Ajar
1. Kemolaran (M)
Untuk menyatakan kadar zat terlarut dalam larutan dinyatakan dengan konsentrasi larutan.
a. Pengertian Kemolaran
M =
mL 1000 x M r
g M atau v n
Keterangan:
M = molaritas (mol⁄Latau mmol mL⁄ ) n = mol zat terlarut (mol atau mmol) V = volume larutan (L atau mL) g = massa zat terlarut (gram)
b. Pengenceran
Pengenceran adalah menurunkan atau memperkecil konsentrasi larutan dengan menambahkan pelarut. Dalam hal ini konsentrasi yang digunakan adalah molaritas (M). Pada proses pengenceran volume dan molaritas berubah, sedangkan jumlah molnya tetap.
V1M1 = V2M2 Keterangan:
V1 = volume larutan sebelum diencerkan (L atau mL) M1 = molaritas larutan sebelum diencerkan
V2 = volume larutan setelah diencerkan (L atau mL) M2 = molaritas larutan setelah diencerkan
c. Pencampuran
Pencampuran adalah campuran dari dua atau lebih zat yang jenisnya sama, tetapi konsentrasi berbeda. Dalam hal ini konsentrasi yang digunakan adalah molaritas (M).
Pada proses pencampuran beberapa zat yang sejenis berlaku rumus:
V1M1V+ V2M2+ V3M3+ …
1+ V2+ V3+…
Untuk pencampuran 2 jenis zat yang sejenis berlaku rumus:
V1MV1+ V2M2
Keterangan:
Mc = molaritas larutan setelah dicampurkan
V1 = volume larutan pertama yang dicampurkan (L atau mL) M1 = molaritas larutan pertama
V2 = volume larutan kedua yang dicampurkan (L atau mL) M2 = molaritas larutan kedua
2. Laju reaksi
Suatu reaksi kimia ada yang berlangsung cepat, ada pula yang berlangsung lambat. Ledakan bom berlangsung cepat, sedangkan proses besi berkarat berlangsung lambat. Cepat lambatnya suatu reaksi kimia dinyatakan sebagai laju reaksi. Apakah laju reaksi itu?
Laju reaksi menyatakan laju perubahan konsentrasi zat yang terlibat dalam reaksi setiap satuan waktu. Perhatikan grafik berikut.
Pada grafik di atas menunjukkan bahwa konsentrasi pereaksi dalam suatu reaksi kimia semakin lama semakin berkurang, sedangkan hasil reaksi semakin lama akan semakin bertambah.
N2(g) + 3 H2(g) 2 NH3(g) Pada reaksi diatas dapat dinyatakan: - Laju penambahan konsentrasi NH3 - Laju pengurangan konsentrasi N2 dan H2
Konsentrasi
Waktu
Hasil reaksi (C + D)
[image:42.595.110.505.233.539.2]Pereaksi (A + B)
Dengan demikian, laju reaksi dapat dinyatakan sebagai pengurangan konsentrasi pereaksi per satuan waktu, atau penambahan konsentrasi hasil reaksi per satuan waktu.
Laju Reaksi (v) =
t) ( waktu Perubahan
C) ( i konsentras Perubahan
Laju reaksi memiliki satuan Ms-1 (M = molar dan s = sekon = detik)
III. Pendekatan Pembelajaran Pendekatan Konsep
IV. Metode Pembelajaran
Demonstrasi, ceramah, diskusi, dan tanya jawab. V. Langkah Kegiatan Pembelajaran
Kegiatan Aktivitas Guru Aktivitas Siswa
Awal (Apersepsi dan
Motivasi) 15 menit
Menciptakan lingkungan belajar, seperti berdoa dan salam.
Menjelaskan tujuan pembelajaran yang akan dicapai dari materi yang akan dibahas.
Memotivasi dan menggali pengetahuan siswa dengan memberikan pertanyaan. Suatu reaksi kimia ada yang berlangsung cepat, ada pula yang berlangsung lambat. Ledakan bom berlangsung cepat, sedangkan proses besi berkarat berlangsung lambat. Cepat lambatnya suatu reaksi kimia dinyatakan sebagai suatu laju reaksi. Apakah laju reaksi itu?
Berdoa dan menyiapkan alat dan bahan pelajaran.
Menyimak penjelasan guru.
Inti 60 menit (eksplorasi diskusi, penjelasan konsep)
Menjelaskan pengertian kemolaran dan laju reaksi.
Melakukan demonstrasi untuk menentukan molaritas dalam suatu larutan.
Mengajak siswa untuk membentuk 4 kelompok. Kemudian guru membagikan lembar kegiatan siswa sebagai bahan diskusi.
Meminta siswa untuk mengadakan diskusi kelompok untuk memahami tentang konsep kemolaran dan laju reaksi.
Membimbing siswa pada tiap-tiap kelompok dalam mengerjakan soal pada lembar kegiatan siswa.
Mengajak siswa membahas hasil diskusi dengan meminta perwakilan siswa dari tiap kelompok untuk membacakan hasil diskusi. Kelompok lainnya memberikan pendapat/ komentar/ saran.
Membahas hasil diskusi dan menjelaskan kembali tentang kemolaran dan konsep laju reaksi.
Meminta siswa maju ke depan untuk mengerjakan soal latihan pada lembar kegiatan siswa.
Menyimak penjelasan guru tentang pengertian kemolaran dan laju reaksi.
Mengamati demonstrasi yang dilakukan guru untuk menentukan molaritas dalam suatu larutan.
Secara berkelompok siswa mempelajari Lembar Kegiatan Siswa (LKS) dan bahan bacaan untuk berdiskusi memahami kemolaran dan konsep laju reaksi
Berperan aktif dalam diskusi dan menjawab soal-soal yang terdapat pada lembar kerja siswa.
Perwakilan siswa dari tiap kelompok menjelaskan hasil diskusi tentang kemolaran dan laju reaksi.
Menyimak penjelasan guru dan memahami pembahasan hasil diskusi
Bertanya sesuai konsep yang dijelaskan.
pengerjaan soalnya. Akhir
15 menit (Pengemban gan dan aplikasi)
Membimbing siswa menyimpulkan materi yang telah dipelajari dan melakukan tanya jawab tentang materi yang belum dipahami.
Memberikan tugas individu yang terdapat pada buku pelajaran kimia SMA Kelas XI
Salah seorang siswa menyimpulkan tentang konsep kemolaran dan laju reaksi.
VI. Sumber dan Alat/ Media Pembelajaran 1. Sumber
Buku kimia SMA kelas XI (Yudhistira)
Buku kimia SMA kelas XI (Yrama Widya) dan Lembar kegiatan siswa 2. Alat/media
Media pembelajaran yang digunakan adalah papan tulis, spidol, alat dan bahan percobaan.
VII. Penilaian
Penilaian untuk mengevaluasi hasil belajar siswa adalah tes uraian yang terdapat pada lembar kegiatan siswa dan Penilaian performance dilakukan melalui pengamatan pada saat siswa melakukan kegiatan pembelajaran.
Guru Kimia Peneliti
Dra. Wara Gawatiningsiah Nur Cholifah NIP: 19651111 200701 2 017 NIM: 106016200624
Mengetahui,
Kepala SMAN 3 Tangerang Selatan
Lembar Kegiatan Siswa (LKS) Kelas Kontrol
Kelompok : Nama : 1.
2. 3. 4.
5.
A. Materi
a. Kemolaran (M)
Untuk menyatakan kadar zat terlarut dalam larutan dinyatakan dengan konsentrasi larutan.
1. Pengertian Kemolaran
Kemolaran adalah satuan konsentrasi larutan yang menyatakan jumlah mol zat terlarut dalam 1 liter larutan. Kemolaran sama dengan jumlah mol (n) zat terlarut dibagi dengan volume (v) larutan.
M=Vn atau M= Mrg 1000mL
Keterangan:
M = molaritas (mol⁄Latau mmol mL⁄ ) n = mol zat terlarut (mol atau mmol)
V = volume larutan (L atau mL) g = massa zat terlarut (gram)
Contoh soal:
10 gram NaOH (Mr = 40) dilarutkan ke dalam air sehingga volume larutan 2 liter. Tentukanlah molaritas larutan NaOH tersebut!
Zat terlarut NaOH 10 gram = 40 10
mol = 0,25 volume larutan = 2 liter
[NaOH] = v n = 2 25 , 0
M = 0,125 M
2. Pengenceran
Pengenceran adalah menurunkan atau memperkecil konsentrasi larutan dengan menambahkan pelarut. Dalam hal ini konsentrasi yang digunakan adalah molaritas (M). Pada proses pengenceran volume dan molaritas berubah, sedangkan jumlah molnya tetap.
V1M1 = V2M2 Keterangan:
V1 = volume larutan sebelum diencerkan (L atau mL) M1 = molaritas larutan sebelum diencerkan
V2 = volume larutan setelah diencerkan (L atau mL) M2 = molaritas larutan setelah diencerkan
Contoh Soal:
250 mL larutan CaCl2 0,15 M diencerkansampai memperoleh konsentrasi ion Cl- 0,1 M. Berapakah volume larutan CaCl2 sekarang?
Jawab:
V1M1n = V2M2n 250 x 0,15 x 2 = V2 x 0,1 x 1
V2 = 750 mL 3. Pencampuran
Pencampuran adalah campuran dari dua atau lebih zat yang jenisnya sama, tetapi konsentrasi berbeda. Dalam hal ini konsentrasi yang digunakan adalah molaritas (M).
Untuk pencampuran 2 jenis zat yang sejenis berlaku rumus: Mc = 2 1 2 2 1 1 V V ... M V M V Keterangan:
Mc = molaritas larutan setelah dicampurkan
V1 = volume larutan pertama yang dicampurkan (L atau mL) M1 = molaritas larutan pertama
V2 = volume larutan kedua yang dicampurkan (L atau mL) M2 = molaritas larutan kedua
Contoh soal:
100 mL larutan HCl 0,1 M dicampurkan dengan 150 mL larutan HCl 0,2 M. Hitunglah konsentrasi larutan setelah dicampurkan!
Jawab:
Rumus percampuran
Mc =
2 1 2 2 1 1 V V ... M V M V = 150 100 0,2) x (150 0,1) x 10 ( = 250 40 = 0,16
b. Laju reaksi
Suatu reaksi kimia ada yang berlangsung cepat, ada pula yang berlangsung lambat. Ledakan bom berlangsung cepat, sedangkan proses besi berkarat berlangsung lambat. Cepat lambatnya suatu reaksi kimia dinyatakan sebagai laju reaksi. Apakah laju reaksi itu?
Pada grafik di atas menunjukkan bahwa konsentrasi pereaksi dalam suatu reaksi kimia semakin lama semakin berkurang, sedangkan hasil reaksi semakin lama akan semakin bertambah.
N2(g) + 3 H2(g) 2 NH3(g) Pada reaksi diatas dapat dinyatakan:
- Laju penambahan konsentrasi NH3 - Laju pengurangan konsentrasi N2 dan H2
Dengan demikian, laju reaksi dapat dinyatakan sebagai pengurangan konsentrasi pereaksi per satuan waktu, atau penambahan konsentrasi hasil reaksi per satuan waktu.
Laju Reaksi (v) =
t) ( waktu Perubahan
C) ( i konsentras Perubahan
Laju reaksi memiliki satuan Ms-1 (M = molar dan s = sekon = detik) Molaritas larutan
Tujuan: Untuk menentukan molaritas dari suatu larutan
Alat dan Bahan:
- Gelas kimia 100 mL - 5 gram NaCl (Ar: Na=23, Cl=35,5)
- Spatula - aquades
Konsentrasi
Waktu
Hasil reaksi (C + D)
[image:49.595.154.403.85.269.2]Pereaksi (A + B)
Langkah Kerja:
1. Siapkan satu buah gelas kimia.
2. Masukkan 100 mL aquades ke dalam gelas kimia. 3. Masukkan 5 gram NaCl, aduk hingga larut. Pertanyaan:
Hitung molaritas dari larutan NaCl tersebut?
... ... ... B. Soal
Jawablah pertanyaan-pertanyaan di bawah ini dengan benar!
1. Sejumlah asam sulfat dilarutkan ke dalam air sehingga volume larutan 500 mL dan konsentrasinya 0,1 M. Tentukanlah berapa gram asam sulfat yang dilarutkan (Mr H2SO4 = 98) ?
Jawab: ……….. ………..
2. Sebanyak 2 gram NaOH (Mr = 40) dilarutkan ke dalam air hingga volume larutan 200 mL. Tentukanlah molaritas larutan NaOH tersebut!
Jawab: ……….. ………..
3. Diketahui 500 mL larutan HCl 0,1 M. Tentukan berapa mol dan berapa gram HCl terdapat dalam larutan tersebut! Ar H = 1; Cl = 35,5
Jawab: ……….. ………..
4. 100 mL larutan H2SO4 0,1 M diencerkan sehingga konsentrasinya menjadi 0,01 M. Hitunglah volume larutan setelah pengenceran dan volume pelarut yang ditambahkan!
5. Jika 100 mL larutan HBr 0,8 M dicampurkan dengan 100 mL larutan HBr 0,2 M, tentukanlah molaritas larutan setelah percampuran!
Jawab: ………..
……….. 6. Tentukan reaksi pembentukan gas ammonia sesuai reaksi,
N2(g) + 3H2(g) → 2NH3(g)
c. Tentukan laju reaksi masing-masing zat!
d. Bagaimanakah hubungan antara , ?
Jawab: ……….. ………..
7. Jelaskan yang dimaksud dengan laju reaksi!
Jawab: ………..
……….. 8. Zat X bereaksi dengan zat Y menurut persamaan kimia:
X + Y → Z. Jika konsentrasi awal Y = 0,5 M dan setelah bereaksi dengan zat X selama satu menit konsentrasinya menjadi 0,2 M; maka tentukan laju reaksi tersebut terhadap Y!
Jawab: ……….. ………..
9. Ke dalam suatu ruangan 1 liter dicampurkan x mol gas P dan y mol gas Q. Selang waktu t detik sebagian dari gas-gas tersebut telah membentuk a mol gas R sesuai persamaan reaksi: 2P(g) + 3Q(g) → R(g). Nyatakan laju reaksi gas P, Q, dan R tersebut.
Jawab: ……….. ………..
10. Laju reaksi dapat diartikan sebagai perubahan konsentrasi tiap satuan waktu. Bagaimana pengaruh konsentrasi terhadap laju reaksi?
RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
KELAS KONTROL
PERTEMUAN KE-2
Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia
Kelas/ Semester : XI/ I Tahun Pelajaran : 2010/2011 Pokok Bahasan : Laju Reaksi Alokasi Waktu : 90 menit
Standar Kompetensi : 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta
penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi Dasar : 3.1 Mendeskripsikan pengertian laju reaksi dengan
melakukan percobaan tentang faktor-faktor yang mempengaruhi laju reaksi.
Indikator : Menentukan faktor-faktor yang mempengaruhi laju reaksi dengan melakukan percobaan.
I. Tujuan Pembelajaran
Siswa dapat menentukan faktor-faktor yang mempengaruhi laju reaksi dengan melakukan percobaan.
II. Materi Ajar
Faktor-faktor yang mempengaruhi laju reaksi a. Pengaruh konsentrasi terhadap laju reaksi
b. Pengaruh luas permukaan
Makin luas permukaan sentuhan semakin banyak kemungkinan terjadinya tumbukan antarpartikel pereaksi sehingga makin cepat reaksinya. Zat padat bentuk serbuk memiliki luas permukaan lebih besar daripada bentuk kepingan, sehingga zat padat bentuk serbuk bereaksi lebih cepat daripada bentuk kepingan. c. Pengaruh suhu
Pada umumnya reaksi makin cepat bila suhu dinaikkan, makin tinggi cepat gerak partikel-partikel pereaksi dan makin besar pula energi kinetiknya. Sehingga banyak partikel-partikel pereaksi yang memiliki energi yang mencapai energi pengaktifan akibatnya reaksi makin cepat.
d. Pengaruh katalis
Katalis adalah zat yang dapat mempercepat reaksi di mana pada akhir reaksi terbentuk kembali dengan jumlah yang tetap. Katalis mempercepat reaksi dengan jalan menurunkan energi aktivasi yaitu energi minimum yang harus dimiliki agar reaksi dapat berlangsung.
III. Pendekatan Pembelajaran Pendekatan Konsep
IV. Metode Pembelajaran
Ceramah, demonstrasi, diskusi, tanya jawab V. Langkah Kegiatan Pembelajaran
Kegiatan Aktivitas Guru Aktivitas Siswa
Awal (Apersepsi dan
Motivasi) 15 menit
Menciptakan lingkungan belajar, seperti berdoa dan salam.
Menyiapkan sumber belajar, alat dan bahan untuk melakukan demonstrasi tentang faktor-faktor yang mempengaruhi laju reaksi.
Menjelaskan tujuan pembelajaran yang akan dicapai dari materi yang akan dibahas.
Berdoa dan menyiapkan alat dan bahan pelajaran
Memotivasi dan menggali pengetahuan siswa dengan memberikan pertanyaan
Mengapa wortel yang dipotong kecil-kecil jika direbus lebih cepat matang dari pada wortel yang tidak dipotong-potong ?
Siswa menyimak pertanyaan guru dan menjawab. Inti 60 menit (eksplorasi diskusi, penjelasan konsep)
Menjelaskan tentang faktor-faktor yang mempengaruhi laju reaksi.
Mengajak siswa untuk membentuk 4 kelompok (kelompok yang telah dibentuk pada pertemuan pertama). Kemudian guru membagikan lembar kerja siswa.
Melakukan demonstrasi untuk menjelaskan faktor-faktor yang mempengaruhi laju reaksi.
Meminta siswa mendiskusikan hasil pengamatan dari demonstrasi dan menghubungkannya dengan teori laju reaksi berdasarkan fakta-fakta yang mereka temukan dari hasil pengamatan.
Menyimak penjelasan guru.
Secara berkelompok siswa mempelajari Lembar Kerja Siswa (LKS) dan mengamati demonstrasi yang dilakukan guru sebagai bahan diskusi untuk memahami faktor-faktor yang mempengaruhi laju reaksi.
Secara berkelompok siswa mendiskusikan faktor-faktor yang mempengaruhi laju reaksi berdasarkan data percobaan.
Akhir 15 menit (Pengemban gan dan aplikasi)
Membimbing siswa menyimpulkan materi yang telah dipelajari dan melakukan tanya jawab tentang materi yang belum dipahami.
VI. Sumber dan Alat/ Media Pembelajaran 1. Sumber
Buku kimia SMA kelas XI (Yrama Widya)
Buku kimia SMA kelas XI (Grafindo)
Buku kimia SMA kelas XI (Yudhistira)
Lembar kerja siswa 2. Alat/media
Media pembelajaran yang digunakan adalah papan tulis, spidol, alat dan bahan percobaan.
VII. Penilaian
Penilaian untuk mengevaluasi hasil belajar siswa adalah tes uraian yang terdapat pada lembar kerja siswa dan Penilaian performance dilakukan melalui pengamatan pada saat siswa melakukan kegiatan pembelajaran.
Guru Kimia Peneliti
Dra. Wara Gawatiningsiah Nur Cholifah NIP: 19651111 200701 2 017 NIM: 106016200624
Mengetahui,
Kepala SMAN 3 Tangerang Selatan
Lembar Kerja Siswa (LKS) Kelas Kontrol
Kelompok : 1.
2.
3.
4.
5.
A.Pengaruh konsentrasi terhadap laju reaksi
Tujuan: Untuk mengetahui pengaruh konsentrasi terhadap laju reaksi Alat dan Bahan:
1. Gelas kimia 100 mL 2. Gelas ukur
3. Labu ukur 50 mL
4. Kertas putih ukuran 15 15 cm yang diberi tanda “X” hitam
5. Stopwatch 6. Larutan HCl 2 M 7. Larutan Na2S2O3 1 M
Langkah kerja:
1. Encerkan larutan Na2S2O3 1 M menjadi Na2S2O3 0,5 M; 0,15 M; 0,10 M; 0,05 M masing-masing 50 mL.
2. Masukkan 5 mL larutan HCl 2 M ke dalam gelas kimia.
3. Simpan gelas kimia di atas kertas putih bertanda”X”.
4. Tambahkan 25 mL larutan Na2S2O3 0,05 M ke dalam gelas kimia.
5. Catat waktu yang diperlukan sejak penambahan Na2S2O3 sampai tanda ”X” tidak terlihat lagi.
Data Pengamatan
V Na2S2O3 1 M yang dipipet
M Na2S2O3 Sebelum Pengenceran
V Na2S2O3 Setelah Pengenceran
M Na2S2O3 Setelah Pengenceran
… mL 1 M 50 mL 0,05 M
… mL 1 M 50 mL 0,10 M
… mL 1 M 50 mL 0,50 M
Gelas [HCl] [Na2S2O3] Waktu (s) Laju Reaksi (s-1)
1 2 M 0,05 M … …
2 2 M 0,10 M … …
3 2 M 0,50 M … …
Pertanyaan:
1. Gelas manakah yang lebih cepat menghilangkan tanda “X”?
... ... ... 2. Berdasarkan data hasil pengamatan, bagaimana pengaruh konsentrasi terhadap
laju reaksi?
... ... ...
B. Pengaruh suhu terhadap laju reaksi
Tujuan: Untuk mengetahui pengaruh suhu terhadap laju reaksi. Alat dan bahan:
1. Gelas kimia 100 mL 5. Stopwatch
2. Termometer 6. Logam seng 3. Penangas air 7. Larutan HCl 1 M 4. Es batu
Langkah kerja
1. Siapkan gelas kimia sebanyak tiga buah yang telah diberi label 1, 2 dan 3. 2. Tuangkan sekitar 50 mL HCl 1 M ke dalam setiap gelas kimia.
3. Simpan gelas 1 di atas es batu, ukurlah suhunya. 4. Simpan gelas 2 pada suhu kamar.
6. Masukkan ke dalam setiap gelas, logam seng dalam berat yang sama (1 g). 7. Catat hasil pengamatan hingga semua logam seng bereaksi.
Data Pengamatan
Gelas Waktu (s) Laju Reaksi (s-1)
1 … …
2 … …
3 … …
Pertanyaan:
1. Gelas manakah yang lebih cepat membuat logam seng bereaksi?
... ... ... 2. Berdasarkan data hasil pengamatan, bagaimana pengaruh suhu terhadap laju
reaksi?
... ... ... C. Pengaruh luas permukaan terhadap laju reaksi
Tujuan: Untuk mengetahui pengaruh luas permukaan terhadap laju reaksi.
(Percobaan I) (Percobaan II) (Percobaan III) Alat dan Bahan:
- Gelas kimia - garam halus - Spatula - garam kristal
- Stopwatch - garam balok
Langkah kerja:
1. Siapkan gelas kimia sebanyak tiga buah dan diberi label 1, 2 dan 3. 2. Tuangkan sekitar 100 mL air ke dalam setiap gelas kimia.
3. Masukkan sekitar 3 gram garam halus ke dalam gelas kimia 1. 4. Masukkan sekitar 3 gram garam kristal ke dalam gelas kimia 2. 5. Masukkan sekitar 3 gram garam balok ke dalam gelas kimia 3.
6. Catat hasil pengamatan hingga garam pada masing-masing gelas larut.
Data Pengamatan
Gelas Bentuk Garam Waktu (s)
1 Garam halus
2 Garam kristal
3 Garam balok
Pertanyaan:
1. Manakah garam yang memiliki luas permukaan yang paling besar?
... ... ... 2. Berdasarkan data hasil pengamatan, bagaimana pengaruh luas permukaan
terhadap laju reaksi?
... ... ... D. Pengaruh katalis terhadap laju reaksi
Tujuan: Untuk mengetahui pengaruh katalis terhadap laju reaksi.
Alat dan Bahan:
- Alas logam - gula
- Korek api - abu rokok
Langkah kerja:
1. Siapkan alas yang terbuat dari logam.
2. Letakkan satu sendok gula diatas alas logam, lalu bakar. 3. Letakkan abu rokok di salah satu sisi gula, lalu bakar. 4. Catat hasil pengamatan, apa yang akan terjadi pada gula. Data Pengamatan
Bahan yang digunakan Pengamatan Percobaan I
Percobaan II
Pertanyaan:
1. Pada percobaan I, apa yang terjadi pada saat gula dibakar?
... ... ... 2. Pada percobaan II, apa yang terjadi pada gula yang telah diberikan abu rokok di
salah satu sudutnya pada saat dibakar?
... ... ... 3. Pada percobaan II, apakah yang akan terjadi pada abu rokok setelah proses
pembakaran selesai?
... ... ... 4. Apakah fungsi abu rokok pada proses pembakaran tersebut?
... ... ... 5. Bagaimana pengaruh katalis terhadap laju reaksi?
Kesimpulan:
Berdasarkan kegiatan yang telah dilakukan, jelaskan kembali apa yang dimaksud dengan molaritas, laju reaksi serta faktor-faktor apa saja yang dapat mempengaruhi laju reaksi dan bagaimana hubungan antara faktor-faktor yang mempengaruhi laju reaksi berdasarkan teori tumbukan!
RENCANA PELAKSANAAN PEMBELAJARAN (RPP)
KELAS KONTROL
PERTEMUAN KE-3
Sekolah : SMAN 3 Tangerang Selatan Mata Pelajaran : Kimia
Kelas/ Semester : XI/ I Tahun Pelajaran : 2010/2011 Pokok Bahasan : Laju Reaksi Alokasi Waktu : 90 menit
Standar Kompetensi : 3. Memahami kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya, serta
penerapannya dalam kehidupan sehari-hari dan industri. Kompetensi Dasar : 3.1 Mendeskripsikan pengertian laju reaksi dengan
melakukan percobaan tentang faktor-faktor yang mempengaruhi laju reaksi.
Indikator : Menjelaskan pengaruh konsentrasi, luas permukaan, suhu dan katalis terhadap laju reaksi berdasarkan teori
tumbukan. I. Tujuan Pembelajaran
Siswa dapat menjelaskan pengaruh konsentrasi, luas permukaan, suhu dan katalis terhadap laju reaksi berdasarkan teori tumbukan.
II. Materi Ajar
Teori Tumbukan dan Energi Aktivasi
Reaksi kimia terjadi karena tumbukan antara partikel-partikel zat yang bereaksi. Namun tidak semua tumbukan antarmolekul pereaksi akan menghasilkan zat hasil reaksi. Hanya tumbukan efektif yang akan menghasilkan zat hasil reaksi. Keefektifan suatu tumbukan bergantung pada posisi molekul dan energi kinetik yang dimilikinya.
Teori tumbukan dan energi aktivasi berguna untuk menjelaskan faktor-faktor yang mempengaruhi laju reaksi. Laju suatu reaksi kimia dapat dipercepat dengan cara memperbesar harga energi kinetik molekul atau menurunkan harga energi aktivasi. 1. Pengaruh konsentrasi terhadap laju reaksi
Semakin besar konsentrasi semakin cepat reaksi berlangsung (kecepatan reaksi makin besar). Hal ini disebabkan semakin besar konsentrasi berarti jarak antarmolekul rapat/padat, sehingga semakin banyak/mudah terjadi tumbukan yang menghasilkan reaksi, akibatnya menjadi lebih cepat.
2. Pengaruh luas permukaan
Makin luas permukaan sentuhan semakin banyak kemungkinan terjadinya tumbukan antarpartikel pereaksi sehingga makin cepat reaksinya. Zat padat bentuk serbuk memiliki luas permukaan lebih besar daripada bentuk kepingan, sehingga zat padat bentuk serbuk bereaksi lebih cepat daripada bentuk kepingan. 3. Pengaruh suhu
Pada umumnya reaksi makin cepat bila suhu dinaikkan, makin tinggi cepat gerak partikel-partikel pereaksi dan makin besar pula energi kinetiknya. Sehingga banyak partikel-partikel pereaksi yang memiliki energi yang mencapai energi pengaktifan akibatnya reaksi makin cepat.
4. Pengaruh katal