STUDI PENETAPAN KADAR CAPOZID DALAM SEDIAAN TABLET
SKRIPSI
Oleh: GEMA RIYANI
NIM 050804026
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
STUDI PENETAPAN KADAR CAPOZID DALAM SEDIAAN TABLET
SKRIPSI
Diajukan untuk Melengkapi Salah Satu Syarat untuk Mencapai Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
Oleh: GEMA RIYANI
PENGESAHAN SKRIPSI
STUDI PENETAPAN KADAR CAPOZID DALAM SEDIAAN TABLET
Oleh: GEMA RIYANI
NIM 050804026
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal: September 2009
Pembimbing I,
(Dra. Salbiah, M.Si., Apt.) NIP 194810031987012001
Pembimbing II,
(Drs. Syafruddin, M.S., Apt.) NIP 194811111976031003
Panitia Penguji,
(Drs. Fathur Rahman Harun, M.Si., Apt.) NIP 195201041980031002
(Dra. Salbiah, M.Si., Apt.) NIP 194810031987012001
(Dra. Sudarmi, M.Si., Apt.) NIP 195409101983032001
(Drs. Nurmadjuzita, M.Si., Apt.) NIP 194809041974122001 Dekan,
KATA PENGANTAR
Puji dan syukur penulis haturkan ke hadirat Allah SWT Yang Maha Agung yang telah melimpahkan rahmat, hidayah dan kemudahan kepada penulis sehingga dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Studi Penetapan Kadar Capozid dalam Sediaan Tablet” sebagai salah satu syarat untuk mencapai gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Penulis mempersembahkan rasa terima kasih yang tak terhingga kepada ayahanda Managam Silaban dan Ibunda Erlina Simarmata. yang telah memberikan semangat dan cinta yang teramat tulus, untuk abangku Darman Silaban, Edi Saputra Silaban, Rijal Silaban dan kakakku Erawati Silaban, atas semua doa, kasih sayang, semangat dan pengorbanan baik moril maupun materil. Semoga Allah SWT selalu melindungi kalian semua.
Pada kesempatan ini, penulis juga mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Ibu Dra. Salbiah, M.Si., Apt., dan Bapak Drs. Syafruddin, M.S., Apt., selaku pembimbing yang telah memberikan waktu, bimbingan dan nasehat selama penelitian hingga selesainya penyusunan skripsi ini.
3. Bapak Drs. Fathur Rahman Harun, M.Si., Apt., Ibu Dra. Salbiah, M.Si., Apt., Dra. Sudarmi, M.Si., Apt., dan Dra. Nurnadjuzita, M.Si., Apt., selaku dosen
penguji yang telah memberikan saran, arahan dan kritik kepada penulis dalam penyelesaian skripsi ini.
4. Bapak dan Ibu staf Laboratorium Kimia Farmasi Kuantitatif yang telah memberikan arahan dan fasilitas selama penulis melakukan penelitian dan pengalaman berharga penulis sebagai asisten dosen.
5. Sahabat-sahabat penulis: Rina, Devi, Syebi, Ida, k’muti, k’paksi, k’mimi, saudara/i ku UKMI Ath-Thibb dan rekan-rekan mahasiswa Farmasi khususnya stambuk 2005 atas dukungan, semangat, bantuan dan persahabatan yang indah selama ini serta seluruh pihak yang telah, memberikan kasih sayang, bantuan, motivasi dan inspirasi bagi penulis selama masa perkuliahan sampai penyusunan skripsi ini.
Semoga Allah SWT memberikan balasan yang berlipat ganda dan pahala yang sebesar-besarnya kepada semua pihak yang telah membantu penyelesaian skripsi ini.
Penulis mengharapkan kritik dan saran yang membangun dari semua pihak guna perbaikan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Oktober 2009 Penulis,
Studi Penetapan Kadar Capozid Dalam Sediaan Tablet
Abstrak
Tablet Kombinasi Kaptopril dan Hidroklorotiazid merupakan salah satu sediaan obat yang sering digunakan dalam pengobatan hipertensi. Tujuan penelitian ini adalah untuk mengetahui metode penentuan kadar dan untuk menetapkan kadar Kaptopril dan Hidroklorotiazid dalam sediaan tablet yang beredar di pasaran apakah memenuhi persyaratan mutu obat. Sehingga dengan kadar yang tepat obat dapat memberikan efek terapi yang dikehendaki.
Penetapan kadar Kaptopril dan Hidroklorotiazid dalam sediaan tablet dilakukan bersamaan secara analisis multikomponen (spektrofotometri ultraviolet) dengan menggunakan pelarut natrium hidroksida 0,1 N, Kaptopril diukur pada panjang gelombang 237 nm, Hidroklorotiazid diukur pada panjang gelombang 273 nm; Kaptopril secara Iodatometri dan Hdroklorotiazid secara Spektrofotometri Sinar Tampak. Uji validitas dilakukan berdasarkan parameter akurasi (dengan metode penambahan baku) dan presisi (keseksamaan).
Diperoleh kadar Kaptopril dan Hidroklorotiazid dalam sediaan tablet Capozid(Bristol Meyer Squibb) dengan metode analisis multikomponen (Spektrofotometri Ultraviolet) berturut-turut sebesar 96,51 % ± 2,1753 dan 103,21% ± 0,7150. Kaptopril secara Iodatometri sebesar 95,38% ± 0.0540 dan Hidroklorotiazid secara Spektrofotometri Sinar Tampak sebesar 98,03% ± 0,0945.
Hasil penelitian menunjukkan bahwa kadar Kaptopril dan Hidroklorotiazid dalam sediaan tablet Capozid memenuhi standar persyaratan tablet menurut The United States Pharmacopeia 30 yaitu tidak kurang dari 90% dan tidak lebih dari 110% dari jumlah yang tertera pada etiket.
Determination of Capozide in The Tablet Abstract
Combination of captopril and hydrochlorthiazide in the tablet is one of the drugs which is usually use for hypertension treatment. The aim of this study is to find out the determination method and to determination the value of captopril and hydrochlorthiazide in the tablets which circulates in the general whether it fulfilled requirement of drug quality or not, so that it will give the therapeutic effect.
The determination of captopril and hydrochlorthiazide in the tablet conducted by ultraviolet spectrophotometry using sodium hydroxide 0,1 N as a solvent at wavelength 237 nm for captopril and 273 nm for hydrochlorthiazide and Iodatometry-Visible Spectrophotometry and tested it validity based on parameter accuracy using standard addition method and precision.
It has been found that amount of captopril and hydrochlorthiazide in the Capozid (Bristol Meyer Squibb) tablet using ultraviolet spectrophotometry in a row 96.51 % ± 2.1753 and 103.21% ± 0.7150; using Captopril Iodatometry- Hydrochlorthiazide Visible Spectrophotometry in a row 95.38% ± 0.0540 and 98.03% ± 0.0945.
The result of research indicate that determining of captopril and hydrochlorthiazide in the Capozid tablet was fullfilled requirement of The United States Pharmacopeia 30, not less than 90.0% and not more than 110.0% of the labelled amount.
Keywords : captopril, hydrochlorthiazide, Capozid, detrmination, ultraviolet
DAFTAR ISI
Halaman
JUDUL ...i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... v
ABSTRACT ...vii
DAFTAR ISI ... viii
DAFTAR TABEL ...xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Perumusan Masalah ... 3
1.3. Hipotesis ... 4
1.4. Tujuan ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Kaptopril ... 5
2.1.1 Sifat Fisikokimia... 5
2.1.2 Kegunaan... 6
2.1.3 Efek samping ... 6
2.2.1 Sifat Fisikokimia... 7
2.2.2 Kegunaan... 8
2.2.3 Efek samping ... 8
2.2.4 Dosis ... 8
2.2.5 Farmakologi ... 9
2.3 Teori spektrofotometri ... 9
2.4 Titrasi dengan Kalium Iodat ... 15
2.5 Validasi Metode Analisis ... 15
2.5.1 Kecermatan... 16
2.5.2 Keseksamaan ... 16
BAB III METODOLOGI PENELITIAN ... 17
3.1 Alat-alat ... 17
3.2 Bahan-bahan ... 17
3.3 Pengambilan Sampel ... 17
3.4 Prosedur Penelitian ... 18
3.4.1 Pembuatan Pereaksi ... 18
3.4.1.1 Pembuatan Larutan Natrium Hidroksida 0,1 N ... 18
3.4.1.2 Pembuatan Larutan Natrium Nitrit 0,5% ... 18
3.4.1.3 Pembuatan Larutan Amonium Sulfamat 1% ... 18
3.4.1.4 Pembuatan Larutan N-1-naftiletilendiamin 0,2% ... 18
3.4.1.5 Pembuatan Larutan Asam Klorida 1 N ... 18
3.4.1.6 Pembuatan Larutan Kalium Iodat 0,1 N ... 18
3.4.1.7 Pembuatan Larutan Asam Sulfat 3,6 N ... 19
3.4.1.9 Pembuatan LarutanNatrium Hidroksida P ... 19
3.5 Penetapan Kadar Sampel Metode Spektrofotometri Ultraviolet ... 19
3.5.1 Pembuatan Larutan Induk Baku BPFI... 19
3.5.1.1 Pembuatan Larutan Induk Baku Kaptopril BPFI ... ...19
3.5.1.2 Pembuatan Larutan Induk Baku Hidroklorotiazid BPFI ... ..19
3.5.2 Penentuan Panjang Gelombang Maksimum ... 20
3.5.2.1 Penentuan Panjang Gelombang Maksimum Kaptopril ... 20
3.5.2.2 Penentuan Panjang Gelombang Maksimum Hidroklorotiazid ... 20
3.5.3 Penentuan Absorptivitas ... 20
3.5.3.1 Penentuan Absorptivitas Kaptopril... 20
3.5.3.2 Penentuan Absorptivitas Hidroklorotiazid ... 20
3.5.4 Penetapan Kadar Sampel ... 21
3.6 Penetapan Kadar metode Iodatometri-Spektrofotometri Sinar Tampak ... 21
3.6.1 Kaptopril secara Iodatometri ... 21
3.6.2 Hidroklorotiazid secara Spektrofotometri Sinar tampak ... 22
3.6.2.1 Pembuatan Larutan Induk Baku BPFI ... 22
3.6.2.2 Penentuan Panjang Gelombang Maksimum ... 22
3.6.2.3 Penentuan Waktu Kerja ... 23
3.6.2.4 Pembuatan Kurva Kalibrasi ... 23
3.6.2.5 Penetapan Kadar Sampel ... 24
3.7.2 Penentuan uji presisi ... 25
3.7.3 Analisa data secara statistik ... 25
BAB IV HASIL DAN PEMBAHASAN ... 27
BAB V KESIMPULAN DAN SARAN ... 40
5.1 Kesimpulan ... 40
5.2 Saran ... 40
DAFTAR PUSTAKA ... 41
DAFTAR TABEL
Halaman
Tabel 1. Data Panjang Gelombang Maksimum Kaptopril BPFI ... 28
Tabel 2. Data Panjang Gelombang Maksimum Hidroklorotiazid BPFI ... 29
Tabel 3. Data Absorptivitas Kaptopril BPFI ... 31
Tabel 4. Data Absorptivitas Hidroklorotiazid BPFI ... 31
Tabel 5. Hasil Penetapan Kadar Kaptopril secara Iodatometri ... 31
Tabel 6. Data Panjang Gelombang Maksimum Hidroklorotiazid Secara Spektrofotometri Sinar Tampak ... 33
Tabel 7. Data Kurva Kalibrasi Hidroklorotiazid BPFI ... 34
Tabel 8. Kadar rata-rata Kaptopril dan Hidroklorotiazid dalam sedian tablet Secara Spektrofotometri Ultraviolet ... 35
Tabel 9. Hasil Pengujian perolehan kembali Kaptopril dan Hidroklorotiazid Metode adisi secara Spektrofotometri Ultraviolet ... 37
Tabel 10. Hasil pengujian perolehan kembali Kaptopril Metode adisi Secara Iodatometri ... 38
DAFTAR GAMBAR
Halaman Gambar 1. Kurva serapan kaptopril Baku Pembanding Farmakope Indonesia
(konsentrasi 18 mcg/ml) dalam pelarut NaOH 0,1 N ... 27 Gambar 2. Kurva serapan Hidroklorotiazid Baku Pembanding Farmakope
Indonesia (konsentrasi 8 mcg/ml) dalam pelarut NaOH 0,1 N ... 26 Gambar 3. Kurva serapan overlay Kaptopril dan Hidroklorotiazid
Baku Pembanding Farmakope Indonesia dalam pelarut NaOH 0,1 N ... 30 Gambar 4. Kurva serapan Hidroklorotiazid Baku Pembanding Farmakope
DAFTAR LAMPIRAN
Halaman Lampiran 1. Data kadar Kaptopril dan Hidroklorotiazid dalam sediaan tablet
Secara Spektrofotometri Ultraviolet ... 43 Lampiran 2. Perhitungan konsentrasi pengukuran kaptopril dan Hidroklorotiazid
Secara multikomponen ... 44 Lampiran 3. Perhitungan statistik kadar Kaptopril secara Spektrofotometri
Ultraviolet ... 46 Lampiran 4. Perhitungan statistik kadar Hidroklorotiazid secara
Spektrofotometri Ultraviolet ... 48 Lampiran 5. Hasil penetapan kadar Kaptopril secara Iodatometri ... 50 Lampiran 6. Perhitungan statistik kadar Kaptopril secara Iodatometri ... 51 Lampiran 7. Perhitungan persamaan regresi Hidroklorotiazid secara
Spektrofotometri Sinar Tampak ... 53 Lampiran 8. Data kadar Hidroklorotiazid secara Spektrofotometri
Sinar Tampak ... 54 Lampiran 9. Contoh perhitungan mencari kadar Hidroklorotiazid secara
Spektrofotometri Sinar Tampak ... 55 Lampiran 10. Perhitungan statistik kadar Hidroklorotiazid secara
Spektrofotometri Sinar Tampak ... 56 Lampiran 11. Data hasil perolehan kembali Kaptopril dan Hidroklorotiazid
Metode adisi Secara Spektrofotometri Ultraviolet ... 58 Lampiran 12. Data hasil perolehan kembali Kaptopril metode adisi
Secara Iodatometri ... 59 Lampiran 13. Data hasil perolehan kembali Hidroklorotiazid metode adisi
Lampiran 17. Serapan absorptivitas Kaptopril dan Hidroklorotiazid ... 65
Lampiran 18. Data pengukuran waktu kerja Hidroklorotiazid ... 66
Lampiran 19. Contoh perhitungan penimbangan sampel secara Spektrofotometri Ultraviolet ... 67
Lampiran 20. Nilai distribusi t ... 68
Lampiran 22. Sertifikat pengujian Kaptopril BPFI ... 69
Lampiran 23. Sertifikat pengujian Hidroklorotiazid BPFI ... 70
Studi Penetapan Kadar Capozid Dalam Sediaan Tablet
Abstrak
Tablet Kombinasi Kaptopril dan Hidroklorotiazid merupakan salah satu sediaan obat yang sering digunakan dalam pengobatan hipertensi. Tujuan penelitian ini adalah untuk mengetahui metode penentuan kadar dan untuk menetapkan kadar Kaptopril dan Hidroklorotiazid dalam sediaan tablet yang beredar di pasaran apakah memenuhi persyaratan mutu obat. Sehingga dengan kadar yang tepat obat dapat memberikan efek terapi yang dikehendaki.
Penetapan kadar Kaptopril dan Hidroklorotiazid dalam sediaan tablet dilakukan bersamaan secara analisis multikomponen (spektrofotometri ultraviolet) dengan menggunakan pelarut natrium hidroksida 0,1 N, Kaptopril diukur pada panjang gelombang 237 nm, Hidroklorotiazid diukur pada panjang gelombang 273 nm; Kaptopril secara Iodatometri dan Hdroklorotiazid secara Spektrofotometri Sinar Tampak. Uji validitas dilakukan berdasarkan parameter akurasi (dengan metode penambahan baku) dan presisi (keseksamaan).
Diperoleh kadar Kaptopril dan Hidroklorotiazid dalam sediaan tablet Capozid(Bristol Meyer Squibb) dengan metode analisis multikomponen (Spektrofotometri Ultraviolet) berturut-turut sebesar 96,51 % ± 2,1753 dan 103,21% ± 0,7150. Kaptopril secara Iodatometri sebesar 95,38% ± 0.0540 dan Hidroklorotiazid secara Spektrofotometri Sinar Tampak sebesar 98,03% ± 0,0945.
Hasil penelitian menunjukkan bahwa kadar Kaptopril dan Hidroklorotiazid dalam sediaan tablet Capozid memenuhi standar persyaratan tablet menurut The United States Pharmacopeia 30 yaitu tidak kurang dari 90% dan tidak lebih dari 110% dari jumlah yang tertera pada etiket.
Determination of Capozide in The Tablet Abstract
Combination of captopril and hydrochlorthiazide in the tablet is one of the drugs which is usually use for hypertension treatment. The aim of this study is to find out the determination method and to determination the value of captopril and hydrochlorthiazide in the tablets which circulates in the general whether it fulfilled requirement of drug quality or not, so that it will give the therapeutic effect.
The determination of captopril and hydrochlorthiazide in the tablet conducted by ultraviolet spectrophotometry using sodium hydroxide 0,1 N as a solvent at wavelength 237 nm for captopril and 273 nm for hydrochlorthiazide and Iodatometry-Visible Spectrophotometry and tested it validity based on parameter accuracy using standard addition method and precision.
It has been found that amount of captopril and hydrochlorthiazide in the Capozid (Bristol Meyer Squibb) tablet using ultraviolet spectrophotometry in a row 96.51 % ± 2.1753 and 103.21% ± 0.7150; using Captopril Iodatometry- Hydrochlorthiazide Visible Spectrophotometry in a row 95.38% ± 0.0540 and 98.03% ± 0.0945.
The result of research indicate that determining of captopril and hydrochlorthiazide in the Capozid tablet was fullfilled requirement of The United States Pharmacopeia 30, not less than 90.0% and not more than 110.0% of the labelled amount.
Keywords : captopril, hydrochlorthiazide, Capozid, detrmination, ultraviolet
BAB I PENDAHULUAN
1.1 Latar Belakang
Saat ini produksi obat – obatan di Indonesia mengalami perkembangan yang sangat pesat, diantaranya adalah golongan obat anti hipertensi. Dari sejumlah obat anti hipertensi yang beredar di Indonesia, salah satunya merupakan kombinasi antara kaptopril dan hidroklorotiazida. Kaptopril berfungsi sebagai Angiotensin Converting Enzyme (ACE) inhibitor dan Hidroklorotiazida berfungsi sebagai diuretik (Ganiswara, 1995).
Hipertensi merupakan penyakit kardiovaskular dengan gejala adanya gangguan pada mekanisme regulasi tekanan darah. Hipertensi bercirikan kenaikan tekanan darah yang mendadak dengan gejala encefalopati akut (sakit kepala hebat, gangguan kesadaran, serangan epilepsi) (Katzung, 1998).
Dalam bidang farmasi, pemeriksaan mutu obat mutlak diperlukan agar obat dapat sampai pada titik tangkapnya dengan kadar yang tepat, sehingga dapat memberikan efek terapi yang dikehendaki. Salah satu persyaratan mutu adalah kadar yang terkandung harus memenuhi persyaratan kadar seperti yang tercantum dalam Farmakope Indonesia atau buku resmi lainnya.
Farmakope Indonesia edisi III, ditentukan secara Titrasi Bebas Air sebagai Asam, sedangkan monografi untuk sediaan tablet penetapan kadar Hodroklorotiazid ditentukan dengan Spektrofotometri Sinar Tampak. Menurut USP 30, penetapan kadar tablet kombinasi Kaptopril dan Hidroklorotiazid ditentukan dengan Kromatografi Cair Kinerja Tinggi(KCKT), menggunakan fase gerak campuran air : metanol : asam fosfat (750 ml : 250 ml : 0,5 ml).
Dilihat dari struktur Kaptopril dan Hidroklorotiazid yang mempunyai gugus kromofor, maka senyawa ini dapat menyerap radiasi pada daerah Ultra Violet. Menurut Moffat, (2004) Kaptopril memiliki serapan maksimum dalam larutan basa pada 238 nm (A = 235c). Hidroklorotiazid memiliki serapan maksimum dalam larutan basa pada 274 nm (A = 520a). Menurut Gandjar, I. G., dan Rohman, A. (2007), bila diinginkan pengukuran 2 buah senyawa secara bersama-sama secara spektrofotometri, maka dapat dilakukan pada 2 panjang gelombang yang mana masing-masing komponen saling mengganggu. Pengukuran dilakukan pada masing-masing larutan pada 2 panjang gelombang.
multikomponen (Spektrofotometri Ultraviolet); Kaptopril secara Iodatometri dan Hidroklorotiazid secara Spektrofotometri Sinar Tampak.
Metode spektrofotometri memiliki keuntungan antara lain dapat digunakan untuk analisis suatu zat dalam jumlah kecil, pengerjaannya cepat, sederhana, cukup sensitif dan selektif serta mudah dalam interpretasi hasil yang diperoleh. Berdasarkan hal tersebut, peneliti tertarik untuk memeriksa kadar kaptopril dan Hidrokorotiazid pada sediaan tablet secara multikomponen dengan Spektrofotometri Ultraviolet dan Kaptopril secara Iodatometri-Hidroklorotiazid secara Spektrofotometri Sinar Tampak. Adapun uji validasi yang digunakan yaitu uji akurasi dengan parameter % perolehan kembali dan uji presisi dengan parameter SD (Standar Deviasi) dan RSD (Relative Standar Deviasi)
1.2. Perumusan Masalah
1. Apakah Kaptopril dan Hidroklortiazid dalam sediaan tablet dapat ditentukan kadarnya dengan metode Spektrofotometri Ultraviolet (analisis multikomponen), Kaptopril secara Iodatometri dan Hidroklorotiazid secara Spektrofotometri Sinar Tampak?
1.3. Hipotesa
1. Diduga bahwa Kaptopril dan Hidroklortiazid dalam sediaan tablet dapat ditentukan kadarnya dengan metode Spektrofotometri Ultraviolet (analisis multikomponen), Kaptopril secara Iodatometri dan Hidroklorotiazid secara Spektrofotometri Sinar Tampak
2. Kadar kombinasi Kaptopril dan Hidroklortiazid dalam sediaan tablet yang beredar di pasaran memenuhi persyaratan menurut The United States Pharmacopeia 30 tidak kurang dari 90% dan tidak lebih dari 110%
1.4. Tujuan Penelitian
1. Untuk mengetahui metode penentuan kadar Kaptopril dan Hidroklortiazid dalam sediaan tablet secara spektrofotometri ultraviolet (analisis multikomponen), Kaptopril secara Iodatometri dan Hidroklorotiazid secara Spektrofotometri Sinar Tampak
BAB II
TINJAUAN PUSTAKA 2.1 Kaptopril
2.1.1 Sifat Fisikokima
Rumus struktur :
Rumus molekul : C9H15NO3S Sinonim : - Acepril
- Capoten - Lopirin
-1[(2S)-3-merkapto-2-metilpropionil]-L-prolina Berat Molekul : 217,28
Pemerian : Serbuk hablur putih atau hampir putih, bau khas seperti sulfida. Melebur pada suhu 1040 sampai 1100.
Kelarutan : Mudah larut dalam air, dalam metanol, dalam etanol, dan dalam kloroform
2.1.2 Kegunaan
Tujuan Penggunaan adalah sebagai terapi pada hipertensi esensial dan hipertensi renovaskuler (Tjay dan Kirana, 2002).
2.1.3 Efek Samping
Efek sampingnya yang sering terjadi adalah hilangnya rasa (kadang-kadang juga penciuman), batuk kering, dan exanthema (Tjay dan Kirana, 2002). 2.1.4 Dosis
Untuk hipertensi: 1-2 kali sehari 25 mg, bila perlu setelah 2-3 minggu 1-2 kali sehari 50 mg. Gagal jantung: 3 kali sehari 12,5-25 mg (Tjay dan Kirana, 2002).
2.1.5 Farmakologi
Kaptopril mengandung gugus -SH yang dapat berinteraksi membentuk kelat dengan ion Zn dalam tempat aktif ACE (Angiotensin Converting Enzyme), terjadi hambatan secara kompetitif ACE sehingga peredaran angiotensin II dan kadar aldosteron menurun. Akibatnya, tidak terjadi vasokonstriksi dan retensi Natrium, sehingga tekanan darah menurun
Mekanisme yang lain dari senyawa penghambat ACE adalah menghambat pemecahan bradikinin menjadi fragmen tidak aktif, sehingga kadar bradikinin dalam darah meningkat, menyebabkan vasodilatasi dan penurunan tekanan darah. Penghambat ACE memiliki peran khusus yang penting dalam pengobatan pasien dengan nefropati diabetes karena dapat mengurangi proteinuria dan menstabilkan fungsi ginjal (bahkan walaupun tidak terjadi penurunan tekanan darah).
System). Bila volume darah yang mengalir melalui ginjal berkurang dan tekanan darah di glomeruli ginjal menurun, misalnya karena penyempitan arteri setempat, maka ginjal dapat membentuk dan melepaskan enzim proteolitis renin. Dalam plasma, renin menghidrolisis protein angiotensinogen (yang terbentuk di dalam hati) menjadi angiotensin I (AT I). Zat ini diubah oleh enzim ACE menjadi zat aktif angiotensin II. AT II ini kuat, dan menstimulasi sekresi hormon aldosteron oleh anak-ginjal dengan sifat retensi garam dan air. Akibatnya ialah volume darah dan tekanan darah naik.
Faktor-faktor yang dapat meningkatkan tekanan darah antara lain: mengkonsumsi terlalu banyak garam, stress, merokok, kehamilan. Tindakan-tindakan umum untuk menurunkan tekanan darah; mengurangi berat badan, mengurangi garam dalam pola makan, berhenti merokok, membatasi minum kopi dan alkohol, cukup istirahat dan tidur.
Pengobatan dengan antihipertensi dimulai dengan dosis rendah agar tekanan darah jangan menurun terlalu drastis dengan mendadak. Kemudian, setiap 1-2 minggu dosis berangsur-angsur dinaikkan sampai tercapai efek yang diinginkan. Begitu pula penghentian terapi harus secara berangsur pula (Tjay dan Kirana, 2002).
2.2 Hidroklorotiazid 2.2.1 Sifat Fisikokimia
Rumus molekul : C4H8ClN3O4S2 Sinonim : - Chlorosultiadil
- 3,4-dihidro-6-klorobenzo-1-tiol-2,4-diazina-7-sulfonamida-1,1-dioksida
Berat Molekul : 297,74
Pemerian : serbuk hablur, putih atau praktis putih; praktis tidak berbau.
Kelarutan : praktis tidak larut dalam air, dalam kloroform P, dalam asam encer dan dalam eter P; larut dalam 200 bagian etanol(95%)P dan dalam 20 bagian aseton; mudah larut dalam larutan alkali hidroksida, dalam n-butilamina, dan dalam dimetilfornamida; agak sukar larut dalam metanol (Ditjen POM, 1975;USP 30, 2007; Moffat, 2004) 2.2.2 Kegunaan
Tujuan Penggunaan adalah sebagai terapi pada edema, hipertensi. 2.2.3 Efek Samping
Efek sampingnya yang sering terjadi adalah dapat menyebabkan hipokalemia; memperburuk diabetes dan pirai; mungkin memperburuk SLE (eritema lupus sistemik); usia lanjut; kehamilan dan menyusui; gangguan hati dan ginjal (hindarkan bila berat); porifiria.
2.2.4 Dosis
berat, awalnya 75 mg sehari. Hipertensi dosis awal 12,5 mg sehari jika perlu tingkatkan sampai 25 mg sehari. Usia lanjut dosis awal 12,5 mg sehari mungkin cukup. (Dollery, 1999).
2.2.5 Farmakologi
Senyawa sulfamoyl ini diturunkan dari klorthiazida yang dikembangkan dari sulfanilamida. Bekerja dibagian muka tubulu distal, efek diuretisnya lebih ringan dari diuretika lengkungan tetapi bertahan lebih lama, 6-12 jam. Daya hipotensifnya lebih kuat (pada jangka panjang), maka banyak digunakan sebgai pilihan pertama untuk hipertensi ringan sampai sedang. Sering kali pada kasus yang lebih berat dikombinasikan dengan obat-obat lain untuk memperkuat efeknya, khususnya beta-blockers. Efek optimal ditetapkan pada dosis 12,5 mg, dan dosis di atasnya tidak akan memperoleh penurunan tensi lagi(kurva dosis efek datar). Zat induknya klorthiazida berkhasiat 10 kali lebih lemah, maka kini tidak digunakan lagi (Tjay dan Kirana, 2002).
2.3 Teori Spektrofotometri
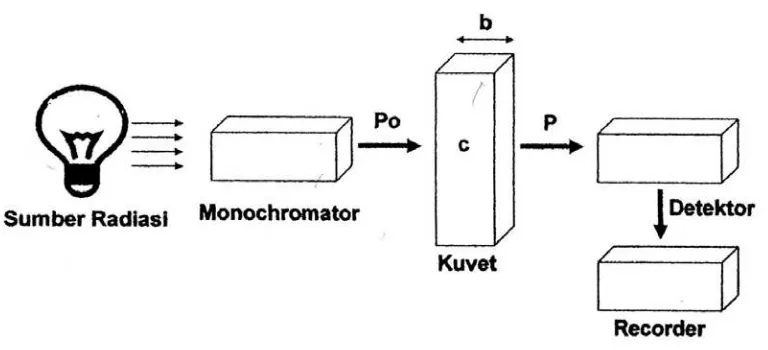
Unsur-unsur terpenting suatu spektrofotometer ditunjukkan dalam gambar berikut (Khopkar, 1990; Day, 2002):
Gambar 1. Diagram Blok Spektrofotometer UV-VIS a. Sumber cahaya
Sumber energi radiasi yang biasa untuk daerah ultraviolet dan daerah cahaya tampak adalah sebuah lampu wolfram ataupun lampu tabung discas hidrogen (atau deutrium).
b. Monokromator
Monokromator berfungsi mengubah cahaya polikromatis menjadi cahaya yang monokromatis. Alatnya dapat berupa berupa prisma atau kisi difraksi.
c. Sel
Peranan detektor adalah memberikan respon terhadap cahaya pada berbagai panjang gelombang. Detektor yang paling sederhana digunakan ialah tabung foto.
e. Recorder
Recorder digunakan sebagai perekam absorbansi yang dihasilkan dari pengukuran.
Radiasi ultraviolet dan sinar tampak diabsorpsi oleh molekul organik aromatik, molekul yang mengandung elektron-π terkonyugasi dan atau atom yang mengandung elektron-n, menyebabkan transisi elektron di orbital terluarnya dari tingkat energi elektron dasar ke tingkat energi elektron tereksitasi lebih tinggi. Besarnya serapan radiasi tersebut sebanding dengan banyaknya molekul analit yang mengabsorpsi sehingga dapat digunakan untuk analisis kuantitatif (Satiadarma, 2004).
mengalami perubahan. Hal ini terjadi karena adanya geseran pada λmax, contohnya, ketika suatu senyawa mengalami ionisasi (Cairns,D., 2008).
Geseran λmax menuju panjang gelombang yang lebih panjang dikenal sebagai geseran batokromik atau geseran merah. Geseran ini biasanya terjadi karena kerja ausokrom. Ausokrom adalah gugus fungsi yang menempel pada kromofor yang tidak menyerap energi cahayanya sendiri, tetapi memengaruhi panjang gelombang cahaya yang diserap kromofor. Contoh auksokrom di antaranya adalah gugus-NH2, -OH, -SH. Gugus-gugus fungsi ini mempunyai pasangan electron sunyi yang dapat berinteraksi dengan electron π pada kromofor
dan memungkinkan terjadinya penyerapan cahaya yang memiliki panjang gelombang yang lebih panjang (Cairns,D., 2008).
Geseran λmax menuju panjang gelombang yang lebih pendek disebut dengan efek hipsokromik atau geseran biru, dan biasanya terjadi jika senyawa dengan ausokrom basa terion, dan pasngan electron sunyi tidak lagi dapat berinteraksi dengan electron-elektron kromofor. Efek batokromik dan hipsokromik jarang terlihat dalanm isolasi. Efek batokromik biasanya terkait dengan adanya peningkatan intensitas cahaya yang diserap disebut efek
hiperkromik, sedangkan efek hipsokromik biasanya terjadi dengan adanya
penurunan intensitas serapan disebut efek hipokromik (Cairns,D., 2008)
Bila diinginkan pengukuran dua buah senyawa secara bersama-sama secara spektrofotometri, maka dapat dilakukan pada 2 panjang gelombang yang mana masing-masing komponen saling mengganggu. Dua buah kromofor yang berbeda akan mampunyai kekuatan absorpsi cahaya yang baebeda pula pada satu daerah panjang gelombang. Pengukuran dilakukan pada masing-masing larutan pada 2 panjang gelombang, sehingga diperoleh dua persamaan hubungan antara absorbansi dengan konsentrasi pada dua panjang gelombang, akibatnya konsentrasi masing-masing komponen dapat dihitung (Rohman, 2007)
Menurut hukum Lambert, serapan (A) berbanding lurus dengan ketebalan lapisan (b) yang disinari :
A = k.b
Keterangan A = serapan
b = ketebalan lapisan.
Dengan bertambahnya ketebalan lapisan, serapan akan bertambah. Menurut Hukum Beer, yang hanya berlaku untuk cahaya monokromatis dan larutan yang sangat encer, serapan (A) dan konsentrasi (c) adalah :
A = k.c
Keterangan A = serapan c = konsentrasi
Umumnya digunakan dua satuan c (konsentrasi zat yang menyerap) yang berlainan, yaitu gram per liter atau mol per liter. Nilai tetapan (k) dalam hukum Lambert-Beer tergantung pada sistem konsentrasi mana yang digunakan. Bila c dalam gram perliter, tetapan disebut dengan absorptivitas (a) dan bila dalam mol per liter tetapan tersebut adalah absortivitas molar (Є). Jadi dalam sistem dikombinasikan, hukum Lambert-Beer dapat mempunyai dua bentuk:
A = a.b.c g/liter atau A = Є . b. C mol/liter
Penandaan lain untuk a adalah ekstingsi spesifik, koefisien ekstingsi, dan indeks absorbansi, sedangkan Є adalah koefisien ekstingsi molar (Day and Underwood, 1999; Rohman, 2007).
Pada spektrofotometri sinar tampak, pengamatan mata terhadap warna timbul dari penyerapan selektif panjang gelombang tertentu dari sinar masuk oleh objek yang berwarna (Vogel, 1994).
Ada beberapa hal yang harus diperhatikan dalam analisis dengan spektrofotometri ultraviolet dan cahaya tampak terutama untuk senyawa yang tidak berwarna yang akan dianalisis yaitu :
1. Pembentukan molekul yang dapat menyerap sinar UV-Vis
Cara yang digunakan adalah dengan merubahnya menjadi senyawa lain atau direaksikan dengan pereaksi tertentu sehingga dapat menyerap sinar UV-Vis. 2. Waktu kerja (operating time)
3. Pemilihan panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal.
4. Pembuatan kurva baku
Dilakukan dengan membuat seri larutan baku dalam berbagai konsentrasi kemudian absorbansi tiap konsentrasi diukur lalu dibuat kurva yang merupakan hubungan antara absorbansi dengan konsentrasi.
5. Pembacaan absorbansi sampel
Absorbansi yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai 0,6.
2.4 Titrasi dengan Kalium Iodat
Metode titrimetri masih digunakan secara luas karena merupakan metode yang murah dan mampu memberikan ketepatan (presisi) yang tinggi. Titrasi redoks merupakan salah satu dari metode-metode titrimetri yang digunakan dalam bidang farmasi. Beberapa cara titrasi redoks, salah satunya adalah dengan menggunakan Kalium Iodat (Rohman, 2007).
Dilihat dari struktur kaptopril yang memiliki gugus merkaptan, maka penetapan kadar senyawa obat ini dapat dilakukan secara Iodatometri. Dimana gugus merkaptannya dioksidasi oleh iodium, yang diperoleh dari kalium iodat dan kalium iodida. Titik akhir titrasi ditandai dengan terbentuknya warna biru yang dihasilkan komplek iodium dengan amilum (Siggia, 1963).
memenuhi persyaratan untuk penggunaannya (WHO, 1992). Validasi dilakukan untuk menjamin bahwa metode analisis yang dilakukan akurat, spesifik, reprodusibel dan tahan pada kisaran analit yang akan dianalisis (Rohman, 2007). 2.4.1 Kecermatan/Ketepatan (accuracy)
Kecermatan merupakan ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit sebenarnya. Kecermatan dapat ditentukan dengan dua cara yaitu metode simulasi (spiked-placebo recovery) dan metode penambahan baku (standard addition method). Dalam metode simulasi, sejumlah analit bahan murni pembanding kimia ditambahkan ke dalam campuran bahan pembawa sediaan farmasi (plasebo) lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan. Metode adisi dapat dilakukan dengan menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa lalu dianalisis lagi dengan metode tersebut (WHO, 1992).
% Perolehan kembali = A
C∗A = konsentrasi larutan baku yang ditambahkan 2.4.2 Keseksamaan/Ketelitian (precision)
BAB III
METODOLOGI PENELITIAN
Metode penelitian yang dilakukan adalah metode eksperimental. Penelitian ini dilaksanakan di Laboratorium Kimia Farmasi Kuantitatif Fakultas Farmasi Universitas Sumatera Utara
3.1 Alat–alat
Alat–alat yang digunakan dalam penelitian ini adalah spektrofotometer ultra violet-Visible (UV mini 1240 Shimadzu), oven, neraca listrik (Vibra AJ), dan alat-alat gelas yang lazim digunakan di laboratorium analisis.
3.2 Bahan–bahan
Bahan- bahan yang digunakan dalam penelitian ini jika tidak dinyatakan lain adalah yang berkualitas pro analisa dari E.Merck, yaitu : natrium hidroksida, natrium nitroprusid, iodin, asam sulfat, kalium iodida, kalium iodat, merkuri iodida; asam klorida, natrium nitrit, ammonium sulfamat, N-1-naftiletilendyamin, aseton, akuades (Laboratorium Kimia Farmasi Kuantitatif); kaptopril dan Hidroklorotiazid BPFI (Badan POM RI); tablet Capozide (PT. Bristol-Myers Squibb K.).
3.3 Pengambilan Sampel
3.4 Prosedur Penelitian 3.4.1 Pembuatan pereaksi
3.4.1.1 Pembuatan Larutan NaOH 0.1 N (Ditjen POM, 1979 )
Dilarutkan sebanyak 4 g NaOH dalam akuades bebas CO2 kemudian dicukupkan sampai 1000 ml.
3.4.1.2 Pembuatan Larutan Natriun Nitrit 0,5%b/v
Dilarutkan sebanyak 500 mg NaNO2 dalam akuades kemudian dicukupkan sampai 100 ml.
3.4.1.3 Pembuatan Larutan Amonium Sulfamat 1%b/v
Dilarutkan sebanyak 1 g amonium sulfamat kristal dalam akuades kemudian dicukupkan sampai 100 ml.
3.4.1.4 Pembuatan Larutan N-1-naftiletilendiamin 0,2 %b/v
Dilarutkan sebanyak 200 mg N-1-naftiletilendiamin dalam HCl 1 N kemudian dicukupkan sampai 100 ml.
3.4.1.5 Pembuatan Larutan Asam Klorida 1 N
Dimasukkan kira – kira 25 ml akuades ke dalam wadah, lalu ditambahkan 8,3 ml HCl pekat melalui dinding wadah biarkan dingin, kemudian dicukupkan sampai 100 ml.
3.4.1.6 Pembuatan Larutan Kalium Iodat 0,1 N ( Ditjen POM, 1995 )
3.4.1.7 Pembuatan larutan Asam Sulfat 3,6 N
Dimasukkan kira – kira 25 ml akuades ke dalam wadah, lalu ditambahkan 10 ml H2SO4 pekat melalui dinding wadah biarkan dingin, kemudian dicukupkan sampai 100 ml.
3.4.1.8 Pembuatan Kanji LP ( Ditjen POM, 1995 )
Dicampur 1 g kanji dengan 10 mg Raksa (II) iodida merah (P) dan air dingin secukupnya hingga menjadi pasta tipis. Ditambahkan 200 ml air mendidih, dan dididihkan selama 1 menit sambil terus diaduk, dinginkan dan gunakan hanya bagian larutan yang jernih.
3.4.1.9 Pembuatan Larutan Natrium Hidroksida P(Ditjen POM, 1979 )
Dilarutkan sebanyak 20 g NaOH dalam akuades bebas CO2 kemudian dicukupkan sampai 100 ml.
3.5 Penetapan Kadar Sampel secara Spektrofotometri Ultraviolet 3.5.1 Pembuatan Larutan Induk Baku BPFI
3.5.1.1 Pembuatan larutan induk baku Kaptopril BPFI
Ditimbang seksama lebih kurang 50 mg Baku Pembanding Kaptopril, dimasukkan kedalam labu tentukur 100 ml, dilarutkan dengan NaOH 0,1 N lalu dicukupkan sampai garis tanda dengan NaOH 0,1 N dan dikocok homogen, sehingga diperoleh larutan dengan konsentrasi 500 mcg/ml, larutan induk baku. 3.5.1.2 Pembuatan larutan induk baku Hidroklorotiazid BPFI
3.5.2 Penentuan Panjang Gelombang Maksimum
3.5.2.1 Penentuan panjang gelombang maksimum Kaptopril
Dipipet sebanyak 1,8 ml larutan induk baku Kaptopril, dimasukkan ke dalam labu tentukur 50 ml dan diencerkan dengan NaOH 0,1 N sampai garis tanda, dikocok sampai homogen hingga diperoleh larutan dengan konsentrasi 18 mcg/ml. diukur serapannya pada panjang gelombang 200-400 nm (hasil dapat dilihat pada gambar 1 tabel 1 halaman 27, 28).
3.7.2.2 Penentuan panjang gelombang maksimum Hidroklorotiazid
Dipipet sebanyak 0,8 ml larutan induk baku Hidroklorotiazid, dimasukkan ke dalam labu tentukur 50 ml dan diencerkan dengan NaOH 0,1 N sampai garis tanda, dikocok sampai homogen hingga diperoleh larutan dengan konsentrasi 8 mcg/ml. diukur serapannya pada panjang gelombang 200-400 nm (hasil dapat dilihat pada gambar 2 tabel 2 halaman 28, 29).
3.5.3 Penentuan Absorptivitas
3.5.3.1 Penentuan Absorptivitas Kaptopril
Dipipet sebanyak 2 ml larutan induk baku Kaptopril, dimasukkan ke dalam labu tentukur 50 ml dan diencerkan dengan NaOH 0,1 N sampai garis tanda, dikocok sampai homogen hingga diperoleh larutan dengan konsentrasi 20 mcg/ml. diukur serapannya pada panjang gelombang maksimum Kaptopril dan pada panjang gelombang maksimum Hidroklorotiazid (hasil dapat dilihat pada tabel 3 halaman 31)..
3.5.3.2 Penentuan Absoptivitas Hidroklorotiazid
tanda, dikocok sampai homogen hingga diperoleh larutan dengan konsentrasi 10 mcg/ml. diukur serapannya pada panjang gelombang maksimum Kaptopril dan pada panjang gelombang maksimum Hidroklorotiazid (hasil dapat dilihat pada tabel 4 halaman 31)..
3.5.3.3 Penetapan Kadar Sampel
Sejumlah 20 tablet ditimbang seksama dan diserbukkan homogen. Sejumlah serbuk setara dengan lebih kurang 10 mg Kaptopril dan 5 mg Hidroklorotiazid ditimbang seksama, dilakukan sebanyak 6 kali. Masing-masing dimasukkan ke dalam labu tentukur 100 ml dilarutkan dengan NaOH 0,1 N dicukupkan dengan NaOH 0,1 N sampai garis tanda dan disaring, 10 ml filtrat pertama dibuang, filtrat selanjutnya ditampung. Filtrat ini dipipet 10 ml kemudian masukkan ke dalam labu tentukur 50 ml (Kaptopril 20 mcg/ml dan
Hidroklorotiazid 10 mcg/ml), dicukupkan dengan NaOH 0,1 N sampai garis
tanda, dikocok homogen, diukur serapannya pada panjang gelombang maksimum Kaptopril dan pada panjang gelombang maksimum Hidroklorotiazid yang diperoleh.
3.6 Penetapan Kadar Kaptopril Secara Iodatometri-Hidroklorotiazid secara Spektrofotometri Sinar Tampak
(Vt – Vb) x N KIO3 x BE Kaptopril x 100% Bs
Keterangan: Vb = Volume blanko
Vt = Volume titrasi larutan KIO3 N KIO3 = Normalitas KIO3
BE = Berat ekivalen Kaptopril (217,28) Bs = Berat sampel (mg)
(Hasil dapat dilihat pada tabel 5 halaman 31)
3.6.2. Hidroklorotiazid secara Spektrofotometri Sinar Tampak( Ditjen POM, 1979)
3.6.2.1. Pembuatan Larutan Induk Baku Hidroklorotiazid BPFI
Serbuk ditimbang setara 48 mg Hidroklorotiazid BPFI, dikocok dengan aseton P 70 ml, diencerkan dengan aseton P secukupnya hingga 100 ml(480
mcg/ml) Larutan induk baku I, dipipet 25 ml dimasukkan dalam labu tentukur 50
ml dicukupkan volumenya dengan aseton P sampai garis tanda (240 mcg/ml). Larutan induk baku II.
3.6.2.2 Penentuan Panjang Gelombang Maksimum
Dipipet sebanyak 5 ml larutan induk baku II dimasukkan kedalam erlenmeyer, biarkan aseton P menguap, direfluks dengan 10 ml NaOH P selama 1 jam, dinginkan, masukkan kedalam labu tentukur 50 ml, tambahkan 10 ml akuades, ditambah 20 ml HCl P, diencerkan dengan akuades hingga garis tanda. Dipipet 6,25 ml dimasukkan dalam labu tentukur 25 ml tambahkan 1 ml NaNO2 0,5% campur dan biarkan selama 3 menit, tambahkan 1,5 ml Amonium Sulfamat 1%, kocok dan birkan selama 3 menit, tambahkan 2,5 ml N-1-naftiletilendiamin
0.2% diencerkan dengan akuades sampai garis tanda, diukur serapannya pada panjang gelombang 400-800 nm (hasil dapat dilihat pada tabel 6 halaman 33). 3.6.2.3 Penentuan Waktu Kerja Hidroklorotiazid
Dipipet sebanyak 5 ml larutan induk baku II dimasukkan kedalam erlenmeyer, biarkan aseton P menguap, direfluks dengan 10 ml NaOH P selama 1 jam, dinginkan, masukkan kedalam labu tentukur 50 ml, tambahkan 10 ml akuades, ditambah 20 ml HCl P, diencerkan dengan akuades hingga garis tanda.Dipipet 6,25 ml dimasukkan dalam labu tentukur 25 ml tambahkan 1 ml NaNO2 0,5% campur dan biarkan selama 3 menit, tambahkan 1,5 ml Amonium Sulfamat 1%, kocok dan birkan selama 3 menit, tambahkan 2,5 ml N-1-naftiletilendiamin 0.2% diencerkan dengan akuades sampai garis tanda, diukur serapannya pada panjang gelombang yang diperoleh dengan selang waktu 1 menit(hasil dapat dilihat pada lampiran 18 halaman 66).
3.8.2.4 Pembuatan Kurva Kalibrasi
Kemudian diukur serapannya pada panjang gelombang maksimum yang diperoleh (hasil dapat dilihat pada tabel 7 halaman 34).
3.6.2.5 Penetapan Kadar Sampel
Sejumlah 20 tablet ditimbang seksama dan diserbukkan homogen. Sejumlah serbuk setara dengan lebih kurang 12 mg Hidroklorotiazid ditimbang seksama, dilakukan sebanyak 6 kali. Masing-masing dimasukkan ke dalam labu tentukut 50 ml dikocok dengan aseton 30 ml, diencerkan dengan aseton P secukupnya hingga 50 ml(240 mcg/ml). Masing-masing dipipet sebanyak 5 ml dimasukkan kedalam erlenmeyer, biarkan aseton P menguap, direfluks dengan 10 ml NaOH P selama 1 jam, dinginkan, masukkan kedalam labu tentukur 50 ml, tambahkan 10 ml akuades, ditambah 20 ml HCl P, diencerkan dengan akuades hingga garis tanda. Dipipet 6,25 ml dimasukkan dalam labu tentukur 25 ml tambahkan 1 ml NaNO2 0,5% campur dan biarkan selama 3 menit, tambahkan 1,5 ml Amonium Sulfamat 1%, kocok dan birkan selama 3 menit, tambahkan 2,5 ml N-1-naftiletilendiamin 0.2% diencerkan dengan akuades sampai garis tanda, diukur serapannya pada panjang gelombang yang diperoleh.
3.7 Uji Validasi dengan Parameter Akurasi dan Presisi
3.7.1 Uji Akurasi dengan Persen Perolehan Kembali (%Recovery)
Uji akurasi dilakukan dengan metode penambahan baku (Standard
Addition Method) yaitu dengan membuat 3 konsentrasi analit dengan rentang
penetapan kadar sampel (hasil dapat dilihat pada Tabel 10, 11, 12, halaman 37, 38,39).
Persen perolehan kembali (% recovery) dapat dihitung dengan rumus sebagai berikut :
%Recovery = C
B
A−
x 100%
Keterangan :
A = konsentrasi sampel yang diperoleh setelah penambahan analit B = konsentrasi sampel sebelum penambahan analit
C = konsentrasi analit yang ditambahkan 3.7.2 Uji Presisi
Uji presisi (keseksamaan) ditentukan dengan parameter RSD (Relative
Standard Deviasi) dengan rumus :
RSD = x100%
X SD
Keterangan :
RSD = Relative Standard Deviasi SD = Standard Deviasi
X = Kadar Rata-rata Nifedipin dalam Sampel
(WHO, 1992; Indrayanto dan Yuwono, 2003). 3.8 Analisis Data secara Statistik
Untuk mengetahui apakah data diterima atau ditolak digunakan rumus seperti dibawah ini :
t =
n SD
X X− =
Dasar penolakan data jika thitung ≥ ttabel dan bila thitung mempunyai nilai negatif, data ditolak jika thitung ≤ - ttabel.
Untuk mencari kadar sebenarnya dengan taraf kepercayaan 99 persen, dengan derajat kebebasan dk = n – 1, digunakan rumus:
µ = X ± t (1-1/2 α)dk x SD / n Keterangan:
µ = interval kepercayaan
X = kadar rata – rata sampel
X = kadar sampel
t = harga t tabel sesuai dengan dk = n-1 α = tingkat kepercayaan
BAB IV
HASIL DAN PEMBAHASAN
4.1 Penetapan Kadar Sampel secara Spektrofotometri Ultraviolet 4.1.1 Penentuan Panjang Gelombang
4.1.1.1 Penentuan Panjang Gelombang Maksimum Kaptopril BPFI
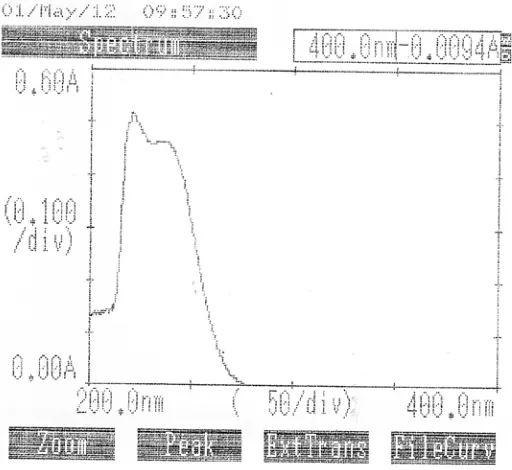
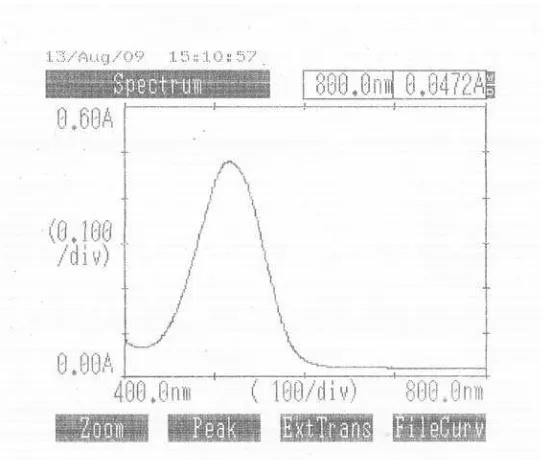
Pada penelitian ini digunakan Baku Pembanding Kaptopril dari Badan Pengawasan Obat dan Makanan Republik Indonesia (BPOM RI ). Kurva serapan Kaptopril BPFI dengan konsentrasi 18 mcg/ml dalam pelarut NaOH 0,1 N dapat dilihat pada gambar 1 dibawah ini.
Tabel 1. Data Panjang Gelombang Serapan Maksimum Kaptopril BPFI
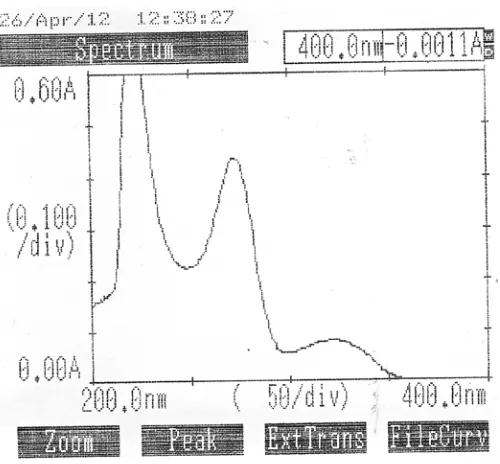
4.1.1.2 Penentuan Panjang Gelombang Maksimum Hidroklorotiazid BPFI Pada penelitian ini digunakan Baku Pembanding Hidroklorotiazid dari Badan Pengawasan Obat dan Makanan Republik Indonesia (BPOM RI ). Kurva serapan Hidroklorotiazid BPFI dengan konsentrasi 8 mcg/ml dalam pelarut NaOH 0.1 N dapat dilihat pada gambar 2 dibawah ini.
Tabel 2. Data Panjang Gelombang Serapan Maksimum Hidroklorotiazid BPFI
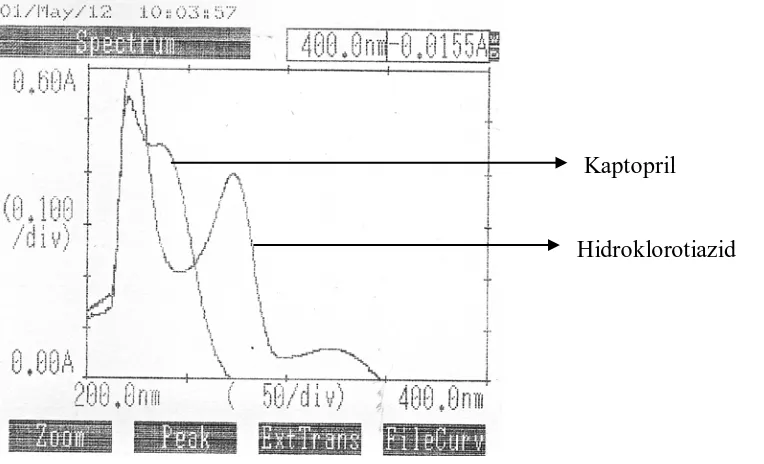
Kurva overlay diambil dari panjang gelombang 200-400 nm pada konsentrasi Kaptopril 20 mcg/ml dan Hidroklorotiazid 10 mcg/ml, maka diperoleh kurva seperti yang terlihat pada gambar 3 di bawah ini.
Gambar 3. Kurva serapan overlay Kaptopril dan Hidroklorotiazid Baku Pembanding Farmakope Indonesia dalam pelarut NaOH 0,1 N. Dari gambar 3 terlihat bahwa terjadi saling tumpang tindih antara spektrum Kaptopril dan Hidroklorotiazid.
4.1.2 Penentuan Absorptivitas
4.1.2.1 Penentuan Absorptivitas Kaptopril
Pada penelitian ini digunakan Baku Pembanding Kaptopril BPFI yang diukur pada panjang gelombang Kaptopril (237 nm) dan Hidroklorotiazid (273 nm). Hasil dapat dilihat pada tabel 3.
Kaptopril
Tabel 3. Data Absorptivitas Kaptopril BPFI
(data serapannya dapat dilihat pada lampiran 17 halaman 65) 4.1.2.2 Penentuan Absorptivitas Hidroklotiazid
Pada penelitian ini digunakan Baku Pembanding Hidroklorotiazid BPFI yang diukur pada panjang gelombang Kaptopril(237nm) dan Hidroklorotiazid(273 nm). Hasil dapat dilihat pada tabel 6.
Tabel 4. Data Absorptivitas Hidroklorotiazid BPFI
N0 Sampel Panjang
Gelombang
Absorbansi(A) Absorptivitas(a)
1. Hidroklorotiazid 237 0,3010 0,03010
2. 273 0,4791 0.04791
(data serapannya dapat dilihat pada lampiran 17 halaman 65)
4.2 Penetapan Kadar Kaptopril Secara Iodatometri dan Hidroklorotiazid secara Spektrofotometri Sinar Tampak
4.2.1 Kaptopril dengan Titrasi Kalium Iodat 0,1 N ( Ditjen POM, 1995 ) Dilakukan penetapan kadar kaptopril dalam tablet Capozid secara titrasi Iodatometri, menggunakan pentiter Kalium Iodat 0,1 N. Hasil dapat dilihat pada tabel 5 yaitu:
Dari hasil penelitian ini diperoleh kadar kaptopril yang dihitung secara statistik adalah 95,38% dengan kadar sebenarnya 95,38 ± 0,1205. (perhitungan kadar dapat dilihat pada lampiran 5 halaman 50).
4.2.2. Hidroklorotiazid secara Spektrofotometri Sinar Tampak 4.2.2.1. Penentuan Panjang Gelombang Maksimum
Hidroklorotiazid adalah senyawa yang tidak berwarna maka untuk memperoleh senyawa yang berwarna dilakukan pengkoplingan (Diazotasi) dengan Naftiletilendiamin (NED), dimana sebelum proses pengkoplingan dilakukan, terlebih dahulu struktur Hidroklorotiazid dirubah membentuk amin aromatis primer dengan merefluks menggunakan NaOH P selama 1 jam. Hasil penentuan panjang gelombang maksimum Hidroklorotiazid dengan konsentrasi 6 mcg/ml, diperoleh panjang gelombang maksimum pada 518 nm. Kurva serapan Hidroklorotiazid dapat dilihat pada Gambar 4 dibawah ini.
Tabel 6. Data Panjang Gelombang Serapan Maksimum Hidroklorotiazid BPFI
4.2.2.2 Penentuan Kurva Waktu Kerja Hidroklorotiazid
Penentuan waktu kerja (kestabilan warna) Hidroklorotiazid baku dengan reaksi pengkoplingan menggunakan N-1-naftiletilendiamin secara spektrofotometri sinar tampak dilakukan dengan selang waktu 1 menit. Dari data yang diperoleh, waktu pengukuran yang stabil dimulai dari menit ke-2 sampai menit ke-6. (Data Pengamatan pada Lampiran 19 halaman 62)
Dari data waktu kerja, tidak diperoleh data yang mempunyai kesamaan angka 4 desimal. Sehingga dalam hal ini yang diambil sebagai waktu kerja adalah data yang mempunyai kesamaan angka 3 desimal.
4.2.2.3 Penentuan Linearitas Kurva Kalibrasi
Gambar 5. Kurva Kalibrasi Hidroklorotiazid dengan Berbagai Konsentrasi secara Spektrofotometri Sinar Tampak pada Panjang Gelombang 518 nm
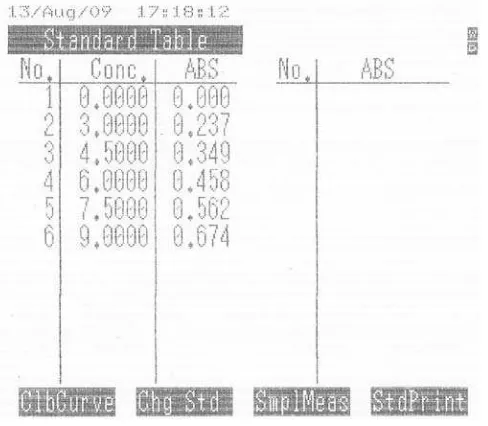
Tabel 7. Data Kurva Kalibrasi Hidroklorotiazid BPFI
menunjukkan bahwa nilai determinasinya terdapat 99,96 % data yang memiliki hubungan linear (Sudjana, 2002)
4.3 Penentuan Kadar Kaptopril dan Hidroklorotiazid dalam sediaan tablet Capozid
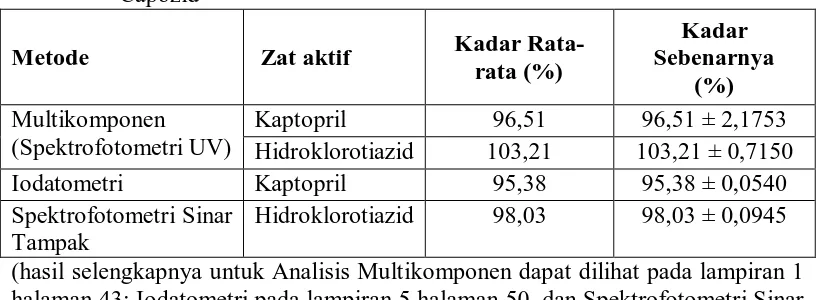
Hasil penentuan kadar Kaptopril dan Hidroklorotiazid dalam sediaan tablet Capozid dapat dilihat pada tabel 8 dibawah ini.
Tabel 8. Kadar rata-rata Kaptopril dan Hidroklorotiazid dalam sediaan tablet Capozid Hidroklorotiazid 103,21 103,21 ± 0,7150
Iodatometri Kaptopril 95,38 95,38 ± 0,0540
Spektrofotometri Sinar Tampak
Hidroklorotiazid 98,03 98,03 ± 0,0945 (hasil selengkapnya untuk Analisis Multikomponen dapat dilihat pada lampiran 1 halaman 43; Iodatometri pada lampiran 5 halaman 50, dan Spektrofotometri Sinar Tampak pada lampiran 9 halaman 55,).
Dari data diatas menunjukkan bahwa Kaptopril dan Hidroklorotiazid dapat ditentukan kadarnya secara multikomponen dengan Spektrofotometri Ultraviolet, Kaptopril secara Iodatometri dan Hidroklorotiazid secara Spektrofotometri Sinar Tampak. Menurut Gandjar, I. G., dan Rohman, A. (2007), bila diinginkan pengukuran 2 buah senyawa secara bersama-sama secara spektrofotometri, maka dapat dilakukan pada 2 panjang gelombang yang mana masing-masing komponen saling mengganggu. Dua buah kromofor yang berbeda akan mempunyai kekuatan absorpsi cahaya yang berbeda pula pada satu daerah panjang gelombang.
(30) yaitu tidak kurang dari 90,0 % dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket.
4.4 Uji Validasi Metode Analisis
Pada penelitian ini dilakukan juga validasi metode analisis dengan cara penambahan baku (standard addition method) dengan maksud untuk melihat sejauh mana kebenaran metode yang digunakan. Adapun uji validasi yang digunakan yaitu uji akurasi dengan parameter % perolehan kembali dan uji presisi dengan parameter SD (Standar Deviasi) dan RSD (Relative Standar Deviasi) (WHO, 1992; Indriyanto dan Yuwono, 2003).
Uji akurasi dengan parameter persen perolehan kembali dilakukan dengan membuat 3 konsentrasi analit dengan rentang spesifik 80%, 100%, 120%, masing-masing dengan 3 replikasi dan setiap rentang spesifik mengandung 70% analit dan 30% baku pembanding.
4.4.1 Uji Validasi secara Spektrofotometri Ultraviolet
Data hasil pengujian perolehan kembali Kaptopril dan Hidroklorotiazid dengan metode penambahan bahan baku (standard addition method) dapat dilihat pada tabel 9.
Tabel 9. Data hasil pengujian perolehan kembali Kaptopril dan Hidroklorotiazid dengan metode penambahan bahan baku (standard addition method)
120
Dari data diatas menunjukkan bahwa persen perolehan kembali (%
recovery), pada Kaptopril dan Hidroklorotiazid berturut-turut dengan kadar
rata-rata 96,73% dan 103,68%, standar deviasi (SD) sebesar 0,80 dan 1,93. Persen perolehan kembali ini dapat diterima karena memenuhi syarat akurasi dimana rentang rata-rata hasil persen perolehan kembali adalah 80-110%. Sedangkan dari hasil uji presisi dengan parameter Relative Standar Deviasi (RSD) adalah 0,83% dan 1,86%. Nilai RSD yang diizinkan adalah ≤ 2%. Maka dapat disimpulkan bahwa metode yang digunakan mempunyai akurasi dan presisi yang baik (WHO, 1992).
(data selengkapnya dapat dilihat pada lampiran 11 halaman 58)
4.4.2 Uji Validasi Kaptopril secara Iodatometri-Hidroklorotiazid secara Spektrofotometri Sinar Tampak
4.4.2.1 Uji Validasi titrasi Iodatometri dengan KIO3 0,1N
Tabel 10. Data hasil pengujian perolehan kembali Kaptopril dengan metode penambahan bahan baku (standard addition method)
102,22 102,22 Kadar rata-rata (% recovery) 100,72
Standar Deviasi (SD) 1,39
Relatif Standar Deviasi (RSD) (%) 1,38
Dari data diatas menunjukkan bahwa persen perolehan kembali (%
recovery)dengan kadar rata-rata 100,72%, standar deviasi (SD) sebesar 0,39.
Persen perolehan kembali ini dapat diterima karena memenuhi syarat akurasi dimana rentang rata-rata hasil persen perolehan kembali adalah 80-110%. Sedangkan dari hasil uji presisi dengan parameter Relative Standar Deviasi (RSD) adalah 0,38%. Nilai RSD yang diizinkan adalah ≤ 2%. Maka dapat disimpulkan bahwa metode yang digunakan mempunyai akurasi dan presisi yang baik (WHO, 1992).
(data selengkapnya dapat dilihat pada lampiran 12 halaman 59)
3.4.1.2 Uji Validasi Hidroklorotiazid secara Spektrofotometri Sinar Tampak Tabel 15. Data hasil pengujian perolehan kembali Hidroklorotiazid dengan
metode penambahan bahan baku (standard addition method)
Rentang Spesifik Kadar rata-rata (% recovery) 100,22
Standar Deviasi (SD) 0,97
Dari data diatas menunjukkan bahwa persen perolehan kembali (%
recovery)dengan kadar rata-rata 100,22%, standar deviasi (SD) sebesar 0,97.
Persen perolehan kembali ini dapat diterima karena memenuhi syarat akurasi dimana rentang rata-rata hasil persen perolehan kembali adalah 80-110%. Sedangkan dari hasil uji presisi dengan parameter Relative Standar Deviasi (RSD) adalah 0,97%. Nilai RSD yang diizinkan adalah ≤ 2%. Maka dapat disimpulkan bahwa metode yang digunakan mempunyai akurasi dan presisi yang baik (WHO, 1992).
BAB V
KESIMPULAN DAN SARAN 5.1. Kesimpulan
Untuk penentuan kadar Kaptopril dan Hidroklorotiazid secara bersamaan dapat dilakukan metode analisis multikomponen (spektrofotometri ultraviolet), sedangkan untuk Kaptopril secara Iodatometri dan Hidroklorotiazid secara Spektrofotometri Sinar Tampak karena dari hasil uji validasi, metode ini menunjukkan akurasi dan presisi yang baik .
Dari hasil penelitian menunjukkan bahwa kadar Kaptopril dan hidroklorotiazid dalam sediaan tablet Capozid yang diperiksa memenuhi standar persyaratan tablet menurut The United States Pharmacopeia 30 tahun 2007 yaitu tidak kurang dari 90,0 % dan tidak lebih dari 110,0 % dari jumlah yang tertera pada etiket.
5.2. Saran
DAFTAR PUSTAKA
Budavari, S. (2001). The Merck Index. Encyclopedia of Chemicals, Drugs, and
Biologicals. Thirteenth Edition. Whitehouse: Merck & Co., Inc. Page
1170.
Cairns, D., (2008). Inti Sari Kimia Farmasi. Edisi Kedua. Jakarta: EGC. Halaman 152-154.
Dachriyanus (2004). Analisis Struktur Senyawa Organik Secara Spektrofotometri. Padang : Andalas University Press. Halaman 1.
Day, R. A., dan Underwood, A. L. (2002). Analisis Kimia Kuantitatif. Edisi Keenam. Jakarta: Penerbit Erlangga. Hal. 394, 396-404.
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen kesehatan Republik Indonesia. Jakarta. Halaman 288-290,747-748.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen kesehatan Republik Indonesia. Jakarta. Halaman 167-168,1179.
Gandjar, I. G., dan Rohman, A. (2007). Kimia Farmasi Analisis. Cetakan II. Yogyakarta: Pustaka pelajar. Halaman 249.
Indriyanto, G. dan Yuwono M. (2003). In Gazales, J.Ed. Encyclopedia of
Chromatography (Marcel Dekker). Suplement
Katzung, B.G., (2001). Farmakologi Dasar dan Klinik. Penerjemah dan Editor Bagian Farmakologi Fakultas Kedokteran Universitas Airlangga. Edisi Pertama. Jakarta: Penerbit Salemba Medika. Halaman 247.
Khopkar, S.M. (1990). Konsep Dasar Kimia Analitik. Penerjemah A. Saptoraharjo. Cetakan Pertama. Jakarta: Penerbit Universitas Indonesia. Halaman Kesehatan Republik Indonesia. Jakarta. Halaman 26-217. Moffat, A.C. (2004) Clarke’s Analysis of Drugs and Poisons. Second Edition.
London: The Pharmaceutics Press. Page 1109,1611-1612
Siggia, S. (1963). Quantitative Organic Analysis via Functional Groups. Third Edition. New York and London: John Wiley and Sons, Inc. Pages 563, 578 – 579.
Sudjana. (2002). Metode Statistika. Edisi Statistika. Edisi Keenam. Bandung: Penerbit Tarsito. Hal. 168, 371.
Vogel, A.I. (1994). Kimia Analisis Kuantitatif Anorganik. Cetakan Pertama. Jakarta: Penerbit EGC. Hal. 809-810.
Voight, R. (1995). Buku Pelajar Teknologi Farmasi. Penerjemah: Dr.Soendani Noerono, Apt. Edisi Kelima. Yogyakarta: Gadjah Mada Universuty Press. Halaman 161-162.
USP Pharmacopeia, (2007). The National Formulary. 30st Edition. The United State Pharmacopeia Convention. Pages 681, 1612-1613, 2287.
WHO. (1992). Validation of Analytical Procedures Used in Examination of
Pharmaceutical materials. WHO Technical Report Series. No. 823.
Lampiran 1. Data kadar Kaptopril dan Hidroklorotizid sediaan tablet Capozid secara Spektrofotometri Ultraviolet
Peni mba ngan (mg)
Setara (mg) Absorbansi Kons
Teoritis (mcg/ml)
Konsentrasi Perolehan
(mcg/ml)
Kadar (%)
kaptopril HCT 237 273 Kaptopril HCT Kaptopril HCT Kaptopril HCT
61 10,0522 5,0261 0,8625 0.5320 20,1044 10,0522 19,5239 10,3820 97,11
103,28 61
10,0522 5,0261 0,8615 0,5303 20,1044 10,0522 19,5262 10,3455 97,12 102,91 61
10,0522 5,0261 0,8564 0,5326 20,1044 10,0522 19,2848 10,4019 95,92 103,47 61
10,0522 5,0621 0,8519 0,5338 20,1044 10,0522 19,0897 10,4352 94,95 103,61 61
10,0522 5,0621 0,8633 0,5300 20,1044 10,0522 19.6006 10,3355 97,49 102,81 61,1
Lampiran 2.Perhitungan Konsentrasi Pengukuran Kaptopril dan Hidroklorotiazid dalam sediaan tablet Capozid secara Multikomponen
Tablet Capozid mengandung 50 mg Kaptopril dan 25 mg Hidroklorotiazid Berat 20 tablet = 6.068,3 mg
Berat yang ditimbang setara 10 mg Kaptopril dan 5 mg Hidroklorotiazid
Berat serbuk yang ditimbang =
mg
I. Pada Panjang Gelombang Kaptopril 237 nm A237 = akap . b . ckap + ahct . b . chct
akap1 = Absorptivitas kaptopril pada panjang gelombang 237 nm
ahct1 = Absorptivitas hidroklorotiazid pada panjang gelombang 237 nm II. Pada Panjang Gelombang Hidroklorotiazid 273 nm
A273 = akap . b . ckap + ahct . b . chct
akap2 = Absorptivitas kaptopril pada panjang gelombang 273 nm
Lampiran 2. Lanjutan..
Lampiran 3. Perhitungan Statistik Kadar Kaptopril Dalam sediaan tablet Capozid Bristol Meyer Squibb secara Spektrofotometri Ultraviolet
distribusi t diperoleh nilai ttabel = 4,0321
Data ditolak jika thitung ≥ ttabel atau thitung ≤ - ttabel terhadap data yang dianggap tidak menyimpang.
(
)
distribusi t diperoleh nilai ttabel = 4,6040.
Data ditolak jika thitung ≥ ttabel atau thitung ≤ - ttabel
karena thitung ≤ttabel maka data diterima maka kadar sebenarnya terletak antara:
Lampiran 4. Perhitungan Statistik Kadar Hidroklorotiazid Dalam sediaan tablet Capozid Bristol Meyer Squibb secara Spektrofotometri Ultraviolet
No Kadar [X] (%) Xi – X ( Xi – X)2
distribusi t diperoleh nilai ttabel = 4,0321
(
)
distribusi t diperoleh nilai ttabel = 4,6040.Data ditolak jika thitung ≥ ttabel atau thitung ≤ - ttabel
karena thitung ≤ttabel maka data diterima maka kadar sebenarnya terletak antara:
Lampiran 5. Hasil penetapan kadar kaptopril dalam sediaan tablet Capozid secara Iodatometri.
Lampiran 6. Perhitungan Statistik kadar kaptopril dalam sediaan tablet Capozid
distribusi t diperoleh nilai ttabel = 4,03
Lampiran 6. sambungan... karena thitung ≤ttabel maka data diterima maka kadar sebenarnya terletak antara:
µ = X ± t (1-1/2 α)dk x SD / n
= 95,38 ±
6 0328 , 0 0321 ,
4 x
Lampiran 7. Perhitungan Persamaan Regresi BPFI Hidroklorotiazid secara
Maka persamaan garis regresinya adalah Y = 0,074485X – 0,007575
Lampiran 8. Data Kadar Hidroklorotiazid dalam sediaan tablet Capozid secara spektrofotometri Sinar Tampak
Nama sediaan Penimbangan
(mg)
Setara
(mg) Absorbansi
Kons Teoritis (mcg/ml)
Konsentrasi Perolehan
(mcg/ml)
Kadar (%)
Capozid(Bristol Meyer squibb)
145,8 12,0132 0,4464 6,0066 5,8914 98,08
145,8 12,0132 0,4462 6,0066 5,8887 98,03
145,9 12,0214 0,4464 6,0107 5,8914 98,01
145,9 12,0214 0,4468 6,0107 5,8968 98,10
145,9 12,0214 0,4464 6,0107 5,8914 98,01
Lampiran 9. Contoh perhitungan untuk mencari kadar Hidroklorotiazid secara Spektrofotometri Sinar Tampak
Perhitungan kadar sampel Y = 0,074485X – 0,007575 Absorbansi (Y) = 0.4464
X =
074485 ,
0
007575 ,
0 4464 ,
0 −
=
X 5,8914 mcg/ml
Kadar =
0066 , 6
8914 , 5
x 100 %
Lampiran 10. Perhitungan Statistik Data Kadar Hidroklorotiazid dalam sediaan tablet Capozid secara spektrofotometri Sinar Tampak
(
)
distribusi t diperoleh nilai ttabel = 4,7733
Lampiran 10, sambungan... karena thitung ≤ ttabel maka data diterima maka kadar sebenarnya terletak antara:
µ = X ± t (1-1/2 α)dk x SD / n
= 98,03 ±
6 0485 . 0 7733 ,
4 x
Lampiran 11. Data hasil persen perolehan kembali Kaptopril dan Hidroklorotiazid dalam sediaan tablet Capozid secara Spektrofotometri Ultraviolet dengan Metode Penambahan Baku (standard addition method)
Kadar rata-rata (%) Recovery 96,73
103,68
Standar Deviasi (SD) 0,80 1,93
Lampiran 12. Data hasil persen perolehan kembali Kaptopril dalam sediaan tablet Capozid secara Titrasi Iodatometri dengan Metode Penambahan Baku (standard addition method)
No Konsentrasi
Standar Deviasi (SD) 1,39
Lampiran 13. Data hasil persen perolehan kembali Hidroklorotiazid dalam sediaan tablet Capozid secara Spektrofotometri Sinar Tampak dengan Metode Penambahan Baku (standard addition method)
No Konsentrasi
Standar Deviasi (SD) 0,97
Lampiran 14. Contoh Perhitungan % Recovery dengan Metode Penambahan Baku (Standard Addition Method)
% Recovery =
A = konsentrasi sampel setelah penambahan analit B = konsentrasi sampel sebelum penambahan analit
% Recovery Kaptopril =
Lampiran 15. Contoh Perhitungan Persentase (%) Perolehan Kembali Berat 20 tablet = 6.068,3 mg
Berat 1 tablet = 303,415 mg
Kandungan zat berkhasiat = 50 mg Kaptopril dan 25 Hidroklorotiazid Perolehan 80 %
Sampel yang ditimbang =
mg
Baku Kaptopril yang ditambahkan 12 mg Baku Hidroklorotiazid yang ditambahkan 6 mg Perolehan 100 %
Sampel yang ditimbang =
Baku 30 %
=
100 30
x 50 mg = 15 mg
Baku Kaptopril yang ditambahkan 15 mg
Baku Hidroklorotiazid yang ditambahkan 7,5 mg Perolehan 120 %
Sampel yang ditimbang =
mg
Lampiran 16. Contoh perhitungan nilai absorptivitas Kaptopril dan Hidroklorotiazid
a =
c b
A
.
Keterangan: a = Absorptivitas A = Absorbansi
b = Tebal kuvet(1 cm) c = Konsentrasi(mcg/ml)
Absorptivitas kaptopril pada panjang gelombang 237 nm
a = 20 1
5635 , 0
x
= 0.028175
Absorptivitas Hidroklorotiazid pada panjang gelombang 273 nm
a = 10 1
0347 , 0
x
Lampiran 17 Serapan Absorptivitas
Data Serapan Absorptivitas Kaptopril BPFI
Data Serapan Absorptivitas Hidroklorotiazid BPF
Kaptopril Hidroklorotiazid
Lampiran 19. Contoh Perhitungan Penimbangan Sampel Spektrofotometri Ultraviolet
Diketahui:
Berat 20 tablet = 6,0683 g
Kandungan pada etiket = 50 mg Kaptopril dan 25 ml Hidroklorotiazid Ditanya:
Dibuat larutan uji dengan kadar lebih kurang 20 mcg/ml Kaptopril dan 10 mcg/ml Hidroklorotiazid.
Ditimbang serbuk setara dengan 10 mg Kaptopril dan 5 mg Hidroklorotiazid, maka berat sampel yang ditimbang adalah:
Berat penimbangan sampel =
mg
Sampel yang telah ditimbang dimasukkan dalam labu ukur 100 ml, lalu dilarutkan dalam pelarut NaOH 0.1 N dan cukupkan sampai garis tanda dengan NaOH 0,1 N.
Kadar larutan uji Kaptopril = ml mg
100 10
X 1000 = 100 mcg/ml
Kadar larutan uji Hidroklorotiazid = ml mg
100 5
X 1000 = 50 mcg/ml
Kemudian dipipet 10 ml larutan uji, lalu dimasukkan ke dalam labu ukur 50 ml dan dicukupkan dengan NaOH 0,1N sampai garis tanda.
Kadar larutan uji Kaptopril =
ml
Kadar larutan uji Hidroklorotiazid =