OPTIMASI FASE GERAK DAN LAJU ALIR PADA
PENETAPAN KADAR CAMPURAN GUAIFENESIN
DAN DEKSTROMETORFAN HBr DALAM SIRUP
DENGAN METODE KROMATOGRAFI CAIR
KINERJA TINGGI (KCKT)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
LISA BELLA
060804043
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
OPTIMASI FASE GERAK DAN LAJU ALIR PADA
PENETAPAN KADAR CAMPURAN GUAIFENESIN
DAN DEKSTROMETORFAN HBr DALAM SIRUP
DENGAN METODE KROMATOGRAFI CAIR
KINERJA TINGGI (KCKT)
OLEH: LISA BELLA 060804043
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal Januari 2010
Pembimbing I, Panitia Penguji,
(Prof. Dr.rer.nat. Effendy De Lux Putra,SU.,Apt.)
(Dra. Tuty Roida Pardede,Msi.,Apt) NIP : 195306191983031001 NIP : 130810736
Pembimbing II, (Dra. Nurmadjuzita,Msi.,Apt.)
NIP : 194809041974122001
(Drs. Muchlisyam,MSi,Apt.) (Dra. Sudarmi,Msi,Apt.) NIP : 195006221980021001 NIP : 195409101983032001
(Dra. Tuty Roida Pardede,Msi.,Apt) NIP : 130810736
Medan, Januari 2010 Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah melimpahkan rahmat dan karuniaNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “ Optimasi Fase Gerak dan Laju Alir pada Penetapan Kadar Campuran Guaifenesin dan Dekstrometorfan HBr dalam Sirup dengan Metode Kromatografi Cair Kinerja Tinggi (KCKT)”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Ibu Dra. Tuty Roida Pardede,Msi.,Apt. Dan Bapak Drs. Muchlisyam,Msi.,Apt. selaku dosen pembimbing yang telah membimbing penulis dari awal penelitian hingga selesainya skripsi ini.ucapan terima kasih juga disampaikan kepada Bapak Dekan Fakultas Farmasi Universitas sumatera Utara, Prof.Dr.Sumadio Hadisahputra,Apt. yang telah memberikan bantuan dan fasilitas selama masa pendidikan.
Penulis juga mengucapkan terima kasih kepada kedua orangtua, abang, kakak, dan teman-teman atas doa, dorongan, dan pengorbanan baik moril maupun materil dalam penyelesain skripsi ini.
Medan, Januari 2010 Penulis,
OPTIMASI FASE GERAK DAN LAJU ALIR PADA PENETAPAN KADAR CAMPURAN GUAIFENESIN DAN DEKSTROMETORFAN HBr DALAM SIRUP DENGAN METODE KROMATOGRAFI CAIR KINERJA
TINGGI (KCKT)
Abstrak
Salah satu variabel metode analisis yang sangat penting dalam Kromatografi Cair Kinerja Tinggi (KCKT) adalah fase gerak karena komposisi fase gerak berpengaruh nyata terhadap kinerja kromatografi. Oleh karena itu, untuk mendapatkan kondisi yang optimal dalam analisis perlu dilakukan optimasi terhadap fase gerak. Selain fase gerak, terdapat beberapa variabel penting lainnya, yaitu kolom (fase diam), suhu dan pH. Adapun optimasi yang paling sederhana dan yang paling sering dilakukan yaitu optimasi terhadap komposisi fase gerak dan laju alir.
Pada penelitian ini dilakukan penetapan kadar pada sediaan farmasi yang mengandung guaifenesin dan dekstrometorfan HBr dengan terlebih dahulu dilakukan optimasi fase gerak dan laju alir dengan cara menyuntikan larutan guaifenesin BPFI dengan konsentrasi 1200 mcg/ml dan larutan dekstrometorfan HBr BPFI dengan konsentrasi 180 mcg/ml ke dalam sistem KCKT dengan perbandingan fase gerak metanol : air: buffer amonium format (45:54:1), (55:44:1), dan (65:34:1) dengan laju alir yang berbeda yaitu 1,0 ml/menit, 1,1 ml/menit, 1,2 ml/menit, 1,3 ml/menit, 1,4 ml/menit dan 1,5 ml/menit. Dari hasil optimasi, diperoleh kondisi optimal dengan perbandingan fase gerak metanol : air: buffer amonium format (55:44:1) dan laju alir 1,5 ml/menit, waktu tambat guaifenesin 3,1 menit dan dekstrometorfan HBr 5,4 menit dengan tekanan kolom 182 kgf/cm2. Kondisi optimal ini dipilih karena diperoleh waktu tambat yang cepat, theoritical plate yang besar, dan resolusi yang lebih baik.
Dari hasil analisis guaifenesin dan dekstrometorfan HBr dalam sampel diperoleh bahwa sirup Dextrosin dan Dextrofort memenuhi persyaratan kadar guaifenesin yang tertera dalam USP 30 tahun 2007 yaitu mengandung guaifenesin tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket, sedangkan sirup Vicks
Dextrosin memenuhi persyaratan kadar dekstrometorfan HBr yang tertera dalam USP 30 tahun 2007 yaitu mengandung dekstrometorfan HBr tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket, sedangkan sirup Vicks Anak-Anak Formula 44 dan sirup Dextrofort tidak memenuhi persyaratan. Dari uji validasi metode yang dilakukan, dapat disimpulkan bahwa metode ini memenuhi persyaratan uji validasi dengan persen perolehan kembali guaifenesin 100,8243 % dan dekstrometorfan HBr 100,9337 %, Relatif Standar Deviasi (RSD) guaifenesin 0,3521 % dan dekstrometorfan HBr 0,2790 %, batas deteksi (LOD) guaifenesin 47,6866 mcg/ml dan dekstrometorfan HBr 5,8694 mcg/ml dan batas kuantitasi (LOQ) guaifenesin 144,5049 mcg/ml dan dekstrometorfan HBr 17,7860 mcg/ml.
OPTIMIZATION OF MOBILE PHASE AND FLOW RATE FOR ANALYSIS OF GUAIFENESIN AND DEXTROMETHORPHAN HBr MIXTURE IN SYRUP WITH
HIGH PERFORMANCE LIQUID CHROMATOGRAPHY (HPLC) METHOD
ABSTRACT
One of the analysis method variables that is very important in high performance liquid chromatography (HPLC) is mobile phase because the composition of mobile phase is really influences to chromatography process. To get the optimal condition of analysis, it is necessary to do mobile phase optimization. Besides mobile phase, there are some other important variables like column (stationary phase), temperature, and pH. The simples optimization and very often done are optimization of mobile phase and flow rate.
Analysis in pharmacy dosage that contains guaifenesin and dextromethorphan HBr is doned in this research but the first is doned mobile phase and flow rate optimization by injected guaifenesin BPFI solution with concentration of 1200 mcg/ml and dextromethorphan HBr solution with concentration 180 mcg/ml into HPLC system with used methanol: water: buffer ammonium formate as mobile phase, with comparison (45:54:1), (55:44:1), (65:34:1) with different flow rate 1,0 ml/minute, 1,1 ml/ minute, 1,2 ml/ minute, 1,3 ml/ minute, 1,4 ml/minute and 1,5 ml/ minute. Then the retention time and column pressure is written at every injection with various comparisons of mobile phase and flow rate . From optimization, is obtained the comparison of methanol : water: buffer ammonium formate as mobile phase (55:44:1) and 1,5 ml/ minute flow rate, retention time of guaifenesin is 3,1 minute and retention time of dextromethorphan HBr is 5,4 minute,column pressure 182 kgf/cm2. This optimal condition is choosed because of the fast retention time, the large of theoritical plate, and the better resolution.
is obtained that all samples fulfilled the requirement of USP 30 NF 25 (2007), that is contains dextromethorphan HBr not less than 90,0 % and not more than 110,0% of the labeled amount of C18H25NO.HBr.H2O except Vicks Anak-Anak
Formula 44 syrup and Dextrofort syrup.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... v
ABSTRACT ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xi
DAFTAR GAMBAR... xii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN 1.1. Latar Belakang ... 1
1.2. Perumusan Masalah ... 3
1.3. Hipotesis ... 3
1.4. Tujuan Penelitian ... 4
1.5 Manfaat Penelitian... 4
BAB II TINJAUAN PUSTAKA 2.1. Sirup ... 5
2.2. Dekstrometorfan HBr ... 5
2.2.1. Sifat Fisikokimia... 5
2.2.2. Kegunaan ... 6
2.3. Guaifenesin ... 6
2.3.1. Sifat Fisikokimia... 6
2.3.2. Kegunaan ... 7
2.4. Kromatografi Cair Kinerja Tinggi (KCKT) ... 7
2.4.1. Pengertian Kromatografi Cair Kinerja Tinggi ... 7
2.4.2. Kegunaan Kromatografi Cair Kinerja Tinggi ... 8
2.4.3 Komponen Kromatografi Cair Kinerja Tinggi ... 9
2.4.3.1 Wadah Fase Gerak ... 9
2.4.3.2 Pompa ... 10
2.4.3.3 Injektor ... 10
2.4.3.4 Kolom ... 11
2.4.3.5 Detektor ... 12
2.4.3.6 Fase Gerak ... 12
2.4.4. Proses Kromatografi Cair Kinerja Tinggi ... 13
2.4.5. Parameter Kromatografi ... 14
2.4.6. Keuntungan dan Keterbatasan Kromatografi Cair KinerjaTinggi . 17 2.4.7. Validasi ... 17
2.2. Alat-alat ... 19
2.3. Bahan-bahan ... 19
2.4. Prosedur Penelitian ... 20
2.4.1. Pengambilan Sampel ... 20
2.4.2. Pembuatan Pereaksi ... 20
2.4.2.1 Pembuatan Buffer Amonium Format ... 20
2.4.2.2 Pembuatan Fase Gerak (Metanol-Air-Buffer Amonium Format)... 20
2.4.2.3 Pembuatan Pelarut Metanol-Air-Buffer Amonium Format (55:44:1)... 21
2.4.3 Penyiapan Alat Kromatografi Cair Kinerja Tinggi... 21
2.4.4 Penentuan Perbandingan Fase Gerak dan Laju alir Sistem KCKT... 21
2.4.5 Uji Identifikasi... 21
2.4.6 Penentuan Kuantitatif... 21
2.4.6.1 Pembuatan Larutan Induk Baku Dekstrometorfan HBr BPFI... 21
2.4.6.2 Pembuatan Larutan Induk Guaifenesin BPFI... 21
2.4.6.3 Penentuan Linieritas Kurva Kalibrasi... 21
2.4.6.3.1 Pembuatan Kurva Kalibrasi Dekstrometorfan HBr BPFI dan Guaifenesin BPFI... 21
2.4.6.4 Penyiapan Sampel... 22
2.4.6.5 Penetapan Kadar Guaifenesin dan Dekstrometorfan HBr pada Sampel... 23
2.4.7 Penentuan Uji Akurasi dengan Parameter Persen Perolehan Kembali Menggunakan Metode Penambahan Bahan Baku (Standard Addition Method)... 23
2.4.8 Penentuan Uji Presisi... 24
2.4.9 Penentuan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ).... 24
2.4.10 Analisa Data Secara Stastistik... 25
BAB III HASIL DAN PEMBAHASAN ... 28
BAB IV KESIMPULAN DAN SARAN 4.1. Kesimpulan ... 45
4.2. Saran ... 45
DAFTAR PUSTAKA ... 46
DAFTAR TABEL
Halaman
Tabel 1. Hasil optimasi fase gerak dan waktu alir terhadap tekanan, waktu
tambat, resolusi, dan theoritical plate... 20
Tabel 2. Data hasil penetapan kadar guaifenesin dan dekstrometorfan
HBr dalam sediaan sirup ... .. 28
Tabel 3. Data hasil pengujian perolehan kembali guaifenesin dan dekstrometorfan HBr dengan metode penambahan bahan baku
DAFTAR GAMBAR
Halaman
Gambar 1 Kromatogram hasil penyuntikan larutan uji dengan perbandingan fase gerak metanol : air : buffer amonium format
(45:54:1) dan laju alir 1,0 ml/menit ... 15
Gambar 2 Kromatogram hasil penyuntikan larutan uji dengan perbandingan fase gerak metanol : air : buffer amonium format
(65:34:1) dan laju alir 1,0 ml/menit ... 16
Gambar 3 Kromatogram hasil penyuntikan larutan uji dengan perbandingan fase gerak metanol : air : buffer amonium format
(55:44:1) dan laju alir 1,0 ml/menit ... 16
Gambar 4 Kromatogram hasil penyuntikan larutan uji dengan perbandingan fase gerak metanol : air : buffer amonium format
(55:44:1) dan laju alir 1,1 ml/menit ... 17
Gambar 5 Kromatogram hasil penyuntikan larutan uji dengan perbandingan fase gerak metanol : air : buffer amonium format
(55:44:1) dan laju alir 1,2 ml/menit ... 17
Gambar 6 Kromatogram hasil penyuntikan larutan uji dengan perbandingan fase gerak metanol : air : buffer amonium format
(55:44:1) dan laju alir 1,3 ml/menit ... 18
Gambar 7 Kromatogram hasil penyuntikan larutan uji dengan perbandingan fase gerak metanol : air : buffer amonium format
(55:44:1) dan laju alir 1,4 ml/menit ... 18
Gambar 8 Kromatogram hasil penyuntikan larutan uji dengan perbandingan fase gerak metanol : air : buffer amonium format
(55:44:1) dan laju alir 1,5 ml/menit ... 19
Gambar 9 Kromatogram hasil penyuntikan larutan uji dengan penambahan bahan baku dekstrometorfan HBr BPFI dengan perbandingan fase gerak metanol : air : buffer amonium format
(55:44:1) dan laju alir 1,5 ml/menit ... 19
Gambar 10 Kurva kalibrasi larutan guaifenesin BPFI konsentrasi versus
luas puncak. ... 23
Gambar 11 Kurva kalibrasi larutan dekstrometorfan HBr BPFI konsentrasi
Gambar 12 Kromatogram hasil penyuntikan larutan sirup Dextrofort (PT. Pembangunan Rocella Laboratories) dengan konsentrasi
guaifenesin 600 mcg/ml dan dekstrometorfan HBr 90 mcg/ml... 26
Gambar 13 Kromatogram hasil penyuntikan larutan sirup Vicks Anak-Anak Formula 44 (PT. Darya Varia Laboratoria) dengan konsentrasi guaifenesin 600 mcg/ml dan dekstrometorfan HBr
42 mcg/ml... 26
Gambar 14 Kromatogram hasil penyuntikan larutan sirup Dextrosin (PT. Otto Pharmaceutical Industries) dengan konsentrasi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Gambar alat KCKT dan syringe 100 µl ... 35
Lampiran 2. Gambar Sonifikator (Branson 1510) dan Penyaring... 36
Lampiran 3. Kromatogram hasil penyuntikan larutan guaifenesin BPFI dan dekstrometorfan HBr BPFI dengan berbagai konsentrasi... 37
Lampiran 4. Perhitungan persamaan regresi dari kurva kalibrasi guaifenesin BPFI dan dekstrometorfan HBr BPFI yang diperoleh secara KCKT... 40
Lampiran 5. Contoh perhitungan konsentrasi guaifenesin dan dekstrometorfan HBr yang ditambahkan pada uji perolehan
kembali... 43
Lampiran 6. Kromatogram hasil persen perolehan kembali dari Sirup
Dextrofort (PT. Rocella Pembangunan Indonesia)... 44
Lampiran 7. Data hasil persen perolehan kembali guaifenesin dan dekstrometorfan HBr pada sirup Dextrofort (PT. Pembangunan Rocella Laboratories) dengan metode penambahan baku (Standard addition Method)... 47
Lampiran 8. Analisa data statistik persen perolehan kembali guaifenesin dan dekstrometorfan HBr pada Sirup Dextrofort ( PT.
Pembangunan Rocella Laboratories)... 48
Lampiran 9. Contoh perhitungan persen perolehan kembali... 50
Lampiran 10. Kromatogram dari larutan Sirup Dextrosin (PT. Otto Pharmaceutical Industries)... 52
Lampiran 11. Analisa data statistik untuk mencari kadar guaifenesin dan dekstrometorfan HBr sebenarnya dari penyuntikan larutan Sirup Dextrosin (PT. Otto Pharmaceutical Industries) secara KCKT... 55
Lampiran 12. Kromatogram dari larutan Sirup Dextrofort (PT. Rocella Pembangunan Indonesia)... 58
sirup Dextrofort (PT. Pembangunan Rocella Laboratories)
secara KCKT……….. 61
Lampiran 14. Kromatogram dari larutan Sirup Vicks Anak-Anak Formula 44 (PT. Darya-Varia Laboratoria )... 64
Lampiran 15. Analisa data statistik untuk mencari kadar guaifenesin dan dekstrometorfan HBr sebenarnya dari penyuntikan larutan Vicks Anak-Anak Formula 44 (PT. Darya-Varia Laboratoria ) secara KCKT... 67
Lampiran 16. Rekapitulasi hasil pengolahan data Guaifenesin dan Dekstrometorfan Hidrobromida dari sediaan sirup (sampel).... 70
Lampiran 17. Contoh perhitungan kadar guaifenesin dan dekstrometorfan hidrobromida pada sirup Dextrofort... 72
Lampiran 18. Contoh perhitungan kadar perolehan Guaifenesin dan dekstrometorfan HBr... 74
Lampiran 19. Daftar spesifikasi sampel... 76
Lampiran 20. Sertifikat pengujian guaifenesin BPFI... 77
Lampiran 21. Sertifikat pengujian dekstrometorfan HBr BPFI... 78
Lampiran 22. Sertifikat pengujian baku guaifenesin... 79
Lampiran 23. Sertifikat pengujian baku dekstrometorfan HBr... 80
BAB I
PENDAHULUAN
1.1 Latar Belakang
Kromatografi cair kinerja tinggi merupakan metode pemisahan dengan kecepatan dan efisiensi tinggi yang dapat mengidentifikasi serta menetapkan secara kuantitatif bahan dalam jumlah yang sangat kecil. KCKT mempunyai kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang sensitif. Dengan teknologi ini, kromatografi cair dapat menghasilkan pemisahan yang cepat dalam banyak hal , dengan keunggulan zat-zat yang tidak menguap atau tidak tahan panas dapat dikromatografi tanpa peruraian atau tanpa perlu membuat derivat yang dapat menguap (Depkes RI,1995). Disamping itu, Komposisi fase gerak berpengaruh nyata terhadap kinerja kromatografi dan harus dikendalikan dengan cermat (Depkes RI,1995).
Dalam obat batuk terdapat guaifenesin yang berkhasiat sebagai ekspektoran dan dekstrometorfan yang berkhasiat menekan rangsangan batuk (Tjay dan Rahardja,2007).Banyak obat batuk yang komposisinya berupa gabungan antara penekan batuk (dekstormetorfan) dan ekspektoran (guaifenesin) (Moffet,et.al.,2005). Di pasaran guaifenesin dan dekstrometorfan HBr tersedia dalam bentuk tablet dan sirup (ISFI,2008).
Penetapan kadar analit secara simultan dengan metode kromatografi cair kinerja tinggi adalah berdasarkan perbedaan interaksi atau afinitas analit terhadap fase diam, sehingga menghasilkan perbedaan waktu retensi pada masing-masing zat (Kazakevich and LoBrutto,2007). Jika fase gerak bersifat polar dan fase diam bersifat nonpolar disebut dengan kromatografi fase balik (Depkes RI,1995). Pada fase balik, analit yang lebih polar akan terelusi lebih cepat dibandingkan analit yang kurang polar (Ardrey,2003).
Menurut McSharry and Savage tahun 1980, kadar guaifenesin dan dekstrometorfan HBr dalam sediaan sirup ditentukan dengan metode kromatografi cair kinerja tinggi secara simultan dengan menggunakan kolom 300 x 4 mm Bondapak C18 dengan perbandingan fase gerak metanol: air: buffer amonium format (45:54:1), laju alir 2,0 ml, menggunakan internal standar yaitu o-dinitrobenzen, dan deteksi pada panjang gelombang 280 nm.Disamping itu, dapat ditentukan dengan menggunakan kolom C5 dengan perbandingan fase gerak metanol : air yang mengandung 3% larutan buffer ammonium format pH 3,9 (43:57), laju alir 1,0 ml,dan deteksi panjang gelombang 278 nm (Rauha,et.al.,1996). Ada literatur yang menyatakan dapat juga ditentukan dengan perbandingan fase gerak metanol : air yang mengandung larutan buffer ammonium format pH 4,3 (45:55) (Shervington,1997).
melakukan optimasi fase gerak dan laju alir untuk mendapatkan kondisi yang optimal dalam analisis.
1.2 Perumusan Masalah
1. Apakah kadar campuran guaifenesin dan dekstrometorfan HBr dalam sirup dapat dianalisis dengan metode KCKT secara simultan dengan menggunakan eksternal standar?
2. Berapakah perbandingan fase gerak metanol: air: dapar amonium formiat dan laju alir yang diperlukan agar diperoleh kondisi yang optimal dalam analisis?
3. Apakah kondisi optimal yang diperoleh memenuhi persyaratan uji
validasi?
1.3 Hipotesis
1. Kadar campuran guaifenesin dan dekstrometorfan HBr dalam sirup dapat dianalisis dengan metode KCKT secara simultan dengan menggunakan eksternal standar.
2. Kondisi yang optimal dalam analisis dapat diperoleh dengan perbandingan fase gerak metanol-air-dapar amonium formiat dan laju alir tertentu dan yang terpilih.
1.4 Tujuan Penelitian
1. Mengetahui apakah kadar campuran guaifenesin dan dekstrometorfan HBr dalam sirup dapat dianalisis dengan metode KCKT secara simultan dengan menggunakan eksternal standar.
2. Mengetahui perbandingan fase gerak metanol: air: dapar amonium formiat dan laju alir yang diperlukan agar diperoleh kondisi yang optimal dalam analisis.
3. Melakukan uji validasi terhadap metode penetapan kadar guaifenesin dan
dekstrometorfan HBr yang diperoleh dari optimasi fase gerak dan laju alir.
1.5 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Sirup
Sirop adalah sediaan cair berupa larutan yang mengandung sakarosa. Kecuali dinyatakan lain, kadar sakarosa, C12H22O11, tidak kurang dari 64,0% dan tidak lebih dari 66,0% ((Depkes RI,1979).
Sirup adalah larutan oral yang mengandung sukrosa atau gula lain kadar tinggi. Penggunaan istilah sirup juga digunakan untuk bentuk sediaan cair lain yang dibuat dengan pengental dan pemanis, termasuk suspensi oral (Depkes RI,1995).
2.2 DEKSTROMETORFAN HBr
2.2.1 Sifat Fisikokimia
Rumus struktur :
Sinonim : 3-Metoksi-17-Metil-9α,13α,14α-morfinan hidrobromida,
monohidrat
Pemerian : hablur hampir putih atau serbuk hablur, bau lemah. Melebur pada suhu kurang dari 126 0 disertai peruraian
pH : antara 5,2 sampai 6,5.
Wadah dan penyimpanan : dalam wadah tertutup rapat (Depkes RI,1995).
Kelarutan : larut dalam 60 bagian air dan dalam 10 bagian etanol (95% P), mudah larut dalam kloroform P disertai pemisahan air, praktis tidak larut dalam eter P (Depkes RI,1979).
Kestabilan : dalam bentuk larutan stabil pada pH antara 4,5-6,0 dan terlindung dari cahaya (Semla, et.al.,2004; Leonard,1994; Windholz,et.al.,1983).
2.2.2 Kegunaan
Dekstrometorfan merupakan derivat fenantren non narkotik sintetis yang berkhasiat menekan rangsangan batuk. Mekanisme kerjanya berdasarkan peningkatan ambang pusat batuk di otak (Tjay dan Rahardja,2007).
2.3 GUAIFENESIN
2.3.1 Sifat Fisikokimia
Rumus Struktur :
Rumus Molekul : C10H14O4
Pemerian : Serbuk hablur, putih sampai agak kelabu ; bau khas lemah ; rasa pahit
Kelarutan : larut dalam air, etanol, kloroform, dan propilen glikol ; agk sukar larut dalam gliserin
pH : antara 5,0 dan 7,0
wadah dan penyimpanan : dalam wadah tertutup rapat (Depkes RI,1995). Kestabilan : terlindung dari cahaya (Semla, et.al.,2004; Leonard,1994).
2.3.2 Kegunaan
Guaifenesin atau Gliseril Guaiakolat adalah derivat guaiakol yang banyak digunakan sebagai ekspektoran dalam berbagai jenis sediaan obat modern (Tjay dan Rahardja,2007).
2.4 Kromatografi Cair Kinerja Tinggi (KCKT)
2.4.1 Pengertian Kromatografi Cair Kinerja Tinggi
KCKT merupakan teknologi analitik yang cakap dalam berbagai bidang dan secara luas digunakan untuk analisis obat-obatan, biomolekul, polimer-polimer, dan banyak komponen organik maupun ionik (Dong,2006). Selain itu, KCKT merupakan bentuk kromatografi cair modern yang menggunakan kolom dengan partikel kecil melalui fase gerak yang dipompa pada tekanan tinggi (Dong,2006).
Di industri farmasetikal modern, kromatografi cair kinerja tinggi (KCKT) merupakan peralatan analitik yang paling utama dan sempurna dalam seluruh tingkat penelitian, pengembangan, dan produksi obat (Kazakevich and LoBrutto,2007).
2.4.2 Kegunaan Kromatografi Cair Kinerja Tinggi
Kegunaan umum KCKT adalah untuk pemisahan sejumlah senyawa organik, anorganik, maupun senyawa biologis; analisis ketidakmurnian (impurities); analisis senyawa-senyawa yang tidak mudah menguap (non-volatil); penentuan molekul-molekul netral, ionik, maupun zwitter ion; isolasi dan pemurnian senyawa; pemisahan senyawa-senyawa yang strukturnya hampir sama; pemisahan senyawa-senyawa dalam jumlah sekelumit (trace elements), dalam jumlah banyak, dan dalam skala proses industri.
memurnikan senyawa dalam suatu campuran ; memisahkan polimer dan menentukan distribusi berat molekulnya dalam suatu camapuran ; kontrol kualitas ; dan mengikuti jalannya reaksi sintetis (Rohman,2007).
2.4.3 KomponenKromatografi Cair Kinerja Tinggi
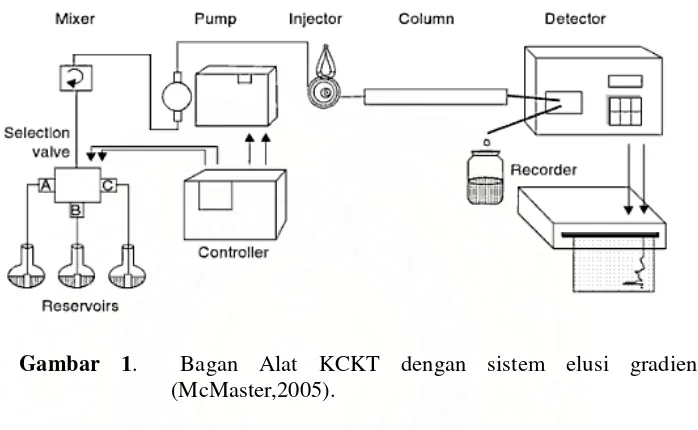
Gambar 1. Bagan Alat KCKT dengan sistem elusi gradien (McMaster,2005).
Sistem Dasar KCKT terdiri dari wadah fase gerak, pompa, injektor, kolom, dan detektor. Pompa menarik fase gerak dari wadah dan memompanya menuju kolom. Pada bagian depan kolom dihubungkan dengan injektor yang berfungsi sebagai tempat memasukkan sampel ke sistem. Pada aliran keluar, terdapat detektor yang mendeteksi komponen sampel dan menghasilkan sinyal yang ditampilkan sebagai sebuah puncak pada bagian rekorder (Kenkel,1994).
2.4.3.1 Wadah Fase gerak
2.4.3.2 Pompa
Pompa berfungsi menarik fase gerak dari wadah dan memompanya menuju kolom.. Pompa harus mampu menghasilkan tekanan 6000 Psi pada kecepatan alir 0,1 – 10 ml/menit. Pompa terbuat dari bahan yang inert terhadap fase gerak. Bahan yang umum digunakan adalah gelas,baja antikarat,teflon, dan batu nilam. Tujuan penggunaan pompa adalah untuk menjamin proses penghantaran fase gerak berlangsung secara tepat, reproduksibel, konstan, dan bebas dari gangguan.
Ada 2 jenis pompa dalam KCKT yaitu pompa dengan aliran fase gerak yang tetap dan pompa dengan tekanan konstan.
2.4.3.3 Injektor
Sampel-sampel cair dan larutan disuntikkan secara langsung ke dalam fase gerak yang mengalir dibawah tekanan menuju kolom menggunakan alat penyuntik yang terbuat dari tembaga tahan karat dan katup teflon yang dilengkapi dengan keluk sampel (sample loop) internal atau eksternal.
Ada tiga jenis dasar injektor, yaitu:
a. Hentikan aliran/stop flow: Aliran dihentikan, injeksi dilakukan pada
kinerja atmosfir, sistem tertutup, dan aliran dilanjutkan lagi. Tehnik ini bisa digunakan karena difusi di dalam aliran kecil dan resolusi tidak dipengaruhi.
partikel kecil dari septum yang terkoyak (akibat jarum injektor) dapat menyebabkan penyumbatan.
c. Katup putaran (loop valve): ditunjukkan secara skematik dalam Gambar 2, tipe injektor ini umumnya digunakan untuk menginjeksi volume lebih besar dari pada 10 µl dan sekarang digunakan dengan cara automatis (dengan adaptor khusus, volume-volume lebih kecil dapat diinjeksikan secara manual). Pada posisi LOAD, sampel loop (cuplikan dalam putaran) diisi pada tekanan atmosfir. Bila katup difungsikan, maka cuplikan di dalam putaran akan bergerak ke dalam kolom.
Gambar 2. Tipe injektor katup putaran
2.4.3.4 Kolom
Kolom adalah jantung sistem KCKT karena pemisahan terjadi di kolom (McMaster,2005). Berhasil atau gagalnya suatu analisis tergantung pada pemilihan kolom dan kondisi percobaan yang sesuai.
Kolom dapat dibagi menjadi dua kelompok:
• Kolom analitik: diameter khas adalah 2-6 mm. Panjang kolom tergantung
adalah 50-100 cm. Untuk kemasan poros mikropartikilat, umumnya 10-30 cm. Sekarang ini sudah tersedia yang berukuran 5 cm.
• Kolom preparatif: umumnya memiliki diameter 6 mm atau lebih besar dan
panjang kolom 25 -100 cm.
Kolom umumnya dibuat dari stainless steel dan biasanya dioperasikan pada temperatur kamar, tetapi bisa juga digunakan temperatur lebih tinggi, terutama untuk kromatografi penukar ion dan kromatografi eksklusi. Kemasan kolom tergantung pada mode kromatografi cair kinerja tinggi yang digunakan.
2.4.3.5 Detektor
Detektor pada KCKT dikelompokkan menjadi 2 golongan yaitu:
• Detektor universal: Mampu mendeteksi zat secara umum, tidak bersifat
spesifik, dan tidak bersifat selektif, seperti detektor indeks bias dan detektor spektrometri massa.
• Detektor spesifik: Hanya mendeteksi analit secara spesifik dan selektif,
seperti detektor UV-Vis, detektor fluoresensi dan elektrokimia (Rohman,2007).
2.4.3.6 Fase Gerak
Elusi gradien dan isokratik
Elusi pada kromatografi cair kinerja tinggi dapat dibagi menjadi dua sistem yaitu:
1. Sistem elusi isokratik. Pada sistem ini, elusi dilakukan dengan satu macam atau lebih fase gerak dengan perbandingan tetap (komposisi fase gerak tetap selama elusi).
2. Sistem elusi gradien. Pada sistem ini, elusi dilakukan dengan campuran fase gerak yang perbandingannya berubah-ubah dalam waktu tertentu (komposisi fase gerak berubah-ubah selama elusi). Elusi bergradien digunakan untuk meningkatkan resolusi campuran yang kompleks terutama jika sampel mempunyai kisaran polaritas yang luas (Rohman,2007;Kenkel 1994).
2.4.4 Proses Kromatografi Cair Kinerja Tinggi
Pemisahan dalam KCKT berdasarkan aliran larutan (fase gerak) yang membawa campuran analit melalui pori media dan perbedaan interaksi-interaksi analit dengan permukaan pori media yang menghasilkan perbedaan waktu migrasi untuk campuran komponen-komponen.
Ada dua fase yang terlibat dalam kromatografi yaitu satu fase yang berfungsi membawa analit dan biasanya disebut fase gerak, dan fase lain yang tidak bergerak atau disebut fase diam.Terdapat hubungan diantara permukaan kedua fase tersebut. Campuran komponen biasanya disebut analit, yang didispersikan dalam fase gerak pada tingkat molekular sehingga memudahkan transpor yang seragam dan interaksi dengan fase gerak dan fase diam.
berbeda dalam campuran. Molekul-molekul analit mengalami transisi berbagai fase saat berada diantara fase gerak dan permukaan adsorben. Rata-rata waktu interaksi molekul pada permukaan fase diam tergantung pada energi interaksi. Untuk molekul-molekul yang berbeda dengan perbedaan energi interaksi yang sangat kecil maka adanya permukaan signifikan adalah penting karena semakin besar jumlah transisi fase atau perubahan molekul analit yang bergerak melalui kolom kromatografi, semakin berbeda retensinya (Kazakevich and LoBrutto,2007).
Komposisi fase gerak dalam analisis KCKT berperan penting dalam keberhasilan pemisahan. Dalam percobaan fase normal dan balik, sebagai contoh, kelarutan relatif dari campuran komponen baik dalam fase gerak dan fase diam berperan dalam besarnya pemisahan. Campuran komponen yang kelarutannya tinggi dalam fase diam tetapi kelarutannya rendah dalam fase gerak akan menghasilkan waktu retensi yang lama. Sebaliknya, campuran komponen yang kelarutannya tinggi dalam fase gerak tetapi kelarutannya rendah dalam fase diam akan menghasilkan waktu retensi yang singkat. Karena pengaruh kelarutan pada polaritas molekul, maka polaritas relatif pada campuran komponen penting dibandingkan dengan fase diam dan fase gerak (Kenkel,1994).
2.4.5 Parameter Kromatografi
Ada beberapa parameter kromatografi yang digunakan secara umum, yaitu:
Jarak antara puncak maksimal dari titik injeksi yang dinyatakan dalam unit waktu disebut waktu retensi. Waktu retensi berfungsi sebagai pengidentifikasi analit pada sisitem partikuler.
Waktu retensi merupakan deskriptor yang paling luas digunakan untuk analit, dan parameter yang paling mudah diukur. walaupun mudah diukur, waktu retensi merupakan parameter universal yang paling akhir.
Waktu retensi analit tergantung pada laju alir fase gerak dan stabilitas laju alir. Semakin cepat laju alir, semakin singkat waktu retensi (Dong,2006).
2. Resolusi
Tujuan sederhana dan bahkan sangat penting dalam KCKT adalah mendapatkan pemisahan campuran sampel yang baik. Untuk mencapai tujuan ini, kita perlu menghitung ukuran kuantitatif dari pemisahan relatif atau resolusi. Resolusi, Rs, dari dua puncak berdekatan didefinisikan sebagai perbandingan jarak antara dua puncak, dibagi dengan rata-rata lebar puncak. Rumusnya :
) (
2 / 1
) (
2 1
1 2
w
w t
t t t Rs
+ − =
Dimana : t1 dan t2 = waktu retensi puncak 1 dan 2 tw1 dan tw2 = lebar puncak 1 dan 2
3. Height Equivalent of a Theoritical Plate (HETP)
Rumus : H
L N =
dimana : H = height equivalent of a theoritical plate (HETP) N = jumlah total theoritical plate
L = panjang kolom
Nilai H menunjukkan ukuran efisiensi yang diberikan kolom tiap unit panjang kolom. Nilai H yang kecil menyatakan kolom yang lebih efisien dan nilai N yang besar. Objek yang paling penting dalam KCKT adalah menimalkan nilai H sehingga nilai N maksimum dan efisiensi kolom paling tinggi.
Nilai H menurun dengan : 1. ukuran partikel kolom yang kecil 2. laju alir fase gerak yang rendah 3. fase gerak yang kurang kental 4. pemisahan pada temperature tinggi
5. molekul-molekul sampel yang kecil (Ahuja,2002). 6. meningkatkan panjang kolom (Cazes,2005).
2.4.6 Keuntungan dan Keterbatasan Kromatografi Cair Kinerja Tinggi
Ada beberapa keuntungan kromatografi cair kinerja tinggi, yaitu :
1. Dapat menganalisis sampel yang tidak mudah menguap atau tidak stabil dengan pemanasan
2. Interaksi yang lebih selektif dengan molekul sampel karena fase gerak dan fase diam berperan dalam proses kromatografi
3. Berbagai jenis kolom yang selektif (Ahuja and Jespersen,2006). 4. Menghasilkan pemisahan dengan kecepatan tinggi
5. Waktu analisis yang cepat (Kenkel,1994).
6. Pemasukan sampel yang tepat dan mudah dikendalikan sehingga
menjamin presisi kuantitaif
7. Risiko peruraian sampel yang lebih kecil karena tidak dilakukan pemanasan
8. Keragaman kolom dan detektor berarti bahwa selektivitas metode tersebut dapat disesuaikan dengan mudah (Watson,2007; Cazes,2005). Keterbatasan KCKT adalah untuk identifikasi senyawa, kecuali jika KCKT dihubungkan dengan spektrofotometer massa (MS). Selain itu, keterbatasan lainnya adalah jika sampel yang dianalisis sangat kompleks, maka resolusi yang baik sulit diperoleh (Rohman,2007).
2.4.7 Validasi
Validasi metode menurut United States Pharmacopeia (USP) dilakukan untuk menjamin bahwa metode analisis akurat, spesifik, reprodusibel dan tahan pada kisaran analit yang akan dianalisis. Suatu metode analis harus divalidasi untuk verifikasi bahwa parameter-parameter kinerjanya cukup mampu untuk mengatasi masalah dalam analisis. Parameter analisis yang ditentukan pada validasi adalah akurasi, presisi, batas deteksi, batas kuantitasi, spesifikasi, linieritas dan rentang, kekasaran (Ruggedness) dan ketahanan (Robutness).
Akurasi merupakan ketelitian metode analisis atau kedekatan antara nilai terukur dengan nilai yang diterima. Akurasi diukur sebagai banyaknya analit pada suatu pengukuran dengan melakukan spiking pada suatu sampel.
Presisi merupakan ukuran keterulangan metode analisis dan biasanya diekspresikan sebagai relatif standar deviasi (RSD) dari sejumlah sampel yang berbeda secara signifikan secara statistik (Rohman,2007).
Batas deteksi (limit of detection, LOD) didefinisikan sebagai konsentrasi analit terendah dalam sampel yang masih dapat terdeteksi (Epshtein,2004).
BAB III
METODOLOGI PENELITIAN
2.1 Waktu dan Tempat Penelitian
Penelitian ini merupakan penelitian eksperimental terhadap optimasi fase gerak dan laju alir, yang dilakukan di Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara pada bulan Agustus sampai Oktober 2009.
2.2 Alat-alat
Alat-alat yang digunakan dalam penelitian ini meliputi seperangkat instrumen kromatografi cair kinerja tinggi (Shimadzu) yang terdiri dari pompa (LC 20 AD), detektor UV/Vis (SPD 20 A), kolom Sim-Pack VP ODS (4,6 x 250 mm), degasser (DGU 20 A5), injector (Rheodyne 7225 i), pompa vakum (Gast DO A-PG04-BN), Sonifikator (Branson 1510), syringe 100 l (SGE), alat penyaring fase gerak dan sampel dilengkapi membran Whatman PTFE 0,5 m, membran selulosa nitrat 0,45 m, dan membran Whatman PTFE 0,2 m, neraca analitik (Mettler Tolledo), pH meter (Hanna), dan alat gelas lainnya.
2.3 Bahan-bahan
Rocella Laboratories), sirup Dextrofort (PT. Pembangunan Rocella Laboratories), sirup Vicks Anak-Anak Formula 44 (PT. Darya Varia Laboratoria), dan sirup Dextrosin (PT. Otto Pharmaceutical Industries).
2.4 Prosedur Penelitian
2.4.1 Pengambilan Sampel
Sampel yang diambil adalah guaifenesin dan dekstrometorfan HBr yang mempunyai komposisi berbeda yaitu sirup Dextrofort (PT. Pembangunan Rocella Laboratories) dengan No. Batch 8C 018, sirup Vicks Anak-Anak Formula 44 (PT. Darya Varia Laboratoria) dengan No. Batch 9011P2H1, dan sirup Dextrosin (PT. Otto Pharmaceutical Industries) dengan No. Batch 8H 2334.
2.4.2 Pembuatan Pereaksi
2.4.2.1 Pembuatan Buffer Amonium Format pH 3,9
Dilarutkan 34 ml amoniak 25% dengan 30 ml air lalu ditambahkan 30 ml asam formiat 98%. Setelah larutan dingin, diperiksa pH (pH 3,9) lalu diencerkan dengan air sampai 100 ml (McSharry and Savage,1980).
2.4.2.2 Pembuatan Fase Gerak (Metanol-Air-Buffer Amonium Format)
Disaring 500 ml aquabidest dengan penyaring membran selulosa nitrat
2.4.2.3 Pembuatan Pelarut Metanol-Air-Buffer Amonium Format (55:44:1)
Dicampur 275 ml metanol, 220 ml aquabidest dan 5 ml buffer amonium format lalu dikocok.
2.4.3 Penyiapan Alat Kromatografi Cair Kinerja Tinggi
Masing-masing unit diatur, kolom yang digunakan Sim-Pack VP ODS (4,6 mm x 25 cm) dengan detektor UV/Vis. Pompa yang digunakan metode aliran tetap dengan sistem elusi gradien, sensitivitas 1,000 AUFS.
Setelah alat KCKT dihidupkan, maka pompa dijalankan dan fase gerak dibiarkan mengalir sekitar 30 menit sampai diperoleh garis alas yang datar, hal ini menunjukkan sistem tersebut telah stabil.
2.4.4 Penentuan Perbandingan Fase Gerak dan Laju alir Sistem KCKT
Larutan guaifenesin BPFI dengan konsentrasi 1200 mcg/ml dan dekstrometorfan HBr BPFI dengan konsentrasi 180 mcg/ml diinjeksikan ke dalam sistem KCKT menggunakan fase gerak metanol : air : buffer amonium format, dengan perbandingan (45:54:1), (55:44:1), (65:34:1) dengan laju alir yang berbeda yaitu 1,0 ml/menit, 1,1 ml/menit 1,2 ml/menit, 1,3 ml/menit, 1,4 ml/menit,dan 1,5 ml/menit. Kemudian dicatat waktu tambat dan tekanan kolom pada tiap penyuntikan dengan berbagai perbandingan fase gerak dan laju alir (data dapat dilihat pada Tabel 1).
2.4.5 Uji Identifikasi
gelombang 280 nm. Bila waktu retensi sampel hampir sama dengan waktu tambat guaifenesin BPFI dan dekstrometorfan HBr BPFI, berarti sampel mengandung guaifenesin dan dektrometorfan HBr.
Selain itu, uji identifikasi dilakukan dengan metode spiked yaitu menambahkan bahan baku dekstrometorfan HBr ke dalam larutan baku campur. Kemudian dianalisa secara KCKT dengan kondisi yang sama. Selanjutnya dilihat peningkatan luas area puncak dari sebelum penambahan baku dan sesudah penambahan baku. Jika terjadi peningkatan luas area berarti puncak tersebut merupakan puncak dekstrometorfan HBr (data dapat dilihat pada Gambar 9).
2.4.6 Penentuan Kuantitatif
2.4.6.1 Pembuatan Larutan Induk Baku Dekstrometorfan HBr BPFI
Ditimbang 50 mg dekstrometrofan HBr BPFI, dimasukkan ke dalam labu tentukur 50 ml, dilarutkan dengan pelarut metanol-air-buffer amonium format (55:44:1) sampai garis tanda (1000 mcg/ml) lalu dikocok.
2.4.6.2 Pembuatan Larutan Induk Guaifenesin BPFI
Ditimbang 100 mg guaifenesin BPFI, dimasukkan ke dalam labu tentukur 25 ml, dilarutkan dengan pelarut metanol-air-bufer amonium format (55:44:1 ) sampai garis tanda ( 4000 mcg/ml) lalu dikocok.
2.4.6.3 Penentuan Linieritas Kurva Kalibrasi
2.4.6.3.1 Pembuatan Kurva Kalibrasi Dekstrometorfan HBr BPFI dan
Guaifenesin BPFI
tentukur 10 ml yang telah dibungkus dengan aluminum foil. Konsentrasi larutan 20 ; 60 ; 100 ; 140; 180 ; 220 mcg/ml selanjutnya larutan induk baku guaifenesin BPFI dipipet 0,25 ml; 1,0 ml; 1,75 ml; 2,5 ml; 3,25 ml; 4,0 ml, masing-masing dimasukkan ke dalam labu tentukur 10 ml yang telah dibungkus dengan aluminum foil . Konsentrasi larutan 100 ; 400 ; 700 ; 1000 ;1300 ; 1600 mcg/ml lalu diencerkan dengan pelarut campur metanol-air-buffer amonium format (55:44:1) sampai garis tanda dan dikocok. Kemudian masing-masing larutan disaring dengan membran Whatman PTFE 0,2 m. Diawaudarakan selama 10 menit. Kemudian diinjeksikan filtrat sebanyak 100 µl menggunakan syringe ke dalam injektor dengan loop 20 µl, diukur pada panjang gelombang 280 nm. Selanjutnya dari konsentrasi dan luas area yang diperoleh pada kromatogram, dibuat kurva kalibrasi serta dihitung persamaan garis regresinya (data dapat dilihat pada Lampiran 4).
2.4.6.4 Penyiapan Sampel
2.4.6.5 Penetapan Kadar Guaifenesin dan Dekstrometorfan HBr pada sampel
Dinjeksikan 20 L larutan sampel ke dalam injektor menggunakan syringe dengan kondisi kromatografi yaitu fase gerak : metanol-air-buffer amonium format (55:44:1), laju alir 1,5 mL/menit dan detektor UV dengan panjang gelombang 280 nm, dan sistem elusi berupa gradien low pressure. Diamati puncak yang muncul dalam kromatogram.
Luas area (luas puncak) dari kromatogram sampel (Y) disubsitusikan ke persamaan garis regresi yang diperoleh dari kurva kalibrasi (Y = aX + b), sehingga diperoleh konsentrasi sampel (X) dan dihitung kadarnya (data dapat dilihat pada Lampiran 17).
2.4.7 Penentuan Uji Akurasi dengan Parameter Persen Perolehan Kembali
Menggunakan Metode Penambahan Bahan Baku (Standard Addition
Method)
Uji perolehan kembali dilakukan dengan menambahkan larutan guaifenesin dengan konsentrasi 600 mcg/ml dan larutan dekstrometorfan HBr dengan konsentrasi 65 mcg/ml ke dalam sampel kemudian dianalisis dengan perlakuan yang sama seperti pada sampel.
Menurut Harmita (2004), perolehan kembali dapat dihitung dengan rumus sebagai berikut :
% Perolehan kembali = A
A F C
C C
*
−
x 100
Keterangan : CF = konsentrasi sampel yang diperoleh setelah penambahan larutan baku
C∗A = konsentrasi larutan baku yang ditambahkan
(data dapat dilihat pada Lampiran 18)
2.4.8 Penentuan Uji Presisi
Uji presisi (keseksamaan) ditentukan dengan parameter Relatif Standar Deviasi (RSD) dengan rumus:
RSD = X SD
x 100%
Keterangan :
RSD = Relatif Standar deviasi SD = Standar deviasi
X = Kadar rata-rata sampel (Epshtein,2004) (data dapat dilihat pada Lampiran 8)
2.4.9 Penentuan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ)
Batas deteksi adalah jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blangko (Harmita, 2004). Batas deteksi dapat dihitung dengan rumus sebagai berikut :
Batas Deteksi (LOD) =
Slope SY
×
3 , 3
SY =
2 )
( 2
− − ∑
n Yi Y
Batas kuantitasi adalah kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004). Batas kuantitasi dapat dihitung dengan rumus sebagai berikut :
Batas Kuantitasi (LOQ) =
Slope SY
×
10
Keterangan :
SY = Simpangan Baku Residual Y = Luas puncak
Yi = Luas puncak dari persamaan regresi n = Jumlah perlakuan
LOD = Batas Deteksi
LOQ = Batas Kuantitasi (Epshtein,2004)
(Data dapat dilihat pada Lampiran 9)
2.4.10 Analisa Data Secara Stastistik
Untuk menghitung Standar Deviasi (SD) digunakan rumus:
SD =
1 )
( 2
− −
∑
n x x
Keterangan : SD = Standar deviasi X = Kadar sampel
X = Kadar rata-rata sampel
n = Jumlah perlakuan (Epshtein,2004)
t hitung =
n SD
X X
/
−
Dengan dasar penolakan data adalah apabila t hitung ≥ t tabel
Untuk mencari kadar sebenarnya dengan α = 0,005; dk = n-1, dapat digunakan rumus :
µ= X
n SD X t(1−1/2α).dk
±
Keterangan :
µ = Kadar sebenarnya X = Kadar rata-rata sampel n = Jumlah perlakuan
t = Suatu harga yang besarnya tergantung pada derajat kebebasan dan tingkat kepercayaan
BAB III
HASIL PERCOBAAN DAN PEMBAHASAN
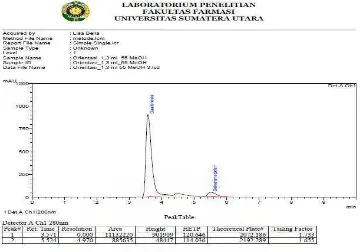
[image:42.612.136.502.324.618.2]Untuk memperoleh kondisi yang optimal dilakukan optimasi fase gerak dan laju alir. Optimasi dilakukan dengan menyuntikkan larutan guaifenesin BPFI dan dekstrometorfan HBr BPFI dengan konsentrasi 1200 mcg/ml dan 180 mcg/ml ke dalam sistem KCKT dengan perbandingan fase gerak metanol : air : buffer amonium format (45:54:1), (55:44:1), (65:34:1) dengan laju alir yang berbeda yaitu 1,0 ml/menit, 1,1 ml/menit, 1,2 ml/menit, 1,3 ml/menit, 1,4 ml/menit, dan 1,5 ml/menit. Hasil optimasi dapat dilihat pada gambar di bawah ini:
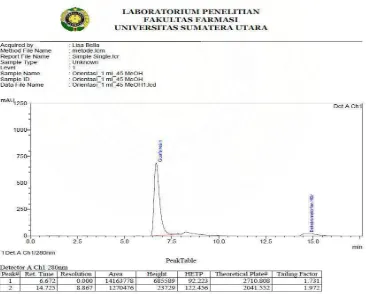
Gambar 2 Kromatogram hasil penyuntikan larutan uji dengan perbandingan fase gerak metanol : air : buffer amonium format (65:34:1) dan laju alir 1,0 ml/menit.
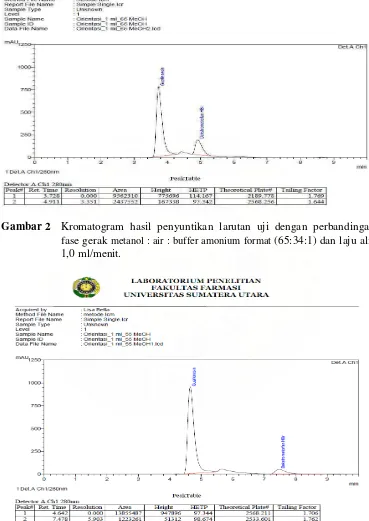
[image:43.612.131.500.124.645.2]Gambar 4 Kromatogram hasil penyuntikan larutan uji dengan perbandingan fase gerak metanol : air : buffer amonium format (55:44:1) dan laju alir 1,1 ml/menit.
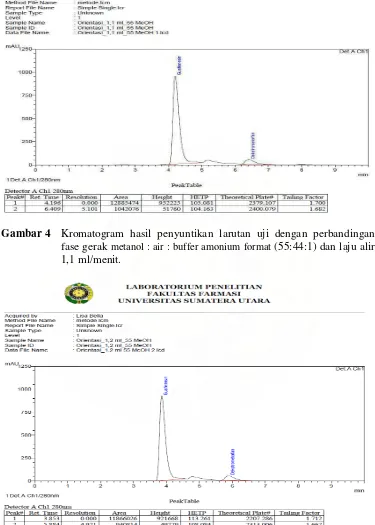
[image:44.612.131.506.119.644.2]Gambar 6 Kromatogram hasil penyuntikan larutan uji dengan perbandingan fase gerak metanol : air : buffer amonium format (55:44:1) dan laju alir 1,3 ml/menit.
[image:45.612.136.496.83.335.2]Gambar 8 Kromatogram hasil penyuntikan larutan uji dengan perbandingan fase gerak metanol : air : buffer amonium format (55:44:1) dan laju alir 1,5 ml/menit.
[image:46.612.132.506.144.670.2]Dari kromatogram hasil penyuntikan baku campur guaifenesin BPFI dan dekstrometorfan HBr BPFI diperoleh 3 puncak yaitu 1 puncak guaifenesin, 1 puncak dekstrometorfan HBr, dan 1 puncak yang terletak disebelah puncak guaifenesin. Puncak ini kemungkinan merupakan hasil degradasi dari baku guaifenesin, akibatnya kadar guaifenesin yang terdeteksi menjadi berkurang. Hal ini berarti perhitungan kadar guaifenesin dalam sampel yang diperoleh dari persamaan regresi menjadi kurang akurat.
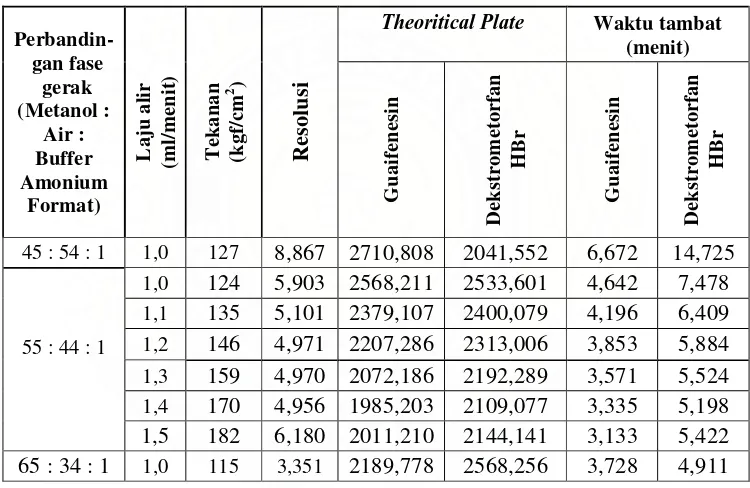
Tabel 1. Hasil optimasi fase gerak dan waktu alir terhadap tekanan, waktu tambat, resolusi, dan theoritical plate.
Perbandin-gan fase gerak (Metanol : Air : Buffer Amonium Format) L a ju a li r (m l/m enit ) T eka na n (kg f/ cm 2 ) R e so lu si
Theoritical Plate Waktu tambat (menit) G ua if ene sin D eks tr o m et o rf a n H B r G ua if ene sin D eks tr o m et o rf a n H B r
45 : 54 : 1 1,0 127 8,867 2710,808 2041,552 6,672 14,725
55 : 44 : 1
1,0 124 5,903 2568,211 2533,601 4,642 7,478
1,1 135 5,101 2379,107 2400,079 4,196 6,409
1,2 146 4,971 2207,286 2313,006 3,853 5,884
1,3 159 4,970 2072,186 2192,289 3,571 5,524
1,4 170 4,956 1985,203 2109,077 3,335 5,198 1,5 182 6,180 2011,210 2144,141 3,133 5,422 65 : 34 : 1 1,0 115 3,351 2189,778 2568,256 3,728 4,911
Pada kromatrografi dengan perbandingan fase gerak metanol-air-buffer amonium format (65:34:1) dan laju alir 1,0 ml menghasilkan kromatogram dengan resolusi yang kecil yaitu 3,351. Akibatnya puncak guaifenesin dan dekstrometorfan HBr saling berdekatan. Kondisi ini bukan merupakan kondisi optimal.
Sedangkan kromatografi dengan perbandingan fase gerak metanol : air : buffer amonium format (55:44:1), laju alir 1,5 ml/menit, waktu tambat guaifenesin 3,133 menit dan dekstrometorfan HBr 5,422 menit dengan tekanan kolom 182 kgf/cm2 merupakan kondisi kromatografi yang optimal. Kondisi optimal ini dipilih karena waktu tambat guaifensin dan dekstrometorfan HBr yang cepat yaitu 3,133 menit dan 5,422 menit, theoritical plate yang besar, dan resolusi yang lebih baik. Persyaratan resolusi yang tertera di USP 30 yaitu harus lebih besar dari 1,5. Menurut Kazakevich dan LoBrutto (2007) bahwa semakin besar laju alir, semakin cepat waktu tambat analit. Menurut Ahuja (2002) semakin besar theoritical plate, semakin besar efisiensi kolom. Umumnya, theoritical plate lebih besar dari 2000 (Chemistry Manufacturing Controls Coordinating Committee,1994). Hal ini berarti resolusi dan theoritical plate yang diperoleh memenuhi persyaratan.
Dalam penelitian ini optimasi dengan laju alir > 1,5 ml/menit tidak dilanjutkan karena pada laju alir > 1,5 ml/menit dihasilkan tekanan pompa > 200 kgf/cm2 . Kondisi ini tidak dapat digunakan karena dapat menyebabkan kerusakan dalam kolom.
retensi 5,4 menit yaitu dari 876709 menjadi 934516. Hal ini berarti konsentrasi dekstrometorfan HBr juga meningkat sehingga dapat disimpulkan bahwa puncak dengan wakru retensi 5,4 menit merupakan puncak dekstrometorfan HBr.
Dari kromatogram hasil penyuntikan larutan baku campur diperoleh bahwa guaifenesin lebih dulu terelusi dibandingkan dekstrometorfan HBr. Hal ini disebabkan guaifenesin bersifat lebih polar dibandingkan dengan dekstrometorfan HBr sehingga interaksi guaifenesin dengan fase diam lebih singkat dibandingkan interaksi dekstrometorfan HBr dengan fase diam. Akibatnya waktu tambat guaifenesin lebih cepat dibandingkan dekstrometorfan HBr.
Larutan dekstrometorfan HBr dan guaifenesin akan stabil jika terlindung dari cahaya (Semla, et.al.,2004; Leonard,1994). Agar larutan guaifenesin dan dekstrometorfan HBr tetap stabil maka guaifenesin dan dekstrometorfan HBr dilarutkan dengan fase gerak yang mengandung buffer amonium format karena larutan dekstrometorfan hidrobromida stabil dalam jangka panjang jika pH larutan disesuaikan antara 4,5-6,0 (Windholz,et.al.,1983) dan diletakkan dalam alat gelas yang ditutup dengan aluminium foil sehingga terlindung dari cahaya.
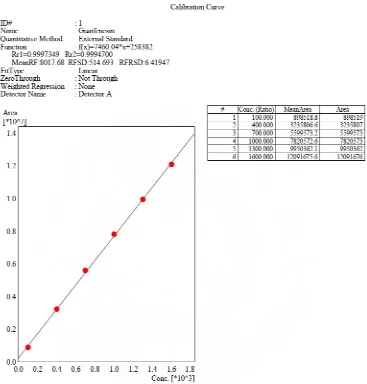
Penentuan linieritas kurva kalibrasi guaifenesin BPFI ditentukan
Gambar 10 Kurva kalibrasi larutan guaifenesin BPFI konsentrasi versus luas puncak.
[image:50.612.135.502.146.530.2]Gambar 11 Kurva kalibrasi larutan dekstrometorfan HBr BPFI konsentrasi versus luas puncak
Hasil identifikasi pada penyuntikan larutan guaifenesin BPFI dengan konsentrasi 1200 mcg/ml dan larutan dekstrometorfan HBr BPFI dengan konsentrasi 180 mcg/ml ke dalam alat KCKT diperoleh kromatogram dengan waktu tambat guaifenesin 3,133 menit dan dekstrometorfan HBr 5,422 menit. Hasil pengujian untuk sampel diperoleh waktu tambat yang hampir sama dengan guaifenesin BPFI dan dekstrometorfan HBr BPFI . Waktu tambat rata-rata guaifenesin 3,14 menit dan dekstrometorfan HBr 5,46 menit pada sirup Dextrofort (PT. Pembangunan Rocella Laboratories), waktu tambat rata-rata guaifenesin 3,14 menit dan dekstrometorfan HBr 5,50 menit pada sirup Vicks Anak-Anak Formula 44 (PT. Darya Varia Laboratoria), dan waktu tambat rata-rata guaifenesin 3,16 menit dan dekstrometorfan HBr 5,58 menit pada sirup Dextrosin (PT. Otto Pharmaceutical Industries). Menurut Weston and Brown (1997), perbedaan waktu tambat yang diperbolehkan 5 % sedangkan dari penelitian perbedaan waktu tambat masing-masing sampel dan baku dibawah 5 %. Hal ini berarti bahwa sampel yang digunakan dalam penelitian ini mengandung guaifenesin dan dekstrometorfan HBr.
Gambar 12 Kromatogram hasil penyuntikan larutan sirup Dextrofort (PT. Pembangunan Rocella Laboratories) dengan konsentrasi guaifenesin 600 mcg/ml dan dekstrometorfan HBr 90 mcg/ml.
[image:53.612.141.486.351.648.2]Gambar 14 Kromatogram hasil penyuntikan larutan sirup Dextrosin (PT. Otto Pharmaceutical Industries) dengan konsentrasi guaifenesin 600 mcg/ml dan dekstrometorfan HBr 180 mcg/ml.
Dari kromatogram hasil penyuntikan larutan sirup Dextrosin diperoleh 3 puncak yaitu 1 puncak guaifenesin, 1 puncak dekstrometorfan HBr, dan 1 puncak zat lain. Zat lain yang terdeteksi tersebut kemungkinan adalah zat aktif obat selain guaifenesin dan dekstrometorfan HBr karena dalam etiket sirup ini juga dicantumkan zat aktif obat lain yaitu fenilpropanolamin HCl dan difenhidramin HCl atau zat lain tersebut merupakan zat tambahan yang digunakan dalam pembuatan formulasi sirup, yang merupakan rahasia perusahaan tersebut. Zat-zat tambahan kemungkinan merupakan zat pengawet, zat pewarna, atau zat perasa.
Tabel 2. Data hasil penetapan kadar guaifenesin dan dekstrometorfan HBr dalam sediaan sirup.
No Nama Sampel
Kadar Guaifenesin (%) Kadar Dekstrometorfan HBr (%)
1. Sirup Dextrofort
(PT. Rocella Pembangunan Indonesia)
102,3803 ± 0,8303
127,8214 ± 6,1504
2. Sirup Dextrosin
(PT. Otto Pharmaceutical Industries)
94,3559 ±
4,9605 98,2744 ± 5,6745 3. Sirup Vicks Anak-Anak Formula 44
(PT. Darya-Varia Laboratoria)
86,9205 ± 2,3141
125,5116 ± 8,6803
Sirup Dextrosin dan Dextrofort memenuhi persyaratan kadar guaifenesin yang tertera dalam USP 30 tahun 2007 yaitu mengandung guaifenesin C10H14O4 tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket, sedangkan sirup Vicks Anak-Anak Formula 44 tidak memenuhi persyaratan. Selain itu, diperoleh bahwa sirup Dextrosin memenuhi persyaratan kadar dekstrometorfan HBr yang tertera dalam USP 30 tahun 2007 yaitu mengandung dekstrometorfan HBr C18H25NO.HBr.H2O tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket, sedangkan sirup Vicks Anak-Anak Formula 44 dan sirup Dextrofort tidak memenuhi persyaratan.
Uji akurasi dengan parameter persen perolehan kembali dilakukan dengan menambahkan guaifenesin konsentrasi 600 mcg/ml dan dekstrometorfan HBr konsentrasi 65 mcg/ml ke dalam sirup Dextrofort dengan 6 kali pengulangan. Data hasil pengujian perolehan kembali guaifenesin dan dekstrometorfan HBr dengan metode penambahan bahan baku (standard addition method) dapat dilihat pada Tabel 3.
Tabel 3. Data hasil pengujian perolehan kembali guaifenesin dan dekstrometorfan hidrobromida dengan metode penambahan bahan baku (standard addition method)
a. Guaifenesin
No. Luas
puncak Konsentrasi Analit yang ditambahkan (C) mcg/ml Persen perolehan
(A-B) X 100% C Setelah penambahan analit (A) mcg/ml Sebelum penambahan analit (B) mcg/ml
1 9355598 1219,4589 615,0203 600 100,7398
2 9342024 1217,6394 615,0203 600 100,4365
3 9346956 1218,3005 615,0203 600 100,5467
4 9365297 1220,7591 615,0203 600 100,9565
5 9386920 1223,6576 615,0203 600 101,4396
6 9359503 1219,9824 615,0203 600 100,8270
Kadar rata – rata (%) 100,8243
Standar Deviasi (SD) 0,3550
b. Dekstrometorfan HBr
Dari hasil uji akurasi diperoleh persen perolehan kembali guaifenesin 100,8243% dan dekstrometorfan HBr 100,9337%, standar deviasi (SD) guaifenesin dan dekstrometorfan HBr sebesar 0,3550 dan 0,2816. Menurut Harmita (2004), untuk analit yang ditambahkan pada matrik sampel > 10% maka rata-rata % perolehan kembali yang diperoleh antara 98-102%. Hal ini berarti persen perolehan kembali guaifenesin dan dekstrometorfan HBr dapat diterima. Sedangkan dari hasil uji presisi dengan parameter Relative Standar Deviasi (RSD) diperoleh RSD guaifenesin sebesar 0,3521% dan dekstrometorfan HBr sebesar 0,2790%. Nilai RSD yang diizinkan adalah ≤ 2% (Epshtein,2004). Hal ini berarti metode yang digunakan dalam penelitian ini mempunyai akurasi dan presisi yang baik (WHO, 1992). Batas deteksi (LOD) guaifenesin dan dekstrometorfan HBr yang diperoleh sebesar 47,6866 mcg/ml dan 5,8694 mcg/ml sedangkan batas kuantitasi (LOQ) guaifenesin dan dekstrometorfan HBr sebesar yang diperoleh dari penelitian ini sebesar 144,5049 mcg/ml dan 17,7860 mcg/ml.
No. Luas
puncak Konsentrasi Analit yang ditambahkan (C) mcg/ml Persen perolehan
(A-B) X 100% C Setelah penambahan analit (A) mcg/ml Sebelum penambahan analit (B) mcg/ml
1 741639 181,1326 115,3970 65 101,1317
2 741115 181,0023 115,3970 65 100,9312
3 740768 180,9160 115,3970 65 100,7985
4 740020 180,9787 115,3970 65 100,5123
5 741020 180,9787 115,3970 65 100,8949
6 742167 181,2638 115,3970 65 101,3335
Kadar rata – rata (%) 100,9337
Standar Deviasi (SD) 0,2816
BAB IV
KESIMPULAN DAN SARAN
6.1 Kesimpulan
- Kadar campuran guaifenesin dan dekstrometorfan HBr dalam sirup dapat dianalisis dengan metode KCKT secara simultan dengan menggunakan eksternal standar.
- Kondisi kromatografi optimal yang diperoleh yaitu dengan perbandingan fase gerak Metanol : Air : dapar Amonium Formiat (55:44:1), laju alir 1,5 ml/menit, volume penyuntikan 20 µl, menggunakan kolom Sim-Pack VP ODS (4,6 x 250 mm), dan deteksi pada panjang gelombang 280 nm. - Kondisi optimal yang diperoleh dalam penelitian ini memenuhi
persyaratan uji validasi sehingga dapat digunakan dalam analisis guaifenesin dan dekstrometorfan HBr dalam sirup yaitu dari hasil uji akurasi diperoleh persen perolehan kembali guaifenesin 100,8243 % dan dekstrometorfan HBr 100,9337 %, hasil uji presisi diperoleh Relatif Standar Deviasi (RSD) guaifenesin 0,3521% dan dekstrometorfan HBr 0,2790%, batas deteksi (LOD) guaifenesin 47,6866 mcg/ml dan dekstrometorfan HBr 5,8694 mcg/ml dan batas kuantitasi (LOQ) guaifenesin 144,5049 mcg/ml dan dekstrometorfan hidrobromida 17,7860 mcg/ml.
6.2 Saran
DAFTAR PUSTAKA
Ahuja,S.(2002).Chromatography and Separation Science.California: Academic Press:10,163.
Ahuja,S. and Jespersen,N.D.(2006). Modern instrumental analysis. New York: Elsevier : 488.
Ardrey,R.E.(2003). Liquid chromatography-mass spectrometry: an introduction. New York: John Wiley and Sons: 12.
Cazes,J.(2005). Encyclopedia of Chromatography. 2nd Edition. New York: Marcel Dekker : 1435.
Chemistry Manufacturing Controls Coordinating Committee.(1994).Validation of Chromatographic Methods,Reviewer Guidance.Rockville: Center for Drug Evaluation and Research, Food and Drug Administration: 12,28.
Depkes RI. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta:Departemen Kesehatan RI: 31,206.
Depkes RI. (1995). Farmakope Indonesia. Edisi Keempat. Jakarta:Departemen Kesehatan RI: 15,299,421-422,1009-1011.
Dong,M.W.(2006). Modern HPLC for practicing scientists. New York: John Wiley and Sons: 26.
Epshtein,N.A.(2004).Validation of HPLC Techniques for Pharmaceutical Analysis. J Pharm Chemistry.Apr. 38(4):216,222-223.
Harmita.(2004).Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Review artikel. Majalah Ilmu Kefarmasian.Vol.I(3): 119,130.
ISFI.(2008).Informasi Spesialite Obat Indonesia. Volume 43.Jakarta:PT. ISFI Penerbitan: 405.
Kazakevich,Y. and LoBrutto,R.(2007). HPLC for pharmaceutical scientists. New York: John Wiley and Sons,Inc.:3-4,15.
Kenkel,J.(1994). Analytical chemistry for technicians. 2nd Edition. New York: CRC Press : 394,412
McMaster,M.C.(2005). LC/MS: a practical user's guide. New York: John Wiley and Sons : 9, 15.
McSharry,W.O.,Savage,I.V.E.(1980).Simultaneous High Pressure Liquid Chromatographic Determination of Acetaminophen, Guaifenesin, and Dextromethorphan Hydrobromide in Cough Syrup. J Pharm.69:212-214. Moffet,H.L., Fisher,R.G., Boyce,T.G.(2005). Moffet's Pediatric Infectious
Diseases: a Problem-Oriented Approach. 4 th Edition. New York: Lippincott Williams & Wilkins:16.
Rauha,J.P., Salomies,H. dan Aalto,M. (1996). Simultaneous determination of bromhexine hydrochloride and methyl and propyl p-hydroxybenzoate and determination of dextromethorphan hydrobromide in cough-cold syrup by high-performance liquid chromatography.J Pharm Biomed Anal. Nov.15 (2):287-293.
Rohman,A.(2007).Kimia Farmasi Analisis.Cetakan I. Jakarta: Pustaka Pelajar: 378-384.
Semla,T.P., Beizer,J.L. and Higbee,M.D.(2004). Geriatric dosage handbook: including monitoring, clinical recommendations, and OBRA guidelines. 10th Edition.Michigan: Lexi Comp:592.
Shervington,L.A.(1997). A Quantitative simultaneous high performance liquid chromatographic determination of pseudoephedrien HCl, guaifenesin, and dextromethorphan HBr. Analytical Letters:30(V).
Tjay,T.H. dan Rahardja,K.(2007).Obat-Obat Penting Khasiat, Penggunaan, dan Efek-Efek Sampingnya. Edisi Keenam.Jakarta: PT. Elex Media Komputindo:663-665.
USP Pharmacopoeia, (2007). The National Formulary. 30th Edition. United States: The United States Pharmacopeia Convention,Inc.:1906,2257. Watson,D.G.(2007). Analisis farmasi : BA untuk mahasiswa farmasi dan praktisi
kimia farmasi. Jakarta: EGC : 314.
Weston,A. and Brown,P.R.(1997).HPLC and CE Principles and Practice. California: Academic Press:216.
Wibisono. Y (2005). Metode Statistik. Jogjakarta:Gajah Mada University Press: 449-454.
Lampiran 1. Gambar alat KCKT dan syringe 100 µl
Gambar 15. Alat KCKT (Shimadzu)
[image:63.612.132.507.129.622.2]Lampiran 2. Gambar Sonifikator (Branson 1510) dan Penyaring
Gambar 17. Sonifikator (Branson 1510)
Gambar Penyaring
[image:64.612.163.476.102.655.2]Lampiran 3. Kromatogram hasil penyuntikan larutan guaifenesin BPFI dan dekstrometorfan HBr BPFI dengan berbagai konsentrasi.
a. Konsentrasi guaifenesin BPFI 100 mcg/ml dan dekstrometorfan HBr BPFI 20 mcg/ml
c. Konsentrasi guaifenesin BPFI 700 mcg/ml dan dekstrometorfan HBr BPFI 100 mcg/ml
e. Konsentrasi guaifenesin BPFI 1300 mcg/ml dan dekstrometorfan HBr BPFI 180 mcg/ml
Lampiran 4. Perhitungan persamaan regresi dari kurva kalibrasi guaifenesin BPFI dan dekstrometorfan HBr BPFI yang diperoleh secara KCKT. a. Guaifenesin No. Konsentrasi (mcg/ml) X Luas Puncak
Y XY X
2
Y2
1 100 898519 89851900 10000 807336030000
2 400 3235807 1294322800 160000 10470444000000
3 700 5599573 3919701100 490000 31355220000000
4 1000 7820573 7820573000 1000000 61161355000000
5 1300 9950362 12935470000 1690000 99009705000000
6 1600 12091676 19346681000 2560000 146208610000000
∑ 5100 39596510 45406601000 5910000 349012690000000
Rata-
rata 850 6599418,3330
Y = a X + b
a =
(
) ( )( )
( )
x( )
x n n y x xy / / 22 − ∑
∑
∑ ∑ − ∑
a =
(
) (
)(
)
(
5910000) (
5100)
/66 / 39596510 5100 0 4540660100 2 − − a = 4335000 5910000 0 3365703300 0 4540660100 − − a = 1575000 0 1174956800
a = 7460,0432
b = Y - a X
Sehingga diperoleh persamaan regresi Y = 7460,0432 X + 258381,6130
Untuk mencari hubungan kadar (X) dengan luas puncak (Y) digunakan pengujian koefisien kolerasi (r).
r =
(
) ( )( )
(
) ( )
[
x x n]
[
(
y) ( )
y n]
n y x xy / / / 2 2 2 2
∑
∑
∑
∑
− − ∑ ∑ − ∑r =
(
) (
)(
)
(
) (
)
(
)
[
5910000 5100 /6]
[
(
349012690000000) (
39596510)
/6]
6 / 39596510 5100 0 4540660100 2 2 − − − r =(
5910000 4335000)(
349012690000000 261313930000000)
0 3365703300 0 4540660100 − − − r =
(
1575000)(
87698760000000)
0 1174956800 r = 0 1175268200 0 1174956800
r = 0,999735039
b. Dekstrometorfan HBr
No Konsentrasi (mcg/ml) X Luas Puncak Y
XY X2 Y2
1 20 92032 1840640 400 8469889024
2 60 254114 15246840 3600 64573925000
3 100 410434 41043400 10000 168456060000
4 140 588775 82428500 19600 346656000000
5 180 735410 132373800 32400 540827860000
6 220 893780 196631600 48400 798842680000
∑ 720 2974545 469564780 114400 1927826400000
Rata-
rata 120 495757,5
a =
(
) ( )( )
( )
x( )
x n n y x xy / / 22 − ∑
∑
∑ ∑ − ∑
a =
(
) ( )(
)
(
114400) ( )
720 /6 6 / 2974545 720 469564780 2 − − a = 86400 114400 35694480 469564780 − − a = 28000 112619380a = 4022,1207
b = Y - a X
b = 495757,5 – 4022,1207 (120) b = 495757,5000 – 482654,4840 b = 13103,016
Sehingga diperoleh persamaan regresi Y = 4022,1207 X + 13102,016
Untuk mencari hubungan kadar (X) dengan luas puncak (Y) digunakan pengujian koefisien kolerasi (r)
r =
(
) ( )( )
(
) ( )
[
x x n]
[
(
y) ( )
y n]
n y x xy / / / 2 2 2
2
∑
∑
∑
∑
− −∑ ∑
−
∑
r =
(
) ( )