Lampiran 1. Hasil analisis sidik ragam diameter zona hambat ekstrak daun binahong terhadap pertumbuhan bakteri A. hydrophila
Sumber
Keterangan: ** = sangat nyata
Lampiran 1. Hasil analisis sidik ragam diameter zona hambat ekstrak daun binahong terhadap pertumbuhan bakteri A. hydrophila
Sumber
Lampiran 2. Bahan-Bahan dalam Penelitian
Daun Binahong FeCl3 1%, CeSO4 1%, Pereaksi Liebermann-Bouchard, Pereaksi Wagner,Pereaksi
Dragendroff, Pereaksi Mayer, Pereaksi Bouchardat
Etanol 96% Akuades Etil Asetat Kapas
Standart β-sitosterol Kertas Label Tryptose Soy Agar
dan triterpenoid (TSA)
larutan crystal violet, larutan iodine lugol, Media MIO, Media O/F paraffin, larutan alkohol aseton, larutan safranin Media O/F
Lampiran 3. Alat-Alat dalam Penelitian
Blender Timbangan biasa Botol kaca Timbangan digital
Penangas air Rotary evaporator Erlenmeyer Corong
Gelas ukur Labu takar Bunsen Pipet tetes Mikroskop
Water Bath (digital) Cawan Petri Sarung tangan & Masker
Inkubator Object glass Pinset
Lampiran 4. Persiapan Bahan dan Pembuatan Simplisia
Penimbangan Bahan setelah dicuci, ditiriskan Pengeringan bahan bahan
Bahan yang telah kering/Simplisia Simplisia diblender
Lampiran 5. Ekstraksi
Serbuk dimasukkan ke Erlenmeyer Sampel dimaserasi Sampel disaring dengan Etanol 96%
Filtrat di rotary evaporator Ekstrak diuapkan pelarut etanolnya
Ekstrak ditimbang Ekstrak pekat
Lampiran 6. Skrining Fitokimia
Lampiran 7. Analisis Kriteria Bakteri
Pembuatan preparat Pewarnaan Gram
Uji motilitas Uji Oksidatif/Fermentatif
Lampiran 8. Pembuatan Media Agar Miring & Media Dasar
TSA ditimbang sesuai kebutuhan Volume ditakar sesuai kebutuhan
Disterilisasi Dimasukkan kedalam water bath
Lampiran 9. Peremajaan Bakteri
Lampiran 10. Pembuatan Suspensi Bakteri
Lampiran 11. Pembuatan Larutan Uji
Lampiran 12. Pengujian Antibakteri
Penyebaran larutan suspensi bakteri Peletakkan kertas cakram pada media
Pengukuran zona bening
DAFTAR PUSTAKA
Aoki T. 1999. Motile Aeromonads (Aeromonas hydrophila). Journal Laboratory of Genetics and Biochemistry 11: 427-435.
Astuti, S. M., M. Sakinah, R. Andayani, A. Ricsh. 2011. Determination of Saponin Compound from Anredera cordifolia (Ten) Steenis Plant (Binahong) to Potential Treatment for Several Diseases. Journal of Agricultural Science 3(4): 227.
Darsana, I. G. O., Nengah, K. B., Hapsari, M. 2012. Potensi Daun Binahong (Anredera Cordifolia (Tenore) Steenis) dalam Menghambat Pertumbuhan Bakteri Escherichia Coli secara In Vitro. Indonesia Medicus Veterinus 1(3):337 – 351
Dwidjoseputro, D. 1978. Dasar-Dasar Mikrobiologi. Penerbit Djambatan. Jakarta. Gan, S., M. Yurian, K. Istianda. 1980. Farmakologi dan Terapi. Edisi ke-2. UI
Press. Jakarta.
Ghufran M, H dan Kordi K. 2004. Penanggulangan Hama dan Penyakit Ikan. PT. Rineka Cipta dan PT. Bina Adiaksara. Jakarta.
Gunawan, D. dan Mulyani, S. 2010. Ilmu Obat Alam (Farmakognosi) Jilid 1. Penebar Swadaya. Jakarta.
Indriani, N. 2007. Aktivitas Antibakteri Daun Senggugu (Clerodendron serratum [L.] Spr.). [skripsi]. Bogor: Institut Pertanian Bogor
Irianto, A. 2005. Patologi Ikan Teleostei. Gajahmada University Press. Yogyakarta.
Katzung, B., G. 2004. Farmakologi Dasar dan Klinik. Penerjemah: Bagian Farmakologi Fakultas Kedokteran Universitas Airlangga. Penerbit Salemba Medika. Jakarta.
Kismiyati, S. Subekti, R. W. N Yusuf, R. Kusdarwati. 2009. Isolasi dan Identifikasi Bakteri Gram Negatif pada Luka Ikan Maskoki (Carassius
auratus) Akibat Infestasi Ektoparasit Argulus sp. Jurnal Ilmiah Perikanan
dan Kelautan 1(2):131-132.
Lathifah, Q. A. 2008. Uji Efektifitas Ekstrak Kasar Senyawa Antibakteri Pada Buah Belimbing Wuluh (Averrhoa bilimbi L.) Dengan Variasi Pelarut. [skripsi]. Malang: Fakultas Sains dan Teknologi Universitas Islam Negeri (UIN).
Laelatul, L., A. Kadarohman, R. Eko. 2010. Efektivitas Biolarvasida Ekstrak Etanol Limbah Penyulingan Minyak Akar Wangi (Vetiveria zizanoides) Terhadap Larva Nyamuk Aedes aegyptii, Culex sp., Anopheles sundaicus. Jurnal Sains dan Yeknologi Kimia 1(1):60-61.
Manoi, F. 2009. Binahong (Anredera cordifolia) Sebagai Obat. Warta Penelitian dan Pengembangan Tanaman Industri 15(1):3-4.
Muslim, M.P. Hotly, H. Widjajanti. 2009. Penggunaan Ekstrak Bawang Putih (Allium sativum) untuk Mengobati Benih Ikan Patin Siam (Pangasius
hypophthalmus) yang Diinfeksi Aeromonas hydrophyla. Jurnal Akuakultur
Indonesia, 8(1):99-100.
Murphy MC. 1999. Plant products as antimicrobial agents. Clin Microbiol Rev 12: 564–582l.
Nuitja, N. S. 2010. Manajemen Sumberdaya Perikanan. Penerbit IPB Press. Bogor.
Nugrahaningtyas, K. D. 2005. Isolasi dan Identifikasi Senyawa Flavonoid dalam Rimpang Temu Ireng (Curcuma aeruginosa Roxb.). Biofarmasi 3 (1): 34. Pelczar, M. J., dan Chan, E. C. S. 1988. Dasar-dasar Mikrobiologi. Diterjemahkan
oleh Hadioetomo, R. S., Imas, T., Tjitrosomo, S. S., dan Angka, S. L. UI-Press. Jakarta.
Pratiwi, S. T. 2008. Mikrobiologi Farmasi. Erlangga. Jakarta.
Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. Penerjemah Padmawinata, K. Penerbit ITB. Bandung.
Selawa, W., M. R. J. Runtuwene, G. Citraningtyas. 2013. Kandungn Flavonoid dan Kapasitas Antioksidan Total Ekstrak Etanol Daun Binahong (Anredera
cordifolia (Ten.)Steenis.).
Setiaji, A. 2009. Efektifitas Ekstrak Daun Pepaya Carica papaya L. untuk Pencegahan dan Pengobatan Ikan Lele Dumbo Clarias sp. Yang Diinfeksi Bakteri Aeromonas hydrophila. [skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor.
Setiaji, A. 2009. Uji Aktivitas Antibakteri Ekstrak Petroleum eter, Etil asetat dan Etanol 70% Rhizoma (Anredera cordifolia (Tenore) Steen) Terhadap
Serta Skrining Fitokimianya. [makalah]. Surakarta : Fakultas Farmasi Universitas Muhammadiyah Surakarta.
Shabella, R. 2012. Terapi Daun Binahong. Cable Book. Klaten.
Singkoh, M. F. O. 2011. Aktivitas Antibakteri Ekstrak Alga Laut Caulerpa
racemosa dari Perairan Pulau Nain. Jurnal Perikanan dan Kelautan Tropis,
7(3): 124.
Sirait, M. 2007. Penuntun Fitokimia dalam Farmasi. Penerbit ITB. Bandung. Siregar, R. F. 2009. Uji Aktivitas Antibakteri dari Ekstrak Etanol dan Air Rebusan
Kulit Batang Ingul (Toona sinensis M. Roem) Terhadap Beberapa Bakteri. [skripsi]. Medan: Fakultas Farmasi Universitas Sumatera Utara.
SNI 7303: 2009. 2009. Metode Identifikasi Bakteri Aeromonas hydrophila secara biokimia.
Sukenda, L. Jamal, D. Wahjuningrum dan A. Hasan. 2008. Penggunaan Kitosan Untuk Pencegahan Infeksi Aeromonas hydrophila Pada Ikan Lele Dumbo
Clarias sp. Jurnal Akuakultur Indonesia, 7(2):159–169.
Sutama, I. K. J. 2002. Efektivitas Ekstrak Daun Jambu Biji (Psidium guajava L.), Sambiloto (Andrographis paniculata Nees) dan Daun Sirih (Piper betle L.) Terhadap Infeksi Bakteri Aeromonas hydrophila Pada Ikan Lele Dumbo (Clarias sp). [skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor.
Tanjung, K. N, Sudarno, S. Laksmi. 2008. Efektivitas Ekstrak Kulit Jeruk Lemon (Citrus limonum) terhadap Daya Hambat Pertumbuhan Aeromonas
hydrophila secara in vitro. Berkala Ilmiah Perikanan. 3(1):89-93.
Tsuchiya, H., M. Sato, T. Miyazaki, S. Fujiwara, S. Tanigaki, M. Ohyama, T. Tanaka, and M. Iinuma. 1996. Comparative study on the antibacterial activity of phytochemical flavanones against methicillin -resistant Staphylococcus aureus. J. Ethnopharmacol. 50:27–34.
Waluyo, L. 2007. Mikrobiologi Umum. UMM Press. Malang.
Wardiyanto, Sukoso, U. Yanuhar. 2008. Analisis Daya Hambat Ekstrak Daun Pepaya (Carica papaya L.) Terhadap infeksi Seluler Aeromonas hydrophila Pada Ikan Mas (Cyprinus carpio L.). Jurnal Penelitian Perikanan, 2(1):107-114.
METODE PENELITIAN
Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan pada bulan Maret sampai bulan April 2013. Pembuatan ekstrak dan pengujian fitokimia daun binahong dilakukan di Laboratorium Kimia Bahan Alam, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara (Lampiran 1). Pengujian antibakteri dilakukakn
di Balai Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Medan I.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah daun binahong, etanol 96%, asam klorida (HCl) 2N, etil asetat, aquades steril, besi (III) klorida (FeCl3) 1%, cerium sulfat (CeSO4) 1%, pereaksi Liebermann-Bouchard, pereaksi Wagner, pereaksi Dragendroff, pereaksi Mayer, pereaksi Bouchardat, standar triterpenoid dan β-sitosterol, kultur murni bakteri Aeromonas hydrophila ATCC 35654 didapat dari Balai Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Medan I, tryptose soya agar (TSA), kertas blank cakram merek Oxoid, kapas, natrium klorida (NaCl), kertas label, tissu, alumunium foil, alkohol 70%, larutan crystal violet, larutan iodine lugol, larutan alkohol aseton, larutan safranin, parafin, kertas oksidase, media O/F, media MIO (Lampiran 2).
Alat-alat yang digunakan dalam penelitian ini adalah blender, ayakan mesh 65, stoples kaca, timbangan digital, penangas air (water bath), botol kaca,
Petri, tabung reaksi, rak tabung reaksi, jarum ose, api bunsen, inkubator, laminar
air flow, object glass, hot plate, pinset, jangka sorong, sarung tangan, masker,
pipet tetes, kamera digital, mikroskop (Lampiran 3).
Pelaksanaan Penelitian
Persiapan bahan dan pembuatan simplisia
Daun binahong diperoleh dari tanaman pekarangan rumah di Binjai, Sumatera Utara. Daun yang diambil yaitu daun yang kira-kira berumur tua (tanaman ditandai dengan adanya bunga) dan berwarna hijau tua. Daun dikumpulkan sebanyak 400 gram. Daun yang telah dikumpulkan kemudian dicuci dibawah air mengalir sampai bersih, lalu ditiriskan. Daun dikeringkan dengan cara diangin-anginkan sampai kering selama 5 hari, setelah kering diblender sampai menjadi bubuk dan diayak sehingga didapat bubuk yang halus (simplisia). Bubuk ini disimpan dalam wadah kaca tertutup dan tidak terkena sinar matahari langsung (Lampiran 4).
Simplisia adalah bahan alami yang digunakan untuk membuat obat dan belum mengalami proses apapun kecuali berupa bahan yang dikeringkan (Gunawan dan Mulyani, 2010). Simplisia yang digunakan dalam penelitian ini dibuat dari daun binahong (A. cordifolia) yang telah dikeringkan.
simplisia dihaluskan hingga menjadi bubuk dan disimpan dalam stoples kaca dan terhindar dari sinar matahari (Lampiran 4).
Pembuatan ekstrak daun binahong
Ekstraksi tumbuhan adalah proses penarikan zat aktif dalam tanaman dengan menggunakan pelarut tertentu. Ekstraksi tergantung pada tekstur dan kandungan bahan dalam tanaman. Senyawa/kandungan dalam tanaman memiliki kelarutan yang berbeda-beda dalam pelarut yang berbeda (Harbone, 1996 diacu oleh Indriani, 2007).
Pembuatan ekstrak dilakukan secara maserasi dengan menggunakan pelarut etanol 96% dengan cara melarutkan serbuk simplisia sebanyak 50 gram ke dalam 500 ml etanol 96% lalu ditutup dengan alumunium foil dan dibiarkan selama 2 hari sambil sesekali diaduk. Setelah 2 hari, sampel yang direndam tersebut disaring dengan kapas sehingga diperoleh filtrat dan ampas. Kemudian filtrat dievaporasi dengan rotary evaporator sehingga diperoleh ekstrak kental daun binahong. Kemudian dilanjutkan pemekatan ekstrak dengan penangas air (water bath) sampai seluruh pelarut etanolnya habis menguap dan diperoleh
ekstrak pekat. Ekstrak kemudian disimpan dalam botol kaca tertutup (Lampiran 5).
Skrining Fitokimia (Indah (2006) dan Harborne (1987) dalam Laelatul, dkk., (2010).
Skrining fitokimia saponin
kurang lebih 10 menit dan buih tidak hilang jika ditambahkan 1 tetes HCl 2N maka menunjukkan adanya saponin (Lampiran 6).
Skrining fitokimia steroid/terpenoid
Ekstrak sampel sebanyak 2 ml dimasukkan ke dalam tabung reaksi, kemudian dilakukan pengujian steroid/terpenoid sebagai berikut:
a. Ekstrak ditambahkan dengan 2 tetes pereaksi Liebermann-Bouchard. Apabila terbentuk warna biru ungu/biru hijau menunjukkan adanya steroid/terpenoid
Untuk pengujian dengan CeSO4 dilakukan dengan metode Thin Layer
Cromatography (TLC) dengan cara ekstrak sampel diteteskan ke plat TLC
kemudian disemprot dengan pereaksi CeSO4 1% dan dipanaskan di atas hot plate. Kemudian diamati perubahan warna yang terjadi dan dibandingkan dengan standar triterpenoida dan β-sitosterol yang terbentuk (Lampiran 6).
Skrining fitokimia alkaloid
Ekstrak sampel sebanyak 1 ml dimasukkan ke dalam tabung reaksi, kemudian dilakukan pengujian alkaloida sebagai berikut :
a. Ekstrak ditambahkan 2 tetes pereaksi Wagner. Apabila terbentuk endapan berwarna cokelat maka reaksi positif.
b. Ekstrak ditambahkan 2 tetes pereaksi Dragendroff. Apabila terbentuk endapan berwarna merah/jingga maka reaksi positif.
c. Ekstrak ditambahkan 2 tetes pereaksi Mayer. Apabila terbentuk endapan menggumpal berwarna putih/kuning maka reaksi positif.
Skrining fitokimia fenolik dan flavonoid
Ekstrak sampel sebanyak 1 ml dimasukkan ke dalam tabung reaksi untuk dilakukan pengujian fenolik dengan cara ekstrak ditambahkan pereaksi FeCl3 1%, jika terjadi warna hitam menunjukkan adanya senyawa fenolik. Untuk memisahkan adanya senyawa flavonoid, maka serbuk daun kering (simplisia) ditambahkan 5 ml etil asetat dan dikocok hati-hati lalu didiamkan sebentar, kemudian ditambahkan pereaksi FeCl3 1%. Apabila terjadi perubahan warna menjadi warna hitam menunjukkan adanya flavonoid.
Sterilisasi Alat
Sterilisasi alat dilakukan sebelum alat-alat digunakan dalam penelitian yaitu dengan cara alat-alat yang akan dipakai seperti cawan petri, tabung reaksi, erlenmeyer dibersihkan terlebih dahulu lalu dibungkus dengan menggunakan kertas dan dimasukkan kedalam autoklaf. Selanjutnya di autoklaf dengan suhu 121oC dan tekanan 15 lbs atau 1 atm selama 15 menit (Waluyo, 2007). Sebelum digunakan, alat yang sudah disterilisasi, disimpan didalam oven. Untuk alat-alat seperti jarum ose, pinset disterilisasi dengan cara dipanaskan dengan api bunsen.
Analisa Kriteria Bakteri Aeromonas hydrophila
secara biokimia yang dikeluarkan oleh SNI 7303 (2009) (Lampiran 7) dan bakteri dinyatakan sebagai A. hydrophila apabila memenuhi kriteria antara lain pada pewarnaan Gram menghasilkan sifat Gram negatif berwarna merah/pink dan berbentuk batang pendek, hasil uji motilitas yaitu motil, hasil uji oksidase yaitu positif oksidatif, hasil uji O/F yaitu positif O/F dan hasil uji RS yaitu positif RS
Pewarnaan Gram
diamati sifat bakteri Gram negatif ditandai dengan sel bakteri berwarna merah/pink, bentuk batang pendek (Lampiran 7).
Uji motilitas
Uji motilitas bertujuan untuk mengetahui apakah bakteri tersebut motil atau tidak. Uji ini menggunakan media MIO (Motility Indole Ornitin) (Kismiyati, dkk., 2009). Cara kerjanya adalah diambil isolat murni bakteri dengan ose steril dan dinokulasikan dengan menusukkan pada media semi solid (MIO agar), kemudian diinkubasikan pada suhu 25oC-28oC selama 18 jam-24 jam. Setelah itu dilakukan pengamatan reaksi positif ditandai dengan adanya pertumbuhan bakteri yang menyebar dan tidak terlihat bekas tusukan (Lampiran 7).
Uji oksidase
Uji oksidase adalah untuk mengetahui ada tidaknya enzim oksidase pada bakteri dengan menggunakan paper oksidase yang dapat dilihat perubahan warna yang terjadi pada kertas oksidase (Kismiyati, dkk., 2009). Cara kerjanya kultur murni bakteri diambil sebanyak 1 ose dengan menggunakan ose steril lalu digoreskan ke kertas oksidase. Selanjutnya diamati perubahan warna yang terjadi. Reaksi oksidase positif ditandai munculnya warna biru keungunan pada goresan (Lampiran 6).
Uji O/F (Oksidatif/Fermentatif)
berisi media O/F, lalu diambil isolat bakteri dengan menggunakan ose steril. Kemudian inokulasi isolat bakteri ke dalam tabung reaksi yang berisi media O/F dengan cara ditusukkan. Lalu satu tabung diisi dengan parafin cair steril hingga ketinggian 1 cm di atas permukaan media O/F, sedangkan tabung lainnya tanpa parafin cair. Setelah itu diamati perubahan yang terjadi. Reaksi fermentatif ditandai dengan perubahan warna media pada tabung yang diisi parafin cair dari hijau menjadi kuning (Lampiran7).
Uji Rimmler-Shoots (RS)
Cara kerja Uji Rimmler-Shoots (RS) adalah diambil isolat bakteri dengan jarum ose steril dan digoreskan pada media RS, kemudian diinkubasikan pada suhu 37oC selama 18-24 jam. Setelah itu diamati koloni yang tumbuh, apabila berwarna kuning tanpa warna hitam di tengah koloni berarti positif A. hydrophila (Lampiran 7).
Pembuatan Media
Pembuatan media agar miring
Bahan yang digunakan adalah bubuk TSA sebanyak 5 gram dilarutkan dalam 125 ml aquades di dalam erlenmeyer, disterilisasi dengan autoklaf pada suhu 121oC dan tekanan 15 lbs atau 1 atm selama 15 menit. Setelah itu, erlenmeyer yang berisi larutan dimasukkan kedalam water bath sampai larutan agak dingin, kemudian larutan dituangkan sebanyak 5 ml ke tabung reaksi.
pada suhu ruangan. Media miring yang tidak terkontaminasi ini selanjutnya bisa digunakan untuk peremajaan bakteri (Lampiran 8).
Pembuatan media dasar
Media dibuat dengan menggunakan bubuk TSA sebanyak 10 gram dilarutkan dalam 250 ml aquades di dalam labu takar, kemudian disterilisasi dengan autoklaf pada suhu 121oC dan tekanan 15 lbs atau 1 atm selama 15 menit. Setelah itu, erlenmeyer yang berisi larutan dimasukkan kedalam water bath sampai larutan agak dingin, kemudian larutan TSA dituangkan sebanyak 15 ml ke
dalam cawan petri (Singkoh, 2011) dan dibiarkan dibiarkan mengeras selama 24 jam dalam laminar air flow pada suhu ruangan. Media dasar yang tidak
terkontaminasi ini selanjutnya bisa digunakan untuk pengujian antibakteri (Lampiran 8).
Uji Efektivitas Antibakteri
Peremajaan bakteri
Pembuatan larutan NaCl 0,9%
Pembuatan larutan dilakukan dengan cara melarutkan NaCl 0,9 gram dan 100 ml akuades ke dalam gelas ukur, kemudian di aduk hingga tercampur rata.
Pembuatan suspensi bakteri
Bakteri diambil dari kultur murni dengan jarum ose kemudian disuspensi ke dalam tabung reaksi berisi 10 ml NaCl 0,9% steril sampai kekeruhannya sama dengan suspensi standart 0,5 Mc.Farland dan konsentrasi bakteri yang diperoleh adalah 108 cfu/ml (Siregar, 2009) (Lampiran 10).
Pembuatan konsentrasi larutan uji
Konsentrasi % (b/v) yang akan digunakan yaitu 0 % (kontrol); 0,2 %; 0,4 %; 0,6 %; 0,8 % (Muslim, dkk., 2009). Larutan uji dibuat dengan cara menimbang ekstrak daun binahong sebanyak 0,2 g; 0,4 g; 0,6 g; 0,8 g kemudian masing-masing dilarutkan dalam 100 ml aquades steril (Lampiran 10). Untuk konsentrasi 0% (kontrol) digunakan kontrol negatif (aquades steril) dan kontrol positif (Oksitetrasiklin).
Pengujian Antibakteri
Metode difusi
Metode disc diffusion (tes Kirby & Bauer) untuk menentukan aktivitas agen antimikroba. Piringan yang berisi agen antimikroba diletakkan pada media agar yang telah ditanami mikroorganisme yang akan berdifusi pada media agar tersebut. Area jernih mengindikasikan adanya hambatan pertumbuhan
Pada percobaan in vitro dengan metode lempeng agar, dapat dilihat pada besar diameter hambatan pertumbuhan mikroba disekeliling antibiotik. Bila antibiotik pada kadar yang rendah dapat memberikan diameter hambatan yang luas dan bening di sekeliling antibiotik, hal ini menunjukkan bahwa antibiotik
tersebut berpotensi tinggi terhadap mikroba uji yang digunakan (Wattimena, dkk., 1991).
Zona hambat yang kecil menunjukkan adanya aktivitas antibakteri yang rendah, sedangkan zona hambat yang besar menunjukkan adanya aktivitas antibakteri yang tinggi (Setiaji, 2009).
Pengujian antibakteri dilakukan dengan metode difusi disk menggunakan kertas cakram. Larutan suspensi bakteri disebar diatas media TSA dan diratakan, lalu didiamkan sebentar. Kertas cakram yang telah direndam larutan uji dengan berbagai konsentrasi selama 15 menit diletakkan di atas media TSA yang sebelumnya telah disebar larutan suspensi bakteri. Kertas cakram diletakkan dengan sedikit agak ditekan bertujuan agar kertas cakram menempel dengan baik pada permukaan media. Selanjutnya cawan petri diinkubasi pada suhu 37oC selama 24 jam di inkubator (Lampiran 12).
Parameter yang Diamati
Pengamatan zona hambat pertumbuhan bakteri
Pengumpulan Data
Data-data yang dikumpulkan dalam penelitian ini meliputi :
a. Hasil fitokimia daun binahong berupa senyawa metabolit sekunder yang terkandung di dalamnya.
b. Pengaruh ekstrak daun binahong yang mempunyai daya hambat terhadap pertumbuhan bakteri.
c. Diameter zona hambat pertumbuhan bakteri
Analisis Data
Penelitian ini menggunakan metode eksperimental laboratoris untuk uji
in vitro. Rancangan yang digunakan adalah rancangan acak lengkap (RAL)
dengan enam perlakuan dan setiap perlakuan diulang tiga kali.
HASIL DAN PEMBAHASAN
Hasil
Persiapan Bahan dan Pembuatan Simplisia
Bahan yang digunakan adalah daun binahong segar sebanyak 400 gram kemudian setelah proses pengeringan diperoleh daun kering sebanyak 50 gram. Daun kering dihaluskan menjadi serbuk (simplisia) dan diperoleh serbuk kering sebanyak 50 gram.
Ekstraksi
Ekstraksi dilakukan secara maserasi. Ekstrak yang diperoleh berupa ekstrak pekat berwarna cokelat tua dengan bau seperti jamu sebanyak 20 gram. (Lampiran 4).
Skrining Fitokimia
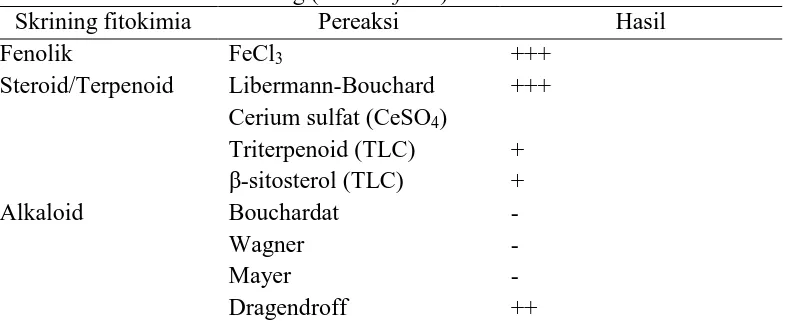
Berdasarkan skrining fitokimia didapatkan hasil bahwa ekstrak mengandung senyawa metabolit sekunder yaitu fenolik, flavonoida, terpenoida/steroida (triterpenoida dan β-sitosterol), alkaloid dan saponin seperti pada Tabel 1 dan hasil skrining fitokimia dapat dilihat pada Gambar 2.
Tabel 1. Hasil skrining fitokimia metabolit sekunder yang terkandung dalam ekstrak daun binahong (A. cordifolia)
Skrining fitokimia Pereaksi Hasil
Fenolik FeCl3 +++
Steroid/Terpenoid Libermann-Bouchard +++ Cerium sulfat (CeSO4)
Triterpenoid (TLC) + β-sitosterol (TLC) +
Alkaloid Bouchardat -
Wagner -
Mayer -
Saponin Aquades-HCl +++
Keterangan :
+ : berubah warna (reaksi positif) berlangsung lama pada penambahan pereaksi tetes pertama.
++ : berubah warna (reaksi positif) berlangsung perlahan-lahan pada penambahan pereaksi pertama kali tetes (diperkirakan 1 tetes = 0,05 ml). +++ : langsung berubah warna (reaksi positif) pada penambahan pereaksi
pertama kali tetes (diperkirakan 1 tetes = 0,05 ml).
Gambar 2. Ekstrak daun binahong yang mengandung senyawa (A) triterpenoid/steroid, (B) saponin, (D) alkaloid, (F) fenolik
Gambar 3. Hasil uji fenolik dan flavonoida menunjukkan adanya senyawa fenolik dan flavonoida ditandai perubahan warna hijau ekstrak asli (A) menjadi warna hitam (B dan C)
Hasil skrining fitokimia steroid/terpenoid (Tabel 1) diperoleh hasil positif terhadap pereaksi Liebermann-Bouchard ditandai dengan adanya perubahan warna biru-kehijauan dan adanya reaksi positif pada pereaksi Liebermann-Bouchard menunjukkan adanya senyawa steroid/terpenoid. Selanjutnya ekstrak di uji dengan metode TLC menggunakan pereaksi CeSO4 1% untuk mengetahui golongan steroid dan terpenoid. Hasil yang diperoleh yaitu positif triterpenoida dan β-sitosterol ditandai dengan adanya perubahan warna pada ekstrak yang menyerupai warna standar triterpenoida dan β-sitosterol seperti pada Gambar 4.
Hasil skrining fitokimia alkaloid (Tabel 1) diperoleh hasil negatif (tidak ada perubahan warna) pada pereaksi Bouchardat, pereaksi Wagner, pereaksi Mayer, tetapi bereaksi positif pada pereaksi Dragendroff ditandai adanya endapan seperti pada Gambar 5A.
Hasil skrining fitokimia saponin (Tabel 1) diperoleh hasil positif ditandai dengan adanya buih stabil selama 10 menit dengan ketinggian 1-10 cm dan buih tidak hilang jika ditambahkan 1 tetes (0,05 ml) HCl 2N. Hasil skrining fitokimia saponin dapat dilihat pada Gambar 5B.
A B
Gambar 5. Hasil skrining fitokimia : (A) alkaloid dengan pereaksi Dragendroff menunjukkan adanya endapan dan (B) saponin menunjukkan adanya buih.
Analisis Kriteria Bakteri Aeromonas hydrophila
Tabel 2. Hasil analisa kriteria bakteri A. hydrophila
Uji Hasil
Pewarnaan Gram Gram negatif, bentuk batang pendek
Uji Motilitas Motil
Uji Oksidase Positif Oksidatif
Uji Oksidatif/Fermentatif Positif O/F
Uji RS Positif RS
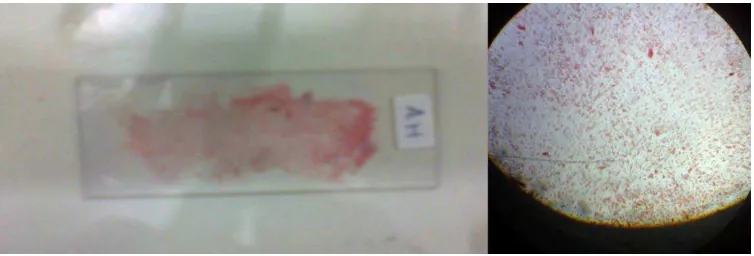
Hasil pewarnaan Gram menunjukkan sifat bakteri Gram negatif ditandai dengan sel bakteri berwarna merah/pink. Hal ini karena bakteri Gram negatif melepaskan warna pertama ungu crystal violet dan mengikat zat warna kedua yaitu safranin (countestain) (Kumala, 2006). Hasil pewarnaan Gram dapat dilihat pada Gambar 6.
Gambar 6. Hasil pewarnaan Gram menunjukkan bakteri Gram negatif dengan
adanya sel bakteri berwarna merah.
Gambar 7. Hasil uji motilitas dan uji O/F menunjukkan reaksi positif pada uji motilitas ditandai tidak terlihat bekas tusukkan (A) dan reaksi fermentatif/oksidatif pada uji O/F ditandai dengan perubahan warna menjadi kuning (B dan C).
Hasil uji oksidase menunjukkan adanya reaksi oksidase positif ditandai dengan adanya warna biru keunguan pada goresan kertas oksidase seperti pada Gambar 8.
Gambar 8. Hasil uji oksidase menunjukkan reaksi positif oksidase ditandai dengan warna biru-keunguan pada goresan di kertas oksidase.
Hasil uji Rimmler-Shoots (RS) menunjukkan hasil positif ditandai dengan adanya pertumbuhan koloni yang berwarna kuning seperti pada Gambar 9.
Gambar 9. Hasil uji RS menunjukkan hasil positif ditandai dengan adanya pertumbuhan koloni bakteri berwarna kuning.
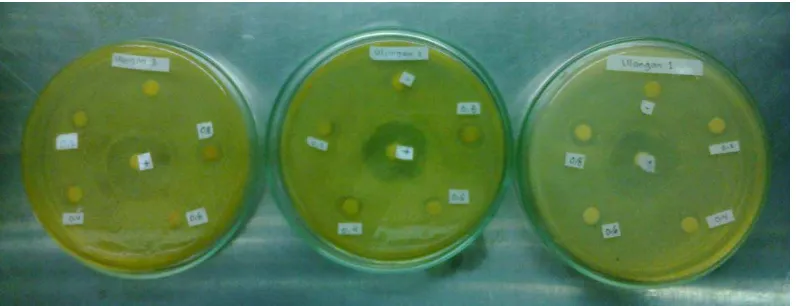
Pengujian Antibakteri
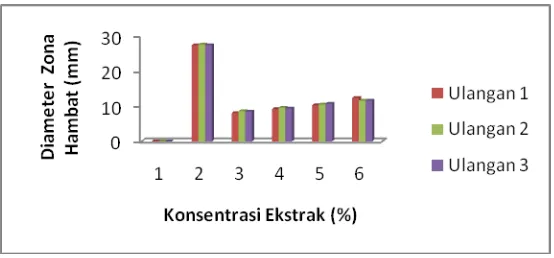
Pengujian antibakteri menggunakan metode difusi disk menggunakan kertas cakram dengan diameter 6 mm. Pengamatan dilakukan setelah masa inkubasi selama 24 jam dan diperoleh hasil sebagai berikut yang terdapat pada Tabel 3 dan Gambar 10.
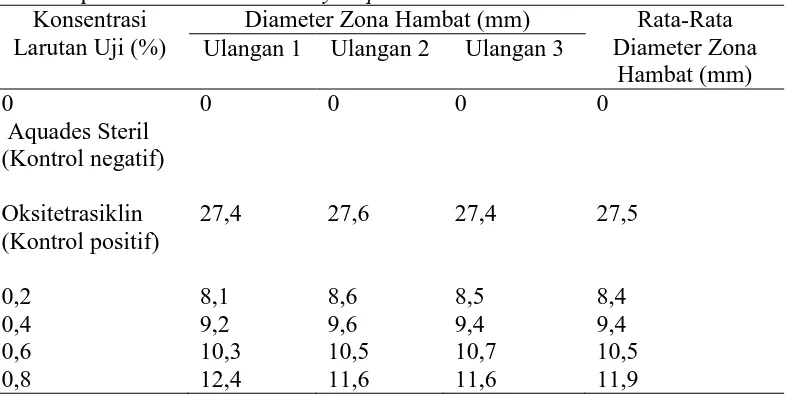
Tabel 3. Hasil pengukuran diameter zona hambat ekstrak daun binahong terhadap pertumbuhan bakteri A. hydrophila
Konsentrasi Larutan Uji (%)
Gambar 10. Hasil zona hambat ekstrak daun binahong terhadap pertumbuhan bakteri A. hydrophila
Pembahasan
Hasil diameter zona hambat yang terbentuk menunjukkan semakin bertambah konsentrasi ekstrak daun binahong yang digunakan, maka kemampuan ekstrak dalam menghambat pertumbuhan bakteri juga semakin meningkat.
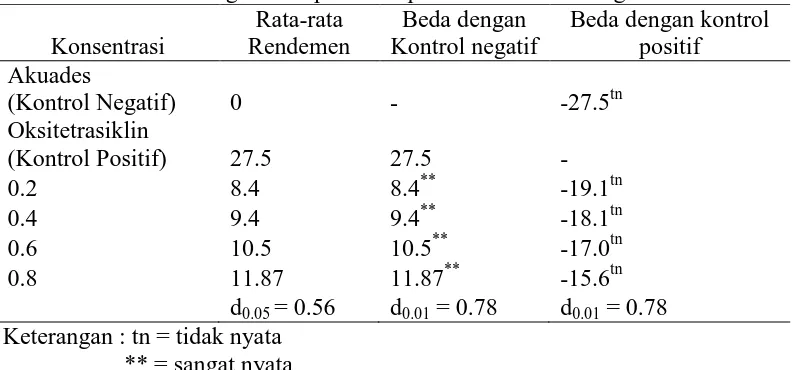
Hasil pengukuran diameter zona hambat ekstrak daun binahong terhadap pertumbuhan bakteri A. hydrophila kemudian dianalisis secara statistik dengan Analisis Sidik Ragam. Hasil analisis dapat dilihat pada Tabel 4.
Tabel 4. Hasil analisis sidik ragam diameter zona hambat ekstrak daun binahong terhadap pertumbuhan bakteri A. hydrophila
Sumber
Keterangan: ** = sangat nyata
Berdasarkan hasil analisis sidik ragam zona hambat ekstrak daun binahong terhadap pertumbuhan bakteri A. hydrophila dapat dinyatakan bahwa konsentrasi ekstrak daun binahong memberikan pengaruh sangat nyata (P > 0,01) terhadap pertumbuhan bakteri A. hydrophila.
berbagai konsentrasi dengan kontrol positif dan kontrol negatif. Hasil perhitungan uji Dunnett dapat dilihat pada Tabel 5.
Tabel 5. Hasil uji Dunnett diameter zona hambat berbagai konsentrasi ekstrak daun binahong terhadap kontrol positif dan kontrol negatif
Konsentrasi
Hasil analisis uji Dunnett menunjukkan bahwa berbagai konsentrasi ekstrak daun binahong ( 0,2 %; 0,4 %; 0,6 %; 0,8%) mempunyai perbedaan yang sangat nyata terhadap kontrol negatif yaitu kertas cakram yang diberi akuades yang dapat dilihat dari semua nilai konsentrasi ekstrak daun binahong (P > 0,01). Sedangkan konsentrasi ekstrak daun binahong ( 0,2 %; 0,4 %; 0,6 %; 0,8%) menunjukkan hasil tidak nyata terhadap kontrol positif yaitu kertas cakram yang
diberi oksitetrasiklin dapat dilihat dari nilai konsentrasi ekstrak daun binahong (P < 0,01).
Flavonoid dapat berperan langsung sebagai antibiotik dengan menggangu fungsi kerja dari mikroorganisme seperti bakteri (Manoi, 2009). Flavonoid yang telah di uji secara in vitro lebih efektif sebagai zat antimikroba terhadap berbagai macam mikroorganisme. Flavonoid lipofilik juga dapat mengganggu membran mikroba (Tsuchiya, dkk, 1996). Menurut Robinson (1991) saponin dapat bekerja sebagai antimikroba. Menurut Murphy (1999) alkaloid merupakan golongan senyawa nitrogen heterosiklik. Alkaloid juga memiliki sifat antibakteri, karena memiliki kemampuan menginterkalasi DNA. Adanya senyawa fenol juga dapat mempengaruhi daya hambat bakteri. Senyawa fenol bekerja dengan cara mendenaturasi protein sel dan merusak dinding sel bakteri tanpa dapat diperbaiki lagi sehingga pertumbuhan bakteri terhambat (Pelczar dan Chan, 1988).
Kertas cakram yang mengandung Oksitetrasiklin digunakan sebagai kontrol positif berfungsi sebagai kontrol bakteri yang di tanam apakah benar terhambat atau tidak dan sebagai pembanding untuk perlakuan lain (Darsana, dkk., 2012). Daerah bening yang terbentuk disekitar kertas cakram menunjukkan bakteri mengalami penghambatan dan zona bening ini menunjukan bahwa pertumbhan bakteri terhambat.
Hasil uji in vitro ekstrak daun binahong terhadap bakteri A. hydrophila menunjukkan bahwa ekstrak daun binahong dapat menghambat pertumbuhan bakteri A. hydrophila penyebab penyakit pada ikan. Hasil penelitian dapat dilihat bahan alami yaitu daun binahong dapat dijadikan alternatif dalam pengobatan ikan karena daun binahong dapat menghambat pertumbuhan bakteri penyebab penyakit ikan secara in vitro.
KESIMPULAN DAN SARAN
Kesimpulan
1. Hasil skrining fitokimia ekstrak daun binahong mengandung senyawa fenolik, flavonoid, triterpenoid, β-sitosterol, alkaloid, dan saponin.
2. Hasil diameter zona hambat pertumbuhan bakteri A. hydrophila dalam berbagai konsentrasi ekstrak yaitu 0 mm (0% kontrol negatif); 8,4 mm (0,2%); 9,4 mm (0,4%); 10,5 mm (0,6%); 11,9 mm (0,8%); 27,5 mm (kontrol positif).
3. Hasil diameter zona hambat menunjukkan bahwa ekstrak daun binahong dapat menghambat pertumbuhan A. hydrophila penyebab penyakit Motile
Aeromonads Septicaemia (MAS) secara in vitro.
4. Daun binahong (A. cordifolia) dapat digunakan sebagai satu diantara bahan alami untuk pengobatan penyakit ikan karena mengandung senyawa
metabolit sekunder yang dapat menghambat pertumbuhan bakteri
A. hydrophila.
Saran
TINJAUAN PUSTAKA
Tanaman Binahong (Anredera cordifolia (Ten.) Steenis)
Tanaman ini berasal dari dataran Cina dengan nama asalnya adalah Dheng shan chi, di Inggris disebut madeira vine. Sinonim Boussingaulatia gracilis
Miers. Boussingaultia cordifolia Boussingaultia basselloides. Tanaman
binahong (A. cordifolia) termasuk dalam famili Basellaceae merupakan salah satu tanaman obat yang mempunyai potensi besar ke depan untuk diteliti, karena dari
tanaman ini masih banyak yang perlu diteliti sebagai bahan fitofarmaka (Manoi, 2009).
Tanaman ini menyebar ke Asia Tenggara. Di negara Eropa maupun Amerika, tanaman ini cukup dikenal, tetapi para ahli disana belum tertarik untuk meneliti serius dan mendalam, padahal beragam khasiat sebagai obat telah diakui. Di Indonesia tanaman ini dikenal sebagai gendola yang sering digunakan sebagai gapura yang melingkar di atas jalan taman. Tanaman merambat ini perlu dikembangkan dan diteliti lebih jauh. Terutama untuk mengungkapkan khasiat dari bahan aktif yang dikandungnya (Manoi, 2009).
Hampir semua bagian tanaman binahong seperti umbi, batang, bunga dan daun dapat digunakan dalam terapi herbal. Tanaman ini memang tumbuh baik dalam lingkungan yang dingin dan lembab (Shabella, 2012).
Taksonomi Tanaman Binahong
Divisi : Magnoliophyta Kelas : Magnoliopsida Ordo : Caryphyllales Famili : Basellaceae Genus : Anredera
Spesies: Anredera cordifolia (Ten.) Steenis
Daun Binahong
Daun binahong adalah jenis tanaman yang sangat berkhasiat untuk menyembuhkan beberapa penyakit. Beberapa lembar daun ini dikunyah hingga halus atau dimasak dengan segelas air dan diminum beserta ampasnya atau lebih mudah di jus atau diblender. Adapun khasiat dari daun binahong dapat dimanfaatkan untuk pengobatan berbagai jenis penyakit seperti batuk/muntah darah, paru-paru/bolong, diabetes, sesak nafas, borok akut (menahun), patah tulang, darah rendah, radang ginjal, gatal-gatal/eksim kulit, geger otak ringan/berat, disentri/buang air besar, ambeien berdarah, hidung mimisan, luka pasca bedah/operasi, luka bakar, kecelakaan/cedera benda tajam, jerawat, usus bengkak, gusi berdarah, kurang nafsu makan, haid tidak lancar, penyembuhan pasca bersalin/melahirkan, menjaga stamina tubuh, penghangat badan, lemah syahwat, kanker dan lain sebagainya (Shabella, 2012).
Kandungan Senyawa Kimia pada Tanaman Binahong
pelarut akuades, etanol dan metanol pada sampel umbi, daun dan batang binahong mengungkapkan adanya zat obat aktif saponin triterpenoid, steroid, glikosida dan alkaloid. Dengan tes skrining saponin dari sampel segar dan kering tanaman binahong, semua sampel diperoleh senyawa saponin yang positif, dengan
menunjukkan hasil stabil persisten saponin dari sampel segar dan kering. Manoi (2009) menyatakan tanaman ini dikenal dengan sebutan Madeira Vine
dipercaya memiliki kandungan antioksidan tinggi dan antivirus.
Setiaji (2009) yang telah melakukan ekstraksi rhizoma binahong menggunakan pelarut petroleum eter, etil asetat dan etanol 70% diperoleh senyawa alkaloid, flavonoid, dan saponin. Sedangkan pada uji kromatografi lapis tipis (KLT) ekstrak petroleum eter diperoleh saponin, ekstrak etil asetat diperoleh alkaloid, saponin, flavonoid, dan polifenol sedangkan ekstrak etanol 70% diperoleh alkaloid, saponin, dan flavonoid.
Selawa, dkk., (2013) juga telah melakukan penelitian tentang ekstraksi pada sampel segar dan serbuk kering daun binahong menggunakan pelarut etanol diperoleh senyawa flavonoid dan jenis flavonoid yang diperoleh dari hasil isolasi dan identifikasi serbuk segar dan serbuk kering ekstrak etanol daun binahong ialah flavonol. Ekstrak etanol daun binahong juga diperoleh senyawa antioksidan dimana antioksidan sampel segar lebih besar dari sampel kering.
Senyawa Antibakteri Pada Tanaman Binahong
Flavonoid
menggangu fungsi kerja dari mikroorganisme seperti bakteri dan virus (Manoi, 2009).
Terpenoid
Terpenoid adalah senyawa alam yang terbentuk dengan proses biosintesis, terdistribusi luas dalam dunia tumbuhan dan hewan (Sirait, 2007). Senyawa terpenoid adalah senyawa hidrokarbon isometrik membantu tubuh dalam proses sintesa organik dan pemulihan sel-sel tubuh (Manoi, 2009).
Alkaloid
Alkaloid adalah senyawa kimia tanaman hasil metabolit sekunder yang terbentuk berdasarkan prinsip pembentukan campuran. Pada daun tempat proses fotosintesis terjadi dapat dibuat alkaloid. Selain pada daun, alkaloid juga terdapat pada kuncup muda, akar dan juga pada getah (Sirait, 2007). Alkaloid adalah bahan organik yang mengandung nitrogen sebagai bagian dari sistem heterosiklik. Alkaloid memiliki aktivitas hipoglikemik (Manoi, 2007).
Saponin
Saponin adalah senyawa aktif permukaan yang kuat yang menimbulkan
mempunyai sifat sebagai antioksidan, antivirus dan anti karsinogenik (Manoi, 2009).
Uji Antibakteri
Antibakteri
Antibakteri adalah antimikroba yang dapat menghambat pertumbuhan bakteri. Pengertian antimikroba secara umum adalah zat yang dapat menghambat pertumbuhan mikroba, dan digunakan untuk kepentingan pengobatan infeksi pada manusia dan hewan (Gan, dkk., 1980).
Aktivitas antibakteri ditentukan oleh spektrum kerja (spektrum kerja luas, spektrum kerja sempit), cara kerja (bakterisid atau bakteriostatik) dan ditentukan juga oleh konsentrasi minimum inhibisi (KMI) serta potensi pada KMI. Suatu antibakteri dikatakan mempunyai aktivitas yang tinggi bila KMI terjadi pada kadar antibiotik yang rendah tetapi mempunyai daya bunuh atau daya hambat yang besar (Wattimena, dkk., 1991).
Zat-zat yang dapat membunuh atau menghambat pertumbuhan bakteri dapat dibagi atas garam-garam logam, fenol dan senyawa-senyawa lain yang sejenis, formaldehida, alkohol, yodium, klor dan persenyawaan klor, zat warna, deterjen, sulfonamide dan antibiotika (Dwidjoseputro, 1978).
Bakteri Uji
antara 0,3-0,5 mikron. Bentuknya berbeda menurut genusnya. Ciri-ciri bakteri adalah sifatnya yang dapat tumbuh dan bertambah banyak dalam kelompok, berbentuk rantai atau benang, memiliki koloni yang berwarna dan berkilau atau tidak, halus atau kasar, metabolism aerob atau anaerob dan membutuhkan media tertentu untuk mengkultur disertai dengan menghasilkan asam atau gas. Kebanyakan bakteri patogen ikan termasuk golongan Gram negatif, seperti Aeromonas, Vibrio, dan Flexibacter (Ghufran dan Kordi, 2004).
Aeromonas hydrophila
Aeromonas hydrophila merupakan bakteri Gram negatif, berbentuk batang,
motil, merupakan agen penyebab hemoragik septicemia Bacterial Hemorrhagic
Septicemia (BHS) atau Motile Aeromonas Septicaemia (MAS) pada beragam
spesies ikan air tawar. A. hydrophila merupakan bakteri patogen pada ikan budidaya air tawar seperti pada ikan lele (Clarias batrachus) ikan mas (Cyprinus
carpio) ikan gurami (Osphronemus gouramy) dan ikan nila (Oreochromis niloticus) (Irianto, 2005).
Bakteri Aeromonas umumnya hidup di air tawar yang mengandung bahan organik tinggi. Ciri utama bakteri Aeromonas adalah bentuknya seperti batang, ukurannya 1-4 x 0,4-1 mikron, bersifat gram negatif, fakultatitf aerobik (dapat hidup dengan atau tanpa oksigen), tidak berspora, bersifat motil (bergerak aktif) karena mempunyai satu flagel (monotrichous flagella) yang keluar dari salah satu kutubnya, senang hidup di lingkungan bersuhu 15-30oC dan pH antara 5,5-9 (Ghufran dan Kordi, 2004).
pemeliharaan dengan padat tebaran tinggi. Umumnya penyebaran terjadi secara
horizontal lewat kontak langsung dengan air atau hewan yang sakit (Irianto, 2005).
Bakteri Aeromonas menyerang hampir semua jenis ikan air tawar dan ikan kakap putih yang dipelihara ditambak bersalinitas rendah. Kerugian yang ditimbulkannya sangat besar, sebab dalam waktu relatif singkat puluhan ton ikan mati secara massal, baik ukuran benih maupun induk. Serangan bakteri ini bersifat laten (berkepanjangan). Serangan bakteri ini baru terlihat apabila ketahanan tubuh ikan menurun akibat stress yang disebabkan oleh penurunan kualitas air,
kekurangan pakan atau penanganan ikan yang kurang baik (Ghufran dan Kordi, 2004).
Motile Aeromonads Septicaemia (MAS)
Penyakit bercak merah atau septicemia haemorahagica disebabkan oleh bakteri Aeromonas sp. Bakteri Aeromonas termasuk ke dalam famili Pseudomonadaceae yang terdiri atas tiga spesies utama, yaitu Aeromonas
punctata, A. hydrophila, dan A. liquiefacieus yang bersifat patogen
(Ghufran dan Kordi, 2004).
Tanda-tanda klinis infeksi A. hydrophila bervariasi, tetapi umumnya ditunjukkan adanya hemoragik pada kulit, insang, rongga mulut dan borok pada kulit yang dapat meluas ke jaringan otot. Sering pula tanda-tanda klinis ditunjukan
Ikan yang terserang penyakit ini biasanya memperlihatkan gejala-gejala seperti warna tubuh ikan menjadi gelap, kemampuan berenang menurun, mata ikan rusak dan agak menonjol, sisik terkelupas, seluruh siripnya rusak, insang berwarna merah keputihan, ikan terlihat megap-megap dipermukaan air, insangnya rusak sehingga sulit bernapas, kulit ikan menjadi kasat dan timbul pendarahan yang selanjutnya diikuti dengan luka-luka borok-borok, perut ikan kembung (dropsi), dan apabila dilakukan pembedahan maka akan kelihatan pendarahan pada hati, ginjal, dan limpa (Ghufran dan Kordi, 2004).
Beberapa Bahan Alami yang dapat Digunakan dalam Pengendalian Bakteri
Aeromonas hydrophila
Wardiyanto, dkk (2008) yang telah melakukan penelitian menggunakan ekstrak daun papaya (Carica papaya L) dalam menghambat A. hydrophila pada ikan mas. Uji yang dilakukan dalam penelitian ini memperoleh hasil yaitu ekstrak daun pepaya dapat menghambat bakteri A. hydrophila pada konsentrasi tertentu karena ekstrak daun pepaya mengandung senyawa yang bersifat antimikroba yaitu flavonoid, alkaloid, dan saponin.
Muslim, dkk (2010) yang telah melakukan penelitian tentang ekstrak bawang putih dalam mengobati benih ikan patin siam yang diinfeksi bakteri A.
hydrophila. Konsentrasi ekstrak bawang putih yang digunakan adalah 0 %
Sutama (2002) yang telah melakukan penelitian menggunakan ekstrak daun jambu biji, sambiloto, dan daun sirih untuk mengendalikan infeksi A.
hydrophila pada ikan lele dumbo. Dari penelitian ini diperoleh hasil bahwa pakan
PENDAHULUAN
Latar Belakang
Melihat potensi perairan dan sumber daya manusia serta sumber daya ikan yang ada dan untuk menjaga kelestarian sumberdaya perikanan serta memenuhi kebutuhan manusia akan produk perikanan, maka budidaya ikan di Indonesia merupakan slah stu usaha yang dapat dilakukan, baik untuk memenuhi kebutuhan konsumsi dalam negeri maupun untuk ekspor. Budidaya ikan biasanya dilakukan pada kolam-kolam, tambak ataupun keramba jaring apung. Budidaya ikan juga mengalami bebera masalah. Masalah yang sering terjadi dalam proses budidaya ikan terbesar adalah terjadinya serangan penyakit (Ghufran dan Kordi, 2004).
Satu diantara beberapa penyakit yang sering menyebabkan kematian ikan adalah penyakit Motile Aeromonads Septicaemia (MAS) yang disebabkan oleh infeksi bakteri A. hydrophila. Bakteri A. hydrophila adalah bakteri penyebab penyakit pada ikan, umumnya hidup di air tawar yang mengandung bahan organik tinggi (Aoki, 1999).
Penggunaan bahan-bahan kimia dianggap sangat praktis, efektif, dan murah. Tetapi perlu diingat, karena obat-obatan kebanyakan tidak spesifik dan dapat menimbulkan strain bakteri yang resisten dan menimbulkan pencemaran lingkungan. Sebab kesalahan pengobatan, selain dapat merusak lingkungan perairan juga dapat membuat beberapa jenis penyakit menjadi kebal terhadap
pengobatan serta ikan-ikan budidaya mudah mengalami kematian (Ghufran dan Kordi, 2004).
Penggunaan bahan-bahan alami untuk mengendalikan penyakit yang menyerang ikan perlu ditingkatkan untuk menggantikan bahan-bahan kimia yang dapat mengakibatkan pencemaran lingkungan. Satu diantara beberapa bahan-bahan alami yang dapat digunakan untuk pengendalian penyakit ikan yaitu daun binahong. Tanaman binahong (A. cordifolia) adalah tanaman obat potensial yang dapat mengatasi berbagai jenis penyakit. Manfaat tanaman ini sangat besar dalam dunia pengobatan, secara empiris binahong dapat menyembuhkan berbagai jenis penyakit. Bagian tanaman binahong yang dapat digunakan sebagai obat berasal dari akar, batang, daun, dan bunga maupun umbi (Manoi, 2009).
Penggunaan bahan-bahan kimia sebagai pengobatan penyakit ikan yang dapat menyebabkan dampak negatif seperti pencemaran limgkungan dapat digunakan alternative pengobatan dengan bahan-bahan alami. Berdasarkan hal
tersebut maka dilakukan penelitian untuk melihat apakah daun binahong (A. cordifolia) dapat digunakan untuk menghambat pertumbuhan bakteri
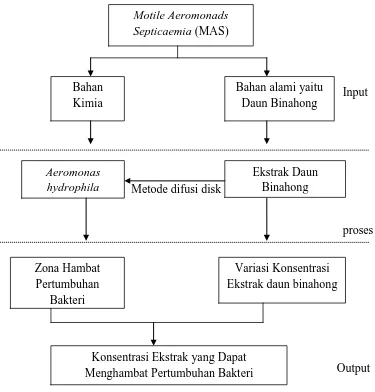
Kerangka Pikir Penelitian
Berdasarkan latar belakang penelitian, penyakit ikan merupakan masalah yang sering dihadapi dalam usaha budidaya ikan dan penggunaan bahan-bahan kimia untuk menanggulangi penyakit dapat menyebabkan resistensi penyakit terhadap bahan-bahan kimia tersebut. Oleh karena itu diperlukan alternatif pengobatan dengan menggunakan bahan-bahan alami salah satunya adalah daun binahong. Satu diantara khasiat daun binahong adalah dapat digunakan sebagai obat berbagai macam penyakit. Selain itu terdapat golongan senyawa metabolit sekunder yang telah diteliti dari daun binahong antara lain saponin, terpenoid, steroid, glikosida, alkaloid yang berdasarkan penelitian-penelitian sebelumnya diketahui besifat antibakteri (Astuti, dkk., 2011).
Pengujian fitokimia dilakukan terhadap golongan senyawa metabolit sekunder seperti saponin, tanin, steroida/terpenoida, glikosida, alkaloida, flavonoida. Pengujian fitokimia dilakukan untuk mendeteksi golongan senyawa metabolit sekunder yang terkandung di dalam tumbuhan sehingga dapat menjadi informasi awal untuk mengetahui senyawa kimia apa yang mempunyai aktivitas antibakteri dari tumbuhan tersebut.
Pengujian antibakteri dilakukan dengan metode difusi disk dengan menggunakan kertas cakram yang mengandung ekstrak akan diletakkan langsung diatas media agar yang mengandung bakteri uji. Pengujian antibakteri dilakukan terhadap bakteri Gram negatif A. hydrophila. Aktivitas antibakteri dapat dilihat dengan mengukur daerah bening disekitar kertas cakram. Bagan alir kerangka pikir penelitian dapat dilihat pada Gambar 1.
Input
Metode difusi disk
proses
Output
Gambar 1. Bagan alir kerangka pikir penelitian
Perumusan Masalah
Uraian diatas dapat dirumuskan beberapa permasalahan sebagai berikut : 1. Apakah golongan senyawa metabolit sekunder yang terkandung didalam
daun binahong (A. cordifolia) yang bersifat antibakteri?
2. Apakah senyawa metabolit sekunder dalam ekstrak daun binahong (A. cordifolia) memiliki aktivitas antibakteri dalam menghambat
pertumbuhan A. hydrophila ?
Tujuan Penelitian
Tujuan dari penelitian ini adalah :
a. Untuk mengetahui golongan senyawa metabolit sekunder yang terkandung di daun binahong (A. cordifolia) yang mempunyai aktivitas sebagai antibakteri.
b. Untuk mengetahui efektivitas antibakteri ekstrak daun binahong (A. cordifolia) dalam mengahambat pertumbuhan bakteri A. hydrophila
secara in vitro.
Manfaat Penelitian
Hipotesis Penelitian
ABSTRACT
PRITA YULIANTI ANASTA BR GINTING. Phytochemical Screening of Secondary Metabolite in Binahong Leaves (Anredera cordifolia (Ten.) Steenis) to Test In Vitro Inhibitation Growth of Aeromonas hydrophila. Supervised by MOHAMMAD BASYUNI and INDRA LESMANA.
Binahong leaves are one of natural product to be used to treat the disease of living organisme due to having secondary metabolite to show antibacterial activity. The purpose of this research was to study secondary metabolite of Binahong leaves of which showing antibacterial, to analysis effectivity of antibacterial Binahong leaves extract to inhibit growth of bacteria Aeromonas
hydrophila.
An experimental laboratory with six treatments and three replications for
in vitro was tested. A paper disc soaked in a solution of Binahong leaves extract
was used for in vitro at a concentration of 0% (w/v); 0,2%; 0,4%; 0,6%; 0,8%; positive control (Oxytetracycline), then placed on a Tryptose Soya Agar (TSA) medium containing bacteria A. hydrophila and then incubated at 37oC for 24 hours.
In vitro test showed that Binahong leaves extract inhibited the growth of
bacteria A. hydrophila with a inhibition area around the paper disc. The increase concentration of Binahong leaves extract enhanced the growth inhibition area. Phytochemical screening of Binahong leaves extract showed that the extracts contained flavonoid, phenol, saponin, alkaloid, triterpenoid and β-sitosterol.
ABSTRAK
PRITA YULIANTI ANASTA BR GINTING. Skrining Fitokimia Metabolit Sekunder Pada Daun Binahong (Anredera cordifolia (Ten) Steenis) untuk Uji In
Vitro Daya Hambat Pertumbuhan Aeromonas hydrophila. Dibimbing oleh
MOHAMMAD BASYUNI dan INDRA LESMANA.
Daun Binahong merupakan satu diantara bahan alami yang dapat digunakan untuk mengatasi penyakit pada makhluk hidup karena memiliki senyawa metabolit sekunder yang bersifat antibakteri. Tujuan penelitian ini adalah mengetahui senyawa metabolit sekunder dalam daun binahong yang bersifat antibakteri, untuk mengetahui efektivitas antibakteri ekstrak daun binahong dalam menghambat pertumbuhan bakteri Aeromonas hydrophila.
Metode penelitian yang digunakan adalah eksperimen di laboratorium dengan enam perlakuan dan tiga ulangan secara in vitro. Perlakuan uji in vitro menggunakan metode difusi disk dengan cara kertas cakram direndam dalam larutan ekstrak daun binahong pada konsentrasi 0% (b/v); 0,2%; 0,4%; 0,6%; 0,8%; kontrol positif (Oksitetrasiklin), kemudian diletakkan pada media Tryptose
Soya Agar (TSA) yang telah disebar bakteri A. hydrophila lalu diinkubasi pada
suhu 37oC selama 24 jam.
Hasil uji in vitro menunjukkan ekstrak daun binahong mampu menghambat pertumbuhan bakteri A. hydrophila ditunjukkan adanya daerah bening disekitar kertas cakram. Diameter daerah bening yang terbentuk yaitu 0 mm (0% kontrol negatif); 8,4 mm (0,2%); 9,4 mm (0,4%); 10,5 mm (0,6%); 11,9 mm (0,8%); 27,5 mm (kontrol positif). Peningkatan konsentrasi ekstrak daun binahong menunjukkan pertambahan daerah bening. Hasil skrining fitokimia ekstrak daun binahong menunjukkan bahwa ekstrak mengandung flavonoid, fenolik, saponin, alkaloid, triterpenoid, β -sitosterol.
SKRINING FITOKIMIA METABOLIT SEKUNDER PADA
DAUN BINAHONG (Anredera cordifolia (Ten) Steenis) UNTUK
UJI IN VITRO DAYA HAMBAT PERTUMBUHAN
Aeromonas hydrophila
SKRIPSI
Oleh:
PRITA YULIANTI ANASTA BR. GINTING 090302044
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
SKRINING FITOKIMIA METABOLIT SEKUNDER PADA
DAUN BINAHONG (Anredera cordifolia (Ten) Steenis) UNTUK
UJI IN VITRO DAYA HAMBAT PERTUMBUHAN
Aeromonas hydrophila
SKRIPSI
Oleh:
PRITA YULIANTI ANASTA BR. GINTING 090302044
Skripsi sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana di Fakultas Pertanian Universitas Sumatera Utara
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
LEMBAR PENGESAHAN
Judul Hasil Penelitian : Skrining Fitokimia Metabolit Sekunder Dalam Daun Binahong (Anredera cordifolia (Ten) Steenis) Untuk Uji In Vitro Daya Hambat Pertumbuhan Aeromonas
hydrophila
Nama Mahasiswa : Prita Yulianti Anasta Br. Ginting
NIM : 090302044
Program Studi : Manajemen Sumberdaya Perairan
Disetujui oleh Komisi Pembimbing
Mohammad Basyuni, S.Hut, M.Si, Ph.D Indra Lesmana, S.Pi., M.Si
Ketua Anggota
Mengetahui,
Dr. Ir. Yunasfi, M.Si
ABSTRACT
PRITA YULIANTI ANASTA BR GINTING. Phytochemical Screening of Secondary Metabolite in Binahong Leaves (Anredera cordifolia (Ten.) Steenis) to Test In Vitro Inhibitation Growth of Aeromonas hydrophila. Supervised by MOHAMMAD BASYUNI and INDRA LESMANA.
Binahong leaves are one of natural product to be used to treat the disease of living organisme due to having secondary metabolite to show antibacterial activity. The purpose of this research was to study secondary metabolite of Binahong leaves of which showing antibacterial, to analysis effectivity of antibacterial Binahong leaves extract to inhibit growth of bacteria Aeromonas
hydrophila.
An experimental laboratory with six treatments and three replications for
in vitro was tested. A paper disc soaked in a solution of Binahong leaves extract
was used for in vitro at a concentration of 0% (w/v); 0,2%; 0,4%; 0,6%; 0,8%; positive control (Oxytetracycline), then placed on a Tryptose Soya Agar (TSA) medium containing bacteria A. hydrophila and then incubated at 37oC for 24 hours.
In vitro test showed that Binahong leaves extract inhibited the growth of
bacteria A. hydrophila with a inhibition area around the paper disc. The increase concentration of Binahong leaves extract enhanced the growth inhibition area. Phytochemical screening of Binahong leaves extract showed that the extracts contained flavonoid, phenol, saponin, alkaloid, triterpenoid and β-sitosterol.
ABSTRAK
PRITA YULIANTI ANASTA BR GINTING. Skrining Fitokimia Metabolit Sekunder Pada Daun Binahong (Anredera cordifolia (Ten) Steenis) untuk Uji In
Vitro Daya Hambat Pertumbuhan Aeromonas hydrophila. Dibimbing oleh
MOHAMMAD BASYUNI dan INDRA LESMANA.
Daun Binahong merupakan satu diantara bahan alami yang dapat digunakan untuk mengatasi penyakit pada makhluk hidup karena memiliki senyawa metabolit sekunder yang bersifat antibakteri. Tujuan penelitian ini adalah mengetahui senyawa metabolit sekunder dalam daun binahong yang bersifat antibakteri, untuk mengetahui efektivitas antibakteri ekstrak daun binahong dalam menghambat pertumbuhan bakteri Aeromonas hydrophila.
Metode penelitian yang digunakan adalah eksperimen di laboratorium dengan enam perlakuan dan tiga ulangan secara in vitro. Perlakuan uji in vitro menggunakan metode difusi disk dengan cara kertas cakram direndam dalam larutan ekstrak daun binahong pada konsentrasi 0% (b/v); 0,2%; 0,4%; 0,6%; 0,8%; kontrol positif (Oksitetrasiklin), kemudian diletakkan pada media Tryptose
Soya Agar (TSA) yang telah disebar bakteri A. hydrophila lalu diinkubasi pada
suhu 37oC selama 24 jam.
Hasil uji in vitro menunjukkan ekstrak daun binahong mampu menghambat pertumbuhan bakteri A. hydrophila ditunjukkan adanya daerah bening disekitar kertas cakram. Diameter daerah bening yang terbentuk yaitu 0 mm (0% kontrol negatif); 8,4 mm (0,2%); 9,4 mm (0,4%); 10,5 mm (0,6%); 11,9 mm (0,8%); 27,5 mm (kontrol positif). Peningkatan konsentrasi ekstrak daun binahong menunjukkan pertambahan daerah bening. Hasil skrining fitokimia ekstrak daun binahong menunjukkan bahwa ekstrak mengandung flavonoid, fenolik, saponin, alkaloid, triterpenoid, β -sitosterol.
RIWAYAT HIDUP
Penulis dilahirkan di Medan pada tanggal 31 Juli 1991 dari ayahanda Rasta Ginting dan ibunda Rr. Ekotina Saptapramanti. Penulis merupakan anak pertama dari tiga bersaudara. Tahun 2009 penulis lulus dari SMU Negeri 15 Medan dan pada tahun yang sama lulus seleksi masuk Universitas Sumatera Utara (USU) melalui jalur Seleksi penerimaan mahasiswa baru program studi baru (SPMPSB) pada Program Studi Manajemen Sumberdaya Perairan, Fakultas Pertanian.
Penulis pernah mengikuti kegiatan Praktek Kerja Lapangan di Balai Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas 1 Medan 1 selama periode Juli sampai dengan Agustus 2012.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT kerena berkat rahmat dan karunia-Nya, skripsi ini dapat diselesaikan. Adapun judul dari penelitian ini yaitu “Skrining Fitokimia Metabolit Sekunder pada Daun Binahong (Anredera cordifolia (Ten) Steenis) untuk Uji In Vitro Daya Hambat Pertumbuhan
Aeromonas hydrophila”. Skripsi ini ditulis sebagai satu diantara beberapa syarat
untuk melaksanakan sidang meja hijau dan untuk mendapatkan gelar sarjana perikanan pada program studi Manajemen Sumberdaya Perairan, Fakultas Pertanian, Universitas Sumatera Utara. Pada kesempatan ini penulis mengucapkan terima kasih kepada :
1. Ayahanda Rasta Ginting dan ibunda Rr. Ekotina Saptapramanti serta adik-adik yang senantiasa memberikan kasih sayang, dukungan dan doa.
2. Bapak Mohammad Basyuni, S.Hut, M.Si, Ph.D selaku ketua komisi pembimbing skripsi dan Bapak Indra Lesmana, S.Pi, M.Si selaku anggota komisi pembimbing skripsi yang telah banyak memberikan arahan dan bimbingan kepada penulis dalam menyelesaikan skripsi ini.
3. Bapak Dr. Ir. Yunasfi, M.Si selaku Ketua Program Studi Manajemen Sumberdaya Perairan, serta semua dosen dan pegawai program studi Manajemen Sumberdaya Perairan.
Penulis menyadari bahwa hasil penelitian ini masih jauh dari kesempurnaan, sehingga penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan penulisan hasil penelitian ini.
DAFTAR ISI
Tanaman Binahong (Andera cordifolia (Ten) Steenis ... 7
Kalsifikasi Tanaman Binahong ... 8
Daun Binahong ... 8
METODE PENELITIAN ... 16
Waktu dan Lokasi Penelitian ... 16
Bahan dan Alat ... 16
Pelaksanaan Penelitian ... 17
Persiapan Sampel dan Pembuatan Simplisia ... 17
Pembuatan Ekstrak Daun Binahong ... 18
Pengujian Fitokimia ... 19
Pengujian Saponin ... 19
Pengujian Steroida/Terpenoida ... 19
Pengujian Alkaloida ... 20
Pengujian Flavonoida ... 20
Sterilisasi Alat ... 20
Pembuatan Konsentrasi Larutan Uji ... 25
Pengujian Antibakteri ... 25
Parameter yang Diamati ... 26
Pengamatan Zona Hambat Pertumbuhan Bakteri ... 27
Pengumpulan Data ... 27
Analisis Data ... 27
HASIL DAN PEMBAHASAN ... 28
Hasil ... 28
Persiapan Bahan dan Pembuatan Simplisia ... 28
DAFTAR TABEL
No. Halaman
1. Hasil skrining fitokimia metabolit sekunder yang terkandung
dalam ekstrak daun binahong (A. cordifolia) ... 28 2. Hasil analisis kriteria bakteri A. hydrophila ... 32 3. Hasil pengukuran diameter zona hambat ekstrak daun binahong
terhadap pertumbuhan bakteri A. hydrophila ... 34 4. Hasil analisis sidik ragam diameter zona hambat ekstrak
daun binahong terhadap pertumbuhan bakteri A. hydrophila ... 36 5. Hasil uji Dunnett diameter zona hambat berbagai konsentrasi
DAFTAR GAMBAR
No. Halaman
1. Bagan Alir Kerangka Pemikiran ... 12
2. Ekstrak daun binahong yang mengandung senyawa triterpenoid/ saponin, alkaloid, fenolik ... 29
3. Hasil Uji fenolik dan flavonoida ... 30
4. Hasil Uji Thin Layer Cromatography (TLC) ... 30
5. Hasil skrining fitokimia alkaloid dan saponin ... 31
6. Hasil pewarnaan Gram ... 32
7. Hasil uji motilitas dan Uji O/F ... 33
8. Hasil uji oksidase ... 33
9. Hasil uji RS ... 34
DAFTAR LAMPIRAN
No. Halaman
1. Bahan-bahan dalam penelitian ... 44
2. Alat-alat dalam penelitian ... 46
3. Persiapan bahan dan pembuatan simplisia ... 48
4. Ekstraksi ... 50
5. Skrining fitokimia ... 51
6. Analisis kriteria bakteri ... 52
7. Pembuatan media agar miring dan media dasar ... 53
8. Peremajaan bakteri ... 54
9. Pembuatan suspensi bakteri ... 55
10. Pembuatan larutan uji ... 56