Penatalaksanaan Varises Esophagus pada Sirosis Hati Gontar Alamsyah Siregar
Divisi Gastroentero-Hepatologi, Departemen Imu Penyakit Dalam, Fakultas Kedokteran Universitas Sumatera Utara/ RSUP H. Adam Malik Medan
Pendahuluan
Varises esofagus merupakan kolateral portosistemik yang terbentuk setelah adanya dilatasi saluran pembuluh darah vena mulai dari distal esofagus akibat hipertensi portal. Varises esofagus sering terjadi pada 2 – 5 cm distal dari esofagus.1 Penderita sirosis hati yang memiliki varises esofagus yang besar akibat hipertensi portal beresiko 25 % - 35 % mengalami perdarahan serta 15 % - 20 % beresiko kematian pada setiap episode perdarahan. Tingkat kematian bergantung kepada keadaan umum pasien dan beratnya perdarahan.2
Epidemiologi
Varises dan perdarahan varises merupakan komplikasi sirosis yang diakibatkan langsung dari hipertensi portal. Pasien dengan sirosis dan varises gastroeseofageal memiliki nilai HVPG setidaknya 10 – 12 mmHg. Varises gastroesofageal tampak pada sekitar 50% pasien sirosis.3 Pada saat sirosis pertama kali didiagnosis, varises tampak pada 30 – 40% pasien stadium kompensata dan pada 60% pasien stadium dekompensata.4 Pada pasien sirosis tanpa varises saat pemeriksaan endoskopi pertama kali, insidensi tahunan terbentuknya varises yang baru rata – rata 7% (berkisar antara 5 – 10% per tahun).5,6,7 Setelah terbentuknya varises, ukuran varises akan bertambah dari kecil sampai besar sebelum akhirnya ruptur dan berdarah. Progresi dari varises ukuran kecil hingga menjadi besar masih kontroversial, namun menunjukkan angka laju progresi varises yang berkisar antara 5 – 30% per tahun.5,6,7,8 Perdarahan varises pertama memiliki angka insidensi sekitar 4% per tahun, dan resiko ini meningkat menjadi 15% per tahun pada pasien dengan varises ukuran medium sampai besar. Insidensi perdarahan ulang berkisar antara 30 – 40% pada 6 minggu pertama.7
Patofisiologi
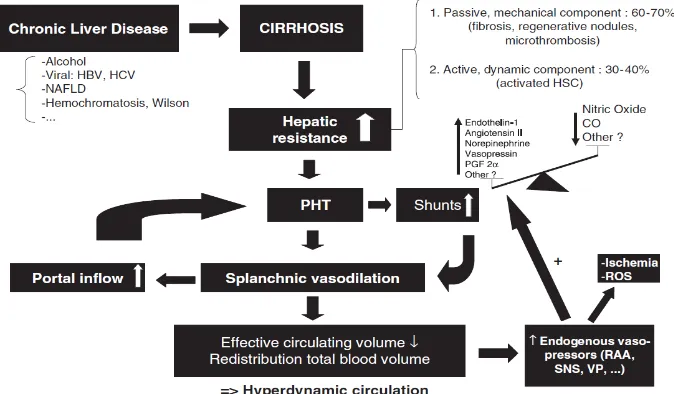
Pada sirosis, hipertensi portal terinisiasi melalui peningkatan resistensi vaskular intrahepatik dan kemudian diperberat oleh perubahan pada sirkulasi sistemik dan splanik yang meningkatkan aliran portal. Peningkatan resistensi vaskular intrahepatik tidak hanya disebabkan oleh faktor mekanikal (seperti : jaringan fibrosis dan nodul - nodul regeneratif yang mendistorsi arsitektur pembuluh darah hepar), tetapi juga oleh komponen dinamis reversibel yang dimediasi oleh peningkatan tonus vaskular disebabkan oleh kontraksi aktif miofibrolast di sekitar sinusoid hepatik dan dalam septa fibrous. Komponen dinamik ini (menyumbang sekitar 30% pada peningkatan resistensi vaskular intrahepatik) menggambarkan gangguan fungsional dari sirkulasi hepar akibat dari peningkatan produksi vasokonstriktor (contoh : endotelin – 1, norepinephrin, angiotensin II, leukotriene, tromboxane A2) dan penurunan pelepasan vasodilator endogen (terutama NO / nitric oxide).10,11,12,13 Sel stelata memiliki sifat kontraktil yang dapat dimodulasi oleh substansi vasoaktif antara lain NO dan endothelin yang dapat meningkatkan resitensi intrahepatik dan aliran darah tertutama pada sinusoidal.14 Angiogenesis juga telah menunjukkan pengaruh terhadap hipertensi portal melalui studi – studi yang menggambarkan pengaturan peningkatan tekanan portal, sirkulasi hiperdinamik, neovaskularisasi splangnik, dan kolateralisasi portosistemik yang diregulasi oleh VEGF (Vascular Endothelial Growth Factor ) dan PDGF (Platelet derived Growth Factor ).15
HVPG adalah 3 – 5 mmHg.3,16 Nilai HVPG ≥ 10 mmHg sudah menggambarkan hipertensi portal yang signifikan secara klinis dan ≥ 12 mmHg untuk terjadinya perdarahan varises akut dan perubahan nilai HVPG yang terjadi setiap waktu memiliki nilai prediksi untuk perkembangan varises esofagogastrik, resiko perdarahan variseal, perkembangan komplikasi hipertensi portal non – variseal (asites, sindrom hepatorenal, dan ensefalopati), dan mortalitas.4,17,18,19,20 Pengukuran satu kali sangat bermanfaat dalam menentukan prognosis sirosis kompensata dan dekompensata, sedangkan pengukuran berulang sangat berguna untuk monitor respon terhadap terapi farmakologi dan progresi penyakit hati. Pada pasien sirosis didapati peningkatan resistensi intrahepatik dan peningkatan aliran darah splanik. Faktor awal yang berperan yaitu peningkatan resitensi intrahepatik sementara peningkatan aliran darah splanik meruapakan fenomena sekunder untuk mempertahankan atau memperburuk peningkata hipertensi portal dan menimbulkan keadaan hiperdinamik ditandai dengan peningkatan nadi, kardiak output, dan volum plasma.21
Gambar 2. Patogenesis Hipertensi Portal.21
Perjalanan alamiah varises esofagus
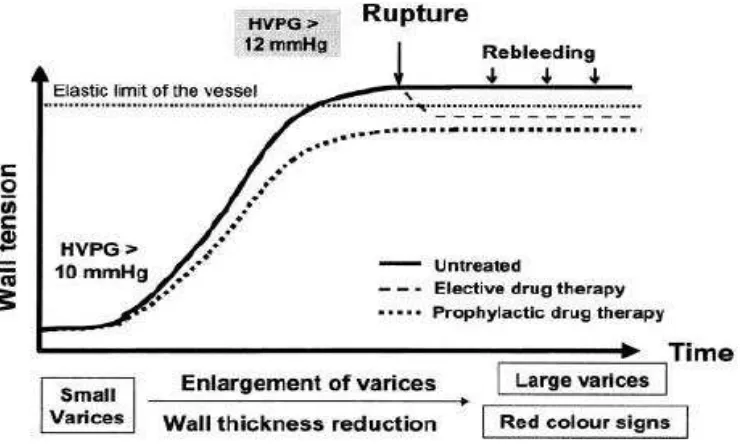
progresi mengalami varises yang kecil. Bertambahnya waktu dan sejalan dengan peningkatan sirkulasi hiperdinamik, aliran darah yang melalui varises akan meningkat sehingga meningkatkan tekanan pada dinding varises. Perdarahan varises disebabkan ruptur terjadi ketika bertambahnya ketegangan maksimal pada dinding varises.9 Diameter pembuluh darah merupakan salah satu penentu tekanan variseal. Pada tekanan yang sama, pembuluh darah dengan diameter besar akan ruptur sedangkan pembuluh darah dengan diameter kecil tidak akan ruptur. Selain diameter pembuluh darah, salah satu penentu tekanan padan dinding varises adalah tekanan di dalam varix yang berkaitan langsung dengan HVPG. Oleh karena itu, penurunan HVPG seharusnya memicu penurunan tekanan pada dinding varises sehingga mengurangi resiko ruptur. Perdarahan varises tidak akan terjadi ketika HVPG diturunkan menjadi < 12 mmHg, dan resiko perdarahan ulang juga menurun secara signifikan dengan penurunan HVPG lebih dari 20% nilai awal.3 Faktor lain yang juga sangat konsisten dengan progresi varises adalah klasifikasi keparahan penyakit hati berdasarkan skor Child – Pugh, dan tampilan red wale marks (didefinisikan sebagai venula yang membesar dan memanjang pada permukaan varises) pada saat pemeriksaan endoskopi awal. 3,6,22
Gambar 3. Perjalanan alamiah varises esofagus.7 Diagnosis
menjalani skrining varises dengan endoskopi pada saat diagnosis. Tujuan dari skrining varises esofagus adalah untuk mendeteksi pasien yang memerlukan terapi profilaksis. Pemeriksaan endoskopi sebaiknya diulang setelah 2 – 3 tahun kemudian pada pasien tanpa varises pada saat endoskopi pertama. Berdasarkan angka laju progresi besar varises yang berkisar 10 – 15 % per tahun, endoskopi sebaiknya diulang setiap 2 tahun pada pasien dengan varises yang kecil. Pada pasien dengan sirosis yang dekompensata atau tampak red wale marks pada endoskopi, interval pemeriksaan endoskopi tiap 1 tahun sangat direkomendasikan.3,6,7,8,23,24
Gambar 4. Guideline diagnosis varises esofagus.9
Telah lama diketahui bahwa gambaran varises secara endoskopi sangat krusial untuk memprediksi pasien mana yang memiliki resiko tinggi untuk perdarahan varises dan juga yang mana akan memiliki keuntungan dari terapi. Oleh sebab itu dibutuhkan sistem yang divalidasi untuk klasifikasi gambaran varises esofagus secara endoskopi. Pada tahun 1980 Japanese Research Society for Portal Hypertension merancang sistem klasifikasi yang kompleks untuk menggambarkan varises esofagus, sistem ini menggambarkan varises berda sarkan warna, ukuran, bentuk, lokasi, dan stigmata.25
Tatalaksana
varises lebih efektif dibandingkan skleroterapi dalam mengontrol pendarahan. Jika terapi medikamentosa dan endoskopi gagal, maka teknik bedah transjugular intrahepatic portosystemic shunt (TIPS) dapat menjadi pilihan.26,27
Daftar Pustaka
1. Sharara AI, Rockey DC. Gastroesophageal Variceal Hemoorhage. N Engl J Med 2001; 345:669-681
2. Cheney CP, Goldberg EM, Chopra S. Cirrhosis and portal hypertension : an overview. In : Friedman LS and Keeffe EB, eds.Handbook of Liver Disease. 2nd ed. China, Pa : Churchill Livingstone; 2004: 125-138
3. Garcia-Tsao G, Sanyal AJ, Grace ND, Carey W and the Practice Guidelines Committee of the American Association for the Study of Liver Diseases, the Practice Parameters Committee of the American College of Gastroenterology. Prevention and mana gement of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology 2007; 46:922-938
4. Groszmann RJ, Garcia-Tsao G, Bosch J, Grace ND, Burroughs AK, Planas R, Escorsell A, Garcia-Pagan JC, Patch D, Matloff DS, Gao H, Makuch R. B-blockers to prevent gastroesophageal varices in patients with cirrhosis. N Engl J Med 2005; 353: 2254-2261 5. Merkel C, Marin R, Angeli P, et al. A placebo-controlled clinical trial of nadolol in the
prophylaxis of growth of small esophageal varices in cirrhosis. Gastroenterology 2004;127:476–484
6. Merli M, Nicolini G, Angeloni S, et al. Incidence and natural history of small esophageal varices in cirrhotic patients. J Hepatol 2003;38:266–272
7. Bosch J et al. Portal Hypertension and Gastrointestinal Bleeding .Seminars in liver disease/volume 28, number 1, 2008
8. de Franchis R. Evaluation and follow-up of patients with cirrhosis and oesophageal varices. J Hepatol 2003;38:361–363
9. Dite P et al. Esophageal varices. World Gastroenterology Organisation practice guideline: June 2008
11. R. de Franchis, “Stellate cells and the “reversible component” of portal hypertension,” Digestive and Liver Disease, vol. 32, no. 2, pp. 104–107, 2000.
12. Y. Iwakiri and R. J. Groszmann, “Vascular endothelial dysfunction in cirrhosis,” Journal of Hepatology, vol. 46, no. 5, pp. 927–934, 2007.
13. D. C. Rockey, “Hepatic blood flow regulation by stellate cells in normal and injured liver,” Seminars in Liver Disease, vol. 21, no. 3, pp. 337–349, 2001
14. Wheatley AM , Zhang X - Y 1998 . Intrahepatic modulation of portal pressure and its role in portal hypertension . Digestion ; 59 : 424 – 428 .
15. M. Fernandez, M. Mejias, E. Garcia-Pras, R. Mendez, J. C. Garcia-Pagan, and J. Bosch, “Reversal of portal hypertension and hyperdynamic splanchnic circulation by combined vascular endothelial growth factor and platelet-derived growth factor blockade in rats,” Hepatology, vol. 46, no. 4, pp. 1208–1217, 2007
16. Bari K, Garcia-Tsao G. Treatment of portal hypertension. Wor ld J Gastroenterol 2012 March 21; 18(11): 1166-1175
17. Berzigotti A, Seijo S, Reverter E, Bosch J. 2013 Assessing Portal Hypertension in liver diseases. Expert Rev. Gastroenterol. Hepatol. 7(2), 141–155
18. Ripoll C, Groszmann R, Garcia-Tsao G, Grace N, Burroughs A, Planas R, Escorsell A, Garcia-Pagan JC, Makuch R, Patch D, Matloff DS, Bosch J. Hepatic venous pressure gradient predicts clinical decompensation in patients with compensated cirrhosis. Gastroenterology 2007; 133: 481-488
19. D’Amico G, Garcia-Pagan JC, Luca A, Bosch J. HVPG reduction and prevention of variceal bleeding in cirrhosis. A systematic review. Gastroenterology 2006;131:1624
20. D’Amico G, Garcia-Tsao G, Pagliaro L. Natural history and prognostic indicators of survival in cirrhosis. A systematic review of 118 studies. J Hepatol 2006;44:217-231
21. Laleman W, Van Landeghem L, Wilmer A, Fevery J, Nevens F. 2005. Portal hypertension: from pathophysiology to clinical practice. Liver International : 25: 1079–1090.
22. D’Amico G, de Franchis R. Upper digestive bleeding in cirrhosis: post-therapeutic outcome
and prognostic indicators. Hepatology 2003;38:599–612
24. de Franchis R. Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatol 2010; 53:762-768
25. Idezuki Y: General rules for recording endoscopic findings of esophagogastric varices. (1991). Japanese Society for Portal Hypertension. World J Surg 19:420-422, 1995
26. Yoshida H, et al. New mwthods for the management of esophagea varices. World J Gastroenterology. 13(11):1641-45