UJI BIOEKIVALENSI TABLET METOKLOPRAMID
BAHAN TAMBAHAN SARI TAPE DIBANDINGKAN
DENGAN TABLET METOKLOPRAMID MEREK
DAGANG PADA HEWAN KELINCI SECARA KCKT
SKRIPSI
OLEH:
DESY SUSANTI
NIM 081501007
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
UJI BIOEKIVALENSI TABLET METOKLOPRAMID
BAHAN TAMBAHAN SARI TAPE DIBANDINGKAN
DENGAN TABLET METOKLOPRAMID MEREK
DAGANG PADA HEWAN KELINCI SECARA KCKT
SKRIPSI
Diajukan untuk Melengkapi Salah Satu Syarat untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatra Utara
OLEH
DESY SUSANTI
NIM 081501007
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
UJI BIOEKIVALENSI TABLET METOKLOPRAMID BAHAN
TAMBAHAN SARI TAPE DIBANDINGKAN DENGAN
TABLET METOKLOPRAMID MEREK DAGANG PADA
HEWAN KELINCI SECARA KCKT
OLEH:
DESY SUSANTI
NIM 081501007
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: Juli 2012
Pembimbing I, Panitia Penguji:
Prof. Dr. Karsono, Apt. Prof. Dr. rer. Nat. Efendy D. P, S.U., Apt.
NIP 195409091982011001 NIP 195306191983031001
Pembimbing II, Prof. Dr. Karsono, Apt.
NIP 195409091982011001
Prof. Dr. M.T. Simanjuntak, M.Sc., Apt. Dr. Kasmirul Ramlan Sinaga, M.S., Apt.
NIP 195212041980021001 NIP 195504241983031003
Drs. Rasmadin Muktar, M.S., Apt. NIP 194909101980031002
Medan, Juli 2012 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Allah SWT atas segala limpahan
rahmat dan karuniaNya, sehingga penulis dapat menyelesaikan penelitian dan
penyusunan skripsi ini, serta shalawat dan salam kepada Nabi Muhammad SAW
sebagai suri tauladan dalam kehidupan.
Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar
Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara yang berjudul
“Uji Bioekivalensi Tablet Metoklopramid Bahan Tambahan Sari Tape
Dibandingkan dengan Tablet Metoklopramid Merek Dagang pada Hewan Kelinci
Secara KCKT” dapat diselesaikan dengan baik.
Pada kesempatan ini dengan segala kerendahan hati penulis mengucapkan
terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. Sumadio
Hadisahputra, Apt., yang telah memberikan izin fasilitas sehingga penulis dapat
menyelesaikan pendidikan. Ucapan terimakasih juga kepada Bapak Prof. Dr.
Karsono, Apt., dan bapak Prof. Dr. M.T. Simanjuntak, M.Sc., Apt., selaku
pembimbing yang telah memberikan waktu, bimbingan, kesabaran dan petunjuk
serta saran-saran selama penelitian hingga selesainya skripsi ini. Ucapan
terimakasih disampaikan kepada Bapak Prof. Dr. rer. nat. Efendy De Lux Putra,
S.U., Apt., bapak Dr. Kasmirul Ramlan Sinaga, M.S., Apt., dan bapak Drs.
Rasmadin Mukhtar, M.S., Apt., selaku penguji yang telah memberi kritik dan
saran demi kesempurnaan skripsi ini.
Penulis juga tidak lupa mengucapkan terimakasih kepada Ayahanda
dan kasih sayang yang tidak ternilai dengan apapun, doa yang tulus serta
pengorbanan baik materi maupun non-materi dan kakak tersayang Anita Tanjung
dan adik tersayang Yuliana Sari serta seluruh keluarga yang slalu mendoakan dan
memberikan semangat. Spesial untuk teman-teman, abang dan kakak angkatan
2008 dan 2007, terima kasih untuk perhatian, semangat, doa, dan kebersamaannya
selama ini dan seluruh pihak yang telah ikut membantu penulis namun tidak
tercantum namanya.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih
jauh dari kesempurnaan, oleh karena itu dengan segala kerendahan hati, penulis
menerima kritik dan saran demi kesempurnaah skripsi ini.
Akhirnya, penulis berharap semoga skripsi ini dapat memberi manfaat
bagi kita semua.
Medan, Juli 2012
Penulis,
UJI BIOEKIVALENSI TABLET METOKLOPRAMID BAHAN TAMBAHAN SARI TAPE DIBANDINGKAN DENGAN TABLET METOKLOPRAMID MEREK DAGANG PADA HEWAN KELINCI
SECARA KCKT
ABSTRAK
Masalah ketersediaan hayati zat aktif suatu obat timbul sejak adanya ketidaksetaraan terapetik diantara sediaan bermerek dagang yang mengandung zat aktif yang sama dan dalam bentuk sediaan yang sama, serta diberikan dengan dosis yang sama.
Metoklopramid adalah suatu obat yang berkhasiat antiemetik yang digunakan dalam klinis. Obat ini bekerja di sistem saraf pusat dan lambung, dan memblok reseptor dopamine di CTZ (Chemoreseptor Trigerzone). Tujuan penelitian ini adalah untuk mengetahui bioekivalensi dari tablet metoklopramid yang diformulasi dengan bahan tambahan sari tape dan metoklopramid merek dagang (Primperan®).
Penelitian ini dilakukan dengan menggunakan metode eksperimental di laboratorium menggunakan alat ukur kromatografi cair kinerja tinggi (KCKT) dengan mengukur kadar metoklopramid dalam plasma. Fase gerak yang digunakan untuk mengukur kadar metoklopramid dalam plasma kelinci adalah asam asetat glacial dalam air : metanol/asetonitril (60 : 40) dan laju alir 1 ml/menit. Penelitian ini dilakukan dengan menggunakan metode Cross Over Design yang dianalisa dengan uji T menggunakan program SPSS.
Hasil penelitian menunjukkan bahwa sediaan tablet metoklopramid yang diformulasi dengan bahan tambahan sari tape memiliki = 1,868 mcg/ml,
= 61,80 menit dan AUC = 1007,37 mcg/ml menit. Sedangkan untuk metoklopramid merek dagang (Primperan ) memiliki = 1,37 mcg/ml,
= 74,57 menit dan AUC = 745,23 mcg/ml menit. Dari hasil ini diketahui bahwa metoklopramid bahan tambahan sari tape tidak bioekivalen dengan tablet metoklopramid merek dagang (Primperan®), di mana p < 0,05.
BIOEQUIVALENCE TEST OF METOCLOPRAMIDE TABLET WITH ADDITIVES FERMENTED GLUTINOUS RICE EXTRACT COMPARED
WITH BRAND METOCLOPRAMIDE ON RABBITS BY HPLC
ABSTRACT
Active matter bioavailability term of drugs began since existence of therapeutic un-equivalence between brand preparation containing the same active ingredient in the same preparation, and the same dose.
Metoclopramide is an antiemetic drug which has been in clinical. It has actions both on the central nervous system and the gut, and exhibits the properties of a dopamine reseptor antagonist in CTZ (Chemoreseptor Trigerzone). Intention of this research was to know bioequivalence of metoclopramide tablet in rabbit and knew bioequivalence metoclopramid tablet of fermented glutinous rice extract and (Primperan®) brand metoclopramide.
Research was done by using experimental method in laboratory applied HPLC (High Performance Liquid Chromatography) by determining
metoclopramide in plasma. Mobile phase that used to measure plasma levels of metoclopramide is acetic acid glacial in water : MeOH/acetonitrile (60:40) and flow rate of 1 ml/min. The study was using Cross Over Design method and applied T-test analysis with SPSS.
The result showed that metoclopramide of fermented glutinous rice extract had = 1.868 mcg/ml, = 61.80 min and AUC = 1007.37 mcg/ml.min. while primperan® had = 1.37 mcg/ml, = 74.57 min and AUC = 745.23 mcg/ml.min. From the result known that metoclopramide of fermented glutinous rice extracts un-equivalence with (Primperan®) brand metoclopramide (p < 0.05).
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Konsep Penelitian... ... 4
BAB II TINJAUAN PUSTAKA .... ... 5
2.1 Metoklopramid HCl ... 5
2.1.1 Tinjauan Umum ... ... 5
2.1.2 Farmakologi ... ... 6
2.1.3 Efek Samping dan Interaksi Obat ... ... 6
2.2.1 Liberasi (Pelepasan) ... ... 7
2.2.2 Disolusi (Pelarutan) ... ... 7
2.2.3 Absorpsi (Pelarutan) ... ... 7
2.3 Bioavailabilitas ... ... 9
2.3.1 Faktor-faktor dalam Bioavailabilitas Obat ... ... 10
2.3.2 Parameter-parameter Bioavailabilitas ... ... 11
2.4 Bioekivalensi ... ... 13
2.5 Kromatografi Cair Kinerja Tinggi (KCKT) ... ... 13
2.5.1 Prinsip KCKT ... ... 14
2.5.2 Jenis KCKT ... 15
2.5.3 Fase Gerak ... ... 15
2.5.4 Fase Diam ... ... 16
2.5.5 Elusi Gradien dan Isokratik ... 16
2.5.6 Instrumen KCKT ... ... 17
2.5.6.1 Wadah Fase Gerak ... ... 17
2.5.6.2 Pompa ... ... 18
2.5.6.3 Tempat Injeksi Sampel ... ... 18
2.5.6.4 Kolom ... ... 18
2.5.6.5 Detektor ... ... 19
BAB III METODE PENELITIAN ... 20
3.1 Waktu dan Tempat Penelitian ... 20
3.2 Alat-alat ... 20
3.3 Bahan-bahan ... 21
3.5 Pembuatan Fase Gerak... .... 21
3.6 Pencampuran Fase Gerak... 22
3.7 Penyiapan Alat KCKT... 22
3.8 Penentuan Perbandingan Fase Gerak dan Laju Alir... 22
3.9 Bahan-bahan yang digunakan pada formulasi tablat Metoklopramid bahan tambahan sari tape... ... 23
3.10 Perlakuan Terhadap Hewan Percobaan... ... ... 23
3.10.1 Hewan Percobaan ... ... 23
3.10.2 Penyiapan Plasma ... ... 23
3.10.3 Penetuan Kurva Kalibrasi ... ... 24
3.10.4 Penetapan Kadar Metoklopramid Bahan Tambahan Sari Tape dan Metoklopramid Merek Dagang dalam Plasma Kelinci .... ... 24
3.11 Analisis Data ... 25
BAB IV HASIL DAN PEMBAHASAN... 27
4.1 Penentuan Kurva Kalibrasi Metoklopramid HCl ... 28
4.2 Penentuan Kadar Metoklopramid HCl ... ... 29
4.3 Penentuan Parameter Bioavailabilitas ... .... 31
4.4 Analisis Data ... 34
BAB V KESIMPULAN DAN SARAN ... .. 37
5.1 Kesimpulan ... ... 37
5.2 Saran ... 37
DAFTAR PUSTAKA ... ... 38
DAFTAR TABEL
Tabel Halaman
1. Pemberian Metoklopramid pada Kelinci Metode Cross over ... 24
2. Penentuan Kurva Kalibrasi Metoklopramid dalam Plasma ... 28
3. Nilai Konsentrasi Rata-rata ± Standart Deviasi Terhadap
Waktu Metoklopramid Bahan Tambahan Sari Tape (BTS)
dan Primperan® ... 30
4. Nilai Rata-rata Parameter Ketersediaan Hayati ± SD ... 32
5. Data Perhitungan Bioekivalensi Obat ... 35
6. Data Statistik Pengujian Metoklopramid Bahan Tambahan
DAFTAR GAMBAR
Gambar Halaman
1. Kerangka Konsep Penelitian ... 4
2. Rumus Bangun Metoklopramid HCl ... ... 5
3. Instrumen Dasar KCKT ... ... 17
4. Kromatogram hasil penyuntikan larutan Metoklopramid BPFI dengan konsentrasi 100 mcg/ml dalam plasma, dengan fase gerak (a) Campuran 1% Asam asetat glasial dalam Air dan, (b) Campuran Asetonitril-methanol (3,7 : 1),
dimana a : b = 60:40 ... 27
5. Kurva Kalibrasi Metoklopramida HCl dalam Plasma ... 28
6. Nilai Kadar Rata-rata Terhadap Waktu Tablet Metoklopramid BTST (Bahan Tambahan Sari Tape) dan Primperan® dalam Plasma Kelinci Jantan secara per Oral, masing – masing
n = 6 ekor ... 31
7. Konsentrasi Maksimum (Cmaks) Tablet Metoklopramid BTST (Bahan Tambahan Sari Tape) dan Primperan® dalam Plasma
Kelinci ... 32
8. Waktu Konsentrasi Mencapai Puncak (Tmaks) Tablet Metoklopramid BTST (Bahan Tambahan Sari Tape) dan
Primperan® dalam Plasma Kelinci ... 33
9.Area Dibawah Kurva (AUC) Tablet Metoklopramid BTST (Bahan Tambahan Sari Tape) dan Primperan®
DAFTAR LAMPIRAN
Lampiran Halaman
1. Sertifikat Pengujian Metoklopramid HCl BP ... 40
2. Hasil Orientasi Menentukan Perbandingan Fase Gerak
dengan Menggunakan Alat KCKT ... 41
3. Plasma yang Diperoleh Secara KCKT ... 44
4. Perhitungan Persamaan Regresi dari Kurva Kalibrasi ... 45
5. Pengambilan Plasma Untuk Kurva Kalibrasi
Metoklopramid HCl ... 47
6. Pembuatan Kurva Kalibrasi Metoklopramid HCl ... 48
7. Perlakuan Pada Hewan Percobaan dengan Pemberian
Tablet Metoklopramid HCl ... 50
8. Kadar Metoklopramid Bahan Tambahan Sari Tape (BTST) dalam Plasma Pada Kelinci Jantan Setiap Waktu
Pengambilan ... 51
9. Gambar Konsentrasi (c) vs Waktu (t) Metoklopramid BTST (Bahan Tambahan Sari Tape) Pada Plasma Kelinci,
n=6 ... 52
10. Kadar Metoklopramid Merek Dagang (Primperan®) dalam Plasma Pada Kelinci Jantan Setiap Waktu
Pengambilan ... 53
11. Gambar Konsentrasi (c) vs Waktu (t) Metoklopramid Merek Dagang (Primperan®) Pada Plasma Kelinci,
n=6 ... 54
12. Parameter Bioavailabilitas Tablet Metoklopramid (BTST) Bahan Tambahan Sari Tape pada 6 Kelinci Jantan dengan
Dosis 10 mg ... 55
13. Parameter Bioavailabilitas Tablet Metoklopramid
Merek Dagang (Primperan®) pada 6 Kelinci Jantan dengan
14. Contoh Perhitungan Parameter Bioavailabilitas Secara
Manual ... 57
15. Contoh Perhitungan Pengujian Hipotesis ... 59
16. Data Statistik Kadar Metoklopramid BTST dan Primperan® dalam Plasma Tiap Waktu Pengambilan pada 6 ekor Kelinci Menggunakan Statistik Independent T-Test ... 62
17. Data Statistik Parameter Bioavailabilitas Metoklopramid BTST dan Primperan® Menggunakan Statistik Independent T-Test ... 77
18. Formula Metoklopramid Bahan Tambahan Sari Tape ... 82
19. Gambar Alat yang Digunakan Pada KCKT ... 83
20. Gambar Alat Tambahan Untuk Penentuan Bioavailabilitas ... 86
UJI BIOEKIVALENSI TABLET METOKLOPRAMID BAHAN TAMBAHAN SARI TAPE DIBANDINGKAN DENGAN TABLET METOKLOPRAMID MEREK DAGANG PADA HEWAN KELINCI
SECARA KCKT
ABSTRAK
Masalah ketersediaan hayati zat aktif suatu obat timbul sejak adanya ketidaksetaraan terapetik diantara sediaan bermerek dagang yang mengandung zat aktif yang sama dan dalam bentuk sediaan yang sama, serta diberikan dengan dosis yang sama.
Metoklopramid adalah suatu obat yang berkhasiat antiemetik yang digunakan dalam klinis. Obat ini bekerja di sistem saraf pusat dan lambung, dan memblok reseptor dopamine di CTZ (Chemoreseptor Trigerzone). Tujuan penelitian ini adalah untuk mengetahui bioekivalensi dari tablet metoklopramid yang diformulasi dengan bahan tambahan sari tape dan metoklopramid merek dagang (Primperan®).
Penelitian ini dilakukan dengan menggunakan metode eksperimental di laboratorium menggunakan alat ukur kromatografi cair kinerja tinggi (KCKT) dengan mengukur kadar metoklopramid dalam plasma. Fase gerak yang digunakan untuk mengukur kadar metoklopramid dalam plasma kelinci adalah asam asetat glacial dalam air : metanol/asetonitril (60 : 40) dan laju alir 1 ml/menit. Penelitian ini dilakukan dengan menggunakan metode Cross Over Design yang dianalisa dengan uji T menggunakan program SPSS.
Hasil penelitian menunjukkan bahwa sediaan tablet metoklopramid yang diformulasi dengan bahan tambahan sari tape memiliki = 1,868 mcg/ml,
= 61,80 menit dan AUC = 1007,37 mcg/ml menit. Sedangkan untuk metoklopramid merek dagang (Primperan ) memiliki = 1,37 mcg/ml,
= 74,57 menit dan AUC = 745,23 mcg/ml menit. Dari hasil ini diketahui bahwa metoklopramid bahan tambahan sari tape tidak bioekivalen dengan tablet metoklopramid merek dagang (Primperan®), di mana p < 0,05.
BIOEQUIVALENCE TEST OF METOCLOPRAMIDE TABLET WITH ADDITIVES FERMENTED GLUTINOUS RICE EXTRACT COMPARED
WITH BRAND METOCLOPRAMIDE ON RABBITS BY HPLC
ABSTRACT
Active matter bioavailability term of drugs began since existence of therapeutic un-equivalence between brand preparation containing the same active ingredient in the same preparation, and the same dose.
Metoclopramide is an antiemetic drug which has been in clinical. It has actions both on the central nervous system and the gut, and exhibits the properties of a dopamine reseptor antagonist in CTZ (Chemoreseptor Trigerzone). Intention of this research was to know bioequivalence of metoclopramide tablet in rabbit and knew bioequivalence metoclopramid tablet of fermented glutinous rice extract and (Primperan®) brand metoclopramide.
Research was done by using experimental method in laboratory applied HPLC (High Performance Liquid Chromatography) by determining
metoclopramide in plasma. Mobile phase that used to measure plasma levels of metoclopramide is acetic acid glacial in water : MeOH/acetonitrile (60:40) and flow rate of 1 ml/min. The study was using Cross Over Design method and applied T-test analysis with SPSS.
The result showed that metoclopramide of fermented glutinous rice extract had = 1.868 mcg/ml, = 61.80 min and AUC = 1007.37 mcg/ml.min. while primperan® had = 1.37 mcg/ml, = 74.57 min and AUC = 745.23 mcg/ml.min. From the result known that metoclopramide of fermented glutinous rice extracts un-equivalence with (Primperan®) brand metoclopramide (p < 0.05).
BAB I
PENDAHULUAN
1.1Latar Belakang
Beberapa obat dibuat dan dipasarkan oleh lebih dari satu pabrik farmasi.
Dari studi biofarmasetik memberi fakta yang kuat bahwa metode formulasi
dengan nyata mempengaruhi bioavaibilitas obat tersebut (Shargel dan Yu, 2005).
Istilah ketersediaan hayati zat aktif suatu obat timbul sejak adanya
ketidaksetaraan terapetik diantara sediaan bermerek dagang yang mengandung zat
aktif yang sama dan dalam bentuk sediaan yang sama, serta diberikan dengan
dosis yang sama. Berbagai kejadian (zat aktif menjadi tidak aktif atau menjadi
toksik) merupakan sebab ketidaksetaraan tersebut. Dari data kadar zat aktif dalam
darah dapat diketahui ketersediaanhayati dan manfaat dari dosis obat yang
diberikan (Aiache, 1993).
Alasan utama dilakukan studi bioekivalensi oleh karena produk obat yang
dianggap ekivalen farmasetik tidak memberikan efek terapetik yang sebanding
pada penderita. Studi bioekivalensi berguna dalam membandingkan bioavaibilitas
suatu obat dari berbagai produk obat. Apabila produk–produk obat dinyatakan
ekivalensi, maka efek terapetik dari produk-produk obat ini dianggap sama
(Shargel dan Yu, 2005). Dengan ini efektifitas pengobatan akan dicapai dengan
baik. Selain itu, ketersediaan hayati juga menekankan tentang pembatasan atau
pengaturan dan pemakaian obat agar keamanan (safety) pemakaian obat dapat
dijamin, dan terhindar dari pengaruh toksik atau efek yang tidak diinginkan.
darah untuk mampu memberikan respon klinik yang sesuai baik zat aktif tunggal
maupun kombinasi beberapa zat aktif dari suatu bentuk obat (Anonim, 2006).
Absorbsi sistemik suatu obat dari saluran cerna atau tempat ekstravaskuler
yang lain bergantung pada bentuk sediaan, anatomi, dan fisiologi tempat absorbsi.
Faktor–faktor seperti luas permukaan dinding usus, kecepatan pengosongan
lambung, pergerakan saluran cerna dan aliran darah ketempat absorbsi
mempengaruhi laju dan jumlah absorbsi obat (Shargel dan Yu, 2005).
Metoklopramid adalah suatu obat yang berkhasiat memperkuat motilitas
dan pengosongan lambung, khasiat antidopamin di pusat dan perifer, serta kerja
langsung terhadap otot polos. Maka zat ini sering digunakan sebagai gangguan
peristaltik lemah dan setelah pembedahan. Selain itu obat ini berdaya kuat
antiemetik sentral berdasarkan blockade reseptor dopamine di CTZ
(Chemoreseptor Trigerzone). Oleh karena itu, metoklopramid digunakan pada
mual/muntah, termasuk akibat radioterapi dan pada migrain (Tjay dan Rahardja,
2002).
Mual dan muntah dapat merupakan manifestasi dari beragam kondisi,
termasuk kehamilan, mabuk perjalanan, obstruksi gastrointestinal, ulkus
peptikum, keracunan obat, gagal ginjal, dan hepatitis. Dalam kemoterapi kanker,
mual dan muntah yang disebabkan oleh obat-obat kemoterapi dapat terjadi ketika
pasien kembali menjalani pengobatan sebelum agen kemoterapi diberikan
(Katzung, 2004)
Sari tape padat memiliki rasa manis dan sedikit asam dan larut bila
diletakan di atas
bila diletakan di atas lidah. Oleh karena sifatnya dapat larut dalam air juga dapat
digunakan sebagai bahan disintegran dan karena rasanya yang manis dapat
digunakan sebagai penyamaran rasa yang enak dimulut (Bhowmik, et al., 2009).
Oleh karena itu, peneliti tertarik memeriksa bioekivalensi pada tablet
metoklopramid dengan bahan tambahan sari tape dan dibandingkan dengan
metoklopramid merek dagang yang terdapat dipasaran.
1.2 Perumusan Masalah
Berdasarkan latar belakang diatas, maka perumusan masalah penelitian ini
adalah apakah tablet metoklopramid yang diformulasikan dengan bahan
tambahan sari tape bioekivalen terhadap metoklopramid merek dagang yang
terdapat di pasaran?
1.3Hipotesa
Berdasarkan perumusan masalah di atas, maka yang menjadi hipotesa
dalam penelitan ini adalah sediaan tablet metoklopramid dengan bahan tambahan
sari tape bioekivalen dengan metoklopramid merek dagang yang terdapat di
pasaran.
1.4Tujuan Penelitan
Adapun yang menjadi tujuan penelitian ini adalah untuk mengetahui
apakah sediaan tablet metoklopramid dengan bahan tambahan sari tape
1.5Manfaat Penelitian
Hasil penelitian ini diharapkan bermanfaat untuk pengembangan ilmu
pengetahuan farmasi khususnya biofarmasi dan informasi mengenai bioekivalensi
tablet metoklopramid dengan bahan tambahan sari tape dan metoklopramid merek
dagang yang terdapat dipasaran.
1.6Kerangka Konsep Penelitian
Kerangka konsep penelitian dapat dilihat pada Gambar 1 di bawah ini:
Variable Bebas Variabel Terikat Parameter
X1 = Metoklopramida HCl
Dengan Bahan Tambahan -
Sari Tape Kadar obat
-dalam darah - AUC
X2 = Metoklopramida HCl Merek Dagang
BAB II
TINJAUAN PUSTAKA
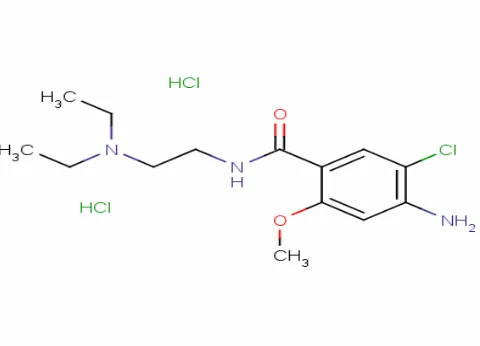
2.1 Metoclopramidi Hydrochloridum
2.1.1 Tinjauan umum
Gambar 2. Rumus bangun Metoclopramidi Hydrochloridum
Rumus molekul: C14H22ClN3O2.HCl.H2O
Nama kimia: 4-Amino-5-kloro-N-[2-(dietilamino)etil-o-anisamida
monohidroklorida, monohidrat [54143-57-6]
Berat molekul: 354,28
Pemerian: Serbuk hablur, putih atau praktis putih; tidak berbau atau praktis
tidak berbau.
Kelarutan: Sangat mudah larut dalam air; mudah larut dalam etanol; agak sukar
larut dalam klorofom; praktis tidak larut dalam eter.
2.1.2 Farmakologi
Mual dan muntah mempunyai banyak penyebab, termasuk obat-obatan
(misalnya sitotoksik, opioid, anastetik, digoksin), penyakit vestibular, gerakan
provokatif (misalnya mabuk laut), migren dan kehamilan. Lebih mudah untuk
mencegah muntah daripada menghentikannya bila muntah sudah terjadi. Oleh
karena itu, bila memungkinkan antiemetik sebaiknya diberikan sesaat sebelum
stimulus emetik (Neal, 2005).
Metoklopramida HCl berkhasiat antiemetik kuat berdasarkan blokade
reseptor dopamin di CTZ (chemoreceptor Trigger Zone). Di samping itu, zat ini
juga memperkuat pergerakan dan pengosongan lambung. Efektif pada jenis
muntah akibat kemoterapi dan migrain. Reabsorpsinya dari usus cepat, mulai
kerjanya dalam 20 menit (Tjay dan Rahardja, 2002)
2.1.3 Efek samping dan interaksi obat.
Efek samping yang terpenting adalah sedasi dan gelisah. Efek samping
lainnya berupa gangguan lambung dan usus serta gangguan ekstrapiramidal,
terutama pada anak kecil. Interaksi obat, obat-obat seperti digoksin yang terutama
diserap di lambung akan mengurangi reabsorpsinya bila diberikan bersamaan
dengan metoklopramida (Tjay dan Rahardja, 2002).
2.2 Fase Biofarmasetik
Biofarmasetika adalah ilmu yang mempelajari hubungan sifat fisikokimia
formulasi obat terhadap bioavaibilitas obat. Bioavaibilitas menyatakan kecepatan
Fase biofarmasetik melibatkan seluruh unsur-unsur yang terkait mulai saat
permberian obat hingga terjadinya penyerapan zat aktif. Peristiwa tersebut
tergantung pada cara pemberian dan bentuk sediaan. Fase biofarmasetik dapat
diuraikan dalam tiga tahap utama yaitu liberasi (pelepasan), disolusi (pelarutan)
dan absorpsi (penyerapan) (Aiache, 1993).
2.2.1 Liberasi (Pelepasan)
Apabila pasien menerima obat berarti ia mendapat zat aktif yang
diformulasi dalam bentuk sediaan dan dosis tertentu. Proses pelepasan zat aktif
dari bentuk sediaan tergantung pada jalur pemberiaan dan bentuk sediaan serta
dapat terjadi secara cepat. Pelepasan zat aktif dipengaruhi oleh keadaan
lingkungan biologis dan mekanisme pada tempat pemasukan obat, misalnya gerak
peristaltik usus, hal ini penting untuk bentuk sediaan yang keras atau yang kenyal
(tablet, supo sitoria dan lain-lain). Tahap pelepasan ini dapat dibagi dalam dua
tahap yaitu tahap pemecahan dan peluruhan, misalnya untuk sebuah tablet
(Aiache, 1993).
2.2.2 Disolusi (Pelarutan)
Setelah terjadi pelepasan, maka tahap kedua adalah pelarutan zat aktif.
Tahap kedua ini merupakan keharusan agar selanjutnya terjadi penyerapan
(Aiache, 1993).
2.2.3 Absorpsi (Penyerapan)
Absorpsi atau penyerapan suatu zat aktif adalah masuknya
molekul-molekul obat ke dalam tubuh atau menuju ke peredaran darah tubuh setelah
berada dalam bentuk terlarut. Tahap ini merupakan bagian dari fase biofarmasetik
dan tahap awal dari fase farmakokinetika.
Penyerapan zat aktif bergantung pada berbagai parameter, terutama sifat
fisikokimia molekul obat. Dengan demikian proses penyerapan zat aktif terjadi
apabila sudah dibebaskan dari sediaan dan sudah melarut dalam cairan biologis
(Aiache, 1993).
Menurut Shargel dan YU (2005) pada umumnya produk obat mengalami
absorpsi sistemik melalui suatu rangkaian proses. Proses itu meliputi:
1. Disintegrasi produk obat yang diikuti pelepasan obat.
Sebelum absorpsi terjadi, suatu produk obat padat harus mengalami
disintegrasi ke dalam partikel–partikel kecil melepaskan obat.
2. Pelarutan obat dalam media “aqueous”
Pelarutan merupakan proses di mana suatu bahan kimia atau obat
menjadi terlarut dalam suatu pelarut. Dalam sistem biologik pelarutan
obat dalam media “aqueous” merupakan suatu bagian penting sebelum
kondisi absorpsi sistemik.
3. Absorpsi melewati membran sel menuju sirkulasi sistemik.
Agar suatu obat dapat mencapai tempat kerja di jaringan suatu
organ, obat tersebut harus melewati berbagai membrane sel. Pada
umumnya, membrane sel mempunyai struktur lipoprotein yang bertindak
sebagai membrane lipid semipermeabel. Banyak obat mengandung
substituen lipofilik dan hidrofilik. Obat–obat yang lebih larut dalam lemak
lebih mudah melewati membrane sel daripada obat yang kurang larut
Obat dalam Pelepasan dengan partikel pelarutan obat absorbsi obat produk obat cara penghancuran obat dalam dalam
padat larutan tubuh
Menurut Siswandono dan Soekardjo (2000) Adapun faktor–faktor yang
mempengaruhi proses absorpsi obat di saluran cerna antara lain:
• Bentuk sediaan obat, meliputi ukuran partikel bentuk sediaan, adanya bahan-bahan tambahan dalam sediaan.
• Sifat kimia fisika obat, misalnya: bentuk garam, basa, amorf, kristal.
• Faktor biologis, seperti: gerakan saluran cerna, luas permukaan saluran cerna, waktu pengosongan lambung, banyaknya pembuluh
darah dalam usus, aliran (perfusi) darah dari saluran cerna.
• Faktor-faktor lain, seperti: usia, interaksi obat dengan makanan, interaksi obat dengan obat lain, penyakit tertentu.
2.3 Bioavailabilitas
Bioavailabilitas menunjukkan suatu pengukuran laju dan jumlah obat
yang aktif terapetik yang mencapai sirkulasi umum. Studi bioavailabilitas
dilakukan baik terhadap bahan obat aktif yang telah disetujui maupun terhadap
obat dengan efek terapetik yang belum disetujui FDA (Food Drug Administration)
untuk dipasarkan. Bioavalabilitas digunakan untuk menggambarkan fraksi dari
dosis obat yang mencapai sirkulasi sistemik yang merupakan salah satu bagian
dari aspek farmakokinetik obat. Defenisi tersebut diartikan bahwa obat yang di
melalui rute pemberian lain (seperti melalui oral) bioavalibilitasnya berkurang
(karena absorpsi yang tidak sempurna dan metabolisme lintas pertama) (Shargel
dan Yu, 2005).
Bioavailabilitas relatif adalah ketersediaan dalam sistemik suatu produk
obat dibandingkan terhadap suatu standar yang diketahui. Availabilitas suatu
formulasi obat dibandingkan terhadap availabilitas formula standar, yang biasanya
berupa suatu larutan dari obat murni, dievaluasi dalam studi “cross over”.
Availabilitas relatif dari dua produk obat yang diberikan pada dosis dan rute
pemberian yang sama dapat diperoleh dengan persamaan berikut:
Availabilitas relatif =
Jika dosis yang diberikan berbeda, suatu koreksi untuk dosis yang dibuat, seperti
dalam persamaan berikut:
Availabilitas relatif =
2.3.1 Faktor – faktor yang Mempengaruhi Bioavailabilitas Obat
Menurut Anonim (2006), Faktor-faktor yang mempengaruhi
bioavailabilitas obat antara lain:
1) Sifat Fisikokimia Obat
• Ukuran partikel
• Luas permukaan obat
• Kelarutan obat
• Bentuk kimia obat, yaitu garam, bentuk anhydrous atau hidrous
• Lipofilisitas
2) Faktor Formulasi
Untuk merancang suatu produk obat yang akan melepaskan obat
aktif dalam bentuk yang paling banyak berada dalam sistemik, farmasis
harus mempertimbangkan: (1) jenis produk obat; (2) sifat bahan tambahan
dalam produk obat; (3) sifat fisikokimia obat itu sendiri (Shargel dan Yu,
2005).
Untuk obat yang diberikan secara oral, bioavailabilitasnya
mungkin kurang dari 100% karena :
•Obat diabsorpsi tidak sempurna
•Eliminasi lintas pertama (First-Pass Elimination), Obat diabsorpsi menembus dinding usus, darah vena porta mengirimkan obat ke
hati sebelum masuk ke dalam sirkulasi sistemik. Obat dapat
dimetabolisme di dalam dinding usus atau bahkan di dalam darah
vena porta. Hati dapat mengekskresikan obat ke dalam empedu.
•Laju absorpsi
2.3.2. Parameter–parameter Bioavailabilitas.
a. T maksimum ( ) yaitu konsentrasi plasma mencapai puncak dapat
disamakan dengan waktu yang diperlukan untuk mencapai konsentrasi
obat maksimum setelah pemberian obat. Pada absorpsi obat adalah
terbesar, dan laju absorpsi obat sama dengan laju eliminasi obat. Absorpsi
masih berjalan setelah tercapai, tetapi pada laju yang lebih lambat.
Harga menjadi lebih kecil (berarti sedikit waktu yang diperlukan
untuk mencapai konsentrasi plasma puncak) bila laju absorpsi obat
= log
b. Konsentrasi plasma puncak ( ) menunjukkan konsentrasi obat
maksimum dalam plasma setelah pemberian secara oral. Untuk beberapa
obat diperoleh suatu hubungan antara efek farmakologi suatu obat dan
konsentrasi obat dalam plasma (Shargel dan Yu, 2005).
=
c. AUC (Area Under Curve) adalah permukaan dibawah kurva (grafik) yang
menggambarkan naik turunnya kadar plasma sebagai fungsi dari waktu.
AUC dapat dihitung secara matematis dan merupakan ukuran untuk
bioavailabilitas suatu obat. AUC dapat digunakan untuk membandingkan
kadar masing-masing plasma obat bila penentuan kecepatan eliminasinya
tidak mengalami perubahan. Selain itu antara kadar plasma puncak dan
bioavailabilitas terdapat hubungan langsung (Waldon, 2008).
AUC
0-∞= AUC
0-t+ AUC
t-∞AUC
0-t=
2
1 n
n C
C − +
( t
n- t
n-1)
dan
AUC
t-∞=
el tnK C
2.4 Bioekivalensi
Alasan utama dilakukan studi bioekivalensi oleh karena produk obat yang
pada penderita. Persyaratan bioekivalensi diberlakukan oleh FDA atas dasar
sebagai berikut (Shargel dan Yu, 2005):
1. Adanya fakta dari percobaan klinik atau pengamatan pada penderita
yang menyatakan berbagai produk obat tidak memberi efek terapik
yang sebanding.
2. Adanya fakta dari studi bioekivalensi menyatakan bahwa
produk-produk tersebut bukan merupakan produk-produk obat yang bioekivalen.
3. Adanya fakta bahwa produk-produk obat memperhatikan rasio terapik
yang sempit dan konsentrasi efektif minimum dalam darah, serta
penggunaannya secara aman dan efektif memerlukan dosis yang
cermat dan memerlukan pemantauan pada penderita.
2.5. Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi cair kinerja tinggi (KCKT) merupakan sistem pemisahan
dengan kecepatan dan efisiensi yang tinggi. Hal ini karena didukung oleh
kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang
sangat sensitif dan beragam. KCKT mampu menganalisa berbagai cuplikan secara
kualitatif maupun kuantitatif, baik dalam komponen tunggal maupun campuran
(Ditjen POM, 1995).
KCKT merupakan teknik pemisahan yang diterima secara luas untuk
analisis dan pemurnian senyawa tertentu dalam suatu sampel pada sejumlah
bidang antara lain; farmasi, lingkungan dan industri-industri makanan (Rohman,
2007).
Kegunaan umum KCKT adalah untuk pemisahan sejumlah senyawa
(impurities) dan analisis senyawa-senyawa yang tidak mudah menguap
(nonvolatil). KCKT paling sering digunakan untuk menetapkan kadar
senyawa-senyawa tertentu seperti asam-asam amino, asam-asam nukleat dan
protein-protein dalam cairan fisiologis, menentukan kadar senyawa-senyawa aktif obat
dan lain-lain (Rohman, 2007).
Menurut De Lux Putra (2007) kelebihan KCKT antara lain:
− Mampu memisahkan molekul-molekul dari suatu campuran
− Resolusinya baik
− Mudah melaksanakannya
− Kecepatan analisis dan kepekaannya tinggi
− Dapat dihindari terjadinya dekomposisi/kerusakan bahan yang dianalisis
− Dapat digunakan bermacam-macam detektor
− Kolom dapat digunakan kembali
− Instrumennya memungkinan untuk bekerja secara automatis dan kuantitatif
− Waktu analisis umumnya singkat
− Kromatografi cair preparatif memungkinkan dalam skala besar
− Ideal untuk molekul besar dan ion. 2.5.1 Prinsip KCKT
Kromatografi merupakan tekhnik pemisahan yang mana solut atau zat-zat
terlarut terpisah oleh perbedaan kecepatan elusi, dikarenakan solut-solut ini
melewati suatu kolom kromatografi. Pemisahan solut-solut ini diatur oleh
distribusi dalam fase gerak dan fase diam. Penggunaan kromatografi cair
operasional seperti jenis kolom, fase gerak, panjang dan diameter kolom,
kecepatan alir fase gerak, suhu kolom, dan ukuran sampel (Rohman, 2007).
2.5.2 Jenis KCKT
Pemisahan dapat dilakukan dengan fase normal atau fase terbalik
tergantung pada polaritas relative fase diam dan fase gerak. Berdasarkan pada
kedua pemisahan ini, seringkali KCKT dikelompokkan menjadi KCKT fase
normal dan KCKT fase terbalik. Kromatografi fase terbalik merupakan kebalikan
dari kromatografi fase normal. Kromatografi fase terbalik menggunakan fase diam
yang bersifat nonpolar, dan fase geraknya yang relatif lebih polar daripada fase
diam (Rohman, 2007).
2.5.3 Fase Gerak
Fase gerak atau eluen biasanya terdiri atas campuran pelarut yang dapat
bercampur yang secara keseluruhan berperan dalam daya elusi dan resolusi. Daya
elusi dan resolusi ini ditentukan oleh polaritas keseluruhan pelarut, polaritas fase
diam, dan sifat komponen-komponen sampel. Untuk fase normal (fase diam lebih
polar daripada fase gerak), kemampuan elusi meningkat dengan meningkatnya
polaritas pelarut. Sementara untuk fase terbalik (fase diam kurang polar daripada
fase gerak), kemampuan elusi menurun dengan meningkatnya polaritas pelarut
(Rohman, 2007).
Menurut Johnson dan Stevenson (1991) fase gerak harus:
- Murni, tanpa cemaran
- Tidak bereaksi dengan kemasan
- Sesuai dengan detektor
- Harganya wajar
2.5.4 Fase Diam
Oktadesil silika (ODS atau C18) merupakan fase diam yang paling banyak
digunakan karena mampu memisahkan senyawa-senyawa dengan kepolaran yang
rendah, sedang maupun tinggi (Watson, 2008).
2.5.5 Elusi Gradien dan Isokratik
Menurut De Lux Putra (2007) elusi pada KCKT dapat dibagi menjadi dua
sistem yaitu:
1. Sistem elusi isokratik. Pada sistem ini, elusi dilakukan dengan satu macam
atau lebih fase gerak dengan perbandingan tetap (komposisi fase gerak tetap
selama elusi).
2. Sistem elusi gradien. Pada sistem ini, elusi dilakukan dengan campuran fase
gerak yang perbandingannya berubah-ubah dalam waktu tertentu (komposisi
fase gerak berubah-ubah selama elusi).
Elusi gradien didefinisikan sebagai penambahan kekuatan fase gerak
selama suatu analisis kromatografi berlangsung. Digunakan untuk meningkatkan
resolusi campuran yang kompleks terutama jika sampel mempunyai kisaran
polaritas yang luas. Pengaruh yang menguntungkan dari elusi gradien adalah
memperpendek waktu analisis senyawa-senyawa yang secara kuat ditahan di
Gambar 3. Instrumen dasar KCKT. (sumber: McMaster, 2007). 2.5.6 Instrumen KCKT
Instrumen KCKT terdiri dari wadah fase gerak (reservoir), pompa
(pump), tempat injeksi sampel (injector), kolom (column), detektor (detector) dan
perekam (recorder) (McMaster, 2007).
Sampel diinjeksikan ke dalam injektor KCKT menggunakan vial
autosampler sebanyak 10 µ l secara otomatis, kemudian melewati kolom.
Didalam kolom terjadi pemisahan karena adanya perbedaan elusi dan diatur oleh
adanya fase gerak dan fase diam (Oktadesil silika atau C18). Setelah dari kolom
masuk ke detektor yang mendeteksi adanya komponen cuplikan dalam aliran yang
keluar dari kolom. Detektor yang digunakan adalah detektor photodiode-array
(PDA) pada panjang gelombang 273 nm. Rekorder yang dihubungkan ke detektor
akan menangkap sinyal elektronik dari detektor dan memplotkannya ke dalam
kromatogram.
2.5.6.1 Wadah Fase Gerak
Wadah fase gerak harus bersih dan lembam (inert) terhadap fase gerak.
tandon harus lebih besar dari 500 ml, yang dapat digunakan selama 4 jam untuk
kecepatan alir yang umumnya 1-2 ml/menit (Munson, 1991)
2.5.6.2 Pompa
Pompa digunakan untuk menggerakkan fase gerak melalui kolom. Pompa
yang cocok digunakan untuk KCKT adalah pompa yang mempunyai syarat harus
inert terhadap fase gerak. Bahan yang umum dipakai untuk pompa adalah gelas,
baja tahan karat, teflon, dan batu nilam. Pompa yang digunakan sebaiknya mampu
memberikan tekanan sampai 5000 psi dan mampu mengalirkan fase gerak dengan
kecepatan alir 3 ml/menit. Aliran pelarut dari pompa harus tanpa denyut untuk
menghindari hasil yang menyimpang pada detektor (Watson, 2008).
Tujuan penggunaan pompa atau sistem penghantaran fase gerak adalah
untuk menjamin proses penghantaran fase gerak berlangsung secara tepat,
reprodusibel, konstan, dan bebas dari gangguan (Watson, 2008).
2.5.6.3 Tempat Injeksi Sampel
Sampel-sampel cair dan larutan disuntikkan secara langsung ke dalam
fase gerak yang mengalir di bawah tekanan menuju kolom menggunakan alat
penyuntik yang terbuat dari tembaga tahan karat dan katup teflon yang dilengkapi
dengan keluk sampel (sample loop) internal atau eksternal (Rohman, 2007).
2.5.6.4 Kolom
Kolom adalah jantung kromatografi. Berhasil atau gagalnya suatu analisis
tergantung pada pemilihan kolom dan kondisi percobaan yang sesuai. Kolom
dapat dibagi menjadi dua kelompok :
a. Kolom analitik: diameter khas adalah 2–6 mm. Panjang kolom tergantung
adalah 50–100 cm. Untuk kemasan poros mikropartikulat, umumnya 10 –
30 cm. Dewasa ini ada yang 5 cm.
b. Kolom preparatif: umumnya memiliki diameter 6 mm atau lebih besar dan
panjang kolom 25–100 cm.
Kolom umumnya dibuat dari stainless steel dan biasanya dioperasikan pada
temperatur kamar, tetapi bisa juga digunakan temperatur lebih tinggi, terutama
untuk kromatografi penukar ion dan kromatografi eksklusi. Kemasan kolom
tergantung pada mode KCKT yang digunakan (De Lux Putra, 2007).
2.5.6.5 Detektor
Idealnya, suatu detektor harus mempunyai karakteristik sebagai berikut
(Rohman, 2007):
• Mempunyai respon terhadap solut yang cepat dan reprodusibel
• Mempunyai sensitifitas yang tinggi, yakni mampu mendeteksi solut pada kadar yang sangat kecil
• Stabil dalam pengoperasiannya
• Mempunyai sel volume yang kecil sehingga mampu meminimalkan pelebaran pita.
BAB III
METODE PENELITIAN
Metode penelitian yang dilakukan adalah metode eksperimental. Tahap
penelitian meliputi penyiapan bahan, perlakuan, pemberian obat kepada hewan
percobaan, pengambilan darah, darah yang didapat divorteks dan disentrifuge
sehingga menjadi plasma. Selanjutnya menginjeksikan plasma pada alat
Kromatografi Cair Kinerja Tinggi (KCKT). Parameter yang dilihat adalah luas
area dari plasma sehingga didapat besarnya kadar dari metoklopramida.
3.1 Waktu dan tempat penelitian.
Penelitian ini dilakuka n di Laboratorium Biofarmasi dan di Laboratorium
Penelitian Fakultas Farmasi Universitas Sumatra Utara pada tanggal 20 Februari
2012 sampai tanggal 25 April 2012.
3.2 Alat
Alat-alat yang digunakan pada penelitian ini adalah timbangan hewan,
beaker gelas (oberol), neraca analitis, mat pipet (oberol), pipet tetes, tabung
sentrifugasi, rak tabung, gelas ukur (oberol), alat vortex, alat sentrifuga si, spuit 1
ml, spuit 3 ml, labu tentukur (oberol), mikrotube, indikator universal, satu unit alat
KCKT (Agilent 1120 Compact LC), kolom ODS C-18, wadah solven (oberol),
vial (agilent), animal box, pompa vakum (Gast DO), sonikator (branson), kertas
membran filter cellulosa nitrate 0,45 μm (whatman), kertas membran filter nylon
0,45 μm (whatman), penyaring PTFE (polytetraflouroethylen) 0,2 μm (whatman )
3.3 Bahan
Bahan–bahan yang digunakan dalam penelitian ini yaitu asam asetat
glasial, asetonitril, metanol, aquabidestillata, metoklopramid HCl BP (PT. Kairos
Tritunggal), trikloroasetat (TCA) 20% dan heparin.
3.4 Pembuatan Larutan Baku
3.4.1 Pembuatan Larutan Induk Baku Metoklopramid
Ditimbang seksama 10,0 mg metoklopramid BP, dimasukkan ke dalam
labu tentukur 10 ml, ditambahkan aquabides hingga larut dan dicukupkan sampai
10 ml. Maka didapat larutan dengan konsentrasi 1000 mcg/ml.
3.4.2 Pembuatan Larutan Induk Baku II Metoklopramid
Dari larutan induk baku I, dipipet 1 ml, lalu dimasukkan ke dalam labu
tentukur 10 ml, dicukupkan dengan aquabides hingga 10 ml. Maka didapat larutan
dengan konsentrasi 100 mcg/ml.
3.4.3 Pembuatan Larutan Induk Baku III Metoklopramid
Dari larutan induk baku II, dipipet 1 ml , lalu dimasukkan ke dalam labu
tentukur 10 ml, dicukupkan dengan aquabides hingga 10 ml. Maka didapat larutan
dengan konsentrasi 10 mcg/ml.
3.5 Pembuatan Fase Gerak
Fase gerak yang digunakan terdiri dari larutan asam asetat glacial 1%
dalam aquabidest dan larutan metanol-asetonitril (1 : 3,7), di mana larutan asam
asetat glasial dan campuran metanol-asetonitril berbanding 60 : 40. (Munson,
3.6 Pencampuran Fase Gerak
Dipipet asam asetat glasial 5 ml, dimasukkan ke dalam labu tentukur dan
dicukupkan dengan aquadest hingga 500 ml, dicek pH (pH = 4), lalu disaring
dengan menggunakan membrane filter cellulose nitrat 0,45 µm. Kemudian
sebanyak 185 ml asetonitril dan 50 ml metanol atau dengan perbandingan 3,7 : 1
dicampur, lalu disaring dengan menggunakan membrane filter nylon 0,45 µ m.
Masing-masing fase gerak disonikasi selama 30 menit.
3.7 Penyiapan Alat Kromatografi Cair Kinerja Tinggi.
Alat kromatografi yang telah dirangkai sedemikian rupa dihidupkan.
Dimana pengukuran dilakukan dengan menggunakan kolom Agilent XDB-C18,
laju alir 1 ml/menit, detector PDA pada panjang gelombang 273 nm. Pompa yang
digunakan mode perbandingan berubah-ubah dalam waktu tertentu dengan sistem
elusi gradien.
Setelah alat KCKT dihidupkan, maka pompa dijalankan dan fase gerak
dibiarkan mengalir selama lebih kurang 30 menit sampai diperoleh garis tanda
yang datar sehingga menandakan sistem tersebut telah stabil. Sehingga KCKT
siap untuk digunakan.
3.8 Penentuan Perbandingan Fase Gerak dan Laju Alir sistem KCKT
Larutan metoklopramid baku dengan konsentrasi 10 mcg/ml diinjeksikan
sebanyak 10 ul kedalam sistem KCKT menggunakan campuran fase gerak Asam
perbandingan campuran asam asetat glasial dalam air dan campuran
metanol/asetonitril adalah 60 : 40, dengan laju alir yang tetap 1 ml per menit.
3.9 Bahan-bahan yang digunakan pada formulasi tablet Metoklopramid Bahan Tambahan Sari Tape.
Metoklopramid HCl Baku Pabrik (PT. Kairos Tritunggal), Sari tape padat
(Brem), corn starch, avicel, LH-11, aspartam, Mg. stearat, dan talkum. Tablet
metoklopramid bahan tambahan sari tape diperoleh dari Penelitian Disertasi Drs.
Samran, M.Si., Apt.
3.10 Perlakuan Terhadap Hewan Percobaan
3.10.1 Hewan Percobaan
Hewan uji yang digunakan dalam penelitian ini adalah kelinci jantan
dengan berat 1,5-2 kg, yang telah dikondisikan terhadap lingkungan dan
makanannya selama 1 minggu dan diberi makanan kangkung dan wartel selama
penelitian berlangsung. Kelinci yang diambil darahnya adalah kelinci yang telah
diberi tablet metoklopramid bahan tambahan sari tape dan tablet metoklopramid
merek dagang (Primperan secara peroral. Waktu pengambilan darah adalah 10
menit setelah pemberian obat.
3.10.2 Penyiapan Plasma
Kelinci dipuasakan minimal 8 jam sebelum percobaan. Ditimbang dan
dibersihkan bulu telinganya hingga bersih. Ambil darah 2 ekor kelinci jantan
masing-masing lebih kurang 5 ml, dibagi dalam 4 tabung yang telah berisi 2 tetes
3000 rpm selama 10 menit. Diambil masing-masing supernatan dan digunakan
sebagai blanko dan kurva kalibrasi.
3.10.3 Penentuan Kurva Kalibrasi
Larutan induk baku III dengan konsentrasi 10 mcg/ml, dipipet sebanyak
0,05 ml, 0,1 ml, 0,15 ml, 0,2 ml dan 0,25 ml setara dengan konsentrasi 0,5; 1; 1,5;
2; dan 2,5 mcg/ml. Masing–masing dimasukkan ke dalam vial dan dicukupkan
dengan plasma 1 ml. Diukur kadarnya dengan menggunakan alat KCKT dengan
menyuntikkan supernatan sebanyak 10 µl.
3.10.4 Penetapan Kadar Metoklopramid Bahan Tambahan Sari Tape dan Metoklopramid merek dagang dalam Plasma Darah Kelinci
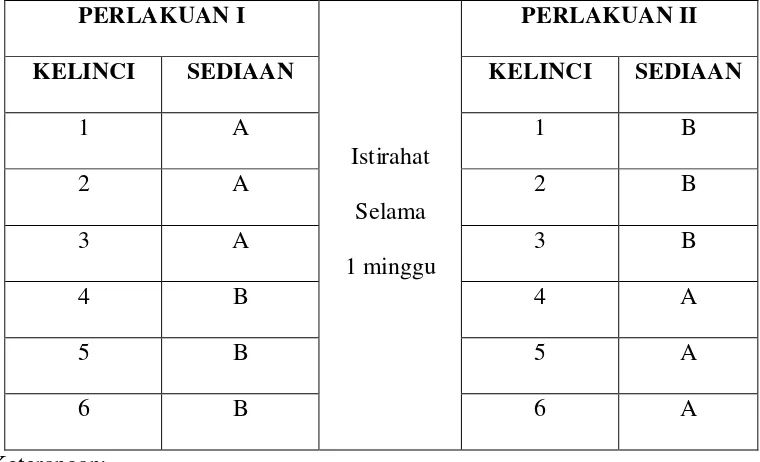
Pengujian dilakukan dengan metode Cross Over Design menggunakan 6
kelinci. Pemberian metoklopramid pada hewan kelinci dengan metode ini dapat
dilihat pada Tabel 1.
Table 1. Pemberian Metoklopramid pada kelinci dengan metode Cross Over Design.
PERLAKUAN I
Istirahat
Selama
1 minggu
PERLAKUAN II
KELINCI SEDIAAN KELINCI SEDIAAN
1 A 1 B
2 A 2 B
3 A 3 B
4 B 4 A
5 B 5 A
6 B 6 A
Keterangan:
A = Tablet Metoklopramid 10 mg dengan Bahan Tambahan Sari Tape
[image:40.595.118.498.471.702.2]Prosedur penentuan konsentrasi metoklopramid dalam plasma :
1. Kelinci dipuasakan selama lebih kurang 8 jam.
2. Diambil 1 ml darah kelinci dan digunakan sebagai blanko
3. Diberikan sediaan tablet metoklopramid secara per oral.
4. Dibilas spuit dengan heparin dan diambil 1 ml darah kelinci melalui vena
marginal setelah 10 menit pemberian obat, kemudian 20, 30, 45, 60, 90,
120, 180, 300, dan 420 menit.
5. Dimasukkan kedalam tabung sentrifuge yang telah berisi 2 tetes heparin.
6. Ditambahkan TCA 20% sebanyak 1 ml lalu divorteks hingga homogen
7. Disentrifuge dengan kecepatan 3000 rpm selama 10 menit untuk diambil
supernatannya, dan masing-masing disaring dengan menggunakan
membrane filter PTFE 0,2 um.
8. Diukur kadarnya menggunakan alat KCKT dengan menyuntikkan
supernatan sebanyak 10 ul.
3.11 Analisis Data
Data hasil penelitian yang diperoleh, kemudian ditentukan parameter
bioavailabilitanya, yaitu , , dan AUC. Untuk mengetahui apakah harga
variansinya sama besarnya atau tidak, maka dilakukan uji pendahuluan untuk
hipotesis (Jones, 2002).
H0: σ12 = σ22 H1: σ12 ≠ σ22
Pengujian Hipotesi
dibandingkan dengan nilai kritis: f α/2 , v1, v2
Bila f hitung < f kritis (diterima), maka harga kedua variansi tersebut
adalah sama, maka uji selanjutnya dalam membedakan dua rata-rata
menggunakan uji t. H0 : µ1 = µ2 H1: µ1 ≠ µ2
Pengujian hipotesis t = (y1− y2 /s 1/r1 +1/r2
s =
/
1
/
2/
(
1 22
)
2 1 2 2 1 2 2 1 1 1 2 1 2 2 \ 1 1
−
+
−
+
−
∑
∑
∑
∑
= − − =r
r
r
y
y
r
y
y
r i i r i i r i r i i i atau:s =
nilai t hasil pengujian statistik ini kemudian dibandingkan dengan nilai kritis
BAB IV
HASIL DAN PEMBAHASAN
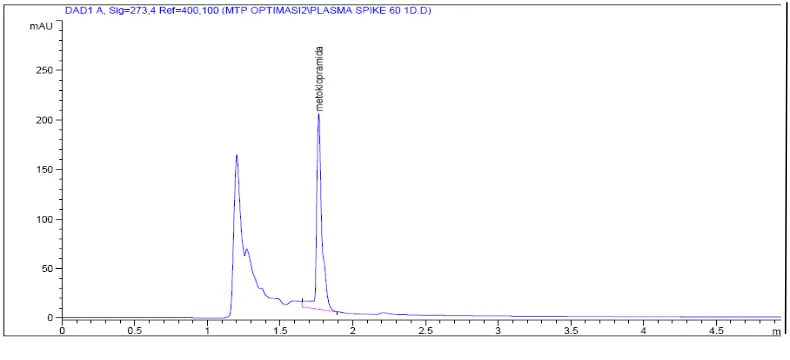
Penentuan perbandingan fase gerak 1% asam asetat glasial dalam air dan
campuran asetonitril-MeOH (metanol) (3,7 : 1) dilakukan terlebih dahulu sebelum
dilakukan penetapan kadar metoklopramid dalam plasma pada panjang
gelombang 273 nm. Setelah fase gerak diperoleh kemudian ditentukan laju alir,
waktu tambat dan tekanan kolom yang optimal. Hasil orientasi menentukan
perbandingan fase gerak terlampir pada Lampiran 2, halaman 41. Kemudian
dilakukan penyuntikan larutan plasma yang ditambah dengan larutan
metoklopramid BP dengan konsentrasi 100 mcg/ml sebanyak 10 µ l ke dalam
sistem Kromatografi Cair Kinerja Tinggi (KCKT) dengan perbandingan fase
gerak yang terdiri dari: (a) Campuran 1% asam asetat glasial dalam air dan, (b)
campuran asetonitril-metanol (3,7 : 1), di mana a : b = (60:40) dan laju alir 1
[image:43.595.118.513.498.678.2]ml/menit diperoleh waktu tambat 1,7 seperti yang tertera pada Gambar 4.
4.1. Penentuan Kurva Kalibrasi Metoklopramid HCl
Kurva kalibrasi metoklopramid dalam plasma dengan hasil seperti yang
[image:44.595.142.484.196.402.2]tertera pada Tabel 2.
Tabel 2. Penentuan kurva Kalibrasi Metoklopramid dalam plasma.
Data Konsentrasi (mcg/ml) Luas Area
1 0.0000 0.0000
2 0.5000 42.2830
3 1.0000 68.4420
4 1.5000 86.7360
5 2.0000 114.0300
6 2.5000 134.8500
Dari Tabel 2 selanjutnya digambarkan kurva kalibrasi metoklopramid
seperti yang tertera pada Gambar 5.
[image:44.595.118.505.488.706.2]Kadar (konsentrasi) metoklopramid dapat dihitung menggunakan
persamaan berikut Y = 51.8734 X + 9.5484 yaitu dengan mensubtitusikan harga Y
(luas area sampel) maka didapat harga X (kadar sampel). Data perhitungan
persamaan regresi dari kurva kalibrasi Metoklopramid HCl dapat dilihat pada
Lampiran 4, halaman 45.
4.2. Penentuan Kadar Metoklopramid HCl
Berdasarkan kromatogram dan kurva kalibrasi hasil penyuntikan
metoklopramid BP, selanjutnya dilakukan penyuntikan dari plasma 6 ekor kelinci
jantan yang telah diberi tablet metoklopramid bahan tambahan sari tape (BTST)
dan metoklopramid merek dagang (Primperan®) secara per oral dengan rentang
waktu pemberian tablet metoklopramid BTST dan metoklopramid merek dagang
(Primperan®) yaitu 1 minggu, maka dapat diketahui nilai kadar rata-rata ± SD
(standard deviasi) seperti yang terlihat pada Tabel 3. Data dan kadar rata-rata
Tabel 3. Nilai Kadar Rata-rata ± Standard Deviasi Terhadap Waktu Metoklopramid Bahan Tambahan Sari Tape (BTST) dan Primperan® dalam Plasma Kelinci
Waktu
(menit)
Kadar (mcg/ml) ± SD
Metoklopramid BTST Primperan®
10 0.91702 ± 0.079 0.66876 ± 0.082
20 1.11178 ± 0.181 0.81483 ± 0.152
30 1.43976 ± 0.114 0.99764 ± 0.038
45 1.76276 ± 0.122 1.23424 ± 0.252
60 1.90516 ± 0.175 1.54821±0.267
90 1.76063 ± 0.229 1.39065±0.316
120 1.56884 ± 0.272 1.23840±0.266
180 1.36235 ± 0.239 1.00584 ± 0.049
300 1.11083 ± 0.195 0.77121 ± 0.134
420 0.93360 ± 0.762 0.65665 ± 0.413
Hasil dari Tabel 3 dapat digambarkan konsentrasi rata-rata (C) lawan
waktu (t) tablet metoklopramid BTST (Bahan Tambahan Sari Tape) dan
Gambar 6. Nilai Konsentrasi (kadar) Rata-rata Terhadap Waktu Tablet Metoklopramid BTST (Bahan Tambahan Sari Tape) dan Primperan® dalam Plasma Kelinci Jantan secara per Oral, masing – masing n = 6 ekor.
4.3 Penentuan Parameter Bioavailabilitas (Ketersediaan Hayati)
Hasil yang ditunjukkan pada Tabel 3, selanjutnya digunakan untuk
menentukan parameter ketersediaan hayati (Bioavailabilitas) tablet
metoklopramid bahan tambahan sari tape dan tablet Primperan dengan metode
manual seperti yang tertera pada Tabel 4. Data dan contoh perhitungan dapat
dilihat pada Lampiran 12, halaman 55 dan Lampiran 14, halaman 57.
Adapun parameter dalam penentuan ketersedian hayati untuk data plasma
(Shargel dan Yu, 1995) adalah:
a. Waktu konsentrasi plasma (darah) mencapai puncak
b. Konsentrasi plasma puncak
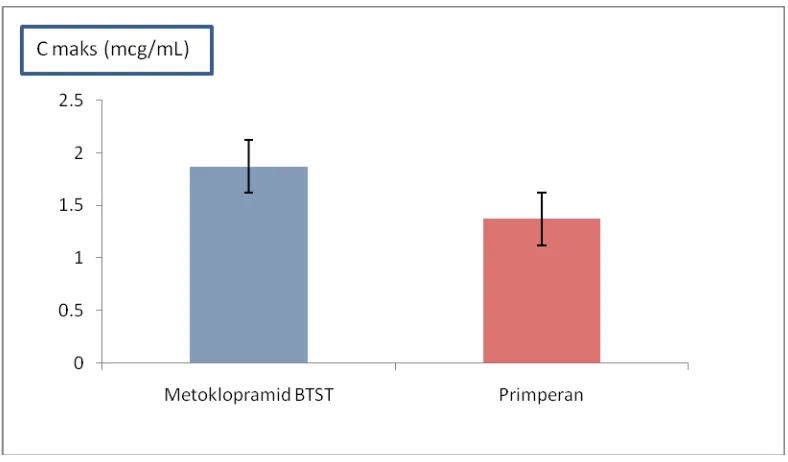
[image:47.595.113.513.110.347.2]Tabel 4. Nilai Rata-rata Parameter Ketersedian hayati ± Standar Deviasi Masing – masing Tablet.
Sedian Tablet
Rata - rata ± SD
Tmaks (menit)
Cmaks (mcg/ml) AUC (mcg/ml. menit)
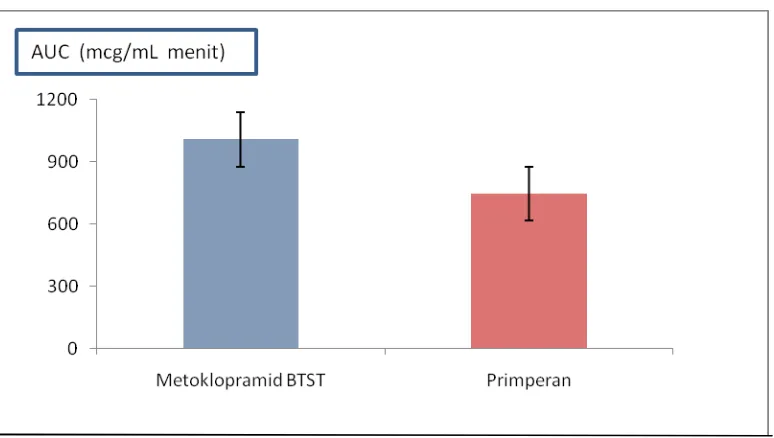
Metoklopramid BTST 61,80±6,22 1.87±0,23 1007.37±86,53
Primperan 74,57±22,13 1.37±0,27 745,23±116,61
DariTabel 4 dapat diperoleh grafik parameter ketersediaan hayati masing
– masing tablet dalam plasma , seperti yang terlihat pada gambar dibawah ini:
Gambar 7. Konsentrasi Maksimum (Cmaks) Rata-rata Tablet Metoklopramid BTST (Bahan Tambahan Sari Tape) dan Primperan® dalam Plasma Kelinci.
[image:48.595.115.509.409.640.2]Gambar 8. Waktu Konsentrasi Obat Mencapai Puncak (Tmaks) Rata-rata Tablet Metoklopramid BTST (Bahan Tambahan Sari Tape) dan Primperan® dalam Plasma Kelinci.
[image:49.595.115.502.400.619.2]4.4 Analisis Data
Hasil penelitian dari Tabel 4 dapat dilihat bahwa konsentrasi maksimum
( ) dari tablet metoklopramid BTST (1,87 mcg/ml) lebih besar dibandingkan
dengan tablet Primperan® (1,37 mcg/ml). Adapun waktu yang diperlukan untuk
mencapai konsentrasi tertinggi ) dari tablet metoklopramid BTST (61,80
menit) lebih cepat dibandingkan dengan tablet Primperan® (74,58 menit). Jika
dilihat dari nilai AUC yang diperoleh dengan menggunakan rumus trapesium
jumlah (kadar) obat yang diabsorpsi didalam darah pada tablet metoklopramid
BTST (1007,37 mcg/ml menit) lebih besar dibanding dengan tablet Primperan®
(745,23 mcg/ml menit). Hal ini kemungkinan dikarenakan bahan tambahan sari
tape padat pada tablet metoklopramid memiliki sifat larut dalam air, sehingga
tablet metoklopramid yang diformulasi dengan sari tape padat ini lebih cepat larut
dan diabsorpsi sehingga waktu yang diperlukan untuk mencapai konsentrasi
tertinggi ) lebih cepat dan kadar tertinggi ( ) serta jumlah (kadar) obat
yang diabsorpsi didalam darah (AUC) lebih besar dibanding tablet Primperan®.
(Bhowmik, et al., 2009).
Untuk mengetahui apakah sedian metoklopramid yang diformulasi dengan
bahan tambahan sari tape bioekivalen dengan tablet metoklopramid merek dagang
yang terdapat di pasaran (Primperan ®) adalah dengan menggunakan parameter:
Bioavailabilitas Relatif (BR):
Adapun syarat dari kedua obat dikatakan ekivalen adalah jika:
0,8 <
>
1,250,8 <
>
1,25 [image:51.595.257.381.83.164.2]Maka hasil perhitungan tersebut dapat dilihat dari tabel 5 dibawah ini :
Tabel 5. Data perhitungan Bioekivalensi Obat
BR
1,39 0,82 1,38
Hasil yang ditunjukkan pada Tabel 5 dapat dilihat bahwa bioavailabilitas
relative (BR) lebih besar dari 1,25, lebih besar dari 0,8 dan lebih
besar dari 1,25. Berdasarkan hasil tersebut maka kedua sedian dikatakan tidak
bioekivalen. Hal ini seperti yang dijelaskan sebelumnya yaitu bahan tambahan
sari tape padat pada tablet metoklopramid memiliki sifat larut dalam air, sehingga
tablet metoklopramid yang diformulasi dengan sari tape padat ini lebih cepat larut
dan diabsorpsi sehingga waktu yang diperlukan untuk mencapai konsentrasi
tertinggi ) lebih cepat dan kadar tertinggi ( ) serta jumlah (kadar) obat
yang diabsorpsi didalam darah (AUC) lebih besar dibanding tablet Primperan®.
Oleh karena itu terdapat perbedaan yang signifikan dari kedua tablet tersebut.
Data dianalisis dengan Independent Sample T-Test menggunakan program
SPSS. Tabel pengujian parameter ketersediaan hayati metoklopramid BTST dan
[image:51.595.192.432.235.298.2]Tabel 6. Data Statistik Pengujian Metoklopramid Bahan Tambahan Sari Tape dan Primperan®
Perlakuan N Rata-rata Std.Deviasi Rata-rata
Std.Eror
Signifikan
Metoklopramid BTST
Primperan
6 1,868
1,365 0,24 0,26 0,096 0.11 0,006 0,006 Metoklopramid BTST Primperan
6 61,80
74,58 6,22 22,13 2,54 9,03 0,203 0,224
AUC Metoklopramid BTST
Primperan
6 1007.377
745,23 86,53 112,61 35,33 45,97 0,001 0,001
Hasil data statistik dapat dilihat bahwa hanya Tmaks dari kedua sediaan
yang menunjukkan nilai signifikan lebih besar dari 0,05 (p>0,05), sedangkan
Cmaks dan AUC lebih kecil dari 0,05 (p<0,05). Berdasarkan hal tersebut maka
terdapat perbedaan diantara tablet Metoklopramid BTST dan Primperan®. Ini
berarti bahwa pada tingkat kepercayaan 95% terdapat perbedaan yang signifikan
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Hasil penelitian ini dapat dilihat bahwa sedian tablet Metoklopramid
bahan tambahan sari tape memiliki = 1,868 mcg/ml, = 61,80 menit
dan AUC = 1007,377 mcg/ml menit. Sediaan tablet metoklopramid merek dagang
yang terdapat dipasaran (Primperan®) memilki = 1,365 mcg/ml ,
= 74,58 menit dan AUC = 745,23 mcg/ml menit. Berdasarkan data yang
diperoleh dapat disimpulkan bahwa sediaan metoklopramid bahan tambahan sari
tape tidak bioekivalen dengan metoklopramid merek dagang (Primperan®) di
mana hasil yang ditunjukkan pada Tabel 5 dapat dilihat bahwa bioavailabilitas
relative (BR) lebih besar dari 1,25, lebih besar dari 0,8 dan lebih
besar dari 1,25.
5.2Saran
Disarankan kepada peneliti selanjutnya untuk melakukan penelitian
penetapan kadar metoklopramid bahan tambahan sari tape secara in vivo
DAFTAR PUSTAKA
Anonim. (2006). Ketersediaan Hayati Obat. Tanggal Akses Juli 2008. http//www.Portalkalbe.com
Aiache, J.M. (1993). Farmasetika 2-Biofarmasi. Edisi ke II. Penerjemah: Widji Soeratri. Surabaya: Airlangga University Press. Halaman 11, 12, 13, 14, 104.
Bhowmik, D., Chiranjib, B., Krishnakanth, dan Margret, R. (2009). Fast Dissolving Tablet: An Overview. Journal of Chemical and Pharmaceutical Research. 1(1): 1-5
Ditjen POM. (1995). Farmakope Indonesia. Edisi ke IV. Jakarta: Departemen Kesehatan RI. Halaman 555, 556, 1009, 1010, 1011.
De Lux Putra, E. (2007). Dasar-dasar Kromatografi Cair Kinerja Tinggi. Fakultas Farmasi Universitas Sumatera Utara-Medan. Halaman 82-88.
Jones, D.S. (2002). Statistik Farmasi. Penerjemah: Hesty Utami Ramadaniati dan Harrizul Rivai. Jakarta: EGC. Halaman 218-221.
Johnson, E.L. dan Stevenson, R. (1991). Dasar Kromatografi Cair. Bandung: Penerbit ITB. Halaman 236.
Katzung, B. (2001). Farmakologi Dasar dan Klinik. Edisi ke VIII. Penerjemah: Bagian Farmakologi FKUA. Jakarta: Penerbit Salemba Medika. Halaman 36.
McMaster, M.C (2007). HPLC A Practical User’s Guide, Edisi ke II, New Jersey: John Wiley and Sons Inc. Halaman 106.
Munson, J.W. (1991). Analisis Farmasi Metode Modern. Parwa B. Surabaya: Airlangga University Press. Halaman 46 dan 96.
Neal, M.J. (2005). At at Glance Farmakologi Medis. Edisi ke V. Jakarta: Penerbit Erlangga. Halaman 66 dan 67.
Shargel, L., dan Yu, A.B.C. (2005). Biofarmasetika dan Farmakokinetika Terapan. Cetakan Kedua. Penerjemah: Sitti Sjamsiah. Surabaya: Airlangga University Press. Halaman 137, 160 – 186 dan 201.
Siswandono dan Soekardjo, B. (2000). Kimia Medisinal. Edisi kedua. Surabaya: Airlangga Universitas Press. Halaman 32 dan 33.
Tjay, T.H., dan Rahardja, K. (2002). Obat-Obat Penting. Edisi ke V. Jakarta: PT. Elex Media Komputindo. Halaman 254, 263, 264, 296, 309, 313.
Waldon, D.J. (2008). Pharmacokinetics and Drug Metabolism. Cambridge: One Kendall Square. Halaman 86-89.
Lampiran 2. Hasil Orientasi Menentukan Perbandingan Fase Gerak dengan Menggunakan Alat KCKT
2.1. Kromatogram hasil penyuntikan larutan Metoklopramid BP dengan konsentrasi 10 mcg/ml, fase gerak (a) Campuran 1% Asam asetat glasial dalam Air dan, (b) Campuran Asetonitril-methanol (3,7 : 1), dimana a : b = 60:40.
2.3. Kromatogram hasil penyuntikan larutan Metoklopramid BP dengan konsentrasi 10 mcg/ml, fase gerak (a) Campuran 1% Asam asetat glasial dalam Air dan, (b) Campuran Asetonitril-methanol (3,7 : 1), dimana a : b = 50:50.
2.4. Kromatogram hasil penyuntikan larutan Metoklopramid BP dengan
2.5. Kromatogram hasil penyuntikan larutan Metoklopramid BP dengan
konsentrasi 10 mcg/ml dalam plasma , fase gerak (a) Campuran 1% Asam asetat glasial dalam Air dan, (b) Campuran Asetonitril-methanol (3,7 : 1), dimana a : b = 50:50.
2.6. Kromatogram hasil penyuntikan larutan Metoklopramid BP dengan
Lampiran 4. Perhitungan persamaan regresi dari kurva kalibrasi Metoklopramid BP yang diperoleh secara KCKT
Data X Y X2 Y2 XY
1 0,0000 0,0000 0,0000 0,0000 0,0000
2 0,5000 42,2830 0,2500 1787,8521 21,1415
3 1,0000 68,4420 1,0000 4684,3074 68,4420
4 1,5000 86,7360 2,2500 7523,1337 130,1040
5 2,0000 114,0300 4,0000 13002,8409 228,0600
6 2,5000 134,8500 6,2500 18184,5225 337,1250
Total 7,5000 446,3410 13,7500 45182,6565 784,8725
Rataan 1,2500 74,3902 2,2917 7530,4428 130,8121
y = ax + b
51,8734
b = y – ax
b =
74,3902–
51,8734 (1,2500)b = 9,5484
r = 0,9913
Jadi, persamaannya didapat :
Lampiran 5. Pengambilan Plasma Untuk Kurva Kalibrasi Metoklopramid HCl
Kelinci
Dipuasakan minimal 8 jam sebelum percobaan
Ditimbang
Dicukur bulu telinganya hingga bersih
Diambil darah lebih kurang 10 ml
Dimasukkan kedalam 5 tabung yang telah berisi 2 tetes heparin
Ditambahkan 2 ml TCA 20%
Divorteks hingga homogen
Disentrifuge pada kecepatan 3000 rpm selama 10 menit
Diambil supernatannya
Lampiran 6. Pembuatan Kurva Kalibrasi Metoklopramid HCl
Metoklopramid HCl
Ditimbang sebanyak 10 mg
Dimasukkan kedalam labu tentukur 10 ml
Ditambahkan Aquabidest hingga larut dan cukupkan sampai garis tanda
Larutan Metoklopramid HCl
(LIB I)
(1000mcg/ml)
Dipipet sebanyak 1 ml
Dimasukkan kedalam labu tentukur 10 ml
Ditambahkan Aquadest hingga larut dan cukupkan hingga garis tanda
Larutan Metoklopramid HCl
(LIB II)
(100 mcg/ml)
Dipipet sebanyak 1 ml
Dimasukkan kedalam labu tentukur 10 ml
Ditambahkan Aquadest hingga larut dan cukupkan hingga garis tanda
Larutan Metoklopramid HCl
(LIB III)
Lampiran 6. (lanjutan)
Larutan Metoklopramid HCl
(LIB III)
(10 mcg/ml)
Dipipet sebanyak 0,05 ml, 0,1 ml, 0,15 ml, 0,2 ml dan 0,25 ml
Diencerkan dengan plasma hingga 1 ml
Diinjekkan ke alat KCKT pada panjang gelombang 273 nm
Lampiran 7. Perlakuan Pada Hewan Percobaan dengan Pemberian Tablet Metoklopramid HCl
Kelinci
Dipuasakan minimal 8 jam sebelum percobaan
Ditimbang
Dicukur bulu telinganya hingga bersih dan diambil 1 ml darah untuk blanko
Diberikan Tablet Metoklopramid HCl dengan dosis 10 mg secara peroral
Dibilas spuit dengan heparin dan diambil darah sebanyak 1 ml pada waktu 10 menit setelah pemberian obat, kemudian 20, 30, 45, 60, 90, 120, 180, 300, dan 420 menit
Dimasukkan kedalam tabung sentrifuge yang telah berisi 2 tetes heparin
Cuplikan Darah
Ditambahkan TCA 20% sebanyak 1 ml
Divorteks hingga homogeny
Disentrifuge pada kecepatan 3000 rpm selama 10 menit
Diambil supernatan
Diukur pada alat KCKT pada panjang gelombang 273 nm
Lampiran 8. Kadar Metoklopramid Bahan Tambahan Sari Tape (BTST) dalam Plasma Pada Kelinci Jantan Setiap Waktu Pengambilan Sampel
waktu (menit)
Hewan Uji
Rata-rata Kadar ± SD
(mcg/ml)
I II III IV V VI
Area Kadar Area Kadar Area Kadar Area kadar Area Kadar Area Kadar
10 58.55643 0.94476 58.47541 0.94320 63.35810 1.03733 57.20463 0.91870 52.88734 0.83548 52.22290 0.82267 0.91702±0.079
20 60.88715 0.98969 79.34096 1.34544 79.34090 1.34543 60.88014 0.98956 61.52069 1.00191 61.35101 0.99864 1.11178±0.181
30 79.96545 1.35748 87.75655 1.50767 85.17495 1.45791 91.21939 1.57443 86.57891 1.48497 74.70572 1.25608 1.43976±0.114
45 95.59378 1.65876 110.25919 1.94147 98.95189 1.72349 107.49596 1.88820 96.16418 1.66975 97.46774 1.69488 1.76276±0.122
60 110.73630 1.95067 122.64136 2.18017 112.44984 1.98370 96.01249 1.66683 103.82399 1.81742 104.58865 1.83216 1.90516±0.175
90 90.10239 1.55290 115.25043 2.03769 116.18242 2.05566 90.10239 1.55290 97.46774 1.69488 96.16418 1.66975 1.76063±0.22