SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIJAMUR EKSTRAK METANOL DAUN SIKKAM (Bischofia javanica
Blume) TERHADAP JAMUR YANG DIISOLASI DARI TANAMAN PADI
SKRIPSI
HARYATI 140802007
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
2018
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIJAMUR EKSTRAK METANOL DAUN SIKKAM (Bischofia javanica
Blume) TERHADAP JAMUR YANG DIISOLASI DARI TANAMAN PADI
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
HARYATI 140802007
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUANALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2018
PENGESAHAN SKRIPSI
Judul : Skrining Fitokimia dan Uji Aktivitas Antijamur Ekstrak Metanol Daun Sikkam (Bischofia javanica Blume) Terhadap Jamur yang di Isolasi dari Tanaman Padi
Kategori : Skripsi
Nama : Haryati
Nomor Induk Mahasiswa : 140802007
Program Studi : Sarjana (S1) Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara
Disetujui di, Medan, September 2018
Ketua Program Studi Pembimbing,
Dr. Cut Fatimah Zuhra, M.Si Dr. Rumondang Bulan, MS NIP. 1974 0405 1999 032001 NIP. 1954 0830 1985 032001
PERNYATAAN ORISINALITAS
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIJAMUR EKSTRAK METANOL DAUN SIKKAM (Bischofia javanica Blume)
TERHADAP JAMUR YANG DIISOLASI DARI TANAMAN PADI
SKRIPSI
Saya menyatakan bahwa skripsi ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan , September 2018
HARYATI 140802007
PENGHARGAAN
Alhamdulillahirabbil‟alamin, segala puji dan syukur penulis panjatkan kepada Allah SWT karena telah melimpahkan rahmat dan keberkahan sehingga penulis dapat menyusun skripsi yang berjudul “Skrining Fitokimia dan Uji Aktivitas Antijamur Ekstrak Metanol Daun Sikkam (Bischoffia javanica Blume) Terhadap Jamur yang di Isolasi dari Tanaman Padi”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Kimia pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Ayah tercinta, Sumarno dan Ibu tercinta, Agustina serta kepada kedua adik penulis Avryana dan Alvia Riskyana yang selalu menyemangati, mendoakan dan memberikan dukungan baik moril ataupun material kepada penulis dalam studi.
Penulis juga mengucapkan terima kasih kepada:
1. Ibu Dr. Rumondang Bulan, MS selaku Dosen Pembimbing yang telah membimbing, mengarahkan, memberikan saran dan masukan dengan sabar sehingga penulisan skripsi ini terselesaikan.
2. Ibu Dr. Cut Fatimah Zuhra, S.Si., M.Si selaku Ketua Departemen Kimia FMIPA USU dan Ibu Dr. Sovia Lenny, S.Si, M.Si. selaku Sekretaris Departemen Kimia FMIPA USU. Bapak Dr. Firman Sebayang M.S, Bapak M. Zulham Effendi Sinaga, S.Si, M.Si, Ibu Dr. Emma Zaidar Nst, M.Si dan Ibu Dr. Yuniarti Yusak, MS yang memberi masukan-masukan kepada penulis.
3. Teman dekat Muhammad Syahputra Tanjung dan sahabat-sahabat penulis Siti Ismi Ningrum, Tri Indah Rezeki, Wirda Lena, Yuni Romasni Purba, Ismi Azizah, Kakak dan abang serta teman-teman seperjuangan Kimia S1 2014 yang tidak dapat disebutkan satu persatu terimakasih untuk semangat, saran, masukan dan bantuan yang kalian berikan kepada penulis.
Harapan saya, semoga skripsi ini dapat bermanfaat bagi pembaca dan menambah ilmu pengetahuan.
Medan, September 2018 Penulis
(Haryati)
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIJAMUR EKSTRAK METANOL DAUN SIKKAM (Bischofia javanica Blume)
TERHADAP JAMUR YANG DIISOLASI DARI TANAMAN PADI
ABSTRAK
Skrining fitokimia dan uji aktivitas antijamur telah dilakukan dari ekstrak metanol daun sikkam (Bischofia javanica Blume) terhadap jamur yang diisolasi dari tanaman padi. Penelitian ini bersifat eksperimen laboratorium yang bertujuan untuk mengetahui kandungan senyawa aktif dan aktivitas antijamur ekstrak metanol daun sikkam terhadap jamur uji. Skrining fitokimia dilakukan terhadap serbuk simplisia ekstrak metanol daun sikkam. Ekstraksi dilakukan dengan cara maserasi menggunakan pelarut metanol. Pengujian aktivitas antijamur dilakukan secara in vitro dengan metode difusi agar menggunakan cakram kertas. Hasil skrining fitokimia ekstrak metanol daun sikkam menunjukkan adanya senyawa flavonoid, terpenoid, tanin dan saponin. Jamur patogen yang berhasil diisolasi dari tanaman padi yaitu Fusarium oxysporum dan Rhizoctonia solani. Hasil uji aktivitas antijamur ekstrak metanol daun sikkam terhadap jamur Fusarium oxysporum dan Rhizoctonia solani menunjukkan daya hambat yang berbeda pada tiap variasi konsentrasi. Hasil uji aktivitas antijamur ekstrak metanol daun sikkam terhadap jamur Fusarium oxysporum pada konsentrasi 5, 25, 45, 65, 85% (b/v) berturut-turut yaitu 0 ; 0,81 ; 1,28 ; 1,83 dan 2,20 mm, dengan variasi konsentrasi yang sama uji aktivitas antijamur ekstrak metanol daun sikkam terhadap jamur Rhizoctonia solani berturut- turut yaitu 0 ; 0,60 ; 1,09 ; 1,86 dan 2,47 mm. Dari hasil yang diperoleh dapat disimpulkan bahwa ekstrak metanol daun sikkam memiliki daya hambat yang lemah terhadap jamur Fusarium oxysporum dan Rhizoctonia solani.
Kata kunci : Antijamur, Daun Sikkam, Fusarium oxysporum, Rhizoctonia solani, skrining fitokimia
THE PHYTOCHEMICAL SCREENING AND ANTIFUNGAL ACRIVITY METHANOL EXTRACT FROM SIKKAM (Bischofia javanica
Blume ) LEAVES ON FUNGI ISOLATED FROM RICE PLANTS
ABSTRACT
Phytochemical screening and antifungal activity test of methanol extract from sikkam leaves (Bischofia javanica Blume) on against fungi isolated from rice plants has been done. This research is a laboratory experiment which aims to determine the content of active compounds and antifungal activity from methanol extract of sikkam leaves on the test fungi. Phytochemical screening was carried out on simplicia powder of methanol extract from sikkam leaves. Extraction is done by maceration using methanol. Testing of antifungal activity was carried out in vitro by diffusion method use paper discs. The results of phytochemical screening of methanol extract from sikkam leaves showed contain compaunds of flavonoids, terpenoids, tannins and saponins. Pathogenic fungi that have been isolated from rice plants are Fusarium oxysporum and Rhizoctonia solani. The results of antifungal activity test of methanol extract from sikkam leaves on Fusarium oxysporum and Rhizoctonia solani fungi showed different inhibitory power at each variation of concentration. Antifungal activity test results of methanol extract from sikkam leaves on Fusarium oxysporum fungi at concentrations of 5, 25, 45, 65, 85% (b / v), respectively 0 mm; 0.81 mm; 1.28 mm; 1.83 mm and 2.20 mm, with the same variation concentration of antifungal activity test of methanol extract from sikkam leaves on Rhizoctonia solani, respectively 0 ; 0.60 ; 1.09 ; 1.86 and 2.47 mm. From the results, can be concluded that methanol extract of sikkam leaves has a weak inhibitory effect on Fusarium oxysporum and Rhizoctonia solani fungi.
Keywords : Antifungal, Sikkam leaves, Fusarium oxysporum, Rhizoctonia solani, Phytochemical screening
DAFTAR ISI
Halaman
PENGESAHAN SKRIPSI i
PERNYATAAN ORISINALITAS ii
PENGHARGAAN iii
ABSTRAK iv
ABSTRACT v
DAFTAR ISI vi
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Rumusan Masalah 3
1.3 Pembatasan Masalah 3
1.4 Tujuan Penelitian 4
1.5 Manfaat Penelitian 4
1.6 Metodologi Penelitian 4
BAB 2 TINJAUAN PUSTAKA
2.1 Tumbuhan Sikkam 6
2.1.1 Morfologi Tumbuhan Sikkam 7
2.1.2 Kandungan Kimia Tumbuhan Sikkam 8
2.1.3 Kegunaan Tumbuhan Sikkam 8
2.2 Senyawa Metabolit Sekunder 9
2.2.1 Flavonoid 10
2.2.2 Tanin 11
2.2.3 Terpenoid 11
2.2.4 Saponin 12
2.2.5 Alkaloid 12
2.3 Simplisia dan Ekstrak 12
2.3.1 Ekstraksi 13
2.4 Jamur (Fungi) 14
2.5 Isolasi Jamur dan Pengujian Jamur (Fungi) 16
2.6 Antijamur 19
2.6.1 Mekanisme Penghambatan Mikroorganisme 19 2.6.1.1 Mengganggu Pembentukan Dinding Sel 20 2.6.1.2 Bereaksi dengan Membran Sel 20
2.6.1.3 Menginaktivasi Enzim 20
2.6.1.4 Menginaktivasi Fungsi Material Genetik 20
2.6.2 Uji Antimikroba 21
2.6.2.1 Metode Penyebaran (Diffusion Methods) 21 2.6.2.2 Metode Pengenceran (Dilution Methods) 23
2.6.2.3 Metode Bioautografi 24
2.6.2.4 Metode Gores Silang 25
BAB 3 Metode Penelitian
3.1 Waktu dan Tempat 26
3.2 Alat dan Bahan 26
3.2.1 Alat 26
3.2.2 Bahan 27
3.3 Prosedur Penelitian 28
3.3.1 Pengambilan dan Pengolahan Tumbuhan 28
3.3.2 Pembuatan Pereaksi 28
3.3.3 Analisa Kadar Air 29
3.4 Pembuatan Ekstrak Metanol Daun Sikkam 29
3.5 Skrining Fitokimia 30
3.5.1 Uji Tanin 30
3.5.2 Uji Terpenoid 30
3.5.3 Uji Alkaloid 30
3.5.4 Uji Saponin 31
3.5.5 Uji Flanonoid 31
3.6 Isolasi Jamur Patogen dari Tanaman Padi 31 3.7 Uji Aktivitas Antijamur Ekstrak Metanol Daun Sikkam
Metode Cakram Kertas 31
3.7.1 Sterilisasi Alat 31
3.7.2 Pembuatan Media 32
3.7.2.1 Pembuatan Media Potato Dextrose Agar` 30
3.7.2.2 Pembuatan Stok Kultur 31
3.7.3 Pembuatan Larutan Uji Ekstrak Metanol Daun
Sikkam dengan berbagai Konsentrasi 32 3.7.4 Pengujian Aktivitas Antijamur Ekstrak Metanol
Daun Sikkam 33
3.8 Bagan Penelitian 34
3.8.1 Pembuatan Ekstrak Metanol Daun Sikkam 34
3.8.2 Analisa Kadar Air 35
3.8.3 Uji Skrining Fitokimia Ekstrak Metanol
Daun Sikkam 35
3.8.4 Isolasi Jamur dari Tanaman Padi 36 3.8.5 Uji Aktivitas Antijamur dengan Metode
Cakram Kertas 36
3.8.5.1 Pembuatan Media Potato Dextrose Agar 36 3.8.5.2 Pembuatan Stok Kultur Jamur 37 3.8.5.3 Preparasi Larutan Uji 38
3.8.5.4 Uji Antijamur 39
BAB 4 HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian 40
4.1.1 Penentuan Kadar Air Serbuk Daun Sikkam 40
4.1.2 Ekstraksi Daun Sikkam 40
4.1.3 Skrining Fitokimia Ekstrak Metanol Daun Sikkam 40 4.1.4 Isolasi dan Identifikasi Jamur Patogen dari Tanaman
Padi 41
4.1.5 Hasil Uji Aktivitas Antijamur Ekstrak Metanol Daun
Sikkam 43
4.2 Pembahasan
4.2.1 Penentuan Kadar Air Daun Sikkam 44 4.2.2 Ekstrak Metanol Daun Sikkam 45 4.2.3 Skrining Fitokimia Ekstrak Metanol Daun Sikkam 46 4.2.4. Isolasi Jamur Patogen dari Tanaman Padi 48
4.2.4.1 Fusarium oxysporum 48
4.2.4.2 Rhizoctonia solani 50
4.2.5 Hasil Uji Aktivitas Antijamur Ekstrak Metanol Daun
Sikkam 52
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 57
5.2 Saran 57
Daftar Pustaka 58
Lampiran 62
DAFTAR TABEL
Nomor Judul Halaman
Tabel
4.1 Hasil Skrining Fitokimia Ekstrak Metanol Daun Sikkam 41 4.2 Hasil Karakteristik Jamur Fusarium oxysporum 42 4.3 Hasil Karakteristik Jamur Rhizoctonia solani 43 4.3 Hasil Uji Aktivitas Antijamur Ekstrak Metanol Daun Sikkam 44
DAFTAR GAMBAR
Nomor
Gambar Judul Halaman
2.1(a) Daun Tanaman Sikkam 7
2.1(b) Batang Tanaman Sikkam 7
2.1(c) Buah Tanaman Sikkam 7
2.1(d) Tanaman Sikkam 7
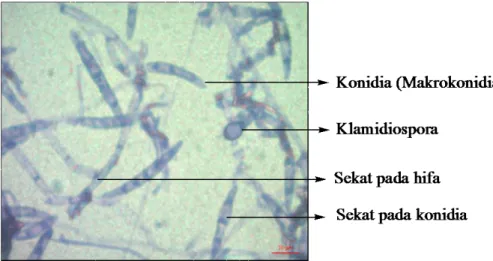
4.1 Koloni Jamur Fusarium oxysporum 42
4.2 Koloni Jamur Rhizoctonia solani 43
4.3 Prediksi Reaksi Uji Flavonoid dengan HCl pekat dan Serbuk Mg 47
4.4 Reaksi hidrolisis saponin dalam air 47
4.5 Reaksi Dugaan Pembentukan Fe-Tanin yang Berwarna Hijau
Kehitaman 48
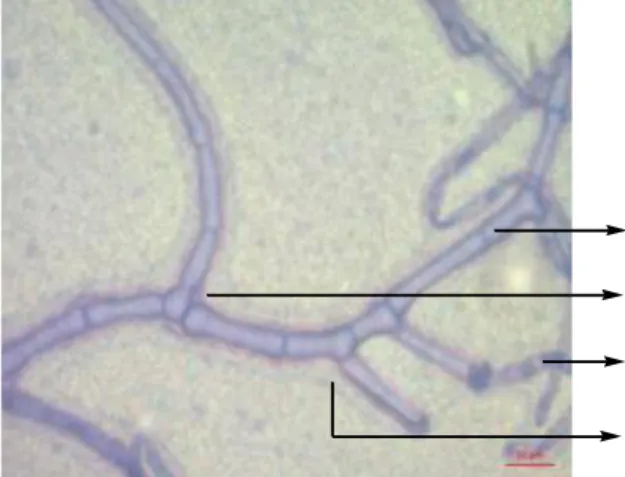
4.6 Mikroskopis Jamur Fusarium oxysporum Hasil Penelitian 50 4.7 Mikroskopis Jamur Fusarium oxysporum (Watanabe, 2002) 50 4.8 Mikroskopis Jamur Rhizoctonia solani Hasil Penelitian 51 4.9 Mikroskopis Jamur Rhizoctonia solani (Watanabe,2002) 51
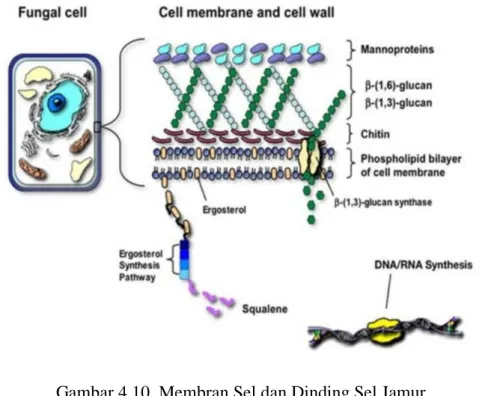
4.10 Membran Sel dan Dinding Sel Jamur 55
DAFTAR LAMPIRAN
No. Judul Halaman
Lampiran
L.1 Hasil Herbarium/Identifikasi Tumbuhan Sikkam 62 L.2 Perhitungan Penentuan Kadar Air Serbuk Daun Sikkam 64 L.3 Perhitungan Penentuan Persentase Kadar Ekstrak Metanol Daun
Sikkam 64
L.4 Dokumentasi Proses Isolasi Jamur Patogen Tanman Padi 64 L.5 Hasil Uji Aktivitas Antijamur Ekstrak Metanol Daun Sikkam
(Bischofia javanica Blume) 66
L.6 Dokumentasi Beberapa Alat dan Bahan yang Digunakan dalam
Penelitian 67
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Tanaman padi (Oryza sativa L.) merupakan tanaman pangan penting yang menjadi makanan pokok lebih dari setengah penduduk dunia karena mengandung nutrisi yang diperlukan tubuh, di Indonesia padi merupakan sumber makanan pokok bagi hampir seluruh penduduk Indonesia. Menurut (Suwandi, 2015) jumlah penduduk Indonesia mencapai 252,17 juta orang dengan laju pertumbuhan sebesar 1,31% serta tingkat konsumsi beras mencapai 132,98 kg/perkapita/pertahun, sehingga memerlukan pangan yang cukup besar. Oleh karena itu peningkatan produksi beras di Indonesia saat ini menjadi prioritas utama untuk mengatasi kekurangan suplai. Berkaitan dengan peningkatan produksi, Direktorat Jendral Tanaman Pangan menetapkan strategi pencapaian produksi tanaman pangan melalui empat strategi dan salah satunya yaitu perlindungan tanaman pangan dari gangguan OPT. Upaya yang telah dilakukan pemerintah tersebut nampaknya belum mencapai hasil yang optimal, hal ini dapat dilihat dari pencapaian produksi padi yang relatif kurang signifikan dibandingkan dengan laju pertumbuhan jumlah penduduk, dan ada kecenderungan produksi padi justru cenderung mengalami penurunan pada beberapa tahun terakhir. Berdasarkan data Badan Pusat Statistik dan Derektorat Jendral Tanaman Pangan, Produktivitas padi sawah pada tahun 2017 di Indonesia yaitu 53,15% dibanding tahun 2016 yaitu sebesar 55,08 sehingga disimpulkan mengalami penurunan sebesar 1,93%.
(Kasijadi dkk, 2007) menyebutkan penyebab terjadinya penurunan produktivitas dan efisiensi usaha padi adalah sebagian besar petani menggunakan benih kualitas rendah dan berlebihan, bibit relatif tua, penanaman yang intensif diikuti penggunaan pupuk yang tidak rasional, berkembangnya Organisme Pengganggu Tanaman (OPT). Ou (1985) menyatakan bahwa lebih dari 60 jenis penyakit padi disebabkan oleh jenis patogen yang beragam seperti nematoda, virus, bakteri dan jamur. Terdapat beberapa jenis jamur patogen yang secara umum menimbulkan penyakit pada tanaman padi sehingga berakibat pada kerugian petani, yaitu Helmintosporium oryzae (penyebab penyakit bercak daun coklat), Pyricularia
oryzae (penyebab penyakit blast), Rhizoctonia solani (penyebab penyakit busuk pelepah daun), Fussarium oxysporum (penyebab penyakit layu pada padi).
Penggunaan pestisida di lingkungan persawahan khususnya untuk mengendalikan hama yang menyerang tanaman di persemaian dan tanaman saat ini masih menimbulkan dilema. Penggunaan pestisida khususnya pestisida sintetis/kimia memberikan keuntungan secara ekonomis, namun dapat mendatangkan kerugian diantaranya adalah residu yang tertinggal tidak hanya pada tanaman, tapi juga air, tanah dan udara dan penggunaan terus-menerus akan mengakibatkan efek resistensi dari berbagai jenis hama (Djafaruddin, 2001).
Menurut Kordi (2004), metode yang paling baik dalam penanggulangan hama dan penyakit tanaman adalah metode yang tidak menimbulkan dampak terhadap lingkungan dalam jangka pendek maupun jangka panjang. Hal ini menyebabkan perlu adanya fungisida alternatif yang ramah lingkungan dan mudah didapatkan dari alam. Salah satu cara untuk mendapatkan fungisida alternatif yaitu dengan memanfaatkan ekstrak tanaman. Ekstrak tanaman mengandung metabolit sekunder dapat dikembangkan sebagai fungisida alternatif untuk menghambat pertumbuhan jamur patogen. Tumbuhan sikkam (Bischofia javanica Blume) merupakan salah satu tanaman yang telah diketahui mengandung senyawa metabolit sekunder yang berpotensi sebagai antimikroba. Beberapa penelitian telah dilakukan terhadap tumbuhan sikkam, penelitian (Saragih, 2001) ekstrak kulit batang sikkam memiliki sifat antimikroba yang diuji pada beberapa jenis bakteri dimana fraksi etil asetat menunjukan diameter hambat yang paling tinggi yaitu berkisar antara 5-24,5 mm dengan volume ekstrak (15-75 µl).
Penelitian (Tambunan, 2014) ekstrak etanol kulit batang sikkam juga menunjukkan sifat antidiare yang diberikan pada tikus yang diinduksi dengan oleum ricini menggunakan metode defekasi. Pemberian dosis 125 mg/kg bb menunjukkan efek yang tidak berbeda secara signifikan (p < 0,05) dengan obat pembanding loperamid HCl 1 mg/kg bb.
Penelitian (Sutharson et al., 2011) menunjukkan bahwa ekstrak metanol daun sikkam (Bischofia javanica Blume) menunjukan nilai sitotoksis yang sangat signifikan dengan nilai IC50 dari ekstrak metanol daun sikkam sangat rendah yaitu 3.5µg/ml dalam waktu inkubasi 72 jam pada sel manusia HL60 secara invitro.
Pengujian ekstrak tanaman sikkam sebagai salah satu pemanfaatan sumber daya alam cukup banyak dilakukan seperti yang telah disebutkan diatas, namun sejauh ini belum ada penelitian yang menggunakan daun sikkam sebagai antijamur karena terdapat sumber menyebutkan bahwa daun sikkam dapat menghalau hama pada tanaman padi dan jagung. Oleh karena itu peneliti tertarik untuk melakukan uji antijamur ekstrak metanol daun sikkam terhadap jamur patogen dimana jamur patogen yang di uji di isolasi langsung dari tanaman padi.
1.2 Perumusan Masalah
Permasalahan pada penelitian ini adalah :
1. Golongan senyawa metabolit sekunder apakah yang terdapat didalam ekstrak metanol daun sikkam (Bischofia javanica Blume) berdasarkan uji skrining fitokimia ?
2. Apa saja jenis jamur patogen yang menyerang tanaman padi ?
3. Apakah ekstrak metanol daun sikkam (Bischofia javanica Blume) memiliki aktivitas antijamur terhadap jamur patogen yang di isolasi dari tanaman padi?
1.3 Pembatasan Masalah
1. Sampel daun Sikkam yang digunakan diambil dari kebun salah satu warga di Kampung Manjangkir, Kecamatan Sidamanik, Kabupaten Simalungun.
2. Pengambilan ekstrak metanol daun Sikkam dilakukan dengan metode ekstraksi maserasi.
3. Pengambilan tanaman padi terinfeksi jamur dilakukan di lahan persawahan salah satu warga di Kampung Susuk, Padang Bulan.
4. Metode isolasi jamur yang digunakan adalah Metode Inkubasi Agar (Agar Test).
5. Uji antijamur dilakukan dengan metode cakram kertas menggunakan jamur yang diisolasi dari tanaman padi.
6. Variasi konsentrasi ekstrak metanol daun sikkam : dimetilsulfoksida untuk uji antijamur yaitu 5%, 25%, 45%, 65%, 85% (b/v).
7. Pengukuran zona hambat dilakukan menggunakan jangka sorong.
8. Uji antijamur dilakukan dengan kontrol positif berupa ketokonazole dan kontrol negatif berupa dimetilsulfoksida.
1.4 Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Untuk mengetahui golongan senyawa metabolit sekunder yang terdapat di dalam ekstrak metanol daun sikkam (Bischofia javanica Blume) berdasarkan uji skrining fitokimia.
2. Untuk mengetahui jenis jamur patogen yang menyerang tanaman padi.
3. Untuk mengetahui aktivitas anti jamur ekstrak metanol daun sikkam (Bischofia javanica Blume) terhadap jamur patogen yang di isolasi dari tanaman padi.
1.5 Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi kandungan metabolit sekunder yang terdapat dalam ekstrak metanol daun sikkam serta hasil penelitian ini diharapkan dapat digunakan sebagai suatu alternatif pemanfaatan zat ekstraktif daun sikkam sebagai bahan fungisida nabati/antijamur untuk mengendalikan jamur patogen yang menyerang tanaman padi.
1.6 Metodologi Penelitian
Penelitian yang dilakukan bersifat eksperimen laboratorium dan sebagai objek penelitian yaitu Daun Sikkam (Bischofia javanica Blume) dan jamur yang digunakan dalam uji aktivitas antijamur diisolasi langsung dari tanaman padi yang terinfeksi jamur patogen. Penelitian diawali dengan pengeringan daun sikkam dengan cara diangin-anginkan di dalam ruang tanpa terpapar sinar matahari secara langsung selama ±5 hari. Setelah kering kemudian dihaluskan dengan cara diblender.
Pembuatan ekstrak metanol daun sikkam diperoleh dengan metode ekstraksi maserasi yaitu dengan merendam serbuk daun sikkam dengan menggunakan pelarut metanol selama 3×24 jam sambil diaduk beberapakali, lalu disaring. Filtrat yang diperoleh dirotarievaporator dan ekstrak pekat metanol yang diperoleh dipekatkan
kembali pada penangas air sampai diperoleh ekstrak bebas dari pelarut metanol dan ditimbang.
Isolasi jamur patogen dari tanaman padi dilakukan dengan menggunakan metode Inkubasi Agar (Agar test). Bagian yang terinfeksi seperti daun, bagian batang tanaman padi dan biji padi dibersihkan di bawah air mengalir lalu dipotong-potong sebesar ±1 cm. Lalu disterilkan dengan menggunakan larutan kloroks (NaOCl) 1%
selama 15-30 detik dan dibilas dengan aquadest sebanyak 2-3 kali. Selanjutnya potongan daun ditanam dalam media PDA yang telah disediakan terlebih dahulu dimana tiap petri berisi 2 ulangan dan diinkubasi pada suhu kamar selama ±1 minggu sampai miselium jamur tumbuh. Dilakukan pengamatan menggunakan mikroskop stereo untuk melihat struktur mikroskopis cendawan. Kemudian uji aktivitas antijamur ekstrak metanol daun sikkam terhadap jamur yang diisolasi dari tanaman padi dilakukan dengan Metode Cakram Kertas dan dihitung nilai zona hambat menggunakan jangka sorong.
BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Sikkam
Sikkam (Bischofia javanica Blume) adalah jenis tanaman dari suku phyllanthaceae dan beberapa sumber lain menyebut suku Euphorbiaceae, umumnya dikenal sebagai Bischop Wood atau Java cedar. Tanaman ini asli Asia selatan dan Tenggara, Australia, dan China. Spesies ini biasanya ditemukan tersebar di hutan kering, hutan hujan, kadang-kadang di hutan hijau, rawa dan hutan jati. Tanaman ini dapat tumbuh dengan subur dalam kondisi lembab, tempat- tempat teduh seperti tepi sungai, rawa dan jurang. Tanaman sikkam cenderung subur di daerah lembab dan gugur di area kering (Kundu et al., 2012).
Sistematika tumbuhan sikkam yang berasal dari hasil identifikasi tumbuhan di laboratorium Herbarium Medanense (MEDA) Universitas Sumatera Utara, adalah sebagai berikut :
Kingdom : Plantae
Devisi : Spermatophyta Kelas : Dicotyledoneae Ordo : Malpighiales Famili : Phyllanthaceae Genus : Bischofia
Spesies : Bischofia javanica Blume
Nama Lokal : Sikkam (Herbarium Medanense (MEDA) (Lampiran 1)
Genus ini ditemukan di Asia Selatan dan selatan timur Australia dan Polinesia. Tanaman ini juga ditemukan di bagian Cina tengah, timur, dan selatan.
Bischofia javanica di distribusikan secara luas di Kepulauan Pasifik, Malaysia, Asia
Tenggara termasuk Indonesia, China Selatan, mungkin juga di Tonga dan Samoa termasuk Taiwan, Jepang Selatan, Myanmar, dan India (Rajbongshi et al., 2014).
Disetiap daerah tanaman ini memiliki nama yang berbeda-beda: sikkam, singkam, cingkam (Batak); tingkeum (Gayo); gadog, gintung, kerinjing (Jawa);
mirentek, kayawu (Minahasa); simamo (Ternate) (Tambunan, 2014), di negara- negara lain disebut jitang (Malaysia); tuai (Sabah, Filiphina); toem, pradu-som (Thailand); khom „fat (Laos), dan nhoi (Vietnam) Bhillar, kaen, kot semla, paniala, pankain (Hindi); akagi (Jepang); Bishop wood, Java cedar (Inggris) (Orwa et al., 2009, Rajbongshi et al., 2014).
2.1.1 Morfologi Tumbuhan
Pohon sikkam (Bischofia javanica Blume) merupakan pohon besar, tingginya dapat mencapai 30-50 m, bercabang-cabang, bagian tanpa cabang biasanya pendek tetapi kadang-kadang hingga mencapai 20 m, batangnya berdiameter hingga 80-170 cm (Orwa et al., 2009) arah tumbuh tegak lurus, berkayu dan kuat, tanpa mata kayu dan termasuk dalam tumbuhan menahun (Kundu et al., 2012).
Gambar 2.1 berurut dari kiri ke kanan : a) Daun Sikkam, b) Batang Sikkam, c) Buah Sikkam, d) Tumbuhan Sikkam (sumber gambar : Google search)
Kulit batang kayu bagian luar memecah dan bersisik dengan sisik-sisik kecil dan tebal, berwarna cokelat kemerahan sampai coklat keunguan, kulit kayu bagian dalam berserat, berwarna merah muda, berserat dan mengeluarkan getah berwarna merah bening (Orwa et al.2009), encer dan agak kental seperti jeli (Rajbongshi et al., 2014).
Daun berwarna hijau dengan panjang 6-16 cm dan lebar 3-10 cm, berbentuk spiral, lonjong dan mempunyai tangkai daun dengan panjang 8-20 cm,
setiap tangkai daun memiliki 3 helai daun dengan ketebalan 7-22 mm, tepi daun bergerigi halus, bertulang daun menyirip, dan pada bagian atas daun mengkilap (Kundu et al., 2012). Bunga bersifat uniseksual, simetris, terdiri dari 5 bagian kelopak bunga, kecil dan berwarna kuning kehijauan. Buah tidak memecah, berbentuk bulat, bergetah, dengan diameter 1,2-1,5 cm, berwarna coklat kemerahan dan berwarna hitam kebiruan jika matang (Kundu et al., 2012), dengan 1-2 biji disetiap ruang, biji berwarna coklat muda, lonjong dengan panjang 5 mm (Indra et al.,2013).
2.1.2 Kandungan Kimia Tumbuhan Sikkam
Daun sikkam mengandung asam tartarat (8-10%), vitamin C, asam elagit, friedelin, friedelin- -ol, friedelin- -ol dan -sitosterol serta tanin. Kulit batangnya mengandung tannin, epi-fiedelanol asetat, asam betulenic, -sitosterol, dan alkaloid. Akar sikkam mengandung - amyrin, asam ursolonik dan -sitosterol.
Biji tanaman sikkam mengandung protein (18,69%), karbohidrat (18,91%), serat (5,32%), tanin (16%) flavonoid, kuersetin, sitosterol, asam stearat (3,89%), asam linolenat (56,76%), asam palmitat (12,28%), asam oleat (12,19%), phospour, kalsium, kalium, natrium, magnesium, zinc, (Rajbongshi et al., 2014).
2.1.3 Kegunaan Tumbuhan
Khasiat tanaman sikkam telah diketahui sejak dahulu oleh masyarakat, misalnya masyarakat Simalungun yang menggunakan ekstrak kulit kayu sikkam sebagai tambahan dalam memasak makanan khas suku batak di Simalungun yaitu nahinasumbah, selain itu digunakan pula sebagai obat sakit perut (antidiare). Studi yang dilakukan oleh (Indra et al., 2013) menyimpulkan bahwa biji Bischofia javanica Blume adalah sumber nutrisi makanan yang baik karena mengandung mineral, protein dan karbohidrat. Minyak biji Bischofia javanica Blume adalah sumber penting asam lemak omega 3 yaitu asam linolenat.
Sikkam juga digunakan sebagai salah satu pewarna alami yang telah dikenal dan digunakan secara turun-temurun jauh sebelum mengenal zat pewarna sintetis untuk mewarnai pakaian, jala dan anyaman dari bambu. Kulitnya menghasilkan tanin yang digunakan untuk menguatkan jaring dan tali dan pewarna merah yang digunakan untuk mewarnai keranjang rotan, kulit kayunya juga digunakan untuk
pengobatan demam tinggi dan luka bakar, buahnya digunakan dalam pembuatan anggur, biji menghasilkan minyak kering yang berguna untuk pelapisan permukaan dan pelumasan, daun digunakan sebagai obat sakit gigi dan untuk pengobatan penyakit mata, tanaman ini memiliki sifat anti-ulkus, antihelmintik (Shu et al., 2008;
Kundu et al., 2012). Kulit batangnya digunakan sebagai aplikasi eksternal pada penyakit kulit (Prasad et al., 2008).
Bischofia javanica telah dilaporkan untuk aktivitas antitusifnya (Gairola et al., 2010) dan juga sebagai obat tradisional yang digunakan untuk pengobatan tuberkulosis, bisul, fraktur, dislokasi dan kondisi peradangan lainnya karena sifat anti radikal bebas (Sutharson et al., 2009). Daun Bischofia javanica digunakan dalam pengobatan Lactagogue yaitu sakit payudara dan untuk memperbaiki aliran susu (Lamxay et al., 2011). Kulit dan daun digunakan untuk pengobatan sakit tenggorokan, diare, kelainan saraf dan untuk merangsang pertumbuhan rambut (Ignacimuthu et al., 2006; Pradhan dan Badola, 2008). Bischofia javanica telah menunjukkan aktivitas antinematoda yang kuat (Alen et al., 2000) dan aktivitas antibakterial (Khan et al., 2001), aktivitas antileukemia (Sutharson et al., 2011), aktivitas antiinflamantori, aktivitas antioksidan, anti-aging dan dapat digunakan sebagai bahan tambahan pada kosmetik yang memberikan efek putih pada kulit dan anti alergi (Rajbongshi et al., 2014).
2.2 Senyawa Metabolit Sekunder
Dalam perkembangannya senyawa metabolit sekunder dipelajari dalam disiplin ilmu tersendiri yaitu kimia bahan alam (natural product chemistry). Contoh metabolit sekunder adalah antibiotik, pigmen, toksik, efektor kompetisi ekologi dan simbiosis, feromon, inhibitor enzim, agen immunemodulasi, reseptor antagonis dan agonis, pestisida, agen antitumor, dan promotor pertumbuhan binatang dan tumbuhan. Identifikasi kandungan metabolit sekunder merupakan langkah awal yang penting dalam penelitian pencarian senyawa bioaktif baru dari bahan alam yang dapat menjadi prekursor bagi sintesis obat baru atau prototipe obat beraktivitas tertentu (Rasyid, 2012). Identifikasi ini merupakan uji fitokimia. Metode yang dilakukan merupakan metode uji berdasarkan yang telah dimodifikasi. Uji yang
dilakukan antara lain uji flavonoid, senyawa fenolik, alkaloid, saponin, tanin dan terpenoid (Harbone, 1987).
Senyawa metabolit sekunder merupakan biomolekul yang dapat digunakan sebagai lead compounds dalam penemuan dan pengembangan obat-obat baru . Lenny (2006) Senyawa-senyawa kimia yang merupakan hasil metabolisme sekunder pada tumbuhan sangat beragam dan dapat diklasifikasikan dalam beberapa golongan senyawa bahan alam yaitu alkaloid, flavonoid, terpenoid, saponin dan tanin.
2.2.1 Flavonoid
Tidak ada benda yang begitu mencolok seperti flavonoid yang memberikan kontribusi keindahan pada bunga dan buah-buahan di alam. Flavin memberikan warna kuning atau jingga, antosianin memberikan warna merah, ungu dan biru.
Secara biologis flavonoid memberikan peranan penting dalam kaitan penyerbukan pada tanaman oleh serangga, sejumlah flavonoid juga memberikan rasa pahit sehingga bersifat menolak pada jenis ulat tertentu (Sastrohamidjojo, 1996)
Flavonoid merupakan golongan terbesar dari senyawa fenol, senyawa fenol mempunyai sifat efektif menghambat pertumbuhan virus, bakteri, dan jamur.
Senyawa flavonoid dan turunannya memiliki dua fungsi fisiologi tertentu, yaitu sebagai bahan kimia untuk mengatasi serangan penyakit (sebagai antibakteri) dan anti virus bagi tanaman. Para peneliti lain juga menyatakan pendapat sehubungan dengan mekanisme kerja dari flavonoid dalam menghambat pertumbuhan bakteri, antara lain bahwa flavonoid menyebabkan terjadinya kerusakan permeabilitas dinding sel bakteri (Sabir, 2005).
Flavonoida pada tumbuhan berfungsi dalam pengaturan fotosintesis, kerja antimikroba dan antivirus dan kerja terhadap serangga (Robinson, 1995). Adapun fungsi flavonoida dalam kehidupan manusia yaitu sebagai stimulant pada jantung, hesperidin mempengaruhi pembuluh darah kapiler. Flavon terhidrolisasi bekerja sebagi diuretik dan antioksidan pada lemak (Sirait, 2007).
2.2.2 Tanin
Tanin terdapat luas pada tumbuhan berpembuluh. Tanin dapat bereaksi dengan protein membentuk kopolimer yang tak larut dalam air. Sebagian besar
tumbuhan banyak mengandung tanin rasanya sepat. Salah satu fungsi tanin dalam tumbuhan ialah sebagai penolak hewan pemakan tumbuhan (Robinson, 1995).
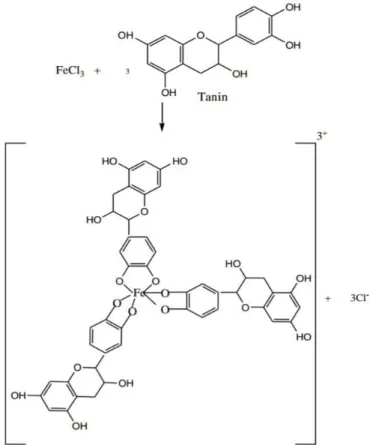
Secara kimiawi tanin merupakan kompleks, biasanya merupakan campuran polifenol yang sulit dipisahkan karena tidak mengkristal. Apabila tanin direaksikan dengan air membentuk larutan koloid yang memberikan reaksi asam dan reaksi yang tajam (Harborne, 1996). Tanin memiliki peranan fisiologis yang kompleks mulai dari pengendap protein hingga pengkhelat logam. Tanin juga dapat berfungsi sebagai antioksidan biologis (Hagerman, 2002). Secara kimia terdapat dua jenis tanin yang tersebar tidak merata dalam dunia tumbuhan yaitu tanin terkondensasi (Proantosianidin) dan tanin terhidrolisis (Hydrolyzable tannin) (Harbone, 1987).
Kedua golongan tanin menunjukkan reaksi yang berbeda dalam larutan garam Fe (III). Tanin terkondensasi menghasilkan warna hijau kehitaman sedangkan tanin terhidrolisis memberikan biru kehitaman.
2.2.3 Terpenoid
Terpenoid mencakup sejumlah besar senyawa tumbuhan. Kebanyakan terpenoid alam memiliki struktur siklik dan mempunyai satu gugus fungsi atau lebih.
Secara kimia, terpenoid umumnya larut dalam lemak dan terdapat di sitoplasma sel tumbuhan. Terpenoid diekstraksi dari jaringan tumbuhan dengan memakai eter atau kloroform dan dapat dipisahkan secara kromatografi (Harbone, 1987). Golongan terpenoid rendah (senyawa C10 dan C15) diperoleh dengan cara destilasi uap dari tanaman segar atau kering, sedangkan anggota yang lebih tinggi biasanya diperoleh dengan cara diekstraksi dengan menggunakan pelarut kemudian dipisahkan dan dimurnikan (Sastrohamidjojo, 1996). Manfaat terpenoid yang telah diketahui yaitu sebagai zat pengatur tumbuh, pemberi aroma atau bau yang khas, dan sebagai pertahanan pada serangga.
Beberapa hasil penelitian menunjukkan bahwa senyawa terpenoid dapat menghambat pertumbuhan dengan mengganggu proses terbentuknya membran dan atau dinding sel, membran atau dinding sel tidak terbentuk atau terbentuk tidak sempurna (Ajizah, 2004).
2.2.4 Saponin
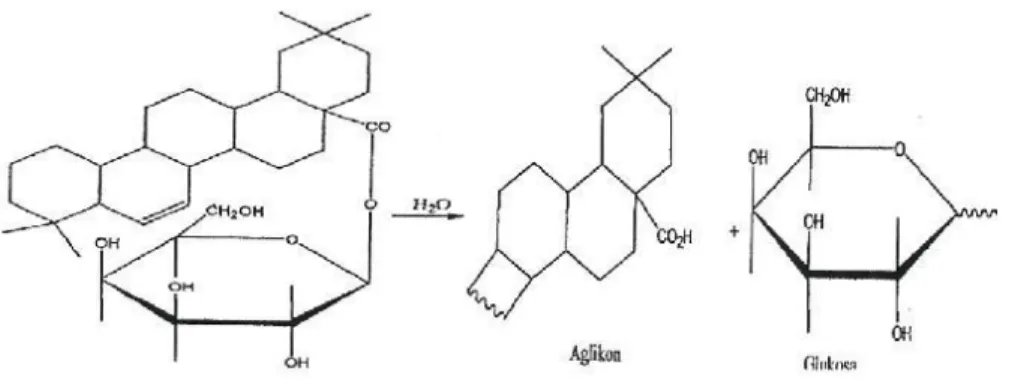
Saponin merupakan glukosida yang larut dalam air dan etanol, tetapi tidak larut dalam eter. (Ganiswarna, 1995) mengatakan Saponin bekerja sebagai antimikroba dengan mengganggu stabilitas membran sel mikroba sehingga menyebabkan sel menjadi lisis, jadi mekanisme kerja saponin termasuk dalam kelompok antimikroba yang mengganggu pemeabilitas membran sel mikroba, yang mengakibatkan kerusakan membran sel dan menyebabkan keluarnya berbagai komponen penting dari dalam sel mikroba yaitu protein, asam nukleat dan nukleotida.
2.2.5 Alkaloid
Alkaloid merupakan senyawa metabolit sekunder yang tidak hanya di temukan pada tanaman tetapi juga pada hewan, serangga, organisme laut, mikroorganisme. Di dalam tanaman yang mengandung alkaloid , alkaloid mungkin terlokasi pada jumlah yang tinggi pada bagian tanaman tertentu. Sebagai contoh reserpin yang terdapat pada akar tanaman Rauvolfia spp, quinin yang terdapat pada kulit Cinchona ledgeriana dan morfin yang terdapat pada getah Papever samniferum.
Kebanyakan alkaloid bersifat basa. Sifat tersebut bergantung pada adanya pasangan elektron pada nitrogen. Jika gugus fungsional yang berdekatan dengan nitrogen bersifat melepas elektron, maka ketersedian elektron pada nitrogen naik sehingga senyawa alkaloid akan bersifat basa. Kebanyakan alkaloid yang telah diisolasi berbentuk kristal, amorf, dan adapula berbentuk cairan seperti nikotin dan koniin (Sastrohamidjojo, 1996).
2.3 Simplisia dan Ekstrak
Simplisia adalah bahan alamiah yang digunakan sebagai obat dan belum mengalami pengolahan apapun, kecuali dikatakan lain, berupa bahan yang telah dikeringkan. Simplisia dibedakan atas simplisia nabati, simplisia hewani dan simplisia pelikan (Depkes, 2000).
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan (Ditjen POM, 1995).
2.3.1 Ekstraksi
Ekstraksi adalah suatu cara untuk menarik satu atau lebih zat dari bahan awal dengan menggunakan pelarut. Tujuan utama ekstraksi ini adalah untuk mendapatkan atau memisahkan sebanyak mungkin zat-zat yang memiliki khasiat pengobatan.
Berdasarkan prinsipnya, proses ekstraksi dapat berlangsung bila terdapat kesamaan dalam sifat kepolaran antara senyawa yang diekstraksi dengan senyawa pelarut. Suatu zat memiliki kemampuan terlarut yang berbeda dalam pelarut yang berbeda. Hal ini menunjukkan adanya interaksi antara zat terlarut dengan pelarut.
Senyawa polar akan larut dalam pelarut polar, begitu juga sebaliknya. Sifat penting yang harus diperhatikan dalam pemilihan pelarut adalah kepolaran senyawa yang dilihat dari gugus polarnya (seperti OH, COOH, dan lain sebagainya). Dalam hal ini yang perlu diperhatikan dalam pemilihan pelarut adalah selektivitas, kemampuan untuk mengekstrak, toksisitas, kemudahan untuk diuapkan, dan harga (Harbone, 1987).
Metode ekstraksi dengan menggunakan pelarut dapat dibagi kedalam dua cara yaitu:
a) Cara dingin
1. Maserasi, adalah ekstraksi simplisia menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruang. Secara teknologi termasuk ekstraksi dengan prinsip metode pencapaian konsentrasi yang seimbang antara bahan dan pelarut.
2. Perkolasi, adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhaustive extraction), umumnya dilakukan pada temperatur ruangan. Proses ini terdiri dari tahapan pengembangan bahan, tahap maserasi dan tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus-menerus sampai diperoleh ekstrak (perkolat).
b) Cara panas
1. Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
2. Soxhlet, adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
3. Digesti, adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur 40 - 50oC.
4. Infus, adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96 - 98ºC) selama waktu tertentu (15 - 20 menit).
5. Dekok, adalah infus pada waktu yang lebih lama (≥ 30oC) dan temperatur sampai titik didih air.
2.4 Fungi (Jamur)
Jamur merupakan organisme yang kebanyakan relatif kecil atau disebut mikroskopik, umumnya berbentuk filamen batang, eukariotik, heterotrofik, dan umumnya bereproduksi dengan spora. Jamur disebut sebagai orgamisme eukariotik karena mempunya inti sel sejati. Intinya kira-kira 1-5 mm dan berisi DNA dengan pasangan basa. Jamur heterotrofik, yaitu jamur yang tidak berklorofil sehingga harus mengkonsumsi senyawa organik untuk pertumbuhan dan perkembangannya. Jamur dapat hidup sebagai saprofit, simbion dan parasit. Jamur parasit memperoleh nutrisi dari organisme lain yang disebut sebangai inang (host). Jamur bersifat kosmopolitan yang artinya terdapat dimana-mana dan habitat jamur berbeda-beda sesuai dengan spesiesnya. Sebagian besar tubuh fungi terdiri atas benang-benang yang disebut dengan hifa, yang saling berhubungan menjalin semacam jala, yaitu miselium.
Miselium dapat dibedakan atas miselium vegetatif yang berfungsi menyerap nutrisi dari lingkungan, dan miselium fertil yang berfungsi dalam reproduksi (Ginting, 2016)
Banyak jenis jamur yang dapat menyerang organisme lain, baik dari golongan hewan maupun tumbuhanyang masih hidup. Genus Fussarium dapat menyebabkan penyakit baik pada tumbuhan, hewan, maupun manusia. Dalam peristiwa penyakit, disamping menghasilkan enzim perombak, jamur juga menghasilkan toksin dan atau hormon yang digunakan untuk melemahkan sistem ketahanan inang sehingga
merusak dan merugikan inangnya. Dalam hal ini dikenal dengan jamur patogen.
Jamur banyak yang menyebabkan kerusakan pada berbagai habitat misalnya pada habitat tanah yang dapat menimbulkan kerusakan pada berbagai tanaman. Jamur demikian dikenal dengan jamur patogen tular tanah. Contoh jamur tular tanah yaitu Fussarium, Phytopthora, Pythium, Rhizoctonia solani (Ginting, 2016)
Daur penyakit atau siklus penyakit merupakan tahapan tahapan yang terjadi dari suatu penyakit hingga dampaknya terhadap tumbuhan yang diserang. Menurut Ginting, (2016) Tahapan tersebut meliputi :
a. Inokulasi
Inokulasi atau penularan merupakan kontak pertama kali antara patogen dengan tumbuhan inangnya. Patogen terbawa oleh agen penular (air hujan, angin, serangga dan sebagainya) dan menempel pada bagian tanaman. Bagian patogen yang mengadakan kontak dengan tanaman disebut inokulum.
b. Penetrasi
Penetrasi merupakan proses masuknya patogen atau bagian dari patogen kedalam sel, jaringan atau tubuh tanaman inang. Patogen melakukan penetrasi ke permukaan tanaman, kedalam sel, jaringan atau tubuh tanaman inang melalui lubang- lubang alami (stomata), melalui luka, langsung menembus permukaan tubuh tanaman, atau melalui perantara (pembawa).
c. Infeksi
Infeksi merupakan suatu proses dimulainya patogen memanfaatkan nutrien dari tanaman. Patogen akan tumbuh dan berkembang didalam jaringan tanaman selama proses infeksi. Setelah patogen menembus ke dalam tubuh tanaman atau bagian epidermis tanaman, ujung pembuluh kecambah fungi membesar dan membentuk aspresorium. Kemudian membentuk hifa infeksi lalu melebar kesemua arah dan membentuk haustorium yang menghisap makanan tanaman inang.
d. Invasi
Invasi merupakan tahap perkembangan patogen setelah terjadi infeksi. Fungi patogen biasanya melakukan invasi pada tanaman dimulai sejak proses infeksi
kehilangan nutrien juga mengalami kerusakan pada sel atau jaringannya. Kerusakan pada sel atau jaringan tanaman ini dapat dilihat secara visual sebagai gejala serangan penyakit pada tanaman.
e. Reproduksi
Tahap reproduksi merupakan tahap dimana patogen akan tumbu terus menerus dan berkembang serta memperbanyak diri di dalam tanaman dengan jangka waktu yang tidak terbatas. Tingkat reproduksi patogen berbeda-beda tergantung pada jenis patogen dan keadaan lingkungan.
f. Penyebaran
Proses penyebaran merupakan proses perpindahan inokulum dari sumber ke tempat lainnya. Penyebaran patogen dapat terjadi secara aktif yaitu spora mampu berpindah dalam jarak yang relatif pendek atau secara pasif melalui perantara angin, air, serangga, dan manusia.
g. Sintas
Sintas (survival) merupakan tahapan krusial karena untuk menjamin keberlangsungan hidupnya, patogen harus dapat mempertahankan hidupnya selama penyebaran atau bila sewaktu-waktu tumbuhan inang tidak tersedia. Salah stunya yaitu dengan berasosiasi dengan jaringan tumbuhan inang denagn membentuk miselium atau tubuh buah.
2.5 Isolasi Jamur dan Pengujian Fungi/Jamur
Menurut (Balai Karantina Pertanian, 2012) terdapat beberapa metode isolasi dan pengujian jamur atau cendawan, yaitu sebagai berikut :
a. Metode Pemeriksaan Benih Kering
Pilih benih yang memiliki perbedaan warna, bentuk, ukuran, atau gejala lain akibat serangan cendawan. Benih disiapkan pada cawan petri untuk diamati dibawah mikroskop stereo. Amati morfologi dan struktur cendawan yang ditemukan. Untuk pengamatan lebih lanjut, isolasi cendawan yang ditemukan ke dalam preparat slide untuk diamati lebih detail dengan mikroskop kompon. Identifikasi cendawan temuan dengan literatur/referensi ilmiah cendawan.
b. Metode Pencucian Benih (Washing Test)
Benih sebanyak 50 butir diambil secara acak dari sampel benih yang tersedia.
Benih tersebut dibagi menjadi 2 kelompok, masing-masing 25 butir. Masukkan setiap kelompok benih ke dalam tabung Erlenmeyer dan kemudian beri akuades sebanyak 10 ml. Untuk mempermudah peluruhan cendawan tambahkan 1-2 tetes tween 20%. Kedua tabung Erlenmeyer tersebut dipasang pada alat pengocok (mechanical shaker) dan dikocok selama 10 menit, apabila tidak ada alat pengocok maka tabung dapat dikocok dengan kuat menggunakan tangan. Air kocokan dari tabung erlenmeyer masing-masing dimasukkan ke dalam tabung centrifuge dengan volume yang sama. Kemudian putar dengan centrifuge pada kecepatan 2000-2500 rpm selama 10-15 menit. Setelah dicentrifugasi, air kocokan dibuang sehingga yang tertinggal hanya endapan saja. Untuk Cendawan yang tak berwarna/tak berpigmen masukkan 2 ml laktofenol blue. Sedangkan untuk cendawan yang berwarna/berpigmen gunakan larutan shear solution atau laktogliserol. Kemudian aduk dengan baik atau divortex. Dengan menggunakan pipet, ambillah suspensi tersebut lalu teteskan pada gelas obyek dan tutup dengan gelas penutup. Kemudian amati dibawah mikroskop kompon propagul-propagul cendawan yang tampak.
c. Metode Kertas Saring (Blotter Test)
Lima helai kertas saring steril dilembabkan dengan mencelupkan ke dalam akuades steril, kemudian letakkan kertas saring tersebut ke dalam cawan petri steril (diameter 12,5 cm). Benih dicampur merata dan disebarkan diatas kertas saring yang telah dilembabkan tersebut sebanyak 10-25 butir untuk setiap cawannya.
Pengulangan dilakukan sebanyak 10 kali. Letakkan cawan petri dalam ruang inkubasi di bawah lampu NUV (Near Ultra Violet) 40 W atau lampu TL 40 W ADL (Artificial Day Light) dengan pengaturan penyinaran selama 12 jam terang dan 12 jam gelap secara bergantian. Setelah 7 hari inkubasi, cendawan-cendawan yang tumbuh pada benih diamati di bawah mikroskop stereo binokuler. Berilah tanda dengan pensil berwarna disamping benih mengenai cendawan yang ditemukan tersebut. Pengamatan lebih lanjut terhadap spora, piknidium, peritesium, dan bagian- bagian cendawan lainnya dilakukan di bawah mikroskop kompon. Foto atau buatlah gambar cendawan yang ditemukan selama pengamatan baik yang terlihat di bawah
mikroskop stereo maupun yang terlihat di bawah mikroskop kompon. Pengamatan juga dilakukan terhadap persentase perkecambahan benih.
d. Metode Inkubasi Agar (Agar Test)
Benih dicuci terlebih dahulu dengan menggunakan larutan kloroks (NaOCl) 1
% selama 1-3 menit. Kemudian bilas dengan akuades steril selama 1 menit.
Kemudian benih ditiriskan pada kertas saring steril. Buatlah media agar (biasanya media PDA) dalam cawan petri, tunggu hingga media agar kering. Pengulangan dilakukan sebanyak 10 kali. Benih ditanam pada media agar sebanyak 10 butir per cawan petri, kemudian diinkubasi selama 7 hari dengan penyinaran lampu NUV 12 jam terang dan 12 jam gelap secara bergantian. Pengamatan dapat dilakukan pada hari ke-4 hingga ke-7, dibawah mikroskop stereo untuk melihat struktur makroskopis cendawan. Untuk melihat struktur mikroskopis cendawan, ambil bagian cendawan (hifa/miselium) yang tumbuh disekitar benih dengan menggunakan jarum/tusuk gigi kemudian letakkan pada gelas obyek dan ditutup dengan gelas penutup. Amati di bawah mikroskop kompon. Foto/gambar struktur makroskopis dari mikroskop stereo dan struktur mikroskopis dari mikroskop kompon.
e. Metode Growing on Test
Benih dicampur secara merata, kemudian dilakukan sterilisasi permukaan dengan mencelupkannya ke dalam larutan kloroks (Natrium Hipoklorit/NaOCl) 1%
selama 5 menit. Buatlah media agar (biasanya media PDA) dalam cawan petri, tunggu hingga media agar kering. Pengulangan dilakukan sebanyak 10 kali.
Selanjutnya 5-10 butir benih disemai pada media PDA pada masing-masing cawan petri. Penyebaran benih sebaiknya dilakukan di dalam laminar air flow untuk mencegah kontaminasi. Cawan petri bisa juga diganti dengan tabung reaksi.
Masukkan cawan petri ke dalam plastik tembus cahaya, kemudian tutup plastik.
Letakkan cawan petri/tabung reaksi di ruang inkubasi di bawah lampu NUV 40W atau lamptu TL 40W ADL dengan pengaturan penyinaran 12 jam terang dan 12 jam gelap secara bergantian. Setelah kurang lebih 7 hari inkubasi, dilakukan pengamatan secara makroskopis pada dasar cawan petri. Perhatikan pertumbuhan dan warna koloni cendawan yang tumbuh pada agar.
Untuk mengidentifikasi cendawan tersebut maka dari setiap koloni dibuat preparat dan diamati secara mikroskopis. Pengambilan preparat inipun sebaiknya dilakukan di dalam laminar air flow untuk mencegah kontaminasi dari udara. Jika belum terbentuk spora maka pengamatan dilanjutkan pada keesokan harinya dan seterusnya.
2.6 Antijamur
Antijamur merupakan zat berkhasiat yang digunakan untuk penanganan penyakit jamur/fungi. Umumnya suatu senyawa dikatakan sebagai zat antijamur apabila senyawa tersebut mampu menghambat pertumbuhan jamur/fungi (Siswandono, 1995). Komponen antimikroba adalah suatu komponen yang dapat menghambat pertumbuhan bakteri atau kapang (bakteristatik dan fungistatik) atau membunuh bakteri atau kapang (bakterisidal atau fungisidal) khususnya mikroorganisme yang merugikan manusia. Mikroorganisme adalah setiap organisme yang dapat dilihat dengan mikroskop yaitu, protozoa, bakteri, jamur dan virus.
Berdasarkan sifat toksisitas selektif, ada antimikroba yang bersifat menghambat pertumbuhan mikroba, dikenal sebagai aktifitas bakteriostatik dan ada yang bersifat membunuh mikroba, dikenal sebagai aktivitas bakterisid (Febriani, 2013
2.6.1 Mekanisme Penghambatan Mikroorganisme
Keefektifan menghambat merupakan salah satu kriteria pemilihan suatu senyawa antimikroba. Semakin kuat penghambatannya semakin efektif digunakan.
Kerusakan yang ditimbulkan komponen antimikroba dapat bersifat mikrosidal (kerusakan tetap) atau mikrostatik (kerusakan sementara yang dapat kembali). Suatu komponen akan bersifat mikrosidal dan mikrostatik tergantung pada konsentrasi kultur yang digunakan. Mekanisme penghambatan mikroorganisme oleh senyawa antimikroba dapat disebabkan oleh beberapa faktor yaitu, gangguan pada senyawa penyusun dinding sel, peningkatan permeabilitas membran sel yang dapat menyebabkan kehilangan komponen penyusun sel, menginaktivasi enzim, destruksi atau kerusakan fungsi material genetik (Febriani, 2013).
2.6.1.1 Mengganggu Pembentukan Dinding Sel
Sebagian besar fungi membentuk dinding selnya terutama dari kitin, suatu
pautan di antara gula-gula seperti yang terdapat pada selulosa dan peptidoglikan.
Mekanisme yang terjadi pada perubahan pembentukan di dinding sel disebabkan karena adanya akumulasi komponen lipofilat yang terdapat pada dinding atau membran sel sehingga menyebabkan perubahan komposisi penyusun dinding sel (Febriani, 2013).
2.6.1.2 Bereaksi dengan Membran Sel
Komponen bioaktif dapat menggangu dan mempengaruhi integritas membran sitoplasma, yang dapat mengakibatkan kebocoran materi intraseluler, seperti senyawa phenol yang dapat mengakibatkan kebocoran lisis sel dan menyebabkan denaturasi protein, menghambat pembentukan protein sitoplasma dan asam nukleat serta menghambat ikatan ATP-ase pada membran sel (Febriani, 2013).
2.6.1.3 Menginaktivasi Enzim
Mekanisme yang terjadi menyebabkan kerja enzim akan terganggu dalam mempertahankan kelangsungan aktivitas mikroba, sehingga mengakibatkan enzim akan memerlukan energi dalam jumlah besar untuk mempertahankan kelangsungan aktivitasnya. Akibatnya energi yang dibutuhkan untuk pertumbuhan menjadi berkurang sehingga aktivitas mikroba menjadi terhambat atau jika kondisi ini berlangsung lama maka akan mengakibatkan pertumbuhan mikroba terhenti (inaktif).
Efek senyawa antimikroba dapat menghambat kerja enzim jika mempunyai spesifitas yang sama antara ikatan komplek yang menyusun struktur enzim dengan komponen senyawa antimikroba (Febriani, 2013).
2.6.1.4 Menginaktivasi Fungsi Material Genetik
Komponen bioaktif dapat menggangu pembentukan asam nukleat (RNA dan DNA), menyebabkan terganggunya transfer informasi genetik yang selanjutnya akan menginaktivasi atau merusak material genetik sehingga terganggunya proses pembelaha sel untuk pembiakan (Febriani, 2013).
2.6.2 Uji Antimikroba
Febriani, (2013) Banyak metode yang dapat diterapkan untuk menentukan aktivitas antimikroba dimana masing-masing metode memiliki kelebihan dan
kekurangan. Kegunaan uji antimikroba adalah diperolehnya suatu sistem pengobatan yang efektif dan efisien. Terdapat macam-macam metode uji antimikroba seperti berikut :
2.6.2.1 Metode Penyebaran/Difusi (Diffusion Methods)
Prinsip metode difusi merupakan uji potensi antimikroba yang didasarkan pada pengamatan luas daerah hambatan pertumbuhan bakteri karena berdifusinya antibakteri dari titik awal pemberian kedaerah difusi. Metode difusi agar-cakram kertas merupakan teknik yang paling sering digunakan untuk menentukan kepekaan bahan antimikroba sampai senyawa kemoterapi. Dalam metode ini, ada beberapa cara yaitu cara Kirby Bauer, cara Sumuran, cara Pour Plate.
1. Metode Kirby-Bauer
Untuk menentukan aktivitas agen antimikroba. Piringan yang berisi agen antimikroba diletakkan pada media agar yang telah ditanami mikroorganisme yang akan berdifusi pada media agar tersebut. Area jernih mengindikasikan adanya hambahan pertumbuhan mikroorganisme oleh agen antimikroba pada permukaan media agar.
Cara kerja pengujian antimikroba dengan metode Kirby-Bauer :
1. Tanam mikroba dalam media agar padat yang sesuai. Celupkan cotton bud (cotton swab) dalam biakan bakteri/jamur kemudian tekan kapas kesisi tabung agar air tiris. Bakteri/jamur ditumbuhkan pada media agar miring dan diinkubasi pada suhu 37ºC. Kemudian pembuatan suspensi bakteri/jamur dengan menumbuhkan bakteri/jamur pada media cair Natrium Klorida fisiologis dan diinkubasi pada suhu 37ºC.
2. Ulaskan pada seluruh permukaan cawan Mueller-Hinton Agar secara merata biarkan selama 5 menit.
3. Kertas cakram dicelupkan dalam larutan dengan konsentrasi tertentu. Angkat, biarkan sejenak agar tiris, selanjutnya letakkan kertas cakram pada permukaan agar. Kertas cakram ditekan menggunakan pinset supaya menempel sempurna dipermukaan agar.
4. Diinkubasi pada suhu 36-37ºC selama 24-48 jam.
5. Aktivitas antimikroba dilihat dengan mengukur daerah di sekitas cakram, lubang, atau cangkir yang tidak ditumbuhi mikroba.
6. Diukur diameter zona hambat (mm) dengan jangka sorong, kemudian bandingkan dengan tabel sensitivits antibiotik. Makin besar diameter hambatan pertumbuhantersebut berarti aktivitas bahan yang diuji terhadap mikroba makin baik.
Metode Kirby-Bauer tidak dapat digunakan untuk mengukur derajat antimikroba suatu zat sehingga metode ini tidak menjamin diidentifikasinya bahan pembunuh antimikroba yang efektif untuk terapi (bakterisida dan fungisida).
2. Metode E-test
Black., (2014) mengemukakan adanya versi terbaru metode difusi yang disebut E-test (Epsilo Test). Pada E-test digunakan strip plastik yang mengandung gradien konsentrasi antibiotik. Pada strip tercetak nilai konsentrasi yang memungkinkan secara langsung membaca konsentrasi minimum yang dibutuhkan untuk menghambat pertumbuhan.
3. Metode Ditch – Plate Technique
Pada metode ini sampai uji berupa agen antimikroba yang diletakkan pada parit yang dibuat dengan cara memotong media agar dalam cawan petri pada bagian tengah secara membujur dan mikroba uji (maksimum 6 macam) digoreskan kearah parit yang berisi agen antimikroba.
4. Metode Cup – Plate Technique (Metode Sumuran)
Metode ini sama dengan metode disc diffusion, dimana dibuat sumur pada media agar yang telah ditanami dengan mikroorganisme dan pada sumur tersebut diberi agen antimikroba yang akan diuji (Febriani, 2013). Jamur uji yang umurnya 18-24 jam disuspensikan ke dalam media agar pada suhu sekitar 45 . Suspensi jamur dituangkan ke dalam cawan petri steril. Setelah agar memadat, dibuat lubang- lubang dengan diameter 6 mm kemudian dimasukkan larutan zat yang akan diuji aktivitasnya sebanyak 20 μL dan diinkubasi pada suhu 37 selama 18-24 jam.
Aktivitas antijamur dapat dilihat dari daerah bening yang mengelilingi lubang perforasi (Pratiwi, 2008).
5. Metode Gradient – Plate Technique
Pada metode ini agen antimikroba pada media agar secara teoritis bervariasi dari 0 sampai maksimal. Media agar dicairkan dan larutan uji ditambahkan.
Campuran kemudian dituang kedalam cawan petri dan diletakkan dalam posisi miring. Nutrisi kedua selanjutnya dituang diatasnya.
Plate kemudian diinkubasi selama 24 jam untuk memmungkinkan agen antimikroba berdifusi dan permukaan media mengering. Mikroba uji (maksimal 6 macam) digoreskan pada arah mulai dari konsentrasi tinggi hingga rendah. Hasil perhitungan sebagai panjang total pertumbuhan mikroorganisme maksimum yang mungkin dibandingkan dengan panjang petumbuhan hasil goresan (Febriani, 2013).
6. Metode Cakram Kertas
Zat yang akan diuji diserapkan ke dalam cakram kertas dengan cara meneteskan pada cakram kertas kosong larutan antijamur sejumlah volume tertentu dengan kadar tertentu pula. Cakram kertas diletakkan di atas permukaan agar padat yang telah dituangkan jamur sebelumnya. Cawan petri diinkubasi pada suhu 30 selama 2 sampai 4 hari. Aktivitas antijamur dapat dillihat dari daerah hambat di sekeliling cakram kertas (Pratiwi, 2008).
2.6.2.2 Metode Pengenceran/Dilusi (Dilution Methods)
Metode pengenceran/dilusi dapat digunakan untuk menguji beberapa zat antimikroba secara simultan, tetapi memakan waktu yang cukup lama dan mahal.
Metode ini memungkinkannya dilakukan uji kedua untuk menilai daya antimikroba suatu zat. Kegunaan dari metode dilusi adalah untuk mencari kadar terendah yang dapat menghambat pertumbuhan bakteri. Uji ini mampu dengan tepat mengukur konsentrasi antimikroba yang diperlukan untuk menghambat pertumbuhan suatu inokulum di bawah kondisi yang ditentukan. Metode dilusi dibedakan menjadi dua, yaitu dilusi cair (broth dilution) dan dilusi padat (solid dilution) (Febriani, 2013).
1. Metode Dilusi Cair (Broth Dilution)
Metode ini mengukur MIC (minimum inhibitory concentration atau kadar hambat minimum) dan MBC (minimum bactericidal concentration atau kadar bunuh
pada medium cair yang ditambahkan dengan mikroba uji. Inokulasi dengan suspensi bakteri atau jamur dan diinkubasi selama 24 jam pada temperatur 36-37ºC dan diamati pertumbuhan mikroba. Larutan uji agen antimikroba pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan mikroba uji ditetapkan sebagai kadar hambat minimum. Larutan yang ditetapkan sebagai kadar hambat minimum tersebut selanjutnya dikultur ulang pada media cair tanpa penambahan mikroba uji ataupun agen antimikroba dan diinkubasi sesuai dengan mikroba uji. Media cair yang bening setelah diinkubasi ditetapkan sebagai kadar bunuh minimum (Febriani, 2013).
2. Metode Dilusi Padat (Solid Dilution Test)
Metode ini sama dengan metode dilusi cair namun menggunakan media padat (solid). Keuntungan dari metode ini adalah satu konsentrasi agen antimikroba yang diuji dapat digunakan untuk menguji beberapa mikroba uji. Pengujian terhadap jamur dengan menggunakan metode cair kurang bagus karena sebagian jamur tidak tumbuh dan terdispersi dengan baik kecuali beberapa jamur dengan pertumbuhan seperti ragi (yeast-like growth). Jamur yang tumbuh seperti ragi antara lain candida spp (Febriani, 2013).
2.6.2.3 Metode Bioautografi (Bioautography Methods) (Hostettmann,1991) Metode ini sangat berguna untuk mengetahui senyawa baru atau senyawa yang belum diketahui aktivitas antimikrobanya. Bioautografi kontak menggunkan prinsip difusi senyawa yang terpisah dengan kromatografi Lapis Tipis (KLT) atau Kromatografi Kertas (KK). Lempeng kromatografi ditempatkan pada permukaan agar yang telah diinokulasi dengan mikroba. Setelah kira–kira 30 menit, lempeng dipindahkan, diinkubasi dan diamati, senyawa antimikroba akan berdifusi kedalam lapisan agar dan menghambar pertumbuhan mikroba. Pada bioautografi langsung, zona hambatan diamatai secara langsung pada lempeng kromatografi yang sebelumnya telah disemprot dengan suatu suspensi mikroba dalam media agar cair dan diinkubasi pada temperatur dan waktu yang sesuai. Sedangkan metode bioautografi pencelupan, dilakukan dengan mencelupkan lempeng kromatografi ke dalam media dan media dibiarkan mengeras. Lempeng kromatografi kemudian diinkubasi dan daerah hambatannya diamati.
2.6.2.4 Metode Gores Silang
Metode gores silang (Cross Scratching Method) merupakan metode baku untuk menguji aktivitas penghambatan suatu bahan uji terhadap jamur. Cara kerja metode gores silang yaitu, celupkan kertas saring ke dalam larutan yang akan diuji lalu diletakkan diatas lempeng agar yang telah digoreskan inokulum jamur. Media agar kemudian diinkubasi pada suhu 24-25ºC selama 3-7 hari. Petumbuhan jamur diamati, jarak yang tidak ditumbuhi jamur diukur sebagai zona hambat. Cara yang sama juga dilakukan pada waktu yang bersamaan untuk antijamur pembanding.
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian dilakukan pada 03 Maret 2018 sampai Agustus 2018 di Laboratorium Biokimia FMIPA Universitas Sumatera Utara, skrining fitokimia ekstrak metanol daun sikkam dilakukan di Laboratorium Kimia Bahan Alam Hayati FMIPA Universitas Sumatera Utara dan Isolasi serta identifikasi Jamur dilakukan di Laboratorium Hama dan Penyakit Fakultas Pertanian Universitas Sumatera Utara.
Determinasi tumbuhan dilakukan di Laboratorium Herbarium FMIPA Universitas Sumatera Utara.
3.2 Alat dan Bahan 3.2.1 Alat
Adapun alat-alat yang digunakan dalam penelitian ini adalah :
Nama Alat Merek
- Rotary evaporator Buchi
- Labu destilasi Pyrex
- Hot plate Cimerec
- Botol vial -
- Bunsen -
- Erlenmeyer Pyrex
- Beaker glass Pyrex
- Penangas air -
- Lemari pendingin LG
- Neraca analitik Acis
- Mikroskop Stereo Zeiss
- Cawan petri Normax
- Gelas ukur Pyrex
- Labu ukur Pyrex
- Tabung reaksi -
- Kertas label Panda
- Spatula -
- Pipet tetes -
- Jangka sorong -
- Alu dan lumpang -
- Oven -
- Botol plastik -
- Corong kaca Pyrex
- Jarum ose -
- Laminar air flow -
- Statif dan klem -
- Pinset -
- Cling wrap Glad
- Aluminium voil Klinpark
- Autoclave Memmert
- Blender
- Cockborer -
- Spray -
- Kantung Plastik -
- Kertas Cakram -
3.2.2 Bahan
Adapun bahan-bahan yang digunakan dalam penelitian ini adalah : Bahan
- Daun Sikkam (Bischofia javanica Blume)
- Metanol p.a Merk
- Aquadest - Alkohol 96%
- FeCl3 5%
- HCl(p) - Etil Asetat - Amoniak - Kloroform
- HCl 2N
- CeSO4 1% dalam H2SO4 10%
- NaOH 10%
- H2SO4(p)
- Pereaksi Bouchardart - Pereaksi Dragendorf - Pereaksi Maeyer - Pereaksi Salkowsky
- PDA (Potatoe Dexstro Agar(s))
- DMSO (Dimetilsulfoksida) p.a Fisons
- Chloramphenicol(s) - Metilena blue - Ketokenazol
- Kloroks (NaOCl) 1%
- Spritus
3.3 Prosedur Penelitian
3.3.1 Pengambilan dan Pengolahan Tumbuhan
Metode pengambilan sampel dilakukan berdasarkan pertimbangan peneliti yaitu dengan memilih daun pohon sikkam yang telah tua dan tanpa membandingkan dengan tanaman sikkam yang ada di daerah lain. Sampel yang digunakan merupakan daun sikkam yang diperoleh dari kebun warga di Desa Manjangkir, kecamatan Sidamanik, Kabupaten Simalungun, Sumatera Utara. Daun sikkam dipisahkan dari rantingnya, kemudian dikeringkan dengan cara diangin-anginkan di dalam ruang dan tidak terpapar sinar matahari secara langsung selama ±5 hari. Kemudian dihaluskan dengan cara di blender.
3.3.2 Pembuatan Pereaksi 3.3.2.1 Pereaksi Maeyer
Dilarutkan sebanyak 1,36 gram raksa (II) klorida dalam air suling sebanyak 60 ml, pada wadah lain kalium iodida sebanyak 5 gram dilarutkan dalam 20ml air suling. Kedua larutan dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 ml (Depkes RI, 1989).
3.3.2.2 Pereaksi Dragendroff
Dilarutkan sebanyak 0,8 gram bismut (III) nitrat dalam asam nitrat pekat 20 ml lalu dicampurkan dengan kalium iodida sebanyak 27,2 gram dalam 50ml air suling. Campuran didiamkan sampai memisah sempurna. Larutan jernih diambil dan diencerkan dengan air suling secukupnya hingga 100 ml (Depkes RI, 1989).
3.3.2.3 Pereaksi Bouchardat
Dilarutkan sebanyak 4 gram kalium iodide (KI) dalam 20 ml air suling secukupnya kemudian ditambahkan 2 gram iodida (I) sedikit demi sedikit, cukupkan dengan air suling sampai 100 ml (Depkes RI, 1989).
3.3.2.4 Larutan Pereaksi Besi (III) Klorida 5 %
Dilarutkan 5 gram besi (III) klorida dalam air suling hingga diperoleh 100 ml larutan kemudian disaring (Ditjen POM, 1995).
3.3.2.5 Larutan Pereaksi Natrium Hidroksida 2 N
Dilarutkan 8,001 gram natrium hidroksida pellet dalam air suling hingga diperoleh 100 ml larutan (Ditjen POM, 1995).
3.3.2.6 Larutan Pereaksi Asam Sulfat 2 N
Sebanyak 10 ml asam sulfat pekat diencerkan dengan air suling hingga diperoleh 100 ml larutan (Ditjen POM, 1979).
3.3.2.7 Larutan Pereaksi Asam Klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling hingga diperoleh 100 ml larutan (Ditjen POM. (1979).
3.3.3 Analisa Kadar Air
Ditimbang 2 gram sampel lalu dikeringkan dalam oven pada suhu 0 - 0 C selama 2 jam, lalu didinginkan dalam desikator selama 30 menit. Kemudian ditimbang. Diulangi pengeringan sampai diperoleh berat tetap.
3.4 Pembuatan Ekstrak Metanol Daun Sikkam
Ditimbang serbuk daun Sikkam sebanyak 600 gram, dimaserasi dengan menggunakan pelarut metanol sebanyak 3 liter selama 3×24 jam. Kemudian disaring.