SKRIPSI
MODIFIKASI PATI GARUT (Marantha arundinacea) DENGAN PERLAKUAN SIKLUS PEMANASAN SUHU TINGGI-PENDINGINAN
(AUTOCLAVING-COOLING CYCLING) UNTUK MENGHASILKAN
PATI RESISTEN TIPE III
RATIH PRATIWI F24104028
2008
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
MODIFIKASI PATI GARUT (Marantha arundinacea) DENGAN PERLAKUAN SIKLUS PEMANASAN SUHU TINGGI-PENDINGINAN
(AUTOCLAVING-COOLING CYCLING) UNTUK MENGHASILKAN
PATI RESISTEN TIPE III
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh:
RATIH PRATIWI F24104028
2008
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
MODIFIKASI PATI GARUT (Marantha arundinacea) DENGAN PERLAKUAN SIKLUS PEMANASAN SUHU TINGGI-PENDINGINAN
(AUTOCLAVING-COOLING CYCLING) UNTUK MENGHASILKAN
PATI RESISTEN TIPE III
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh : RATIH PRATIWI
F24104028
Dilahirkan pada tanggal 15 Agustus 1986 di Bandar Lampung
Tanggal lulus :
Menyetujui, Bogor, 2008
Dr. Ir. Sugiyono M.App.Sc Didah Nur Faridah STP, M.Si Dosen Pembimbing I Dosen pembimbing II
Mengetahui,
Dr. Ir. Dahrul Syah, M.Sc
Ratih Pratiwi. F24104028. Arrowroot (Marantha arundinacea) Starch Modification Through Autoclaving-Cooling Cycling Treatment to Produce Resistant Starch Type III. Under supervision of Dr. Ir. Sugiyono M.App,Sc and Didah Nur Faridah STP., M.Si.
ABSTRACT
The objective of this research was to modify arrowroot starch to produce resistant starch type III by autoclaving-cooling cycling and to characterize the modified arrowroot starches according to their chemical properties. The research consisted of three steps : arrowroot extraction, starch modification, and chemical characterization. The extraction of arrowroot produced 10.78% starch. Starch modification by autoclaving-cooling cycle(s) was run in 6 different treatments with the aim of observing optimal yield of resistant starch. Resistant starch (RS) was derived from 1, 3, 5 cycle(s) of autoclaving-cooling treatment with different gelatinization periods (15 and 30 minutes) for each cycle. Properties analyzed were starch digestibility, proximate analysis, amylose content, starch content, resistant starch content, and dietary fiber content. Native starch and commercial RS type III (Novelose 330) were also analyzed as a comparison.
Based on the starch digestibility, modified starch from 5 cycles, 15 minutes gelatinization period had the lowest digestibility while modified starch from 3 cycles, 15 minutes gelatinization period had no significant difference with commercial RS type III. Those 2 modified starches, native starch, and Novelose 330 were chosen for further chemical analysis. The 4 samples had moisture content below 14%. In addition, the fat content and protein content were below 1% (db). Low fat and protein content were needed to optimize the RS yield. Amylose content of modified starches was not significantly different from native starch. The modification treatment increased the dietary fiber content. The RS content of native starch, Novelose 330, modified starch 3 cycles, 15 minutes gelatinization period, and modified starch 5 cycles, 15 minutes gelatinization period were 2.12% (db), 20.80% (db), 10.91% (db), and 12.15% (db), respectively. It means that repeating autoclaving-cooling cycling could increase RS yield up to 6 times.
Ratih Pratiwi. F24104028. Modifikasi Pati Garut (Marantha arundinacea)
dengan Perlakuan Siklus Pemanasan Suhu Tinggi-Pendinginan ( Autoclaving-Cooling Cycling) untuk Menghasilkan Pati Resisten Tipe III. Di bawah
bimbingan Dr.Ir.Sugiyono, M.App,Sc dan Didah Nur Faridah, STP., M.Si.
RINGKASAN
Kajian mengenai sifat fungsional pangan yang berkhasiat untuk kesehatan dan kebugaran semakin meningkat sejalan dengan semakin meningkatnya kesadaran masyarakat akan pentingnya hidup sehat. Umbi-umbian merupakan sumber karbohidrat yang memiliki potensi untuk diversifikasi pangan dan sebagai bahan pangan fungsional di Indonesia. Garut mudah dibudidayakan dan memiliki produktivitas tinggi. Umbi garut diketahui memiliki indeks glisemik rendah sehingga mempunyai potensi yang cukup baik sebagai bahan pangan. Pengolahan garut menjadi pati dapat meningkatkan nilai ekonomis umbi garut. Salah satu cara untuk meningkatkan kegunaan dan nilai tambah pati adalah dengan melakukan modifikasi pati agar diperoleh sifat-sifat yang cocok untuk aplikasi tertentu.
Proses modifikasi pati dengan pemanasan suhu tinggi yang digabungkan dengan pendinginan dapat menurunkan daya cerna pati dan meningkatkan kadar pati resisten. Pati resisten telah terbukti baik bagi fungsi fisiologi tubuh, antara lain : menurunkan indeks glikemik, menurunkan kolestrol, dan mengurangi risiko kanker usus sehingga dapat dimanfaatkan untuk pembuatan pangan fungsional. Penelitian ini bertujuan mengetahui pengaruh perlakuan modifikasi secara fisik berupa perlakuan siklus pemanasan suhu tinggi-pendinginan (autoclaving-cooling cycling treatment) untuk menghasilkan pati garut dengan kandungan pati resisten tinggi dan mempelajari karakterisasi sifat kimia pati garut yang telah dimodifikasi. Penelitian ini dilakukan dalam tiga tahap. Pada tahap pertama dilakukan ekstraksi pati garut sebagai bahan baku. Pada tahap kedua dilakukan modifikasi pati garut dengan perlakuan siklus pemanasan suhu tinggi-pendinginan. Proses perlakuan modifikasi pati terdiri dari enam perlakuan untuk menghasilkan pati modifikasi yang mengandung pati resisten tipe III. Perlakuan tersebut yaitu : modifikasi pati 1, 3, dan 5 siklus (dengan waktu gelatinisasi 15 dan 30 menit tiap siklus). Pada pembuatan pati modifikasi 1 siklus, pengeringan dilakukan dengan menggunakan dua jenis alat pengering untuk memilih jenis pengering yang lebih sesuai untuk digunakan dalam mengeringkan pati garut modifikasi. Pada tahap ketiga dilakukan analisis sifat kimia terhadap sampel pati umbi garut yang dimodifikasi dan sampel kontrol positif. Kontrol positif yang digunakan adalah Novelose 330 yang merupakan pati resisten tipe III komersial. Analisis yang dilakukan antara lain : analisis daya cerna pati, analisis proksimat, kadar pati resisten, kadar pati total, kadar amilosa, dan kadar serat pangan.
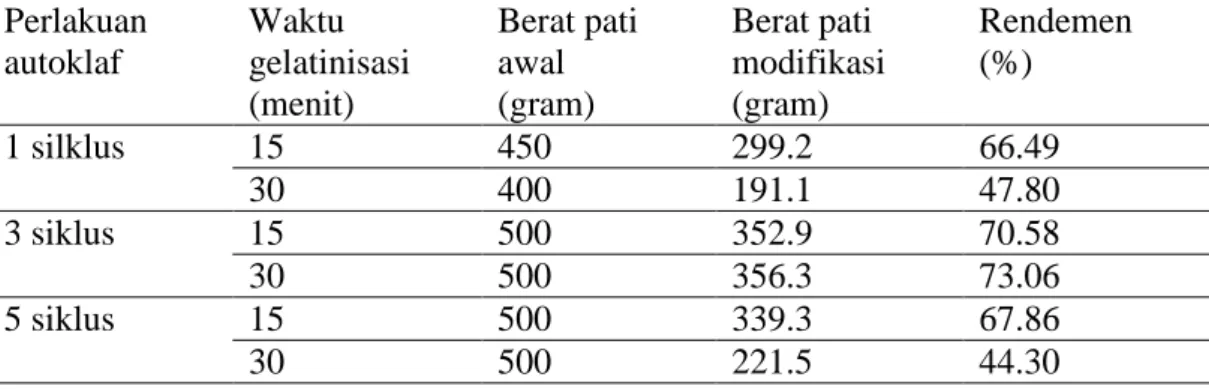
Rendemen pati garut hasil ekstraksi sebesar 10.78%. Rendemen pati garut modifikasi dengan pengeringan menggunakan drum dryer dan evaporator vakum masing adalah 47.78% dan 55.30%. Lama pengeringan masing-masing adalah drum dryer 31 menit/ 100 gram dan evaporator 163 menit/ 100 gram. Berdasarkan data tersebut, pengeringan pati modifikasi selanjutnya menggunakan drum dryer.
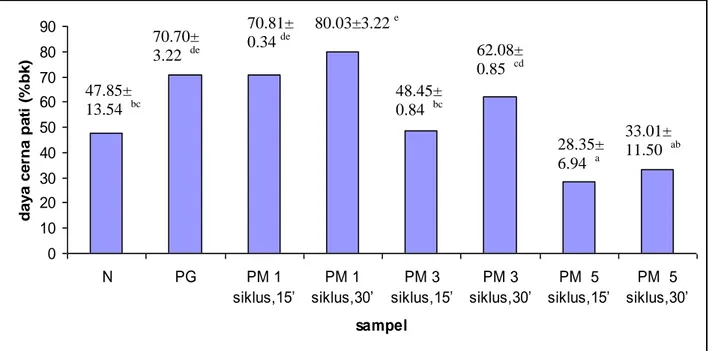
Pati garut, Novelose 330 dan pati modifikasi 1 siklus dengan waktu gelatinisasi 15 menit, 1 siklus dengan waktu gelatinisasi 30 menit, 3 siklus dengan waktu gelatinisasi 15 menit, 3 siklus dengan waktu gelatinisasi 30 menit, 5 siklus dengan waktu gelatinisasi 15, dan 5 siklus dengan waktu gelatinisasi 30 menit masing-masing memiliki daya cerna 70.69%, 47.85%, 70.81%, 80.02%, 48.44%, 62.08%, 28.35%, dan 33.01%. Pati modifikasi 3 siklus dipilih untuk dianalisis lebih lanjut karena memiliki daya cerna yang tidak berbeda nyata dengan produk pati resisten tipe III komersial berdasarkan analisis ragam. Pati modifikasi 5 siklus juga dipilih karena memiliki daya cerna pati terendah. Waktu gelatinisasi 15 menit pada pati modifikasi 3 dan 5 siklus dipilih karena lama pemanasan yang lebih singkat.
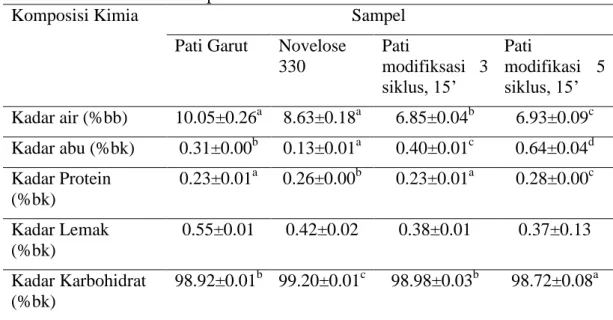
Kadar air pati garut, Novelose 330, pati modifikasi 3 dan 5 siklus dengan gelatinisasi 15 menit masing-masing adalah 10.05%, 8.63%, 6.85%, 6.93% dan kadar abunya berturut-turut sebesar 0.31%bk, 0.13%bk, 0.40%bk, dan 0.64%bk. Kadar protein pati garut, Novelose 330, pati modifikasi 3 dan 5 siklus dengan gelatinisasi 15 menit masing-masing 0.23%bk, 0.26%bk, 0.23%bk, dan 0.28%bk, sedangkan kadar lemak berturut-turut sebesar 0.55%bk, 0.42%bk, 0.38%bk, dan 0.37%bk. Berdasarkan by difference, diperoleh kadar karbohidrat sampel berturut-turut sebesar 98.92%bk, 99.20%bk, 98.98%bk, dan 98.72%bk.
Kadar pati dari pati garut, Novelose 330, pati modifikasi 3 dan 5 siklus dengan gelatinisasi 15 menit masing-masing 94.89%bk, 83.00%bk, 94.56%bk, dan 94.00%bk. Kadar amilosa sampel tersebut berturut-turut sebesar 18.66%bk, 32.50%bk, 18.69%bk, dan 19.11%bk. Kadar amilosa pati garut dan pati garut yang telah dimodifikasi tidak berbeda nyata. Hal ini memperlihatkan bahwa proses modifikasi tidak menghasilkan perubahan pada kadar amilosa namun perubahan terjadi pada strukturnya. Kadar serat pangan total pati garut, Novelose 330, pati modifikasi 3 dan 5 siklus dengan gelatinisasi 15 menit masing-masing 3.82%bk, 35.89%bk, 13.56%bk, dan 15.67 %bk, sedangkan kadar pati resisten berturut-turut sebesar 2.12%bk, 20.80%bk, 10.91%bk, dan 12.15%bk. Hasil analisis memperlihatkan bahwa autoclaving-cooling cycling treatment dapat meningkatkan kadar pati resisten tipe III. Berdasarkan hasil analisis ragam kadar pati resisten tipe III pati garut modifikasi 3 siklus dan 5 siklus dengan waktu gelatinisasi 15 menit tidak berbeda nyata. Untuk penerapan di industri, penerapan modifikasi pati 3 siklus 15 menit akan lebih efisien karena mempersingkat lama
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 15 Agustus 1986 di Bandar Lampung. Penulis adalah putri dari pasangan Bapak Sofyan Arsyad dan Ibu Zaleha, merupakan anak pertama dari tiga bersaudara.
Penulis menempuh pendidikan di TK Dolog pada tahun 1991-1992, pendidikan sekolah dasar di SD Negeri 2 Teladan pada tahun 1992-1998, pendidikan sekolah lanjutan tingkat pertama di SLTP Negeri 4 Bandar lampung pada tahun 1998-2001, dan pendidikan sekolah lanjutan tingkat atas di SMU Negeri 2 Bandar Lampung pada tahun 2001-2004. Pada tahun 2004, penulis melanjutkan pendidikan di Institut Pertanian Bogor pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian yang diterima melalui jalur USMI (Undangan Seleksi Masuk IPB).
Selama kuliah di Departemen Ilmu dan Teknologi Pangan, penulis terlibat dalam organisasi IAAS (International Association of Agricultural and Related Science), IDC (IPB Debating Community) dan HIMITEPA (Himpunan Mahasiswa Ilmu dan Teknologi Pangan). Penulis terlibat dalam beberapa kepanitian dan aktif dalam berbagai kompetisi debat, karya tulis nasional dan PIMNAS. Selain itu, penulis berkesempatan mewakili Indonesia dalam The 13th Tri University International Joint Seminar and Symposium di Chiang Mai University, Thailand.
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian, penulis menyusun skripsi setelah melakukan penelitian di Techno-Park
dan laboratorium Departemen Ilmu dan Teknologi Pangan, FATETA, IPB mulai bulan Februari 2008 sampai bulan Juni 2008, dengan judul ”Modifikasi Pati Garut (Marantha arundinacea) dengan Perlakuan Siklus Pemanasan Suhu Tinggi-Pendinginan (Autoclaving-Cooling Cycling) untuk Menghasilkan Pati Resisten Tipe III” di bawah bimbingan Dr.Ir.Sugiyono.M.App,Sc dan Ibu Didah Nur Faridah STP.,M.Si.
KATA PENGANTAR
Syukur Alhamdulillah penulis panjatkan ke hadirat Allah Subhanahu Wata`ala karena atas limpahan rahmat dan karuniaNya, penulis dapat menyelesaikan skripsi yang berjudul Modifikasi Pati Garut (Marantha arundinacea) dengan Perlakuan Siklus Pemanasan Suhu Tinggi-Pendinginan (Autoclaving-Cooling Cycling) untuk Menghasilkan Pati Resisten Tipe III. Shalawat dan salam semoga tercurah kepada junjungan kita Nabi Muhammad SAW. Tulisan ini merupakan laporan penelitian yang telah dilakukan penulis di
Techno-Park dan Laboratorium Departemen Ilmu dan Teknologi Pangan, Institut Pertanian Bogor.
Penulisan skripsi ini tidak terlepas dari bantuan banyak pihak. Oleh karena itu, penulis ingin menyampaikan terima kasih yang sebesar-besarnya kepada: 1. Keluargaku tercinta: Mama, Papa dan kedua adikku Rifky Prayogie dan
Raihan Ferdyanza yang selalu memberikan doa, kasih sayang, nasihat, dan motivasi tiada henti.
2. Dr.Ir.Sugiyono M.App,Sc selaku dosen pembimbing akademik yang telah memberi bimbingan, bantuan, serta nasehat kepada penulis selama perkuliahan, penelitian, dan penyelesaian tugas akhir.
3. Ibu Didah Nur Faridah STP.M.Si selaku dosen pembimbing yang telah membimbing penulis dalam pelaksanaan penelitian dan penulisan.
4. Ibu Dr. Ir. Endang Prangdimurti M.Si atas saran dan kesediannnya menjadi dosen penguji.
5. Seluruh Staf pengajar di Departemen Ilmu dan Teknologi Pangan IPB yang telah membagi ilmunya kepada penulis, semoga ilmu yang diberikan menjadi ilmu yang bermanfaat.
6. Semua teknisi dan laboran Departemen ITP dan Techno-Park: Pak Wahid, Pak Gatot, Pak Rojak, Pak Sobirin, Bu Rubiah, Mas Edi, Pak Iyas, Pak Nur, Pak Basri terima kasih atas bantuan, saran, dan kerja samanya selama penulis melakukan penelitian.
7. Direktorat Jendral Pendidikan Tinggi (DIKTI) yang telah mendanai penelitian ini melalui Program Penelitian Hibah Bersaing.
8. National Starch Food Innovation atas bantuan pati resistennya
9. Bima Sakti Aswan yang selalu mendampingi, membantu, dan menyemangati penulis.
10.Teman-teman Golongan A ITP 41 dan teman-teman mata kuliah gizi. Terima kasih atas kebersamaannya selama menjalani praktikum di Departemen ITP. 11.Rekan-rekan penulis sesama beswan Djarum, IDC, dan Himitepa terutama
divisi DPPI yang selalu yang selalu mendukung dan menyemangati penulis selama kuliah dan penelitian di Departemen ITP ini.
12.Keluarga besar TPG/ ITP angkatan 38, 39, 40, 41, 42, 43 atas kebersamaannya selama ini. Semoga persahabatan kita tidak akan pernah hilang.
13.Dra Alfa Chasanah MA, Dr Rimbawan, Ir Sri Endah Agustina MS atas kepercayaan, motivasi, dan bimbingannya kepada penulis untuk selalu berprestasi.
14.Teman-teman Ponytail Bawah : Uni Neni, Uni Susi, Mba Dian, Mba Umi, Mba Uli, Mba Nana, Sita, Ndhit, Nira atas kebersamaan dan keceriaannya. 15.Sahabat-sahabatku ”10sisters” serta Ila. Terima kasih selalu mau berbagi
kebersamaan, keceriaan, kesedihan, serta terima kasih untuk tiap doa kesuksesannya.
16.Teman lab dan penulisan skripsi : Ade, Tomi, Andri, Lia, Mba Friska, Mba Dian, Amel, Hesti, Ari, Rhais terima kasih atas semangat dan bantuannya 17.Serta semua pihak yang telah membantu penulis semenjak kuliah sampai
penulisan skripsi ini, yang tidak bisa penulis tuliskan satu per satu.
Penulis menyadari bahwa skripsi ini memiliki banyak kekurangan. Oleh karena itu, penulis mengharapkan saran dan kritik bagi perbaikan selanjutnya. Semoga tulisan ini bermanfaat bagi pembaca dan menjadi amal shalih bagi penulis.
Bogor, Agustus 2008
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR GAMBAR ... v
DAFTAR TABEL ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN PENELITIAN ... 3
C. MANFAAT PENELITIAN ... 3
II. TINJAUAN PUSTAKA ... 4
A. GARUT ... 4
B. KARBOHIDRAT ... 6
C. PATI ... 7
1. Amilosa dan Amilopektin ... 8
2. Gelatinisasi ... 9
3. Retrogradasi ... 11
D. MODIFIKASI PATI ... 11
1. Modifikasi Pati Secara Kimia ... 12
2. Modifikasi Pati Secara Fisik ... 12
E. PATI RESISTEN ... 14
F. SERAT PANGAN ... 16
III. METODE PENELITIAN ... 18
A. BAHAN DAN ALAT ... 18
B. METODE ... 18
a. Ekstraksi Pati Garut ... 19
b. Pembuatan Pati Modifikasi ... 19
b.1. Pembuatan Pati Modifikasi 1 Siklus ... 20
b.2. Pembuatan Pati Modifikasi 3 Siklus ... 21
b.3. Pembuatan Pati Modifikasi 5 Siklus ... 21
C. PROSEDUR ANALISIS ... 22
1. Rendemen Pati ... 22
2. Kadar Air ... 23
3. Kadar Abu ... 23
4. Kadar Protein Metode Kjeldahl ... 23
5. Kadar Lemak Metode Soxhlet ... 24
6. Kadar Karbohidrat by difference ... 24
7. Kadar Pati Total ... 25
8. Kadar Amilosa ... 26
9. Kadar Serat Pangan Metode Enzimatik ... 27
10. Kadar Pati Resisten Metode Enzimatik Gravimetri ... 28
11. Daya Cerna Pati... 29
IV.HASIL DAN PEMBAHASAN ... 30
A. EKSTRAKSI PATI GARUT ( Marantha arundinacea) ... 30
B. PEMBUATAN PATI MODIFIKASI UNTUK MENGHASILKAN PATI RESISTENTIPE III ... 32
C. ANALISIS DAYA CERNA PATI ... 35
D. ANALISIS PROKSIMAT PATI MODIFIKASI ... 39
1. Kadar Air ... 40
2. Kadar Abu ... 41
3. Kadar Protein dan Lemak... 42
4. Kadar Karbohidrat ... 43
E. KADAR PATI TOTAL ... 44
F. KADAR AMILOSA DAN AMILOPEKTIN ... 45
G. KADAR SERAT PANGAN ... 48
H. KADAR PATI RESISTEN ... 50
V. KESIMPULAN DAN SARAN ... 55
A. KESIMPULAN ... 55
B. SARAN ... 56
DAFTAR PUSTAKA ... 57
DAFTAR GAMBAR
Halaman
1 Umbi garut sebelum dan sesudah dikupas ... 4
2 Ekstraksi pati garut ... 19
3 Bagan proses modifikasi dengan panas ... 20
4 Analisis kimia yang dilakukan pada sampel pati modifikasi ... 22
5 Daya cerna pati garut, Novelose 330, dan pati modifikasi ... 36
6 Kadar pati garut, Novelose 330, dan pati modifikasi ... 45
7 Kadar amilosa pati garut, Novelose 330, dan pati modifikasi... 47
8 Kadar serat pangan Novelose 330, pati garut, pati modifikasi 3 siklus, 15 menit dan pati modifikasi 5 siklus, 15 menit ... 50
DAFTAR TABEL
Halaman 1 Komposisi zat gizi dan kimia kultivar umbi garut (per 100 gram umbi) 5 2 Rendemen pati umbi garut ... 31 3 Rendemen dan lama pengeringan pati termodifikasi hasil drum dryer
dan evaporator vakum ... 33 4 Rendemen pati modifikasi dengan pengeringan menggunakan
drum dryer ... 34 5 Hasil analisis proksimat ... 39
DAFTAR LAMPIRAN
Halaman
1 Hasil analisis daya cerna pati sampel ... 63
2 Hasil analisis proksimat sampel ... 65
3 Hasil analisis kadar pati total ... 66
4 Hasil analisis kadar amilosa ... 67
5 Hasil analisis kadar serat pangan ... 68
6 Hasil analisis kadar pati resisten ... 69
7 Analisis ragam daya cerna pati ... 70
8 Analisis ragam kadar air... 71
9 Analisis ragam kadar abu ... 72
10 Analisis ragam kadar protein ... 73
11 Analisis ragam kadar lemak ... 74
12 Analisis ragam kadar karbohidrat ... 75
13 Analisis ragam kadar pati total ... 76
14 Analisis ragam kadar amilosa ... 77
15 Analisis ragam kadar serat pangan larut ... 78
16 Analisis ragam kadar serat pangan tidak larut ... 79
17 Analisis ragam kadar serat pangan total... 80
18 Analisis ragam kadar pati resisten... 81
I. PENDAHULUAN
A. LATAR BELAKANG
Saat ini, fungsi pangan semakin berkembang, tidak hanya untuk memenuhi kebutuhan gizi saja. Akan tetapi, dapat juga bersifat fungsional karena berfungsi untuk menjaga kesehatan dan kebugaran tubuh, memperbaiki fungsi fisiologis, atau membantu menyembuhkan penyakit. Kajian mengenai sifat fungsional pangan yang berkhasiat untuk kesehatan dan kebugaran semakin meningkat sejalan dengan semakin meningkatnya kesadaran masyarakat akan pentingnya hidup sehat.
Umbi-umbian adalah sumber karbohidrat yang memiliki potensi untuk diversifikasi pangan dan sebagai bahan pangan fungsional di Indonesia. Beberapa jenis umbi-umbian yang memiliki sifat fungsional yang berkhasiat untuk kesehatan telah banyak diteliti diantaranya adalah ubi jalar (Ipomoea batatas L). Marsono (2002) telah meneliti berbagai indeks glisemik makanan khas Indonesia. Nilai IG jenis sukun, singkong, pisang tanduk, gembili, kimpul, dan ganyong masing-masing 90, 73, 92, 90, 95 dan 105. Dibandingkan nilai IG umbi lainnya, nilai IG garut tergolong rendah yaitu 32 (Utami 2007). Dari hasil penelitian tersebut terlihat bahwa garut dapat memberi harapan sebagai bahan pangan fungsional yang cukup baik.
Umbi garut sebenarnya merupakan tanaman yang tidak terlalu asing bagi sebagian masyarakat Indonesia namun pemanfaatannya untuk kepentingan pangan secara komersil belum dieksplorasi secara optimum. Pengolahan garut menjadi pati akan meningkatkan nilai ekonomis umbi garut. Program pengembangan tanaman garut sebagai sumber bahan baku alternatif industri pangan diluncurkan mantan presiden BJ Habibie sejak 1998 sebagai salah satu langkah pemenuhan pangan nasional. Tanaman garut dipilih karena dinilai memiliki keunggulan dibandingkan jenis umbi lainnya. Garut merupakan sumber pati yang baik digunakan sebagai bahan pangan fungsional (Raja dan Shindu 2000). Dasar pengembangan tanaman garut adalah niat pemerintah mengubah paradigma impor bahan pangan dan menjual produk lanjutan bukan sekedar hasil panen (Anwar et al. 1999). Tanaman garut merupakan tanaman
yang mudah dibudidayakan. Tanaman ini telah dibudidayakan di daerah Jawa Tengah dan Jawa Timur dengan prokduktivitas 2 kg/ m2 (Deptan 2008).
Di Indonesia pati umbi-umbian sangat berpotensi untuk dikembangkan sebagai bahan baku dan bahan pembantu untuk industri pangan dan non pangan. Salah satu cara untuk meningkatkan kegunaan pati adalah dengan membuat modifikasi pati menjadi produk modifikasi pati agar diperoleh sifat-sifat yang cocok untuk aplikasi tertentu. Pati termodifikasi adalah pati yang diberi perlakuan tertentu yang bertujuan untuk menghasilkan sifat yang lebih baik untuk memperbaiki sifat sebelumnya atau untuk mengubah beberapa sifat lainnya (Saguilan et al. 2005). Industri pangan sudah mulai memanfaatkan penggunaan pati termodifikasi sebagai bahan pembantu bagi produk makanan tertentu. Penambahan pati termodifikasi pada produk pangan dapat meningkatkan nilai fungsional dan mempunyai keunggulan kualitas. Menurut beberapa penelitian dilaporkan bahwa proses modifikasi melalui perlakuan
autoclaving-cooling terhadap pati dapat menurunkan daya cerna pati dan meningkatkan kadar pati resisten. Pati resisten telah terbukti baik bagi fungsi fisiologi tubuh, antara lain : menurunkan indeks glisemik, menurunkan kolesterol, dan mengurangi risiko kanker usus sehingga dapat dimanfaatkan untuk pembuatan pangan fungsional (Soto et al. 2004)
Dibandingkan dengan beberapa pati dari jenis umbi-umbian lain yang dipanen pada umur panen optimum, pati garut memiliki kadar amilosa yang cukup tinggi. Kadar amilosa yang tinggi pada pati garut menjadikan pati garut sesuai untuk dijadikan bahan baku pati resisten tipe III (Naraya dan Moorthy 2002). Tanaman garut memiliki potensi hasil dan mutu pati yang tinggi serta memiliki banyak kegunaan. Namun pengkajian tentang sifat kimia terhadap pati modifikasi dari umbi garut belum dilakukan, padahal hal ini perlu agar pati garut modifikasi dapat dijadikan bahan bahan baku produk pangan fungsional.
B. TUJUAN PENELITIAN
Penelitian ini bertujuan melakukan modifikasi pati garut dengan perlakuan siklus pemanasan suhu tinggi-pendinginan untuk menghasilkan pati garut dengan kandungan pati resisten tinggi serta melakukan karakterisasi sifat kimia pati garut yang telah dimodifikasi.
C. MANFAAT PENELITIAN
Manfaat dilakukannya penelitian ini, antara lain :
1. Menyediakan informasi perlakuan siklus pemanasan suhu tinggi-pendinginan yang sesuai untuk menghasilkan pati resisten tipe III yang tinggi.
2. Menyediakan informasi ilmiah mengenai sifat kimia pati garut termodifikasi yang dapat dijadikan dasar pemanfaatan umbi garut untuk dijadikan produk olahan yang memiliki sifat fungsional dan pada akhirnya dapat meningkatkan nilai tambah dari umbi tersebut.
II. TINJAUAN PUSTAKA
A. GARUT (Maranta arundinacea L.)
Daerah asal tanaman garut adalah Amerika tropis, yang kemudian tersebar luas ke daerah tropis lainnya termasuk Indonesia. Tanaman ini dapat tumbuh pada ketinggian 0-900 m dpl, dan tumbuh baik pada ketinggian 60-90 m dpl, pada tempat-tempat dengan tanah lembab yang terlindung dari sinar matahari langsung (Sastrapradja et al. 1977).
Tinggi tanaman 60-80 cm, dengan batang sejati terdapat dalam tanah, berbentuk silinder yang menebal di ujungnya. Daunnya berbentuk bulat telur hingga lanset bulat telur berwarna hijau polos atau berbercak putih. Umbinya berwarna putih ditutupi oleh kulit berupa sisik berwarna coklat muda yang tersusun bersesuaian. Gambar 1 menyajikan klasifikasi ilmiah tanaman garut (Anonim 2008)
Kingdom : Plantae
Sub kingdom : Tracheobionta Divisi : Magnoliophyta Kelas : Liliopsida Sub kelas : Zingiberidae Ordo : Zingiberales Famili : Marantaceae
Genus : Maranta
Spesies : M. arundinacea
Garut atau arrowroot memiliki dua kultivar utama yaitu creole dan
banana. Kultivar creole memiliki rizoma yang kecil memanjang, dengan susunan menyebar di sekitar batang dan terpenetrasi lebih dalam ke dalam tanah, sedangkan kultivar banana berumbi pendek tebal, sedikit berserat, dan rizomanya terbentuk lebih dekat ke permukaan tanah. Setelah dipanen, kultivar creole mempunyai daya tahan tujuh hari sebelum dilakukan pengolahan. Sedangkan, kultivar banana cepat sekali rusak sehingga harus diolah paling lama 48 jam setelah pemanenan (Kay 1973).
Terdapat perbedaan jumlah pati dan serat diantara kultivar garut. Jenis
creole memiliki kadar pati dan serat yang lebih tinggi dibandingkan banana. Komposisi zat gizi dan kimia kultivar umbi garut dapat dilihat pada Tabel 1.
Tabel 1 Komposisi zat gizi dan kimia kultivar umbi garut (per 100 gram umbi) (Kay 1973).
Komponen banana creole
Pati (g) 19.4 21.7 Serat (g) 0.6 1.3 Protein (g) 2.2 1.0 Lemak (g) 0.1 0.1 Abu (g) 1.3 1.4 Air (g) 72.0 69.1
Tanaman garut dibudidayakan terutama untuk diambil patinya. Pati garut mudah dicerna sehingga dimanfaatkan sebagai makanan bayi, makanan anak penyandang autis, orang yang mengalami gangguan pencernaan, pasien dalam masa penyembuhan serta diet bagi manula (Deptan 2008). Pati garut juga digunakan sebagai bahan baku industri kosmetik, lem, alkohol, juga tablet yang diinginkan bersifat mudah larut. Secara tradisional umbi garut dapat dikonsumsi langsung hanya dengan dikukus atau dipanggang. Umbi garut juga dijadikan sebagai obat luka (Kay 1973). Umbi garut segar mengandung pati 19-21 %, sehingga garut merupakan sumber karbohidrat yang patut didayagunakan. Tanaman garut dapat menjadi lumbung pangan di
daerah hutan dan perkebunan, terutama di lahan kering. Garut dapat dipanen setiap tahun dengan rotasi 5-7 tahun dengan cara cukup meniggalkan ujung umbi saat dipanen. Hal ini membuat biaya produksi murah dan perawatannya mudah (Lingga et al. 1986). Akan tetapi, hingga saat ini potensi garut belum didayagunakan secara optimal (BKP 2008).
B. KARBOHIDRAT
Karbohidrat adalah sumber kalori utama bagi hampir seluruh populasi dunia yaitu sebesar 4 Kal per 1 gram. Sebagian besar karbohidrat tubuh diperoleh dari asupan makanan terutama yang berasal dari tumbuhan. Karbohidrat merupakan salah satu makromolekul organik yang tersusun terutama oleh tiga unsur yaitu karbon (C), hidrogen (H), dan oksigen (O), dengan rumus umumnya (CH2O)n. Berdasarkan jumlah molekul gula
sederhana pembentuknya, karbohidrat digolongkan menjadi monosakarida, disakarida, oligosakarida dan polisakarida (Belitz dan Grosch 1999).
Monosakarida merupakan bentuk karbohidrat paling sederhana, hanya terdiri dari satu molekul gula sederhana. Penamaan monosakarida didasarkan pada jumlah atom C penyusunnya mulai dari triosa dengan 3 molekul atom C, tetrosa (4 atom C), pentosa (5 atom C), heksosa 6 atom C), dan seterusnya. Monosakarida digolongkan juga berdasarkan gugus fungsional yang dimiliki, monosakarida digolongkan menjadi aldosa dengan gugus fungsional berupa aldehid, dan ketosa dengan gugus fungsional berupa keton (Winarno 2004). Monosakarida yang penting dalam pangan sebagai nutrisi adalah glukosa yang merupakan bentuk gula yang disirkulasikan oleh darah, galaktosa, dan fruktosa dengan tingkat rasa manis tertinggi diantara jenis-jenis gula yang banyak terkandung dalam buah-buahan dan madu (Bender 2003).
Disakarida tersusun dari dua molekul gula sederhana yang dihubungkan dengan ikatan glikosidik yang terbentuk dari kondensasi dua gugus hidroksil masing-masing dari setiap molekul monosakarida pembentuknya. Ikatan glikosidik dapat pecah kembali dengan bantuan air sehingga termasuk reaksi hidrolisis. Contoh disakarida yang penting adalah
sukrosa atau gula meja yang tersusun dari satu molekul glukosa dan satu molekul fruktosa, maltosa yang tersusun dari dua molekul glukosa, dan laktosa atau gula susu yang tersusun dari satu molekul glukosa dan satu molekul galaktosa. Polisakarida adalah golongan karbohidrat yang paling banyak ditemukan pada tanaman seperti pati, selulosa, dan hemiselulosa, juga pada jaringan tubuh hewan yaitu glikogen pada otot (Rimbawan dan Siagian 2004).
Semua jenis karbohidrat dimulai dalam mulut oleh enzim α-amilase (ptialin) dalam saliva. Karbohidrat rantai panjang termasuk pati yang tercerna dalam proses ini hanya sebagian. Setelah melewati lambung, karbohidrat dicerna lebih lanjut dalam duodenum oleh enzim amilase yang dihasilkan oleh pankreas menjadi rantai yang lebih pendek. Pencernaan karbohidrat diakhiri oleh enzim-enzim disakaridase yang dihasilkan oleh sel-sel mukosa usus halus, menjadi monosakarida yang dapat diserap ke dalam aliran darah (Bender 2003). Berdasarkan sifat karbohidrat (pati) terhadap aktivitas enzim, Berry (1986) didalam Sajilata et al. (2006) membagi jenis pati dalam tiga golongan yaitu pati yang cepat terhidrolisis, pati yang terhidrolisis dengan lambat, dan pati resisten.
C . PATI
Pati merupakan sumber utama karbohidrat dalam pangan. Pati adalah bentuk penting polisakarida yang tersimpan dalam jaringan tanaman, berupa granula dalam kloroplas daun dan dalam amiloplas pada biji dan umbi (Sajilata et al. 2006). Pati merupakan homopolimer glukosa dengan ikatan alfa-glikosidik. Molekul pati berbentuk semikristalin yang tersusun dari unit kristal dan unit amorphous. Unit kristal lebih tahan terhadap perlakuan asam kuat dan enzim, sedangkan unit amorphous pati bersifat lebih labil terhadap asam kuat dan enzim dibandingkan unit amorphous (Hood 1981). Dalam pembentukan gel, unit amorphous berkaitan dengan unit kristal membentuk jaringan kerja yang lebih kuat.
Sifat-sifat umum dari pati adalah tidak larut air, memiliki sifat yang berbeda tergantung kepada panjang rantai karbonnya, dan terdiri dari granula-granula yang berukuran mikroskopik. Selain itu, pati memperlihatkan warna biru dalam larutan yodium sehingga sifat ini dijadikan cara untuk menganalisis pati secara kualitatif. Struktur pati yang berbentuk spiral akan mengikat molekul yodium sehingga menyebabkan terbentuknya warna biru (Muchtadi et al. 1993). Pati terdiri dari dua fraksi yang dapat dipisahkan dengan air panas. Fraksi terlarut disebut amilosa dan fraksi tidak larut disebut amilopektin (Winarno 2004).
1. Amilosa dan Amilopektin
Pati tersusun dari dua jenis polimer glukosa, yaitu amilosa dan amilopektin. Amilosa merupakan polimer berantai lurus dan amilopektin yang merupakan struktur dengan rantai bercabang. Polimer glukosa berantai lurus terbentuk dari ikatan α-(1-4)-D-glukosa, sedangkan percabangan polimer terbentuk dari ikatan α-(1-6)-D-glukosa (BeMiller dan Whistler 1996).
Komposisi pati dari suatu tanaman pada umumnya mengandung amilosa 20-25% dan sisanya adalah amilopektin. Amilosa dan amilopektin memiliki perbedaan sruktur yang menyebabkan perbedaan ketahanan terhadap enzim pencernaan. Rantai bercabang dari amilopektin mempunyai sifat yang mudah sekali didegradasi oleh enzim-enzim pencernaan, sedangkan amilosa tidak mudah didegradasi oleh enzim (Ananta 2006)
Percabangan pada amilosa mungkin ditemui namun jumlahnya sangat terbatas. Percabangan ini akan timbul setelah lebih dari 500 unit glukosa membentuk rantai lurus. Panjang rantai polimer akan mempengaruhi berat molekul amilosa. Rantai polimer sendiri dipengaruhi oleh sumber patinya. Pada umumnya amilosa dari umbi-umbian mempunyai berat molekul lebih besar dan rantai polimer amilosa yang lebih panjang dibandingkan dengan berat molekul dan panjang rantai polimer amilosa serealia (Fennema 1985). Pada pati umumnya, amilosa yang merupakan fraksi linear merupakan komponen minor yaitu sekitar 17-30% total pati. Pembentukan warna biru yang dihasilkan oleh pati melalui penambahan yodium menunjukan fraksi
linear (Muchtadi et al. 1993). Menurut Villamajor dan Jurkema (1996) pati garut mengandung amilosa sebesar 20% dan mengandung kalium dalam jumlah yang cukup besar. Pernyataan ini diperkuat oleh Muchtadi et al.
(1993) yang menyatakan bahwa kadar amilosa pati garut adalah 21%.
Amilopektin merupakan komponen yang bercabang karena terdapat ikatan alpha 1-6 pada titik tertentu dari molekul tersebut. Reaksi dengan yodium akan menghasilkan warna merah (Muchtadi et al. 1993). Pada amilopektin, sebanyak 4–5% glukosanya menyusun percabangan, dengan jumlah glukosa antarcabang sekitar 20–25 unit (Sajilata et al. 2006) sedangkan menurut Muchtadi et al. 1993 jumlah glukosa yang menyusun percabangannya sekitar 20-30 unit. Menurut Satin (2001) dan Muchtadi et al.
(1993) menyatakan bahwa jumlah amilopektin pada pati garut sebesar 79% dari total pati.
2. Gelatinisasi
Pati dalam jaringan tanaman memiliki bentuk granula (butir) yang berbeda-beda. Jenis pati dapat dibedakan secara mikroskopis karena memiliki bentuk, ukuran, letak hilum, dan juga sifat birefringent yang unik (Winarno 2004). Granula pati memiliki sifat merefleksikan cahaya terpolarisasi sehingga di bawah mikroskop terlihat kristal gelap terang, sifat inilah yang disebut sifat
birefringent. Gelatinisasi pati merupakan fenomena umum yang terjadi pada pati dan sering menjadi prinsip utama pada berbagai cara pengolahan pati. Gelatinisasi adalah peristiwa hilangnya sifat birefringent granula pati akibat penambahan air secara berlebih dan pemanasan pada waktu dan suhu tertentu sehingga granula membengkak dan tidak dapat kembali pada kondisi semula (irreversible) (Belitz dan Grosch 1999). Suhu pada saat granula pati pecah disebut suhu gelatinisasi. Hasil penelitian Kawabata et al. (1984) menyebutkan bahwa suhu gelatinisasi pati garut adalah 70 0C. Sedangkan berdasarkan penelitian Nasution (2008) menyebutkan bahwa suhu gelatinisasi pati garut adalah 85,5 0C.
Granula pati tidak larut pada air dingin tetapi bagian amorphous pada granula pati dapat menyerap air sampai 30%. Bila pati mentah dimasukkan ke
dalam air, granula patinya akan menyerap air dan membengkak. Akan tetapi jumlah air yang terserap dan pembengkakannya terbatas. Menurut Winarno (2004) peningkatan volume granula pati terjadi di dalam air pada suhu 55-65
0
C merupakan pembengkakan yang sesungguhnya dan setelah pembengkakan ini granula pati dapat kembali ke kondisi semula. Granula pati dapat dibuat sangat membengkak tetapi tidak dapat kembali pada kondisi semula.
Pada proses gelatinisasi terjadi pengrusakan ikatan hidrogen. Ikatan hidrogen ini berfungsi untuk mempertahankan struktur integritas granula. Terdapatnya gugus hidroksil yang bebas akan menyerap molekul air sehingga selanjutnya terjadi pembengkakan granula pati (Greenwood 1979). Menurut Winarno (2004) jumlah gugus hidroksil dari molekul pati yang sangat besar menyebabkan kemampuan penyerapan airnya juga besar. Terjadinya peningkatan viskositas disebabkan oleh air yang sebelumnya berada di luar granula pati dan bebas bergerak sebelum suspensi dipanaskan, kini berada dalam granula dan tidak dapat bergerak bebas lagi.
Pada dasarnya proses gelatinisasi terjadi melalui tiga fase antara lain : air secara perlahan-lahan dan bolak-balik masuk ke dalam granula pati, fase kedua ditandai dengan pengembangan granula dengan cepat sehingga kehilangan sifat birefringent, dan fase ketiga terjadi jika suhu terus naik, maka molekul amilosa terdifusi keluar granula (Cready 1970). Remsen dan Clark (1978) di dalam Harper (1981) mengemukakan bahwa mekanisme gelatinisasi di awali dengan adanya pemberian air yang mengganggu kristanilitas amilosa dan mengganggu struktur heliksnya. Granula pati mengembang dan volumenya menjadi 20-30 kalinya. Bila diberi air panas terus-menerus maka amilosa akan keluar dari granula. Jika proses gelatinisasi terus berlanjut maka granula akan pecah dan terbentuklah struktur gel koloidal.
Suhu gelatinisasi tergantung pada konsentrasi pati. Makin kental larutan, maka suhu tersebut akan semakin lama tercapai. Pada suhu tertentu keketalan tidak bertambah bahkan kadang-kadang turun (Winarno 2004). Selain konsentrasi, pembentukan gel dipengaruhi oleh pH larutan. Pembentukan gel optimum pada pH 4-7. Pada pH yang terlalu tinggi
pembentukan gel berlangsung dengan cepat tetapi juga cepat menurun. Sedangkan bila pH terlalu rendah, gel terbentuk terlalu lambat dan saat pemanasan diteruskan maka viskositas akan kembali turun.
Pati yang telah mengalami gelatinisasi dapat keringkan, tetapi molekul-molekul tersebut tidak dapat kembali lagi ke sifat-sifat sebelum gelatinisasi. Bahan yang dikeringkan tersebut mampu menyerap air kembali dalam jumlah yang besar. Sifat pati yang telah tergelanisasi inilah yang diaplikasikan pada berbagai produk pangan (Winarno 2004)
3. Retrogradasi
Jika gel pati didiamkan beberapa lama maka akan terjadi perluasan daerah kristal sehingga mengakibatkan pengkerutan struktur gel yang biasanya diikuti dengan keluarnya air dari gel. Pati tergelatinisasi yang kemudian mengalami penurunan suhu dapat mengkristal kembali, peristiwa ini disebut dengan retrogradasi (BeMiller dan Whistler 1996).
Bila pati didinginkan energi kinetik tidak cukup tinggi untuk mencegah kecenderungan molekul-molekul amilosa untuk berikatan satu sama lain. Dengan demikian terjadi semacam jaring-jaring yang membentuk mikrokristal dan mengendap (Winarno 2004). Retrogradasi mengakibatkan perubahan sifat gel pati diantaranya meningkatkan ketahanan pati terhadap hidrolisis enzim amilolitik, menurunkan kemampuan melewatkan cahaya (transmisi) dan kehilangan kemampuan untuk membentuk kompleks berwarna biru dengan iodin. Faktor yang mendukung terjadinya retrogradasi adalah temperatur yang rendah, derajat polimerisasi yang relatif rendah, konsentrasi amilosa yang tinggi, dan adanya ion-ion organik tertentu (Jane 2004).
D. MODIFIKASI PATI
Pati tanpa perlakuan modifikasi telah banyak digunakan dalam proses pengolahan pangan namun terdapat keterbatasan dari segi properti fisik dan kimia pati untuk diaplikasikan pada produk pangan tertentu. Untuk mendapatkan pati sesuai dengan karakteristik produk pangan dan meningatkan
sifat fungsionalnya maka pati tersebut perlu dimodifikasi (Elliason 2004). Pati modifikasi adalah pati yang diberi perlakuan tertentu agar dihasilkan sifat yang lebih baik untuk memperbaiki sifat sebelumnya, terutama sifat fisiko – kimia dan fungsionalnya atau untuk mengubah beberapa sifat lainnya (Saguilan et al. 2005).
Perlakuan untuk memodifikasi pati mencakup perlakuan secara fisik dan kimia. Beberapa metode modifikasi pati antara lain modifikasi dengan pemuliaan tanaman, konversi dengan hidrolisis (asam atau oksidator), cross linking, derivatisasi secara kimia (esterifikasi dan eterifikasi), serta perlakuan fisik yang akan menghasilkan perubahan bentuk, ukuran serta struktur molekul pati (Bao dan Bergman 2004).
1. Modifikasi Pati Secara Kimia
Menurut Fleche (1985), pati modifikasi merupakan pati yang gugus hidroksilnya telah diubah lewat suatu reaksi kimia (esterifikasi atau oksidasi) atau dengan mengganggu struktur asalnya. Teknik modifikasi pati antara lain modifikasi sifat reologi dan modifikasi dengan stabilisasi. Modifikasi sifat reologi meliputi depolimerisasi dan ikatan silang. Proses depolimerisasi akan menurunkan viskositas sehingga dapat digunakan untuk tingkat total padatan yang tinggi. Depolimerisasi dapat dilakukan dengan cara dekstrinasi, konversi asam, dan oksidasi. Teknik ikatan silang akan membentuk jembatan antara molekul sehingga didapatkan jaringan molekul yang kaku. Cara ini akan mengubah sifat reologi pati dan sifat resistennya terhadap asam. Modifikasi dengan stabilisasi dilakukan melalui reaksi esterifikasi dan eterifikasi. Modifikasi ini menghasilkan pati dengan tingkat retrogradasi yang lebih rendah dan stabilitas yang meningkat.
2. Modifikasi Pati Secara Fisik
Perlakuan modifikasi pati secara fisik melibatkan beberapa faktor antara lain : suhu, tekanan, pemotongan dan kadar air pada pati. Granula pati dapat diubah secara parsial maupun total. Prinsip modifikasi fisik secara umum adalah dengan pemanasan. Bila dibandingkan dengan modifikasi kimia, modifikasi fisik cenderung lebih aman karena tidak menggunakan berbagai
pereaksi kimia. Perlakuan modifikasi secara fisik antara lain : ekstruksi, praboiling, steam-cooking, iradiasi microwave, pemanggangan, hydrotermal treatment dan autoclaving. (Sajilata et al. 2006 ; Bao dan Bergman 2004).
Sebagian besar metode modifikasi fisik yang telah disebutkan dapat meningkatkan kadar pati resisten (Sajilata et al. 2006). Metode steaming-cooking dan praboiling umumnya diaplikasikan pada beras. Metode ekstruksi merupakan metode yang paling populer digunakan untuk memodifikasi karakteristik fungsional pati serealia. Prosesnya menggunakan temperatur tinggi, waktu yang singkat, dan gelatinisasi pati terjadi pada kandungan air rendah (Bao dan Bergman 2004).
Metode hydrotermal-treatment terdiri dari annealing dan Heat
Moisture Treatment (HMT). Prinsip metode hydrotermal-treatment
menggunakan air dan panas untuk memodifikasi pati. Pada annealing, modifikasi dilakukan dengan menggunakan jumlah air yang banyak (lebih dari 40%) dan dipanaskan pada temperatur dibawah suhu gelatinisasi pati (Zondag 2003). Sedangkan HMT dilakukan dengan menggunakan jumlah kandungan air rendah (18, 21, 24, 27%) dan dipanaskan pada temperatur melebihi suhu gelatinisasi. Metode hydrotermal-treatment dapat mengubah karakteristik gelatinisasi pati yaitu meningkatkan suhu gelatinisasi, meningkatkan viskositas pasta pati, dan meningkatkan kecenderungan pati untuk mengalami retrogradasi (Adebowale et al. 2005).
Perlakuan fisik lainnya adalah metode autoclaving. Menurut Sajilata
et al. (2006) perlakuan pemanasan dengan menggunakan metode autoclaving
dapat meningkatkan produksi pati resisten hingga 9%. Metode autoclaving
dilakukan dengan mensuspensikan pati dengan rasio penambahan air 1 : 3.5 atau 1 : 5. Kemudian dipanaskan menggunakan autoklaf pada suhu tinggi. Setelah diautoklaf, suspensi pati tersebut disimpan pada suhu rendah agar terjadi retrogradasi. Untuk meningkatkan kadar pati resisten, siklus tersebut dilakukan berulang. Perlakuan modifikasi ini disebut autoclaving-cooling cycling treatment (Shin et al. 2002 ; Zabar et al. 2008)
E. PATI RESISTEN
Badan Kesehatan Dunia (WHO) pada tahun 1997 mengemukakan bahwa penemuan pati resisten merupakan salah satu pemikiran utama selama 20 tahun terakhir untuk mengetahui pentingnya karbohidrat terhadap fungsi kesehatan (Ananta 2006). Pati resisten (resistant starch atau RS) didefinisikan sebagai fraksi pati atau produk degradasi pati yang tidak terabsorbsi dalam usus halus individu yang sehat (Asp 1992 di dalam Champ 1996) karena masih diperoleh setelah melewati degradasi enzim secara sempurna (Shin et al. 2004). Sebutan pati resisten awalnya dikemukakan oleh Englyst et al. (1982) di dalam Sajilata et al. (2006) untuk menjelaskan sejumlah kecil fraksi yang bersifat resisten terhadap perlakuan hidrolisis oleh enzim α-amilase lengkap dan pullulanase secara in vitro. EURESTA (1994) di dalam Akerberg
et al. (1997) mendefinisikan pati resisten sebagai bagian pati atau hasil degradasi pati yang dapat lolos dari pencernaan dan absorbsi dalam usus halus manusia dan dapat mencapai usus besar pada subjek yang sehat.
Seperti serat pangan, pati resisten juga mengalami fermentasi oleh mikroflora pada dinding kolon, menghasilkan asam lemak rantai pendek (short chain fatty acid atau SCFA). Profil SCFA yang diperoleh dari RS lebih banyak mengandung butirat dan lebih sedikit mengandung asetat dibandingkan dengan serat pangan konvensional (Segal et al. 2000). Dengan sifat-sifat yang dimilikinya, RS dikategorikan sebagai bagian dari serat pangan. Pati resisten memiliki efek fisologis yang bermanfaat bagi kesehatan seperti pencegahan kanker kolon, memiliki efek hipoglikemik (menurunkan kadar gula darah setelah makan), berperan sebagai prebiotik, mengurangi resiko pembentukan batu empedu, memiliki efek hipokolesterolemik, menghambat akumulasi lemak dan meningkatkan absorbsi mineral (Sajilata et al. 2006). Penggantian 5.4 % total karbohidrat dalam diet dengan pati resisten juga mengindikasikan peningkatan oksidasi lipida setelah makan sehingga dapat menurunkan akumulasi lemak dalam jangka panjang (Higgins et al., 2004).
Pati resisten dibagi menjadi empat golongan yaitu RSI, RSII, RSIII, dan RSIV. RSImerupakan pati yang resisten secara fisik karena enkapsulasi dalam matriks alaminya seperti dalam biji-bijian yang tidak digiling sempurna. RS II merupakan pati dengan bentuk granular tertentu dan secara alami lebih resisten terhadap pencernaan enzim, seperti yang ditemukan pada pisang yang belum matang dan pada pati kentang mentah (Akerberg et al. 1997). RS III merupakan fraksi pati yang paling resisten, terutama berupa amilosa teretrogradasi yang terbentuk selama pendinginan pati tergelatinisasi. RS IVbenar-benar resisten terhadap pencernaan oleh amilase pankreas. RSIV
adalah pati resisten yang memiliki ikatan kimia baru selain α-(1-4) dan α-(1-6) akibat perlakuan kimia seperti dengan garam trimetafosfat yang membentuk jembatan ester fosfat di antara dua molekul pati (Sajilata et al. 2006).
Dari semua jenis RS, RS III adalah yang paling menarik karena RS tipe ini dapat mempertahankan karakteristik organoleptik suatu makanan ketika makanan tersebut ditambahkan RS III (Lehmann, 2002). RS tipe ini juga disukai karena relatif tahan panas dibandingkan RS tipe lainnya sehingga RS tipe III dapat mempertahankan sifatnya selama proses pengolahan pangan. RS tipe III merupakan jenis pati resisten yang paling banyak digunakan sebagai bahan baku pangan fungsional berbasis RS. Kandungan RS III dalam makanan alami umumnya rendah. Jumlah RS dapat meningkat saat makanan dipanggang atau dalam bentuk pasta dan produk sereal (Shamai et al. 2003).
Menurut Jacobash et al. (2006) pati resisten tipe III merupakan RS yang paling sesuai dijadikan sebagai prebiotik. RS III telah banyak diproduksi dan dijual komersial, salah satunya adalah Novelose 330. Novelose 330 merupakan RS tipe III yang diproduksi oleh National Starch and Chemical (Brigewater, NJ, USA) dengan menggunakan metode Heat Moisture Treatment (HMT). Bahan baku Novelose 330 adalah Hi-Amylose corn strach.
HMT yang digunakan adalah dengan memanaskan suspensi pati (60% - 90% w/w) selama 1 jam pada suhu 121 0C, kemudian diretrogradasi selama 1 jam pada suhu -20 0C (Jacobash et al. 2006).
F. SERAT PANGAN
Menurut Winarno (2004) serat pangan atau dietary fiber merupakan bagian dari jaringan tanaman yang tahan terhadap proses hidrolisis oleh enzim dalam lambung dan usus kecil. Secara kolektif sejumlah polisakarida bukan pati pada bahan pangan nabati disebut polisakarida non pati (non starch polysaccharides atau NSP), yang merupakan komponen utama serat pangan (Bender 2003). Beberapa contoh NSP antara lain selulosa, hemiselulosa dan inulin yang termasuk IDF, lalu pektin, gum dan musil tanaman yang termasuk SDF.
Selulosa merupakan polimer rantai lurus dari glukosa dengan ikatan β-(1-4) yang tidak dapat terhidrolisis oleh enzim amilase. Hemiselulosa merupakan polisakarida yang tersusun dari xilosa, galaktosa, glukosa dan monosakarida lainnya yang terikat bersama-sama. Pektin merupakan polimer yang tersusun dari asam galakturonat dan monosakarida lain, banyak ditemukan pada dinding sel tanaman, gum adalah polimer dari galaktosa, asam glukuronat, dan monosakarida lain, ditemukan dalam eksudat dari batang tanaman, sedangkan musil adalah polimer dari galaktosa, mannosa dan monosakarida lain yang ditemukan dalam rumput laut (Wardlaw 1999). Komponen lain yang penting dari serat pangan yaitu lignin yang bukan termasuk karbohidrat tetapi merupakan polimer kompleks dari berbagai jenis alkohol aromatik (Bender 2003).
Serat pangan dikelompokkan berdasarkan kemampuannya larut dalam air menjadi serat pangan larut (soluble dietary fiber atau SDF) dan serat pangan tidak larut (insoluble dietary fiber atau IDF). SDF diartikan sebagai serat pangan yang dapat larut air hangat atau panas serta dapat terendapkan oleh air yang telah tercampur dengan empat bagian etanol. IDF diartikan sebagai serat pangan yang tidak larut dalam air panas dan air dingin. Gabungan dari serat pangan yang larut air dan serat pangan yang tidak larut air disebut serat pangan total (total dietary fiber atau TDF). Pengertian dietary fiber atau serat pangan berbeda dengan crude fiber (serat kasar). Menurut Winarno (2004), serat kasar adalah bagian makan yang
tidak dapat terhidrolisis oleh bahan-bahn kimia yang digunakan untuk menentukan serat kasar yaitu asam sulfat 1.25% dan natrium hidroksida 1.25%.
Efek fisiologis dari serat pangan bagi tubuh terutama adalah dalam saluran pencernaan, dimana komponen yang berbeda memberikan efek yang berlainan pula. Dalam mulut, serat menstimulasi aliran saliva dan meningkatkan volume makanan. Saat melewati lambung serat larut air dan komponen kental serat menunda pengosongan isi lambung. Dalam usus halus, serat membentuk larutan yang kental sehingga menghambat digesti dan absorbsi karbohidrat dan lemak, serta cenderung memperlambat absorbsi glukosa dan memperkecil kadar kolesterol plasma darah. Berlawanan halnya dengan serat pangan tidak larut, di dalam kolon komponen serat larut segera didegradasi oleh bakteri sehingga tidak mempengaruhi bobot feses dan tidak menimbulkan efek laksatif (Sardesai 2003). Serat pangan tidak larut dapat memperbesar volume feses dan mempercepat pengeliminasiannya sehingga mengurangi transit time dan mengurangi resiko pembentukan kanker colorectal.
Respon fisiologis dari konsumsi serat pangan menjadi dasar para pakar menghubungkan diet kaya serat dengan penurunan resiko terhadap penyakit kronis noninfeksi pada saluran pencernaan seperti konstipasi, penyakit divertikular dan kanker kolon, gangguan sistem sirkulasi tubuh seperti atherosklerosis dan penyakit jantung koroner (PJK), serta gangguan metabolisme seperti obesitas dan diabetes (Sardesai 2003). American Dietetic Association (ADA) merekomendasikan konsumsi serat pangan bagi orang dewasa sekitar 20-35 gram per hari. Sebuah studi menunjukkan bahwa konsumsi serat pangan lebih dari 25 gram perhari dapat menurunkan resiko terkena penyakit jantung 36 %, dan konsumsi 29 gram serat perhari dapat menurunkan resiko serangan jantung sebesar 41 % (Wardlaw 1999).
III. METODE PENELITIAN
A. BAHAN DAN ALAT
Bahan utama yang digunakan yaitu umbi garut berumur 4 – 6 bulan yang diperoleh dari kebun percobaan Balit Biogen Cimanggu Bogor. Selain itu digunakan pati resisten tipe III komersial (Novelose 330) sebagai kontrol positif. Bahan-bahan untuk analisis yaitu K2SO4, H2SO4 pekat, larutan
NaOH-Na2S2O3, H3BO3, HCl 1N, indikator metil merah, heksana, kertas saring,
alkohol 80%, eter, HCL 25%, NaOH, pereaksi Anthrone, glukosa murni asam asetat, KI, I2, buffer fosfat pH 6, termamyl (α amilase Sigma A-3403), enzim
pepsin (Sigma P-7000), enzim protease (Sigma P-3910), enzim amiloglukosidase (Sigma A-9913), enzim pankreatin (Sigma P-1750), etanol, aseton, pati murni (E Merck), buffer fosfat pH 7, enzim α-amilase (Fluca), asam dimetilsalisilat (DNS), maltosa murni (E Merck), akuades, dan aluminium foil.
Alat-alat yang digunakan dalam pembuatan pati yaitu rasper, vibrating screen, bak pengendap pati, loyang, oven pengering, autoklaf, drum dryer, evaporator. Alat-alat yang digunakan untuk analisis yaitu tanur, neraca analitik, desikator, perangkat Soxhlet, perangkat Kjeldahl, shaker waterbath, penangas air, hotplate, penyedot vakum, spektrofotometer Jenway, spektrofotometer UV-Vis Spectronic 20D+, sentrifuse, vorteks, pH-meter, gelas ukur, erlenmeyer, pipet volumetrik, gelas piala, crucible filtering glass
dan alat-alat gelas lainnya. B. METODE
Kegiatan penelitian ini dilakukan dalam tiga tahap. Pada tahap pertama dilakukan ekstraksi pati garut sebagai bahan baku. Pada tahap kedua yaitu dilakukan modifikasi pati garut dengan perlakuan siklus pemanasan suhu tinggi-pendinginan. Kemudian dilakukan analisis sifat kimia terhadap sampel pati umbi garut yang dimodifikasi dan sampel kontrol positif.
a. Ekstraksi Pati Garut
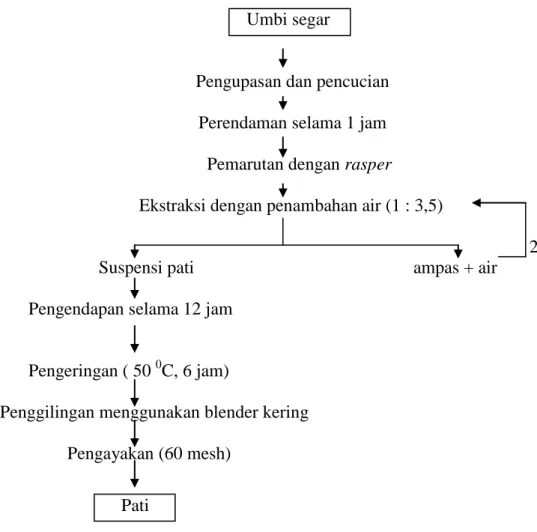
Ekstraksi pati garut dilakukan dengan mengacu metode dari penelitian lain yang pernah dilakukan sebelumnya untuk mendapatkan optimasi pembuatan pati garut. Ekstraksi pati garut dilakukan dengan tahapan proses seperti pada Gambar 2.
Umbi segar
Pengupasan dan pencucian Perendaman selama 1 jam
Pemarutan dengan rasper
Ekstraksi dengan penambahan air (1 : 3,5)
2x Suspensi pati ampas + air
Pengendapan selama 12 jam Pengeringan ( 50 0C, 6 jam)
Penggilingan menggunakan blender kering Pengayakan (60 mesh)
Pati
Gambar 2 Ekstraksi pati garut (Metode Lingga et al. 1986 yang dimodifikasi) b. Pembuatan Pati Modifikasi
Pembuatan pati modifikasi dengan siklus pemanasan suhu tinggi-pendinginan dilakukan dengan 6 perlakuan berbeda. Perlakuan tersebut adalah modifikasi pati dengan 1, 3, dan 5 siklus pemanasan suhu tinggi-pendinginan dengan 2 variasi waktu gelatinisasi (15 dan 30 menit) pada tiap siklusnya.
b.1. Pembuatan Pati Modifikasi 1 Siklus (metode Lehmann 2003 yang dimodifikasi)
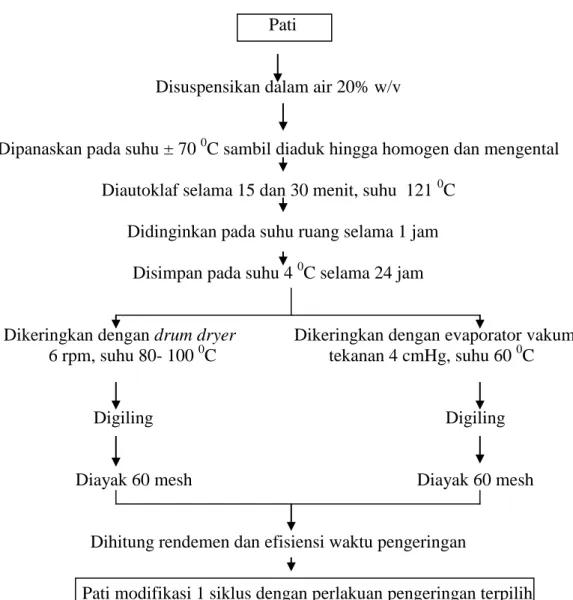
Modifikasi pati garut 1 siklus gelatinisasi dan retrogradasi dilakukan dengan menggunakan 2 alat pengering. Modifikasi pati garut dengan 1 siklus gelatinisasi dan retrogradasi dilakukan dengan tahapan proses seperti pada Gambar 3.
Pati
Disuspensikan dalam air 20% w/v
Dipanaskan pada suhu ± 70 0C sambil diaduk hingga homogen dan mengental Diautoklaf selama 15 dan 30 menit, suhu 121 0C
Didinginkan pada suhu ruang selama 1 jam Disimpan pada suhu 4 0C selama 24 jam
Dikeringkan dengan drum dryer Dikeringkan dengan evaporator vakum 6 rpm, suhu 80- 100 0C tekanan 4 cmHg, suhu 60 0C Digiling Digiling Diayak 60 mesh Diayak 60 mesh
Dihitung rendemen dan efisiensi waktu pengeringan
Pati modifikasi 1 siklus dengan perlakuan pengeringan terpilih
b.2. Pembuatan Pati Modifikasi 3 Siklus
Pati garut yang disuspensikan dalam air 20 % w/v kemudian dipanaskan sambil diaduk hingga homogen. Kemudian diautoklaf selama 15 menit dan 30 menit, pada suhu 121 0C. Setelah itu didinginkan selama 1 jam pada suhu ruang, lalu diretrogradasi melalui pendinginan selama 24 jam pada suhu 4 0C. Proses pemanasan dengan autoklaf hingga pendinginan pada 4 0C diulangi sebanyak 2 kali. Setelah itu, dikeringkan dengan perlakuan pengeringan terpilih, digiling, dan diayak 60 mesh.
b.3. Pembuatan Pati Modifikasi 5 Siklus (metode Mahadevamma dan Tarathanan 2003 yang dimodifikasi)
Pati garut yang disuspensikan dalam air 20 % w/v kemudian dipanaskan sambil diaduk hingga homogen. Kemudian diautoklaf selama 15 menit dan 30 menit, suhu 121 0C. Setelah itu didinginkan selama 1 jam pada suhu ruang, lalu diretrogradasi melalui pendinginan selama 24 jam pada suhu 4 0C. Proses pemanasan dengan autoklaf hingga pendinginan pada 4 0C diulangi sebanyak 4 kali. Setelah itu, dikeringkan dengan perlakuan pengeringan terpilih, digiling, dan diayak 60 mesh.
c. Analisis Kimia Yang Dilakukan Pada Pati Modifikasi
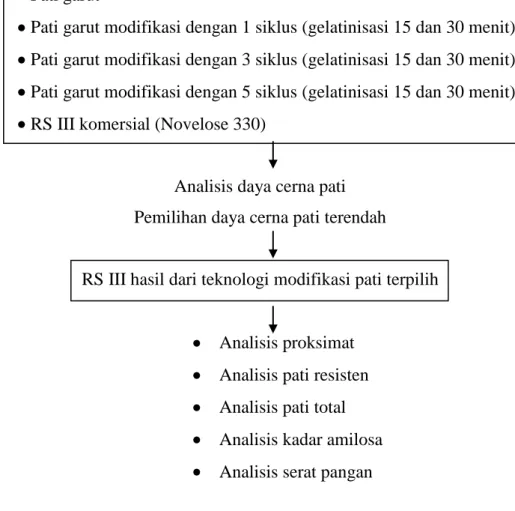
Analisa kimia dilakukan terhadap pati garut, pati garut modifikasi dengan 1 siklus (dengan waktu gelatinisasi 15 dan 30 menit), pati garut modifikasi dengan 3 siklus (dengan waktu gelatinisasi 15 dan 30 menit), pati garut modifikasi dengan 5 siklus (dengan waktu gelatinisasi 15 dan 30 menit), dan RS III komersial (Novelose 330). Parameter yang diamati meliputi daya cerna pati kadar air, kadar abu, kadar protein, kadar lemak, kadar karbohidrat, kadar pati resisten, kadar pati total, kadar amilosa, dan kadar serat pangan. Gambar 4 menunjukan analisis kimia yang dilakukan pada penelitian ini.
Pati garut
Pati garut modifikasi dengan 1 siklus (gelatinisasi 15 dan 30 menit) Pati garut modifikasi dengan 3 siklus (gelatinisasi 15 dan 30 menit) Pati garut modifikasi dengan 5 siklus (gelatinisasi 15 dan 30 menit) RS III komersial (Novelose 330)
Analisis daya cerna pati Pemilihan daya cerna pati terendah RS III hasil dari teknologi modifikasi pati terpilih
Analisis proksimat Analisis pati resisten Analisis pati total Analisis kadar amilosa Analisis serat pangan
Gambar 4 Analisis kimia yang dilakukan pada pati modifikasi C. PROSEDUR ANALISIS
1. Rendemen Pati
Pengukuran rendemen pati dihitung berdasarkan perbandingan berat pati yang diperoleh terhadap berat umbi tanpa kulit yang dinyatakan dalam persen (%).
Rendemen (%) = b x 100% a
Keterangan : a = berat umbi tanpa kulit (g) b = berat pati yang diperoleh (g)
2. Kadar Air (AOAC 1995)
Cawan kosong dikeringkan dalam oven selama 15 menit, lalu didinginkan dalam desikator, dan ditimbang. Sebanyak 4-5 g sampel ditimbang dalam cawan yang telah diketahui bobot kosongnya, lalu dikeringkan dalam oven pengering pada suhu 105oC selama 6 jam. Cawan dengan isinya kemudian didinginkan dalam desikator, dan ditimbang. Pengeringan dilakukan kembali hingga diperoleh berat konstan. Kadar air dihitung berdasarkan kehilangan berat yaitu selisih berat awal sampel sebelum dikeringkan dengan berat akhir setelah dikeringkan.
Kadar air (%bb) = (berat awal-berat akhir) x 100 % berat sampel
3. Kadar Abu (AOAC 1995)
Cawan porselen dipanaskan dalam oven selama 15 menit, lalu didinginkan dalam desikator dan ditimbang. Sebanyak 3-5 g sampel dimasukkan dalam cawan porselen dan ditimbang, lalu dibakar sampai tidak berasap lagi dan diabukan dalam tanur bersuhu 550 oC sampai berwarna putih (semua contoh menjadi abu) dan beratnya konstan. Setelah itu didinginkan dalam desikator dan ditimbang.
Kadar abu (%bb) = berat abu x 100 % berat sampel
Kadar abu (%bk) = kadar abu (%bb) x 100 % 100 - kadar air (%bb)
4. Kadar Protein Metode Kjeldahl (AOAC 1995)
Ditimbang sejumlah kecil sampel (0.2 g) dalam labu Kjeldahl 30 ml. Ditambahkan 1.9 + 0.1 g K2SO4, dan 2.0 + 0.1 ml H2SO4 pekat. Sampel
didestruksi selama 1-1.5 jam sampai cairan menjadi jernih. Cairan didinginkan, ditambah 8-10 ml NaOH-Na2S2O3 dan dimasukkan ke dalam alat
larutan H3BO3 dan beberapa tetes indikator merah metil. Ujung selang
kondensor harus terendam larutan untuk menampung hasil destilasi sekitar 15 ml. Distilat dititrasi dengan HCl 0.0235 N sampai terjadi warna abu-abu. Prosedur yang sama juga dilakukan terhadap blanko (tanpa sampel). Jumlah titran sampel (a) dan titran blanko (b) dinyatakan dalam ml HCl 0.0235 N.
Kadar N (%) = (a - b) x N HCl x 14.007 x 100 % mg sampel
Kadar protein (%bb) = Kadar N (%) x 5.70 Nilai 5.70 = faktor konversi
Kadar protein (%bk) = kadar protein (%bb) x 100 % 100 - kadar air (%bb)
5. Kadar Lemak Metode Soxhlet (AOAC 1995)
Labu lemak dikeringkan dengan oven. Sampel ditimbang sebanyak 5 g dibungkus dengan kertas saring dan ditutup kapas bebas lemak. Kertas saring berisi sampel tersebut diletakkan dalam alat ekstraksi soxhlet yang dirangkai dengan kondensor. Pelarut heksana dimasukkan ke dalam labu lemak lalu direfluks selama minimal 5 jam. Sisa pelarut dalam labu lemak dihilangkan dengan dipanaskan dalam oven, lalu ditimbang.
Kadar lemak (%bb) = berat lemak x 100 % berat sampel
Kadar lemak (%bk) = kadar lemak (%bb) x 100 % 100 - kadar air (%bb)
6. Kadar Karbohidrat by difference
Kadar karbohidrat (%bk) pada sampel dihitung secara by difference,
yaitu dengan cara mengurangkan 100 % dengan nilai total dari kadar abu (%bk), kadar protein (%bk) dan kadar lemak (%bk).
Kadar karbohidrat (%bk) = 100 % - kadar abu (%bk) - kadar protein (%bk) - kadar lemak (%bk)
7. Kadar Pati Total (Apriyantono et al. 1989 yang dimodifikasi)
Hidrolisis pati dengan asam
Sampel tepung sebanyak 0.5 g ditimbang dan dimasukkan ke dalam erlenmeyer 300 ml. Ditambahkan 50 ml etanol dan diaduk selama 1 jam. Suspensi tersebut disaring dengan kertas saring dan dicuci dengan air sampai volume filtrat 250 ml. Filtrat ini mengandung karbohidrat yang terlarut dan dibuang. Residu yang terdapat pada kertas saring dicuci 5 kali dengan 10 ml eter. Eter dibiarkan menguap dari residu, kemudian dicuci kembali dengan 150 ml alkohol 10% untuk membebaskan lebih lanjut karbohidrat yang terlarut. Residu dipindahkan secara kuantitatif dari kertas saring ke erlenmeyer dengan cara pencucian dengan 200 ml air ditambah 20 ml larutan HCl 25 %. Ditutup dengan pendingin balik dan dipanaskan di atas penangas air sampai mendidih selama 2.5 jam untuk menghidrolisis pati. Setelah didinginkan, larutan hasil hidrolisis dinetralkan dengan larutan NaOH 25 % dan diencerkan sampai volume 500 ml dan dihomogenkan dan disaring untuk kemudian disebut sebagai larutan stok.
Penentuan total gula pereduksi dengan metode Anthrone
Disiapkan larutan pereaksi Anthrone 0.1 % dengan melarutkan 0.1 g bubuk Anthrone dalam 100 ml asam sulfat pekat. Larutan dibuat sesaat sebelum digunakan. Larutan stok sampel sebanyak 1 ml dimasukkan ke dalam tabung reaksi bertutup, lalu ditambahkan dengan 5 ml pereaksi Anthrone. Untuk kurva standar, sampel diganti dengan larutan glukosa murni 0.2 mg/ml sebanyak 0.0, 0.2, 0.4, 0.6, 0.8, dan 1.0 ml yang masing-masing kemudian ditepatkan menjadi 1 ml dengan air destilata. Tabung ditutup dan diinkubasikan dalam penangas air pada suhu 100ºC selama 12 menit. Larutan segera didinginkan dengan air mengalir, lalu dibaca absorbansinya dengan spektrofotometer pada panjang gelombang 630 nm. Kadar glukosa sampel ditentukan berdasarkan kurva standar glukosa yang diperoleh dari plot kadar glukosa dan absorbansi larutan glukosa murni.
Penentuan kadar pati sampel
Nilai kadar gula pereduksi yang diperoleh dikalikan dengan faktor pengenceran. Kadar pati total (%bb) dalam sampel diperoleh dengan mengalikan kadar total gula dengan faktor konversi 0.9.
Kadar pati total (%bk) = kadar pati total (%bb) x 100 % 100 - kadar air (%bb)
8. Kadar Amilosa (Apriyantono et al. 1989)
Pembuatan kurva standar amilosa
Sebanyak 40 mg amilosa murni dimasukkan ke dalam labu takar 100 ml, ditambahkan 1 ml etanol 95 % dan 9 ml larutan NaOH 1 N ke dalam labu. Labu takar lalu dipanaskan dalam penangas air pada suhu 95 ºC selama 10 menit. Setelah didinginkan, larutan gel pati ditambahkan air destilata sampai tanda tera sebagai larutan stok standar.
Dari larutan stok dipipet 1, 2, 3, 4, dan 5 ml dan dipindahkan masing-masing ke dalam labu takar 100 ml. Ke dalam masing-masing-masing-masing labu takar tersebut kemudian ditambahkan 0.2, 0.4, 0.6, 0.8, dan 1.0 ml larutan asam asetat 1 N. Ditambahkan 2 ml larutan iod (0.2 g I2 dan 2 g KI dilarutkan dalam
100ml air destilata) ke dalam setiap labu, lalu ditera dengan air destilata. Larutan dibiarkan selama 20 menit, lalu diukur absorbansinya dengan spektrofotometer pada panjang gelombang 625 nm. Kurva standar dibuat sebagai hubungan antara kadar amilosa dan absorbansi.
Analisis sampel
Sebanyak 100 mg sampel pati dimasukkan ke dalam labu takar 100 ml. Kemudian ditambahkan 1 ml etanol 95 % dan 9 ml larutan NaOH 1 N ke dalam labu. Labu takar lalu dipanaskan dalam penangas air pada suhu 95ºC selama 10 menit. Setelah didinginkan, larutan gel pati ditambahkan air destilata sampai tanda tera dan dihomogenkan. Dipipet 5 ml larutan gel pati, dipindahkan ke dalam labu takar 100 ml. Ke dalam labu takar tersebut kemudian ditambahkan 1.0 ml larutan asam asetat 1 N dan 2 ml larutan iod, lalu ditera dengan air destilata. Larutan dibiarkan selama 20 menit, lalu diukur absorbansinya dengan spektrofotometer pada panjang gelombang 625 nm.
Kadar amilosa (%bb) ditentukan berdasarkan persamaan kurva standar yang diperoleh.
Kadar amilosa (%bk) = kadar amilosa (%bb) x 100 % 100 - kadar air (%bb)
9. Kadar Serat Pangan Metode Enzimatik (AOAC 1995)
Sampel kering diekstrak lemaknya dengan pelarut petroleum eter pada suhu kamar selama 15 menit. Sejumlah 1 gram sampel bebas lemak (w) dimasukkan ke dalam erlenmeyer, ditambahkan 25 ml 0.1 M buffer natrium fosfat pH 6 dan dibuat suspensi. Pada suspensi tersebut ditambahkan 0.1 ml termamyl, ditutup dengan alufo dan diinkubasi pada suhu 100ºC selama 15 menit, diangkat dan didinginkan, ditambahkan 20 ml akuades dan pH diatur menjadi 1.5 dengan menambahkan HCl 1 M. Selanjutnya ditambahkan 100 mg pepsin, ditutup dan diinkubasi pada suhu 40 ºC dan diagitasi selama 60 menit. Pada campuran ditambahkan 20 ml akuades dan pH diatur menjadi 6.8, lalu ditambahkan 100 mg pankreatin, ditutup dan diinkubasi pada suhu 40 ºC selama 60 menit sambil diagitasi, dan terakhir pH diatur dengan HCl menjadi 4.5. Selanjutnya disaring dengan kertas Whatman no. 42, lalu dicuci dua kali dengan akuades.
Residu (serat pangan tidak larut/IDF)
Sampel dicuci dengan 2 x 10 ml etanol 95% dan 2 x 10 ml aseton, lalu dikeringkan pada suhu 105 ºC sampai berat tetap (sekitar 12 jam) dan ditimbang setelah didinginkan dalam desikator (D1). Kemudian diabukan dalam tanur 500 ºC selama minimal 5 jam, dan ditimbang setelah didinginkan dalam desikator (I1).
Filtrat (serat pangan larut/SDF)
Volume filtrat diatur dengan akuades sampai dengan 100 ml, lalu ditambah dengan 400 ml etanol 95% hangat (60 ºC), diendapkan 1 jam. Lalu disaring dengan kertas Whatman no. 42 dan dicuci dengan 2 x 10 ml etanol 78%, 2 x 10 ml aseton, lalu dikeringkan pada suhu 105 ºC hingga berat konstan, didinginkan dalam desikator dan ditimbang (D2). Selanjutnya