HUBUNGAN ANTARA EKSPRESI PROTEIN p16 DAN KI67
PADA BEBERAPA FAKTOR PROGNOSTIK
HISTOPATOLOGIK MELANOMA MALIGNUM KULIT
JENIS NODULAR
TESIS
RIESYE ARISANTY
0706312166
FAKULTAS KEDOKTERAN UNIVERSITAS INDONESIA PROGRAM STUDI PENDIDIKAN DOKTER SPESIALIS
PATOLOGI ANATOMIK JAKARTA
OKTOBER 2012
HUBUNGAN ANTARA EKSPRESI PROTEIN p16 DAN KI67
PADA BEBERAPA FAKTOR PROGNOSTIK
HISTOPATOLOGIK MELANOMA MALIGNUM KULIT
JENIS NODULAR
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh gelar Spesialis
RIESYE ARISANTY
0706312166
FAKULTAS KEDOKTERAN UNIVERSITAS INDONESIA PROGRAM STUDI PENDIDIKAN DOKTER SPESIALIS
PATOLOGI ANATOMIK JAKARTA
OKTOBER 2012
iv
Alhamdulillahirobbilalamin puji dan syukur saya panjatkan kepada Allah SWT, karena berkat ridho dan hidayah – Nya, saya dapat menyelesaikan penulisan thesis ini. Tujuan penulisan thesis ini dalam rangka memenuhi salah satu syarat untuk mencapai gelar Dokter Spesialis Patologi Anatomik pada Program Studi Pendidikan Dokter Spesialis Patologi Anatomik di Fakultas Kedokteran Universitas Indonesia. Saya sangat menyadari bahwa tanpa bimbingan serta bantuan dari berbagai pihak, sejak awal perkuliahan sampai pada massa penyusunan thesis ini, begitu berliku dan sangat sulit bagi saya. Olehkarena itu, saya sangat berterima kasih kepada :
1. dr. Budiana Tanurahardja, SpPA(K), Prof.dr. Mpu Kanoko,PhD.,SpPA(K) selaku dosen pembimbing yang telah menyediakan waktu, tenaga, pikiran untuk mengarahkan saya dalam penyusunan thesis ini.
2. Seluruh staf dan karyawan Departemen Patologi Medik Patologi Anatomik RSCM – FKUI yang telah banyak membantu mulai dari usaha pengumpulan data sampai prosesing penelitian ini.
3. Orang tua, suami dan anak-anak serta seluruh keluarga besar yang telah memberikan bantuan besar baik material, moral dan spiritual selama proses pembelajaran ini., serta
4. Rekan – rekan PPDS, yang saling mengingatkan serta memberi support dalam menyelesaikan penulisan ini.
Semoga Allah SWT berkenan membalas semua kebaikan seluruh pihak yang telah membantu. Semoga thesis ini membawa berkah dan manfaat bagi perkembangan ilmu.
Amin Yaa Robbal Alamiin Jakarta, 25 Oktober 2012
Riesye Arisanty
v
Sebagai sivitas akademik Universitas Indonesia, saya yang bertanda tangan di bawah ini :
Nama : Riesye Arisanty
NPM : 07063121166
Program Studi : Program Pendidikan Dokter Spesialis I Patologi Anatomik Departemen : Patologi Anatomik
Fakultas : Kedokteran Jenis Karya : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Indonesia Hak Bebas Royalti Nonekslusif (Non-exclusive Royalty Free Right) atas karya saya yang berjudul :
HUBUNGAN ANTARA EKSPRESI PROTEIN p16 DAN KI67 PADA BEBERAPA FAKTOR PROGNOSTIK HISTOPATOLOGIK MELANOMA MALIGNUM KULIT JENIS NODULAR
Beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Nonekslusif ini, Universitas Indonesia berhak menyimpan, mengalihmediakan / formatkan, mengolah dalam bentuk pangkalan data (database), merawat, dan mempublikasikan tugas akhir saya selama tetap mencantumkan nama saya sebagai penulis/pencipta dan sebagai pemilik Hak Cipta.
Demikian pernyataan ini saya buat dengan sebenarnya. Dibuat di : Jakarta
Pada Tanggal : 25 Oktober 2012 Yang menyatakan,
Riesye Arisanty
vi
Nama : Riesye Arisanty
Program Studi : Program Pendidikan Dokter Spesialis I Patologi Anatomik
Judul : HUBUNGAN ANTARA EKSPRESI PROTEIN p16 DAN
KI67 PADA BEBERAPA FAKTOR PROGNOSTIK HISTOPATOLOGIK MELANOMA MALIGNUM KULIT JENIS NODULAR
Latar Belakang:
Pemahaman mengenai karakteristik biologik dan faktor prognostik melanoma malignum yang merupakan tumor ganas melanositik merupakan hal yang penting karena berhubungan dengan pemilihan terapi serta kesintasan penderita. Agresivitas tumor dapat dinilai dari beberapa faktor histopatologik, antara lain: ada tidaknya ulserasi, aktivitas mitosis, dan keterlibatan kelenjar getah bening. Ekspresi protein p16 dan ki67 merupakan beberapa marker yang memiliki peran dalam prediktif prognostik melanoma malignum.
Tujuan :
Mengetahui hubungan antara ekspresi protein p16 dan Ki67 pada beberapa faktor prognostik histopatologik yang dapat digunakan sebagai penanda agresivitas tumor yaitu ulserasi, aktivitas mitosis dan metastasis pada tumor primer melanoma malignum jenis nodular.
Metode :
Penelitian ini merupakan studi potong lintang dengan metode imunohistokimia menggunakan p16 dan Ki67 pada 25 kasus melanoma malignum jenis nodular.
Hasil :
Ekspresi protein p16 negatif pada 40% kasus melanoma ulseratif dan 52% kasus dengan aktivitas mitosis tinggi, dan 16% kasus pada metastasis kgb . Ekspresi Ki67 positif pada 44% kasus melanoma dengan aktivitas mitosis tinggi, dan 20 % kasus melanoma metastasis serta 32% kasus dengan ulserasi.
Kesimpulan :
Tidak terdapat hubungan yang bermakna antara ekspresi p16 dengan gambaran ulserasi, aktivitas mitosis tinggi, dan metastasis kgb pada melanoma malignum kulit jenis nodular. Tidak terdapat hubungan antara ekspresi Ki67 dengan gambaran ulserasi, aktivitas mitosis tinggi serta metastasis kgb pada melanoma malignum kulit jenis nodular.
Kata Kunci :Melanoma malignum , Faktor prognostik histopatologik, p16 dan ki67
vii
Name : Riesye Arisanty
Study Program : Program Pendidikan Dokter Spesialis I Patologi Anatomik
Title P16 AND KI67 PROTEIN EXPRESSION AND ITS
RELATIONSHIP WITH SEVERAL HISTOPATHOLOGICAL PROGNOSTIC FACTORS IN CUTANEOUS MALIGNANT MELANOMA NODULAR TYPE
Background :
To understanding about biological behaviour and prognostic factor of melanoma malignum as a malignant tumor from melanocyte is important, because its relationship with choise of therapy and survival of the patiens. The aggresivity of the tumour, can be predicted from several prognostic factors: ulceration of the tumour, mitotic activity, and lymph nodes metastasis. P16 and Ki67 protein expressions can be used as a prognostic markers in cutaneous nodular melanoma malignum.
Aim :
Assesing p16 and Ki67 protein expression and its relatinoship with several histopatological prognostic factors as a marker of aggressiveness of the tumors: ulceratin, mitotic activity, and lymph nodes metastasis in cutaneous nodular melanoma malignum.
Metode :
This was a cross-sectional study on 25 cases of nodular melanoma, stained with p16 and ki67 antibody with immunohistochemical methods.
Result :
P16 negative expression can be found in 40% of ulcerated melanoma cases, and 52% cases with high mitotic activity and 16% of cutaneous nodular melanoma with lymph nodes metastasis. Ki67 positive expression was found in 44% of cases with high mitotic activity, 20% cases of metastasis melanoma and 32% cases in ulcerated melanoma.
Conclusion :
There was no statistically significant association between p16 expression with ulcerated melanoma, high mitotic activity,and metastatic melanoma in lymph nodes. Also no statistically significant between Ki67 expression with ulcerated melanoma, high mitotic activity and lymph nodes metastatic melanoma.
Key words :Malignant melanoma , Histopathologic prognostic factors, p16 dan ki67
viii
HALAMAN JUDUL i
LEMBAR PENGESAHAN ii
KATA PENGANTAR iii
LEMBAR PERSETUJUAN PUBLIKASI KARYA ILMIAH iv
ABSTRAK vi
DAFTAR ISI viii
DAFTAR TABEL x
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xii
PENDAHULUAN 1.1 Latar Belakang 1 1.2.. Identifikasi Masalah 3 1.3...Tujuan Penelitian 3 1.4...Rumusan Hipotesis 4 1.5...Manfaat Penelitian 4 TINJAUAN PUSTAKA
2.1...Embriologi dan Anatomi 5
2.2...Sintesis Melanin 7
2.3...Etiologi 8
2.4...Paparan Sinar Ultra Violet 8
2.5...Faktor Genetik 9
2.6...Peranan Siklus Sel dan Proliferasi Sel 10
2.7...p16 10
2.8 Ki67 11
2.9 Tumorigenesis Melanoma 12
2.10 Gambaran Histopatologik Melanoma Maligna 13
2.10.1. Superfisial Spreading Melanoma 13
2.10.2 Nodular Melanoma 14
2.10.3...Lentigo Maligna Melanoma 14
2.10.4...Acral Lentigenous Melanoma 14
2.11. Faktor Prognostik 15
ix
METODE PENELITIAN
3.1. Desain Penelitian 21
3.2...Waktu dan Tempat Penelitian 22
3.3...Populasi dan sampel penelitian 22
3.4. Kriteria Penerimaan dan Penolakan 23
3.5 Alur Kerja 23 3.6 Prosedur Penelitian 23 3.7 Pengolahan Data 25 3.8 Definisi Operasional 26 3.8.1 Ekspresi p16 26 3.8.2 Ekspresi Ki67 26 3.8.3 Aktivitas Mitosis 26 3.8.4 Ulserasi tumor 26
3.8.5 Keterlibatan kelenjar getah bening (metastasis) 26
3.9 Kaji Etik 27
HASIL PENELITIAN
4.1 Demografi dan karakteristik dasar 28
4.2 Ekspresi p16 29
4.3 Ekspresi Ki67 32
4.4 Ekspresi p16 dan Ki67 di tumor primer dan sekunder 33
PEMBAHASAN 37
KESIMPULAN DAN SARAN
6.1 Kesimpulan 42
6.2 Saran 42
DAFTAR PUSTAKA 43
x
Tabel 2.1 Berbagai Faktor Prognostik Pada Melanoma Maligna 17
Tabel 2.2 Staging Melanoma Berdasarkan AJCC 2010 17
Tabel 4.1 Karakteristik Umum Pasien 27
Tabel 4.2 Ekspresi p16 dan ki67 pada berbagai faktor prognostik melanoma malignum jenis nodular
28 Tabel 4.2.1. Ekspresi p16 pada tumor primer melanoma malignum
nodular
30 Tabel 4.2.2 Hubungan ekspresi p16 inti dengan ada tidaknya ulserasi
padatumor primer melanoma malignum jenis nodular
30 Tabel 4.2.3 Hubungan ekspresi p16 inti dengan aktivitas mitosis pada
tumor primer melanoma malignum jenis nodular
31 Tabel.4.2.4 Hubungan ekspresi p16 inti dengan metastasis kgb pada
tumor primer melanoma malignum jenis nodular
31 Tabel 4.3.1 Hubungan ekspresi Ki67 dengan ulserasi pada tumor primer
melanoma malignum jenis nodular
32 Tabel 4.3.2 Hubungan ekspresi Ki67 dengan metastasis kgb pada tumor
primer melanoma malignum jenis nodular
33 Tabel 4.3.3 Hubungan ekspresi Ki67 dengan aktivitas mitosis pada
tumor primer melanoma malignum jenis nodular
33 Tabel 4.4.1 Hubungan ekspresi p16 pada tumor primer dan sekunder
melanoma malignum jenis nodular
34 Tabel 4.4.2 Hubungan ekspresi Ki67 pada tumor primer dan sekunder
melanoma malignum jenis nodular
34
xi
Gambar 2.1 Embriologi 6
Gambar 2.2 Histologik kulit 7
Gambar 2.3 Sintesa Melanin 8
Gambar 2.4 Jalur pRb dan pengaturan siklus sel 11
Gambar 2.5 Tumorigenesis Melanoma 12
Gambar 2.6 Tipe Histologik Melanoma Maligna 15
Gambar 4.1 Hasil Pewarnaan p16 dan Ki67 35
xii
Lampiran 1 Tabel hasil uji kemaknaan Fisher’s antara ekspresi p16 dan ulserasi
47 Lampiran 2 Tabel hasil uji kemaknaan Fisher’s antara ekspresi p16
dan aktivitas mitosis
48 Lampiran 3 Tabel hasil uji kemaknaan Fisher’s antara ekspresi p16
dan metastasis kgb
49 Lampiran 4 Tabel hasil uji kemaknaan Fisher’s antara ekspresi
Ki67 dan metastasis kgb
50 Lampiran 5 Tabel hasil uji kemaknaan Fisher’s antara ekspresi
Ki67 dan ulserasi
51 Lampiran 6 Tabel hasil uji kemaknaan Fisher’s antara ekspresi
Ki67 dan aktivitas mitosis
52 Lampiran 7 Tabel hasil uji kemaknaan Mc Nemar antara ekspresi
p16 tumor primer dan sekunder
53 Lampiran 8 Tabel hasil uji kemaknaan Mc Nemar antara ekspresi
ki67 tumor primer dan sekunder
54
Lampiran 17 Ringkasan Kasus 55
Universitas Indonesia BAB 1
PENDAHULUAN
1.1. Latar Belakang
Melanoma malignum (MM) merupakan tumor ganas kulit yang termasuk dalam kelompokan tumor melanositik. Berdasarkan data berbasis histopatologi yang diambil dari Badan Registrasi Kanker (BRK) yang berasal dari 13 senter patologi di Indonesia tahun 2008, tumor primer kulit terdapat 6.22% atau sebanyak 1255 kasus ,dan menempati urutan ke-3 tumor primer tersering pada pria dan wanita. Khusus di Jakarta, tumor primer kulit menempati urutan ke-5 tersering. Berdasarkan jenis kanker kulit, melanoma malignum berada pada urutan ke-3 setelah karsinoma sel basal dan karsinoma sel skuamosa.1 Data dari American Academy of Dermathology (AAD), MM berada pada peringkat ke-6 tersering dan sebanyak 4% penyebab kematian dari seluruh keganasan, dengan jumlah kasus baru sebanyak 68.000 kasus. Publikasi data dari International Agency for Research on Cancer (IARC), angka kejadian MM invasif di daerah Queensland – Australia menduduki peringkat tertinggi di dunia pada periode 1998 – 2002.2 Berbagai kepustakaan menyebutkan bahwa melanoma malignum jenis “superficial spreading” merupakan jenis tersering. Berbeda dengan di Indonesia, melanoma malignum jenis nodular merupakan jenis yang sering ditemukan terutama di Rumah Sakit Cipto Mangunkusumo Jakarta.3-4
Beberapa kepustakaan menyebutkan bahwa patogenesis melanoma adalah multifaktorial, diantaranya adalah faktor genetik dan lingkungan. Berbagai faktor risiko juga dikaitkan sebagai penyebab terjadinya melanoma, antara lain sinar ultraviolet (UV), riwayat melanoma pada keluarga, ukuran dan jenis nevus pigmentosus. Sebanyak 65 % MM disebabkan oleh pengaruh pajanan sinar matahari / ultraviolet, sedangkan antara 8 – 12% dari jumlah MM bersifat familial yang sangat berhubungan dengan faktor genetik. 5-7
Secara histopatologik, berdasarkan pola pertumbuhannya, MM dikelompokkan menjadi pola pertumbuhan vertikal (tumorigenic melanoma) terdiri atas jenis nodular melanoma(NM) dan radial/horizontal (Non-tumorigenic
Universitas Indonesia melanoma) yang meliputi superfisial spreading melanoma (SSM), lentigo malignant melanoma(LMM) dan acral lentigenous melanoma(ALM). 8
Peningkatan pemahaman terhadap karakteristik biologik dan faktor prognostik melanoma malignum, memiliki peran penting. Hal ini berhubungan dengan pemilihan terapi yang dilakukan serta prognostik pasien tersebut. Sampai saat ini pengangkatan tumor secara eksisi merupakan terapi yang paling tepat untuk melanoma non metastatik. Terapi adjuvan dengan menggunakan IFN alfa – 2b pada melanoma dengan risiko tinggi, hingga kini masih dalam tahap pengembangan. 9 Terdapat 3 kelompok faktor prognostik pada melanoma, yaitu secara klinik, antara lain : usia, jenis kelamin, lokasi, serta metastasis. Beberapa penilaian mikroskopik histopatologik yang merupakan faktor prognostik antara lain : ketebalan lesi, ulserasi, dalamnya invasi, vaskularitas tumor (pembentukan pembuluh darah baru / microvessels), invasi limfovaskular, tumor mikrosatelit,dan jumlah mitosis per mm2,9 Kelompok faktor prognostik lainnya yaitu faktor genetik.5 Beberapa kepustakaan menyebutkan bahwa indeks prognostik merupakan faktor prognostik histopatologik yang lebih baik dibandingkan dengan penilaian berdasarkan ketebalan tumor saja.10-12 The American Joint Committee on Cancer (AJCC) tahun 2010 mengklasifikasi melanoma berdasarkan gambaran klinik dan histopatologik untuk menentukan ketahanan hidup (survival). AJCC tahun 2010 membagi stadium klinik menjadi 4 tingkatan berdasarkan jumlah mitosis per mm2, ada atau tidaknya ulserasi, status kelenjar limfe, dan lokasi metastasis.12Pada penelitian ini, kami melakukan penilaian hanya pada 3 variabel faktor prognostik, yaitu ada tidaknya keterlibatan kelenjar getah bening,ada tidaknya ulserasi serta aktivitas mitosis per mm2.Alasan pemilihan variabel faktor prognostik tersebut berhubungan dengan prediksi perkembangan serta timbulnya penyebaran sel tumor dan faktor respons terapi yang masih dalam tahap pengembangan. Dihubungkan dengan penatalaksanaan pasien, variabel ulserasi dapat dipakai sebagai prediktor respons pasca terapi adjuvan dengan interferon yang sedang dalam perkembangan.9
.Secara molekular perubahan sel melanosit menjadi sel melanosit ganas pada organ kulit melalui 2 jalur utama yaitu jalur familial dan sporadik yang
Universitas Indonesia melibatkan berbagai jenis gen yang mengalami mutasi13 Perubahan gen P16ink4a /Cyclin – dependent kinase 2A (CDKN2A), memiliki peranan penting pada melanoma terutama yang berasal dari jalur familial. Gen tersebut berlokasi pada kromosom 9p21, yang berhubungan erat dengan regulasi siklus sel dalam jalur Retinoblastoma (Rb). Gen p16 yang mengalami inaktivasi karena adanya proses delesi, mutasi titik ataupun metilasi, memiliki peran pada proliferasi serta proses penuaan sel.14 Akibat gangguan pada proses genetik tersebut menyebabkan terjadinya penurunan ekspresi p16 yang terlihat pada sebagian besar melanoma kelompok familial.15-17
Aktivitas proliferasi pada berbagai neoplasma ganas berhubungan dengan perkembangan metastasis dan berhubungan dengan ketahanan hidup (survival) pasien. Berbagai cara dapat dilakukan untuk menilai progresivitas tersebut, salah satunya adalah dengan penilaian ekspresi Ki-67 dengan metode pulasan imunohistokimia. Antigen Ki-67 merupakan protein non-histone, yang terdeteksi pada akhir fase G1 / S / G2 dan M dalam siklus sel. Pada berbagai literatur menyebutkan Ki-67 merupakan marker prognostik yang berguna pada melanoma, karena berhubungan dengan risiko terjadinya metastasis serta penurunan ketahanan hidup.18-19
1.2 IDENTIFIKASI MASALAH
1. Bagaimanakan ekspresi p16 dan Ki67 pada beberapa faktor prognostik histopatologik pada melanoma malignum jenis noduler ?
1.3 TUJUAN PENELITIAN 1.3.1 Tujuan umum
Mengetahui hubungan antara ekspresi p16 dan ekspresi Ki67 pada beberapa faktor prognostik histopatologik melanoma malignum jenis nodular.
1.3.2 Tujuan khusus
Mengetahui hubungan antara ekspresi p16 dengan beberapa faktor prognostik histopatologik yaitu: ulserasi, aktivitas mitosis, dan keterlibatan kelenjar getah bening pada melanoma malignum kulit jenis nodular.
Universitas Indonesia
Mengetahui hubungan antara ekspresi Ki67 dengan beberapa faktor prognostik histopatologik yaitu: ulserasi, aktivitas mitosis, dan keterlibatan kelenjar getah bening pada melanoma malignum kulit jenis nodular.
1.4 RUMUSAN HIPOTESIS
1. Terdapat hubungan yang bermakna antara ekspresi p16 dengan beberapa faktor prognostik histopatologik yaitu: ulserasi, aktivitas mitosis, dan keterlibatan kelenjar getah bening pada melanoma malignum jenis nodular.
2. Terdapat hubungan yang bermakna antara ekspresi Ki67 dengan beberapa faktor prognostik histopatologik yaitu: ulserasi, aktivitas mitosis, dan keterlibatan kelenjar getah bening pada melanoma malignum jenis nodular.
1.5 MANFAAT PENELITIAN
Mengetahui perubahan molekular pada tahapan protein, yang mendasari tumorigenesis melanoma malignum.
Penilaian ekspresi p16 dan Ki67 sebagai marker prediktif prognostik pada kasus melanoma malignum jenis nodular berdasarkan beberapa faktor prognostik histopatologik.
Universitas Indonesia BAB II
TINJAUAN PUSTAKA
2.1. Embriologi dan anatomi
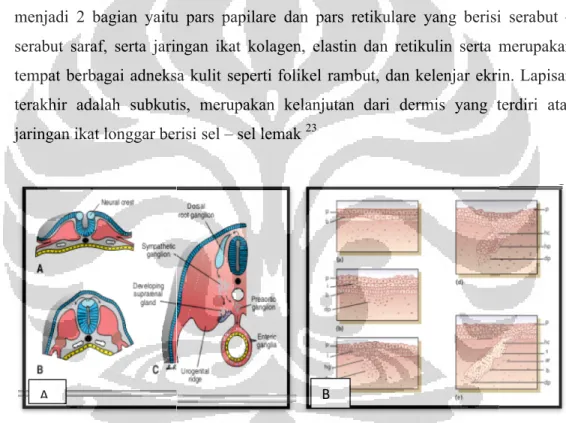
Melanosit adalah sel penghasil pigmen melanin, merupakan perkembangan bagian dorsal neural tube, yang seluruhnya berasal dari sel neural crest pluripoten. Perkembangan melanosit melalui beberapa tahapan berdasarkan populasi dan lokasi yaitu pada sistim integumen, telinga bagian dalam serta mata. Tahapan awal dimulai dari perubahan sel neural crest yang mengalami proses perpindahan dari neuroepitelium atau disebut sebagai progenitor sel melanosit atau melanoblas (gambar 2.1A)20 Sel progenitor tersebut akan berkembang dan melakukan migrasi sepanjang dorsal lateral di bawah ektoderm, dan mengalami diferensiasi, proliferasi serta migrasi ke seluruh bagian tubuh sampai pada lokasinya yaitu pada folikel rambut, kulit serta cochlea di telinga bagian dalam, koroid, badan siliar dan iris. 19-21
Perkembangan organ kulit merupakan kompleks jaringan berasal dari perkembangan lapisan ektoderm dan mesoderm, yang dimulai pada minggu ke – 6 massa gestasional. Dimulai dengan pembentukan lapisan ektodermal termasuk lapisan basal dan lapisan yang lebih superfisial lagi yaitu periderm. Periderm merupakan lapisan embrional yang bersifat sementara pada sekitar akhir trimester 2. Sekitar minggu ke–8 sampai akhir trimester ke-2, dimulailah perkembangan epidermis yang diawali oleh proses stratifikasi lapisan epidermis sampai tahap maturasi sehingga terbentuk lapisan yang tebal.20
Organ kulit secara anatomi, tersusun atas 3 lapisan utama yaitu lapisan epidermis, dermis, serta subkutis. Lapisan epidermis terdiri atas starum korneum yang merupakan lapisan paling luar kulit tersusun oleh beberapa lapis sel gepeng yang telah mati dan berubah menjadi zat tanduk (keratin), stratum lusidum terdiri atas sel – sel gepeng tanpa inti, stratum granulosum (lapisan keratohialin) merupakan 2 – 3 lapis sel – sel gepeng dengan sitoplasma berbutir kasar serta terdapat inti diantaranya, stratum spinosum (stratum malpighi) merupakan lapisan
terbanyak pada epidermis, yang disusun oleh sel yang berbentuk poligonal dengan jembatan antar sel diantara sel
Langerhans yang memiliki fungsi imunologi diantaranya Lapisan terakhir pada epidermis adalah stratum basale tersusun atas sel
perbatasan antara epidermis dan dermis. Pada stratum basale ini ditemukan pula sel – sel melanosit penghasil pigmen melanin. Pigmen yang terbentuk akan ditrasfer kepada sel keratinosit disekitarnya. Hubungan antara satu sel melanosit penghasil pigmen melanin dengan sekitar lebih kurang 36 sel keratinosit di sekitarnya disebut sebagai epiderma
menjadi 2 bagian yaitu pars papilare dan pars retikula
serabut saraf, serta jaringan ikat kolagen, elastin dan retikulin serta merupakan tempat berbagai adneksa kulit seperti folikel rambut, dan kelenjar ekrin. Lapisan terakhir adalah subkutis, merupakan kelanjutan dari dermis yang terd
jaringan ikat longgar berisi sel
Gambar 2.1 Embriologi (A) Formasi dan migrasi neural crest (B) pada embrio umur 4 minggu. Periderm sudah terbentuk (p), terlihat pada beberapa tempat (b). Potongan
kuboidal serta pembentukan stratum intermedium
2.2. Sintesis melanin
Melanin merupakan produk akhir tahapan transformasi kompleks tirosinase.Kandungan serta jenis melanin menentukan warna kulit seseorang. Pada keadaan fisiologik sintesa melanin pada sel melanosit melibatkan melanosom dan reaksi enzimatik. Secara umum strukt
A
terbanyak pada epidermis, yang disusun oleh sel yang berbentuk poligonal dengan jembatan antar sel diantara sel – sel tersebut, serta tempat ditemukannya sel Langerhans yang memiliki fungsi imunologi diantaranya Lapisan terakhir pada epidermis adalah stratum basale tersusun atas sel – sel kolumnar yang merupakan perbatasan antara epidermis dan dermis. Pada stratum basale ini ditemukan pula melanosit penghasil pigmen melanin. Pigmen yang terbentuk akan ditrasfer kepada sel keratinosit disekitarnya. Hubungan antara satu sel melanosit penghasil pigmen melanin dengan sekitar lebih kurang 36 sel keratinosit di sekitarnya disebut sebagai epidermal melanin unit. Lapisan dermis terbagi menjadi 2 bagian yaitu pars papilare dan pars retikulare yang berisi serabut serabut saraf, serta jaringan ikat kolagen, elastin dan retikulin serta merupakan tempat berbagai adneksa kulit seperti folikel rambut, dan kelenjar ekrin. Lapisan terakhir adalah subkutis, merupakan kelanjutan dari dermis yang terd
jaringan ikat longgar berisi sel – sel lemak 23
(A) Formasi dan migrasi neural crest (B) Pembentukan epidermis, (a) Potongan kulit Periderm sudah terbentuk (p), dan lapisan basal (b) atau lapisan germinative terlihat pada beberapa tempat (b). Potongan kulit usia 11 minggu, terdiri atas sel basal yang berbentuk
stratum intermedium mulai terlihat, sel – sel mesenkimal mulai teragregasi.
Melanin merupakan produk akhir tahapan transformasi kompleks tirosinase.Kandungan serta jenis melanin menentukan warna kulit seseorang. Pada keadaan fisiologik sintesa melanin pada sel melanosit melibatkan melanosom dan reaksi enzimatik. Secara umum struktur melanosom berhubungan dengan tipe /
B
terbanyak pada epidermis, yang disusun oleh sel yang berbentuk poligonal dengan ukannya sel Langerhans yang memiliki fungsi imunologi diantaranya Lapisan terakhir pada sel kolumnar yang merupakan perbatasan antara epidermis dan dermis. Pada stratum basale ini ditemukan pula melanosit penghasil pigmen melanin. Pigmen yang terbentuk akan ditrasfer kepada sel keratinosit disekitarnya. Hubungan antara satu sel melanosit penghasil pigmen melanin dengan sekitar lebih kurang 36 sel keratinosit di l melanin unit. Lapisan dermis terbagi e yang berisi serabut – serabut saraf, serta jaringan ikat kolagen, elastin dan retikulin serta merupakan tempat berbagai adneksa kulit seperti folikel rambut, dan kelenjar ekrin. Lapisan terakhir adalah subkutis, merupakan kelanjutan dari dermis yang terdiri atas
(a) Potongan kulit atau lapisan germinative kulit usia 11 minggu, terdiri atas sel basal yang berbentuk
sel mesenkimal mulai teragregasi.
Melanin merupakan produk akhir tahapan transformasi kompleks tirosinase.Kandungan serta jenis melanin menentukan warna kulit seseorang. Pada keadaan fisiologik sintesa melanin pada sel melanosit melibatkan melanosom dan ur melanosom berhubungan dengan tipe /
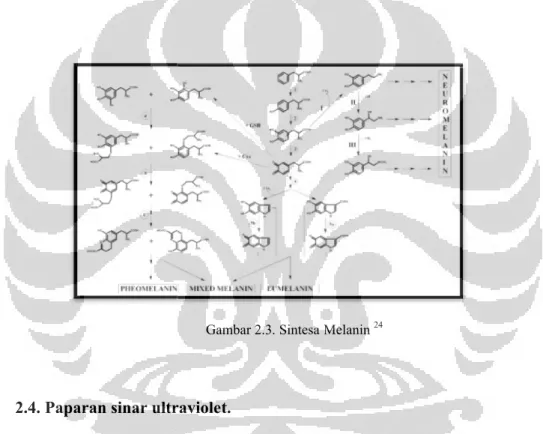
jenis melanin yang diproduksi. Terdapat 4 jenis melanin yang diproduksi yaitu:
eumelanin merupakan melanin penghasil warna hitam penghasil warna kuning
hanya ada pada persarafan, serta melanin tipe campuran terdiri atas
pheomelanin.24-26
Pembentukan melanosom meliputi 4 tahapan yang diawali oleh tahap pengorganisasian matriks. Tahap kedua pembentukan melanosom, matriks telah terorganisasi tetapi tanpa formasi melanin (pada eumelanosom), tetapi khusus untuk pheomelanosom, pada tahapan ini telah ditemukan formasi melanin. Tahap ketiga terjadi deposisi melanin, dan tahap terakhir melanosom telah dipenuhi oleh melanin. Secara kimia, beberapa tahapan yang terjadi dimulai dengan hidroksilasi phenilalanin menjadi tirosin, sampai dengan oksidasi DOPA menjadi dopaquinon serta tahap lanjutan terbentuknya melanin.(gambar 2.3) Produk melanin berhubungan dengan proses pembentukan melanosom
endoplasmik. Interaksi antara retikulum endoplasmik kasar dengan vesikel saluran dari badan golgi, membentuk premelanosom, yang merupakan tahapan awal maturasi melanosom yang terbentuk dari penonjolan membran retikulum endoplasmik halus, berlanjut pada jalur pembentukan eumelanin.
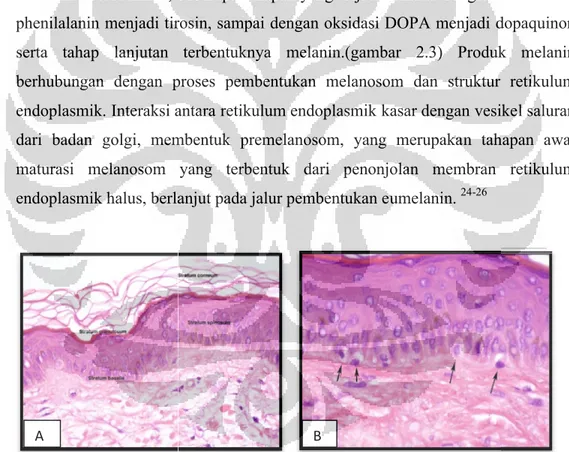
Gambar 2.2 Histologik Kulit
disertai sel keratinosit dengan pigmen melanin, serta sel melanosit bervakuol.
A
jenis melanin yang diproduksi. Terdapat 4 jenis melanin yang diproduksi yaitu: merupakan melanin penghasil warna hitam – kecoklatan, pheomelanin
penghasil warna kuning – kemerahan; neuromelanin, penghasil warna hitam dan hanya ada pada persarafan, serta melanin tipe campuran terdiri atas eumelanin
Pembentukan melanosom meliputi 4 tahapan yang diawali oleh tahap pengorganisasian matriks. Tahap kedua pembentukan melanosom, matriks telah terorganisasi tetapi tanpa formasi melanin (pada eumelanosom), tetapi khusus untuk pheomelanosom, pada tahapan ini telah ditemukan formasi melanin. Tahap ketiga terjadi deposisi melanin, dan tahap terakhir melanosom telah dipenuhi oleh ia, beberapa tahapan yang terjadi dimulai dengan hidroksilasi phenilalanin menjadi tirosin, sampai dengan oksidasi DOPA menjadi dopaquinon serta tahap lanjutan terbentuknya melanin.(gambar 2.3) Produk melanin berhubungan dengan proses pembentukan melanosom dan struktur retikulum endoplasmik. Interaksi antara retikulum endoplasmik kasar dengan vesikel saluran dari badan golgi, membentuk premelanosom, yang merupakan tahapan awal maturasi melanosom yang terbentuk dari penonjolan membran retikulum
alus, berlanjut pada jalur pembentukan eumelanin. 24-26
Histologik Kulit (a) skematik epidermis serta lapisan penyusunnya (b) disertai sel keratinosit dengan pigmen melanin, serta sel melanosit bervakuol.
B
jenis melanin yang diproduksi. Terdapat 4 jenis melanin yang diproduksi yaitu:
pheomelanin
warna hitam dan
eumelanindan Pembentukan melanosom meliputi 4 tahapan yang diawali oleh tahap pengorganisasian matriks. Tahap kedua pembentukan melanosom, matriks telah terorganisasi tetapi tanpa formasi melanin (pada eumelanosom), tetapi khusus untuk pheomelanosom, pada tahapan ini telah ditemukan formasi melanin. Tahap ketiga terjadi deposisi melanin, dan tahap terakhir melanosom telah dipenuhi oleh ia, beberapa tahapan yang terjadi dimulai dengan hidroksilasi phenilalanin menjadi tirosin, sampai dengan oksidasi DOPA menjadi dopaquinon serta tahap lanjutan terbentuknya melanin.(gambar 2.3) Produk melanin dan struktur retikulum endoplasmik. Interaksi antara retikulum endoplasmik kasar dengan vesikel saluran dari badan golgi, membentuk premelanosom, yang merupakan tahapan awal maturasi melanosom yang terbentuk dari penonjolan membran retikulum
(b) lapisan basal
2.3. Etiologi dan tumorigenesis melanoma
Peningkatan angka kejadian dan kematian karena melanoma di dunia masih menjadi perdebatan para ahli. Mereka memikirkan faktor lingkungan dan familial (genetik) seseorang berhubungan dengan etiologi melanoma. Faktor lingkungan utama yang diduga sebagai penyebab terjadinya melanoma adalah paparan sinar matahari. Lebih dari 65% kejadian melanoma berhubungan dengan sinar matahari. Faktor genetik sebagai etiologi berhubungan dengan adanya nevus jinak, atipical nevus, hingga r
2.4. Paparan sinar ultraviolet.
Salah satu etiologi melanoma malign radiasi terutama radiasi ultraviolet (UV) cahaya artifisial seperti
ataupun kosmetik (tanning
dengan frekuensi yang terus menerus merupakan faktor risiko utama pada melanoma, terutama yang berhubungan dengan faktor endogen lainnya seperti jenis kulit, status imunologi sampai predisposisi genetik.
Etiologi dan tumorigenesis melanoma
Peningkatan angka kejadian dan kematian karena melanoma di dunia masih menjadi perdebatan para ahli. Mereka memikirkan faktor lingkungan dan familial (genetik) seseorang berhubungan dengan etiologi melanoma. Faktor kungan utama yang diduga sebagai penyebab terjadinya melanoma adalah paparan sinar matahari. Lebih dari 65% kejadian melanoma berhubungan dengan sinar matahari. Faktor genetik sebagai etiologi berhubungan dengan adanya nevus jinak, atipical nevus, hingga riwayat keganasan pada keluarga.5,27
Gambar 2.3. Sintesa Melanin24
Paparan sinar ultraviolet.
Salah satu etiologi melanoma malignum pada organ kulit adalah solar radiasi terutama radiasi ultraviolet (UV). Sinar UV yang berasal dari sumber artifisial seperti berbagai lampu yang digunakan untuk keperluan medis
tanning) juga menjadi salah satu etiologi. Pajanan sinar dengan frekuensi yang terus menerus merupakan faktor risiko utama pada melanoma, terutama yang berhubungan dengan faktor endogen lainnya seperti jenis kulit, status imunologi sampai predisposisi genetik. 18,25,28-9
Peningkatan angka kejadian dan kematian karena melanoma di dunia masih menjadi perdebatan para ahli. Mereka memikirkan faktor lingkungan dan familial (genetik) seseorang berhubungan dengan etiologi melanoma. Faktor kungan utama yang diduga sebagai penyebab terjadinya melanoma adalah paparan sinar matahari. Lebih dari 65% kejadian melanoma berhubungan dengan sinar matahari. Faktor genetik sebagai etiologi berhubungan dengan adanya nevus
organ kulit adalah solar yang berasal dari sumber berbagai lampu yang digunakan untuk keperluan medis Pajanan sinar UV dengan frekuensi yang terus menerus merupakan faktor risiko utama pada melanoma, terutama yang berhubungan dengan faktor endogen lainnya seperti
Universitas Indonesia Sinar ultraviolet sendiri merupakan bagian dari sinar elekromagnetik dengan panjang gelombang yang paling pendek yaitu 100-400nM, serta memiliki quantum energi yang tertinggi. Sinar UV dapat menimbulkan efek biologik pada manusia antara lain menyebabkan terjadinya kerusakan sel, kerusakan DNA, sintesa vitamin D, melanogenesis, serta reaksi fotokimia pada retina. Berdasarkan efek biologi yang ditimbulkan, sinar UV dibagi menjadi UVA dengan panjang gelombang antara 400 – 320nM, UVB antara 320 – 280 nM, dan UVC antara 280 – 100 nM.25,30,31
Sinar matahari yang sampai di permukaan bumi mengandung 6.3% UVA dan 1.5% UVB. Pada saat sinar UV menyentuh kulit, sebagian besar sinar UVA akan direfleksikan dan hanya sebagian kecil yang akan dipenetrasikan ke lapisan kulit yang lebih dalam, sampai ke lapisan subkutaneus. Peningkatan penetrasi sinar UV yang masuk ke dalam lapisan kulit sejalan dengan peningkatan panjang gelombang UV. Kedalaman penetrasi sinar UV sangat tergantung dari jumlah pigmen kulit, sedangkan peningkatan absorbsi sinar UV tergantung dari asam urokanik yang berasal dari proses keratinisasi pada sel keratinosit di daerah kulit superfisial atau stratum korneum. Pada saat sinar UV bersentuhan dengan kulit, kulit akan mengaktifkan jalur proteksi terhadap sinar UV tersebut, melalui mekanisme penebalan stratum korneum serta sintesis melanin oleh melanosit.25,28 2.5. Faktor Genetik
Adanya anggota keluarga yang memiliki riwayat penyakit melanoma, merupakan faktor risiko yang signifikan untuk terjadinya keganasan. Memiliki satu orang anggota keluarga dengan riwayat melanoma, dapat meningkatkan risiko terjadinya melanoma sampai dua kali lipat. Dua sampai 3 orang anggota keluarga dengan riwayat melanoma kemungkinan meningkatnya kejadian melanoma hingga 35 – 70 kali. Salah satu parameter yang menunjukkan kemungkinan terjadinya suatu melanoma akibat faktor genetik adalah onset di usia muda serta tumor primer yang lebih dari 1 lokasi (multiple)18, 32
Faktor mutasi gen merupakan etiologi pada kasus – kasus melanoma dengan risiko tinggi serta riwayat keluarga dengan melanoma. Gen CDKN2A
Universitas Indonesia merupakan gen yang banyak berperan pada melanoma dengan riwayat keluarga. Gen CDKN2A dan cyclin – dependent kinase 4 (CDK4) merupakan gen yang mengontrol siklus sel dan pembelahan sel. CDKN2A merupakan tumor supresor gen sedangkan CDK4 adalah onkogen. CDKN2A mengkode 2 protein yaitu p16 (yang dikenal sebagai INK4a kinase inhibitor) dan p14ARF. 13,18,32
2.6. Peranan siklus sel dan proliferasi sel
Siklus sel merupakan suatu proses kompleks berhubungan dengan pertumbuhan dan proliferasi sel, pembentukan organisme, pengaturan perbaikan kerusakan DNA, hiperplasia jaringan sebagai respons suatu jejas serta penyakit termasuk keganasan. Pada siklus sel, peran berbagai protein dalam pengaturan proses siklus tersebut sangat tinggi. Hasil akhir suatu siklus sel adalah proses mitosis serta dua turunan sel (daughter cells). Protein yang sangat berperan dalam menjalankan siklus ini adalah cyclin-dependent kinase (cdk).33
Pengaturan protein tersebut secara morfologi dibagi menjadi 2 fase yaitu Interfase meliputi fase G1 – S – G2, serta fase mitosis, terdiri atas fase profase, metafase, anafase, dan telofase. Fase G1 dan G2, merupakan ‘Gap’ pada siklus sel yang ada antara proses DNA sintesis dan mitosis. Pada fase G1, sel mempersiapkan diri untuk proses sintesa DNA. Fase S merupakan fase sintesis DNA. Pada saat fase S berlangsung DNA mengandung 2N dan 4N yang disebut aneuploidi. Fase G2 merupakan ‘gap’ kedua, yaitu saat sel menyiapkan diri untuk proses selanjutnya yaitu mitosis. Fase G0, tidak secara aktif ikut dalam siklus sel. 18,33,34
2.7. P16INK4A
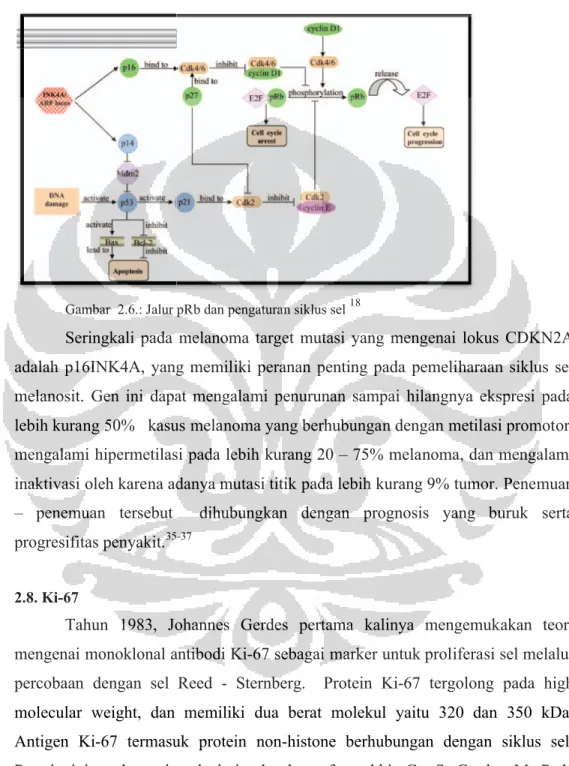
Berlokasi pada kromosom 9p21, gen ini mengkode 156 protein asam amino, dan merupakan keluarga INK4 yang berfungsi sebagai penghambat CDK4. Memiliki fungsi untuk melakukan pengontrolan fase G1 / S pada siklus sel dengan berikatan pada CDK4/6, melakukan penghambatan formasi cdk4/6 dengan kompleks enzim cyclin D, yang dibutuhkan untuk proses fosforilasi pRb dengan faktor transkripsi E2F. Pada keadaan hipofosforilasi, ikatan pRb dengan E2F
menyebabkan fungsi sebagai faktor transkripsi E2F tertekan menyebabkan G1 keluar dari siklus sel serta ekspresi p16 terlihat pada siklus sel yang terhenti. Gambar 2.4) 18,19,35
Gambar 2.6.: Jalur pRb dan
Seringkali pada melanoma target mutasi yang mengenai lokus CDKN2A adalah p16INK4A, yang memiliki peranan penting pada pemeliharaan siklus sel melanosit. Gen ini dapat mengalami penurunan sampai hilangnya ekspresi pada lebih kurang 50% kasus melanoma yang berhubungan dengan metilasi promotor, mengalami hipermetilasi pada lebih kurang 20
inaktivasi oleh karena adanya mutasi titik pada lebih kurang 9% tumor. Penemuan – penemuan tersebut dihubungkan deng
progresifitas penyakit.35
2.8. Ki-67
Tahun 1983, Johannes Gerdes pertama kalinya mengemukakan teori mengenai monoklonal antibodi Ki
percobaan dengan sel Reed molecular weight, dan
Antigen Ki-67 termasuk protein non Protein ini terekspresi
berbagai jenis tumor, termasuk melanoma, peran Ki menentukan proliferasi sel serta berhubungan dengan r dan penurunan ketahanan hidup (survival)
menyebabkan fungsi sebagai faktor transkripsi E2F tertekan menyebabkan G1 keluar dari siklus sel serta ekspresi p16 terlihat pada siklus sel yang terhenti.
alur pRb dan pengaturan siklus sel18
Seringkali pada melanoma target mutasi yang mengenai lokus CDKN2A adalah p16INK4A, yang memiliki peranan penting pada pemeliharaan siklus sel melanosit. Gen ini dapat mengalami penurunan sampai hilangnya ekspresi pada 50% kasus melanoma yang berhubungan dengan metilasi promotor, mengalami hipermetilasi pada lebih kurang 20 – 75% melanoma, dan mengalami inaktivasi oleh karena adanya mutasi titik pada lebih kurang 9% tumor. Penemuan penemuan tersebut dihubungkan dengan prognosis yang buruk serta
5-37
, Johannes Gerdes pertama kalinya mengemukakan teori monoklonal antibodi Ki-67 sebagai marker untuk proliferasi sel
percobaan dengan sel Reed - Sternberg. Protein Ki-67 tergolong pada high molecular weight, dan memiliki dua berat molekul yaitu 320 dan 350 kDa.
67 termasuk protein non-histone berhubungan dengan siklus sel pada inti sel selama fase akhir G1, S, G2 dan M , termasuk melanoma, peran Ki-67 sangat berguna untuk menentukan proliferasi sel serta berhubungan dengan risiko terjadinya metastasis dan penurunan ketahanan hidup (survival). 15-6, 33, 38-9
menyebabkan fungsi sebagai faktor transkripsi E2F tertekan menyebabkan G1 keluar dari siklus sel serta ekspresi p16 terlihat pada siklus sel yang terhenti.(
Seringkali pada melanoma target mutasi yang mengenai lokus CDKN2A adalah p16INK4A, yang memiliki peranan penting pada pemeliharaan siklus sel melanosit. Gen ini dapat mengalami penurunan sampai hilangnya ekspresi pada 50% kasus melanoma yang berhubungan dengan metilasi promotor, 75% melanoma, dan mengalami inaktivasi oleh karena adanya mutasi titik pada lebih kurang 9% tumor. Penemuan an prognosis yang buruk serta
, Johannes Gerdes pertama kalinya mengemukakan teori sebagai marker untuk proliferasi sel melalui tergolong pada high 320 dan 350 kDa. erhubungan dengan siklus sel.
dan M. Pada 67 sangat berguna untuk isiko terjadinya metastasis
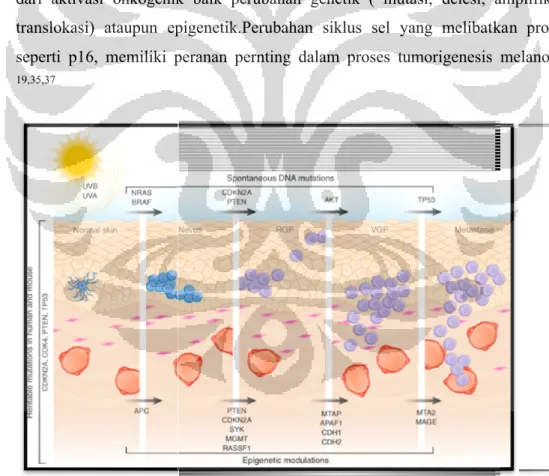
2.9. Tumorigenesis melanoma
Proses tumorigenesis pada melanoma dimulai dengan perubahan sel melanosit menjadi sel melanoma, akibat perubahan yang terjadi pada siklus sel. Progresifitas sel melanosit menjadi sel ganas melanoma dipicu oleh berbagai faktor predisposisi. Secara histopato
dan masih berada di dalam epidermis (
dermis dan papilary dermis superfisial tanpa pembentukan nodul ekspansif ( mikroinvasif melanoma)
pertumbuhan radial, dan pola pertumbuhan vertikal
Perubahan melanosit dipicu oleh rangkaian akumulasi perubahan genetik dan molekular serta faktor lingkungan
dari aktivasi onkogenik baik perubahan genetik ( mutasi, delesi, amplifikasi translokasi) ataupun epigenetik.
seperti p16, memiliki peranan pernting dalam proses tumorigenesis melanoma. 19,35,37
melanoma
Proses tumorigenesis pada melanoma dimulai dengan perubahan sel melanosit menjadi sel melanoma, akibat perubahan yang terjadi pada siklus sel. Progresifitas sel melanosit menjadi sel ganas melanoma dipicu oleh berbagai faktor predisposisi. Secara histopatologik, sel melanosit ganas yang berproliferasi berada di dalam epidermis ( melanoma in – situ), ataupun sampai dermis dan papilary dermis superfisial tanpa pembentukan nodul ekspansif
roinvasif melanoma). Proliferasi lebih lanjut akan membentuk pertumbuhan radial, dan pola pertumbuhan vertikal. (gambar 2.5). 40
Perubahan melanosit dipicu oleh rangkaian akumulasi perubahan genetik serta faktor lingkungan. Proses ini merupakan perubahan sekunder enik baik perubahan genetik ( mutasi, delesi, amplifikasi
epigenetik.Perubahan siklus sel yang melibatkan protein seperti p16, memiliki peranan pernting dalam proses tumorigenesis melanoma.
Gambar 2.5. Tumorigenesis Melanoma
Proses tumorigenesis pada melanoma dimulai dengan perubahan sel melanosit menjadi sel melanoma, akibat perubahan yang terjadi pada siklus sel. Progresifitas sel melanosit menjadi sel ganas melanoma dipicu oleh berbagai berproliferasi ataupun sampai dermis dan papilary dermis superfisial tanpa pembentukan nodul ekspansif
membentuk pola
Perubahan melanosit dipicu oleh rangkaian akumulasi perubahan genetik Proses ini merupakan perubahan sekunder enik baik perubahan genetik ( mutasi, delesi, amplifikasi,
Perubahan siklus sel yang melibatkan protein seperti p16, memiliki peranan pernting dalam proses tumorigenesis melanoma.
Universitas Indonesia 2.10. Gambaran histopatologik melanoma malignum
Sejarah pengklasifikasian melanoma maligna dimulai oleh Wallace Clark dan rekannya yang membagi melanoma menjadi 3 tipe, yaitu : “superficial spreading melanoma”, “lentigo maligna melanoma” serta “nodular melanoma”. Richard Reed, MD, menambahkan pengklasifikasian sebelumnya dengan tipe “acral lentigenous melanoma”.5,27 Sampai saat ini klasifikasi tersebut masih dipergunakan. Secara klinis dan histomorfologi perkembangan tumor yang terlihat dibagi menjadi:8
Melanoma malignum yang terbatas pada epidermis (melanoma in-situ), dikelompokkan ke dalam pola pertumbuhan radial.
Melanoma dengan pola pertumbuhan radial yang sudah mengalami mikroinvasi, terlihat dengan adanya beberapa sel ganas di papila dermis superfisial.
Melanoma dengan pola pertumbuhan vertikal yaitu melanoma yang sudah memasuki fase tumorigenik atau mitogenik.
Berdasarkan pola pertumbuhan tersebut maka yang termasuk pola pertumbuhan radial termasuk di dalamnya adalah tipe” superficial spreading melanoma”, “acral lentigenous melanoma”, serta “lentigo maligna melanoma”. “Nodular melanoma” digolongkan pada pola pertumbuhan vertikal.
2.10.1 “Superficial spreading melanoma”
Berdasarkan beberapa kepustakaan, jenis ini adalah yang tersering ditemukan lebih kurang 75% dari seluruh melanoma dan bersifat de novo. Gambaran histopatologik dari jenis ini adanya perubahan arsitektur dengan batas yang tidak jelas. Proliferasi melanosit berbentuk epiteloid pada lapisan epidermis dengan pola pertumbuhan pagetoid. Penyebaran sel – sel melanoma didominasi oleh penyebaran individual dibandingkan dalam kelompok – kelompok (sarang – sarang) yang tersebar di bagian atas membran basalis dan hanya menyebar sampai lapisan stratum granulosum, jarang yang mencapai lapisan stratum korneum. Sel – sel melanoma berukuran besar dengan inti yang lebih besar dibandingkan inti melanosit ataupun sel nevus. Membran inti ireguler, sitoplasma banyak dan mengandung granula melanin halus yang tersebar merata. Rasio inti : sitoplasma
Universitas Indonesia rendah. Sel – sel melanoma menunjukkan atipia inti yang relatif sama. Mitosis ditemukan pada epidermis. Pada saat lesi masih bersifat in-situ tanpa mikroinvasif, maka membran basalis masih terlihat utuh. Apabila telah mengalami invasif tetapi non tumorigenik, terlihat sel – sel yang sama dengan epidermis dalam susunan sarang – sarang kecil, tanpa struktur sarang yang besar dan tidak ditemukan mitosis intradermal.5,8,27,41-42
2.10.2.“Nodular Melanoma”
Jenis ini termasuk dalam pola pertumbuhan vertikal. Jenis ini memiliki pertumbuhan tumor yang nodular, polipoid ataupun pedunculated. Jenis ini sering mengenai usia dewasa pertengahan dengan tempat predileksi tersering di daerah punggung. Memiliki gambaran histopatologi dengan pola pertumbuhan vertikal tanpa gambaran in- situ ataupun mikroinvasif pada daerah – daerah yang berdekatan dengan sel tumor. Sel – sel melanoma tampak berkelompok pada lapisan dermis , berbatas tegas, dan melakukan penekanan pada jaringan sekitar, dengan atipia inti nyata.5,8,27,41-42
2.10.3. “Lentigo maligna melanoma”
Lokasi tersering jenis ini adalah pada daerah kepala dan leher. Gambaran histopatologiknya sering disertai dengan epidermis yang atrofi. Sel atipik berproliferasi sepanjang dermo-epidermal junction, sampai menyebar ke folikel rambut ataupun kelenjar sebasea. Inti sel besar, banyak mengandung pigmen melanin disertai anak inti nyata.5,8,27,41-42
2.10.4. “Acral Lentigenous Melanoma”
Jenis ini menunjukan penyebaran lentigenous di sepanjang membran basalis dan meluas hingga ke dalam kelenjar keringat. Beberapa sel dapat meluas sampai bagian atas epidermis yang hiperkeratotik dan menyebabkan ulserasi pada stratum korneum. Tidak ditemukan gangguan pada daerah rete ridges. Invasi dermis sering disertai dengan infiltrasi sel radang, fibrosis, dan proliferasi vaskuler yang merupakan tanda respon imunologi.5,8,27,41-42
Gambar 2.6. Tipe histologik Melanoma maligna (A). Superfisial Spreading Melanoma. (B). Nodular Melanoma (C).Lentigo Maligna Melanoma (D). Acral Lentigenous Melanoma27
2.11. FAKTOR PROGNOSTIK
Ketahanan hidup pasien setelah terapi sangat bergantung kepada stadium penyakit dan faktor patologik lainnya. Berbagai faktor baik yang berhubunga dengan pasien dan penyakitnya dihubungkan sebagai faktor prognostik. Faktor prognostik ini secara garis besarnya dibagi menjadi 2, yaitu secara klinik yang berhubungan dengan pasien antara lain, usia, jenis kelamin, lokasi, keterlibatan kelenjar getah bening, metastasis ke organ lain, serta kadar laktat dehidrogenase. Sedangkan faktor histologik yang berperan sebagai penentu prognostik adalah ketebalan tumor, ada tidaknya ulserasi, kedalaman invasi, vaskularisasi tumor, mikrosatelit, indeks mitosis, regresi, serta limfosit yang menginfiltrasi tumor.10 Hubungan dengan prognostik di jelaskan pada tabel 2.1.
Beberapa faktor prognostik histopatologik disebutkan sebagai faktor prognostik bebas atau independen dan memiliki kekuatan dalam memprediksi prognosis penderita melanoma. Faktor ketebalan tumor (Breslow’s) dan ulserasi tumor merupakan 2 faktor yang dianggap memiliki kekuatan tertinggi dan
A
C D
B
Universitas Indonesia independen dalam menentukan prognosis pasien. Faktor ulserasi dimasukan ke dalam AJCC – 2010, untuk menentukan stadium klinis melanoma kutis primer. Secara biologik terjadinya ulserasi masih belum jelas, kemungkinan merupakan progresifitas penyakit yang menyebabkan timbulnya ulserasi. Pada lesi primer dengan gambaran ulserasi memiliki aktivitas mitosis yang tinggi yang merupakan penanda prognosis buruk.10,13
Keterlibatan kelenjar getah bening juga memiliki hubungan dengan kesintasan pasien -5 tahun. Keterlibatan kelenjar getah bening dibedakan menjadi mikrometastasis yaitu ditemukannya tumor sekunder di daerah lain secara mikroskopik tanpa teraba secara klinis, dan makrometastasis, yang dapat ditemukan dengan pemeriksaan klinis, dan memiliki angka kesintasan yang berbeda antara keduanya. Melanoma dapat mengalami metastasis pada semua organ. Perilaku biologis melanoma juga berbeda tergantung lokasi metastasis. Metastasis jauh merupakan penanda progrosis paling buruk pada kesintasan penderita melanoma kutis. Penderita dengan metastasis di daerah kutis subkutis ataupun kelenjar getah bening jauh memiliki prognosis lebih baik dibandingkan dengan metastasis di daerah viseral.10,13
Aktivitas mitosis per mm2 merupakan salah satu faktor prediktor prognostik secara histopatologik, karena aktivitas mitosis yang tinggi menunjukkan waktu pembelahan sel meningkat, dan tumbuh serta invasi ke jaringan sekitar sampai jaringan limfatik dan pembuluh darah. Aktivitas mitosis pada penderita melanoma di usia muda merupakan prediktor positivitas keterlibatan kelenjar getah bening, sehingga peranan aktivitas mitosis sebagai faktor prognostik independen menjadi hal yang penting.10,13
Universitas Indonesia
Tabel 2.1 Berbagai faktor prognostik pada Melanoma Malignum10
Faktor Prognostik Lebih baik
Faktor Klinik :
Usia
Jenis kelaminn Lokasi
Jumlah KGB yang terlibat Metastasis jauh
Kadar Laktat dehidrogenase
< 65 tahun Perempuan Ekstremitas Tidak ada keterlibatan KGB
Tidak ada Metastasis jauh Normal Histologik : Ketebalan tumor Ulserasi Clark Level Tumor vaskularisasi Invasi vaskular Mikrosatelit Indeks mitosis Regresi ...Limfosit infiltratif < 1 mm Tidak ada Level I Tidak ada Tidak ada Tidak ada Rendah Tidak ada Ada
Perkiraan ketahanan hidup pasien di klasifikasikan berdasarkan staging system The American Joint Committee on Cancer (AJCC) tahun 201017, yaitu :
Tabel 2.2. Sistim staging untuk melanoma berdasarkan AJCC (2010)17
Staging Kriteria Angka Ketahanan hidup
5 tahun 10 tahun IA T1a : Tidak ada keterlibatan KGB atau metastasis
jauh < 1 mm ketebalan tumor dan tidak ada ulserasi, Jumlah mitosis < 1 mm2
97% 93%
IB T1b : Tidak ada keterlibatan KGB atau metastasis jauh.< 1 mm ketebalan tumor disertai ulserasi Jumlah mitosis > 1 mm2
T2a : Tidak ada keterlibatan KGB dan Metastasis jauh.Ketebalan tumor 1 – 2 mm dan tidak ada ulserasi
94%
91%
87%
83% IIA T2b : Tidak ada keterlibatan KGB dan Metastasis
jauh.Ketebalan tumor 1 – 2 mm disertai ulserasi T3a : Tidak ada keterlibatan KGB dan Metastasis jauh.Ketebalan tumor 2-4 mm tanpa ulserasi
82% 79%
67% 66% IIB T3b : Tidak ada keterlibatan KGB dan Metastasis 68% 55%
Universitas Indonesia
Staging Kriteria Angka Ketahanan hidup
5 tahun 10 tahun jauh.Ketebalan tumor 2-4 mm disertai ulserasi.
T4a : Tidak ada keterlibatan KGB dan Metastasis jauh.Ketebalan tumor >4 mm tanpa ulserasi
71% 57%
IIC T4b : Tidak ada keterlibatan KGB dan Metastasis
jauh.Ketebalan tumor >4 mm disertai ulserasi 55% 39% IIIA N1a : Mikrometastasis sampai keterlibatan 1 KGB
regionalTanpa metastasis jauh
N2a : Mikrometastis, 2 – 3 KGB regional yang terlibatTanpa metastasis jauh
78% 68%
IIIB N1b : Mikrometastis, tidak ada KGB regional yng terlibat, tanpa metastasis jauh.
N2b : Mikrometastis, 2 – 3 KGB regional yang terlibat, tanpa metastasis jauh.
N2c : Satelitosis / pada fase transit metastasis tanpa metastasis KGB regional
54% 59%
38% 43%
IIIC N3 : 4 atau lebih metastasis KGB regional. Matted metastasis kgb regional atau satelitosis / in transit metastasis disertai metastasis kgb regional
40% 24%
Ketahanan Hidup Median IV
M1a : metastasis ke organ kulit, subkutaneus jaringan atau KGB jauh
M1b : Metasstasis ke paru
M1c : Metastasis ke visera dan lokasi lain.
18 bulan 12 bulan 6 bulan
Universitas Indonesia 2.12. KERANGKA TEORI SSM ALM LMM NM INK4a/ARF P16INK4a P14ARF CDK4/6 pRb pRb E2F pRb E2F P P G1 – S phase CDK4/6 Cyclin M S G1 G2 G0 PROLIFERASI Ki-67 Nevus melanositik & displastik Melanoma (RGP) Melanoma (VGP) AKTIVITAS MITOSIS ULSERASI METASTASIS KGB Normal Melanosit
Universitas Indonesia 2.13. KERANGKA KONSEP
MELANOMA MALIGNUM NODULAR
EKSPRESI p16 DAN EKSPRESI Ki-67 P16 dan Ki67 ULSERASI (+) / (-) AKTIVITAS MITOSIS TINGGI ATAU RENDAH METASTASIS KGB (+) / (-)
Universitas Indonesia BAB III
METODE PENELITIAN
3.1. Desain Penelitian
Desain penelitian ini merupakan studi analitik potong lintang yang diawali dengan pengumpulan slide Hematoksilin-Eosin (HE) dan blok parafin seluruh kasus melanoma malignum jenis nodular di bagian arsip Departemen Patologi Anatomik FKUI-RSCM. Apabila slide dengan pewarnaan HE tersebut sudah tidak layak baca, maka akan dilakukan pemotongan ulang blok dengan pewarnaan HE. Dilakukan pengumpulan data klinik antara lain usia, jenis kelamin, lokasi tumor, dan ada tidaknya metastasis ke kelenjar getah bening / organ lain sebagai bagian dari data prediktif prognostik. Kemudian akan dilakukan pembacaan pada seluruh slide, dan melakukan penilaian faktor prognostik histopatologik (mikro staging) yaitu penghitungan jumlah mitosis per 5 LPB, ada tidaknya ulserasi serta menilai ada tidaknya keterlibatan kelenjar getah bening. Seluruh sampel akan dinilai ekspresi protein p16 dan Ki-67 dengan menggunakan metode pulasan imunohistokimia. Positifitas ekspresi sel tumor akan terlihat pada inti sel serta pada sitoplasma untuk pulasan p16, serta positif pada inti untuk pulasan Ki-67 yang ditandai dengan adanya perubahan warna inti sel dan sitoplasma menjadi merah. Penilaian derajat positifitas akan dilakukan berdasarkan intensitas pewarnaan serta persentase inti dan sitoplasma yang positif mengekspresikan p16. Khusus untuk Ki-67 hanya dilakukan penilaian positivitas saja. Penilaian dilakukan oleh 2 observer menggunakan mikroskop yang sama dan dinilai pada 500 sel tumor.Apabila terdapat ketidaksesuaian akan dilakukan konsesus bersama. Seluruh data penelitian ini akan dianalisa secara statistik dan hasilnya akan ditampilkan dalam bentuk tabulasi dan grafik.
Universitas Indonesia 3.2 Waktu dan Tempat Penelitian :
Penelitian dilaksanakan di Departemen Patologi Anatomik FKUI-RSCM mulai bulan Februari sampai Agustus 2012
3.3 Populasi dan Sampel Penelitian :
Populasi penelitian adalah seluruh sediaan blok parafin kasus kulit yang didiagnosis sebagai melanoma malignum tipe nodular di Departemen Patologi Anatomik FKUI-RSCM mulai Januari 2000 sampai februari 2012 yang memenuhi kriteria penerimaan.
Penghitungan besar sampel :
N1= N2= ( Zα √2PQ + Zβ√P1Q1+ P2Q2)2 (P1-P2)2
N1=N2:Besar sampel penelitian masing – masing kelompok
α :Tingkat kemaknaan satu arah (α) sebesar 5% (1.645)
β : 0.842
P1 :Besarnya proporsi penderita melanoma maligna yang mengekspresi p16 berdasarkan literatur 77% 17 (0.77)
P2 :Besarnya proporsi penderita melanoma maligna yang tidak mengekspresikan p16 berdasarkan literatur 45% (0.45)
P : ½ (P1 + P2 )
Q : 1-P
Berdasarkan penghitungan tersebut, didapatkan N1 = N2 = 27,6725 (28) kasus. Total sampel yang diperlukan minimal : 2x28 = 56 kasus.
Setelah dilakukan pencarian blok parafin, ternyata hanya ditemukan 25 kasus yang sesuai dengan kriteria penerimaan dengan kualitas blok yang masih baik dan dapat digunakan untuk penelitian ini, oleh karena itu diputuskan digunakan total sampling.
Universitas Indonesia 3.4.Kriteria penerimaan dan penolakan :
3.4.1. Kriteria penerimaan :
Penderita melanoma malignum dengan cara pengambilan biopsi eksisi atau operasi.
Kasus MM dengan pola pertumbuhan vertikal pada organ kulit.
Blok parafin tersedia dan dalam kondisi baik 3.4.2. Kriteria penolakan :
Kasus review slide / blok yang dikirimkan ke Departemen PA-FKUI/RSCM
Blok parafin yang telah habis massa tumornya. 3.5.Alur kerja
3.6.Prosedur penelitian
Pemeriksaan histopatologik berdasarkan pewarnaan hematoksilin dan eosin dilakukan pada seluruh slide. Dilakukan penilaian ada tidaknya ulserasi, serta melakukan penilaian jumlah mitosis per 1 5LPB dan keterlibatan kelenjar getah bening dengan ditemukan gambaran mikro metastasis di kelenjar getah bening. Prosedur pulasan secara imunohistokimia dengan antibodi p16 dan Ki-67 dengan prosedur yang bertahap. Tahapan awal yang dilakukan adalah jaringan yang telah Pengumpulan slide Pembacaan ulang Analisa Statistik Tumor Sekunder Tumor Primer Jumlah mitosis / 5 LPB Ulserasi Metastasis Kasus nodular melanoma
Blok Parafin Pewarnaan IHK
Pembacaan hasil (p16 dan Ki67)
Universitas Indonesia dijadikan blok paraffin akan dipotong setebal 5 mikron dilanjutkan dengan dilakukan preparasi sediaan dengan metode pemanasan diatas slide warmer dengan suhu antara 56,5oC – 60oC. Tahapan berikutnya adalah deparafinisasi dengan menggunakan xylol sebanyak 3x masing –masing selama 5 menit, kemudian dilanjutkan dengan penggunaan alkohol yang konsentrasinya menurun bertahap dimulai dari alkohol absolut, konsentrasi 95%, 90%,sampai 70%, masing – masing selama lebih kurang 5 menit.
Setelah tahapan deparafinisasi selesai, dilakukan pencucian slide dengan air yang mengalir selama 5 menit, dan dilanjutkan dengan pencelupan dalam larutan endogen peroksidase 0,5 % selama 30 menit, setelah itu dilakukan pembilasan ulang dengan air mengalir selama lebih kurang 5 menit. Seluruh sediaan dilakukan blocking dengan hidrogen peroksidase 0,5% selama 45 menit. Sediaan kemudian akan direndam dalam target retrieval solutionTris-EDTA (pH 9) dalam microwave sebagai tahapan antigen retrieval. Dilakukan 2 tahapan pemanasan yaitu tahap I selama 5 menit dengan power level tinggi, dilanjutkan dengan tahap kedua dengan power level yang lebih rendah selama 5 menit, kemudian dilakukan pendinginan selama lebih kurang 30 menit. Setelah slide dingin dilakukan pencucian dengan Tris buffer saline (TBS) selama 3 menit, kemudian dilingkari dengan menggunakan pap pen.
Blocking background dari aktivitas non spesifik dengan menggunakan serum normal (normal horse serum / NHS) selama 30 menit. Dilanjutkan dengan tahapan inkubasi antibodi primer p16 menggunakan mouse monoclonal antibody p16
(Biogenex) pengenceran 1 : 1000 dan Rat anti mouse monoclonal antibody Ki-67
(Novocastra) pengenceran 1:100 dengan prosedur over night. Setelah proses inkubasi selesai, dicuci dengan TBS selama 3 menit. Tahapan berikutnya adalah inkubasi dengan antibodi sekunder dalam serum normal menggunakan universal link selama 15 menit, dicuci kembali dengan TBS selama 3 menit.. Dilakukan inkubasi dengan Trekavidin dalam serum normal selama 15 menit, setelah itu lakukan tahapan pencucian ulang dengan TBS 3 menit. Teteskan kromogen 3 Amino-9-ethyl carbazole (AEC) selama 25 menit, cuci dengan air mengalir, terakhir lakukan pencelupan ke dalam larutan Hematoksilin Lilie Mayer sebagai
Universitas Indonesia counterstain, selama 0,5 – 1 menit, kemudian dicuci dengan air mengalir selama 5 menit, dan dilanjutkan dengan perendaman dalam lithium carbonat selama 2 menit ditutup dengan menggunakan cairan penutup (aqueous mounting media) dan gelas penutup.
Interpretasi hasil pulasan imunohistokimia p16 dan Ki-67 dilakukan oleh 2 pengamat, dan apabila terdapat perbedaan, penilaian dilakukan berdasarkan konsensus bersama, berdasarkan Straume dkk dan Talve dkk serta Gimotty dkk 17,39,43yang dimodifikasi. Dilakukan penilaian ekspresi p16 berdasarkan intensitas pewarnaan dan proporsi positif pada pada 500 sel tumor. Positifitas akan terlihat pada inti dan sitoplasma untuk p16 dan, sehingga pada penelitian ini dibedakan antara penilaian positifitas pada keduanya. Nilai negatif apabila inti dan sitoplasma tidak terwarnai atau sesuai dengan kontrol negatif pada tiap sediaan. Penilaian intensitas pewarnaan yaitu (a) nilai 0 bila tidak ada pulasan. (b) nilai 1,bila pulasan lemah, (c) nilai 2,bila intensitas pulasan sedang, dan (d) nilai 3,bila intensitas pulasan kuat, yang dibandingkan dengan kontrol positif sediaan. Proporsi sel tumor yang terpulas positif yaitu, (a) nilai 0 bila tidak ada sel yang positif terpulas. (b) nilai 1, < 10 % sel tumor terpulas positif, (c) 2, 10 – 50% sel tumor terpulas positif, (d) 3, > 50% sel tumor terpulas positif. Selanjutnya dilakukan penghitungan index pewarnaan yang merupakan hasil perkalian intensitas pewarnaan dan proporsi positif sel tumor.17
Penilaian hasil pulasan Ki-67 untuk menilai indeks proliferasi pada 500 sel tumor. Dikatakan positif apabila inti terpulas merah dan negatif apabila inti berwarna biru sesuai dengan kontrol negatif. Nilai positif dicantumkan dalam persentase berdasarkan jumlah inti sel yang terwarnai positif per 500 sel tumor yang dinilai dengan menggunkanakan pembesaran 400x. Dengan menggunakan
cut off sebesar 20% maka (a) 1 apabila positifitas sel tumor < 20% dan (b) 2 apabila sel tumor terwarnai > 20% berdasarkan Pearl,dkk..
Pengolahan data
Data dikumpulkan dalam satu tabel induk untuk kemudian . dianalisis menggunakan aplikasi statistik. Analisis data diawali dengan uji normalitas
Universitas Indonesia Shapiro-Wilk dikarenakan besaran sampel yang kecil. Data berbagai faktor prognostik histopatologik merupakan data kategorik dihubungkan dengan ekspresi p16 dan ki67 yang merupakan skala ordinal / kategorikal dan dilakukan analisa statistik dengan menggunakan Uji Chi-square jika memenuhi syarat, atau uji Fisher’s exact Untuk skala kategorikal pada 2 kelompok yang berpasangan digunakan uji Mc. Nemar. Penyajian hasil analisis data dalam bentuk tekstular dan tabular.
3.8. Definisi Operasional :
3.8.1 Ekspresi p16 : Indeks pewarnaan imunohistokimia dengan menggunakan mouse monoclonal antibody p16 (Biogenex). Penghitungan skor indeks pewarnaan berdasarkan intensitas dan positivitas sel tumor per 500 sel. Intensitas pewarnaan menggunakan skor berdasarkan Straume, dkk : (0) untuk tidak ada pewarnaan (negatif), (1) untuk intensitas lemah,(2) intensitas sedang, dan (3) untuk intensitas kuat. Sedangkan positivitas sel tumor diberi skor : (0) bila tidak ada sel yang positif, (1) bila < 10% sel tumor positif, (2) bila 10-50% sel tumor positif, dan (3) bila > 50 % sel tumor positif Indeks pewarnaan .
3.8.2. Ekspresi Ki-67: Indeks pewarnaan imunohistokimia dengan menggunakan
Rat anti mouse monoclonal antibody Ki-67 ( Novocastra). Hasil pulasan dilakukan penilaian positivitas sel tumor yang terpulas positif pada 500 sel dengan
cutoff sebesar 20% berdasarkan Pearl, dkk :Positif bila > 20% dan negatif bila < 20%.
3.8.3. Aktivitas Mitosis : Melakukan penghitungan banyaknya mitosis menggunakan mikroskop Olympus CX-21 sebanyak 5 LPB.
3.8.4.Ulserasi: Tidak ditemukannya epidermis yang utuh di bagian atas massa tumor primer secara mikroskopik.
3.8.5. Metastasis : Keterlibatan kelenjar getah bening dengan ditemukannya massa tumor secara mikroskopik (mikro metastasis) ataupun teraba/ terdeteksi secara klinis (makrometastasis)
Universitas Indonesia 3.9.Kaji Etik
Penelitian ini telah mendapat surat keterangan lolos kaji etik Nomor: 06/PT 02.FK/ETIK/2012 Tanggal 09 Januari 2012.
Universitas Indonesia BAB IV
HASIL PENELITIAN
4.1. Demografi dan Karakteristik dasar
Berdasarkan hasil penelusuran arsip melanoma malignum selama kurun waktu 2000 – 2011 didapatkan 82 kasus. Tetapi hanya 25 kasus dengan blok parafin yang dapat dipergunakan dan memenuhi kriteria penerimaan. Terdapat 13 pasien (52%) berjenis kelamin laki-laki dan 12 pasien lainnya (48%) berjenis kelamin perempuan. Rentang usia pasien antara usia 24 sampai 89 tahun, dengan rerata usia 55 tahun. Sebanyak 56% atau 14 kasus berlokasi di daerah ekstremitas atas, 5 kasus di ekstremitas bawah, sedangkan sisanya sebanyak 6 kasus di lokasi lain di daerah kulit.
Tabel 4.1. Karakteristik Umum Pasien
VARIABEL FREKUENSI PERSENTASE
Jenis Kelamin Laki – laki 13 52
Perempuan 12 48 Usia 20-30 tahun 31-40 tahun 41-50 tahun 51-60 tahun 61-70 tahun 71-80 tahun 2 1 7 9 2 2 8 4 28 36 8 8 ≥ 80 tahun 2 8
Lokasi Ekstremitas atas Ekstremitas bawah Lainnya 14 5 6 56 20 24
Beberapa faktor prognostik histopatologik yang dianalisis secara statistik adalah ada tidaknya ulserasi pada tumor. Di dapatkan 16 kasus (64%) mengalami ulserasi, dan 9 kasus (36%) tidak didapatkan gambaran ulserasi. Penilaian aktivitas mitosis dilakukan berdasarkan perhitungan jumlah mitosis per mm2. Jumlah mitosis per mm2dikelompokkan menjadi 3 kategorik, Aktivitas mitosis rendah apabila mitosis < 5 per 5 LPB ditemukan pada 6 kasus (24%) dan aktivitas tinggi bila mitosis > 5 per 5 LPB ditemukan pada 19 kasus (76 %). Keterlibatan kelenjar getah bening atau metastasis kelenjar getah bening
Universitas Indonesia ditemukan pada 8 kasus (32%) dan 17 kasus (68 %) tidak mengalami metastasis kelenjar getah bening. Data karakteristik yang lengkap serta ringkasan data pulasan p16 dan ki67 dapat dilihat pada Tabel 4.1. dan tabel 4.2.
Tabel 4.2. Ekspresi p16 dan Ki67 pada berbagai faktor prognostik histopatologik
Variabel Ekspresi p16 Ekspresi ki67 positif Negatif Positif Negatif Ulserasi Positif 6(24%) 10(40%) 8(32%) 8(32%) Negatif 2(8%) 7(28%) 4(16%) 5(20%) Aktivitas mitosis Tinggi 6(24%) 13(52%) 11(44%) 8(32%) Rendah 2(8%) 4(16%) 2(4%) 4(16%) Metastasis KGB Positif 4(16%) 4(16%) 5(20%) 3(12%) Negatif 4(16%) 13(32%) 8(32%) 9(36%) 4.2. Ekspresi p16
Setelah dilakukan pewarnaan imunohistokimia pada seluruh kasus penelitian ini, didapatkan 2 jenis imunoreaktifitas yaitu terpulas positif pada daerah inti dan sitoplasma dengan berbagai variasi intensitas pewarnaan. Pewarnaan protein p16 pada umumnya homogen pada daerah tumor, tetapi pada beberapa kasus menunjukkan hasil pulasan yang heterogen dengan kelompokan sel tumor yang positif dan negatif berdekatan. Ekspresi positif di sitoplasma umumnya ditemukan pada kasus – kasus yang tidak mengekspresikan p16 pada inti, oleh karena itu penghitungan positivitas p16 dibedakan menjadi positif inti dan sitoplasma, seperti pada Tabel 4.2.1. Hanya pulasan pada inti yang dianggap sebagai hasil pulasan yang spesifik. Hasil penelitian ini sebanyak 17 kasus dari total 25 kasus atau sebesar 68%, menunjukkan ekspresi protein p16 inti negatif yang berasal dari penggabungan index pewarnaan 0 – 1. Ekspresi p16 inti positif merupakan penggabungan index pewarnaan 2 – 9 didapatkan pada 8 kasus (32%). Sebanyak 11 kasus (44%) menunjukkan penurunan ekspresi p16 di sitoplasma, dan peningkatan ekspresi p16 sitoplasma terdapat pada 14 kasus (56%)
Universitas Indonesia Tabel. 4.2.1. Ekspresi p16 pada tumor primer melanoma malignum nodular
Indeks Pewarnaana Ekspresi p16 inti sitoplasma 0 17 (68%) 10(40%) 1 - 1(4%) 2 4(16%) 3(12%) 3 1(4%) 4(16%) 4 - 1(4%) 6 3(12%) 4(4%) 9 - 2(8%) Total 25(100%) 25(100%)
a Indeks Pewarnaan = Intensitas X positivitas
Dilakukan pengujian statistik untuk membandingkan ekspresi p16 di inti pada beberapa faktor prognostik. Untuk kepentingan statistik, ekspresi p16 berdasarkan indeks pewarnaan dikelompokan menjadi 2 kelompok yaitu kelompok penurunan ekspresi / ekspresi rendah ( indeks pewarnaan 0-1) sebagai kelompok ekspresi p16 negatif, dan ekspresi p16 positif adalah penggabungan kelompok sedang (indeks 2-4) dan kelompok ekspresi tinggi ( 5-9). Hasil yang didapatkan sesuai tabel 4.2.2
Tabel 4.2.2. Perbedaan ekspresi p16 inti dengan ada tidaknya ulserasi di tumor primer melanoma malignum jenis nodular
Variabel NegatifEkspresi p16 intiPositif p
N(%) N(%)
Ulserasi (+) 10 (40%) 6(24%) 0.374 Ulserasi (-) 7 (28%) 2(8%)
Total 17(68%) 8(32%)
Uji fisher’s
Dilakukan uji asosiasi pada variabel kategorik ulserasi dan ekspresi p16 di inti. Karena tidak memenuhi syarat untuk uji Chi-Square, maka digunakan uji alternatifnya yaitu uji Fisher’s dengan hasil menunjukkan p= 0.374. Karena p >