KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN
UJI TOKSISITAS EKSTRAK KULIT UMBI BAWANG
MERAH ( Allii cepae var. ascalonicum ) DENGAN METODE
UJI BRINE SHRIMP (BST)
SKRIPSI
OLEH:
LELI MANULLANG
NIM 060804062FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN UJI TOKSISITAS EKSTRAK KULIT UMBI BAWANG MERAH ( Allii cepae
var. ascalonicum ) DENGAN METODE UJI BRINE SHRIMP (BST)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
LELI MANULLANG
NIM 060804062FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN UJI TOKSISITAS EKSTRAK KULIT UMBI BAWANG MERAH ( Allii cepae
var. ascalonicum ) DENGAN METODE UJI BRINE SHRIMP (BST)
OLEH:
LELI MANULLANG
NIM 060804062Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara
Pada tanggal:... Pembimbing I, Panitia Penguji,
(Dra. Aswita Hafni Lubis M.Si, Apt) (DR. M. Pandapotan Nasution, MPS., Apt) NIP.19530403 198303 2001 NIP. 19570130 535838 2001
Pembimbing II, (Dra. Aswita Hafni Lubis M.Si, Apt) NIP. 19530403 198303 2001
(Drs. Suryadi Achmad, M.Sc., Apt) (Drs. Awaluddin Saragih, M.Si., Apt)
NIP. 19510908 198503 100 NIP. 19500822 197412 1002
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa atas anugerah dan kasih setia-Nya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini untuk memenuhi syarat dalam mencapai gelar sarjana farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Ucapan terima kasih yang tulus tiada terhingga kepada Ayahanda P. Manullang dan Ibunda D. Rajagukguk (Alm.) yang tercinta, serta kepada
kakanda dan adinda atas doa, perhatian, dan dorongan semangat kepada penulis selama masa perkuliahan hingga selesainya skripsi ini. Ucapan terima kasih kepada teman-teman Farmasi 2006 atas dukungan selama perkuliahan dan penyelesaian skripsi ini.
Penulis menyadari dalam penulisan skripsi ini banyak mendapatkan bimbingan, bantuan, dan fasilitas yang sangat berharga dari berbagai pihak. Pada kesempatan ini dengan segala kerendahan hati penulis juga ingin mengucapkan terima kasih yang sebesar – besarnya kepada :
1. Ibu Dra. Aswita Hafni Lubis M.Si, Apt sebagai pembimbing I dan Bapak Drs. Suryadi Achmad, M.Sc., Apt sebagai pembimbing II yang telah banyak memberikan waktu untuk membimbing dengan penuh kesabaran selama penelitian dan penulisan skripsi ini.
2. Bapak Prof. Dr. Sumadio Hadisahputra, Apt sebagai Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan fasilitas sehingga penulis dapat menyelesaikan pendidikan.
3. Bapak Drs., Syafruddin, MS., Apt sebagai Dosen Wali yang telah membimbing penulis selama masa pendidikan.
4. Bapak Drs. Panal Sitorus, M.Si., Apt selaku Kepala Laboratorium Farmakognosi beserta seluruh staf, yang telah mengijinkan penulis menggunakan fasilitas laboratorium selama penelitian
5. Dr. M. Pandapotan Nasution, MPS., Apt, Drs., awaluddin, M.Si., Apt. dan Drs. Suwarti Aris, M.Si., Apt, selaku dosen penguji yang telah memberikan masukan dan saran kepada penulis sehingga dapat menyelesaikan skripsi ini. 6. Bapak dan Ibu staf Pengajar Fakutas Farmasi yang telah banyak
7. Serta semua pihak yang telah membantu dalam penyelesaian skripsi ini.
Penulis menyadari bahwa tulisan ini masih banyak kekurangan, oleh karena itu sangat diharapkan kritik dan saran yang bersifat membangun dari pembaca. Akhirnya penulis berharap semoga skripsi ini bermanfaat bagi semua orang.
Medan, Agustus 2010 Penulis
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN UJI TOKSISITAS EKSTRAK KULIT UMBI BAWANG MERAH (Allii cepae bulbus var. ascalonicum) DENGAN METODE UJI BRINE SHRIMP (BST)
Abstrak
Bawang merah adalah salah satu rempah-rempah multiguna. Bawang merah selain digunakan sebagai bahan bumbu dapur untuk penyedap masakan juga banyak digunakan sebagai obat tradisional. Bawang merah dapat bertahan lama selama penyimpanan apabila tanpa dikupas, hal ini memperlihatkan bahwa kulit bawang merah mempunyai senyawa aktif yang melindungi umbinya. Kulit bawang merah juga banyak digunakan dalam pembuatan telur pindang dengan tujuan memperpanjang masa penyimpanan telur. Penelitian ini bertujuan untuk melihat perbedaan toksisitas ekstrak n-heksan, ekstrak etilasetat dan ekstrak etanol terhadap Artemia salina Leach.
Karakterisasi simplisia kulit bawang merah dilakukan dengan memeriksa makroskopik dan mikroskopik, kadar air, kadar sari yang larut dalam air, kadar sari yang larut dalam etanol, kadar abu total dan kadar abu yang tidak larut dalam asam. Ekstrak kulit bawang merah diperoleh secara perkolasi dengan menggunakan pelarut n-heksan, etilasetat dan etanol. Ekstrak kulit bawang merah diuji terhadap Artemia salina Leach. Data diolah menggunakan analisis regresi linear untuk memperoleh harga LC50.
Pengamatan makroskopik kulit bawang merah yaitu berwarna merah, berbentuk tidak beraturan dan lembaran tipis, panjang ± 3 cm dan lebar ± 2 cm, mempunyai bau dan rasa yang lebih lemah dari umbi bawang merah. Pemeriksaan mikroskopik serbuk simplisia kulit bawang merah menunjukkan adanya sel epidermis yang berbentuk segi empat, parenkim dengan sel berisi tetesan minyak, kristal kalsium oksalat bentuk prisma dan trakea dengan penebalan tangga. Hasil pemeriksaan karakteristik simplisia diperoleh kadar air 7,98 %, kadar sari yang larut dalam air 8,61 %, kadar sari yang larut dalam etanol 16,59 %, kadar abu total 9,19 % dan kadar abu yang tidak larut dalam asam 1,13 %.
Hasil uji toksisitas ekstrak n-heksan, etilasetat dan etanol terhadap Artemia salina Leach. adalah harga LC50 berturut-turut 237,15 µg/ml; 33,11 µ g/ml dan
29,67 µg/ml. Menurut Meyer at al., (1982), ekstrak dikatakan bersifat toksik apabila LC50 < 1000 µg/ml.
CHARACTERIZATION OF SIMPLEX, PHYTOCHEMICALS SCREENING AND TOXICITY TEST OF ONION SKIN BULB EXTRACT
(Allii cepae bulbus var. ascalonicum) WITH BRINE SHRIMP TEST (BST) METHOD.
Abstract
The red onion is multifunction spices plant. The red onion, besides it’s used as food flavoring it has been known as a traditional medicine too, for along time. Red onion can be stored for a long time without removing it’s skin, this thing shows that red onion’s skin has active compounds that protects the red onion’s bulb. The red onion’s skin is used for making boiled “pindang” eggs so those boiled eggs stay fresh for a long time. This research aimed to see the differences in toxicity of extracts of n-hexane, ethylacetate and ethanolic extracts against Artemia salina Leach.
Simplex characterization of the red onion’s skin was done by examining the macroscopic and microscopic, water content, water soluble extract, ethanol soluble extract, total ash value and acid insoluble ash value. The extraction process was carry out by stepwise percolation using different solvents, first with n-hexane, ethylacetate and then ethanol. Toxicity test has been done for n-hexane extract, ethylacetate extract and ethanol extract. Data was analyzed by linear regression analysis.
The result of macroscopic examination of red onion’s skin simplex is red, irregular shapes and thin sheets, length ± 3 cm and width ± 2 cm, has the weaker smell and taste than onion. The microscopic examination of simplex powder shows epidermis cell is square, parenchyme with oil drop, prismatic crystals of calcium oxalate and trachea with thickening of scalariformly pited. Simplex characteristic result were water content 7,98 %, water soluble extract 8,61 %, ethanol soluble extract 16,59 %, total ash value 9,19 % and acid insoluble ash value 1,13 %.
Result of biology test of n-hexane extract, ethylacetate extract and ethanol extract with Artemia salina Leach., the information LC50 is ; 237,15 µg/ml; 33,11
µg/ml; 29,67 µg/ml. According to Meyer at al, (1982), an extract named toxicity if only the extract has LC50 < 1000 µg/ml
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR GAMBAR ... xi
DAFTAR TABEL ... xii
DAFTAR LAMPIRAN ... xiii
BAB I. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Perumusan Masalah ... 3
1.3. Hipotesis ... 3
1.4. Tujuan Penelitian ... 4
BAB II. TINJAUAN PUSTAKA ... 5
2.1. Uraian tumbuhan ... 5
2.1.1. Sistematika tumbuhan ... 5
2.1.2. Sinonim ... 6
2.1.3. Nama daerah ... 6
2.1.4. Habitat dan Penyebaran ... 6
2.1.6. Kandungan kimia ... 7
2.1.7. Manfaat ... 8
2.2. Ekstraksi ... 9
2.3. Kromatografi ... 11
2.3.1. Kromatografi Lapis Tipis ... 11
2.4. Uji aktivitas ... 13
2.4.1. Metode Potato Disk (menghambat tumor crown gall) ... 14
2.4.2. Brine Shrimp Lethality Test ... 14
2.4.3. Uji terhadap Lemna minor L... 15
2.4.4. Uji terhadap cell line ... 15
2.5. Uraian Artemia salina Leach ... 16
BAB III. METODOLOGI PENELITIAN ... 18
3.1. Alat-alat ... 18
3.2. Bahan-bahan ... 18
3.3. Pengumpulan dan Pengolahan bahan tumbuhan ... 19
3.3.1. Pengumpulan bahan tumbuhan ... 19
3.3.2. Identifikasi tumbuhan ... 19
3.3.3. Pembuatan simplisia ... 19
3.4. Lokasi penelitian ... 20
3.5. Pembuatan larutan pereaksi ... 20
3.6. Karakterisasi simplisia... 22
3.6.1. Pemeriksaan makroskopik ... 22
3.6.2. Pemeriksaan mikroskopik ... 22
3.6.4. Penetapan kadar sari yang larut dalam air ... 23
3.6.5. Penetapan kadar sari yang larut dalam etanol ... 24
3.6.6. Penetapan kadar abu total ... 24
3.6.7. Penetapan kadar abu yang tidak larut dalam asam ... 24
3.7. Skrining fitokimia... ... 25
3.7.1. Pemeriksaan alkaloida ... 25
3.7.2. Pemeriksaan flavonoida ... 25
3.7.3. Pemeriksaan saponin ... 26
3.7.4. Pemeriksaan tanin ... 26
3.7.5. Pemeriksaan glikosida ... 26
3.7.6. Pemeriksaan antrakinon... 27
3.7.7. Pemeriksaan steroida/triterpenoida ... 27
3.8. Pembuatan ekstrak ... 27
3.9. Analisis ekstrak n-heksan,etilasetat dan etanol secara KLT ... 28
3.10. Uji toksisitas ... 29
BAB IV. HASIL DAN PEMBAHASAN ... 31
BAB V. KESIMPULAN DAN SARAN ... 35
5.1. Kesimpulan ... 35
5.2. Saran ... 36
DAFTAR PUSTAKA ... 37
DAFTAR GAMBAR
Gambar Halaman
1. Simplisia kulit bawang merah ... 40
2. Mikroskopik serbuk kulit bawang merah... .... 41
3. Bagan pembuatan simplisia ... 48
4. Bagan ekstraksi serbuk simplisia dan analisa KLT ... 49
5. Kromatogram ekstrak n-heksan kulit bawang merah ... 50
6. Kromatogram ekstrak etilasetat kulit bawang merah ... 51
7. Kromatogram ekstrak etanol kulit bawang merah ... 52
DAFTAR TABEL
Tabel Halaman
1. Hasil karakterisasi simplisia ... 31
2. Hasil skrining fitokimia ... 32
3. Hasil uji toksisitas ... 34
4. Data persen kematian nauplii ekstrak n-heksan ... 54
5. Data persen kematian nauplii ekstrak etilasetat ... 54
6. Data persen kematian nauplii ekstrak etanol ... 55
7. Perhitungan harga LC50 ekstrak n-heksan menggunakan metode analisa regresi linear ... 56
8. Perhitungan harga LC50 ekstrak etilasetat menggunakan metode analisa regresi linear ... 58
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil identifikasi kulit bawang merah ... 39
2. Gambar simplisia kulit bawang merah ... 40
3. Gambar mikroskopik serbuk kulit bawang merah ... 41
4. Perhitungan kadar karakteristik simplisia ... 42
5. Bagan kerja ... 48
6. Gambar kromatogram ekstrak n-heksan kulit bawang merah ... 50
7. Gambar kromatogram ekstrak etilasetat kulit bawang merah ... 51
8. Gambar kromatogram ekstrak etanol kulit bawang merah ... 52
9. Bagan uji toksisitas ... 53
10.Data persen kematian nauplii ... 53
KARAKTERISASI SIMPLISIA, SKRINING FITOKIMIA DAN UJI TOKSISITAS EKSTRAK KULIT UMBI BAWANG MERAH (Allii cepae bulbus var. ascalonicum) DENGAN METODE UJI BRINE SHRIMP (BST)
Abstrak
Bawang merah adalah salah satu rempah-rempah multiguna. Bawang merah selain digunakan sebagai bahan bumbu dapur untuk penyedap masakan juga banyak digunakan sebagai obat tradisional. Bawang merah dapat bertahan lama selama penyimpanan apabila tanpa dikupas, hal ini memperlihatkan bahwa kulit bawang merah mempunyai senyawa aktif yang melindungi umbinya. Kulit bawang merah juga banyak digunakan dalam pembuatan telur pindang dengan tujuan memperpanjang masa penyimpanan telur. Penelitian ini bertujuan untuk melihat perbedaan toksisitas ekstrak n-heksan, ekstrak etilasetat dan ekstrak etanol terhadap Artemia salina Leach.
Karakterisasi simplisia kulit bawang merah dilakukan dengan memeriksa makroskopik dan mikroskopik, kadar air, kadar sari yang larut dalam air, kadar sari yang larut dalam etanol, kadar abu total dan kadar abu yang tidak larut dalam asam. Ekstrak kulit bawang merah diperoleh secara perkolasi dengan menggunakan pelarut n-heksan, etilasetat dan etanol. Ekstrak kulit bawang merah diuji terhadap Artemia salina Leach. Data diolah menggunakan analisis regresi linear untuk memperoleh harga LC50.
Pengamatan makroskopik kulit bawang merah yaitu berwarna merah, berbentuk tidak beraturan dan lembaran tipis, panjang ± 3 cm dan lebar ± 2 cm, mempunyai bau dan rasa yang lebih lemah dari umbi bawang merah. Pemeriksaan mikroskopik serbuk simplisia kulit bawang merah menunjukkan adanya sel epidermis yang berbentuk segi empat, parenkim dengan sel berisi tetesan minyak, kristal kalsium oksalat bentuk prisma dan trakea dengan penebalan tangga. Hasil pemeriksaan karakteristik simplisia diperoleh kadar air 7,98 %, kadar sari yang larut dalam air 8,61 %, kadar sari yang larut dalam etanol 16,59 %, kadar abu total 9,19 % dan kadar abu yang tidak larut dalam asam 1,13 %.
Hasil uji toksisitas ekstrak n-heksan, etilasetat dan etanol terhadap Artemia salina Leach. adalah harga LC50 berturut-turut 237,15 µg/ml; 33,11 µ g/ml dan
29,67 µg/ml. Menurut Meyer at al., (1982), ekstrak dikatakan bersifat toksik apabila LC50 < 1000 µg/ml.
CHARACTERIZATION OF SIMPLEX, PHYTOCHEMICALS SCREENING AND TOXICITY TEST OF ONION SKIN BULB EXTRACT
(Allii cepae bulbus var. ascalonicum) WITH BRINE SHRIMP TEST (BST) METHOD.
Abstract
The red onion is multifunction spices plant. The red onion, besides it’s used as food flavoring it has been known as a traditional medicine too, for along time. Red onion can be stored for a long time without removing it’s skin, this thing shows that red onion’s skin has active compounds that protects the red onion’s bulb. The red onion’s skin is used for making boiled “pindang” eggs so those boiled eggs stay fresh for a long time. This research aimed to see the differences in toxicity of extracts of n-hexane, ethylacetate and ethanolic extracts against Artemia salina Leach.
Simplex characterization of the red onion’s skin was done by examining the macroscopic and microscopic, water content, water soluble extract, ethanol soluble extract, total ash value and acid insoluble ash value. The extraction process was carry out by stepwise percolation using different solvents, first with n-hexane, ethylacetate and then ethanol. Toxicity test has been done for n-hexane extract, ethylacetate extract and ethanol extract. Data was analyzed by linear regression analysis.
The result of macroscopic examination of red onion’s skin simplex is red, irregular shapes and thin sheets, length ± 3 cm and width ± 2 cm, has the weaker smell and taste than onion. The microscopic examination of simplex powder shows epidermis cell is square, parenchyme with oil drop, prismatic crystals of calcium oxalate and trachea with thickening of scalariformly pited. Simplex characteristic result were water content 7,98 %, water soluble extract 8,61 %, ethanol soluble extract 16,59 %, total ash value 9,19 % and acid insoluble ash value 1,13 %.
Result of biology test of n-hexane extract, ethylacetate extract and ethanol extract with Artemia salina Leach., the information LC50 is ; 237,15 µg/ml; 33,11
µg/ml; 29,67 µg/ml. According to Meyer at al, (1982), an extract named toxicity if only the extract has LC50 < 1000 µg/ml
BAB I
PENDAHULUAN
1.1. Latar Belakang
Tumbuhan bawang merah adalah sejenis tumbuhan semusim, yang memiliki umbi berlapis, berakar serabut, dengan daun berbentuk silinder berongga. Tumbuhan bawang merah (Allium cepa L. var. ascalonicum (L.) Back.), famili Alliaceae adalah spesies dengan nilai ekonomi yang penting, yang dibudidayakan secara luas di seluruh dunia khususnya di benua Asia dan Eropa (Rukmana, 1995).
Bawang merah adalah salah satu rempah multiguna. Paling penting didayagunakan sebagai bahan bumbu dapur sehari- hari dan penyedap berbagai masakan. Kegunaan lain dari umbi bawang merah adalah sebagai obat tradisional untuk pelayanan kesehatan masyarakat. Sudah sejak lama, nenek moyang menggunakan umbi bawang merah sebagi obat nyeri perut dan penyembuhan luka atau infeksi. Selain itu banyak digunakan untuk penyembuhan penyakit demam, kencing manis dan batuk (Wibowo, 1999).
Proses pengolahan bawang merah sebelum dipasarkan yaitu proses penjemuran tumbuhan bawang merah dibawah terik matahari selama ± 2 hari,
pembersihan dari tanah yang menempel dan akar. Setelah itu bawang merah disimpan dan selama penyimpanan bawang merah akan mengering dan kulit terluar bawang merah tersebut akan mudah terkelupas (Rukmana, 1994). Umbi bawang merah dapat disimpan lama dalam keadaan kering apabila tanpa dikupas, hal ini memperlihatkan bahwa kulit bawang merah mempunyai senyawa aktif yang melindungi umbinya. Kulit bawang merah ini banyak digunakan dalam pembuatan telur pindang, hal ini bertujuan untuk menambah masa penyimpanan telur rebus (Anonim,2009). Kulit bawang merah banyak ditemukan sebagai limbah petani bawang merah.
Untuk mengetahui kandungan kimia aktif suatu tumbuhan dapat dilakukan uji aktivitas. Salah satu uji aktivitas yang paling sederhana, yang dapat dilakukan dengan mudah dan dapat diandalkan adalah uji aktivitas Metode Brine Shrimp menggunakan larva (nauplii) udang laut Artemia salina Leach. Kandungan kimia aktif dimaksudkan sebagai komponen aktif biologi terhadap manusia maupun hewan dan tumbuhan. Kandungan kimia aktif biologi dapat bersifat racun jika digunakan pada dosis yang tinggi, dengan demikian secara in vivo kematian suatu hewan percobaan dapat dipakai sebagai alat pemantau penapisan awal kandungan kimia aktif suatu bahan alam terhadap ekstrak, fraksi maupun isolat. Namun pengujian ini masih bersifat umum oleh karena itu perlu dilakukan uji lain yang lebih terarah untuk mengetahui aktivitas spesifiknya ( Meyer,1982).
yang terkandung dalam kulit bawang merah, maka peneliti tertarik untuk melakukan karakterisasi simplisia, skrining fitokimia dan uji toksisitas ekstrak kulit bawang merah terhadap udang laut Artemia salina Leach.
1.2. Perumusan Masalah
1. Monografi kulit bawang merah belum terdapat dalam Materia Medika Indonesia sehingga belum diketahui karakternya.
2. Apakah kulit bawang merah dapat disari sempurna dengan cara ekstraksi bertingkat berdasarkan tingkat kepolarannya menggunakan pelarut n-heksan, etilasetat dan etanol 96%.
3. Apakah ekstrak n-heksan, ekstrak etilasetat dan ekstrak etanol dari kulit bawang merah bersifat toksis terhadap larva udang laut (nauplii) Artemia salina Leach.
1.3. Hipotesis
1. Karakterisasi simplisia kulit bawang merah dapat diperoleh dengan menggunakan prosedur Materia Medika Indonesia.
2. Kulit bawang merah dapat disari sempurna dengan cara ekstraksi bertingkat berdasarkan tingkat kepolarannya menggunakan pelarut n-heksan, etilasetat dan etanol 96%.
3. Ekstrak n-heksan, ekstrak etilasetat dan ekstrak etanol dari kulit bawang merah bersifat toksis terhadap larva udang laut (nauplii) Artemia salina Leach.
1.4. Tujuan penelitian
1. Untuk memperoleh informasi mengenai karakteristik simplisia dari kulit
2. Untuk memperoleh informasi kandungan senyawa-senyawa kimia yang terkandung dalam kulit bawang merah
BAB II
TINJAUAN PUSTAKA
2.1. Uraian Tumbuhan
2.1.1. Sistematika Tumbuhan
Sistematika dari tumbuhan bawang merah (Hutapea, 1991) adalah sebagai berikut:
Kingdom : Plantae
Super Divisi : Spermatophyta Divisi : Magnoliophyta Class : Monocotyledoneae Ordo : Asparagalles Famili : Alliaceae Genus : Allium
Spesies : Allium cepa L. var. Ascalonicum (L.) Back.
Kingdom : Plantae
Divisi : Spermatophyta
Sub Divisi : Angiospermae Kelas : Monocotyledonae Ordo : Liliales
Familia : Liliaceae Genus : Allium
2.1.2. Sinonim
Sinonim : Allium cepa L. var. agregatum G. Don
2.1.3. Nama Daerah
Nama daerah dari tumbuhan bawang merah : shallot, potato onion, multiplier onion (Inggris); echalote, oignon patate (Prancis); Bawang abang mirah
(Aceh); Pia (Batak); Bawang abang (Palembang); Bawang sirah, Barambang sirah, Dasun merah (Minangkabau); Bawang suluh (Lampung); Bawang beureum (Sunda); Brambang, Brambang abang (Jawa); Bhabang mera (Madura); Jasun bang, Jasun mirah (BaIi); Lasuna mahamu, Ransuna mahendeng, Yantuna mopura, Dansuna rundang, Lasuna randang, Lansuna mea, Lansuna Raindang (Sulawesi Utara); Bawangi (Gorontalo); Laisuna pilas, Laisuna mpilas (Roti); Kalpeo meh (Timor); Bowang wulwul (Kai); Kosai miha; Bawa rohiha (Ternate); Bawa kahori (Tidore) (Hutapea, 1991).
2.1.4. Habitat dan Penyebaran
Bawang merah termasuk tumbuhan semusim yang biasa tumbuh dan berproduksi dengan baik di tanah yang subur, gembur dan mengandung banyak bahan organik. Tumbuh di dataran rendah sampai dataran tinggi dengan ketinggian sampai 1.100 meter di atas permukaan laut (Rukmana, 1994). Tanaman bawang merah dapat tumbuh dengan baik pada suhu antara 25-32 0C. Tanaman bawang merah menghendaki daerah yang terbuka dengan penyinaran ± 70 % (Sunarjono, 2001).
Sumatera Utara, Sumatara Barat, Jawa Barat, Jawa Tengah, DIY, jawa Timur, bali, NTB, dan Sulawesi selatan. Kesembilan propinsi ini menyumbang 95,8 %( Jawa memberikan kontribusi 75 %) dari produksi total bawang merah di indonesia pada tahun 2003 (Badan Penelitian dan Pengembangan Pertanian, 2007).
2.1.5. Morfologi
Bawang merah (Allium cepa L.var.ascalonicum (L.) Back.; berakar serabut dengan sistem perakaran dangkal dan bercabang terpencar, pada kedalaman 15-30 cm di dalam tanah. Batang sejati yang bentuknya seperti cakram, tipis dan pendek sebagai tempat melekat perakaran dan mata tunas (titik tumbuh). Daun yang berbentuk pipa, yakni bulat kecil memanjang antara 50-70 cm, berlubang, bagian ujungnya meruncing, berwarna hijau muda sampai hijau tua dan letak daun melekat pada tangkai yang ukurannya relatif pendek. Bunga, tangkai daun keluar dari ujung tanaman (titik tumbuh) yang panjangnya antara 30-90 cm, dan di ujungnya terdapat 50-200 kuntum bunga yang tersusun melingkar seolah-olah berbentuk payung. Buah berbentuk bulat dengan ujungnya tumpul membungkus biji berjumlah 2-3 butir. Biji mempunyai bentuk agak pipih,sewaktu masih muda berwarna bening atau putih, tetapi setelah tua menjadi hitam. Umbi lapis bawang merah sangat bervariasi, bentuknya ada yang bulat, bundar sampai pipih; sedangkan ukuran umbi meliputi besar, sedang, dan kecil. Warna kulit umbi merah muda sampai merah tua (Rukmana, 1994; Permadi, 1992; Wibowo, 1991).
2.1.6. Kandungan Kimia
sikloaliin, metilaliin, dihidroaliin, kaemferol, kuersetin, floroglusin dan saponin (Rukmana,1994; Permadi, 1992; Hutapea, 1991). Kandungan lain dari bawang merah diantaranya protein, mineral, sulfur, antosianin, karbohidrat, dan serat (Rodrigues, 2003). Kandungan sulfur umbi bawang merah diketahui dapat mencegah kanker. Prostaglandin A-1, agen yang kuat untuk mengurangkan tekanan darah. Salah satu kandungan umbi bawang merah yang banyak disoroti adalah flavonoid. Flavonoid dipercaya mengurangi resiko kanker, penyakit jantung, dan kencing manis karena mempunyai unsur-unsur antikanker, antibakteria, antiviral,
antialergi dan antiinflammasi.
Umbi lapisnya mengandung protein, lemak, kalsium, fosfor, besi, vitamin B1, dan vitamin C
2.1.7. Manfaat
2.2. Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak larut dengan pelarut cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid, dan lain-lain. Dengan diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat (Ditjen POM, 2000).
Pembagian metode ekstraksi menurut Ditjen POM (2000) yaitu : A. Cara dingin
1. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar). Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif yang akan larut, karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dan di luar sel maka larutan terpekat didesak keluar.
2. Perkolasi
- Aliran cairan penyari menyebabkan adanya pergantian larutan yang terjadi dengan larutan yang konsentrasinya lebih rendah, sehingga meningkatkan derajat perbedaan konsentrasi.
- Ruangan diantara butir-butir serbuk simplisia membentuk saluran tempat mengalir cairan penyari. Karena kecilnya saluran kapiler tersebut, maka kecepatan pelarut cukup untuk mengurangi lapisan batas, sehingga dapat meningkatkan perbedaan konsentrasi.
B. Cara Panas
1. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
2. Sokletasi
Sokletasi adalah ekstraksi dengan menggunakan pelarut yang selalu baru dan yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstrak kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
3. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-50 0C.
4. Infundasi
5. Dekok
Dekok adalah infus pada waktu yang lebih lama dan temperatur sampai titik didih air, yakni 30 menit pada suhu 90-100 0C.
2.3. Kromatografi
Kromatografi adalah suatu metode pemisahan berdasarkan proses migrasi dari komponen-komponen senyawa diantara dua fase, yaitu fase diam dan fase gerak. Fase gerak membawa zat terlarut melalui media sehingga terpisah dari zat terlarut lainnya yang terelusi lebih awal atau lebih akhir. Umumnya zat terlarut dibawa melewati media pemisah oleh aliran suatu pelarut berbentuk cairan atau gas yang disebut eluen. Fase diam dapat bertindak sebagai penjerap, seperti alumina dan silika gel atau dapat bertindak melarutkan zat terlarut sehingga terjadi partisi antara fase diam dan fase gerak. Dalam proses ini suatu lapisan cairan pada penyangga yang inert berfungsi sebagai fase diam (Ditjen POM, 1995).
2.3.1. Kromatografi lapis tipis
tertutup rapat berisi larutan pengembang yang cocok (Adnan, 1997 dan Sastrohamidjojo, 1991).
Kromatografi lapis tipis termasuk kromatografi adsorbsi (serapan), dimana sebagai fase diam digunakan zat padat yang disebut adsorben (penyerap) dan fase gerak adalahzat cair yang disebut dengan larutan pengembang.
Kromatografi lapis tipis dapat dipakai untuk dua tujuan, yaitu :
1. Sebagai metode untuk mencapai hasil kualitatif, kuantitatif, atau preparatif.
2. Mencari sistem pelarut yang akan dipakai dalam kromatografi kolom . Pada kromatografi lapis tipis, fase diam berupa lapisan tipis yang terdiri dari atas bahan padat yang dilapiskan pada permukaan penyangga datar, biasanya terbuat dari kaca dan lapisan melekat pada permukaan dengan bantuan bahan pengikat (Gritter, dkk., 1991).
Pemilihan sistem pelarut (fase gerak) pada pengembangan didasarkan atas prinsip like dissolves like berarti untuk memisahkan campuran yang bersifat non polar digunakan sistem pelarut yang bersifat non polar dan sebaliknya. Fase gerak yang dipakai pada umumnya berupa campuran beberapa pelarut. Proses pengembangan akan lebih baik bila bejana pengembang telah jenuh dengan uap fase gerak (Adnan, 1997; Gritter, dkk., 1991).
yang baik. Kombinasi pelarut berdasarkan atas polaritas masing-masing pelarut sehingga dengan demikian akan diperoleh sistem pengembang yang cocok (Stahl, 1985).
Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan dengan harga Rf (Stahl, 1985).
Rf = Jarak perambatan bercak dari titik penotolan Jarak perambatan pelarut dari titik penotolan
Jarak yang ditempuh oleh tiap bercak dari titik penotolan diukur dari pusat bercak dan harga Rf berada diantara 0,00 – 1,00. Harga Rf ini sangat berguna untuk mengidentifikasi suatu senyawa (Eaton, 1989).
2.4. Uji Aktivitas
Dewasa ini penelitian terhadap senyawa aktif dari bahan alam sangat digalakkan. Tetapi banyak bahan-bahan obat alami yang telah diisolasi, dikarakterisasi dan dipublikasikan tanpa dilanjutkan dengan uji aktivitas biologi. Aktivitas biologi tumbuhan tersebut tidak diketahui hingga bertahun-tahun. Hal ini disebabkan karena karena pencarian untuk senyawa yang memiliki aktivitas farmakologi sering menggunakan uji aktivitas dengan biaya yang mahal. Hambatan biaya ini mempengaruhi kegiatan farmakologis. Oleh karena itu dibutuhkan suatu uji aktivitas yang secara umum sederhana, mudah dan murah namun dapat dipercaya dan dapat mendeteksi adanya senyawa yang mempunyai aktivitas biologi secara luas yang terdapat pada ekstrak, fraksi dan isolat (Rahman, 1991). Beberapa uji pendahuluan yang memenuhi syarat–syarat di atas antara lain: Metode Potato Disk, Brine Shrimp Lethality Test (BST) dan Uji terhadap Lemna
2.4.1. Metode Potato Disk (menghambat tumor crown gall)
Crown gall adalah penyakit tumor pada tumbuhan yang ditimbulkan oleh
strain yang spesifik dari bakteri gram negatif Agrobacterium tumefaciens. Terdapat kesamaan antara mekanisme terjadinya tumor pada tumbuhan dan pada hewan, senyawa yang dapat menghambat pertumbuhan tumor pada tumbuhan juga dapa berfungsi sebagai antitumor pada hewan. Uji ini merupakan uji pendahuluan yang sederhana untuk menemukan senyawa antikanker dari bahan alami. Penghambatan pertumbuhan crown gall tumor pada potato disk oleh ekstrak bahan alami, menunjukkan bahwa ekstrak bahan alami tersebut aktif (McLaughlin, 1990).
2.4.2. Brine Shrimp Lethality Test
Senyawa bioaktif hampir selalu toksik pada dosis tinggi. Oleh karena itu daya bunuh in vivo dari senyawa terhadap organisme hewan dapat digunakan untuk menapis ekstrak tumbuhan yang mempunyai bioaktvitas dan juga untuk memonitor fraksi bioaktif selama fraksinasi dan pemurnian
Artemia salina Lecah adalah sejenis udang air asin. Telurnya merupakan
makanan ikan tropis dan telur tersebut dapat dijumpai di toko-toko yang menjual ikan hias tropis dengan nama brine shrip eggs. Telur ini dapat bertahan selama bertahun-tahun dalam kondisi kering. Setelah ditempatkan dalam larutan air laut, telur-telur akan menetas dalam waktu 48 jam dan menghasilkan sejumlah nauplii. Nauplii Artemia saliana Leach ini dapat dipakai sebagai alat yang baik untuk mendeteksi senyawa-senyawa yang memiliki aktivitas biologi (McLaughlin, 1998).
2.4.3. Uji terhadap Lemna minor L.
Lemna minor L. adalah tumbuhan monokotil yang hidup di daerah
perairan. Pada kondisi normal, kondisi ini secara langsung menghasilkan anak daun. Jika ekstrak bahan alami dapat menghambat pertumbuhan dari anak daun tumbuhan Lemna minnor L., maka ekstrak bahan alami tersebut dikatakan aktif (McLaughlin, 1990).
2.4.4. Uji terhadap cell line
2.5. Uraian Artemia salina Leach.
Artemia merupakan zooplankton yang diklasifikasikan ke dalam filum Arthropoda dan kelas Crustaceae. Secara lengkap sistematika artemia dapat dijelaskan sebagai berikut:
Filum : Arthropoda Kelas : Crustaceae Subkelas : Branchiophoda Ordo : Anostraca Famili : Artemiidae Genus : Artemia
Spesies : Artemia salina Linn.
Pada kondisi alamiah , artemia hidup di danau-danau dan perairan bersalinitas tinggi. Oleh karena itu, artemia disebut juga udang renik asin (brine shrimp). Secara fisik, artemia tidak mempunyai pertahanan tubuh, oleh karena itu
kemampuannya hidup di danau dengan salinitas tinggi merupakan sistem pertahanaan alamiah artemia terhadap musuh-musuh pemangsanya. Artemia dapat tumbuh baik pada temperatur 25-30 0C (Harefa, 1997).
BAB III
METODOLOGI PENELITIAN
Metode yang digunakan adalah metode eksperimental meliputi pengumpulan dan pengolahan sampel, pemeriksaan karakteristik, skrining fitokimia, pembuatan ekstrak, KLT, dan uji toksisitas ekstrak kulit bawang merah menggunakan larva Artemia salina Leach.
3.1. Alat-alat yang digunakan
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas laboratorium, pipet tetes, kertas saring, aluminium foil, kaca penutup, kaca objek, vial, bejana penetasan telur Artemia salina Leach, termometer, lampu 18 watt (Hannochs), cawan berdasar rata, botol bersumbat, krusen tang, seperangkat alat destilasi, seperangkat alat penetapan kadar air, tanur, cawan porselen, seperangkat alat kromatografi lapis tipis, eksikator, mikroskop (Olympus), oven listrik (Stork), elektromantel (EM 2000), neraca analitik (Vibra AJ), dan penangas air (Yenaco). 3.2. Bahan-bahan yang digunakan
Bahan-bahan yang digunakan pada penelitian ini adalah kulit tumbuhan bawang merah (Allium cepa L. var. ascalonicum (L.) Back), telur Artemia salina Leach (ISO), garam laut, ragi, aqua bidestilata.
Bahan-bahan kimia yang digunakan kecuali dinyatakan lain berkualitas pro analisa yaitu n-heksan (destilasi), etil asetat (destilasi), etanol (destilasi), asam asetat anhidrida, asam sulfat pekat, kloroform, toluen, timbal (II) asetat, amil alkohol, metanol, natrium hidroksida, asam klorida pekat, serbuk magnesium,
klorida, iodium, raksa (II) klorida, kalium iodida, bismut (III) nitrat, asam nitrat pekat, Na-CMC, dan ragi tapai.
3.3. Pengumpulan dan Pengolahan Bahan Tumbuhan
3.3.1. Pengumpulan Bahan Tumbuhan
Pengumpulan sampel dilakukan secara purposif. Sampel yang digunakan adalah kulit bawang merah yang diambil dari desa Bakara, Kecamatan Baktiraja, Kabupaten Humbang Hasundutan, Propinsi Sumatera Utara.
3.3.2. Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Pusat lembaga Ilmu Pengetahuan, Bogor. Hasil identifikasi tumbuhan dapat dilihat pada lampiran 1 halaman 39. 3.3.3. Pembuatan Simplisia
3.4. Lokasi Penelitian
Penelitian dilakukan di Laboratorium Farmakognosi Fakultas Farmasi Universitas Sumatera Utara Medan.
3.5. Pembuatan Larutan Pereaksi
3.5.1. Larutan Pereaksi Asam Klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling hingga 100 ml (Ditjen POM, 1978).
3.5.2. Larutan Pereaksi Natrum Hidroksida 2 N
Sebanyak 8,002 g natrium hidroksida dilarutkan dalam air suling bebas karbondioksida hingga 100 ml (Ditjen POM, 1978).
3.5.3. Larutan pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, kemudian dilarutkan dalam air suling, ditambahkan iodium sebanyak 2 g dan dicukupkan dengan air suling hingga 100 ml (Ditjen POM, 1978).
3.5.4. Larutan pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml. Pada wadah lain dilarutkan 5 g kalium iodida dalam 10 ml air suling. Kemudian keduanya dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM, 1978).
3.5.5. Larutan Pereaksi Dragendorff
sampai memisah sempurna. Larutan yang jernih diambil dan diencerkan dengan air suling hingga 100 ml (Ditjen POM, 1978).
3.5.6. Larutan Pereaksi Besi (III) Klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100 ml ((Ditjen POM, 1989).
3.5.7. Larutan Pereaksi Liebermann- Burchard
Sebanyak 20 bagian asam asetat anhidrida dicampurkan dengan 1 bagian asam sulfat pekat (Harborne, 1987).
3.5.8. Larutan Pereaksi Molish
Sebanyak 3 g α-naftol dilarutkan dalam asam nitrat 0,5 N hingga diperoleh
volume 100 ml (Ditjen POM, 1978). 3.5.9. Larutan Air Kloroform
Sebanyak 2,5 ml kloroform dikocok dengan 900 ml air suling, cukupkan dengan air suling hingga 1000 ml ((Ditjen POM, 1995).
3.5.10. Larutan Kloralhidrat
Sebanyak 50 gram kloralhidrat ditimbang dan dilarutkan dalam 20 ml air suling ((Ditjen POM, 1979).
3.5.11. Larutan Pereaksi Timbal (II) Asetat 0,4 M
Sebanyak 15,17 gram timbal (II) asetat dilarutkan dalam air suling bebas karbondioksida secukupnya hingga 100 ml ((Ditjen POM, 1989).
3.5.12. Pereaksi asam sulfat 50% dalam metanol
3.5.13. Pereaksi Asam Nitrat 0,5 N
Sebanyak 3,4 ml asam nitrat pekat diencerkan dengan air suling hingga volume 100 ml (Ditjen POM, 1979).
3.6. Karakterisasi Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik dan mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air, penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total, dan penetapan kadar abu yang tidak larut dalam asam.
3.6.1. Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk, ukuran, warna, bau dan rasa kulit bawang merah. Gambar simplisia kulit bawang merah dapat dilihat pada lampiran 2 halaman 40.
3.6.2. Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia dengan cara menaburkan serbuk simplisia di atas kaca objek yang telah ditetesi dengan kloralhidrat dan ditutupi dengan cover glass (kaca penutup) kemudian dilihat dibawah mikroskop. Gambar mikroskopik dapat dilihat pada lampiran 3 halaman 41.
3.6.3. Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen) ( WHO, 1992).
Cara kerja :
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu alas bulat, didestilasi selama 2 jam. Kemudian toluen didinginkan selama 30 menit dan volume air pada tabung penerima dibaca dengan ketelitian 0,05 ml. 2. Penetapan kadar air simplisia
Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama dimasukkan ke dalam labu yang berisi toluen tersebut, lalu dipanaskan hati-hati selama 15 menit. Setelah toluen mendidih, kecepatan tetesan diatur lebih kurang 2 tetesan perdetik, sampai sebagian air terdestilasi, kemudian kecepatan destilasi dinaikkan hingga 4 tetes perdetik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan dingin sampai suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen, dapat dilihat pada lampiran 4 halaman 42.
3.6.4. Penetapan Kadar Sari Yang larut dalam Air
3.6.5. Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24 jam dengan 100 ml etanol 96% dalam labu bersumbat sambil dikocok selama 18 jam. Kemudian disaring cepat untuk menghindari penguapan etanol 96%, sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan penguap berdasar rata yang telah ditara dan sisanya dipanaskan pada suhu 105 0C sampai bobot tetap. Kadar sari larut dalam etanol dihitung dalam persen terhadap simplisia yang telah dikeringkan (Ditjen POM, 1989). Hasil perhitungan kadar sari yang larut dalam etanol dapat dilihat pada lampiran 4 halaman 44.
3.6.6. Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukkan ke dalam cawan porselen yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan
pada suhu 500 - 600° C selama 3 jam kemudian didinginkan dan ditimbang
sampai diperoleh bobot tetap. Kadar abu dihitung terhadap simplisia yang telah dikeringkan (WHO, 1992). Hasil perhitungan kadar abu total dapat dilihat pada lampiran 4 halaman 45.
3.6.7. Penetapan kadar abu yang tidak larut dalam asam
perhitungan kadar abu yang tidak larut dalam asam dapat dilihat pada lampiran 4 halaman 46.
3.7. Skrining fitokimia
Skrining fitokimia serbuk simplisia meliputi pemeriksaan senyawa gologan alkaloid, flavonoida, glikosida, glikosida antrakinon, saponin, tanin dan steroid/triterpenoida (Ditjen POM, 1989; Farnsworth, 1996). Hasil skrining fitokimia serbuk simplisia dapat dilihat pada halaman 32. Skrining fitokimia ekstrak n-heksan, etilasetat dan etanol dilakukan dengan cara yang sama dengan skrining fitokimia serbuk simplisia.
3.7.1. Pemeriksaan alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g, kemudian ditambah 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit. Dinginkan dan disaring. Filtrat dipakai untuk percobaan berikut :
a. Filtat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Mayer, akan terbentuk endapan menggumpal berwarna putih atau kuning bila terdapat alkaloida.
b. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Bouchardat, akan terbentuk endapan berwarna coklat sampai hitam bila terdapat alkaloida.
c. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes pereaksi Dragendorf akan terbentuk warna merah atau jingga bila terdapat alkaloida.
3.7.2. Pemeriksaan Flavonoida
ditambahkan serbuk magnesium, 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok kuat dan dibiarkan memisah. Bila terdapat flavonoida ditunjukkan dengan timbulnya warna merah, kuning atau jingga pada lapisan amil alkohol. 3.7.3. Pemeriksaan Saponin
Sebanyak 0,5 g serbuk simplisia, dimasukkan ke dalam tabung reaksi, ditambahkan 10 ml air panas, dinginkan kemudian dikocok selama 10 detik. Jika terbentuk busa setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan asam klorida 2 N menunjukkan adanya saponin. 3.7.4. Pemeriksaan Tanin
Sebanyak 0,5 g serbuk simplisia, disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin.
3.7.5. Pemeriksaan Glikosida
asam sulfat pekat melalui dinding tabung, terbentuknya cincin ungu pada batas kedua cairan menunjukkan adanya gula.
3.7.6. Pemeriksaan Antrakinon
Sebanyak 0,2 g serbuk simplisia dicampur dengan 5 ml asam sulfat 2 N, dipanaskan sebentar, lalu didinginkan, ditambahkan 10 ml benzena, dikocok, didiamkan. Lapisan benzena dipisahkan dan disaring. Kocok lapisan benzena dengan 2 ml NaOH 2 N, diamkan. Lapisan air berwarna merah dan lapisan benzena tidak berwarna menunjukkan adanya glikosida antrakinon.
3.7.8. Pemeriksaan Steroida/triterpenoida
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml n-heksan selama 2 jam, disaring, filtrat diuapkan dalam cawan penguap dan pada sisanya ditambahkan 2 tetes Liebermann-Burchard. Apabila terbentuk warna ungu atau merah berubah menjadi ungu atau biru hijau menunjukkan adanya steroida/triterpenoida.
3.8. Pembuatan Ekstrak
Cara kerja :
berwarna lagi atau apabila sebanyak 500 mg cairan perkolat diuapkan di atas penangas air tidak meninggalkan sisa. Perkolat dipekatkan dengan bantuan alat penguap rotary evaporator pada temperatur tidak lebih dari 40 0C, lalu ampas dikeluarkan dari alat perkolator dan dikeringkan dengan cara diangin- anginkan selama 1 jam. Ampas yang telah dikeringkan, disari kembali dengan cairan penyari etilasetat. Ampas dari perkolasi etilasetat dikeringkan lalu disari kembali dengan cairan penyari etanol 96%. Setiap perkolasi dilakukan dengan cara yang sama seperti perkolasi menggunakan n-heksan. Bagan pembuatan ekstrak dapat dilihat pada lampiran 5 halaman 49.
3.9. Analisis Ekstrak n-heksan, etilasetat dan etanol secara KLT
Terhadap ekstrak n-heksan, etil asetat dan etanol dilakukan analisis secara KLT menggunakan fase diam silika gel F254 dan fase gerak campuran n-heksan –
etilasetat dengan perbandingan (80:20), (60:40), (40:60) dan (20:80). Sebagai penampak bercak digunakan pereaksi asam sulfat 50 % dalam metanol.
Cara kerja :
Ekstrak ditotolkan pada plat lapis tipis, kemudian dimasukkan ke dalam chamber yang telah jenuh dengan uap fase gerak. Setelah pengembangan selesai
3.10. Uji Toksisitas
Uji toksisitas ekstrak n-heksan, ekstrak etilasetat dan ekstrak etanol dilakukan terhadap larva Artemia salina Leach, yaitu sebagai berikut :
air laut sintetik sampai 5 ml. Ditambahkan 1 tetes suspensi ragi sebagai makanannya kemudian semua vial diletakkan di bawah cahaya lampu. Setelah 24 jam dihitung jumlah larva yang mati (Mclaughlin et al., 1998). Data dianalisis dengan Analisa regresi linear untuk menentukan LC50. Bagan uji toksisitas dapat
BAB IV
HASIL DAN PEMBAHASAN
Hasil identifikasi yang dilakukan oleh Pusat lembaga Ilmu Pengetahuan Indonesia (LIPI) – Pusat Penelitian dan Pengembangan Biologi – Bogor terhadap kulit bawang merah yang diteliti adalah kulit umbi tumbuhan bawang merah (Allium cepa L. var. ascalonicum (L.) Back.) suku Alliaceae.
Hasil pemeriksaan secara makroskopik yang dilakukan terhadap kulit tumbuhan bawang merah (Allium cepa L. var. ascalonicum (L.) Back.) yaitu berwarna merah, berbentuk tidak beraturan dan lembaran tipis, panjang ± 3 cm dan lebar ± 2 cm, mempunyai bau dan rasa yang lebih lemah dari umbi bawang merah.
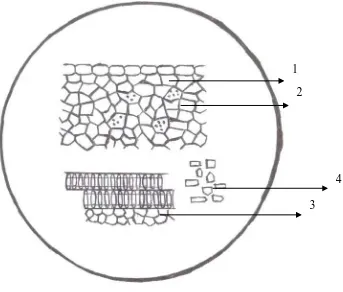
Hasil pemeriksaan secara mikroskopik yang dilakukan terhadap serbuk simplisia kulit bawang merah yaitu terlihat sel epidermis yang berbentuk segi empat, parenkim dengan sel berisi tetesan minyak, kristal kalsium oksalat bentuk prisma dan trakea dengan penebalan tangga.
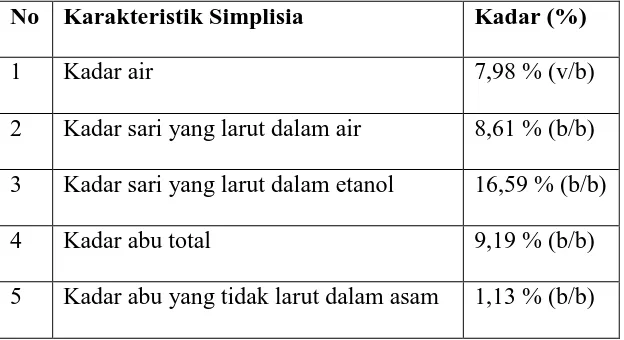
Tabel 1: Hasil karakterisasi simplisia
No Karakteristik Simplisia Kadar (%)
1 Kadar air 7,98 % (v/b)
2 Kadar sari yang larut dalam air 8,61 % (b/b) 3 Kadar sari yang larut dalam etanol 16,59 % (b/b)
4 Kadar abu total 9,19 % (b/b)
Hasil pemeriksaan karakteristik serbuk simplisia kulit bawang merah diperoleh kadar air 7,98 %, hal ini disebabkan sampel sangat sukar dikeringkan karena kandungan lemak, karbohidrat dan protein cukup tinggi seperti yang terkandung dalam umbi bawang merah (Permadi, 1994). Kadar sari yang larut dalam air 8,61 %, ini menunjukkan bahwa kulit bawang merah banyak mengandung senyawa-senyawa yang larut dalam air. Kadar sari yang larut dalam etanol 16,59 %, ini menunjukkan bahwa kulit bawang merah banyak mengandung senyawa-senyawa yang larut dalam lemak dan juga senyawa yang larut dalam air. Kadar abu total 9,91 %, ini menunjukkan bahwa kadar abu total kulit bawang merah tinggi. Hal ini memperlihatkan bahwa kulit bawang merah banyak mengandung mineral. Kadar abu yang tidak larut dalam asam 1,13 %, ini menunjukkan bahwa kulit bawang merah mengandung cukup banyak senyawa anorganik yang tidak larut dalam asam.
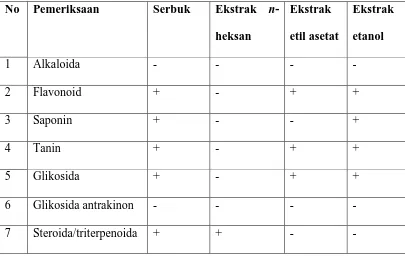
Tabel 2 : Hasil skrining fitokimia
n-Keterangan: + = memberikan reaksi - = tidak memberikan reaksi
Hasil skrining fitokimia serbuk simplisia kulit bawang merah menunjukkan bahwa kulit bawang merah mengandung senyawa kimia golongan flavonoida, tanin, saponin, steroida/triterpenoida dan glikosida. Hasil skrining fitokimia pada ekstrak n-heksan hanya terdapat senyawa kimia golongan steroida/triterpenoida, sedangkan hasil skrining fitokimia ekstrak etil asetat terdapat senyawa kimia golongan flavonoida, tanin dan glikosida, sementara hasil skrining fitokimia ekstrak etanol terdapat senyawa kimia golongan flavonoida, tanin, saponin dan glikosida. Perbedaan kandungan senyawa kimia yang terdapat dalam masing-masing ekstrak disebabkan karena perbedaan kepolaran dari cairan penyari. Analisa KLT ekstrak n-heksan, ekstrak etilasetat dan ekstrak etanol dilakukan dengan menggunakan fase diam silika gel F254 dan fase gerak n-heksan
: etilasetat. Hasil KLT ekstrak n-heksan dengan perbandingan fase gerak (60:40), terdapat 2 noda berwarna ungu. Hasil KLT ekstrak etilasetat dengan perbandingan fase gerak (40:60), terdapat 1 noda berwarna ungu sangat lemah dan hasil KLT ekstrak etanol dengan perbandingan fase gerak (40:60), terdapat juga 1 noda yang berwarna ungu. Senyawa golongan yang memberikan warna ungu tersebut diduga adalah senyawa golongan steroida/triterpenoida.
Tabel 3: Hasil Uji Toksisitas
Harga LC50 yang diperoleh dari hasil uji toksisitas ekstrak n-heksan,
ekstrak etilasetat dan ekstrak etanol menunjukkan bahwa ketiga ekstrak tersebut bersifat toksik terhadap Artemia salina Leach. Ekstrak dikatakan bersifat toksik atau memiliki aktivitas biologi terhadap Artemia salina Leach (Brine shrimp)
apabila memiliki LC50 <1000 µg/ml (Meyer at al., 1982)
Harga LC50 ekstrak etanol yaitu 29,67 µ g/ml menunjukkan bahwa ekstrak
etanol ini lebih toksik, hal ini diduga disebabkan oleh adanya kandungan senyawa golongan saponin dan dengan senyawa golongan lainnya seperti flavonoida, tanin, glikosida memberikan efek sinergis sehingga menghasilkan toksisitas yang lebih kuat dibandingkan dengan ekstrak etilasetat dan ekstrak n-heksan. Saponin bersifat racun karena dapat mengakibatkan hemolisa darah.
No Ekstrak LC50 (µg/ml)
1 n-Heksan 237,15
2 Etilasetat 33,11
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Hasil pemeriksaan makroskopik yang dilakukan terhadap kulit bawang merah yaitu berwarna merah, berbentuk tidak beraturan dan lembaran tipis, panjang ± 3 cm dan lebar ± 2 cm, mempunyai bau dan rasa yang lebih lemah dari umbi bawang merah. Hasil pemeriksaan mikroskopik yang dilakukan terhadap serbuk simplisia kulit bawang merah yaitu terlihat sel epidermis yang berbentuk segi empat, parenkim dengan sel berisi tetesan minyak, kristal kalsium oksalat bentuk prisma dan trakea dengan penebalan tangga.
Hasil pemeriksaan karakteristik serbuk simplisia kulit bawang merah diperoleh kadar air 7,98 %, kadar sari yang larut dalam air 8,61 %, kadar sari yang larut dalam etanol 16,59 %, kadar abu total 9,19 % dan kadar abu yang tidak larut dalam asam 1,13 %.
Hasil perkolasi 200 g serbuk simplisia kulit bawang merah diperoleh ekstrak n-heksan sebanyak 2,83 g (1,41 %), ekstrak etilasetat sebanyak 7,76 g (3,88 %) dan ekstrak etanol sebanyak 19,56 g (9,78 %).
Hasil uji toksisitas ekstrak n-heksan, ekstrak etilasetat dan ekstrak etanol terhadap Artemia salina Leach. menunjukkan bahwa ekstrak etanol lebih toksis dibandingkan ekstrak etilasetat dan ekstrak n-heksan.
5.2. Saran
DAFTAR PUSTAKA
Anonim. (2009). Bawang Merah.CCRC Farmasi UGM. Tanggal akses 20 Februari 2010.www.ugm.ac.id/ccrc.
Anonim, (2010). Telur Pindang. Institut Pertanian Bogor. Tanggal akses 05 Mei 2010. www.warintek.ristek.go.id/ pangan /ipb. Halaman 103-104.
Ditjen POM. (1978). Materia Medika Indonesia. Jilid II. Departemen Kesehatan RI. Jakarta. Halaman 150 – 156, 165 – 167.
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Departemen Kesehatan RI. Jakarta. Halaman 33 – 34, 696.
Ditjen POM. (1986). Sediaan Galenik. Jilid II. Departemen Kesehatan RI. Jakarta. Halaman 19 - 22.
Ditjen POM. (1989). Materia Medika Indonesia. Jilid II. Departemen Kesehatan RI. Jakarta. Halaman 516, 518, 522.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Departemen Kesehatan RI. Jakarta. Halaman 925.
Farnsworth, N. (1966). Biological and Phytochemical Screening of Plant. Journal of Pharmaceutical Sciences. 55(3): 262-263.
Gritter, R. J., Bobbitt, J. dan Schwarting, A. E. (1991). Pengantar Kromatografi. Penerjemah: Padmawinata, K. Ed 2. Bandung: Penerbit ITB. Halaman 6, 107, 109, 111
Harborne, J.B. (1987). Metode Fitokimia, Penuntun Cara Modern Menganalisa Tumbuhan.Terjemahan K. Padmawinata. Edisi II. Bandung: ITB Press. Halaman 152.
Harefa, F. (1997). Pembudidayaan Artemia Untuk Pakan Udang dan Ikan. Jakarta: Penebar Swadaya. Halaman 15-16.
Hutapea, R.J., Sugati, S. (1991). Inventaris Tanaman Obat Indonesia. Edisi I. Depkes RI. Halaman 24-25
Klohs WD, Fry DW, Kraker AJ. (1997). Inhibitors of tyrosine kinase. Curr Opin Oncol. 9:562-568.
Meyer, B.N., Ferrigni, N.R., Nichols,D.E., Jacobsen,L.B., Mclaughlin,J.L., (1982), Brine Shrimp: A Convenient General Bioassay far Active Plant Constituents, Plant Medica Journal. 45: 31-35.
Mudjiman , A. (1989). Udang Renik Air Asin. Jakarta: Penerbit Bhratara. Hal. 11, 14
Murtihapsari, (2009), Analisis Senyawa Kuersetin Bawang bombay (Allium cepa) Melalui Uji Multifragmen Separatif Dan Spektrofotometris,Universitas Negeri Papua. Tanggal akses 20 Februari 2010. www.scribd.com/doc/5339681.
Permadi, A.H., Meer, P.Q. (1992). Prosea Foundation Plant Resources of South-East Asia Vegetable. Plant Resources Of South-South-East Asia. Journal Of Ethnopharmacology.(12)2.Bogor-Indonesia
Rahman, A. (1991). Studies in Natural Product Chemistry. Elsevier Science Publ. 9:383-388.
Rukmana,R., (1994). Bawang Merah.Budidaya dan Pengolahan Pascapanen, Cetakan ke-1.Yogayakarta: Penerbit Kanisius. halaman 13, 50 .
Rodrigues A., Fogliano V., Graziani G., Mendes, S., Vale, A. and Goncalves, C., 2003. Nutrition Value of Onion Regional Varieties in Northwest Portugal, EJEAFChe 2(4): 519-524.
Sastrohamidjojo, H. (1985). Kromatografi. Yogyakarta : Penerbit Liberty. Hal. 1-2, 28, 35-36
Soebagio, B. (2007). Pembuatan gel Aqupec HV-505 dari Ekstrak Bawang Merah (Allium cepa) Sebagai antioksidan,Universitas Padjadjaran. Tanggal akses 20 Februari 2010. www.pustaka.unpad.ac.id/archives/9916/.
Sunarjono, H. (2001). Budidaya Bawang Merah (Allium ascalonicum L.). Cetakan ke-3. Bandung: Penerbit Sinar Baru Algensindo. Halaman 18-19.
Stahl, E. (1985). Analisis Obat Secara Kromatografi Dan Mikroskopik. Penerjemah: Padmawinata, K. Dan Soediro. Penerbit ITB. Bandung. halaman 252.
Wibowo, S. (1999). Budidaya Bawang. Cetakan Ke- 9. Jakarta: Penerbit Penebar Swadaya. halaman 134.
Lampiran 2
Lampiran 3. Mikroskopik serbuk simplisia kulit bawang merah
Gambar 2 : Mikroskopik serbuk simplisia kulit bawang merah perbesaran 10 x 10 Keterangan : 1. Epidermis
2. Parenkim dengan sel yang berisi tetesan minyak
3. Fragmen trakea dengan penebalan tangga dan parenkim 4. Kristal kalsium oksalat bentuk prisma
1 2
Lampiran 4. Perhitungan Kadar Karakteristik Simplisia
1. Penetapan Kadar Air
Kadar air
=
Volume II-Volume IBerat Sampel
× 100%
Sampel I
Berat sampel = 5,0130 g Volume I = 1,9 ml Volume II = 2,3 ml
Kadar air = 2,3-1,9
5,0130 X 100%
= 7,97 % (v/b) Sampel II
Berat sampel = 5,0030 g Volume I = 2,3 ml Volume II = 2,7 ml
Kadar air = 2,7-2,3
5,0030 x 100%
= 7,99 % (v/b) Sampel III
Berat sampel = 5,0040 g Volume I = 2,7 ml Volume II = 3,1 ml
Kadar air = 3,1-2,7
5,004 X 100%
Lampiran 4 (lanjutan)
Kadar air rata-rata = 7,97 %+7,99 %+7,99 %
3
= 7,98 % (v/b)
2. Penetapan Kadar Sari Yang Larut Dalam Air
Kadar sari larut air
=
Berat sari X 100Berat Sampel X 20 X 100%
Sampel I
Berat sampel = 5,0040 g Berat sari = 0,0843 g
Kadar sari larut air = 0,0843 X 100
5,0040 X 20 X 100%
= 8,42 % (b/b) Sampel II
Berat sampel = 5,0120 g Berat sari = 0,0940 g
Kadar sari larut air = 0,0940 X 100
5,0120 X 20
X
100%=
9,37 % (b/b)Sampel III
Berat sampel = 5,0020 g Berat sari = 0,081 g
Kadar sari larut air = 0,081 X 100
5,0020 X 20 X 100%
Lampiran 4 (lanjutan)
Kadar sari larut air rata-rata = 8,42+9,37+8,06
3 X 100%
= 8,61 % (b/b)
3. Penetapan Kadar Sari Yang Larut Dalam Etanol
Kadar sari larut etanol = Berat sari X 100
Berat Sampel X 20 X 100% Sampel I
Berat sampel = 5,0020 g Berat sari = 0,169 g
Kadar sari larut etanol = 0,169 X 100
5,0020 X 20 X 100%
= 16,89 % (b/b) Sampel II
Berat sampel = 5,0040 g Berat sari = 0,165 g
Kadar sari larut etanol = 0,165 X 100
5,0040 X 20 X 100%
= 16,48 % (b/b) Sampel III
Berat sampel = 5,0000 g Berat sari = 0,164 g
Kadar sari larut etanol =0,164 X 100
5,0000 X 20 X 100%
Lampiran 4 (lanjutan)
Kadar sari larut etanol rata-rata = 16,89+16,48+16,40
3 X 100%
= 16,59 % 4. Penetapan Kadar Abu Total
Kadar abu total = W1
W X 100%
Dimana : w = berat sampel w1 = berat abu
Sampel I
Berat sampel = 2,0005 g Berat abu = 0,1815 g
Kadar abu total = 0,1815
2,0005X 100%
= 9,07 % (b/b) Sampel II
Berat sampel = 2,0006 g Berat abu = 0,1877 g
Kadar abu total = 0,1877
2,0006X 100%
= 9,38 % (b/b) Sampel III
Lampiran 4 (lanjutan)
Kadar abu total = 0,1824
2,0001X 100%
= 9,12 % (b/b)
Kadar abu rata-rata = 9,07+9,38+9,12
3 X 100%
= 9,19 % (b/b)
5. Penetapan Kadar Abu Yang Tidak Larut Dalam Asam
Kadar abu tidak larut asam = W1
W X 100%
Dimana : w = berat sampel w1 = berat abu
Sampel I
Berat sampel = 2,0005 g Berat abu = 0,0215 g
Kadar abu = 0,0215
2,0005X 100%
= 1,07 % (b/b) Sampel II
Berat sampel = 2,0006 Berat abu = 0,0268
Kadar abu = 0,0268
2,0006X 100%
Lampiran 4 (lanjutan)
Sampel III
Berat sampel = 2,0001 Berat abu = 0,0201
Kadar abu = 0,0201
2,0001X 100%
= 1,00 % (b/b)
Kadar abu rata-rata = 1,07+1,34+1,00
3 X 100%
Lampiran 5. Bagan Kerja
a. Bagan pengolahan simplisia
dipisahkan kulit bawang merah dari bagian yang tidak digunakan
dicuci dengan air kran mengalir ditiriskan
ditimbang
dikeringkan di dalam lemari pengering dengan suhu 40-50 0C
ditimbang
dihaluskan dengan menggunakan blender
Limbah bawang merah
Kulit bawang merah
Berat basah kulit bawang merah = 620 g
Berat kering kulit bawang merah = 550 g
Serbuk simplisia kulit bawang merah
Ekstraksi Karakterisasi simplisia : - Kadar air
- Kadar sari larut dalam etanol - Kadar sari larut dalam air - Kadar abu total
Lampiran 5 (lanjutan)
b. Bagan ekstraksi serbuk simplisia secara perkolasi
diperkolasi dengan n-heksan
Keterangan : * = Uji Toksisitas
Lampiran 6. Kromatogram Ekstrak n-Heksan Kulit Bawa
Keterangan :Fase diam silika gel GF 254, fase gerak n-heksan – etil asetat
{(80:20) ; (60:40) ; (40:60) ; (20:80)}, penampak bercak asam sulfat
Lampiran 7. Kromatogram Ekstrak Etil Asetat Kulit Bawang Merah
Keterangan : Fase diam silika gel GF 254, fase gerak n-heksan – etil asetat
{(80:20) ; (60:40) ; (40:60) ; (20:80)}, penampak bercak asam
Lampiran 8. Kromatogram Ekstrak Etanol Kulit Bawang Merah
Keterangan : Fase diam silika gel GF 254, fase gerak n-heksan – etil asetat
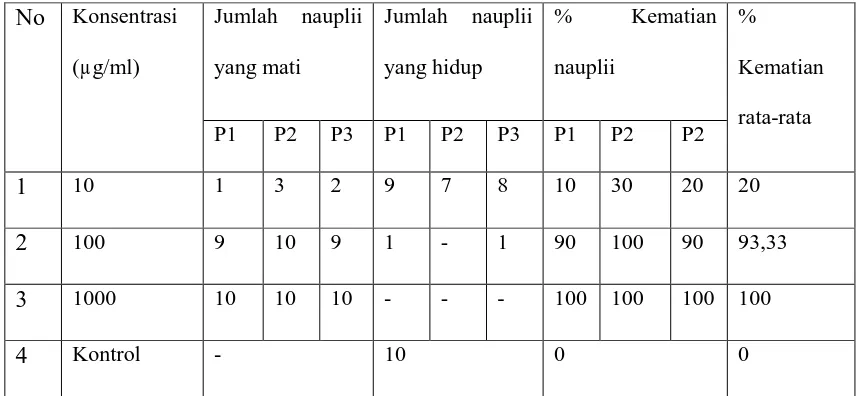
Lampiran 10. Data Persen Kematian Nauplii
Tabel 4: Data Persen Kematian Nauplii Ekstrak n-Heksan
No Konsentrasi
Tabel 5: Data Persen Kematian Nauplii Ekstrak Etil Asetat
Lampiran 10 (lanjutan)
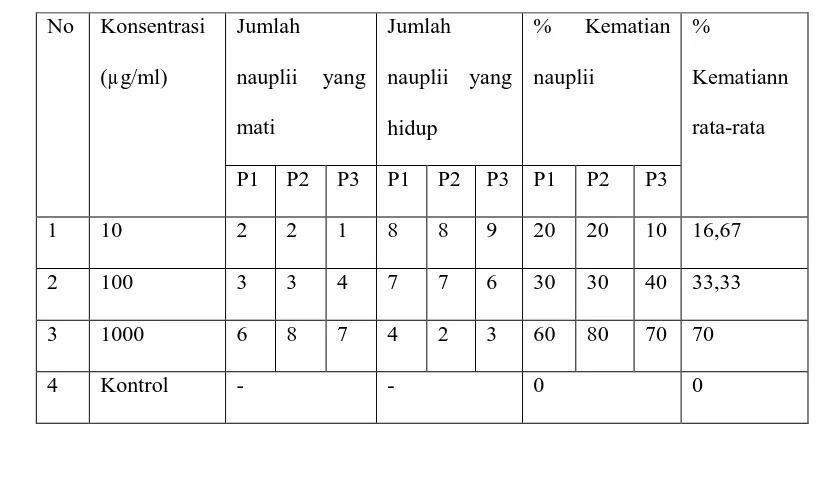
Tabel 6: Data Persen Kematian Nauplii Ekstrak Etanol
No Konsentrasi
(µg/ml)
Jumlah nauplii
yang mati
Jumlah nauplii
yang hidup
% Kematian
nauplii
%
Kematian
rata-rata
P1 P2 P3 P1 P2 P3 P1 P2 P2
1 10 1 3 2 9 7 8 10 30 20 20
2 100 9 10 9 1 - 1 90 100 90 93,33
3 1000 10 10 10 - - - 100 100 100 100
Lampiran 11. Perhitungan Uji Bioassay
1. Perhitungan Persentase Kematian
Persentase Kematian =(Tes-Kontrol)
Total
X 100%
Tes = Jumlah kematian nauplii larutan uji Kontrol = Jumlah kematian nauplii larutan kontrol Total = Jumlah nauplii yang digunakan
2. Perhitungan Harga LC50
Menggunakan Analisa Regresi Linear.
2.1. Perhitungan harga LC50 untuk ekstrak n-heksan
Konsentrasi yang digunakan adalah 10, 100 dan 1000 µg/ml
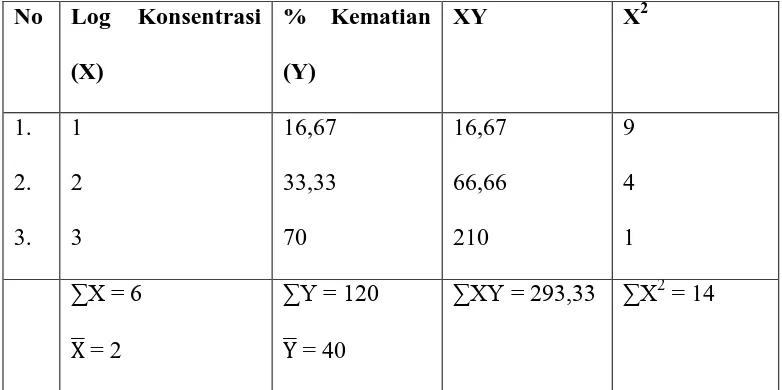
Tabel 7: Perhitungan harga LC50 ekstrak n-heksan menggunakan metode
Analisa Regresi Linear
No Log Konsentrasi
(X) Y = konsentrasi kematian
Lampiran 11 (lanjutan)
a = ∑XY – (∑X∑Y)/n
∑X2- (∑X)2/n
=
293,33-(6.120)/ 3 14-(6)2/ 3= 293,33-240 14-12
= 53,33 2
= 26,665
b = Y� - aX�
= 40 – 26,665.2 = 40 – 53,33 = -13,33 Y = aX + b
= 26,665 X – 13,33 Untuk Y = 50
50 = 26,665 X – 13,33 63,33 = 26,665 X
X = 2,375
LC50 = 237,15 µg/ml
2.2. Perhitungan harga LC50 untuk ekstrak etil asetat
Lampiran 11 (lanjutan)
Tabel 8: Perhitungan harga LC50 ekstrak n-heksan menggunakan metode Analisa
Regresi Linear
No Log Konsentrasi
(X) Y = konsentrasi kematian
X = log konsentrasi
Lampiran 11 (lanjutan)
2.3. Perhitungan harga LC50 untuk ekstrak etanol
Konsentrasi yang digunakan adalah 10, 100 dan 1000 µg/ml
Tabel 9: Perhitungan harga LC50 ekstrak n-heksan menggunakan metode Analisa
Regresi Linear
No Log Konsentrasi
(X) Y = konsentrasi kematian
Lampiran 11 (lanjutan)
a = ∑XY – (∑X∑Y)/n
∑X2- (∑X)2/n
=
506,66-(6.213,33)/ 3 14-(6)2/ 3= 506,66- 426,66 14-12
= 80 2
= 40 b = Y� - aX�
= 71,11 – 40.2 = 71,11 – 80 = -8,89 Y = aX + b
= 40 X – 8,89 Untuk Y = 50