BAB 2
TINJAUAN PUSTAKA
2.1 Kitosan
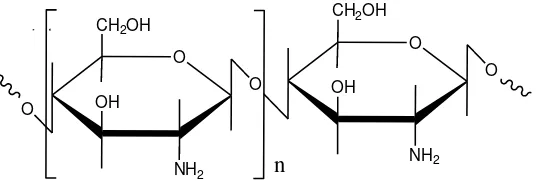
Kitosan adalah poli-(2-amino-2-deoksi-β-(1-4)-D-glokupiranosa) dengan rumus molekul (C6H11NO4)n yang dapat diperoleh dari deasetilasi kitin. Kitosan dijumpai secara alamiah di beberapa organisme. Kitosan bukan merupakan senyawa tunggal, tetapi merupakan kelompok yang terdeasetilasi sebagian dengan derajat polimerisasi yang berbeda (Sugita, 2009).
O
NH2
OH CH2OH
O
O
O
NH2
OH CH2OH
O
n
Gambar 2.1 Struktur Kitosan (Sugita, 2009).
2.1.1 Sifat-Sifat Kitosan
Kitosan merupakan padatan amorf yang berwarna putih kekuningan dengan rotasi spesifik [α]D 11 -3 hingga 10 (pada konsentrasi asam asetat 2%). Kitosan kebanyakan larut dalam asam organik pada kisaran pH 4,0, namun tidak larut pada pH lebih besar dari 6,5, juga tidak larut dalam pelarut air, alkohol, dan aseton. Dalam asam mineral pekat seperti HCl dan HNO3, kitosan larut pada konsentrasi 0,15-1,1%, tetapi tidak larut pada berbagai konsentrasi 10%. Kitosan tidak larut dalam H2SO4 pada berbagai konsentrasi, sedangkan di dalam H3PO4 tidak larut pada konsentrasi 1% sementara pada konsentrasi 0,1% sedikit larut.
Kitosan larut dalam pelarut organik, HCl encer, HNO3 encer, H3PO4 0,5% dan CH3COOH 1%, tetapi tidak larut dalam basa kuat dan H2SO4. Dalam kondisi asam berair, gugus amino (-NH2 ) kitosan akan menangkap H+ dari lingkungannya, sehingga gugus aminonya terprotonasi menjadi –NH3+. Gugus –NH3+ inilah yang menyebabkan kitosan bertindak sebagai garam, sehingga dapat larut dalam air. Selain itu, muatan positif –NH3+ dapat dimanfaatkan untuk adsorpsi zat warna anionik dan kation logam yang memanfaatkan keberadaan pasangan elektron bebas pada gugus – OH dan –NH2 (Sugita, 2009).
Kitosan dalam bentuk terprotonasi menunjukkan kerapatan muatan yang tinggi dan bersifat sebagai polielektrolit kationik dan sangat efektif berinteraksi dengan biomolekul bermuatan negatif dan biomolekul permukaan. Sedangkan dalam bentuk netralnya, kitosan mampu mengkompleks ion logam berat berbahaya seperti Cu, Cr, Cd, Mn, Co, Pb, Hg, Zn, dan Pd. Perilaku aliran polielektrolit kitosan ditentukan oleh konformasi molekular keseluruhan dan tingkat ikatan hidrogen atau tolakan elektrostatik antar segmen rantai yang bersebelahan (Rha, 1984).
2.1.2 Penggunaan Kitosan
Saat ini, penggunaan kitosan di berbagai bidang berkembang sangat pesat karena telah banyak penelitian yang membuktikan bahwa kitosan dan turunannya bermanfaat bagi kehidupan manusia, diantaranya adalah di bidang lingkungan, biologi, medis, farmasi, industri pangan dan fotografi.
a. Bidang Lingkungan
Kitosan lazimnya disintesis dari deasetilasi kitin yang berasal dari limbah kulit udang atau kepiting. Oleh karena itu, penggunaan kitosan sejak awal telah berperan dalam mengurangi pencemaran lingkungan. Manfaat kitosan dalam bidang lingkungan adalah untuk menjerap logam maupun zat warna yang banyak dihasilkan dari industri tekstil atau kertas
.
b. Bidang Biologi
Urea bersifat racun dan dihasilkan dalam proses pemurnian darah. Oleh karena itu, urea harus dihilangkan dari dalam tubuh. Menurut Liu et al., (2003) membran kitosan lebih baik bila dibandingkan dengan kitosan bentuk lainnya dalam hal menjerap urea karena memiliki permukaan yang luas, jalur difusi yang pendek, dan produktivitasnya yang tinggi.
c. Bidang Medis
d. Bidang Farmasi
Selain dapat menjerap zat organik, anorganik, atau logam berat, kitosan juga dapat menjerap golongan senyawa flavonoid. Penelitian Morsch et al., (2004) berhasil mengidentifikasi kitosan termodifikasi heptaldehida (Ch-Hp) sebagai adsorben untuk pemisahan kromatografi flavonoid dari A. moluccana. (Sugita, 2009).
e. Bidang Industri Pangan
Karena sifat kitin dan kitosan yang dapat mengikat air dan lemak, maka keduanya dapat digunakan sebagai media pewarnaan makanan, sebagai pengental dan pembentuk emulsi yang lebih baik daripada mikrokristalin selulosa.
f. Bidang Fotografi
Kitosan banyak digunakan terutama karena sifat resistansinya terhadap abrasi, karakteristik optik, kemampuan membentuk film dan interaksinya dengan kompleks perak sehingga ia dengan mudah ditembus oleh larutan yang membawa kompleks perak dari satu lapisan ke lapisan lain dari suatu film (Muzzarelli, 1977).
2.1.3 Modifikasi Kitosan
a. Dekanol EX841
Penautan silang dilakukan dengan menggunakan senyawa yang setidaknya memiliki 2 gugus fungsi. Salah satu contohnya ialah penautan silang serat kitosan dengan menggunakan dekanol EX841. Hasil penelitian tersebut menunjukkan bahwa kapasitas adsorpsi kitosan setelah penautan silang menurun dengan naiknya jumlah Dekanol EX841.
Glutaraldehid
Glutaraldehida merupakan agen penaut silang kitosan yang paling banyak digunakan. Glutaraldehid dapat menautsilangkan rantai kitosan melalui reaksi pembentukan basa Schiff (imina tersubstitusi, -CH=NR) antara gugus aldehida glutaraldehida dan gugus –NH2 kitosan. Kitosan tertaut silang glutaraldehida telah diterapkan untuk menjerap berbagai logam berat.
b. Epikolorohidrin
Agen penaut silang epikolorohidrin telah digunakan oleh Vieira dan Beppu (2006) serta Chen et al., (2008). Hasil tautan silangnya juga digunakan untuk menjerap logam berat. Berbeda dengan glutaraldehida, epikolorohidrin tidak beraksi dengan gugus –NH2, tetapi berekasi dengan gugus –OH primer.
c. Tripolifosfat
d. 1,6-Heksametilenadiisosianat
Agen 1,6-Heksametilenadiisosianat merupakan contoh lain penaut silang yang berikatan dengan gugus –OH primer kitosan. Agen tersebut digunakan untuk menautkan kitosan dengan β-siklodekstrin yang telah diteliti dapat mengikat kolesterol.
e. Asam Kloroasetat
Reaksi antara kitosan dan asam monokloroasetat akan menghasilkan N,O-karboksimetil kitosan (CMC) (Sun dan Wang, 2006). Pada penitian tersebut, CMC juga ditaut silangkan dengan glutaraldehida dan dilakukan pembuatan cetakan untuk Cu2+. Hasil yang diperolah menunjukkan bahwa kapasitas adsorpsi meningkat seiring dengan kenaikan derajat substitusi. Hal tersebut mengindikasikan bahwa gugus karboksil juga berperan dalam proses penjerapan (Sugita, 2009).
2.2 Karboksimetil Kitosan
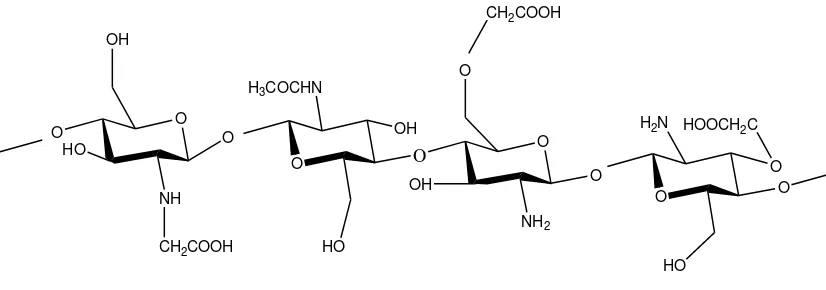
Karboksimetil kitosan merupakan salah satu turunan kitosan yang dapat diperoleh melalui suatu reaksi eterifikasi (karboksimetilasi) antara kitosan dengan asam monokloroasetat dalam suasana alkalis. Gugus karboksimetil dari asam monokloroasetat menstubtitusi gugus hidroksil dan gugus amin pada rantai kitosan. Pada prinsipnya, reaksi pembentukan karboksimetil kitosan adalah reaksi asam-basa. Salah satu faktor yang berpengaruh dalam pembentukan karboksimetil kitosan adalah suhu eterifikasi (Basmal dkk., 2005).
O
Gambar 2.2 Struktur Karboksimetil Kitosan (Sugita, 2009)
2.2.1 Sifat – Sifat Karboksimetil Kitosan
Karboksimetil kitosan terdapat dalam bentuk serbuk yang berwarna putih kotor hingga putih bersih. Adanya gugus karboksil dalam rantai karboksimetil kitosan membuatnya dapat larut dalam media netral, asam maupun basa. Karboksimetil kitosan merupakan bahan polimer yang sangat mudah larut. Sifat lain dari karboksimetil kitosan adalah daya adsorpsi dan retensi kelembapannya sehingga senyawa ini sangat penting di bidang kosmetik dan obat-obatan (Mourya et al., 2010).
2.2.2 Penggunaan Karboksimetil Kitosan
2.3 Adsorpsi
Secara umum, adsorpsi adalah suatu proses pemisahan komponen-komponen tertentu dalam fasa cair atau gas melewati suatu permukaan padat yang disebut adsorben, sedangkan komponen yang diserap disebut adsorbat. Berkas selektivitasnya yang tinggi, proses adsorpsi sangat sesuai untuk memisahkan bahan dengan konsentrasi yang kecil dari campuran yang mengandung bahan lain yang berkonsentrasi tinggi. Adsorbsi digunakan dalam air buangan industri, terutama untuk mengurangi komponen-komponen organik misalnya warna, fenol, detergen, zat toksik dan zat-zat organik yang susah diuraikan (Mc. Cabe dkk., 1999).
Ketika permukaan padatan dipaparkan pada molekul adsorbat, adsorbat akan membentur permukaan padatan, sehingga sebagian akan menempel di permukaan padatan dan terjerap, sedangkan yang lain terpantul kembali. Pada awalnya, laju adsorpsi cukup besar karena seluruh permukaan masih kosong. Namun, setelah waktu kontak semakin lama, permukaan yang terisi oleh molekul gas semakin banyak dan luas daerah kosong menyusut, sehingga laju adsorpsinya ikut menurun. Bersamaan dengan itu, laju desorpsi, yaitu laju pelepasan kembali molekul adsorbat, justru meningkat hingga tercapai suatu kesetimbangan dinamis adsorpsi-desorpsi.
Berdasarkan gaya yang terlibat, adsorpsi dapat dibedakan menjadi dua, yaitu adsorpsi fisik dan kimia. Adsorpsi fisik (fisisorpsi) hanya melibatkan gaya Van der Walls yang lemah antara adsorpsi, pertukaran atau pemakaian bersama elektron antara molekul adsorbat dan permukaan adsorben. Kekuatan interaksi adsorben-adsorbat berbanding lurus dengan kalor adsorpsinya. Kalor adsorbat proses kemisorpsi (40-400 kJ per mol) lebih besar hingga 20 kali lipat dibandingkan dengan gaya yang terdapat pada fisisorpsi, yaitu tidak lebih dari 10-20 kJ per mol (Sugita, 2009).
2.4 Pencemaran oleh Logam Berat
Toksisitas logam berat bisa dikelompokkan menjadi 3, yaitu bersifat toksik tinggi yang terdiri dari unsur-unsur Hg, Cd, Pb, Cu dan Zn; bersifat toksik sedang yang terdiri dari unsur-unsur Cr, Ni dan Co; dan bersifat toksik rendah yang terdiri atas unsur Mn dan Fe. Tingkat toksisitas logam berat terhadap hewan air, mulai dari yang paling toksik, adalah Hg, Cd, Zn, Pb, Cr, Ni dan Co. tingkat toksisitas terhadap manusia dari yang paling toksik adalah Hg, Cd, Ag, Ni, Pb, As, Cr, Sn, dan Zn (Widowati dkk. 2008).
Logam – logam tertentu sangat berbahaya jika ditemukan dalam konsentrasi tinggi dalam lingkungan, karena logam tersebut mempunyai sifat merusak tubuh makhluk hidup. Disamping hal tersebut, beberapa logam sangat diperlukan dalam proses kehidupan makhluk hidup. Dalam hal ini logam dapat dibagi menjadi dua bagian, yaitu logam esensial dan nonesensial. Logam esensial adalah logam yang sangat membantu di dalam proses fisiologis makhluk hidup dengan jalan membantu kerja enzim atau pembentukan organ dari makhluk yang bersangkutan. Sedangkan logam nonesensial adalah logam yang peranannya dalam tubuh makhluk hidup belum diketahui, kandungannya dalam jaringan hewan sangat kecil dan apabila kandungannya tinggi akan merusak organ – organ tubuh makhluk yang bersangkutan (Vogel, A.I., 1994).
2.5 Logam Timbal (Pb)
Logam ini sangat populer dan banyak dikenal oleh orang awam. Hal tersebut disebabkan oleh banyaknya timah hitam yang digunakan di pabrik dan paling banyak menimbulkan keracunan pada makhluk hidup (Darmono, 1995). Timbal memiliki nomor atom 82 dengan berat atom 207,20. Titik leleh timbal adalah 1740C dan memiliki massa jenis 11,34 g/cm3 (Widowati, 2008). Sifat-sifat dan kegunaan logam ini adalah :
- Mempunyai titik lebur yang rendah (327,46C) sehingga mudah digunakan dan murah biaya operasinya.
- Mudah dibentuk karena logam ini lunak
- Bila dicampur dengan logam lain membentuk logam campuran yang lebih bagus daripada logam murninya
Timbal adalah sejenis logam yang lunak dan berwarna coklat kehitaman, serta mudah dimurnikan dari pertambangan. Dalam pertambangan, logam ini berbentuk sulfida logam (PbS). Senyawa ini banyak ditemukan pada banyak pertambangan di seluruh dunia. Bahaya yang ditimbulkan oleh penggunaan timbal ini adalah sering menyebabkan keracunan ( Darmono, 1995).
2.5.1 Sumber Pencemaran Logam Pb
Timbal dapat masuk ke dalam sistem perairan melalui beberapa mekanisme di dalam daerah pertambangan dimana banyak ditemukan batu kapur (limestone) dan galena. Sistem perairan alami dapat mengandung timbal dengan konsentrasi sebesar 0,8 g l-1 , umumnya dihasilkan dari proses leaching dari cat yang menggunakan PbCrO4 atau dari instalasi pipa.
Sumber masuknya Pb ke lingkungan yang paling penting zaman sekarang ini berasal dari emisi kendaraan bermotor. Penggunaan timbal dalam jumlah yang besar adalah sebagai senyawa antiketuk dalam bensin. Meskipun pemakaiannya kini sudah menurun, masih saja pencemaran utama logam Pb berasal dari sumber ini. Makhluk hidup yang berada atau tinggal disekitar jalan raya dapat mengandung kadar logam Pb yang tinggi (Waite, 1984).
Timbal digunakan sebagai bahan untuk solder dan untuk penyambung pipa air, sehingga air untuk rumah tinggi kemungkinan dapat kontak dengan timbal. Air yang tersimpan dalam alat-alat yang dibuat dari hasil pematrian, untuk jangka waktu lama dapat mengakumulasi sejumlah timbal yang sangat tinggi (Achmad, 2004).
2.5.2 Toksisitas Logam Pb
Gejala khas dari keracunan Pb ini pada anak berbeda dengan orang dewasa. Kerusakan saraf perifer (saraf tepi) lebih umum daripada kerusakan saraf pusat yang dialami oleh anak-anak. Pada awal keracunan sampai 4 – 6 minggu mungkin tidak memperlihatkan gejala sama sekali. Kemudian berlanjut dengan kelemahan, sakit kepala, nafsu makan menurun yang diikuti dengan sakit perut dan muntah-muntah. Jika keracunan terus berlanjut maka gejala khas berikutnya akan menyusul yang pada akhirnya akan menyebabkan kematian.
Pada tahun 1953 Bayers dan Lord melaporkan bahwa anak yang telah menderita toksisitas Pb cenderung menunjukkan adanya gangguan tingkah laku pada masa dewasanya nanti, termasuk gangguan neurologinya. Anak tersebut menjadi bodoh, kesulitan dalam berpikir, gangguan tingkah laku termasuk aktivitas sehari-hari. Gamgguan mental juga dapat terjadi dan kerusakan otak secara permanen dapat terjadi pada keracunan yang parah.
Keracunan Pb pada orang dewasa biasanya terjadi di tempat mereka bekerja. Prevalensi keracunan Pb di tempat kerja telah banyak dilaporkan dan hasilnya bervariasi tergantung pada jenis industrinya. Gejala khas keracunan Pb pada orang dewasa ialah kepucatan, sakit perut, konstipasi, muntah-muntah, anemia, dan yang paling sering ialah terlihatnya warna biru “garis biru” pada gusi.
Di samping itu, hasil uji psikologi dan neuropsikologi menunjukkan terjadi penurunan daya ingat, kurang konsentrasi, sulit berbicara, kurang penglihatan, dan psikomotor. Neuropati saraf tepi tersebut dapat terlihat dengan adanya kelemahan otot dan gangguan sistem gerak, kelumpuhan pada berkas otot ekstensor pada tangan dan kaki. Kadang-kadang terjadi penurunan sistem daya sensor saraf yang mengakibatkan daya perasa berkurang ( Darmono, 1995).
2.6 Spektroskopi Infra-Red
panjang gelombang tersebut banyak kalor. Daerah spektrum tersebut selanjutnya disebut infra red. Spektroskopi infra merah ditujukan untuk maksud penentuan gugus-gugus fungsi molekul pada analisa kualitatif disamping untuk tujuan analisis kuantitatif (Mulja, 1995).
Spektrometer Infra-Red modern bekerja dengan menggunakan prinsip yang berbeda-beda. Susunan jalur optiknya menghasilkan suatu pola yang disebut dengan interferogram. Interferogram adalah sebuah sinyal yang kompleks tetapi polanya yang menyerupai gelombang memiliki semua bentuk frekuensi yang menyusun spektrum infra-red tersebut. Interferogram sebenarnya adalah plot intensitas versus waktu. Namun, ahli kimia lebih tertarik pada spektrum yaitu plot intensitas versus frekuensi. Suatu operasi matematika yang dikenal sebagai Fourier-Transform dapat memisahkan absorpsi frekuensi individual dari interferogram, sehingga menghasilkan spektrum yang identik dengan spektrum yang diperoleh dari spectrometer dispersive. Instrumen ini dikenal dengan Fourier Transform Infra-Red atau FT-IR. Kelebihan dari instrumen FT-IR adalah alat ini dapat memperoleh interferogram dalam waktu yang sangat cepat. Hal ini memungkinkan untuk memperoleh banyak interferogram dari sampel yang sama dan mengumpulkannya dalam memori komputer. Dengan demikian FT-IR dapat melakukan proses identifikasi dengan kecepatan dan sensitivitas yang lebih besar dari pada instrumen dispersi.
2.7 Spektrofotometer Serapan Atom
Penggunaan spektrofotometri serapan atom ke unsur-unsur lain semula merupakan akibat perkembangan spektroskopi pancaran nyala. Telah lama ahli kimia menggunakan pancaran radiasi oleh atom yang dieksitasikan dalam suatu nyala sebagai alat analitis. Pada tahun 1955, Walsh menekankan bahwa dalam suatu nyala yang lazim, kebanyakan atom berada dalam keadaan elektronik dasar bukannya dalam keadaan eksitasi. Misalnya untuk transisi yang menghasilkan garis natrium kuning pada 589 nm, rasio banyaknya atom tereksitasi terhadap keadaan dasar, pada 2700C, kira-kira adalah 6 × 10-4.. Selanjutnya ia mencatat bahwa fraksi atom-atom yang terekistasi berubah secara eksponensial dengan temperatur, dengan menaruh premium pada pengaturan nyala dalam studi pancaran, sedangkan dengan begitu sedikit atom yang tereksitasi, populasi keadaan dasar jauh kurang peka terhadap temperatur. Adsorpsi atom berkembang dengan cepat selama tahun 1960, instrumen komersial menjadi tersedia, dan teknik itu sekarang sangat meluas digunakan untuk penetapan sejumlah unsur, kebanyakan logam, dan sampel yang sangat beraneka ragam.
Sistem peralatan pada spektofotometer serapan atom adalah sebagai berikut : Tabung
katoda Pemotong Nyala berongga berputar
- + Monokromator Detektor Amplifier Recorder
Motor
Suplai daya Bahan bakar Sampel Oksigen
Gambar 2.3. Komponen-komponen spektrofotometer serapan atom (Day, 2002). 1. Sumber Sinar
2. Tempat sampel
Dalam analisis dengan spektrofotometri serapan atom, sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan gas. Ada berbagai macam alat yang dapat digunakan untuk mengubah suatu sampel menjadi uap atom-atom yaitu :
a. Nyala (Flame)
Nyala digunakan untuk mengubah sampel yang berupa padatan atau cairan menjadi bentuk uap atomnya, dan juga berfungsi untuk atomisasi. Pada cara spektrofotometri emisi atom, nyala ini berfungsi untuk mengeksitasikan atom dari tingkat dasar ke tingkat yang lebih tinggi.
Suhu yang dapat dicapai oleh nyala tergantung pada gas-gas yang digunakan, misalnya untuk gas batubara-udara, suhunya kira-kira sebesar 18000C, gas alam-udara 17000C, asetilen-udara 22000C, dan gas asetilen-dinitrogen oksida (N2O) sebesar 30000C.
b. Tanpa nyala (Flameless)
Proses pengatoman tanpa nyala dapat dilakukan dalam tungku dari grafit seperti tungku yang dikembangkan oleh Masmann. Sistem pemanasan dengan tanpa nyala ini dapat melalui tiga tahap yaitu pengeringan (drying) yang membutuhkan suhu yang rendah, pengabuan (ashing) yang membutuhkan suhu yang lebih tinggi karena untuk menghilangkan matriks kimia dengan mekanisme volatilisasi atau pirolisis, dan pengatoman (atomizing).
3. Monokromator
4. Detektor
Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat pengatoman. Biasanya digunakan tabung penggandaan foton (photomultiplier tube). Ada dua cara yang dapat digunakan dalam sistem deteksi yaitu yang memberikan respon terhadap radiasi resonansi dan radiasi kontinyu, dan yang hanya memberikan respon terhadap radiasi resonansi.
5. Readout
Readout merupakan suatu alat penunjuk atau dapat juga diartikan sebagai sistem pencatat hasil. Pencatat hasil dilakukan dengan suatu alat yang telah terkalibrasi untuk pembacaan suatu angka transmisi atau absorbsi (Rohman, A. 2007).
Gangguan yang nyata pada SSA sudah dijelaskan oleh persamaan Boltzmann. Pada penentuan nilai serapan atom seringkali didapatkan suatu harga yang tidak sesuai dengan konsentrasi unsur sampel yang ditentukan. Penyebab dari gangguan ini adalah faktor matriks sampel, faktor kimia akibat adanya gangguan molekuler yang bersifat menyerap radiasi.
Ada beberapa usaha untuk mengurangi gangguan kimia pada SSA yaitu dengan jalan :
- Menaikkan temperatur nyala agar mempermudah penguraian, untuk itu dipakai gas pembakar campuran C2H2 + N2O yang memberikan nyala dengan temperatur yang tinggi.
- Menambahkan elemen pengikat gugus atau atom penyangga, sehingga terikat kuat akan tetapi atom yang ditentukan bebas sebagai atom netral.