DISERTASI
PEMBENTUKAN PRODRUG KARBAMAZEPIN-ASAM AMINO
SEBAGAI UPAYA MEMPERBAIKI SIFAT FISIKOKIMIA DAN
BIOAVAILABILITAS KARBAMAZEPIN
(CARBAMAZEPINE-AMINO ACID PRODRUGS
TO IMPROVE PHYSICOCHEMICAL PROPERTIES
AND BIOAVAILABILITY OF CARBAMAZEPINE)
DEWI ISADIARTUTI
NIM 090970201
PROGRAM STUDI S3 MIPA
FAKULTAS SAINS DAN TEKNOLOGI
LEMBAR PENGESAHAN
Naskah disertasi ini telah disetujui Pada tanggal 10 Maret 2015
Oleh:
PROMOTOR
Prof. Dr. Tutuk Budiati, Apt., M.S
NIP. 194801261976032001
KO-PROMOTOR
Prof. Dr. Suwaldi Martodihardjo, Apt., M.Sc NIP 194805071976031001
Mengetahui,
DEKAN
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
Disertasi ini telah diuji pada Ujian Tertutup Tanggal: 11 Februari 2015
_____________________________________________________________________
PANITIA PENGUJI DISERTASI
Ketua : Dr. Alfinda Novi Kristanti, DEA.
Anggota : 1. Prof. Dr. Tutuk Budiati, Apt., M.S. (Promotor) 2. Prof. Dr. Suwaldi Martodihardjo, Apt., M.Sc. (Ko-Promotor) 3. Dr. Achmad Radjaram, Apt.
4. Dr. Fahimah Martak, M.Si.
5. Dr. Hari Basuki Notobroto, dr., M.Kes. 6. Prof. Dr. rer.nat. Moch.Yuwono, Apt., M.S. 7. Dr. Dwi Setyawan, S.Si., Apt., M.Si.
Ditetapkan dengan Surat Keputusan Dekan Fakultas Sains dan Teknologi
Universitas Airlangga Nomor: 119/UN3.1.8/2015
5.1.3 Uji Kemurnian dengan KLT ... 65
5.1.4 Identifikasi Senyawa Prodrug ... 66
5.2 KARAKTERISASI SIFAT FISIKOKIMIA ... 69
5.2.1 Karakterisasi Senyawa Prodrug dengan DTA ... 69
5.2.2 Karakterisasi Senyawa Prodrug dengan PXRD ... 71
5.2.3 Karakterisasi Senyawa Prodrug dengan Mikroskop ... 73
5.2.4 Kelarutan ... 74
5.2.5 Disolusi ... 88
5.2.6 Koefisien Partisi ... 98
5.3 BIOAVAILABILITAS ...100
5.4 HAL BARU DALAM PENELITIAN ...119
BAB VI KESIMPULAN DAN SARAN ...120
PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas segala Kasih Karunia, Hikmat, Bimbingan dan PertolonganNya, sehingga disertasi dengan judul "Pembentukan
Prodrug Karamazepin-Asam Amino Sebagai Upaya Memperbaiki Sifat
Fisikokimia dan Bioavailabilitas Karbamazepin” dapat diselesaikan dengan baik.
Sebagian hasil penelitian ini telah dipublikasikan pada International Journal of Pharmacy and Pharmaceutics Sciences Vol 6 issue 1, 2014 dengan judul "Solubility and Dissolution Study of Physical Mixture of Carbamazepine and Amino Acids".
Disertasi ini dapat diselesaikan berkat dukungan berbagai pihak, oleh karenanya pada kesempatan ini penulis menyampaikan terima kasih dan penghargaan setinggi-tingginya kepada:
1. Prof. Dr. Tutuk Budiati, Apt., M.S. selaku promotor yang telah berkenan meluangkan waktu untuk membimbing, mengarahkan, mendorong, memberikan nasihat dan semangat dalam menyelesaikan disertasi. Dari beliau, penulis belajar tentang ketelitian, kedisiplinan, keuletan dan berpikir kritis dalam menghadapi setiap persoalan.
2. Prof. Dr. Suwaldi Martodihardjo, Apt., M.Sc. selaku kopromotor, beliau juga pembimbing tesis penulis ketika menyelesaikan pendidikan S2 di Fakultas Farmasi Universitas Gadjah Mada yang telah berkenan memberikan bimbingan, arahan, dorongan dan nasehat yang tiada putusnya untuk senantiasa memperluas wawasan dan semangat dalam menyelesaikan disertasi. Dari beliau, penulis belajar tentang ketelitian, berpikir komprehensif, kerendahan hati dan kesabaran dalam menghadapi masalah.
3. Dr. Achmad Radjaram, Apt., Dra. Esti Hendradi, Apt., M.Si., Ph.D., Prof. Dr. Purwanto., Apt., Junaidi Khotib, S.Si., Apt., M.Kes., Ph.D., Dr. Alfinda Novi Kristanti, DEA, Dr. Fahimah Martak, M.Si., Dr. Hari Basuki Notobroto, dr., M.Kes., Prof. Dr. rer. nat. M. Yuwono, Apt., M.S., dan Dr. Dwi Setyawan, S.Si., Apt., M.Si. selaku penguji ujian kualifikasi, ujian proposal, ujian kelayakan dan ujian tertutup yang telah memberikan masukan, saran dan koreksi untuk perbaikan naskah disertasi ini.
4. Dirjen Pendidikan Tinggi Republik Indonesia yang telah memberikan bantuan beasiswa BPPS yang sangat bermanfaat dalam penyelesaian pendidikan Doktor ini dan bantuan dana Penelitian Unggulan Perguruan Tinggi melalui BOPTN Universitas Airlangga Tahun Anggaran 2012-2014.
5. Rektor Universitas Airlangga, Prof. Dr. H. Fasich, Apt., Direktur Pascasarjana Universitas Airlangga, Prof. Dr. Hj. Sri Hajati, SH, M.S, Dekan Fakultas Sains dan Teknologi Universitas Airlangga, Prof. Win Darmanto, Ph.D., Dekan Fakultas Farmasi Universitas Airlangga, Dr. Umi Athiyah, Apt., M.S., Ketua Program Studi S3 MIPA Prof. Dr. Ir. Suhariningsih yang kemudian digantikan oleh Prof. Dr. Bambang Irawan, M.Sc. yang telah memberikan kesempatan dan fasilitas bagi penulis untuk menempuh pendidikan program Doktor.
7. Para staf pengajar program S3 MIPA Universitas Airlangga, Prof. Dr. I Gde Nyoman Astika, Apt., Prof. Dr. Ir. Suhariningsih, Prof. Dr. Muhammad Zainuddin, Apt., Dr. dr. Widodo J. Pudjirahardjo, M.S., MPH, Prof. Win Darmanto Ph.D., Prof. Dr. Ni Nyoman Tri Puspaningsih, M.Si., Prof. Dr. rer. nat Moch. Yuwono, Apt., M.S., Prof. Dr. Amiruddin Prawita, Apt., Prof. Dr. Sudjarwo, Apt., M.S., Dr. Hari Basuki Notobroto, dr., M.Kes, Dr. A. Radjaram, Apt., Prof. Dr. Suwaldi Martodihardjo, Apt., M.Sc, Prof. Dr. Siswandono, Apt., Dra. Esti Hendradi, Apt., M.Si., Ph.D, Junaidi Khotib, S.Si, Apt., M.Kes., Ph.D., Drs. Marcellino Rudyanto, Apt., M.Si., Ph.D., yang telah memberikan ilmu dan wawasan yang berharga kepada penulis dalam mengikuti pendidikan program Doktor.
8. Drs. Marcellino Rudyanto, Apt., M.Si, Ph.D., selaku Ketua Departemen Kimia Farmasi, Dr. Budi Suprapti, Apt., M.Si., selaku Ketua Departemen Farmasi Klinik, Prof. Dr. Sukardiman, M.S, Apt., selaku Ketua Departemen Farmakognosi dan Fitokimia Fakultas Farmasi Universitas Airlangga atas dukungan fasilitas dalam mengerjakan penelitian disertasi ini.
9. Sejawat Dra. Emy Cholida, Apt, M.H. dan PT Mersifarma Tirmaku Mercusana Indonesia yang telah membantu pengadaan bahan Karbamazepin.
10 Teman-teman S3 MIPA Universitas Airlangga angkatan 2009, Dr. Isnani Darti, Dr. Agus Abdul Gani, Dr. drh. Benjamin Christofel Tehupuring, Dr. Ir. Eny Zulaeka, Dr. A.A. Istri Ratnadewi, Dr. Lanny Hartanti, Dr. Choirul Imron, Dr. Ir. Poppy Hardjo, , Dr. Akas Yekti Pulihasih, M.Si, Dr. Noor Hidajat, M.Si, Ir. Achmad Djunaidi, M.P, Dra. Wahyu Hidayatiningsih, M.Si. dan teristimewa sejawat Dr. Aniek Setiya Budiatin, Apt., M.Si., atas kerjasama dan dukungan selama menempuh pendidikan program Doktor.
11. Sejawat di Departemen Farmasetika, Drs. Bambang Widjaja, Apt., M.S., Dr. Dwi Setyawan, S.Si, Apt., M.Si, Dr. A. Radjaram, Apt., Dra. Retno Sari, Apt., M.Sc, Drs. Sugiyartono, Apt., M.S., M. Agus Sjamsyur R., S.Si, Apt., M.Si, Dini Retnowati, S.Farm., Dr. rer. nat M.L Ardhani, S.Si., M. Pharm, Helmy Yusuf, S.Si., Apt., M.Sc, PhD., Abhimata Pramanandana, S.Farm., Apt. yang dengan senang hati telah mendukung penulis dan menjadi teman diskusi dalam penyelesaian disertasi.
12. Dr. Juni Ekowati, Apt., M.Si, Dr. Riesta Primaharinastiti, S.Si., Apt., M.Si., Dra. Suzana, Apt., M.Si, Melanny Ika S., Apt., M.PharmSc, Kholis Amalia N., S.Farm., Apt., dari Departemen Kimia Farmasi yang telah mendukung dan memberi semangat dalam mengerjakan penelitian ini. Drs. Didik Hasmono, Apt., M.S., dari Departemen Farmasi Klinis yang telah membantu penulis dalam mengolah data in vivo.
14. Kedua orangtua penulis, Bp. Ismoeljono B.A. dan Ibu Atikah B.Sc, yang telah membesarkan dengan penuh kasih sayang dan mendidik dalam pengenalan takut akan Tuhan serta selalu mendoakan penulis tanpa berkeputusan. Kedua mertua Bp. (alm) Soeparno dan Ibu (alm) Soenarihati, yang telah memberikan dukungan dan kasih sayang dalam menjalani kehidupan.
15. Terima kasih tak terhingga kepada suami terkasih Dr. Kris Nugroho, M.A., yang telah setia mendukung dengan segenap pengorbanan dan kasih sayang serta doa yang senantiasa dipanjatkan, anak-anak terkasih Andre Bayu Nugroho dan Eunike Mustika Nugroho atas segala pengertian, pengorbanan dan kasih sayang yang telah diberikan selama penulis menunaikan tugas belajar.
16. Saudara dan saudara ipar terkasih, keluarga Dr. Heri Suroto, dr., SPOT (K)/drg. Isdiah Primawati, keluarga dr. Pria Istjahja Utama, Sp. PD./Dr. Damayanti Tinduh, dr., Sp. KFR., keluarga Dipl. Inf. Jesaya Widhia Nugraha/dr. Kartika Ishartadiati, M.Kes. beserta segenap keponakan yang telah mendukung dalam doa dan perhatian yang tak pernah surut selama penulis menyelesaikan program Doktor.
17. Segenap pihak yang telah membantu penelitian disertasi yang tidak dapat penulis sebutkan satu persatu dengan tidak mengurangi rasa hormat, penulis sampaikan terima kasih.
Akhirnya semoga penelitian ini dapat bermanfaat bagi kemajuan dan pengembangan ilmu farmasi, saran dan masukkan bagi kesempurnaan penelitian ini, penulis sambut dengan tangan terbuka. Kiranya Kasih Karunia Tuhan menyertai kita sekalian.
Maret 2015
DAFTAR GAMBAR
Hal
Gambar 1.1 Macam-macam NH asam ... 4
Gambar 2.1 Tahapan proses melarut ... 11
Gambar 2.2 Ilustrasi konsep prodrug ... 15
Gambar 2.3 Ilustrasi sederhana mewakili konsep prodrug ... 16
Gambar 2.4 Prodrug yang larut dalam cairan saluran cerna ... 18
Gambar 2.5 Skema disolusi dari permukaan partikel ... 20
Gambar 2.6 Proses absorbsi suatu obat …... 23
Gambar 2.7 Model membran plasma fluid mosaic ... 26
Gambar 2.8 Kurva kadar obat-waktu pemberian per oral ... 29
Gambar 2.9 Struktur molekul karbamazepin ... 32
Gambar 2.10 Morfologi kristal karbamazepin bentuk I, III, dan IV ... 35
Gambar 2.11 Gambar mikroskop cahaya morfologi KBZ III, I dan DH ... 35
Gambar 2.12 Struktur molekul glisin, alanin, dan lisin ... 39
Gambar 3.1 Kerangka konseptual penelitian ... 45
Gambar 4.1 Skema tahapan penelitian ... 48
Gambar 5.1 Struktur molekul senyawa awal dan senyawa prodrug ……. 62
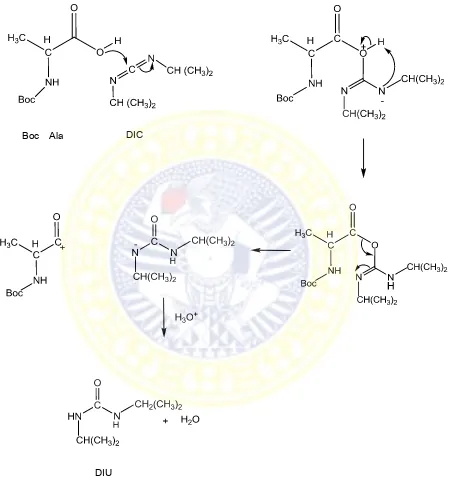
Gambar 5.2 Mekanisme Reaksi Tahap I ……... 63
Gambar 5.3 Mekanisme Reaksi Tahap II …………... 64
Gambar 5.4 Termogram DTA senyawa KBZ dan senyawa prodrug ……. 70 Gambar 5.5 Difraktogram PXRD senyawa hasil sintesis ... 72
Gambar 5.6 Mikrofoto senyawa KBZ dan senyawa prodrug ... 74
Gambar 5.7 Histogram kelarutan senyawa KBZ, CF dan prodrug ... 76
Gambar 5.8 Spektra FTIR KBZ dan senyawa prodrug ……….. 78
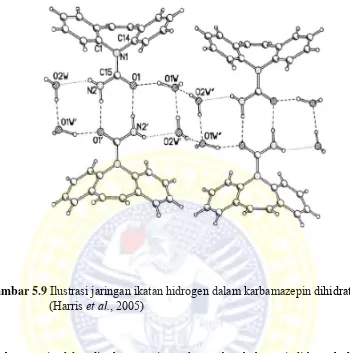
Gambar 5.9 Ilustrasi jaringan ikatan Hidrogen karbamazepin dihidrat ... 82
Gambar 5.10 Termogram DTA karbamazepin dan campuran fisik ... 83
Gambar 5.11 Termogram DTA KBZ dan CF terpapar media air ... 83
Gambar 5.12 Spektra FTIR KBZ dan CF ... 85
Gambar 5.13 Spektra FTIR KBZ dan CF terpapar media air ... 85
Gambar 5.15 Profil Disolusi KBZ, CF dan senyawa prodrug ... 90
Gambar 5.16 Profil disolusi KBZ dengan senyawa prodrug ……….. 91
Gambar 5.17 Profil disolusi KBZ dengan CF …………... 91
Gambar 5.18 Histogram log P KBZ dan senyawa prodrug ………. 98
Gambar 5.19 Profil bioavailabilitas KBZ, CF dan senyawa prodrug …….. 104
Gambar 5.20 Profil bioavailabilitas KBZ dengan senyawa prodrug …… 106
Gambar 5.21 Profil bioavailabilitas KBZ dengan CF …………………… 106
DAFTAR TABEL
Tabel 2.5 Profil farmakokinetika karbamazepin dalam keadaan puasa ... 37
Tabel 5.1 Identifikasi bahan penelitian karbamazepin ... 59
Tabel 5.2 Organoleptis senyawa prodrug ……….... 65
Tabel 5.3 Nilai Rf senyawa karbamazepin dan senyawa prodrug …………... 65
Tabel 5.4 Karakteristik spektra UV, FTIR, NMR senyawa PD-KBZ-GLI ... 66
Tabel 5.5 Karakteristik spektra UV, FTIR, NMR senyawa PD-KBZ-ALA ... 67
Tabel 5.6 Karakteristik spektra UV, FTIR, NMR senyawa PDKBZ-LIS ... 68
Tabel 5.7 Titik lebur senyawa prodrug dan campuran fisik ………... 69
Tabel 5.8 Karakteristik difraktogram karbamazepin dan senyawa prodrug.... 72
Tabel 5.9 Anova Kelarutan ………. 77
Tabel 5.10 Perbandingan prediksi kelarutan dengan hasil penelitian ………... 80
Tabel 5.11 Termogram DTA KBZ, CF dan CF terpapar media air... 84
Tabel 5.12 Spektra FTIR KBZ, CF dan CF terpapar media air ……… 86
Tabel 5.13 Anova Disolusi ……… 94
Tabel 5.14 Harga k disolusi ………... 96
Tabel 5.15 Persentase KBZ terlarut 30´ dan AUC30 ………. 97
Tabel 5.16 Anova nilai log koefisien partisi ………... 99
Tabel 5.17 Nilai ka ... 111
Tabel 5.18 Nilai kel ... 113
Tabel 5.19 Perhitungan ka, kel, dan tmaks ……….... 113
Tabel 5.20 Parameter farmakokinetika ……… 114
Tabel 5.21 Uji Kruskal-Wallis Cmaks ……… 115
Tabel 5.22 Uji Kruskal-Wallis C2 jam ………. 115
DAFTAR LAMPIRAN
Hal
Lampiran 1 Sertifikat Analisis Karbamazepin ………... 129
Lampiran 2 Identifikasi Senyawa Awal Karbamazepin ... 130
Lampiran 3 Termogram DTA Senyawa Prodrug ... 132
Lampiran 4 Spektra UV Senyawa Prodrug ... 133
Lampiran 5 Spektra FTIR Senyawa Prodrug ... 134
Lampiran 6 Spektra NMR Senyawa Prodrug ... 136
Lampiran 7 Difraktogram PXRD Senyawa Prodrug ... 142
Lampiran 8 Kurva Baku Senyawa Karbamazepin ... 144
Lampiran 9 Kurva Baku Senyawa Prodrug ... 145
Lampiran 10 Data Uji Kelarutan ... 148
Lampiran 11 Anova Uji Kelarutan ... 151
Lampiran 12 Data Uji Disolusi ... 153
Lampiran 13 Konstante Laju Disolusi ... 156
Lampiran 14 Anova Uji Disolusi ... 157
Lampiran 15 Data Uji Koefisien Partisi ... 159
Lampiran 16 Anova UJi Koefisien Partisi ... 162
Lampiran 17 Sertifikat Uji Etik ... 164
Lampiran 18 Validasi Metode HPLC ... 165
DAFTAR SINGKATAN
AA = asam amino
ALA = alanin
AUC = area under curve
BCS
Boc = = t-butoksikarbonil biopharmaceutical classification system
CF = campuran fisik = differential thermal analysis = diisopropilurea
HPLC = high pressure liquid chromatography
FTIR = fourier transform infra red
kel = konstante laju eliminasi
ka = konstante laju absorbsi
kdis = konstante laju disolusi
KBZ-AA-1 = campuran fisik karbamazepin asam amino
KBZ-AA-2 = senyawa prodrug karbamazepin asam amino
PEMBENTUKAN PRODRUG KARBAMAZEPIN-ASAM AMINO
SEBAGAI UPAYA PENINGKATAN SIFAT FISIKOKIMIA DAN
BIOAVAILABILITAS KARBAMAZEPIN
Dewi Isadiartuti
INTISARI
Karbamazepin (KBZ) merupakan obat antiepilepsi lini pertama, termasuk BCS (Biopharmaceutical Classification System) kelas II mempunyai permeabilitas melewati membran tinggi dan kelarutan dalam air rendah. Kelarutan KBZ dalam air rendah, sehingga disolusi merupakan tahap penentu kecepatan absorbsi dan bioavailabilitasnya tidak menentu ketika digunakan secara oral. Penelitian ini bertujuan untuk meningkatkan kelarutan KBZ melalui pembentukan senyawa prodrug dengan gugus promoeity asam amino glisin (GLI), alanin (ALA) dan lisin (LIS), sehingga dapat memperbaiki bioavailabilitasnya ketika digunakan secara oral. Pembentukan senyawa prodrug PD-KBZ-GLI, PD-KBZ-ALA, dan PDKBZ-LIS dilakukan dengan menambahkan diisopropilkarbodiimida (DIC) dan direaksikan pada suhu 0 ºC.
Hasil identifikasi dengan DTA, FTIR, dan NMR menunjukkan senyawa prodrug PD-KBZ-GLI, PD-KBZ-ALA, dan PD-KBZ-LIS telah terbentuk. Karakterisasi fisikokimia senyawa prodrug dengan DTA, PXRD, dan mikroskop optik menunjukkan senyawa prodrug memiliki karakteristik yang berbeda dibandingkan senyawa awal KBZ. Titik lebur senyawa prodrug sebesar 179,6, - 188,8 ºC lebih rendah daripada senyawa KBZ sebesar 192,6 ºC. Kelarutan senyawa prodrug dalam media air suling (pH 6,8 ± 0,05 dan suhu 37 ± 0,5 ºC) meningkat sebesar 533,44 - 748,38 μg/mL dari senyawa KBZ sebesar 278,62 μg/mL. Efisiensi disolusi dalam 30 menit (ED30) KBZ meningkat dari 13,69 % untuk KBZ menjadi sebesar 37,90 -
64,27 %. Senyawa prodrug memiliki harga log koefisien partisi (log P) dalam pelarut oktanol/air (suhu 37 ± 0,5ºC) sebesar 1,13 - 1,89, dan nilai tersebut lebih kecil dibandingkan log P senyawa KBZ sebesar 2,41. Uji bioavailabilitas terhadap kelinci jantan jenis New Zaeland menunjukkan senyawa prodrug mampu mempersingkat
tmaks dari senyawa KBZ sebesar 6,14 jam menjadi sebesar 1,63 - 2,77 jam, senyawa
prodrug PD-KBZ-ALA dan PD-KBZ-LIS menunjukkan peningkatan kadar maksimal (Cmaks) KBZ dalam plasma darah dari 2,56 μg/mL pada senyawa KBZ menjadi
berturut-turut sebesar 4,38 dan 6,75 μg/mL serta senyawa prodrug PD-KBZ-ALA dan PD-KBZ-LIS juga menunjukkan peningkatan AUC0-12 dari senyawa KBZ sebesar
CARBAMAZEPINE-AMINO ACID PRODRUGS TO IMPROVE PHYSICOCHEMICAL PROPERTIES AND
BIOAVAILABILITY OF CARBAMAZEPINE
Dewi Isadiartuti
ABSTRACT
Carbamazepine (CBZ) is the first-line treatment of epilepsy, including BCS II which is characterized by high membrane permeability and low solubility in water. The limited solubility of CBZ causes the low dissolution rate of this drug hence results in the low absorption and low bioavailability of CBZ when given orally. One strategy that can be done to overcome the problems associated with limited solubility of CBZ is the formation of prodrug to enhance its solubility. Therefore, this research is aimed to increase solubility of carbamazepine by the formation of CBZ prodrug with promoeity group of amino acid glycine (GLY), alanine (ALA) and lysine (LYS). The formation of prodrug PD-CBZ-GLY, PD-CBZ-ALA and PD-CBZ-LYS are done by adding diisopropylcarbodiimide (DIC) followed by reaction at 0 °C. Identification of the formed compounds are conducted by using DTA, FTIR and NMR. The results obtained show formation of the prodrug PD-CBZ-GLY, PD-CBZ-ALA and PD-CBZ-LYS. Furthermore, the physicochemical characterization of the prodrug is done by using DTA, PXRD and optical microscope. From the results obtained, the prodrug compounds have different characteristics with the CBZ. The melting point of prodrug compounds are 179.6 - 188.8 °C. These values are lower than CBZ which has melting point 192.6 °C. Solubility of the prodrugs in distilled water (pH 6.8 ± 0.05 and T = 37 ± 0.5 ºC) are 533.44 - 748.38 μg/mL higher compared to the solubility CBZ (278.62 μg/mL). Dissolution efficiency within 30 min of the CBZ also increases from 13.69 % for CBZ to 37.90 - 64.27 % for the prodrug compounds. The partition coefficient values (log P) of the prodrugs in octanol/ water at 37 ± 0.5 °C are 1.13 - 1.89. Those values are lower than the log P of CBZ (2.41).The bioavailability study is conducted on male New Zealand Rabbits demonstrated that the formation of prodrug compounds are able to shorten the tmax from 6.14 hours for CBZ to 1.63 - 2.77 hours;
increase the maximum plasma concentration (Cmax) of CBZ from 2.56 μg/mL for CBZ
to 4.38 and 6.75 μg/mL for PD-CBZ-ALA and PD-CBZ-LYS, respectively and also increase the AUC0-12 from 20.59 μg hrs/mL to 21.99 dan 34.48 μg hrs/mL,
respectively. From the results obtained, it can be concluded that the formation of prodrug CBZ-amino acid with promoeity group of GLY, ALA and LYS are able to increase the solubility and the dissolution rate of CBZ, and also reduce the value of log partition coefficient. Based on the bioavalability study, prodrug of PD-CBZ-ALA and PD-CBZ-LYS are able to increase the bioavailability of CBZ. Furthermore, PD-CBZ-LYS is the chosen prodrug which is promising for the further development in order to improve solubility as well as bioavailability of CBZ. Additionally, careful consideration has to be given when choosing the proper promoeity group for the formation of prodrug of CBZ-amino acid therefore a safe and effective CBZ prodrug can be obtained.
Proverbs 21 : 30
BAB I
PENGANTAR
1.1 LATAR BELAKANG
Penemuan obat baru memerlukan waktu sekitar 8 sampai 12 tahun dan biaya yang sangat besar mulai dari proses obat ditemukan, disintesis sampai dipasarkan. Salah satu terobosan dalam menghemat biaya dan waktu dalam pengembangan obat adalah dengan memperbaiki sifat-sifat senyawa obat yang telah diketahui efek farmakologinya. Seringkali senyawa obat yang telah diketahui efek farmakologinya memiliki sifat-sifat biofarmasetika yang tidak menguntungkan karena parameter fisikokimia yang tidak optimal (Chen et al., 2006; Stegemann, et al., 2007).
Pengembangan bentuk sediaan farmasi tidak dapat dilepaskan dari parameter fisikokimia bahan obat. Parameter fisikokimia yang berperan dalam menghasilkan sediaan obat yang aman, efektif, dan berkualitas di antaranya adalah kelarutan, lipofilisitas, dan stabilitas (Chen et al., 2006). Kelarutan bahan obat dalam air merupakan sifat fisikokimia yang selalu menjadi perhatian formulator dalam mengembangkan sediaan farmasi (Avis et al., 1992; Dressmann, 2007). Suatu bahan obat harus berada dalam keadaan terlarut agar dapat memberikan aktivitas farmakologi (Steggemann et al., 2007; Stella dan Nti-Addae, 2007).
Struktur molekul berperan dalam menentukan kelarutan suatu senyawa. Perbandingan gugus polar dan nonpolar pada suatu senyawa akan memengaruhi kelarutan senyawa dalam air. Senyawa yang dominan memiliki gugus polar mempunyai kemampuan membentuk ikatan hidrogen lebih besar dengan air. Menurut Hildebrand kemampuan suatu senyawa membentuk ikatan hidrogen dengan air merupakan faktor penentu kelarutan senyawa dalam air (Sinko, 2011).
perlu ditangani dengan cepat untuk mengendalikan resiko kerusakan otak permanen. Angka kematian untuk orang dewasa yang mengalami status epilepticus ini mencapai sekitar 20%. Efek samping karbamazepin terhadap perubahan tingkah laku maupun kemampuan kognitif lebih rendah dibandingkan antikonvulsan lain seperti fenitoin, fenobarbital, dan primidon (Mc Namara, 2001; Pearce et al., 2002).
Karbamazepin merupakan bahan obat yang praktis tidak larut dalam air (120 µg/mL pada suhu 25C) (Koester et al., 2004) dan mempunyai koefisien partisi 2,45 dalam oktanol/air (Moffat et al., 2004). Karbamazepin mempunyai empat bentuk polimorf anhidrat dan satu bentuk dihidrat (Javadzadzadeh et al., 2009; Mahalaxmi et al., 2009; Šehić, 2008; Grzesiak et al., 2003). Keempat bentuk polimorf anhidrat karbamazepin dalam media air akan berubah menjadi bentuk dihidrat yang mempunyai kelarutan lebih rendah dibandingkan bentuk polimorfnya (Grzesiak et al., 2003). Efektivitas sediaan tablet karbamazepin yang disimpan pada suhu ruangan, diketahui berkurang sampai sepertiganya. Paparan lembap udara pada tablet karbamazepin menyebabkan efektivitas karbamazepin berkurang karena terjadi perubahan bentuk polimorf anhidrat menjadi bentuk dihidrat (Sweetman dan Sean, 2009).
Berdasarkan Biopharmaceutics Classification System (BCS), karbamazepin termasuk golongan obat kelas II, mempunyai sifat permeabilitas tinggi dan kelarutan dalam air rendah (Amidon et al., 1995). Karbamazepin mempunyai tempat aksi di susunan saraf pusat, oleh karena itu karbamazepin harus memiliki karakteristik fisikokimia optimal agar dapat melewati sawar darah-otak. Kemampuan obat menembus sawar darah-otak ditentukan oleh permeabilitasnya. Senyawa-senyawa yang memiliki koefisien partisi kurang dari 3 mempunyai permeabilitas yang cukup untuk dapat menembus sawar darah-otak (Rautioa et al., 2008).
intravena. Hal tersebut mendorong para peneliti terus mengembangkan penelitian untuk mendapatkan metode peningkatan kelarutan karbamazepin.
Kelarutan bahan obat dapat diperbaiki melalui modifikasi molekul secara kimia dan pendekatan formulasi. Modifikasi molekul kimia dengan membentuk prodrug telah dilakukan Hemenway et al. (2010) yaitu dengan menambahkan gugus glisin dan asetil untuk meningkatkan kelarutan karbamazepin. Selain melalui pendekatan modifikasi kimia, beberapa pendekatan formulasi telah dilakukan untuk meningkatkan kelarutan karbamazepin di antaranya penggunaan kosolven atau surfaktan, pembentukan kompleks siklodekstrin, metode kogrinding dengan menggunakan matriks hidrofilik, pembentukan dispersi padat dengan PEG/campuran polimer, dan dengan pembentukan kokristal. Metode tersebut mampu meningkatkan kelarutan karbamazepin (Koester et al., 2004; Jalali et al., 2006; Isadiartuti et al., 2009; Bley et al., 2010; Shikhar et al., 2011).
Sekitar 5-7% obat yang disetujui Food and Drug Administration (FDA) dapat diklasifikasikan sebagai prodrug. Prodrug merupakan molekul yang tidak aktif secara farmakologi yang membutuhkan transformasi enzimatik dan atau kimia untuk melepaskan senyawa bentuk aktif dalam tubuh sebelum memberikan efek terapi. Pelepasan senyawa aktif dan promoeity dapat terjadi sebelum, selama atau sesudah absorbsi atau pada tempat aksi obat. Proses biokonversi di dalam tubuh dimediasi oleh adanya enzim-enzim yang terdapat di dalam darah, hati, dan jaringan lain (Stella dan Nti-Addae, 2007; Rautio aet al., 2008; Rautio b et al., 2008; Han, 2000).
proton pada gugus NH asam (Gambar 1.1) dapat memberikan pengaruh besar terhadap
energi kisi kristal, kelarutan, laju disolusi, dan permeabilitas. memiliki gugus imida dalam struktur molekulnya. Prodrug fosfenitoin dibentuk dari fenitoin dengan menggantikan satu proton pada gugus NH tipe imida fenitoin dengan suatu gugus fosfonooksimetil. Fosfenitoin merupakan salah satu bentuk prodrug yang mampu meningkatkan kelarutan fenitoin dari 20-25 µg/mL menjadi 140 mg/mL. Selain itu fosfenitoin juga memberikan bioavailabilitas dan profil keamanan lebih baik dibandingkan bentuk garam natrium fenitoin (Stegemann et al., 2007; Rautiob et al.,
2008).
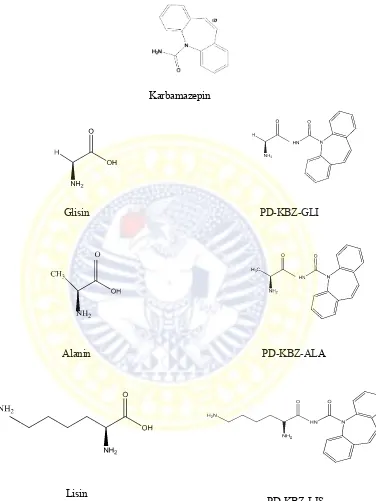
Asam amino mempunyai struktur molekul H2NCHRCOOH, dengan R merupakan
rantai samping berupa gugus organik. Glisin merupakan asam amino yang tidak memiliki rantai samping R, alanin memiliki rantai samping gugus R non polar (CH3),
dan lisin memiliki rantai samping bersifat basa NH2(CH2)4 (Murray, 2008; Fessenden
dan Fessenden, 1982). Ketiga asam amino tersebut merupakan asam amino alifatik yang dapat membentuk ikatan hidrogen dengan air. Kemampuan membentuk ikatan hidrogen pada senyawa tersebut berpotensi dalam meningkatkan kelarutan dalam air.
Karbamazepin dengan gugus promoeity asam amino dapat membentuk ikatan serupa peptida. Pembentukan ikatan peptida dapat dibuat dengan menambahkan carbodiimida. Ikatan peptida dapat dibentuk karena gugus karboksil dari salah satu asam amino bereaksi dengan gugus amino dari asam amino lainnya. Carbodiimida berperan dalam mengaktifkan gugus karboksil terhadap nukleofilik nitrogen. Salah satu bentuk carbodiimida yang paling banyak digunakan sebagai reagen kopling dalam larutan adalah diisopropilkarbodiimida (DIC) (Benoiton, 2006).
gugus karboksil asam amino membentuk ikatan hidrogen (Qiao et al., 2011). Interaksi yang terjadi antara kedua senyawa tersebut dapat menurunkan sudut kontak antara karbamazepin dengan media air dan meningkatkan pembasahan karbamazepin sehingga meningkatkan kelarutan karbamazepin (Sinko, 2011).
1.2 RUMUSAN MASALAH
Karbamazepin merupakan pilihan utama dalam terapi antiepilepsi, dibutuhkan
untuk keadaan segera. Kelarutan karbamazepin dalam air yang rendah mengakibatkan disolusi merupakan tahap penentu kecepatan bioavailabilitas pada penggunaan secara oral dan tidak tersedia bentuk sediaan injeksi intravena.Berdasarkan uraian di atas perlu diupayakan peningkatan kelarutan karbamazepin dengan membentuk prodrug yang lebih larut dalam air. Dengan menggantikan satu proton pada gugus NH amida karbamazepin dengan gugus asam amino akan memberikan pengaruh besar terhadap energi kisi kristal, kelarutan, kecepatan disolusi, dan permeabilitasnya (Stellaet al., 2007). Pembentukan prodrug dalam penelitian ini menggunakan gugus promoeity asam amino alifatik yang larut dalam air dengan perbedaan rantai samping yaitu glisin, alanin, dan lisin. Pembentukan senyawa prodrug karbamazepin dengan gugus promoeity asam amino dilakukan dengan penambahan carbodiimida. Pembentukan prodrug karbamazepin-asam amino memungkinkan karbamazepin dapat segera dilepas di dalam tubuh oleh enzim-enzim peptidase yang terdapat dalam darah, hati, dan jaringan lain menjadi senyawa aktif karbamazepin.
1.2.1 Rumusan Masalah Umum :
1.2.2 Rumusan Masalah Khusus :
1. Apakah senyawa turunan karbamazepin sebagai prodrug dengan gugus promoeity asam amino (glisin, alanin, atau lisin) dapat dibuat dari senyawa awal karbamazepin ?
2.Bagaimanakah sifat fisikokimia (kelarutan, disolusi, dan koefisien partisi)
senyawa prodrug PD-KBZ-GLI, PD-KBZ-ALA, atau PD-KBZ-LIS
dibandingkan senyawa awal karbamazepin?
3. Bagaimanakah bioavailabilitas (tmaks,Cmaks, dan AUC) senyawa prodrug
PD-KBZ-GLI, PD-KBZ-ALA, atau PD-KBZ-LIS dibandingkan senyawa awal karbamazepin ?
4. Senyawa prodrug manakah yang memiliki sifat fisikokimia dan bioavailabilitas optimal ?
1.3 TUJUAN PENELITIAN
1.3.1 Tujuan Umum :
Penelitian ini bertujuan untuk membuat senyawa prodrug karbamazepin dengan gugus promoeity asam amino glisin, alanin, atau lisin sehingga kelarutan karbamazepin dapat meningkat yang akan berdampak pada perbaikan bioavailabilitas karbamazepin.
1.3.2 Tujuan Khusus :
1. Membuat prodrug karbamazepin dengan gugus promoeity asam amino: glisin, alanin atau lisin.
3. Membuktikan pembentukan prodrug karbamazepin dengan gugus promoeity asam amino (glisin, alanin, atau lisin) dapat memperbaiki bioavailabilitas karbamazepin.
4. Menentukan senyawa prodrug karbamazepin-asam amino yang memiliki sifat fisikokimia dan bioavailabilitas optimal.
1.4 MANFAAT PENELITIAN
1.4.1 Manfaat Akademik :
Temuan dalam penelitian ini dapat memberi informasi ilmiah tentang sifat fisikokimia dan bioavailabilitas karbamazepin dalam bentuk prodrug karbamazepin dengan gugus promoeity asam amino glisin, alanin, atau lisin.
1.4.2 Manfaat Praktis :
BAB II
TINJAUAN PUSTAKA
2.1 TINJAUAN TENTANG SIFAT FISIKOKIMIA
Bentuk sediaan farmasi dibuat sesuai dengan sifat-sifat fisikokimia dan tujuan penggunaannya. Masing-masing bentuk sediaan dibuat untuk tujuan pemakaian tertentu, terdapat sediaan dalam bentuk cair, semi padat dan padat. Langkah awal yang harus dilakukan untuk dapat memutuskan bentuk sediaan yang tepat adalah dengan melakukan studi praformulasi.
Studi praformulasi dikenalkan oleh Akers (1976), praformulasi adalah karakterisasi fisikokimia senyawa padat atau larutan. Studi praformulasi meliputi semua studi yang berperan dalam senyawa obat baru yang merupakan kunci informasi penting untuk mengarahkan formulator dan analis pada pengembangan bentuk sediaan yang stabil dan bioavalabilitas yang bagus. Praformulasi yang baik akan membawa formulasi yang sederhana dan bagus serta produk komersial yang berhasil (Avis et al., 1992; Gibson, 2004). Sifat-sifat fisikokimia senyawa obat dapat dilihat pada Tabel 2.1.
menguntungkan seringkali membutuhkan waktu dan biaya yang tinggi dalam mengembangkan sediaan. Untuk mengatasi masalah ini dan memilih senyawa yang terbaik dari sudut pandang biofarmasetika, maka parameter seperti kelarutan, lipofilisitas dan stabilitas perlu dievaluasi sedini mungkin. Pemilihan senyawa yang memiliki sifat fisikokimia sesuai serta stabilitas secara kimia dan fisika bagus akan memudahkan dalam formulasi. Selain itu pemilihan formulasi yang rasional dapat digunakan untuk uji preklinik, farmakokinetika dan toksikologi lebih lanjut (Chen et al., 2006; Aulton, 1988).
2.1.1 Tinjauan Tentang Kelarutan
Kelarutan didefinisikan dalam besaran kuantitatif sebagai konsentrasi zat terlarut dalam larutan jenuh pada suhu dan tekanan tertentu dan secara kualitatif didefinisikan sebagai interaksi spontan dari dua atau lebih zat membentuk dispersi molekuler (Sinko, 2011). Definisi kelarutan menurut Farmakope Indonesia IV (FI IV) adalah seperti yang tertera pada Tabel 2.2 (Depkes, 1995).
Tabel 2.2. Definisi kelarutan menurut FI IV(Depkes, 1995)
Kelarutan senyawa obat merupakan faktor penentu kritis dalam sediaan farmasi, karena kelarutan senyawa obat dalam air menunjukkan jumlah senyawa yang akan melarut. Kelarutan bahan obat dalam air merupakan sifat fisikokimia yang selalu menjadi perhatian formulator dalam mengembangkan sediaan farmasi. Bahan obat yang akan dikembangkan menjadi bentuk sediaan farmasi untuk berbagai tujuan rute pemakaian
Istilah Kelarutan diperlukan untuk melarutkan 1 Jumlah bagian pelarut yang bagian zat
Sangat mudah larut Kurang dari 1
Mudah larut 1 sampai 10
Larut 10 sampai 30
Agak sukar larut 30 sampai 100
Sukar larut 100 sampai 1000
Sangat sukar larut 1000 sampai 10000
harus mampu menunjukkan kelarutan dalam air, karena suatu senyawa obat harus larut dalam air untuk dapat diabsorbsi dari tempat pemberian dan memberikan efek terapi yang diinginkan (Shargel et al., 2005; Aulton, 1988).
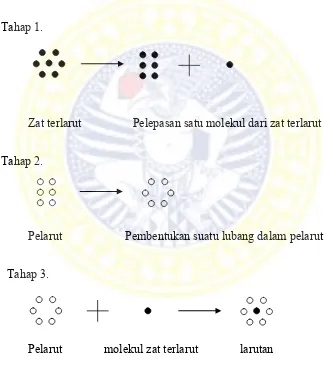
Kelarutan senyawa obat tergantung dari zat terlarut, pelarut dan lingkungan tempat senyawa obat melarut. Kelarutan suatu senyawa tergantung pada energi pelarutan dari zat terlarut di dalam pelarut untuk mengatasi energi kisi kristal zat terlarut dan energi untuk membuat ruang dalam pelarut. Proses melarut terjadi dalam tiga tahap yang dapat digambarkan pada Gambar 2.1.
Tahap 1.
Zat terlarut Pelepasan satu molekul dari zat terlarut
Tahap 2.
Pelarut Pembentukan suatu lubang dalam pelarut
Tahap 3.
Pelarut molekul zat terlarut larutan
Gambar 2.1. Tahapan proses melarut (Florence dan Attwood, 2006; Sinko, 2011)
Tahap 1 menyangkut pemindahan satu molekul dari fase terlarut pada suhu tertentu melibatkan kerja sebesar w22.. Tahap 2 menyangkut pembentukan lubang dalam pelarut
yang cukup besar untuk menerima molekul zat terlarut melibatkan kerja sebesar w11. Tahap
3, molekul zat terlarut akhirnya ditempatkan dalam lubang pelarut melibatkan kerja sebesar -2w12. Kerja yang terlibat dalam ketiga tahapan proses melarut dapat dinyatakan sebagai
w22+w11-2w12. Interaksi zat terlarut dengan pelarut pada tahap akhir melibatkan kerja
sebesar -2w12, merupakan ikatan yang terbentuk antara molekul zat terlarut dengan molekul
pelarut (Florence dan Attwood, 2006; Sinko, 2011).
Kelarutan dipengaruhi oleh sifat fisikokimia dan struktur molekul suatu senyawa obat serta pelarut yang melingkupinya, termasuk berat molekul, bentuk molekul, polaritas, lipofilisitas, kekuatan ionisasi dan ukuran zat terlarut. Kelarutan juga ditentukan oleh sifat pelarut yang digunakan seperti pH larutan, ikatan hidrogen antara molekul obat dengan pelarut (Sinko, 2011; Florence dan Attwood, 2006). Sebagian besar obat merupakan elektrolit lemah dan dalam larutan terdisosiasi menjadi bentuk terion (unionized) dan tak terion (ionized). Kelarutan bentuk ini dipengaruhi oleh pH larutan, sehingga pH turut berpengaruh terhadap sifat fisikokimia seperti koefisien partisi, stabilitas, termasuk juga kelarutan suatu senyawa obat (Sinko, 2011).
Kelarutan dalam air yang rendah disebabkan oleh dua faktor utama yaitu, lipofilisitas yang tinggi dan interaksi intermolekuler yang kuat. Hansch et al. mengamati hubungan kelarutan suatu zat dengan koefisen partisi dan titik lebur sebagaimana dinyatakan dengan persamaan 2.1 (Sinko, 2011; Yalkowsky, 1981).
Log Sw = - log P - 0,01 MP + 0,5 ... (2.1)
dengan Sw adalah kelarutan senyawa dalam air, P (partition coefficient) adalah koefisien
partisi dan MP adalah titik lebur dalam derajat Celsius. Persamaan 2.1 bermanfaat dalam
Koefisien partisi suatu turunan senyawa yang meningkat akan mengurangi Sw sekaligus menurunkan titik lebur dan secara keseluruhan meningkatkan kelarutan dalam air (Sw)
(Yalkowsky, 1981).
Struktur molekul senyawa berperan dalam menentukan lipofilisitas. Perbandingan gugus polar dan nonpolar pada suatu senyawa akan memengaruhi kelarutan senyawa dalam air. Senyawa yang dominan memiliki gugus polar mempunyai kemampuan membentuk ikatan hidrogen lebih besar dengan air. Menurut Hildebrand kemampuan suatu senyawa membentuk ikatan hidrogen dengan air merupakan faktor penentu kelarutan senyawa dalam air (Sinko, 2011).
Beberapa metode peningkatan kelarutan senyawa obat: 1. Modifikasi Kristal
Modifikasi kristal merupakan salah satu cara yang dapat dilakukan untuk meningkatkan kelarutan dan laju disolusi obat. Suatu bahan obat dapat berada dalam dua atau lebih fase kristal yang memiliki konformasi dalam kisi kristal berbeda (polimorf). Polimorf obat yang berbeda memiliki struktur kimia sama tetapi menunjukkan sifat-sifat fisikokimia berbeda. Tehnik kristalisasi menggunakan pelarut, metode dan kondisi kristalisasi berbeda akan diperoleh habit kristal yang berbeda. Habit kristal menggambarkan bentuk kristal dalam istilah umum (seperti bentuk jarum, prismatik, lamelar) dan berpengaruh terhadap titik lebur, kelarutan, disolusi, dan stabilitas (Desh Raj et al., 2011; Mohanachandran et al., 2010; Sehić, 2008).
2. Solubilisasi misel dengan surfaktan
Surfaktan merupakan molekul yang mempunyai gugus polar dan nonpolar. Bila suatu molekul kecil obat nonpolar dimasukkan ke dalam surfaktan, molekul tersebut akan terakumulasi dalam inti hidrofobik misel. Kelarutan obat nonpolar meningkat karena surfaktan dapat menurunkan tegangan permukaan obat dalam larutan (Desh Raj et al., 2011).
3. Kosolvensi
atau elektrolit lemah yang mempunyai kelarutan kecil dalam air dapat ditingkatkan kelarutannya dengan memperbaiki polaritas pelarut. Sistem kosolven bekerja dengan cara menurunkan tegangan permukaan antara pelarut dengan zat terlarut hidrofobik. Adanya efek pembasahan akan menyebabkan peningkatan kelarutan bahan obat (Desh Raj et al., 2011).
4. Pembentukan garam
Pembentukan garam merupakan metode yang umum dan efektif untuk meningkatkan kelarutan dan kecepatan disolusi bahan obat yang bersifat asam dan basa. Suatu senyawa bersifat basa, kelarutannya akan meningkat ketika pH larutan diturunkan menjadi asam. Sebaliknya suatu senyawa bersifat asam, kelarutannya akan meningkat ketika pH larutan dinaikkan menjadi asam karena terbentuk garam yang lebih mudah larut dalam air (Desh Raj et al., 2011).
5. Kompleksasi
Pembentukan senyawa kompleks dapat digunakan untuk meningkatkan kelarutan senyawa obat. Suatu senyawa kompleks terbentuk bila molekul obat dan ligan bergabung membentuk ikatan lemah dengan stokiometri tertentu (seperti interaksi hidrofobik, ikatan hidrogen, gaya van der Waals) (Desh Raj et al., 2011).
2.1.1.1. Tinjauan Tentang Prodrug
Prodrug merupakan derivat molekul obat yang mengalami biotransformasi enzimatis atau kimia menjadi senyawa bentuk aktif dalam tubuh, sebelum memberikan efek farmakologi (Gambar 2.2.). Pelepasan bentuk aktif obat dikendalikan dan dapat terjadi
sebelum, selama atau setelah absorbsi atau pada tempat aksi obat yang spesifik tergantung dari tujuan rancangan obat (Stella et al., 2007; Rautio et al., 2008).
Promoiety merupakan suatu gugus fungsional, digunakan untuk memodifikasi struktur yang aktif secara farmakologi. Promoeity yang digunakan idealnya aman dan segera diekskresikan dari tubuh. Promoeity yang akan direaksikan diseleksi berdasarkan sifat yang ingin diperbaiki dari senyawa induknya. Ilustrasi mengenai gugus-gugus promoeity yang dapat dibuat menjadi senyawa prodrug dengan senyawa obat yang memiliki gugus fungsi tertentu dapat dilihat pada Gambar 2.3. Senyawa induk yang bersifat lipofilik, mempunyai
kemampuan menembus membran biologis besar akan tetapi kelarutannya dalam air kecil. Sebaliknya senyawa induk yang bersifat hidrofilik, mempunyai kelarutan yang besar, akan tetapi kemampuan menembus membran biologis kecil (Rautiob et al., 2008).
Gambar 2.2. Ilustrasi konsep prodrug (prodrug = obat + promoeity)
(Rautioaet al., 2008)
Pendekatan prodrug telah berhasil digunakan untuk mengatasi kelarutan bahan obat yang rendah dalam air atau bioavailabilitas yang tidak menentu. Dengan memodifikasi senyawa induk dengan suatu gugus polar maka kelarutan senyawa obat yang rendah dalam air akan dapat ditingkatkan (Stegemann et al., 2007; Stella et al., 2007; Rautio a et al.,
2008).
Pendekatan prodrug pada umumnya didasarkan pada biotranformasi kimia atau biokimia menjadi bentuk aktif sebelum mencapai tempat aksi. Pendekatan ini khususnya bermanfaat bagi sediaan intravena karena prodrug yang larut air direkonstitusi sebelum digunakan, yang dengan cepat berubah menjadi bentuk aktif senyawa induknya. Bagi sediaan oral, perubahan dalam saluran cerna biasanya terjadi sebelum fase absorbsi, dan selanjutnya bahan obat yang tidak larut mengendap dari larutan dalam saluran cerna. Akan tetapi bentuk prodrug masih menguntungkan oleh karena (i) kelarutan lebih cepat tercapai sehingga menghasilkan kecepatan transpor awal lebih cepat, (ii) dosis obat mungkin cukup kecil sehingga sekali berada dalam bentuk larutan akan tetap dalam bentuk larutan terutama mengingat adanya surfaktan di dalam saluran cerna, dan (iii) bentuk endapan obat mungkin berada dalam bentuk sangat halus sehingga lebih mudah melarut (Yalkowsky, 1981).
Sekitar 5-7% obat yang disetujui Food and Drug Administration (FDA) dapat diklasifikasikan sebagai prodrug dan pada saat ini implementasi pendekatan prodrug pada tahap awal penemuan obat bertumbuh pesat. Pendekatan rancangan prodrug disesuaikan dengan tujuan yang ingin dicapai. Prodrug yang diinginkan untuk melepas senyawa induk dengan segera, dirancang untuk mendapat ikatan lemah antara senyawa induk dengan promoeity. Dengan demikian proses biokonversi dari bentuk prodrug menjadi senyawa induk dapat diperoleh sesaat setelah obat digunakan. Proses biokonversi di dalam tubuh dimediasi oleh adanya enzym-enzym yang terdapat di dalam darah, hati dan jaringan lain
(Stella et al., 2007; Rautio aet al., 2008; Rautio bet al., 2008).
Pendekatan prodrug yang digunakan disesuaikan dengan sifat-sifat fisikokimia, farmasetika, biofarmasetika dan atau farmakokinetika yang akan diperbaiki. Dua pendekatan prodrug yang ditujukan untuk meningkatkan kelarutan senyawa sukar larut dalam air adalah: (1) menurunkan titik lebur senyawa induk dengan derivatisasi dan/ atau (2) menambahkan promoiety polar/yang dapat terionkan pada senyawa induk. Prodrug-prodrug larut air pada umumnya didapat pada gugus fosfat, suksinat atau asam amino dari gugus hidroksil (Stella dan Nti Addae, 2007; Roche, 1987).
Fenitoin merupakan senyawa asam lemah yang sukar larut dalam air (pKa 8,3), memiliki gugus imida dalam struktur molekulnya. Dengan menggantikan satu proton NH tipe imida dengan suatu gugus fosfonooksimetil membentuk prodrug yang dikenal sebagai fosfenitoin. Fosfenitoin merupakan salah satu bentuk prodrug yang mampu meningkatkan kelarutan fenitoin dari 20-25 µg/mL menjadi 140 mg/mL. Selain itu fosfenitoin juga memberikan bioaavailabilitas dan profil keamanan lebih baik dibandingkan bentuk garam natrium fenitoin (Rautiobet al., 2008; Stegemann et al., 2007; Stella, 1995).
Asam-asam amino telah diteliti secara luas dalam penggunaannya sebagai promoiety untuk memperbaiki kelarutan senyawa dalam air dari berbagai macam obat-obat yang mengandung amina dan alkohol. Valacyclovir merupakan bentuk prodrug asam amino acyclovir. Valacyclovir menunjukkan peningkatan kelarutan dari 1,3 mg/mL menjadi 174 mg/mL pada suhu 25 °C dan bioavailabilitas pada penggunaan secara oral meningkat dari 12-20 menjadi 54 % (Santos et al., 2009; Rautiob et al., 2008, Steingrimsdottir et al.,
Midodrine merupakan prodrug dengan gugus promoeity berasal dari asam amino glisin. Bioavailabilitas midodrine setelah penggunaan per oral meningkat dari 50% (desglymidodrine) menjadi 93% (midodrine) (Rautiob et al., 2008). Prodrug ester
camphothecin dengan serangkaian gugus α-asam amino (glisin, alanin, aminobutirat dan norvalin) telah disintesis, dikarakterisasi dan dievaluasi oleh Deshmukh et al. (2010).
Gambar 2.4. Prodrug yang larut dalam cairan saluran cerna memberikan konsentrasi
besar sebagai kekuatan pendorong dalam absorbsi. Pemutusan promoeity oleh suatu enzim di brush border yang terikat membran melepaskan senyawa induk lipofilik di sekitar membran mukosa (Fleisher et al., 1996).
peningkatan kelarutan cephalosporin dengan asam amino glisin hanya sebesar 1,3 kali, akan tetapi prodrug yang terbentuk menunjukkan kecepatan yang cukup untuk berubah menjadi senyawa induk secara in vivo. Oleh karena itu dalam penelitian ini asam amino yang digunakan sebagai promoeity yaitu glisin, alanin, dan lisin.
Selain memberikan kelarutan yang baik dalam air, penggunaan asam-asam amino sebagai promoiety dapat segera diubah oleh enzim esterase dan atau peptidase yang terdapat dalam tubuh. Promoiety asam amino juga disukai karena dilepaskan secara alami sebagai keutuhan non toksik saat terjadi perubahan bentuk dalam tubuh (Hemenway et al., Suatu prodrug dengan kelarutan tinggi memberikan kekuatan pendorong (gradien konsentrasi) dibandingkan senyawa obat induk ketika diabsorbsi. Senyawa induk dengan koefisien partisi tinggi memberikan keuntungan ketika terjadi rekonversi prodrug oleh enzim di brush broder membran mukosa dalam saluran cerna. Pada kondisi tersebut prodrug akan dilepas menjadi senyawa induk yang permeabel. Rekonversi prodrug yang cepat dalam saluran cerna akan membantu memperbaiki keterbatasan absorbsi (Fleisher et al., 1996).
2.1.2. Tinjauan Tentang Disolusi
(Cs C)
dilihat bahwa dengan memperkecil luas permukaan partikel (S) dan meningkatkan kelarutan jenuh (Cs) dapat meningkatkan laju disolusi suatu obat. Oleh karena laju absorbsi
maksimum tidak dapat melebihi laju disolusi ( dt
dC ) maka kelarutan senyawa obat yang
rendah akan menurunkan efektivitas obat. Bila laju disolusi merupakan tahap penentu kecepatan bioavailabilitas obat maka dengan meningkatkan laju disolusi, bioavailabilitas akan dapat diperbaiki (Aulton, 1988; Yalkowsky, 1981).
Pada fase awal disolusi, Cs ≥ dt
dC dan jika luas permukaan (S) selama percobaan dibuat
tetap maka D/h yang merupakan konstante (k) dapat ditentukan. Konstante (k) merupakan konstante laju intrinsik disolusi dan spesifik bagi setiap bahan obat padat dalam pelarut tertentu di bawah kondisi hidrodinamik. Menurut Kaplan, senyawa obat yang memiliki harga k kurang dari 0,1/mg/cm2/menit biasanya laju disolusi merupakan tahap penentu kecepatan absorbsi (Florence dan Attwood, 2005; Aulton, 1988).
Jalali et al. (2006) meneliti tentang korelasi in vitro - in vivo efek antikonvulsi karbamazepin setelah dibuat ko-grinding dengan mikrokristalin selulose. Hasil penelitian menunjukkan peningkatan bioavailabilitas (Cmaks, tmaks dan AUC) karbamazepin seiring
dengan meningkatnya disolusi karbamazepin setelah karbamazepin dibuat sistem ko-grinding dengan mikrokristalin selulose yang merupakan pembawa bersifat hidrofilik. Berdasarkan parameter fisiologi, media disolusi yang menyerupai keadaan lambung dan usus halus dalam keadaan terisi makanan dan puasa dapat memengaruhi disolusi. Macam-macam media disolusi seperti blank fast-state simulated gastric state (FaSSGF), simulated gastric fluid without pepsin (SGF), fed-state simulated intestinal fluid (FESSIF) dan simulated colonic fluid (SCoF) merupakan media bio-relevan terpilih yang dapat dipertimbangkan untuk menyelidiki disolusi suatu bahan obat. Penelitian Bhise dan Rajkumar (2008) menunjukkan disolusi karbamazepin dalam berbagai media bio-relevan tidak berbeda bermakna dibandingkan media air meskipun kelarutan karbamazepin dalam berbagai media tersebut menunjukkan perbedaan. Selain itu diketahui bahwa pH berperan kecil terhadap disolusi karbamazepin, pH asam mendorong pembentukan karbamazepin dihidrat yang kurang larut dalam air. Alasan tersebut menyebabkan bioavailabilitas karbamazepin lambat dan disolusi dalam saluran cerna tidak menentu.
2.1.3 Tinjauan Tentang Koefisien partisi
Koefisien partisi (P) merupakan ukuran lipofilisitas suatu senyawa. Lipofilisitas berkenaan dengan kemampuan molekul obat berpartisi antara dua larutan yang tidak campur, seperti air dan minyak. Koefisien partisi dapat diukur dengan menentukan konsentrasi kesetimbangan suatu obat dalam fase berair (umumnya air) dan fase minyak (umumnya oktanol atau kloroform) yang akan kontak satu dengan yang lain pada suhu dan tekanan konstan. Koefisien partisi dinyatakan dengan persamaan 2.3 di bawah ini.
P = [Cminyak]/ [Cair] ………... (2.3)
dengan P adalah koefisien partisi, Cminyak adalah konsentrasi molekul obat dalam fase
minyak dan Cair adalah konsentrasi molekul obat dalam fase air. Harga koefisien partisi (P)
merupakan ukuran afinitas relatif molekul obat terhadap fase air dan fase non air (minyak). Semakin besar harga P maka semakin besar kelarutan molekul obat dalam minyak (Sinko, 2011; Aulton, 1988).
Membran biologi secara alami bersifat lipoid yang memegang peranan penting dalam transpor obat. Kemampuan suatu molekul obat melintasi membran pada tempat absorbsi dapat dihubungkan dengan koefisien partisi minyak-air suatu obat. Permeabilitas merupakan kemampuan suatu obat melintasi membran biologi yang tersusun atas fosfolipid bilayer. Permeabilitas obat melewati membran biologi tergantung pada lipofilisitas dan koefisien difusi. Senyawa obat yang sangat larut dalam air maka kecepatan permeasi melewati membran biologi merupakan tahap penentu kecepatan absorbsi, sedangkan senyawa obat dengan lipofilisitas yang tinggi atau mempunyai kelarutan besar dalam minyak pada umumnya mempunyai kemampuan melintasi membran biologis dengan baik dibandingkan dengan obat-obat yang bersifat hidrofilik (Shargel et al., 2005; Aulton, 1988).
dengan yang lain dengan rapat sehingga merupakan barrier bagi obat-obat yang bersifat hidrofilik. Untuk dapat menembus sawar darah-otak, suatu obat harus relatif kecil (ukuran molekul kurang dari 500 Da), memiliki koefisien partisi yang tinggi (larut minyak), tetap tidak terion pada pH cairan tubuh dan mampu membentuk ikatan hidrogen kurang dari 8 dengan air (Shargel et al., 2005; Rautiobet al., 2008).
2.2.TINJAUAN TENTANG BIOAVAILABILITAS
Rute pemakaian secara oral merupakan rute umum dan nyaman digunakan untuk bahan obat yang dikehendaki memiliki efek sistemik. Pemberian obat secara oral memiliki beberapa keuntungan seperti kenyamanan dan keamanan pemakaian. Akan tetapi rute oral bukanlah rute yang sederhana, oleh karena barier saluran cerna menyebabkan kadar obat dalam tubuh setelah pemakaian lebih bervariasi dibandingkan pemakaian secara parenteral. Kadar obat dalam tubuh yang bervariasi terutama bagi obat yang sukar larut dalam air menyebabkan penurunan bioavailabilitas dan bioavailabilitas yang berubah-ubah atau tidak sempurna (Shargel et al., 2005; Alavijeh et al., 2012).
Rute pemakaian obat memengaruhi bioavailabilitas obat, oleh karena itu memengaruhi mula kerja dan lama efek farmakologi. Bila suatu obat diberikan melalui rute oral maka obat harus terlarut secara molekuler sebelum diabsorbsi ke dalam sirkulasi sistemik. Obat dalam keadaan terlarut akan berdifusi atau ditranspor ke tempat aksi dan bila konsentrasi obat pada tempat aksi melebihi konsentrasi efektif minimum maka akan dihasilkan suatu respon farmakologis (Shargel et al., 2005)
Gambar 2.6. Proses absorbsi sistemik suatu obat (Shargel et al., 2012)
Absorbsi sistemik dari suatu obat (Gambar 2.6) terdiri dari suatu rangkaian proses
laju, meliputi disintegrasi, disolusi dan absorbsi melewati membran sel menuju sirkulasi sistemik. Kecepatan obat mencapai sistem sirkulasi ditentukan oleh tahapan yang paling
lambat dalam rangkaian di atas. Bagi obat-obat yang mempunyai kelarutan kecil dalam air, laju disolusi obat seringkali merupakan tahap yang paling lambat, sehingga merupakan tahap penentu kecepatan (rate-limiting step) terhadap bioavailabilitas obat. Sebaliknya bagi obat yang mempunyai kelarutan besar dalam air, laju disolusinya cepat sedangkan laju melintasi membran merupakan tahap paling lambat atau tahap penentu kecepatan (Shargel et al., 2005).
Biofarmasetika adalah ilmu yang mempelajari hubungan sifat fisikokimia formulasi obat terhadap bioavailabilitas obat. Ukuran dari laju dan jumlah obat aktif yang mencapai sirkulasi umum atau tempat aksi. Memahami prinsip biofarmasetika merupakan hal penting oleh karena biofarmasetika bertujuan untuk mengatur pelepasan obat sedemikian rupa ke sirkulasi sistemik. Biopharmaceutical classification system (BCS) merupakan kerangka ilmiah untuk membagi senyawa obat berdasarkan kelarutan dalam air dan permeabilitas melalui usus. Tabel 2.3. menyatakan pembagian biofarmasetika suatu obat berdasarkan
sifat kelarutan dan permeabilitas. BCS telah ditetapkan Food and Drug Administration (FDA) pada tahun 1995 dengan tujuan untuk membantu memperkirakan hubungan antara disolusi in vitro dengan bioavailabilitas in vivo (Amidon et al.,1995).
Tabel 2.3. Sistem pembagian biofarmasetika obat (Amidon et al., 1995)
Kelas Kelarutan/Permeabilitas Sifat-sifat
I Tinggi/Tinggi -Obat diabsorbsi baik
-Disolusi dan pengosongan lambung merupakan
tahap penentu kecepatan absorbsi
II Rendah/Tinggi -Disolusi merupakan tahap penentu
kecepatan Absorbsi
III Tinggi/Rendah - Permeabilitas merupakan tahap penentu kecepatan absorbsi
Bioavailabilitas obat dapat diprediksi dengan memilih rute pemberian obat secara teliti dan rancangan bentuk sediaan yang tepat. Suatu obat dapat diberikan dalam berbagai rute dan tetap menghasilkan aktivitas yang ekivalen, akan tetapi lama dan mula kerja obat mungkin sangat berbeda karena perubahan farmakokinetika yang disebabkan oleh rute pemberian. Perubahan fisiologik dan fisikokimia yang mungkin disebabkan oleh perubahan bentuk sediaan merupakan hal penting untuk dipertimbangkan (Shargel et al., 2005).
Rute pemakaian secara oral merupakan rute umum dan nyaman digunakan untuk pengobatan penderita. Akan tetapi rute oral bukanlah rute yang sederhana, oleh karena barier saluran cerna menyebabkan kadar obat setelah pemakaian lebih bervariasi dibandingkan pemakaian parenteral. Bila bahan obat mempunyai kelarutan kecil dalam air (< 0,1 mg/mL) maka disolusi obat merupakan tahap penentu kecepatan absorbsi obat dalam saluran cerna (Aulton, 1988).
Pada absorbsi obat sistemik setelah pemberian secara oral, molekul obat harus melintasi epitel intestinal melalui suatu sel epitel untuk mencapai sirkulasi sistemik. Permeabilitas suatu obat pada tempat absorbsi berkaitan dengan struktur molekul obat dan sifat fisik dan biokimia membran sel. Ketika obat berada dalam plasma, maka obat harus melintasi membran biologis yang bertindak sebagai sawar pelepasan obat untuk mencapai tempat aksi (Shargel et al., 2005).
Membran merupakan struktur utama dalam sel, mengelilingi keseluruhan sel (membran plasma) dan bertindak sebagai antara sel dan cairan interstisial. Secara fungsional membran sel merupakan partisi semipermiabel yang bertindak sebagai sawar selektif untuk lintasan molekul. Beberapa molekul kecil dan molekul larut lemak melewati membran, sedangkan molekul bermuatan dan molekul besar seperti protein dan molekul terikat protein tidak dapat melewatinya.
Dengan struktur membran sel yang demikian, teori ini menjelaskan bahwa obat larut lemak cenderung untuk penetrasi ke membran sel lebih mudah daripada molekul polar. Akan tetapi teori struktur membran sel dua lapis tidak menjelaskan difusi air, molekul dengan berat molekul kecil seperti urea dan ion muatan tertentu.
Teori membran plasma yang diajukan Singer dan Nicolson (1972), menggambarkan membran plasma sebagai model fluid mosaic dapat dilihat pada Gambar 2.7. Menurut
model ini, membran sel terdiri atas protein globular yang tertanam dalam suatu matriks cairan dinamik (dynamic fluid), lipid bilayer. Protein tersebut memberi suatu jalur transpor selektif dari molekul polar tertentu dan ion bermuatan melalui sawar lipid. Protein membran tersebar ke seluruh membran dan pada membran tersebut terdapat dua tipe pori berukuran 10 nm dan berukuran 50 sampai 70 nm. Pori-pori kecil ini memberi suatu kanal yang dapat dilewati oleh air, ion-ion dan obat terlarut seperti urea.
Senyawa obat dapat melintasi membran sel melalui dua mekanisme utama, yaitu difusi pasif (passive diffusion) dan pengangkutan dengan pembawa (carrier mediated transport). Selain mekanisme transpor tersebut, terdapat mekanisme transpor yang lain yaitu transpor vesikular, yang merupakan proses pemindahan molekul secara spesifik ke dalam dan ke luar sel (endositosis dan eksositosis). Transpor obat melewati membran terdiri dari satu atau lebih proses (Shargel et al., 2005, Alavijeh et al., 2005).
Gambar 2.7. Model membran plasma fluid mosaic (Shargel, et al., 2012)
besar obat dan dapat digambarkan melalui persamaan Fick's (persamaan 2.4) sebagai
kadar obat dalam saluran cerna dan dalam plasma.
Menurut persamaan difusi Fick's, laju difusi pasif obat terutama dipengaruhi oleh perbedaan kadar obat antar membran dan koefisien partisi senyawa obat. Kadar obat yang lebih tinggi dalam saluran cerna dibandingkan dalam darah menjadi tenaga pendorong dalam difusi pasif. Demikian juga harga koefisien partisi, K dari senyawa obat yang lebih besar menyatakan partisi obat dalam lemak-air dari obat lebih besar untuk melintasi membran mukosa. Obat-obat yang lebih larut dalam lemak cenderung melintasi membran lebih mudah dibandingkan molekul yang kurang larut dalam lemak atau molekul yang lebih larut dalam air (Shargel et al., 2005).
Keberhasilan proses absorbsi suatu senyawa obat ke dalam sirkulasi sistemik bergantung pada sifat fisikokimia senyawa obat, bentuk sediaan, dan anatomi maupun fisiologi (faktor biologi) tempat absorbsi. Sifat fisikokimia obat selain memengaruhi disolusi senyawa obat pada akhirnya juga memengaruhi keberhasilan proses absorbsi dan akan berdampak terhadap bioavailabilitasnya. Beberapa sifat fisikokimia senyawa obat yang memengaruhi proses absorbsi di antaranya:
1. Lipofilisitas
membran melalui proses difusi pasif. Pada umumnya, senyawa obat yang memiliki koefisien partisi yang baik (log P besar), lebih mudah melintasi membran mukosa sehigga proses absorbsi berjalan dengan baik (Shargel et al., 2005; Sinko, 2011).
2.Kelarutan dan Disolusi Bahan Obat
Kelarutan menyatakan massa solut yang melarut dalam satu volume tertentu dalam keadaan jenuh pada suhu tertentu. Disolusi merupakan proses solut terlarut dalam suatu pelarut. Kelarutan bersifat statik sedangkan disolusi bersifat dinamik. Kelarutan dalam air merupakan salah satu sifat fisikokimia yang berpengaruh terhadap bioavailabilitas obat. Obat yang sukar larut dalam air akan menyebabkan masalah secara in vivo, karena obat diabsorbsi tidak sempurna ketika diberikan secara oral sehingga menyebabkan bioavailabilitasnya tidak menentu. Kelarutan obat dalam saluran cerna yang tinggi akan memberikan gradien konsentrasi yang mendorong absorbsi ketika obat diberikan melalui rute oral dan distribusi menuju tempat aksi sebelum memberikan respon farmakologi (Waterbeemd, 2009). Dalam sistem biologi, disolusi obat dalam media air merupakan bagian sangat penting dalam proses absorbsi. Dalam saluran cerna, laju disolusi obat-obat dengan kelarutan dalam air sangat kecil seringkali mengendalikan laju absorbsi sistemik obat. Uji disolusi suatu senyawa obat atau sediaan obat seringkali dapat digunakan untuk meramalkan bioavailabilitasnya (Shargel et al., 2005).
3. Derajat ionisasi obat
Tingkat ionisasi molekul obat memengaruhi laju transpor obat. Obat-obat yang bersifat elektrolit lemah (asam atau basa lemah) akan terionisasi bergantung pada harga pKa obat dan pH media senyawa obat terlarut. Spesies obat terionisasi mengandung suatu muatan dan lebih larut air dibandingkan spesies obat tak terionisasi yang lebih larut dalam lipid (Sinko, 2011).
2.2.1 Parameter Farmakokinetika (tmaks, Cmaks, dan AUC)
Pengukuran kadar obat dalam plasma darah merupakan pendekatan langsung untuk penetapan farmakokinetika obat dalam tubuh. Plasma diperoleh dari supernatan sentrifugasi darah lengkap yang ditambahkan suatu antikoagulan seperti heparin. Plasma memperfusi semua jaringan tubuh termasuk elemen-elemen seluler dalam darah. Obat dalam plasma dalam kesetimbangan dinamik dengan jaringan, sehingga perubahan kadar obat dalam plasma menggambarkan perubahan kadar obat dalam jaringan (Shargel et al., 2005).
Setelah suatu obat dilepas dari bentuk sediaannya, molekul obat yang telah terdisolusi menembus lapisan mukosa saluran cerna memasuki pembuluh kapiler di sekitar saluran cerna. Setelah itu molekul obat mengalami distribusi melalui pembuluh darah menuju jaringan maupun organ tubuh. Obat dibersihkan dari tubuh melalui berbagai proses eliminasi yaitu ekskresi dan biotransformasi atau metabolisme obat. Rangkaian proses absorbsi, distribusi dan eliminasi obat dalam tubuh dapat dikarakterisasi dengan model farmakokinetika (Shargel et al., 2005).
Gambar 2.8 Kurva kadar obat dalam plasma-waktu setelah pemakaian obat secara per oral
(Shargel et al., 2005)
obat dapat diamati dari kurva kadar plasma-waktu. Kadar obat dalam sampel plasma yang diambil pada berbagai jarak waktu setelah pemberian suatu produk digambarkan dalam kurva kadar dalam plasma-waktu. Selama obat mencapai sirkulasi sistemik, kadar obat dalam plasma akan naik sampai maksimum. Pada umumnya absorbsi suatu obat terjadi lebih cepat daripada eliminasi. Melalui kurva kadar plasma-waktu (Gambar 2.8) dapat
ditentukan parameter farmakokinetika yang meliputi tmaks, Cmaks dan AUC.
Waktu kadar plasma mencapai puncak, tmaks merupakan waktu yang diperlukan untuk
mencapai kadar obat maksimum setelah pemberian obat, secara umum dapat dikatakan sebanding dengan laju absorbsi obat rata-rata Selama fase absorbsi, laju absorbsi obat lebih besar daripada laju eliminasi obat. Pada saat waktu kadar puncak dicapai, laju absorbsi obat sama dengan laju eliminasi obat. Sedangkan setelah waktu kadar puncak, laju fase eliminasi lebih besar daripada laju fase absorbsi (Shargel et al., 2005).
Kadar plasma puncak, Cmaks, menunjukkan kadar obat maksimum dalam plasma setelah
pemakaian obat secara oral. Pada kadar obat puncak dalam plasma, laju absorbsi obat sama dengan laju eliminasi obat, dan tidak ada perubahan dalam jumlah obat dalam tubuh. Untuk beberapa obat diperoleh hubungan antara kadar obat dalam plasma dengan efek farmakologi. Cmaks memberikan petunjuk bahwa obat cukup diabsorbsi secara sistemik dan
memberikan suatu respon terapeutik (Shargel et al., 2005).
Area di bawah kurva, AUC, merupakan jumlah obat yang mencapai sirkulasi sistemik atau merupakan ukuran jumlah bioavailabilitas suatu obat. AUC adalah area di bawah kurva kadar obat dalam plasma-waktu dari t = 0 sampai t = ≈. AUC dapat ditentukan dengan metode trapesium, area tiap waktu ditentukan dengan persamaan 2.5.
Bioavailabilitas menyatakan ukuran kecepatan dan jumlah bahan aktif yang mencapai tempat aksi obat. Studi bioavailabilitas dilakukan baik terhadap bahan aktif obat yang telah disetujui maupun terhadap bahan obat yang belum disetujui oleh FDA untuk dipasarkan maupun produk obat untuk memastikan keamanan dan efektifitas sesuai dengan indikasi penggunaan. Studi bioavailabilitas berguna dalam menetapkan perubahan sifat fisikokimia bahan obat dan pengaruh bentuk sediaan terhadap farmakokinetika obat. Parameter bioavailabilitas dinyatakan sebagai tmaks, Cmaks, dan AUC (Shargel et al., 2005).
2.3. TINJAUAN TENTANG KARBAMAZEPIN
Karbamazepin merupakan antiepilepsi yang efektif mengatasi bangkitan tipe simple partial dan tonik klonik. Pada saat bangkitan dapat terjadi suatu keadaaan darurat yang sering disebut dengan status epilepticus. Status epilepticus merupakan suatu hal serius dan perlu ditangani dengan cepat untuk mengendalikan resiko kerusakan otak permanen. Angka kematian untuk orang dewasa yang mengalami status epilepticus ini mencapai sekitar 20%. Karbamazepin bekerja dengan memblok kanal natrium dan menghambat repetitive neuronal firing frekuensi tinggi dalam jaringan serta mengurangi transmisi presinaptik. Mekanisme efek samping yang ditimbulkan karbamazepin belum diketahui secara pasti, diduga efek samping disebabkan oleh pembentukan metabolit yang reaktif secara kimia. Efek samping karbamazepin terhadap perubahan tingkah laku maupun kemampuan kognitif lebih rendah dibandingkan antikonvulsan lain seperti fenitoin, fenobarbital dan primidon (Mc. Namara, 2001; Pearce et al., 2002).
Setelah pemakaian secara oral, karbamazepin diabsorbsi lambat dan tidak menentu dalam saluran pencernaan. Bioavailabilitas karbamazepin sebesar 85-100%, mengalami metabolisme dalam hati oleh isoenzim CYP 450 yaitu CYP3A4 dan CYP2C8. Metabolit karbamazepin utama yang aktif adalah carbamazepine-10,11 epoxide. Hampir seluruh metabolit karbamazepin diekskresi melalui urin dan sebagian melalui feses (Sweetman, 2009, Pearce et al., 2009).