BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan Buni
2.1.1 Habitat
Buni tumbuh liar di daerah-daerah basah Sumatra, Kalimantan, Sulawesi, Maluku, India, Sri Lanka, Burma, Semenanjung Malaysia, New Guinea. Di Indonesia terutama di Jawa, buni tumbuh di daerah kering di bagian timur Jawa atau pun di bagian barat Jawa yang beriklim lembab (Wulandari, 2011).
2.1.2 Nama daerah
Buni dikenal dengan nama yang berbeda di setiap daerah seperti barune, huni, huni gedeh, huni wera (Sunda), wuni (Jawa); Burneh (Madura), buni. Katakuti, kutikata (Maluku); tedong (Makassar (LIPI, 2009; Wulandari, 2011).
2.1.3 Sinonim
Antidesma crassifolium (Elmer) Merr., Antidesma dallachyanum Baillon.,
Antidesma rumphii Tulase (Wulandari, 2011).
2.1.4 Sistematika tumbuhan
Menurut Wulandari (2011), sistematika dari tumbuhan buni adalah sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae Ordo : Malpighiales Famili : Phyllantaceae Genus : Antidesma
2.1.5 Morfologi tumbuhan
Buni (Antidesma bunius (L.) Spreng merupakan pohon buah, tinggi 15-30 meter. Pohon berbatang sedang ini tersebar di Asia Tenggara dan Australia, di Jawa tumbuh liar di hutan atau ditanam di halaman dan dapat ditemukan dari dataran rendah. Daun tunggal, bertangkai pendek, bentuknya bulat telur sungsang sampai lanset, panjang 9-25 cm, tepi rata agak bergelombang, ujung meruncing, pangkal tumpul. Daun muda warnanya hijau muda, setelah tua menjadi hijau tua. Buni berumah dua, bunga dalam tandan, keluar dari ketiak daun atau di ujung pecabangan. Buahnya kecil-kecil panjang sekitar 1 cm, bentuknya bulat berwarna hijau, bila masak menjadi ungu kehitaman dan rasanya sedikit asam (LIPI, 2009).
2.1.6 Khasiat
Buni (Antidesma bunius (L.) Spreng) berkhasiat untuk mengobati darah tinggi, jantung berdebar cepat, anemia, sifilis (Wijayakusuma, 1996), anti kanker (Micor, dkk., 2005), antioksidan (Butkhup dan Samappito, 2011), antidiabetes (Elya, dkk., 2012). Daun buni berkhasiat sebagai obat penutup luka dan buahnya yang telah matang berkhasiat untuk menambah air susu ibu (Kassem, dkk., 2013).
2.1.7 Kandungan kimia
2.2 Uraian kandungan kimia
2.2.1 Glikosida
Glikosida adalah suatu golongan senyawa bila dihidrolisis akan terurai menjadi gula (glikon) dan senyawa lain (aglikon atau genin). Umumnya glikosida mudah terhidrolisis oleh asam mineral atau enzim. Hidrolisis oleh asam memerlukan panas, sedangkan hidrolisis oleh enzim tidak memerlukan panas. Glikosida umumnya cukup larut dalam air dan alkohol tetapi sedikit larut dalam eter. Ikatan glikosidik resisten terhadap hidrolisis oleh alkali tetapi mudah pecah oleh asam mineral encer seperti asam sulfat encer (Supriyatna, dkk., 2010).
Menurut Farnsworth (1966) berdasarkan ikatan antara glikon dan aglikonnya, glikosida dapat dibedakan menjadi :
a. Tipe O-glikosida, ikatan antara bagian glikon dengan aglikon melalui jembatan O. Mayoritas glikosida termasuk ke dalam kelompok ini. Contoh : kuarsetin. b. Tipe C-glikosida, ikatan antara bagian glikon dengan aglikon melalui jembatan
C, yakni gula melekat pada aglikon melalui ikatan karbon. Contoh : aloin. c. Tipe S-glikosida, ikatan antara bagian glikon dengan aglikon melalui jembatan
S. Contoh: sinigrin.
d. Tipe N-glikosida, ikatan antara bagian dari glikon dengan aglikon melalui jembatan N. Contoh: nikleosidin.
2.2.2 Triterpenoid/steroid
menjadi empat golongan, yaitu triterpenoid, steroid, saponin dan glikosida jantung (Harborne, 1984).
Uji yang banyak dilakukan untuk identifikasi triterpenoid dan steroid adalah reaksi Liebermann-Burchard yang biasanya menghasilkan warna merah ungu hingga biru-hijau (Harborne, 1984).
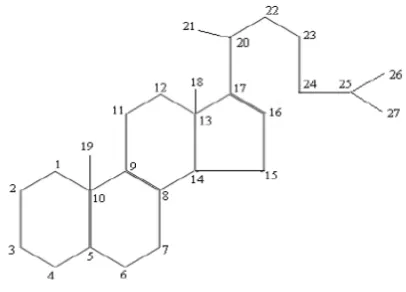
Gambar 2.1 Struktur dasar triterpenoid (Harborne, 1984)
Menurut Robinson (1991) pembagian triterpenoid berdasarkan jumlah cincin yang terdapat pada struktur molekulnya, adalah:
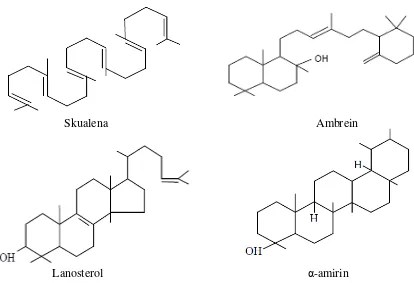
a. Triterpenoid asiklik, yaitu triterpenoid yang tidak mempunyai cincin tertutup dalam cincin molekulnya, contohnya skualen.
b. Triterpenoid trisiklik, yaitu triterpenoid yang mempunyai tiga cincin tertutup dalam cincin molekulnya, contohnya ambrein.
c. Triterpenoid tetrasiklik, yaitu triterpenoid yang mempunyai empat cincin tertutup dalam cincin molekulnya, contohnya lanosterol.
d. Triterpenoid pentasiklik, yaitu triterpenoid yang mempunyai lima cincin tertutup dalam cincin molekulnya, contohnya α-amirin. Contoh struktur kima
Skualena Ambrein
Lanosterol α-amirin
Gambar 2.2 Struktur kimia triterpenoid (Robinson, 1991)
Senyawa triterpenoid menunjukkan aktifitas farmakologi seperti antivirus, antibakteri, antiinflamasi, inhibisi terhadap sintesis kolesterol, antikanker (Nassar dan Majid 2010), antitumor (Lage, dkk., 2009) dan aktifitas sitotoksik terhadap sel pangkreatik (Sanchez, dkk., 2010).
Gambar 2.3 Struktur dasar steroid dan penomorannya (Robinson, 1991) Senyawa steroid dahulu dianggap sebagai senyawa yang hanya terdapat pada hewan tetapi sekarang ini makin banyak senyawa steroid yang ditemukan dalam tumbuhan (fitosterol). Fitosterol merupakan senyawa steroid yang berasal dari tumbuhan. Senyawa fitosterol yang biasa terdapat pada tumbuhan tinggi yaitu sitosterol, stigmasterol dan kampesterol (Harborne, 1984).
Senyawa golongan steroid memiliki sifat fisiologis dan bioaktif yang penting, misalnya berperan dalam pembentukan struktur membran, pembentukan hormon kelamin dan hormon pertumbuhan serta pembentukan vitamin D, sebagai penolak dan penarik serangga dan sebagai antimikroba (Robinson, 1991).
2.2.3 Flavonoid
penyerbukan, pengatur tumbuh, pengatur fotosintesis, kerja antimikroba dan antivirus (Robinson, 1991).
2.2.4 Saponin
Saponin adalah sekelompok senyawa dengan struktur triterpenoid yang mengikat satu atau lebih gula sehingga memiliki sisi hidrofil dan lipofil dengan pengocokan akan menimbulkan buih (Harbone, 1984). Saponin mula-mula diberi nama demikian karena sifatnya yang menyerupai sabun (bahasa Latin sapo berarti sabun). Saponin adalah senyawa aktif permukaan yang kuat yang menimbulkan busa jika dikocok dalam air dan pada konsentrasi yang rendah sering menyebabkan hemolisis sel darah merah. Dalam larutan yang sangat encer saponin sangat beracun untuk ikan. Beberapa saponin bekerja sebagai antimikroba. Saponin merupakan senyawa berasa pahit dan mengakibatkan iritasi terhadap selaput lender (Robinson, 1991).
Uji saponin adalah dengan mengocok ekstrak alkohol air dari tumbuhan dalam tabung reaksi, maka akan terbentuk busa yang bertahan lama pada permukaan cairan (Harborne, 1984).
2.3 Ekstraksi
dikandung simplisia akan mempermudah pemilihan pelarut dengan cara yang tepat (Ditjen POM RI, 2000).
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan (Ditjen POM RI, 1995).
2.3.1 Metode Ekstraksi
Menurut Ditjen POM RI (2000), ada beberapa metode ekstraksi dengan menggunakan pelarut yaitu:
A. Cara Dingin 1. Maserasi
Maserasi adalah proses penyarian simplisia menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur kamar. Maserasi yang dilakukan pengadukan secara terus-menerus disebut maserasi kinetik, sedangkan maserasi yang dilakukan dengan pengulangan penambahan pelarut setelah dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut remaserasi.
2. Perkolasi
B. Cara Panas 1. Refluks
Refluks adalah ektraksi pelarut pada temperature titik didihnya, selama waktu tertentu dan jumlah pelarut yang terbatas yang relatif konstan dengan adanya pendingin balik
2. Digesti
Digesti adalah maserasi dengan pengadukan terus-menerus pada temperatur lebih tinggi dari temperatur ruangan, secara umum dilakukan pada temperature 40-50˚C.
3. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru, dilakukan menggunakan alat Soxhlet sehingga terjadi ekstraksi kontinu dengan jumlah pelarut yang relatif konstan dengan adanya pendingin balik.
4. Infudasi
Infudasi adalah ekstraksi dengan pelarut air pada penangas air dengan temperatur 96-98˚C selama waktu 15-20 menit.
5. Dekoktasi
Dekoktasi adalah ekstraksi dengan pelarut air pada temperatur sampai titik didih air selama 30 menit atau lebih.
2.4 Kromatografi
lainnya yang terelusi lebih awal atau lebih akhir. Umumnya zat terlarut dibawa melewati media pemisah oleh aliran suatu pelarut berbentuk cairan atau gas yang disebut eluen. Fase diam dapat bertindak melarutkan zat terlarut sehingga terjadi partisi antara fase diam dan fase gerak. Dalam proses ini suatu lapisan cairan pada penyangga yang inert berfungsi sebagai fase diam (Ditjen POM RI, 1995).
Cara-cara kromatografi dapat digolongkan sesuai dengan sifat-sifat dari fase diam, yang dapat berupa zat padat atau zat cair. Jika fase diam berupa zat padat maka cara tersebut dikenal sebagai kromatografi serapan, jika berupa zat cair dikenal sebagai kromatografi partisi (Ditjen POM RI, 1995; Sastrohamidjojo, 1985).
Pemisahan dan pemurnian kandungan kimia tumbuhan terutama dilakukan dengan menggunakan salah satu dari lima teknik kromatografi atau gabungan teknik tersebut. Kelima teknik kromatografi itu adalah: kromatografi kolom (KK), kromatografi kertas (KKt), kromatografi lapis tipis (KLT), kromatografi gas cair (KGC), dan kromatografi cair kinerja tinggi (KCKT). Pemilihan teknik kromatografi sebagian bergantung pada sifat kelarutan dan keatsirian senyawa yang akan dipisah (Harborne, 1984).
2.4.1 Kromatografi lapis tipis
kapiler pada pengembangan secara menaik (ascending) atau karena pengaruh gravitasi pada pengembangan secara menurun (descending) (Gandjar dan Rohman, 2007).
Pendeteksian bercak hasil pemisahan dapat dilakukan dengan beberapa cara, untuk senyawa tak berwarna cara yang paling sederhana adalah dilakukan pengamatan dengan sinar ultraviolet (Stahl, 1973). Beberapa senyawa organik berfluorosensi jika disinari dengan sinar ultraviolet gelombang pendek (254 nm) atau gelombang panjang (366 nm), jika dengan cara itu senyawa tidak dapat dideteksi maka harus dicoba disemprot dengan pereaksi yang perlu membuat bercak tersebut tampak yaitu pertama tanpa pemanasan, kemudian bila perlu dengan pemanasan (Gritter, dkk., 1985).
a. Fase diam (lapisan penyerap)
Kromatografi lapis tipis (KLT) merupakan kromatografi adsorbsi dan adsorben bertindak sebagai fase diam (penyerap).Fase diam yang digunakan memiliki dua sifat penting yang harus diperhatikan yaitu besar partikel dan homogenitasnya. Besar partikel yang biasa digunakan adalah 1 – 25 mikron.Partikel dengan butiran yang kasar tidak akan memberikan hasil pemisahan yang memuaskan (Sastrohamidjojo, 1985).
Fase diam yang umum digunakan dalam KLT ada empat, yaitu: silika gel, alumina, kieselguhr, dan selulosa. Pada kromatografi lapis tipis lapisan fase diam harus sesedikit mungkin mengandung air, karena air akan menempati semua titik penyerapan sehingga tidak ada noda senyawa yang melekat. Sebelum digunakan plat kromatografi lapis tipis perlu diaktifkan dengan pemanasan pada 110o
1. Silika gel
Silika gel merupakan fase diam yang paling sering digunakan dalam KLT. Ada beberapa jenis silika gel yang dapat digunakan, yaitu: silika gel G, silika gel H dan silika gel PF (Adnan, 1997).
2. Alumina
Penggunaan alumina dalam KLT tidak sesering silikagel. Alumina dapat digunakan dalam memisahkan bermacam-macam senyawa seperti terpena, alkaloid, steroid dan senyawa-senyawa alisiklik, alifatik, serta aromatik. Sebagai fase diam, alumina tidak mengandung zat perekat, mempunyai sifat sedikit alkalis dan dapat digunakan baik tanpa maupun dengan aktivasi (Adnan, 1997).
3. Kieselguhr dan selulosa
Kieselguhr dan selulosa merupakan bahan penyangga yang berbeda penggunaannya dari silika gel dan alumina karena fase diam ini digunakan dalam memisahkan senyawa polar seperti asam amino, karbohidrat, nukleotida (Gritter, dkk., 1985).
b. Fase gerak (Pelarut pengembang)
karbontetraklorida, benzen, kloroform, eter, etilasetat, piridian, aseton, etanol, metanol dan air (Gritter, dkk., 1985).
c. Harga Rf
Mengidentifikasi noda-noda dalam kromatografi lapis tipis sangat lazim menggunakan harga Rf (Retardation Factor) mulai dari 0 sampai 1.
Rf = jarak yang ditempuh oleh senyawa dari titik penotolan jarak yang ditempuh oleh pelarut dari titik penotolan
Faktor-faktor yang mempengaruhi harga Rf yaitu struktur kimia dari senyawa yang dipisahkan, sifat penjerap, tebal dan kerataan dari lapisan penjerap, pelarut dan derajat kemurniannya, derajat kejenuhan uap pengembang dalam bejana, teknik percobaan, jumlah cuplikan yang digunakan, suhu dan kesetimbangan (Sastrohamidjojo, 1985).
2.4.2 Kromatografi lapis tipis preparatif
bantuan kertas saring yang diletakkan berdiri disekeliling permukaan bagian dalam bejana (Hostettmann, dkk., 1986).
2.4.3 Kromatografi lapis tipis dua arah
KLT dua arah atau KLT dua dimensi ini bertujuan untuk meningkatkan resolusi sampel ketika komponen-komponen solut mempunyai karakteristik kimia yang hampir sama, karena nilai Rf juga hampir sama, selain itu dua sistem fase gerak yang sangat berbeda dapat digunakan secara berurutan pada suatu campuran tertentu sehingga memungkinkan untuk melakukan pemisahan analit yang mempunyai tingkat polaritas yang hampir sama (Rohman, 2009). KLT dua arah dilakukan dengan melakukan penotolan sampel disalah satu sudut lapisan lempeng tipis dan mengembangkannya sebagaimana biasa dengan eluen pertama. Lempeng kromatografi selanjutnya dipindahkan dari chamber yang menggunakan eluen kedua sehingga pengembangan dapat terjadi pada arah kedua yang tegak lurus dengan arah pengembangan yang pertama. Suksesnya pemisahan tergantung pada kemampuan untuk memodifikasi selektifitas eluen kedua dibandingkan dengan selektifitas eluen pertama (Rohman, 2009).
2.5 Spektrofotometri
2.5.1 Spektrofotometri sinar ultraviolet (UV)
Suatu atom atau molekul menyerap sinar UV maka energi tersebut akan menyebabkan tereksitasinya elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Tipe eksitasi tergantung panjang gelombang cahaya yang diserap. Gugus kromofor disebut juga gugus yang dapat mengabsorpsi cahaya (Dachriyanus, 2004).
Menurut Dachriyanus (2004) beberapa kegunaan penggunaan spektrofotometri ultraviolet adalah :
1.Menentukan jenis kromofor, ikatan rangkap yang terkonjugasi dan auksokrom dari senyawa organik,
2.Menjelaskan informasi dari struktur berdasarkan panjang gelombang maksimum suatu senyawa,
3.Analisis kuantitatif senyawa organik menggunakan hokum Lambert-Beer
2.5.2 Spektrofotometri infra merah (IR)
Spektra inframerah mengandung banyak serapan yang dihubungkan dengan sistem vibrasi yang berinteraksi dalam molekul dan karena mempunyai karakteristik yang unik untuk setiap molekul maka dalam spektrum memberikan pita-pita serapan yang karakteristik juga (Sastrohamidjojo, 1985).
Jenis absorpsi energi yang lain, molekul-molekul dieksitasikan ke tingkat energi yang lebih tinggi ketika molekul-molekul ini menyerap radiasi inframerah. Hanya frekuensi (energi) tertentu dari radiasi inframerah yang dapat diserap oleh suatu molekul, agar molekul dapat menyerap radiasi infrared, maka molekul tersebut harus mempunyai gambaran spesifik, yakni momen dipol molekul harus berubah selama vibrasi (Gandjar dan Rohman, 2012).
Terdapat dua macam getaran molekul, yaitu getaran ulur dan getaran tekuk. Getaran ulur adalah suatu gerakan berirama di sepanjang sumbu ikatan sehingga jarak antar atom bertambah atau berkurang. Getaran tekuk dapat terjadi karena perubahan sudut-sudut ikatan antara pada sebuah atom, atau karena gerakan sebuah gugusan atom terhadap sisa molekul tanpa gerakan nisbi atom-atom di dalam gugusan (Silverstein, dkk., 1981).
Identifikasi setiap absorbsi ikatan yang khas dari setiap gugus fungsi merupakan basis dari interpretasi spektrum inframerah. Ada beberapa syarat yang harus dipenuhi dalam menginterpretasikan spektrum, yaitu:
1. Spektrum harus tajam dan jelas serta memiliki intensitas yang tepat 2. Spektrum harus berasal dari senyawa yang murni
3. Spektrofotometer harus dikalibrasi sehingga akan menghasilkan pita atau serapan pada bilangan gelombang yang tepat