BAB II
TINJAUAN PUSTAKA 2.1 Uraian Bahan
2.1.1. Parasetamol
Parasetamol merupakan metabolit dari fenasetin yang dahulunya paling banyak digunakan sebagai analgetik. Khasiatnya analgetik dan antipiretik, tetapi tidak antiradang. Dewasa ini pada umumnya dianggap sebagai zat antinyeri yang paling aman, juga untuk pengobatan swamedikasi (pengobatan mandiri). Efek analgetisnya diperkuat oleh kodein dan kafein dengan kira-kira 50% (Tan dan Rahardja, 2007).
Gambar 2.1. Rumus struktur parasetamol (Ditjen POM, 2014) Rumus Molekul : C8H9NO2
Berat Molekul : 151,16
Nama Kimia : 4-Hidroksiasetanilida
Kandungan : Tidak kurang dari 98,5% dan tidak lebih dari 101,0% C8H9NO2, dihitung terhadap zat anhidrat Pemerian : Serbuk hablur putih, tidak berbau, dan rasa sedikit
pahit.
2.1.2. Kafein
Kafein adalah salah satu jenis alkaloid yang banyak terdapat di daun teh (Camellia sinensis), biji kopi (Coffea arabica), dan biji coklat (Theobroma cacao). Kafein memiliki efek farmakologi yang bermanfaat secara klinis, seperti menstimulasi susunan saraf pusat, relaksasi otot polos terutama otot polos bronkus, dan stimulasi otot jantung . Efek samping dari penggunaan kafein secara berlebihan (overdosis) dapat menyebabkan gugup, gelisah, tremor, insomnia, mual, dan kejang (Tan dan Rahardja, 2007).
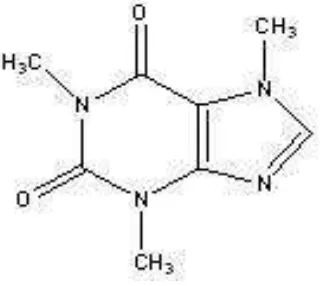
Gambar 2.2. Rumus Struktur Kafein (Ditjen POM, 2014) Rumus Molekul : C8H10N4O2
Berat Molekul : 194,19
Nama Kimia : 1,3,7- trimetilxantine
Kandungan : Tidak kurang dari 98,5% dan tidak lebih dari 101,0% C8H10N4O2, dihitung terhadap zat anhidrat. Pemerian : Serbuk putih; bentuk jarum mengkilat;
Kelarutan : Agak sukar larut dalam air, dalam etanol, mudah larut dalam kloroform; sukar larut dalam eter. 2.2 Spektrofotometri Ultraviolet-Visibel
2.2.1 Pengertian Spektrofotometri Ultraviolet-Visibel
Spekrofotometri ultraviolet-visibel merupakan salah satu teknik analisis spektrofotometri yang menggunakan sumber radiasi elektromagnetik sinar ultraviolet dan sinar tampak dengan memakai instrumen spektrofotometer (Gandjar dan Rohman, 2007). Sinar ultraviolet memiliki panjang gelombang antara 200-400 nm sedangkan sinar tampak memiliki panjang gelombang antara 400-800 nm (Moffat, dkk., 2005).
2.2.2 Pembagian Metode Analisis Spektrofotometri Ultraviolet-Visibel
Spektrofotometri ultraviolet-visibel dibagi atas empat metode analisis yaitu analisis zat tunggal, analisis multikomponen, spektrofotometri perbedaan
(Difference Spectrophotometry), dan spektrofotometri derivatif (Moffat, dkk., 2005).
2.2.3 Proses Penyerapan Radiasi pada Spektrofotometer Ultraviolet-Visibel Radiasi di daerah ultraviolet atau visibel diserap melalui eksitasi elektron yang terlibat dalan ikatan antara atom-atom pembentuk molekul (Gandjar dan Rohman, 2007; Watson, 2005).
sama dengan energi yang dibutuhkan untuk menyebabkan perubahan energi. Kekuatan radiasi juga mengalami penurunan dengan adanya penghamburan dan pemantulan cahaya, akan tetapi penurunan hal ini sangat kecil dibandingkan dengan proses penyerapan (Gandjar dan Rohman, 2007).
Sinar ultraviolet dan sinar tampak (visibel) memberikan energi yang cukup untuk terjadinya transisi elektron (Gandjar dan Rohman, 2007). Sebagai contoh, molekul organik sederhana yang mempunyai dua jenis ikatan karbon-karbon seperti pada etilen. Ikatan π lebih lemah dari ikatan dan akibatnya elektron π lebih tinggi energinya dari elektron (Munson, 1984). Elektron yang energinya tertinggi dalam molekul, berada dalam tingkat energi elektron dasar, terdapat dalam orbital , π, atau n, masing-masing mempunyai keadaan tereksitasi sesuai dengan energi elektron terendah. Transisi elektron yang terkait dengan absorbsi radiasi ultraviolet dan sinar tampak adalah → *, n→ *, n→π*, dan π→π*
(Satiadarma, dkk., 2004).
Penyerapan radiasi ultraviolet dan sinar tampak dibatasi oleh sejumlah gugus fungsional (yang disebut dengan kromofor) yang mengandung elektron valensi dengan tingkat energi eksitasi yang relatif rendah. Elektron yang terlibat pada penyerapan radiasi ultraviolet dan visibel ini ada tiga, yaitu elektron sigma, elektron phi, dan elektron bukan ikatan (non bonding electron) (Gandjar dan Rohman, 2007).
Transisi-transisi elektronik yang terjadi di antara tingkat-tingkat energi di dalam suatu molekul ada empat yaitu transisi → *, transisi n→ *, transisi
1. Transisi → *
Energi yang diperlukan untuk transisi ini besarnya sesuai dengan energi sinar yang frekuensinya terletak di antara ultraviolet vakum (kurang dari 180 nm). Jenis transisi ini terjadi pada daerah ultraviolet vakum sehingga kurang begitu bermanfaat untuk analisis dengan cara spektrofotometri ultraviolet-visibel.
2. Transisi n→ *
Jenis transisi ini terjadi pada senyawa organik jenuh yang mengandung atom-atom yang memiliki elektron bukan ikatan (elektron n). Energi yang diperlukan untuk transisi jenis ini lebih kecil dibandingkan transisi → *
sehingga sinar yang diserap pun mempunyai panjang gelombang lebih panjang, yakni sekitar 150-250 nm. Kebanyakan transisi ini terjadi pada panjang gelombang kurang dari 200 nm.
3. Transisi n→π* dan transisi π→π*
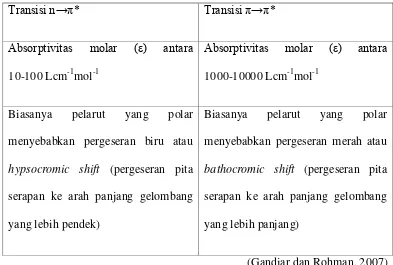
Untuk memungkinkan terjadinya transisi ini, maka molekul organik harus mempunyai gugus fungsional yang tidak jenuh sehingga ikatan rangkap dalam gugus tersebut memberikan orbital phi yang diperlukan. Jenis transisi ini merupakan transisi yang paling cocok untuk analisis sebab dengan panjang gelombang 200-700 nm, dan panjang gelombang ini secara teknis dapat diaplikasikan pada spektrofotometer ultraviolet-visibel. Perbedaan antara transisi
Tabel 2.1. Perbedaan antara transisi n→π* dan transisi π→π*
Transisi n→π* Transisi π→π*
Absorptivitas molar ( ) antara
10-100 Lcm-1mol-1
Absorptivitas molar ( ) antara
1000-10000 Lcm-1mol-1
Biasanya pelarut yang polar menyebabkan pergeseran biru atau
hypsocromic shift (pergeseran pita serapan ke arah panjang gelombang yang lebih pendek)
Biasanya pelarut yang polar menyebabkan pergeseran merah atau
bathocromic shift (pergeseran pita serapan ke arah panjang gelombang yang lebih panjang)
(Gandjar dan Rohman, 2007)
2.2.4 Kegunaan Spektrofotometri Ultraviolet-Visibel
Hukum Lambert-Beer menjadi dasar aspek kuantitatif spektrofotometri ultraviolet-visibel. Menurut Hukum Lambert-Beer, serapan berbanding lurus terhadap konsentrasi dan ketebalan sel, yang dapat ditulis dengan persamaan :
A = a.b.c (g/liter) atau A = . b. c (mol/liter) atau A = A1
1.b.c (g/100 ml)
Dimana: A = serapan
a = absorptivitas
b = ketebalan sel
c = konsentrasi
= absorptivitas molar
A11 = absorptivitas spesifik
2.2.5 Komponen Spektrofotometer Ultraviolet-Visibel
Biasanya spektrofotometer telah mempunyai software untuk mengolah data yang dapat dioperasikan melalui komputer yang telah terhubung dengan spektrofotometer (Moffat, dkk., 2005).
Komponen spektrofotometer UV-Vis adalah sebagai berikut:
1. Sumber-sumber lampu: lampu deuterium digunakan untuk daerah UV pada panjang gelombang dari 190-350 nm, sementara lampu halogen kuarsa atau lampu tungsten digunakan untuk daerah visibel pada panjang gelombang antara 350- 900 nm.
3. Optik-optik: dapat didesain untuk memecah sumber sinar melewati 2 kompartemen.
4. Detektor: digunakan sebagai alat yang menerima sinyal dalam bentuk radiasi elektromagnetik, mengubah, dan meneruskannya dalam bentuk sinyal listrik ke rangkaian sistem penguat elektronika. Respon tiap jenis detektor terhadap bagian dari spektrum radiasi tidak sama, sehingga setiap spektrofotometer menggunakan detektor yang paling cocok untuk daerah pengukurannya (Satiadarma, dkk., 2004; Gandjar dan Rohman, 2007).
2.3 Spektrofotometri Derivatif
2.3.1 Pengertian Spektrofotometri Derivatif
Spektrofotometri derivatif merupakan transformasi spektrum serapan menjadi spektrum derivatif pertama, kedua, atau spektrum derivatif orde lebih tinggi (Ditjen POM, 1995). Spektrofotometri derivatif merupakan metode manipulatif terhadap spektrum pada spektrofotometri ultraviolet-visibel (Moffat, dkk., 2005).
Pada spektrofotometri konvensional, spektrum serapan merupakan plot serapan (A) terhadap panjang gelombang ( ). Pada spektrofotometri derivatif, plot
A lawan , ditransformasikan menjadi plot dA/d lawan untuk derivatif pertama,
dan d2A/ d 2lawan untuk derivatif kedua, dan seterusnya.
A = f(λ), order nol
dA/dλ = f (λ), order pertama
Gambar 2.3. Spektrum serapan normal sampai derivat keempat (Talsky, 1994)
Gambar (a) menunjukkan spektrum serapan normal yang diderivatisasi sampai spektrum derivat keempatnya, sedangkan Gambar (b) menunjukkan spektrum yang saling tumpang tindih yang diderivatisasi mulai dari spektrum serapan normal hingga spektrum derivat keempat (Talsky, 1994).
Spektrum derivatif merupakan sebuah plot perubahan serapan dengan panjang gelombang. Spektrum derivatif pertama dilambangkan dengan dA/dλ, spektrum derivatif kedua dilambangkan dengan dA2/d 2, dan seterusnya (Ditjen POM, 1995). Hal ini dapat dilihat dari persamaan menurut hukum Lambert-Beer berikut ini :
dA/dλ =
bc x d cm dA ) 1 %, 1 (
dA2/dλ2 =
bc x d cm A d 2 2 ) 1 %, 1 (
dn =
2.3.2 Metode Spektrofotometri Derivatif
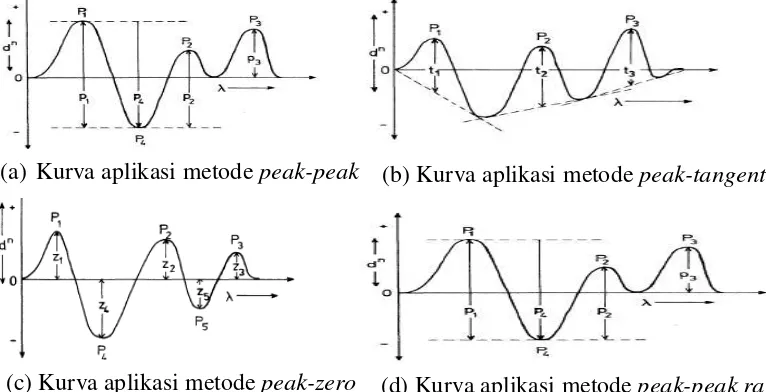
Ada empat metode umum yang digunakan untuk evaluasi spektra pada spektrofotometri derivatif yaitu metode peak-peak, metode peak-tangent, metode
peak-zero (zero crossing), metode peak-peak ratio (rasio spektra) (Talsky, 1994; Nurhidayati, 2007).
Pada metode peak-peak, absorbsinya diukur dari puncak maksimum sampai minimum yang ditunjukkan P1, P2, dan P3 pada gambar (a) sedangkan pada metode peak-tangent, absorbsinya diukur dari puncak maksimum sampai pertengahan puncak minimum yang dapat ditunjukkan pada t1, t2, dan t3 pada gambar (b). Pada metode peak-zero, absorbsinya diukur dari puncak maksimum sampai titik nol kurva yang ditunjukkan pada z1, z2, z3, z4, dan z5 pada gambar (c) sedangkan pada metode peak-peak ratio, absorbsinya diukur sebagai perbandingan antara P1 dengan P2 yang ditunjukkan pada gambar (d) (Talsky, 1994). Kurva aplikasi metode evaluasi spektra derivatif dapat dilihat pada Gambar
Gambar 2.4. Kurva aplikasi metode evaluasi spektra derivative (Talsky, 1994) (a) Kurva aplikasi metode peak-peak (b) Kurva aplikasi metode peak-tangent
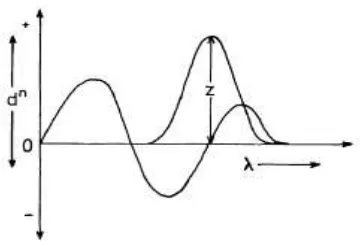
Metode zero crossing merupakan metode yang paling umum digunakan dalam pemilihan panjang gelombang analisis untuk campuran biner. Panjang gelombang zero crossing adalah panjang gelombang dimana senyawa tersebut mempunyai serapan nol dan menjadi panjang gelombang analisis untuk zat lain dalam campurannya. Pengukuran pada metode zero crossing tiap komponen dalam campuran merupakan fungsi tunggal konsentrasi dari yang lainnya (Nurhidayati, 2007). Kurva sederhana aplikasi zero crossing dapat dilihat pada Gambar 2.5.
Gambar 2.5. Kurva sederhana aplikasi zero crossing (Talsky, 1994)
2.3.3 Kegunaan Spektrofotometri Derivatif
Sebagai contoh yaitu penetapan kadar campuran pseuoefedrin HCl, triprolidin HCl dan dekstrometorfan HBr (Watson, 2005), penetapan kadar parasetamol dalam tablet kombinasi parasetamol dengan kofein secara sinar tampak (Naid, 2011), penetapan kadar efedrin dan zat warna dalam sediaan sirup (Cairns, 2008).
Beberapa keuntungan dari spektrofotometri derivatif antara lain yaitu spektrum derivatif memberikan gambaran struktur yang terinci dari spektrum serapan dan gambaran ini makin jelas dari spektum derivatif pertama ke derivatif keempat. Selain itu dapat dilakukan analisis kuantitatif suatu komponen dalam campuran dengan panjang gelombangnya saling berdekatan. Bila dibandingkan dengan kromatografi cair kinerja tinggi (KCKT), metode spektrofotometri derivatif relatif lebih sederhana, alat dan biaya operasionalnya lebih murah dan waktu analisisnya lebih cepat (Nurhidayati, 2007).
Kekurangan utama dari teknik ini adalah ketergantungannya pada parameter instrumentasi, seperti kecepatan pemindaian dan slit width. Kondisi instrumen saat pengukuran spektrum serapan normal memiliki banyak pengaruh pada bentuk dan intensitas dari spektrum derivatifnya (Ojeda dan Rojas, 2013). 2.4.Validasi Metode Analisis
Hasil validasi metode dapat digunakan untuk memutuskan kualitas, reabilitas, dan konsistensi dari hasil analisis. Adapun karakteristik dalam validasi metode menurut (USP 30 NF 25, 2007) yaitu akurasi, presisi, spesifisitas, batas deteksi, batas kuantitasi, linieritas, rentang, dan kekuatan/ketahanan.
2.4.1 Akurasi
Akurasi adalah kedekatan nilai hasil uji yang diperoleh melalui metode analisis dengan nilai yang sebenarnya. Akurasi dinyatakan dengan persen perolehan kembali (% recovery). Akurasi dapat ditentukan dengan dua metode, yaitu spiked-placebo recovery atau metode simulasi dan standard addition method
(metode penambahan baku). Pada metode spiked-placebo recovery, analit murni ditambahkan (spiked) ke dalam campuran bahan pembawa sediaan farmasi, lalu campuran tersebut dianalisis dan jumlah analit yang dianalisis dibandingkan dengan jumlah analit yang telah diketahui konsentrasinya dapat ditambahkan langsung ke dalam sediaan farmasi. Metode ini dinamakan metode penambahan baku atau standard addition method (USP 30 NF 25, 2007, Ermer dan McB. Miller, 2005, Harmita, 2004).
Menurut Harmita (2004), dalam metode penambahan baku, sejumlah sampel yang dianalisis ditambah analit dengan konsentrasi biasanya 80% sampai 120% dari kadar analit yang diperkirakan, dicampur, dan dianalisis kembali. Selisih kedua hasil dibandingkan dengan kadar yang sebenarnya. Dalam kedua metode tersebut, persen perolehan kembali dinyatakan sebagai rasio antara hasil yang diperoleh dengan hasil yang sebenarnya.
2.4.2 Presisi
Presisi adalah ukuran keterulangan metode analisis, termasuk di antaranya kemampuan instrumen dalam melakukan hasil analisis yang reprodusibel. Presisi dinyatakan sebagai standar deviasi relatif. Berdasarkan rekomendasi ICH (the International Conference on the Harmonisation), karakteristik presisi ada tiga tingkatan, yaitu keterulangan (repeatability), presisi antara (intermediate precision), dan reprodusibilitas (reproducibility). Keterulangan dilakukan dengan cara menganalisis sampel yang sama oleh analis yang sama menggunakan instrumen yang sama dalam periode waktu yang singkat. Presisi antara dikerjakan oleh analis yang berbeda sedangkan reprodusibilitas dikerjakan oleh analis yang berbeda dan di laboratorium yang berbeda (USP 30 NF 25, 2007; Satiadarma, dkk., 2004).
2.4.3 Spesifisitas
Spesifitas adalah suatu ukuran seberapa mampu metode tersebut mengukur analit saja dengan adanya senyawa-senyawa lain yang terkandung di dalam sampel (Watson, 2005). Secara umum, spesifitas dapat ditunjukkan oleh minimalnya gangguan oleh senyawa lain terhadap hasil analisis misalnya mendapatkan hasil yang sama dengan atau tanpa senyawa pengganggu. Pendekatan tidak langsung adalah lewat pengamatan karakteristik akurasi dari metode tersebut. Bila akurasi metode telah dapat diterima maka metode tersebut otomatis telah masuk kriteria sebagai metode yang spesifik (Ermer dan McB. Miller, 2005).
2.4.4 Batas Deteksi dan Batas Kuantifikasi
sampel yang masih dapat dideteksi, meskipun tidak dapat dikuantifikasi. Batas deteksi merupakan batas uji yang spesifik menyatakan apakah analit di atas atau dibawah nilai tertentu (Gandjar dan Rohman, 2007).
Batas Kuantifikasi didefinisikan sebagai konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan (Gandjar dan Rohman, 2007).
2.4.5 Linieritas
Linieritas adalah kemampuan suatu metode untuk memperoleh nilai hasil uji langsung atau setelah diolah secara metematika proporsional dengan konsentrasi
analit dalam sampel dalam batas rentang konsentrasi tertentu (Satiadarma, dkk., 2004). Linieritas dapat ditentukan secara langsung dengan
pengukuran analit pada konsentrasi sekurang-kurangnya lima titik konsentrasi yang mencakup seluruh rentang konsentrasi kerja (Ermer dan McB. Miller, 2005).
2.4.6 Rentang