I. Format Ujian
Ujian ini menggunakan format soal pilihan ganda dan esei (walaupun contoh esei tidak diberikan secara eksplisit, namun analisis pada setiap soal menunjukkan keperluan untuk memberikan penjelasan dan justifikasi). Soal-soal dirancang berdasarkan Taksonomi Bloom (revisi) dan empat dimensi pengetahuan: pengetahuan faktual, konseptual, prosedural, dan metakognitif. Setiap soal dikaitkan dengan level kognitif dan dimensi pengetahuan.
1.1 Jenis Soalan
Sebilangan besar soalan adalah pilihan ganda, dengan beberapa soalan yang memerlukan penjelasan ringkas dan analisis. Ini menunjukkan bahawa ujian mengukur bukan sekadar pengetahuan ingatan semata-mata, tetapi juga pemahaman dan aplikasi konsep.
1.2 Topik yang Dilindungi
Topik yang dilindungi merangkumi pelbagai aspek kimia, termasuk teori atom, konfigurasi elektron, bilangan kuantum, sifat-sifat unsur dalam jadual berkala, tindak balas kimia, keseimbangan asid-basa, sifat koligatif larutan, elektrokimia, dan isotop. Kandungannya nampaknya merangkumi silibus kimia sekolah menengah atas atau peringkat sarjana muda.
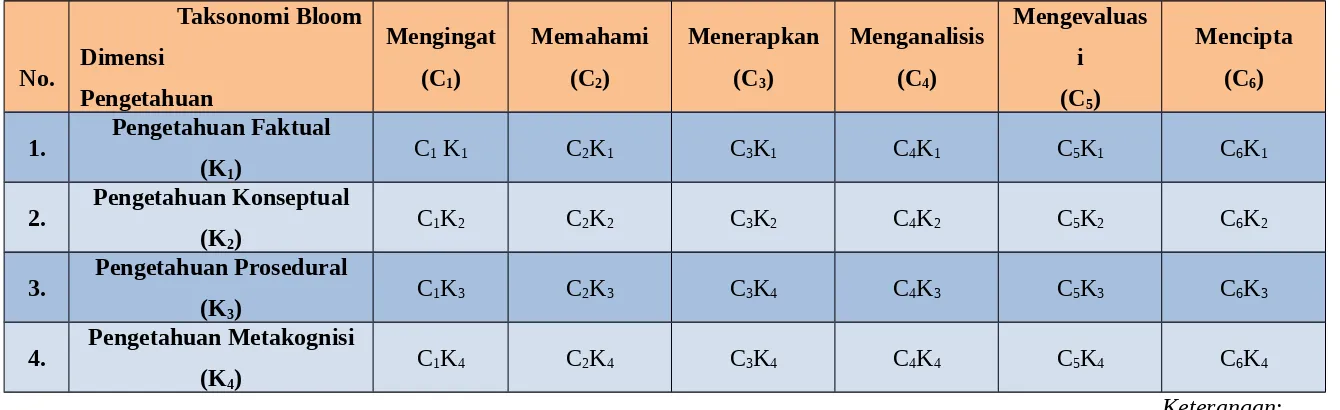
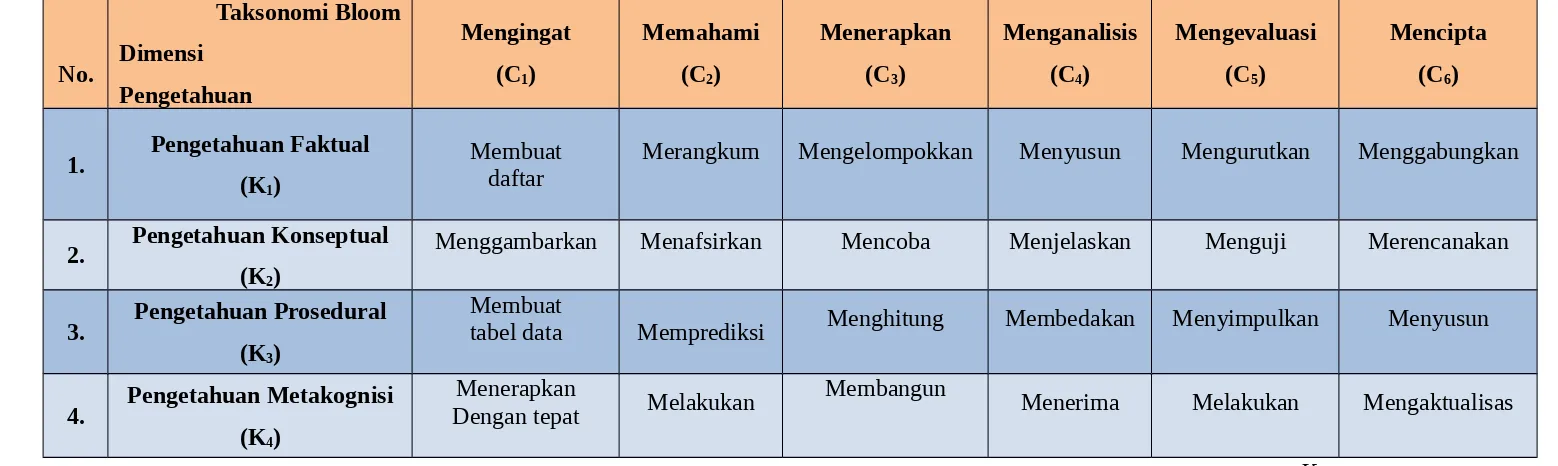
II. Analisis Soalan Mengikut Taksonomi Bloom
Dokumen ini menganalisis soalan kimia berdasarkan enam peringkat Taksonomi Bloom (revisi): Mengingat, Memahami, Menerapkan, Menganalisis, Mengevaluasi, dan Mencipta. Setiap soal disertakan dengan analisis terperinci tentang tahap kognitif dan dimensi pengetahuan yang diuji. Analisis ini menunjukkan bagaimana setiap soal dihubungkaitkan dengan objektif pembelajaran yang khusus.
2.1 Contoh Analisis Soalan (C1, K1)
Contoh: "Siapakah penemu elektron dan prinsip ketidakpastian elektron?" Analisis: Soal ini menguji tahap mengingat (C1) pengetahuan faktual (K1), iaitu mengingati fakta mengenai penemu elektron dan prinsip ketidakpastian. Jawapan: Thomson dan Niels Bohr.
2.2 Contoh Analisis Soalan (C3, K2)
Contoh: Soalan mengenai aplikasi konfigurasi elektron untuk menentukan golongan dan kala unsur. Analisis: Soal ini menguji tahap mengaplikasikan (C3) pengetahuan konseptual (K2), iaitu mengaplikasikan konsep konfigurasi elektron untuk menyelesaikan masalah berkaitan klasifikasi unsur.
2.3 Contoh Analisis Soalan (C6, K4)
Contoh: Soalan yang meminta pelajar untuk membuat kesimpulan tentang unsur-unsur dalam kala ketiga berdasarkan konfigurasi elektron. Analisis: Soal ini menguji tahap mencipta (C6) pengetahuan metakognitif (K4), iaitu mengaktualisasikan pengetahuan tentang konfigurasi elektron untuk membuat kesimpulan yang menyeluruh tentang sifat-sifat unsur.
III. Penilaian Relevan dan Reka Bentuk Ujian
Ujian ini menunjukkan usaha yang baik dalam mengukur pelbagai aspek kemahiran kognitif pelajar, mulai dari mengingat fakta hingga mencipta pengetahuan baharu. Penggunaan Taksonomi Bloom (revisi) memberikan kerangka kerja yang jelas dan sistematik dalam merancang soalan. Analisis terperinci untuk setiap soalan membolehkan pengesanan kelemahan dan penambahbaikan reka bentuk soalan pada masa hadapan.
3.1 Kekuatan Ujian
Ujian ini merangkumi pelbagai topik yang penting dalam kimia, dan tahap kerumitan soalan juga berbeza-beza. Penggunaan Taksonomi Bloom (revisi) membolehkan penilaian yang lebih komprehensif terhadap kemahiran berfikir pelajar.
3.2 Kelemahan Ujian
Walaupun terdapat contoh soalan, lebih banyak contoh soalan bagi setiap peringkat Taksonomi Bloom dan dimensi pengetahuan diperlukan untuk menggambarkan sepenuhnya reka bentuk ujian. Lebih banyak soalan esei perlu disertakan untuk menilai kemahiran pemikiran aras tinggi dengan lebih berkesan. Keseimbangan antara soalan pilihan ganda dan esei perlu dipertimbangkan untuk memastikan penilaian yang lebih seimbang.
3.3 Cadangan Penambahbaikan
Menambah lebih banyak contoh soalan esei yang memerlukan analisis, sintesis, dan evaluasi yang mendalam. Memastikan kesimbangan antara soalan pilihan ganda dan esei. Menyediakan rubrik pemarkahan yang jelas untuk soalan esei. Memperluas skop topik yang diuji supaya meliputi keseluruhan silibus.