LAPORAN PRAKTIKUM ILMU PENYAKIT TUMBUHAN
“MIKOLOGI”
Oleh : Nama : Nely Afifah NIM : 145040201111271 Kelompok : C2
Asisten : Ruli Rohmatul Hidayah
JURUSAN HAMA DAN PENYAKIT TUMBUHAN PROGRAM STUDI AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN UNIVERSITAS BRAWIJAYA
I. PENDAHULUAN 1.1 Pengertian Penyakit
Penyakit tumbuhan yaitu setiap kerusakan yang berkaitan dengan pengambilan nutrisi, mineral dan air, gangguan sintesa bahan makanan, translokasi dan metabolisme sedekimian rupa sehingga mempengaruhi penampakan dan atau hasil tanaman dibandingkan dengan tanaman sehat atau normal dari varietas tumbuhan yang sama karena adanya serangan pathogen atau gangguan faktor lingkungan (Abadi, 2000).
Penyakit sebenarnya adalah suatu proses dimana bagian-bagian tertentu dari organisme tidak dapat menjalankan fungsinya secara normal dengan sebaikbaiknya karena adanya suatu gangguan (Djafarudin, 2001).
A plant disease is usually defined as abnormal growth and/or dysfunction of a plant. Disease are the result of some disturbance in the normal life process of the plant (Small, 2011).
Plant pathology is the study of the organisms and of the environmental factors that cause disease in plants; of the mechanisms by which these factors induce disease in plants; and of the methods of preventing or controlling disease and reducing the damage it causes (Agrios, 2005).
1.2 Mekanisme Terjadinya Penyakit
Mekanisme terjadinya penyakit menurut Abadi (2003), yaitu memalui 5 tahapan:
1) Inokulasi atau penularan
Dimulai dari inokulum patogen sampai ke permukaan tubuh tanaman inang melalui perantara air, angin, serangga, dan sebagainya.
2) Penetrasi
Proses masuknya patogen atau bagian dari patogen ke dalam sel, jaringan, atau tubuh tanaman inang.
3) Infeksi
4) Invasi
Merupakan tahap pertumbuhan dan perkembangan patogen setelah terjadi infeksi.
5) Penyebaran
Merupakan proses berpindahnya patogen atau inokulum dari sumbernya ke tempat lain.
1.3 Cara Patogen Menyerang Tanaman
Cara patogen menyerang tumbuhan yaitu dengan mengonsumsi kandungan sel inang atau mengabsorbsi makanan dari tumbuhan inang secara terus menerus sehingga melemahkan tumbuhan inang, kemudian membunuh sel atau merusak aktivitas metabolisme sel inang karena enzim, toksin, dan zat tumbuh yang disekresikan patogen, setelah itu mengganggu transportasi makanan, nutrisi, mineral dan air pada jaringan pembuluh inang dan selanjutnya menghalangi atau mengurangi proses fotosintesis (Abadi, 2003).
Dalam menyerang tumbuhan, patogen mengeluarkan sekresi zat kimia yang akan berpengaruh terhadap komponen tertentu dari tumbuhan dan juga berpengaruh terhadap aktivitas metabolisme tumbuhan inang. Beberapa cara patogen untuk dapat masuk ke dalam inang diantaranya dengan cara mekanis dan cara kimia.
1. Cara Mekanis
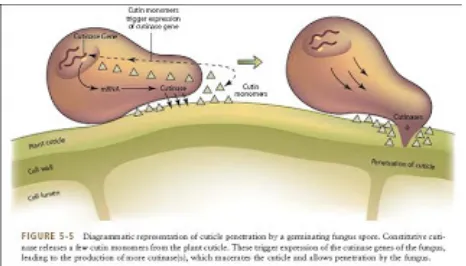
Cara mekanis yang dilakukan oleh patogen yaitu dengan cara penetrasi langsung ke tumbuhan inang. Dalam proses penetrasi ini seringkali dibantu oleh enzim yang dikeluarkan patogen untuk melunakkan dinding sel.
Gambar 1. Skema Penetrasi Patogen terhadap Dinding Sel Tanaman
2. Cara Kimia
II. ISOLASI II.1 Pengertian Isolasi
Isolasi mikroorganisme ialah proses pengambilan mikroorganisme dari lingkungannya untuk kemudian ditumbuhkan dalam suatu medium di laboratorium. Proses isolasi ini menjadi penting dalam mempelajari identifikasi mikrobia, uji morfologi, fisiologi, dan serologi. Sedangkan pengujian sifat-sifat tersebut di alam terbuka sangat mustahill untuk dilakukan (Pelczar,1986).
Isolation of the pathogen is a pathogen of the process of taking a medium or environment of origin and grow in an artificial medium in order to obtain pure cultures. Pathogens are moved from one place to another must use aseptic procedures. Aseptic means free from sepsis, a condition contaminated because of other microorganisms (Singleton dan Sainsbury, 2006).
II.2 Gejala yang Ditimbulkan Oleh Patogen 1. Alternaria porri
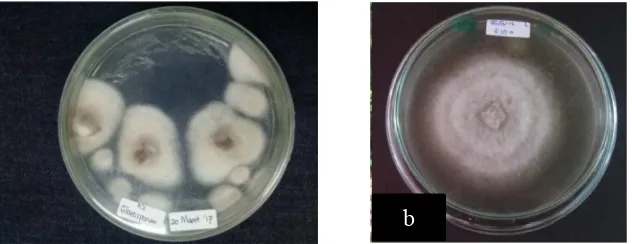
Gejala yang timbul akibat jamur ini menurut Semangun (1994), yaitu terdapat bercak melekuk, berwarna putih atau kelabu. Ukurannya bervariasi tergantung pada tingkat serangan. Pada serangan lanjut, bercak-bercak menyerupai cincin, warna agak keunguan dengan tepi agak kemerahan atau keunguan yang dikelilingi oleh zona berwarna kuning dan dapat meluas ke bagian atas atau bawah bercak, dan ujung daun mengering. Umbi yang terinfeksi oleh jamur A. porri tampak membusuk dan berair dimulai dari bagian leher dan tampak berwarna kuning atau merah kecoklatan.
Gambar 2. Dokumentasi gejala porri di lapang (a) dan gambar literatur (b)
2. Helminthosporium sp.
Gejala serangan akibat jamur ini menurut Semangun (1994), tanaman jagung yang terserang menampakkan gejala berupa bercak coklat kelabu seperti jerami pada permukaan daun. Sisi-sisi bercak sejajar dengan tulang daun utama dan pada tigkat serangan yang berat dapat menyebabkan daun mongering.
Gambar 3. Dokumentasi gejala Helminthosporium sp. di lapang (a) dan gambar literatur (b)
3. Fusarium oxysporum
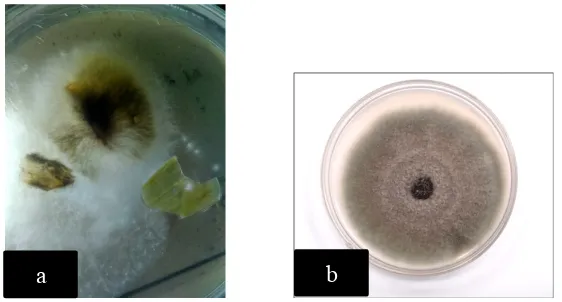
Menurut Varela and Seif (2004), penyakit layu Fusarium menunjukkan gejala yang ditandai dengan menguningnya daun yang lebih tua kemudian berubah menjadi kecoklatan dan layu tanaman akan merambat dan diikuti dengan runtuhnya tanaman. Jika batang yang terinfeksi dibelah, maka jaringan vascular menunjukkan perubahan warna cokelat. Menurut Dwiastuti, ME dkk. (2015), gejala awal penyakit ditandai dengan adanya perubahan warna pada bagian pucuk tanaman yang terserang menjadi cokelat kemerahan, kemudian bagian tersebut akan menjadi layu. Kelayuan tanaman dapat terjadi secara bertahap pada beberapa daun dan akan berkembang ke seluruh bagian tanaman. Gejala tanaman yang terserang parah ditandai oleh tanaman layu dan mati secara cepat. Akar tanaman sakit mengalami pembusukan.
Gambar 4. Dokumentasi gejala Fusarium oxysporum di lapang (a) dan gambar literatur (b)
4. Gloesporium sp.
Busuk buah (Gloeosporium Sp.). Gejala: bercak kecil cokelat dan bintikbintik hitam berubah menjadi orange.Busuk akar (Armilliaria Melea). Gejala: menjerang tanaman apel pada daerah dingin basah, ditandai dengan layu daun, gugur, dan kulit akar membusuk (Kusumo, S. 1986).
Gambar 5. Dokumentasi gejala Gloeosporium sp. di lapang (a) dan gambar literatur (b)
a b
II.3 Kenampakan Makroskopis Patogen pada Media Buatan 1. Alternaria porri
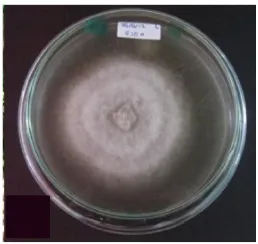
Koloni jamur yang telah diisolasi dimurnikan pada media PDA mempunyai warna abu-abu pada bagian tengah serta berwarna ke kuning-kuningan pada bagaian tepi (pinggir) hal ini didukung oleh pernyataan Veloso (2007) bahwa warna isolat berwarna abu-abu gelap dengan pusat berwarna ungu. Ukurannya sangat besar sehingga dapat dilihat melalui kaca pembesar.
Gambar 6. Kenampakan makroskopis jamur Alternaria porri
2. Helminthosporium sp.
Isolat jamur memiliki ciri makroskopis berupa koloni yang merupakan kumpulan hifa berwarna putih. Tekstur permukaan koloni dan bentuk tepi koloni dari jamur ini berserabut (Kusumadewi dkk., 2014).
Gambar 7. Kenampakan makroskopis jamur Helminthosporium sp.
3. Fusarium oxysporum
Gambar 8. Kenampakan makroskopis jamur Fusarium oxysporum
4. Gloeosporum sp.
Ciri makroskopis jamur ini berbentuk seperti lingkaran, berwarna putih dan tepi koloni tidak rata. Apabila dilihat dari permukaan bawahnya terdapat bintik-bintik hitam. Miselium dari isolasi jamur ini berwarna putih dan terdapat bintik-bintik hitam (Afriyeni, et al, 2013).
Gambar 9. Kenampakan makroskopis jamur Gloeosporium sp.
II.4 Cara Kerja Alat
Cutter : untuk memotong bagian tanaman yang terkena serangan
Pinset : untuk memindahkan potongan sampel bagian yang
bergejala.
Cawan Petri : sebagai tempat media (isolasi), alkohol, khloroks dan aquades
Bunsen : untuk menciptakan kondisi aseptis
Gelas ukur : untuk tempat alkohol (sterilisasi alat)
Plastik wrap : untuk meng-cover hasil isolasi di cawan petri
Bahan
Alkohol : untuk sterilisasi
Aquades : untuk sterilisasi
Kloroks : untuk meluruhkan mikroorganisme
Media PDA : untuk tempat media menanam isolat
Spesimen : sebagai bahan yang akan diamati
Cara Kerja
Mencuci sampel tanaman bergejala di air mengalir
Memotong bagian tanaman ½ sakit dan ½ sehat (± 1 cm)
Potongan sampel direndam dengan Kholorox selama 1 menit, Alkhohol selama 1 menit, dan Aquades selama 1 menit
Mengeringkan di tissue steril atau ditiriskan
Menanam isolat pada media PDA dan diberi label
Menutup dengan plastik wrap
Mengamati setiap hari selama 1 minggu dan medokumentasi
Analisa Perlakuan
II.5 Hasil dan Pembahasan Isolasi 1. Alternaria porri
Berdasarkan hasil pengamatan isolat jamur Alternaria porri dapat diketahui pada hari pertama sampai hari ketiga belum muncul koloni miselium , kemudian pada hari keempat mulai muncul koloni miselium berwarna putih pada satu irisan isolat dengan pusat isolat berwarna cokelat kehitaman. Selanjutnya pada hari kelima dan keenam, koloni miselium mulai meluas pada media PDA. Pada hari ketujuh, koloni miselium yang berwarna kekuningan pada bagian pusat irisan isolat. Sedangkan menurut Veloso (2007), koloni jamur yang telah diisolasi abu-abu gelap dengan pusat berwarna ungu dengan ukuran yang sangat besar sehingga dapat dilihat dengan kaca pembesar. Fitri (2014) menguraikan bahwa genus Alternaria memiliki koloni berwarna hijau keabuan dengan pinggiran putih, bulat, menyebar, bertekstur velvety (seperti beludru), dengan tepian rata seperti benang-benang. Permukaan koloni halus, topografi koloni verugose (kusut dan keriput), warna sebalik koloni (reserve side) hijau kehitaman, tinggi koloni 1 – 4 mm, tidak terdapat lingkaran konsentris dan garis radial. Miselium Alternaria keruh, berwarna coklat, bersel banyak dan berdinding halus.
Gambar 10. Isolat jamur Alternaria porri (a) dan gambar literatur (b)
2. Helminthosporium sp.
Jamur yang telah diisolasi selama tujuh hari menunjukkan karakteristik bahwa isolat jamur ini berwarna putih dan menyebar tidak konsentris. Pusat koloni berwarna cokelat dengan permukaan koloni
bertekstur kasar atau berserabut. Menurut Kusumadewi dkk. (2014), isolat jamur memiliki ciri makroskopis berupa koloni yang merupakan kumpulan hifa berwarna putih. Tekstur permukaan koloni berserabut dan bentuk tepi koloni juga berserabut.
Gambar 11. Isolat jamur Helminthosporium sp. (a) dan gambar literatur (b)
3. Fusarium oxysporum
Berdasarkan hasil pengamatan pada jamur yang telah diisolasi dapat diketahui bahwa koloni miseliumnya berwarna putih dengan pusat koloni berwarna cokelat, tekstur permukaan berserabut atau kasar dan tidak terlalu tebal.
Karakteristik makroskopis dari jamur Fusarium sp adalah miselium yang tumbuh pada medium PDA berwarna putih keunguan (7 his), arah pertumbuhan miselium ke samping dan struktur miselium halus (Elfina dkk.). Koloni Fusarium biasanya cepat tumbuh, pucat atau berwarna cerah. Warna talus bervariasi dari putih menjadi kuning, kecoklatan, merah muda, ungu muda kemerahan (Booth, 1977).
Gambar 12. Isolat jamur Fusarium oxysporum (a) dan gambar literatur (b)
4. Gloeosporum sp.
Berdasarkan hasil praktikum pada hari pertama setelah isolasi, sudah muncul koloni miselium yang tipis berwarna putih. Koloni miselium terus
b a
berkembang dan bertambah banyak memenuhi cawan petri. Koloni miselium yang akan diambil untuk purifikasi adalah yang berwarna putih, yang merupakan koloni miselium Gloeosporium sp (lingkaran putih besar), bukan yang berwarna kehitaman. Warna kehitaman pada hasil isolasi menunjukkan bahwa terjadinya kontaminasi. Menurut Afriyeni dkk. (2013), ciri makroskopis jamur ini berbentuk seperti lingkaran, berwarna putih dan tepi koloni tidak rata. Apabila dilihat dari permukaan bawahnya terdapat bintik-bintik hitam.
Gambar 13. Isolat jamur Gloeosporium sp. (a) dan gambar literatur (b)
III. PURIFIKASI III.1 Pengertian Purifikasi
Purifikasi atau disebut juga pemurnian adalah pemisahan satu jenis mikroorganisme patogen dari media inokulasi yang terdiri mungkin saja, dari beberapa macam mikroorganisme dalam satu media, purifikasi ini dilakukan untuk memudahkan dalam pengidentifikasian patogen tersebut (Semangun, 1996).
Purification of Pathogen Isolates is a way to separate one from other pathogens which aim to obtain pure cultures (Agrios, 1988).
III.2 Tujuan Purifikasi
Purifikasi bertujuan untuk mengisolasi mikroorganisme dari campurannya atau meremajakan kultur ke dalam medium baru. Sebelum melakukan pemurnian (purifikasi) terhadap suatu patogen tanaman, maka patogen tanaman pertama kali harus diisolasi ke dalam media buatan dan dibiakkan secara aseptik. Patogen selalu berasosiasi dengan bagian tanaman yang sakit sehingga harus dilakukan isolasi.
III.3 Cara Kerja Alat
Jarum Ose : digunakan untuk mengambil atau memindahkan koloni patogen
Wrapping : untuk membungkus media dan cawan petri.
Bunsen : digunakan untuk sterilisasi alat
Bahan
Alkohol : digunakan untuk sterilisasi
Spirtus : sebagai bahan bakar bunsen
Media PDA : untuk membiakkan biakan murni yang telah dipurifikasi.
Cara Kerja
Sterilisasi tempat dan alat yang akan digunakan
Meletakkan atau menanam di media PDA baru
Wrapping dan mendokumentasikan
Analisa Perlakuan
Langkah pertama dalam melakukan purifikasi yaitu mensterilkan tempat dan alat yang akan digunakan purifikasi, lalu mengambil sejumlah kecil koloni dari isolat yang telah tumbuh menggunakan jarum ose yang telah distrerilkan, kemudian meletakkan atau menanam di media PDA baru dan menutup dengan plastik wrap dan mendokumentasikannya.
III.4 Pembahasan Hasil Purifikasi 1. Alternaria porri
Berdasarkan hasil praktikum purifikasi jamur Alternaria porri yang telah dilakukan terlihat bahwa koloni jamur yang dimurnikan dari hasil isolasi tumbuh pada media PDA. Jamur mulai tumbuh ditandai dengan adanya miselium pada hari pertama. Perubahan warna miselium terjadi hingga hari ketujuh setelah isolasi. Miselium dari hasil isolasi yang dimurnikan berwarna putih dari pusat. Hasil praktikum sudah sesuai dengan literatur. Menurut Muksin dkk. (2013), koloni jamur yang telah diisolasi dimurnikan pada media PDA mempunyai warna abu-abu pada bagian tengah serta berwarna ke kuning-kuningan pada bagaian tepi (pinggir).
Gambar 14. Hasil purifikasi jamur Alternaria porri (a) dan gambar literatur (b)
2. Helminthosporium sp.
Berdasarkan hasil purifikasi jamur Helminthosporium sp. pada media PDA dapat dilihat bahwa koloni jamur ini mengalami perluasan ukuran diameter pada hari pertama hingga hari ketujuh. Ukurannya yaitu dari 1 cm pada hari pertama sampai 5 cm pada hari ketujuh. Bentuk koloni jamur ini yaitu failamentous dengan elevasi raised, serta margin filiform. Permukaan koloni jamur ini bertekstur halus, rapat, dan koloninya juga tebal. Koloni muda jamur ini berwarna putih dari hari pertama sampai hari ketujuh. Menurut Kusumadewi (2014), isolat jamur berupa koloni yang merupakan kumpulan hifa berwarna putih. Tekstur permukaan ddan bentuk tepi koloni jamur ini berserabut.
Gambar 15. Hasil purifikasi jamur Helminthosporium sp. (a) dan gambar literatur (b)
3. Fusarium oxysporum
Berdasarkan pengamatan pada isolat jamur Fusarium oxysporum yang telah dimurnikan dapat dilihat bahwa koloni jamur yang dibiakkan pada media PDA berwara putih dari pusat sampai ke tepi dengan tekstur miselium kasar atau berserabut.
Fusarium oxysporum membentuk miselium bersekat, membentuk percabangan dan dapat tumbuh dengan baik pada bermacam-macam medium agar yang mengandung ekstrak sayuran. Awalnya miselium tidak berwarna, semakin tua warna menjadi krem atau kuning pucat dalam keadaan tertentu berwarna merah muda agak ungu (Gandjar, et al., 1999). Pada miselium yang lebih tua terbentuk klamidospora. Jamur banyak membentuk mikrokonidium bersel satu, tidak berwarna, lonjong.
Makrokonidium lebih jarang terdapat, berbentuk kumparan, bersekat dua atau tiga (Agrios, 1996)
Gambar 16. Hasil purifikasi jamur Fusarium oxysporum (a) dan gambar literatur (b)
4. Gloeosporum sp.
Berdasarkan hasil praktikum purifikasi jamur Gloeosporium sp yang telah dilakukan terlihat bahwa koloni jamur mulai tumbuh ditandai dengan adanya miselium pada hari pertama setelah isolasi. Ukuran miselium dari hari pertama sampai hari ketujuh setelah purifikasi semakin besar yaitu pada hari pertama 1 cm sampai pada hari ketujuh yaitu 5 cm. bentuk koloni jamur ini yaitu failamentous dengan elevasi raised, serta margin filiform. Permukaan koloni jamur tersebut halus dan rapat, dan tebal. Miselium dari isolat jamur ini berwarna putih dan pada hari keenam dan ketujuh mulai terlihat perubahan warna menjadi putih keabu-abuan.
Ciri mikroskopisnya jamur ini menurut Afriyeni dkk. (2013), konidia berbentuk basil dan tersebar banyak di sekitar hifa. Konidianya bersekat antara dua sampai tiga sel, hifa hialin dan bersekat terbentuk tunggal pada ujung-ujung konidiofor, konidiofor pendek, tidak berwarna, tidak bercabang, tidak bersekat.
Gambar 17. Hasil purifikasi jamur Gloeosporium sp. (a) dan gambar literatur (b) b
a
IV. IDENTIFIKASI JAMUR IV.1 Pengertian Identifikasi
Pengertian identifikasi (penyakit) secara umum adalah membuat kepastian terhadap suatu penyakit berdasarkan gejala yang tampak, atau suatu proses untuk mengenali suatu penyakit tanaman melalui gejala dan tanda penyakit yang khas termasuk faktor-faktor lain yang berhubungan dengan proses penyakit tersebut (Nurhayati, 2012).
Identification is the effort introduction of a thing by observing its distinctive properties (Singleton dan Sainsbury, 2006).
IV.2 Cara Kerja Alat
Mikroskop : untuk mengidentifikasi kenampakan mikroskopis patogen
Objek glass & Cover glass : digunakan sebagai tempat isolat yang diamati
Jarum ose : untuk mengambil koloni
Kamera : untuk mendokumentasikan hasil identifikasi
Bahan
Aquades : untuk membersihkan alat
Alkohol : untuk mensterilkan alat
Biakan murni patogen : spesimen yang diamati
Cara Kerja
Menyiapkan biakan murni patogen
Mengambil dengan jarum ose
Meletakkan di preparat
Analisa Perlakuan
Langkah pertama menyiapkan biakan murni patogen lalu mengambilnya dengan jarum ose kemudian diletakkan di preparat dan diamati di bawah mikroskop perbesaran 10x lalu mendokumentasikannya.
IV.3 Pembahasan Hasil Identifikasi 1. Alternaria porri
Berdasarkan hasil identifikasi dibawah mikroskop dapat dilihat bentuk jamur A. porri berbentuk lonjong dan bersekat. Hifa pada jamur ini tidak bercabang. Menurut Weber (1973), miselium jamur berwarna cokelat, konidiofor tegak, bersekat, dengan ukuran 20 – 180 x 4 – 18 mikrometer. Konidium berbentk gada terbalik berwarna cokelat dengan sekat melintang sebanyak 6 – 12 buah dan 3 buah sekat membujur. Konidium mempunyai paruh (beak) pada ujungnya, paruh bersekat, panjang paruh lebih kurang setengah dari panjang konidium atau lebih.
Gambar 18. Kenampakan mikroskopis jamur Alternaria porri (a) dan gambar literatur (b)
2. Helminthosporium sp.
Berdasarkan identifikasi dengan menggunakan mikroskop dapat dilihat bahwa hifa jamur ini termasuk hifa yang bersekat dengan bentuk oval. Jamur ini memiliki hifa yang bercabang.
Hasil penelitian Soenartiningsih (2011) menunjukkan bahwa jamur Helminthosporium sp. merupakan jamur yang diisolasi dari penyakit hawar daun jagung dengan konidia yang berbentuk oval dengan banyak sekat dan konidiofor bersekat tanpa cabang. Barnett dan Hunter (1972),
menyatakan bahwa jamur Helminthosporium sp. memiliki konidia tunggal, tidak dalam bentuk rangkaian dan dihasilkan melalui pori pada sisi konidiofor dengan jumlah sekat 2 atau lebih.
Gambar 19. Kenampakan mikroskopis jamur Helminthosporium sp. (a) dan gambar literatur (b)
3. Fusarium oxysporum
Jamur yang telah di identifikasi dengan menggunakan mikroskop terlihat berbentuk basil dan tidak bersekat. Ciri mikroskopis jamur Fusarium sp. adalah memiliki dua jenis konidia (makrokonidia dan mikrokonidia). Makrokonidia terdiri atas tiga sel yang berbentuk sabit dan mikrokonidia satu sel dan berbentuk oval. Menurut Booth (1977), spesies Fusarium biasanya menghasilkan makrokonidia dan mikrokonidia dari phialid ramping, makrokonidianya hialin, dua sampai beberapa sel, fusiform sampai berbentuk sabit, sebagian besar dengan sel apikal memanjang dan sel basal, seperti yang ditemukan pada penelitian ini. Mikrokonidianya satu sampai dua sel, hialin, fusiform atau bulat telur, lurus atau melengkung.
Gambar 20. Kenampakan mikroskopis jamur Fusarium oxysporum (a) dan gambar literatur (b)
b a
4. Gloeosporum sp.
Berdasarkan hasil praktikum yang telah dilakukan, didapatkan hasil dari identifikasi mikroskopis jamur Gloeosporium sp. Dari hasil praktikum didapatkan adanya konidia yang berbentuk basil di sekitar hifa. Bahwa hifa dari jamur Gloeosporium sp bersekat dan tidak bercabang. Ciri mikroskopisnya adalah konidia berbentuk basil dan tersebar banyak di sekitar hifa. Konidianya bersekat antara dua sampai tiga sel, hifa hialin dan bersekat, terbentuk tunggal pada ujung-ujung konidiofor, konidiofor pendek, tidak berwarna, tidak bercabang, tidak bersekat (Afriyeni dkk., 2013).
Gambar 21. Kenampakan mikroskopis jamur Gloeosporium sp. (a) dan gambar literatur (b)
V. PENUTUP 5.1 Kesimpulan
Berdasarkan hasil praktikum isolasi, purifikasi, dan identifikasi dapat disimpulkan bahwa pada kegiatan isolasi, jamur Alternaria porri, Helminthosporium sp., Fusarium oxysporum, dan Gloeosporium sp. memiliki warna koloni miselium yang hampir sama yaitu berwarna putih tetapi berbeda pada permukaan koloni dan bagian pusat koloni. Dan pada kegiatan purifikasi terlihat semakin jelas warna koloni miselium pada masing-masing isolat yaitu berwarna putih dengan permukaan halus dan kasar atau berserabut. Sedangkan pada hasil identifikasi terlihat kenampakan mikroskopis masing-masing jamur hasil purifikasi menunjukkan bahwa keempat isolat tersebut memiliki sekat pada hifanya. Hasil identifikasi ada yang berbentuk lonjong seperti gada dan ada juga yang berbentuk oval.
5.2 Saran
DAFTAR PUSTAKA
Abadi, A. L. 2003. Ilmu Penyakit Tumbuhan II. Bayumedia Publishing. Malang. p 3.
Afriyeni, Yenita, Nasril, Nasir, Periadnadi, dan Jumjunidang. 2013. Jenis-jenis Jamur pada Pembusukan Buah Kakao (Theobroma cacao, L.) di Sumatera Barat. Jurnal Biologi Universitas Andalas. ISSN: 2303-2162- DRAFT. Agrios G.N. 1998. Fitopatología, 3era Edición, México, 838 pp
Agrios, George N. 2005. Plant Pathology Fifth Edition. Department of Plant Pathology University of Florida. Elsevier Academic Press.
Djafarudin. 2001. Dasar-dasar Perlindungan Tanaman (Umum). Bumi Aksara. Jakarta
Gholib, D. dan E. Kusumaningtyas. 2006. Penghambatan Pertumbuhan Fusarium Moniliforme oleh Trichoderma Viride. Balai Penelitian Veteriner. Bogor Kusumo, S. 1986. Apel (Malus sylvestris Mill). Penerbit Yasaguna. Jakarta. Martoredjo, T. 1984. Pengantar Ilmu Penyakit Tumbuhan Bagian dari
Perlindungan Tanaman. Andi Offset. Yogyakarta
Nurhayati. 2012. Diagnose Penyakit Tumbuhan. Penebar Swadaya. Jakarta Oka, I. N. 1993.Pengantar Epidemiologi Penyakit Tanaman. Gajah Mada
Panglipur et al., 2013. Uji Ketahanan Kalus Kultivar Tebu (S. officinarum L). Terhadap Penyakit Pokahbung Menggunakan Filtrat Kultur Fusarium Moniliforme Secara In Vitro. Jurusan HPT. FP. UB Malang
Pelczar, M. J. 1986. Chan Eement of Microbiology. Edisi 1. Penerjemah Ratna sri Hadioetomo et. al. UI Press. McGraw-Hill book company. [diunduh tanggal 18 April 2012].
Pitt, J. I. dan Hocking A.D. , 1999. Fungi and food spoilage, 2nd ed. Aspen Publ Inc. Gaithersburg, MD, USA
Semangun, H. 1993. Penyakit-penyakit Tanaman Pangan Di Indonesia. Gajah Mada University Press, Yogyakarta.
Semangun, Haryono. 2007. Penyakit- penyakit tanaman hortikultura di Indonesia. Edisi Kedua. Gadjah Mada University Press. Yogyakarta.
Singleton dan Sainsbury. 2006. Dictionary of Microbiology and Molecular Biology 3rd Edition. John Wiley and Sons. Sussex, England.
Sulastri. 2014. Identifikasi Penyakit Yang Disebabkan Oleh Jamur Dan Intensitas Serangannya Pada Tanaman Cabai (Capsicum annum L.) Di Kebun Percobaan Fakultas Pertanian Universitas Riau
Wakman, W dan Burhanuddin. 2007. Pengelolaan Penyakit Prapanen Jagung. Balai Penelitian Tanaman Serealia, Maros.