BAB II
TINJAUAN PUSTAKA
2.1 Uraian Hewan
Teripang atau timun laut termasuk dalam filum Echinodermata merupakan salah satu biota laut yang banyak ditemukan di perairan Indonesia, sebab secara geografis perairan Indonesia terletak di antara Samudera Pasifik dan Samudera Hindia merupakan habitat terbaik untuk hewan teripang. (Conand dan Byrne, 1993). Uraian hewan meliputi sistematika hewan, sinonim hewan, habitat hewan, morfologi hewan, reproduksi hewan, kandungan dan manfaat dan uraian kimia.
2.1.1 Sistematika hewan
Identifikasi sampel teripang di Pusat Penelitian Oseanografi LIPI. Dengan hasil sebagai berikut:
Filum : Echinodermata Kelas : Holothuroidea
Ordo : Aspidochirotida Grube, 1840 Famili : Holothuriidae Ludwig, 1894 Genus : Holothuria Linnaeus, 1767 Spesies : Holothuria atra Jaeger, 1833
2.1.2 Sinonim
2.1.3 Habitat
Teripang laut hampir ditemui pada semua habitat dalam lingkungan laut tetapi lebih tersebar dan mempunyai distribusi yang besar pada kawasan terumbu karang yang dangkal dengan kedalaman kira-kira 5 meter. Teripang laut bisa dijumpai pada kawasan pasang surut hingga dasar lautan yang dalam (20 meter) (Kwang, 2013).
2.1.4 Morfologi hewan
Teripang Holothuria atra mempunyai tubuh yang berbentuk langsing memanjang. Warna tubuh hitam, dengan tentakel kekuning-kuningan sepanjang 15-20 cm. Jenis ini hidup di perairan atau diantara karang yang tertutup pasir. Badannya tertutup pasir sehingga hanya nelayan yang biasa menangkapnya yang tahu persis tempat persembunyiannya (Ghufran dan Kordi, 2010).
Bagian oral teripang laut dikenali dengan adanya tentakel di bagian tersebut sedangkan bagian anus atau aboral teripang laut terdapat saluran kloaka. Kebanyakan teripang laut merupakan pemakan endapan yang akan menelan sedimen dan mengekstrak komponen organik dalam sedimen (Kwang, 2013).
Jenis kelamin teripang laut tidak dapat dibedakan secara morfologi luar dan hanya dapat diidentifikasi dengan memperhatikan warna gonad di bawah mikroskop dan secara histologi. Gonad jantan pada Holothuria atra berwarna kuning sedangkan betina berwarna merah jambu (Kwang, 2013).
2.1.4 Reproduksi hewan
betina berukuran 600 g dapat mengeluarkan telur 4-5 juta butir dengan ukuran bervariasi antara 160-180 mikron (Ghufran dan Kordi, 2010).
Proses pembuahan terjadi diluar tubuh. Teripang betina biasanya mengeluarkan telur-telurnya terlebih dahulu, kemudian langsung dibuahi oleh sperma jantan. Beberapa jenis teripang di laut dalam, setelah telur dibuahi, telur tersebut akan ditangkap kembali oleh betina dengan tentakelnya, kemudian ditransfer kedalam kantung pengeraman. Telur tersebut akan berkembang dan menetas 32 jam setelah pembuahan (Ghufran dan Kordi, 2010).
2.1.6 Kandungan dan manfaat
Teripang telah dimanfaatkan cukup lama di Indonesia terutama oleh masyarakan sekitar pantai sebagai bahan makanan. Sebagai bahan pangan, teripang mempunyai nilai gizi yang cukup tinggi. Manfaat teripang untuk kesehatan juga sangat banyak, teripang memiliki kandungan Cell Growth factor yang mampu merangsang regenerasi sel dan jaringan yang rusak. Teripang kering mempunyai kadar protein tinggi, yaitu 82% dan mengandung asam lemak tidak jenuh yang penting untuk kesehatan jantung dan mujarab memperkuat sel hati untuk mengeluarkan antibodi. Teripang juga mengandung lebih dari 80% kolagen menyebabkan teripang disebut imunomodulator (Widodo, 2013).
2.1.7 Uraian Kimia
a. Saponin
Saponin mula-mula diberi nama demikian karena sifatnya yang khas menyerupai sabun (bahasa latin sapo = sabun) (Robinson, 1995). Saponin adalah glikosida yang aglikonnya disebut sapogenin. Keberadaan saponin sangat mudah ditandai dengan pembentukan larutan koloidal dengan air yang apabila dikocok menimbulkan buih yang stabil. Saponin juga bersifat menghancurkan butir darah merah lewat reaksi hemolisis darah (Farnsworth, 1966; Gunawan dan Mulyani, 2004).
Berdasarkan struktur dari aglikonnya, saponin dapat dibedakan menjadi dua macam, yaitu saponin steroid dan saponin triterpenoid. Saponin steroid/triterpenoid mudah larut dalam air dan alkohol, tetapi tidak larut dalam eter. Saponin steroid/triterpenoid tersusun dari suatu aglikon steroid/triterpenoid (sapogenin) yang terikat pada suatu oligosakarida yang biasanya heksosa dan pentosa (Farnsworth, 1966). Hasil hidrolisisnya, yaitu sapogenin mudah larut dalam pelarut organik (seperti kloroform, eter, n-heksan) dan tidak larut dalam air (Trease dan Evans, 1983).
antivirus, juga menawarkan potensi yang cukup besar dalam mengelola berbagai penyakit (Francis, dkk., 2002).
b. Steroid/Triterpenoid
Steroid adalah triterpena yang kerangka dasarnya sistem cincin siklopentana perhidrofenantrena. Steroida dianggap sebagai senyawa satwa tetapi makin banyak senyawa steroida yang ditemukan dalam jaringan tumbuhan (fitosterol). Tiga senyawa yang biasa disebut fitosterol terdapat pada hampir setiap tumbuhan tinggi yaitu: sitosterol, stigmasterol dan kampesterol (Harborne, 1987). Beberapa senyawa steroid barangkali mempunyai peran dalam struktur membrane, sebagai hormon kelamin dan feromon, pada tumbuhan steroid berperan sebagai pelindung dari serangga (Robinson, 1995).
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam satuan isoprene dan secara biosintesis diturunkan dari hidrokarbon C-30 asiklik yaitu skualena. Triterpenoid dapat dibagi atas empat golongan yaitu triterpenoid sebenarnya, steroid, saponin dan glikosida jantung. Triterpena atau steroid yang terutama terdapat sebagai glikosida. Triterpenoid merupakan senyawa yang berbentuk kristal, bertitik leleh tinggi dan optik aktif, yang umumnya sukar dicirikan karena tidak mempunyai kereaktifan kimia. Sebagian besar senyawa ini memberikan warna hijau-biru dengan pereaksi Liebermann-Burchard (asam asetat anhidrida-asam sulfat pekat (Harborne, 1987).
2.2 Ekstraksi
Ekstraksi adalah suatu proses pemisahan kandungan senyawa kimia dari jaringan tumbuhan maupun hewan. Sebelum ekstraksi dilakukan biasanya bahan-bahan dikeringkan terlebih dahulu kemudian dihaluskan pada derajat kehalusan tertentu (Harborne, 1987).
Menurut Depkes RI (2000), beberapa metode ekstraksi yang sering digunakan dalam berbagai penelitian antara lain yaitu:
a. Cara Dingin 1. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman menggunakan pelarut dengan sesekali pengadukan pada temperatur kamar. Maserasi yang dilakukan pengadukan secara terus-menerus disebut maserasi kinetik sedangkan yang dilakukan pengulangan penambahan pelarut setelah penyaringan terhadap maserat pertama dan seterusnya disebut remaserasi. 2. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pelembaban bahan, tahap perendaman antara dan tahap perkolasi sebenarnya (penetesan/ penampungan ekstrak).
b. Cara Panas 1. Refluks
2. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pda temperatur lebih tinggi daripada temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-50ºC.
3. Sokletasi
Sokletasi adalah proses penyarian berulang-ulang dengan pelarut tertentu yang mudah menguap, dilakukan dengan menggunakan soklet sehingga menjadi ekstraksi kontinu dengan pelarut relatif konstan dengan adanya pendingin balik.
4. Infundasi
Infundasi adalah proses penyarian dengan pemanasan menggunakan pelarut air pada temperatur 90ºC selama 15 menit.
5. Dekoktasi
Dekoktasi adalah proses penyarian dengan pemanasan menggunakan pelarut air pada temperatur 90ºC selama 30 menit.
2.2.1 Ekstraksi cair-cair
Ekstraksi cair-cair merupakan suatu teknik yang mana suatu larutan (biasanya dalam air) dibuat bersentuhan dengan pelarut kedua (biasanya pelarut organik), yang pada hakikatnya tidak tercampurkan, pada proses ini terjadi pemindahan satu atau lebih zat terlarut (solute) kedalam pelarut yang kedua. Pemisahan yang dilakukan bersifat sederhana, bersih, cepat, dan mudah, yang dapat dilakukan dengan cara mengocok-ngocok dalam sebuah corong pisah selama beberapa menit (Bassett, dkk., 1994).
mudah mengalami ionisasi dan senyawa polar lainnya akan tertahan dalam fase air Pelarut organik yang dipilih untuk ekstraksi pelarut ialah pelarut yang mempunyai kelarutan yang rendah dalam air (>10%), dapat menguap sehingga memudahkan penghilangan pelarut organik setelah dilakukan ekstraksi, dan mempunyai kemurnian yang tinggi untuk meminimalkan adanya kontaminasi sampel (Rohman, 2007)
2.3 Radikal Bebas
Radikal bebas adalah setiap molekul yang mengandung satu atau lebih elektron yang tidak berpasangan. Radikal bebas memiliki reaktivitas yang sangat tinggi, hal ini ditunjukkan dengan sifatnya yang segera menarik electron yang disekelilingnya (Kosasih, dkk., 2004).
Senyawa ini sangat reaktif dan dengan mudah menjurus ke reaksi yang tidak terkontrol menghasilkan ikatan silang (cross-link) pada DNA, protein, lipida atau kerusakan oksidatif pada gugus fungsional yang penting pada biomolekul.. Radikal bebas juga terlibat dan berperan dalam patologi dari berbagai penyakit degeneratif, yakni kanker, aterosklerosis, rematik, jantung koroner, katarak dan penyakit degenerasi saraf seperti parkinson (Silalahi, 2006).
Golongan senyawa oksigen reaktif antara lain adalah hidroksil (OH-), superoksida (O2-), peroksidal (RO2-), asam hipoklorit (HOCl) dan hidrogen peroksida (H2O2) (Ionita, 2005).
Menurut Kumalaningsih (2006), pembentukan radikal bebas melalui 3 tahapan reaksi, yaitu:
a. tahap inisiasi: tahap awal terbentuknya radikal bebas.
c. tahap terminasi: terjadinya pengikatan suatu radikal bebas dengan radikal bebas yang lain sehingga membentuk senyawa non-radikal yang biasanya kurang reaktif dari radikal induknya.
2.4 Antioksidan
Antioksidan atau reduktor berfungsi untuk mencegah terjadinya oksidasi atau menetralkan senyawa yang telah teroksidasi dengan cara menyumbangkan hidrogen dan atau elektron (Silalahi, 2006).
Atas dasar fungsinya antioksidan dapat dibedakan menjadi 5 (lima) sebagai berikut.
a. Antioksidan primer
Antioksidan ini berfungsi untuk mencegah terbentuknya radikal bebas yang baru karena dapat merubah radikal bebas yang ada menjadi molekul yang berkurang dampak negatifnya. Seperti SOD, glutation peroksidase dan katalase. Antioksidan primer sering disebut antioksidan enzimatis.
b. Antioksidan sekunder
Antioksidan sekunder merupakan senyawa yang berfungsi menangkap radikal bebas serta mencegah terjadinya reaksi berantai sehingga tidak terjadi kerusakan yang lebih besar. Contoh yang populer, antioksidan sekunder adalah vitamin E, vitamin C dan β-karoten yang dapat diperoleh dari buah-buahan.
c. Antioksidan tersier
d. Oxygen scavenger
Antioksidan yang termasuk oxygen scavenger mengikat oksigen sehingga tidak mendukung reaksi oksidasi, misalnya vitamin C.
e. Chelators atau sequesstrants
Mengikat logam yang mampu mengkatalisis reaksi oksidasi misalnya asam sitrat dan asam amino (Kumalaningsih, 2006).
2.4.1 Antioksidan alami
Sayur-sayuran dan buah-buahan kaya akan zat gizi (vitamin, mineral, serat pangan) serta berbagai kelompok zat bioaktif lain yang disebut zat fitokimia. Zat bioaktif ini bekerja secara sinergis, meliputi mekanisme enzim detoksifikasi, peningkatan sistem kekebalan, pengurangan agregasi platelet, pengaturan sintesis kolesterol dan metabolisme hormon, penurunan tekanan darah, antioksidan, antibakteri serta efek antivirus (Silalahi, 2006).
2.4.2 SOD (Superoxide dismutase)
Superoksida dismutase (SOD) merupakan salah satu enzim antioksidan penting yang berasal dari tubuh sendiri, berefek sangat kuat dan merupakan pertahanan tubuh garis pertama dalam mengatasi stres oksidatif (Rajkumar, dkk., 2008). SOD merupakan antioksidan pencegah yang dapat menghambat, sebelum anion superoksida menyebabkan kerusakan. Cara kerja SOD adalah dengan mengkonversi anion superoksida (O2-) menjadi komponen lain yang kurang berbahaya, yaitu hidrogen peroksida (H2O2) yang selanjutnya dengan bantuan katalase diubah menjadi air (H2O) (Behndig, dkk., 1998).
mitokondria, ekstraseluler SOD (EC-SOD) dan besi-SOD (Fe-SOD) yang hanya ditemukan pada tumbuhan (Putra, 2014).
Enzim SOD terdapat dalam semua organisme aerob dan sebagian besar berada dalam tingkat subseluler (intraseluler). Organisme aerob selalu membutuhkan oksigen untuk hidupnya, namun dalam setiap aktivitasnya dapat menimbulkan senyawa oksigen reaktif atau ROS. SOD merupakan enzim antioksidan pencegah, yang merupakan suatu antioksidan metalloenzim. SOD berefek sangat kuat dan merupakan pertahanan tubuh pertama dalam menghadapi serangan radikal bebas. SOD adalah enzim antioksidan intraseluler utama yang dapat digunakan untuk menetralisir aktivitas O2- (Putra, 2014).
2.5 Penentuan Aktivitas Antioksidan Dengan Metode DPPH
Pada tahun 1922, Goldschmidt dan Renn menemukan senyawa berwarna ungu radikal bebas stabil DPPH, yang sekarang digunakan sebagai reagen kolorimetri untuk proses redoks. DPPH sangat berguna dalam berbagai penyelidikan seperti inhibisi atau radikal polimerisasi kimia, penentuan sifat antioksidan amina, fenol atau senyawa alami (vitamin, ekstrak tumbuh-tumbuhan, obat obat-obatan) dan untuk menghambat reaksi homolitik. DPPH berwarna sangat ungu seperti KMnO4 dan bentuk tereduksinya yaitu 1,1-difenil-2-picrylhydrazine (DPPH-H) yang berwarna oranye-kuning. DPPH tidak larut dalam air (Ionita, 2005).
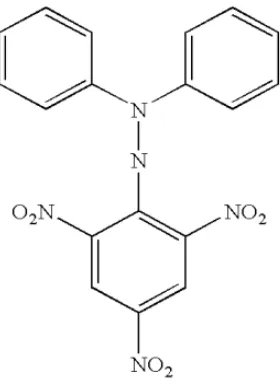
2.5.1 DPPH
dengan rumus molekul C18H12N5O6, larut dalam air. Penyimpanan dalam wadah tertutup baik pada suhu -20°C (Molyneux, 2004).
Gambar 2.1 Rumus Bangun DPPH (Molyneux, 2004)
DPPH merupakan radikal bebas yang stabil pada suhu kamar. Prinsip metode pemerangkapan radikal bebas DPPH, yaitu elektron ganjil pada molekul DPPH memberikan serapan maksimum pada panjang gelombang 516 nm. Interaksi antioksidan dengan DPPH baik secara transfer elektron atau radikal hidrogen pada DPPH akan menetralkan karakter radikal bebas dari DPPH (Molyneux, 2004). Warna ungu larutan DPPH akan berubah menjadi kuning lemah apabila elektron ganjil tersebut berpasangan dengan atom hidrogen yang dari senyawa antioksidan (Prakash, 2001). Reaksi radikal bebas DPPH dengan antioksidan dapat dilihat pada gambar 2.2 berikut:
2.5.2 Pelarut
Metode DPPH akan bekerja dengan baik menggunakan pelarut metanol atau etanol karena kedua pelarut ini tidak mempengaruhi dalam reaksi antara sampel uji sebagai antioksidan dengan DPPH sebagai radikal bebas (Molyneux, 2004).
2.5.3 Pengukuran panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal (Gandjar dan Abdul, 2007). Panjang gelombang maksimum (λmaks) yang digunakan dalam pengukuran sampel uji pada metode pemerangkapan radikal bebas DPPH sangat bervariasi. Menurut beberapa literatur, panjang gelombang maksimum untuk DPPH antara lain 515-520 nm (Molyneux, 2004).
2.5.4 Waktu pengukuran
Waktu pengukuran atau waktu kerja (operating time) bertujuan untuk mengetahui waktu yang tepat untuk melakukan pengukuran yakni saat sampel dalam kondisi yang stabil. Waktu pengukuran yang digunakan dalam beberapa penelitian sangatlah bervariasi, yaitu 1-240 menit. Waktu pengukuran yang paling banyak direkomendasikan menurut literatur adalah 60 menit (Rosidah, dkk., 2008; Molyneux, 2004; Marinova dan Batchvarov, 2011).
2.6 Spektrofotometri UV-Visibel
pengukuran kualitatif dari suatu zat dengan ketelitian yang lebih besar (Day dan Underwood, 1986).