LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT PRADJA PHARIN (PRAFA), DESA KARANG ASEM
BARAT, CITEUREUP, KABUPATEN BOGOR
PERIODE 8 JANUARI - 28 FEBRUARI 2013
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
REDHO MEISUDI, S.Farm.
1206313596
ANGKATAN LXXVI
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
FEBRUARI 2013
DI PT PRADJA PHARIN (PRAFA), DESA KARANG ASEM
BARAT, CITEUREUP, KABUPATEN BOGOR
PERIODE 8 JANUARI - 28 FEBRUARI 2013
Diajukan sebagai salah satu syarat untuk memperoleh gelar
Apoteker
REDHO MEISUDI, S.Farm.
1206313596
ANGKATAN LXXVI
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
FEBRUARI 2013
Alhamdulillaahirabbil’aalamiin. Segala puji syukur kehadirat Allah
SWT yang telah memberikan limpahan rahmat dan kasih sayang-Nya sehingga penulis dapat menyelesaikan Praktek Kerja Profesi Apoteker (PKPA) Angkatan LXXVI Universitas Indonesia, di PT Pradja Pharin (Prafa) yang dilaksanakan mulai tanggal 8 Januari - 28 Februari 2013. Kegiatan PKPA dan penyusunan laporan PKPA merupakan bagian dari kegiatan perkuliahan program pendidikan profesi apoteker dengan tujuan untuk meningkatkan pemahaman, pengetahuan dan keterampilan mahasiswa. Mahasiswa yang telah mengikuti kegiatan PKPA diharapkan dapat mengaplikasikan pengetahuan dan keterampilan yang dimiliki saat memasuki dunia kerja. Kegiatan PKPA dapat terlaksana dengan baik berkat bantuan dari berbagai pihak. Oleh karena itu, pada kesempatan ini penulis ingin menyampaikan terimakasih kepada :
1. Prof. Dr. Yahdiana Harahap, MS., Apt., sebagai Dekan Fakultas Farmasi. 2. Dr. Harmita, Apt., sebagai Ketua Program Profesi Apoteker, Fakultas
Farmasi.
3. Dewi Sulistyowati, S.Farm., Apt., sebagai Manager Quality Control dan pembimbing dari PT Pradja Pharin (Prafa) yang telah memberikan bimbingan dan arahan kepada penulis selama penulisan laporan PKPA.
4. Dr. Mahdi Jufri, M.Si., sebagai pembimbing dari Fakultas Farmasi yang telah memberikan ilmu, bimbingan dan nasehat yang begitu bermanfaat.
5. Bapak Teguh Supriyanto, sebagai Manager Personal and General Affair dan koordinator pelaksanaan PKPA di PT Pradja Pharin (Prafa).
6. Aprilia Primadawati, S.Farm., Apt. (Qualification, Calibration and Validation Supervisor) dan Anggita Mirzautika, S.Farm., Apt., (Analytical Methode Development Section Head) sebagai pembimbing di Departemen Quality Assurance dan Quality Control di PT Pradja Pharin (Prafa).
yang diberikan selama penulis menjalani pendidikan di Program Profesi Apoteker.
9. Keluarga tercinta atas kesabarannya, kasih sayang, dukungan, perhatian dan doanya untuk menyelesaikan pendidikan profesi Apoteker dengan sebaik mungkin.
10. Mamik Yuniarsih, S.Farm., sebagai rekan PKPA di PT Pradja Pharin (PRAFA) yang telah berbagi ilmu, pengalaman dan juga menghibur selama pelaksanaan PKPA.
11. Seluruh sahabat dan teman Program Profesi Apoteker Fakultas Farmasi sebagai teman seperjuangan yang telah memberikan dukungan dan semangat.
Penulis menyadari bahwa penyusunan laporan PKPA ini masih jauh dari kesempurnaan. Oleh karena itu, penulis dengan senang hati menerima segala kritik dan saran demi perbaikan di masa yang akan datang. Tak ada yang penulis harapkan selain sebuah keinginan agar laporan PKPA ini dapat bermanfaat bagi pengembangan ilmu pengetahuan pada umumnya dan ilmu farmasi pada khususnya.
Penulis 2013
Sebagai sivitas akademik Universitas Indonesia, saya yang bertanda tangan di bawah ini:
Nama : Redho Meisudi
NPM : 1206319091
Program Studi : Apoteker
Fakultas : Fakultas Farmasi
Jenis Karya : Laporan Praktek Kerja Profesi Apoteker
demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Indonesia Hak Bebas Royalti Noneksklusif (Non-exclusive Royalty
Free Right) atas karya ilmiah saya yang berjudul:
Laporan Praktek Kerja Profesi Apoteker di PT Pradja Pharin (Prafa), Desa Karang Asem Barat, Citeureup, Kabupaten Bogor, Periode 8 Januari-28 Februari 2013
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Noneksklusif ini Universitas Indonesia berhak menyimpan, mengalihmedia/format-kan, mengelola dalam bentuk pangkalan data (database), merawat dan mempublikasikan tugas akhir saya selama tetap mencantumkan nama saya sebagai penulis/pencipta dan sebagai pemilik Hak Cipta.
Demikian pernyataan ini saya buat dengan sebenarnya. Dibuat di : Depok Pada tanggal : 25 Juni 2013
Yang menyatakan
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... vi
DAFTAR GAMBAR ... vii
DAFTAR TABEL ... viii
DAFTAR LAMPIRAN ... ix
BAB 1. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan ... 2
BAB 2. TINJAUAN UMUM INDUSTRI FARMASI ... 3
2.1. Manajemen Mutu ... 3
2.2. Personalia ... 4
2.3. Bangunan dan Fasilitas ... 4
2.4. Peralatan ... 4
2.5. Sanitasi dan Higiene ... 5
2.6. Produksi ... 5
2.7. Pengawasan Mutu ... 5
2.8. Inspeksi Diri dan Audit Mutu ... 6
2.9 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian ... 6
2.10. Dokumentasi ... 7
2.11. Pembuatan dan Analisis Berdasarkan Kontrak ... 7
2.12. Kualifikasi dan Validasi ... 7
2.13. Pembuatan Produk Steril ... 11
2.14. Sistem Komputerisasi ... 12
BAB 3. TINJAUAN KHUSUS PT PRADJA PHARIN (PRAFA) ... 13
3.1. Plant Department ... 13
3.2. Logistic Department ... 16
3.3. Production Department ... 25
3.4 Quality Assurance Department ... 37
3.5. Quality Control Department... 45
3.6. Technical Department ... 51
3.7. Personal and General Affairs Department ... 56
3.8. Research and Development Department ... 64
BAB 4. PEMBAHASAN ... 68
BAB 5. KESIMPULAN DAN SARAN ... 72
5.1. Kesimpulan... 72
5.2. Saran ... 72
Gambar 3.2 Struktur organisasi Logistic Department... 16
Gambar 3.3 Alur penerimaan bahan baku dan bahan kemas... 20
Gambar 3.4 Struktur organisasi Production Department ... 25
Gambar 3.5 Alur produksi sediaan solid dengan granulasi basah ... 28
Gambar 3.6 Alur produksi sediaan solid dengan spraying ... 29
Gambar 3.7 Alur produksi sediaan solid dengan granulasi kering... 30
Gambar 3.8 Alur produksi sediaan steril ... 32
Gambar 3.9 Alur pengemasan sekunder ... 35
Gambar 3.10 Struktur organisasi Quality Assurance Department ... 37
Gambar 3.11 Struktur organisasi Quality Control Department ... 45
Gambar 3.12 Struktur organisasi Technical Department ... 51
Gambar 3.13 Struktur organisasi Personal and General Affairs Department ... 56
Gambar 3.14 Struktur organisasi Research and Development Department ... 64
Lampiran 1. Peta Lokasi PT Prafa ... 74 Lampiran 2. Denah PT Prafa ... 75
1.1. Latar Belakang
Orientasi produk farmasi adalah produk yang berkualitas, aman dan berkhasiat. Dalam rangka orientasi tersebut, para pemangku kepentingan melakukan usaha-usaha untuk memfasilitasi penjualan produk farmasi, mempromosikan keseragaman perizinan dan memastikan pemeliharaan standar tinggi pada penjaminan mutu dalam pengembangan, pembuatan dan pengawasan produk farmasi. Usaha-usaha tersebut diaktualisasikan dalam Pedoman dan Petunjuk Operasional Cara Pembuatan Obat yang Baik (CPOB).
Pemenuhan dan penerapan CPOB oleh industri farmasi diharapkan akan meningkatkan mutu produk farmasi secara terus menerus serta memberikan perlindungan yang lebih baik terhadap kesehatan masyarakat. Dalam rangka pemenuhan dan penerapan CPOB, keterlibatan apoteker dalam industri farmasi sangat diperlukan karena kompetensi dan kualifikasi yang dimilikinya. Selain itu, CPOB juga mengatur peran penting apoteker dalam industri farmasi sebagai penanggungjawab produksi, pengawasan mutu dan penjaminan mutu. Oleh karena itu, mahasiswa apoteker dalam masa pendidikannya harus mengimplementasikan ilmu yang dimilikinya melalui Praktek Kerja Profesi Apoteker (PKPA) pada industri farmasi dalam rangka pemenuhan dan penerapan CPOB.
PT Pradja Pharin (Prafa) merupakan industri farmasi yang tepat dalam pelaksanaan PKPA karena telah memenuhi dan menerapkan CPOB. Selain itu, Prafa memiliki jenis produk yang bervariasi seperti sediaan solid, semi solid, liquid, dry injection, steril liquid injection, obat golongan cephalosporin dan beta laktam. Prafa juga merupakan pusat penelitian dan pengembangan Unilab Indonesia. Oleh karena itu, Prafa merupakan sarana pendidikan yang tepat bagi apoteker dalam rangka mengimplementasikan ilmu yang dimilikinya untuk pemenuhan dan penerapan CPOB.
1.2. Tujuan
Praktek Kerja Profesi Apoteker (PKPA) di PT Pradja Pharin (Prafa), bertujuan agar para calon Apoteker :
1.2.1. Mengetahui dan memahami peran / tanggung jawab seorang Apoteker sebagai penanggungjawab produksi, pengawasan mutu dan penjaminan mutu.
1.2.2. Mengetahui proses pemenuhan dan pelaksanaan CPOB di PT Pradja Pharin (Prafa).
BAB 2
TINJAUAN UMUM INDUSTRI FARMASI
2.1. Manajemen Mutu
Industri farmasi dituntut untuk memenuhi berbagai persyaratan dari grup perusahaan, pemegang saham, pelanggan, pegawai, pemerintah dan para pemangku kepentingan lainnya dalam rangka mendapatkan produk yang memenuhi kriteria berkualitas, aman dan berkhasiat. Sehingga, pemenuhan dan penerapan CPOB di industri farmasi perlu diimplementasikan melalui pendekatan PDCA (Plan, Do, Check, Action). Pada pendekatan ini, Plan meliputi tanggung jawab manajemen dalam manajemen mutu dan dokumentasi; manajemen sumber daya berupa personalia, bangunan dan fasilitas, peralatan serta sanitasi dan higiene. Do meliputi realisasi produk berupa produksi, pengawasan mutu dan kualifikasi validasi. Check meliputi penilaian, analisis dan pengembangan berupa inspeksi diri dan audit mutu serta penanganan keluhan, penarikan produk dan produk kembalian. Act meliputi CAPA atau Corrective Action Preventive Acation.
Pencapaian kriteria obat yang berkualitas, aman dan berkhasiat memerlukan kebijakan mutu yang melibatkan penjaminan mutu, CPOB, pengawasan mutu, kajian kualitas produk dan manajemen resiko. Pada penjaminan mutu dilaksanakan proses kajian catatan bets, penanganan penyimpangan dan penanganan perubahan. Pada CPOB dilaksanakan 12 pilar CPOB meliputi manajemen mutu, personalia, bangunan dan fasilitas, peralatan, sanitasi dan higiene, produksi, pengawasan mutu, inspeksi diri dan audit mutu, penanganan keluhan terhadap produk-penarikan kembali produk-produk kembalian, dokumentasi, pembuatan dan analisis berdasarkan kontrak serta kualifikasi dan validasi. Pengawasan mutu meliputi metode analisis dan validasi metode analisis. Kajian kualitas produk meliputi evaluasi secara berkala untuk memastikan konsistensi proses dan hasil produksi. Manajemen resiko merupakan upaya untuk memprediksi resiko yang mungkin muncul dan menentukan langkah
solusi dan antisipasi agar kriteria obat berkualitas, aman dan berkhasiat dapat tercapai.
2.2. Personalia
Sumber daya manusia sangat penting dalam pemenuhan dan penerapan CPOB. Industri farmasi hendaklah memiliki sumber daya manusia yang berkompeten, berkualitas dan terkualifikasi; dengan peran dan tanggung jawab yang tepat. Personalia kunci dalam industri farmasi adalah apoteker-apoteker yang berperan dan bertanggung jawab di bagian produksi, pengawasan mutu dan penjaminan mutu. Untuk meningkatkan keterampilan dan pengetahuan CPOB maka hendaknya selalu dilakukan pelatihan bagi seluruh personil. Selain pelatihan juga dilakukan evaluasi dan penilaian terhadap peningkatan kinerja personil.
2.3. Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki desain, konstruksi dan letak yang memadai, serta disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil resiko terjadinya kekeliruan, kontaminasi silang, dan kesalahan lain, selain itu juga untuk memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindari kontaminasi silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat.
2.4. Peralatan
Peralatan yang digunakan untuk pembuatan obat hendaklah memiliki desain dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat, agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets dan untuk memudahkan pembersihan serta perawatan. Permukaan peralatan yang bersentuhan langsung dengan bahan awal, produk antara atau produk jadi tidak boleh menimbulkan reaksi, adisi atau absorbsi yang
dapat mempengaruhi identitas, mutu atau kemurnian di luar batas yang ditentukan. Peralatan yang digunakan untuk menimbang, mengukur, memeriksa, dan mencatat hendaklah diperiksa ketepatannya dan dikalibrasi sesuai program dan prosedur yang ditetapkan. Semua peralatan dibersihkan sesuai prosedur tertulis yang rinci serta disimpan dalam keadaan kering dan bersih.
2.5. Sanitasi dan Higiene
Sanitasi adalah segala upaya yang dilakukan untuk menjamin terwujudnya kondisi yang memenuhi persyaratan kesehatan. Sedangkan higiene adalah upaya kesehatan dengan cara memelihara dan melindungi kebersihan individu subjeknya. Dalam setiap aspek pembuatan obat haruslah diterapkan tingkat sanitasi dan higiene yang tinggi. Ruang lingkup sanitasi dan higiene meliputi personalia, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya dan segala sesuatu yang dapat merupakan sumber pencemaran produk.
2.6. Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin edar (registrasi). Penanganan bahan dan produk jadi seperti penerimaan dan karantina, pengambilan sampel, penyimpanan, penandaan, penimbangan, pengolahan, pengemasan, dan distribusi hendaklah dilakukan sesuai dengan prosedur atau instruksi tertulis dan bila perlu dicatat.
2.7. Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari Cara Pembuatan Obat yang Baik untuk memberikan kepastian bahwa produk secara konsisten memiliki mutu yang sesuai dengan tujuan pemakaian. Keterlibatan dan komitmen semua pihak yang berkepentingan pada semua tahap merupakan keharusan untuk
mencapai sasaran mutu mulai dari awal pembuatan sampai kepada distribusi produk jadi.
2.8. Inspeksi Diri dan Audit Mutu
Inspeksi diri bertujuan untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu telah memenuhi ketentuan CPOB. Program inspeksi diri dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan menetapkan tindakan perbaikan yang diperlukan. Sedangkan audit mutu digunakan sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen mutu dengan tujuan spesifik untuk meningkatkan mutu. Tim inspeksi diri terdiri paling sedikit tiga anggota independen yang berpengalaman dalam bidangnya masing-masing dan memahami CPOB. Anggota tim dapat dibentuk dari dalam atau dari luar perusahaan.
2.9. Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian
Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadinya kerusakan obat dikaji dengan teliti. Penarikan kembali produk adalah suatu proses penarikan kembali dari satu atau beberapa bets atau seluruh bets produk tertentu di peredaran. Penarikan kembali dilakukan apabila ditemukan produk cacat mutu atau bila ada laporan mengenai reaksi yang merugikan yang serius serta beresiko terhadap kesehatan. Produk kembalian adalah obat jadi yang telah beredar, yang kemudian dikembalikan ke pabrik karena keluhan mengenai kerusakan, kadaluarsa atau alasan lain seperti kondisi wadah dapat menimbulkan keraguan identitas. Laporan dan keluhan mengenai produk dapat menyangkut kualitas, adanya reaksi merugikan ataupun efek terapetiknya. Oleh karena itu harus segera dilakukan penyelidikan, evaluasi dan tindak lanjut terhadap laporan dan keluhan yang ada.
2.10. Dokumentasi
Dokumentasi adalah bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi meliputi spesifikasi bahan baku, bahan pengemas, produk antara, produk ruahan dan produk jadi; dokumen produksi; dokumen pengawasan mutu; dokumen penyimpanan dan distribusi; dokumen pemeliharaan, pembersihan, dan pamantauan kondisi rungan dan peralatan; dokumen penanganan keluhan terhadap obat penarikan kembali obat, obat kembalian, dan pemusnahan obat; dokumen untuk peralatan khusus; prosedur dan catatan inspeksi diri; serta pedoman dan catatan pelatihan CPOB bagi karyawan.
2.11. Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisis berdasar kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara Pemberi Kontrak dan Penerima Kontrak harus dibuat dengan jelas untuk menentukan tanggung jawab dan kewajiban masing-masing pihak. Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk diedarkan menjadi tanggung jawab penuh kepala bagian Manajemen Mutu (Pemastian Mutu).
2.12. Kualifikasi dan Validasi
CPOB mensyaratkan Industri Farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan dan proses yang dapat mempengaruhi mutu produk hendaklah divalidasi. Validasi merupakan kegiatan pembuktian dengan cara yang sesuai bahwa tiap bahan, proses, prosedur, kegiatan, sistem, perlengkapan atau mekanisme yang digunakan dalam produksi maupun pengawasan mutu akan senantiasa mencapai hasil yang diinginkan. Kegiatan validasi meliputi kualifikasi (peralatan dan sistem), kalibrasi (instrumen dan alat ukur) dan validasi (prosedur dan proses).
1. Kualifikasi
Kualifikasi merupakan kegiatan pembuktian dan dokumentasi bahwa perlengkapan, fasilitas atau sistem yang digunakan dalam suatu proses/sistem akan selalu bekerja sesuai dengan kriteria yang diinginkan dan konsisten. Sebelum melakukan kualifikasi maka haruslah dibuat Protokol Kualifikasi untuk merinci kualifikasi yang akan dilakukan meliputi langkah kritis dan kriteria penerimaan. Protokol Kualifikasi tersebut dikaji dan disetujui oleh kepala bagian Manajemen Mutu (Pemastian Mutu). Laporan kualifikasi juga harus dibuat setelah proses kualifikasi yang mencakup ringkasan hasil, tanggapan terhadap penyimpangan yang tejadi, kesimpulan dan rekomendasi perbaikan.
Kualifikasi terdiri dari beberapa tahap, yaitu: 1. Kualifikasi Desain atau Design Qualification
Merupakan kegiatan pembuktian yang terdokumentasi bahwa spesifikasi dari fasilitas, sistem atau alat yang digunakan sesuai dengan ketentuan CPOB terbaru.
2. Kualifikasi Instalasi atau Instalation Qualification
Merupakan kegiatan pembuktian yang terdokumentasi bahwa sistem, peralatan atau bangunan telah dipasang atau dibangun sesuai dengan spesifikasi rancangannya.
3. Kualifikasi Operasional atau Operational Qualification
Merupakan kegiatan pembuktian yang terdokumentasi bahwa sistem, peralatan atau bangunan beroperasi/bekerja sesuai dengan spesifikasi yang diinginkan.
4. Kualifikasi Kinerja atau Performance Qualification
Merupakan kegiatan pembuktian yang terdokumentasi bahwa sistem atau peralatan beroperasi secara konsisten dan akan selalu menghasilkan produk yang memenuhi spesifikasi yang telah ditetapkan.
2. Validasi Metode Analisis
Validasi Metode Analisis bertujuan untuk membuktikan bahwa metode analisis yang digunakan baik dalam pengujian maupun pengawasan mutu sesuai dengan tujuan penggunaannya dan mencapai hasil yang konsisten. Dalam Validasi Metode Analisis yang diuji atau divalidasi adalah Protap (prosedur tetap) pengujian yang bersangkutan. Protap tersebut bisa dibuat oleh bagian QC atau bagian Product Development. Apabila protap belum tersedia maka harus dibuat terlebih dahulu dan kemudian divalidasi. Protap metode analisis tersebut dapat diambil (diadopsi) dari berbagai literatur resmi seperti USP, British Pharmacopea dan lain-lain (kompendial) atau yang berasal dari pengembangan sendiri atau modifikasi dari prosedur pengujian yang telah ada.
3. Validasi Proses
Validasi proses terdiri dari proses pengolahan (manufacturing) dan pengemasan.Tujuan dari validasi proses produksi antara lain:
a. Memberikan dokumentasi secara tertulis bahwa prosedur produksi yang berlaku dan digunakan dalam proses produksi menghasilkan hasil yang diinginkan secara terus menerus.
b. Mengidentifikasi dan mengurangi masalah yang terjadi selama proses produksi dan memperkecil kemungkinan terjadinya proses ulang. c. Meningkatkan efektifitas dan efisiensi proses produksi.
Jenis-jenis validasi proses produksi antara lain: a. Prospective Validation (Initial Validation)
Merupakan validasi yang dilakukan pada produk-produk baru (belum pernah diproduksi / dipasarkan sebelumnya). Dilakukan setelah proses scale up dan optimasi prosedur oleh bagian Product Development dan dilakukan pada 3 batch pertama secara berurutan.
b. Concurent Validation
Merupakan validasi yang dilakukan pada proses produksi yang tengah berjalan dan diproduksi yang mana oleh karena suatu hal proses produksi tersebut belum dilakukan validasi. Selain itu juga dapat
disebabkan karena terdapat perubahan pada parameter kritis yang dapat mempengaruhi mutu dan spesifikasi produk. Dilakukan pada 3 batch yang berurutan.
c. Retrospective Validation
Merupakan validasi yang dilakukan terhadap produk-produk yang sudah lama diproduksi namun belum divalidasi. Data yang digunakan adalah 10-30 batch. Data yang dikumpulkan merupakan hasil pengujian terhadap parameter kritis pada setiap tahap kritis produksi. 4. Validasi Pembersihan
Tujuan dari validasi pembersihan yaitu :
a. Memberikan dokumentasi bahwa prosedur pembersihan yang berlaku dan digunakan sudah tepat dan dapat dilakukan berulang-ulang.
b. Peralatan/mesin yang dibersihkan tidak terdapat pengaruh negatif karena efek pembersihan.
c. Operator/pelaksana yang melakukan pembersihan kompeten, mengikuti prosedur pembersihan dan peralatan pembersihan yang telah ditentukan.
d. Cara pembersihan menghasilkan tingkat kebersihan yang telah ditetapkan.
Validasi pembersihan terutama ditujukan untuk bahan-bahan dengan kriteria sebagai berikut:
a. Bahan-bahan yang sulit dibersihkan.
b. Produk-produk yang memiliki tingkat kelarutan yang jelek. c. Produk-produk yang mengandung bahan yang sangat toksik,
karsinogenik, mutagenik, teratogenik, dan sebagainya.
d. Untuk bahan yang sama, dipilih yang memiliki dosis yang lebih tinggi.
Kriteria alat/mesin yang divalidasi yaitu: a. Peralatan/mesin baru.
b. Untuk mesin yang sama (merk, tipe/jenis) hanya salah satu yang divalidasi.
c. Jika dalam proses menggunakan rangkaian mesin yang berbeda secara berkelanjutan, masing-masing mesin harus tetap divalidasi secara terpisah.
d. Jika rangkaian mesin merupakan kombinasi mesin yang permanen, validasi bisa dilakukan bersama-sama.
5. Validasi Media Fill
Validasi proses aseptik hendaklah mencakup uji simulasi proses menggunakan media pertumbuhan (media fill). Pemilihan media pertumbuhan hendaklah dilakukan berdasarkan bentuk sediaan dan selektivitas, kejernihan, konsentrasi, dan cara sterilitas yang sesuai untuk media tersebut.
6. Validasi Sistem Komputer
Sistem komputer harus divalidasi sebelum digunakan pada sistem mutu, misalnya pencatatan stok material, pendataan masalah mutu, dan kontrol proses.
2.13. Pembuatan Produk Steril
Pembuatan produk steril bertujuan untuk menimimalisir resiko kontaminasi mikroba, partikulat dan kontaminasi pirogen. Kelas ruangan dan kelas udara diklasifikasikan berdasarkan EN ISO 14644-1 yang dapat membedakan dengan jelas pemantauan lingkungan pada proses produksi. Kelas ruangan dan kelas udara dipantau secara rutin pada kondisi operasional dan pemantauan lokasi berdasarkan hasil kajian analisi resiko dan hasil yang didapatkan berdasarkan klasifikasi ruangan dan udara. Penggunaan teknologi isolator untuk meminimalisir intervensi manusia dalam area produksi dapat mengurangi resiko kontaminasi mikroba dari lingkungan pada produk steril aseptis secara signifikan. Preparasi bahan baku dan produk setidaknya dilakukan di kelas D untuk mengurangi resiko kontaminasi mikroba dan partikulat. Peralatan
dan bahan yang telah dicuci setidaknya ditangani di ruang kelas D. Hanya personalia dalam jumlah minimum yang diperbolehkan berada di kelas bersih, terutama pada proses aseptis. Dalam ruang bersih, semua permukaan harus halus, tanpa sekat dan retakan untuk meminimalisir akumlasi partikel atau mikroorganisme, serta memudahkan pembersihan dan penggunaan desinfektan. Sanitasi ruang bersih sangat penting dilakukan secara terjadwal dan terdokumentasi. Sikap hati-hati perlu diterapkan selama proses termasuk proses sebelum sterilisasi. Semua proses sterilisasi harus divalidasi. Siklus sterilisasi panas harus dicatat waktu dan suhunya.
2.14. Sistem Komputerisasi
Sistem komputerisasi meliputi system produksi termasuk penyimpanan, distribusi dan pengawasan mutu. Salah satu hal penting adalah keterlibatan penuh personalia kunci dalam sistem komputer. Kebutuhan akan validasi sistem komputerisasi berdasarkan factor-faktor yang digunakan di dalam sistem, apakah secara prospektif atau retrospektif.
BAB 3
TINJAUAN KHUSUS PT PRADJA PHARIN (PRAFA)
3.1. Plant Department
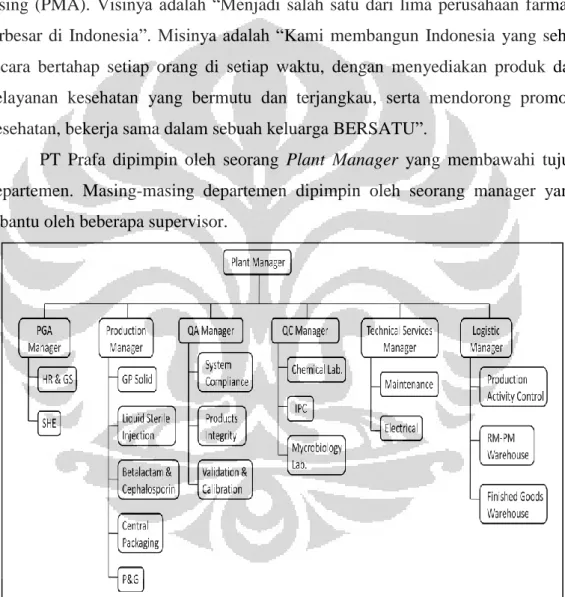
PT Pradja Pharin (Prafa) merupakan salah satu industri farmasi berbentuk Pemilik Modal Dalam Negeri (PMDN) yang berubah menjadi Pemilik Modal Asing (PMA). Visinya adalah “Menjadi salah satu dari lima perusahaan farmasi terbesar di Indonesia”. Misinya adalah “Kami membangun Indonesia yang sehat secara bertahap setiap orang di setiap waktu, dengan menyediakan produk dan pelayanan kesehatan yang bermutu dan terjangkau, serta mendorong promosi kesehatan, bekerja sama dalam sebuah keluarga BERSATU”.
PT Prafa dipimpin oleh seorang Plant Manager yang membawahi tujuh departemen. Masing-masing departemen dipimpin oleh seorang manager yang dibantu oleh beberapa supervisor.
Gambar 3.1 Struktur organisasi PT Prafa.
PT Prafa didirikan oleh Bapak Tjipto Pusposuharto pada tahun 1960. PT Prafa telah berkembang dari sebuah industri rumah tangga menjadi perusahaan farmasi besar yang memproduksi lebih dari 100 jenis sediaan obat dan terus mengalami perkembangan pesat.
PT Prafa mulai beroperasi sebagai perusahaan dagang berbagai obat industri rumah tangga dengan 20 karyawan di areal berukuran 325 m2. Pada tahun 1968, PT Prafa ditunjuk sebagai importir dan penyalur tunggal sah di Indonesia bagi Meiji Seika Jepang. Sejak saat itu dimulai pembangunan pabrik di areal seluas 2300 m2 di Jalan Bandengan Selatan 58 A Jakarta Utara dan PT Prafa mulai memproduksi berbagai jenis sediaan yang jumlahnya semakin besar.
Mulai tahun 1988, PT Prafa telah tumbuh menjadi suatu industri farmasi dengan ± 1000 karyawan, meliputi 200 jenis sediaan obat berkualitas dengan penanaman modal total mencapai lebih dari 10 miliar rupiah. Pada tahun tersebut dimulai pula pengembangan pabrik modern diatas areal seluas ± 12 hektar, dengan luas bangunan 32.208,52 m2 yang terletak di daerah Citeureup-Bogor. Pabrik dirancang dan dibangun sesuai dengan aspek CPOB serta efisien dalam sistem produksi.
Pada tahun 1995, PT Prafa bergabung dalam Darya Varia Group bersama tiga perusahaan lainnya yaitu PT Darya Varia Laboratoria, PT Kenrose Indonesia, dan PT Dupa dengan distributor PT Wigo Distributor Farmasi. Pada tahun 1998 PT Dupa dan PT Kenrose ditutup. Mulai tanggal 21 Desember 2001 hingga sekarang Darya Varia Group diambil alih oleh United Laboratory, Manila-Philippines. Selain Darya Varia Group, perusahaan yang tergabung dalam United Laboratory adalah PT Medifarma Laboratories.
Sejak tahun 2003, PT Prafa diaudit oleh P&G dan memperoleh QAC (Quality Assurance Capability) sebesar 44%. Kemudian dilakukan audit kembali oleh P&G tahun 2004, QAC yang diperoleh meningkat menjadi 72%. Dengan perjuangan dan komitmen yang tinggi, akhirnya dalam waktu satu tahun kemudian, PT Prafa yang diaudit kembali oleh P&G berhasil menaikkan QAC-nya menjadi 92%. Sejak tahun 2004, PT Prafa telah dipercaya oleh perusahaan P&G untuk melakukan toll manufacturing hingga kini. Pada tahun 2008, PT Prafa memperoleh QAC 100% untuk audit yang dilakukan P&G. Pada tahun 2005, PT Prafa memperoleh Sertifikat Industri Farmasi Kelas A dari hasil mapping Badan POM dalam menilai kesiapan industri farmasi menghadapi harmonisasi pasar
ASEAN. Berdasarkan hasil tersebut, PT Prafa dapat melakukan produksi di fasilitas sendiri dan menerima toll dari industri farmasi lain. Hingga kini, PT Prafa senantiasa berusaha untuk meningkatkan kualitas sarana dan SDMnya, terutama mengikuti standar PIC/s dan FDA Regulation.
Pada tahun 2009, Darya Varia Group melakukan project spesialization sehingga PT Prafa dikhususkan pada produksi low volume solid order, produk
ethical (solid dan injeksi), antibiotik betalaktam dan sefalosporin (solid dan
injeksi), serta produk toll manufacturing. PT Prafa dispesialisasikan sebagai
Centre of Excellent Toll Manufacturing. Prinsipal lokal dan multinasional yang
melakukan toll manufacturing diantaranya yaitu P&G, PT Actavis, PT Novartis, PT Novell, PT Pharos, PT Lapi, PT Pyridam, PT Mahakam Beta Farma, PT Guardian Pharmatama, PT Nufarindo, dan PT Kalbe Farma.
Kantor pusat PT Prafa berlokasi di Talavera Office Park, Lantai 8-10, Jl. Letjen TB. Simatupang No. 22-26 Jakarta. Sedangkan lokasi pabrik berada di Desa Karang Asem Barat, Kecamatan Citeureup, Kabupaten Bogor, Jawa Barat. Sarana produksi yang dimiliki PT Prafa antara lain:
1. Bangunan utama terdiri dari tiga gedung besar, yaitu:
a. Gedung pertama digunakan untuk ruang kantor, ruang produksi non betalaktam, ruang produksi dan kemas P&G, Product Development
Department (PDD), ruang pengemasan sentral, dan masjid.
b. Gedung kedua digunakan untuk ruang Departemen Quality Assurance (QA), Quality Control (QC), gudang bahan baku, dan bahan kemas. c. Gedung ketiga digunakan untuk ruang produksi betalaktam dan
sefalosporin.
2. Bangunan penunjang lain meliputi gedung Technical Service, instalasi listrik, Air Handling Unit (AHU), steam unit, compressed air unit, waste
water unit, water system unit, kantin, area parkir, pos satpam, dan unit laundry.
3. Bangunan gudang obat jadi, gudang bahan mudah terbakar, dan
3.2. Logistic Department
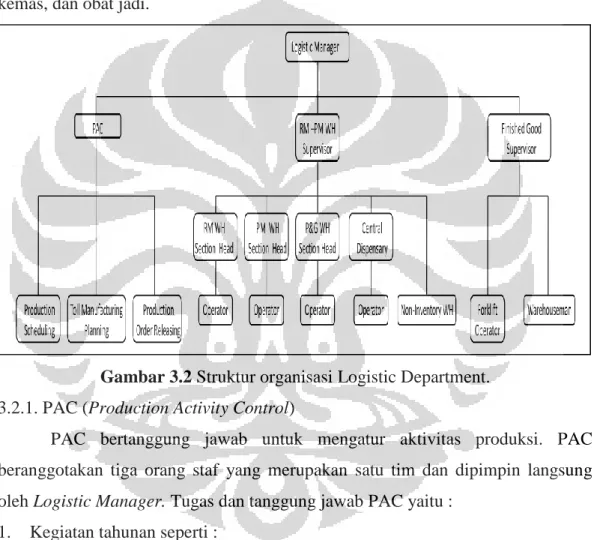
Logistic Department dipimpin oleh seorang manager yang membawahi
bagian PAC (Production Activity Control), Warehouse (gudang), dan Finished
Goods (obat jadi) yang dibantu oleh beberapa supervisor. Logistic Department
mempunyai tugas dan tanggung jawab dalam merencanakan jadwal kegiatan produksi serta menerima, menyimpan, dan mengeluarkan bahan baku, bahan kemas, dan obat jadi.
Gambar 3.2 Struktur organisasi Logistic Department.
3.2.1. PAC (Production Activity Control)
PAC bertanggung jawab untuk mengatur aktivitas produksi. PAC beranggotakan tiga orang staf yang merupakan satu tim dan dipimpin langsung oleh Logistic Manager. Tugas dan tanggung jawab PAC yaitu :
1. Kegiatan tahunan seperti :
a. Membuat perencanaan tahunan (Annually Production Plan) produksi obat jadi.
b. Membuat Production Order (PrO) Released setiap tahun. 2. Kegiatan bulanan seperti:
a. Menerima Master Production Schedule (MPS) dari bagian PPIC. b. Menerima Rolling Forecast (ROFO) dari bagian PPIC.
3. Kegiatan mingguan seperti :
a. Membuat Production Schedule 4. Kegiatan harian yang meliputi :
a. Membuat dan mengeluarkan Pro dua hari sebelum proses produksi. b. Membuat dan mengeluarkan Picking List untuk bahan baku dan bahan
kemas untuk bagian gudang (logistik).
c. Membuat dan mengeluarkan Batch Production Record (BPR)
Compounding, BPR Dispensary, Packaging Direction Record (PDR)
untuk pengemasan primer dan sekunder.
Dalam membuat perencanaan jadwal produksi perlu mempertimbangkan hal-hal berikut :
1. Work in process (WIP), yaitu sejak PrO dikeluarkan sampai sebelum produk masuk ke Gudang Obat Jadi (GOJ).
2. Inventory Policy dari manajemen berupa jumlah buffer stock yang diperbolehkan di gudang.
3. Kapasitas produksi. 4. Batch size.
5. Lead time produksi, sejak barang mulai masuk proses sampai dikirim ke gudang.
6. Lead Time QC, yaitu dari barang selesai diproduksi sampai Finished Goods
Released.
3.2.2. Warehouse (WH)
Warehouse dipimpin oleh seorang Warehouse Supervisor yang dibantu
oleh tiga orang section head yaitu Raw Material (RM) Section Head, Packaging
Material (PM) Section Head, dan P&G Section Head. Adapun tugas dan tanggung
jawab bagian Warehouse :
1. Menerima, menyimpan, dan mengeluarkan raw material/bahan baku, bahan kemas dan finished goods (obat jadi).
2. Menjaga kualitas dan kuantitas bahan baku, bahan kemas, dan obat jadi di dalam gudang sesuai dengan syarat dan ketentuan CPOB.
3. Memonitor persediaan bahan baku,bahan kemas, dan obat jadi.
Bagian P&G Warehouse bertanggung jawab atas bahan baku dan kemas untuk produksi P&G. Warehouse memonitor persediaan bahan baku, bahan kemas, dan obat jadi dengan cara melakukan weekly random stock taking finished
good/raw material.
Penyimpanan barang dilakukan berdasarkan spesifikasi material atau produk menggunakan sistem FIFO dan FEFO. Masing–masing barang memiliki kartu rak (Bincard) untuk mencatat keluar–masuknya barang, jumlah dan tanggal transaksi juga untuk memudahkan pengambilan barang dari gudang.
Pembagian area gudang adalah sebagai berikut : 1. Gudang Bahan Baku Prafa
a. Gudang bahan baku terdiri dari:
Gudang bahan baku Prafa dibagi lagi menjadi tiga area yaitu : gudang non betalaktam, gudang betalaktam, dan gudang sefalosforin, yang berada di gedung yang terpisah.
- AC Area; gudang dengan suhu ≤ 25 oC dan kelembaban ≤ 75% untuk
menyimpan bahan-bahan yang tidak tahan suhu > 25 oC.
- Cool Storage Area, yang merupakan gudang dengan suhu 2-8 o
C untuk menyimpan bahan-bahan yang mudah meleleh pada suhu kamar.
- Non AC Area; gudang dengan suhu kamar (≤ 30 o
C) yang digunakan untuk bahan-bahan yang dapat disimpan pada suhu kamar.
- Area ditolak/ rejected. - Ruang peralatan. b. Gudang Bahan Kemas Prafa
Gudang bahan kemas digunakan untuk menyimpan semua bahan yang dipakai pada proses pengemasan untuk menghasilkan produk jadi. Macam ruangan gudang bahan kemas terdiri dari :
- Ruang AC, untuk label, alu-foil, leaflet.
- Area ditolak/ rejected.
2. Gudang Bahan Kemas dan Bahan Baku P&G
Gudang bahan kemas dan bahan baku produk P&G dipisahkan dari gudang bahan baku dan bahan kemas produk Prafa. Pembagian ruangan di gudang bahan kemas dan bahan baku P&G sama dengan ruangan di gudang Prafa yang terdiri dari ruang AC, ruang non AC dan ruang untuk leaflet.
3. Gudang Obat Jadi Prafa dan P&G
Gudang obat jadi digunakan untuk menyimpan hasil produksi yang siap diserahkan ke distributor.
4. Gudang Umum
Gudang umum menyimpan barang–barang non inventory seperti barang teknik (kabel, sparepart mesin, perkakas) dan peralatan kantor (kertas, kapas, tisu dan alat tulis). Prosedur pengadaan barang non inventory dimulai dengan pembuatan POR (Purchase Order Requisition) oleh masing-masing departemen yang membutuhkan yang ditujukan kepada Purchasing agar melakukan pemesanan barang. Purchasing membuat PO (Purchase Order) dalam melakukan pembelian kepada supplier. Supplier memberikan barang sesuai dengan PO dan menyerahkannya ke gudang. Barang yang diterima dicek dengan menggunakan
checklist, kemudian gudang membuat PRL (Purchase Receipt Local)/PRI
(Purchase Receipt Import) sebagai pernyataan penerimaan barang. 5. Gudang Api
Gudang api mempunyai fungsi untuk menyimpan bahan baku yang mudah terbakar. Gudang ini terbagi atas area Prafa, P&G, Corrosive, Rejected, Washing dan gudang untuk penyimpanan oli.
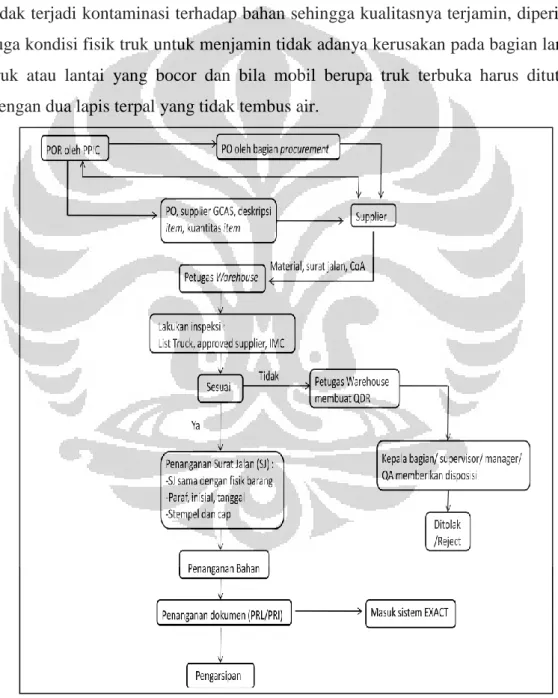
Kegiatan yang dilakukan oleh warehouse meliputi : 1. Proses Penerimaan Barang
Penerimaan barang inventory yang berupa bahan baku ataupun bahan kemas dari supplier diawali dengan pemesanan barang oleh bagian PPIC dengan menggunakan POR (Purchase Order Requisition), kemudian purchasing membuat dan mengirimkan PO (Purchase Order) ke supplier yang dituju.
Supplier datang membawa barang beserta surat jalan dan Certificate of Analysis
(CoA) dari barang tersebut sesuai dengan PO. Pada saat penerimaan barang, petugas gudang selain mengecek kesesuaian barang dengan pesanan, petugas gudang juga harus mengecek supir, mobil yang dipakai dan kondisi fisik barang. Supir seharusnya rapi dan juga bersepatu. Truk yang dipakai untuk mengantar barang hendaknya dicek untuk mengangkut apa sebelumnya untuk memastikan tidak terjadi kontaminasi terhadap bahan sehingga kualitasnya terjamin, diperiksa juga kondisi fisik truk untuk menjamin tidak adanya kerusakan pada bagian langit truk atau lantai yang bocor dan bila mobil berupa truk terbuka harus ditutupi dengan dua lapis terpal yang tidak tembus air.
Pemeriksaan fisik barang dilakukan dengan mengecek kondisi kemasan, jumlah barang, dan lain-lain dan diisi pada IMC (Incoming Material Checklist). Barang yang sesuai dengan persyaratan diterima lalu dilanjutkan penanganan surat jalannya baru kemudian bahan dapat disusun di atas pallet yang sudah bersih. Pihak gudang membuat label quarantine (warna kuning) yang ditempel untuk setiap pallet; label GRN (Goods Received Number) ditempel di kemasan bahan/kardus; bincard untuk mencatat keluar masuknya barang, jumlah dan tanggal transaksi. Selanjutnya bagian gudang akan mengisi IML (Incoming
Material List) dan membuat PRL (Purchase Receipt Local) atau PRI (Purchase Receipt Import) sebagai bukti penerimaan bahan baku atau bahan kemas yang
diterima dan akan diperiksa oleh QC.
Bagian QC akan ke gudang mengambil sampel raw material atau
packaging material untuk diperiksa, jika barang tersebut sesuai dengan spesifikasi
maka barang diluluskan dan dapat digunakan untuk produksi. Material yang diluluskan ditempeli label released warna hijau, stempel released pada bincard dan juga status released pada EXACT. Jika barang tidak sesuai spesifikasi maka barang tersebut tidak diluluskan dan ditempeli label rejected warna merah. Barang yang ditolak akan dikembalikan ke supplier atau dimusnahkan di PT Prafa sesuai dengan kesepakatan kedua belah pihak.
2. Proses Penyimpanan Barang
Penyimpanan barang harus mengikuti prosedur persyaratan kondisi penyimpanan sesuai dengan List of Approved Supplier terutama tentang suhu penyimpanan. Suhu penyimpanan harus sangat diperhatikan sehingga kualitas barang dapat terjamin karena penyimpanannya sesuai. Berdasarkan suhu ruangan, gudang dibagi menjadi beberapa area, antara lain :
a. Non AC Area, yaitu gudang dengan temperatur kamar untuk bahan-bahan yang dapat disimpan pada temperatur kamar seperti talk, paraffin dan sulfa.
b. AC Area, yaitu gudang dengan suhu ≤ 25 oC dan kelembaban ≤ 65% untuk menyimpan bahan-bahan yang tidak tahan suhu > 25 oC seperti vitamin C.
c. Cool Storage Area, yang merupakan gudang dengan suhu 2-8 oC untuk menyimpan bahan-bahan yang mudah meleleh pada suhu kamar.
3. Proses Pengeluaran Barang
Pengeluaran bahan baku dan bahan kemas dari gudang berdasarkan
Production Order (PrO) dan Picking List. Barang-barang yang dikeluarkan dari
gudang menggunakan sistem FEFO untuk bahan baku dan sistem FIFO untuk bahan baku dan kemas. Setelah barang keluar, maka dilakukan pemotongan barang dari sistem EXACT yang disebut dengan PI (Production Issue). PI dilakukan setelah penimbangan dengan mengacu pada BPR (Batch Production
Record) untuk bahan baku dan untuk bahan kemas dilakukan setelah dikirim atau
diterima oleh Central Packaging. 3.2.3. Dispensary
Dispensary merupakan bagian yang melakukan penimbangan dengan
jadwal penimbangan yang disesuaikan dengan jadwal produksi. Dokumen-dokumen penimbangan meliputi:
1. Production Order (PrO) dan Picking List 2. Batch Production Record Dispensary (BPRD) 3. Label penimbangan
Sebelum penimbangan dilakukan, harus terdapat label “BERSIH” untuk alat yang ditempel pada setiap alat timbang yang berisi nama alat, nomor dibersihkan oleh siapa, tanggal mulai dan selesai pembersihan, jam mulai dan selesai pembersihan, terakhir untuk produk apa, nomor batch produk tersebut, kemudian diperiksa dan dinyatakan bersih oleh kepala bagian/supervisor pada tanggal berapa dan paraf, untuk digunakan pada produk apa. Setelah dicek bahwa alat/timbangan bersih maka dilakukan line clearance yang meliputi nama produk dan nomor bets, tanggal, produk yang ditimbang sebelumnya beserta nomor betsnya, dan checklist yang meliputi: pemeriksaan suhu, kelembaban, perbedaan
tekanan antar ruang saat penimbangan; apakah ruang timbang, alat, drum, pallet bersih, serta ruang timbang harus bebas dari bahan penimbangan sebelumnya. Sebelum kegiatan penimbangan dilakukan, alat penimbangan harus selalu diverifikasi dengan batu timbang yang terkalibrasi dengan syarat penyimpangan tidak boleh lebih dari 0,1 % dari berat konvensional anak timbangan.
Bahan baku yang akan ditimbang oleh bagian dispensary terlebih dahulu harus released QC. Penimbangan bahan aktif dilakukan terakhir setelah semua bahan selesai ditimbang, dengan tujuan agar tidak ada kontaminasi dari bahan aktif ke bahan yang lainnya. Untuk produk steril, penimbangan dilakukan dibawah
Laminar Air Flow (LAF).
Sebelum penimbangan, bahan baku disiapkan sesuai dengan Picking List kemudian bahan baku yang akan ditimbang dibawa ke ruang antara untuk dibuka kemasan terluar dan selanjutnya dimasukkan ke dalam ruang dispensary untuk ditimbang beserta bincard yang digunakan untuk mencatat hasil penimbangan dan nantinya akan disesuaikan dengan EXACT. Setelah barang ditimbang oleh pihak
dispensary, gudang mengeluarkan Production Issue dimana waktu pemotongannya di sistem EXACT paling lama 16 jam setelah ditimbang dan selanjutnya diserahkan ke Production Department. Selanjutnya Production
Department melaksanakan kegiatan produksi dan pengemasan berdasarkan
PrO/BPR/PI dan jadwal produksi. 3.2.4. Finished Good (FG)
Gudang obat jadi digunakan untuk menyimpan hasil produksi yang siap diserahkan ke distributor. Proses penerimaan obat jadi di Gudang Obat Jadi (GOJ) prosedurnya hampir sama dengan bahan baku/kemas, namun yang membedakan adalah dokumennya. Untuk penerimaan obat jadi dokumen yang harus ada yaitu PHP (Pengiriman Hasil Produksi) dari bagian produksi. Proses penerimaan obat jadi dimulai dari Central Packaging menyerahkan obat jadi beserta bukti serah terima dan dokumen Pengiriman Hasil Produksi (PHP) yang mencantumkan tanggal dokumen, nomor dokumen, nomor item, nama produk, nomor batch,
Kemudian setelah menandatangani bukti serah terima, barang diterima oleh gudang dan selanjutnya dicatat.
Penyimpanan obat jadi disesuaikan dengan spesifikasi dan persyaratan penyimpanan obat tersebut. Jenis ruangan gudang obat jadi terdiri dari :
1. AC Area dengan suhu ≤ 25 oC dan kelembaban ≤ 75%, digunakan untuk menyimpan obat yang perlu penyimpanan pada suhu tersebut. Area ini dibagi menjadi area AC menggunakan rak dan area AC tanpa rak.
2. Cool Storage Area dengan suhu 2-15 oC yang digunakan untuk menyimpan produk injeksi.
3. Non AC Area, digunakan untuk menyimpan obat jadi yang tidak memerlukan persyaratan khusus dalam penyimpanannya.
4. Area ditolak/ rejected
5. Return Goods Area untuk obat kembalian karena kadarluarsa, kemasan rusak, dan product recall.
Obat jadi yang disimpan di gudang obat jadi belum dapat langsung didistribusikan ke distributor pusat yaitu PT Anugrah Pharmindo Lestari (APL) sebelum mendapat status released dari QA baik itu dari sistem dokumen maupun kondisi fisik dari obat jadi tersebut. Distribusi obat jadi dimulai dari Purchase
Order (PO) yang diterima distributor cabang (meliputi apotek maupun rumah
sakit). Kemudian PO tersebut dikirim ke distributor pusat APL dan selanjutnya diteruskan ke pabrik. Tembusan dari PO dikirim ke Accounting dan selanjutnya
Accounting membuat Sales Order (SO) yang kemudian dikirim ke GOJ. Pihak
gudang melihat stok dari obat yang dipesan. Jika jumlah stok obat tersebut tidak mencukupi PO maka pihak gudang segera melapor ke PPIC, selanjutnya PPIC melakukan follow up. Jika stok obat memenuhi permintaan maka obat tersebut dikeluarkan berdasarkan FEFO dan harus berstatus “RELEASED” dari QA. Pihak GOJ mengeluarkan Delivery Order (DO) sebagai dokumen bukti keluar obat jadi.
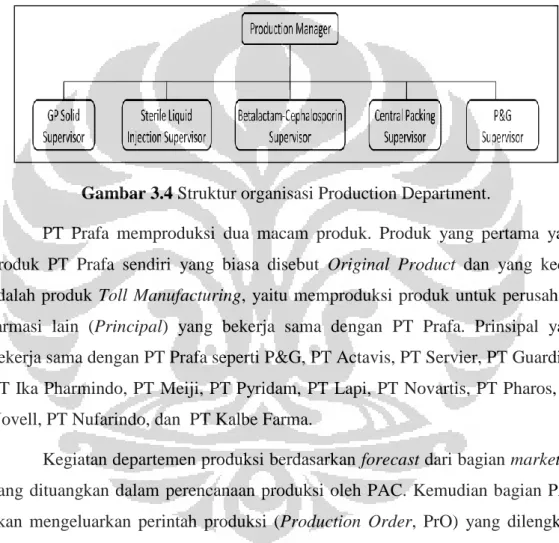
3.3. Production Department
Departemen produksi dipimpin oleh seorang apoteker sebagai manager produksi. Departemen produksi terdiri dari lima subdepartemen yaitu, General
Pharmacy (GP) solid, Sterile Liquid Injection (SLI), betalactam dan cephalosporin, P&G line, serta central packaging. Masing-masing subdepartemen
dipimpin oleh seorang supervisor yang dibantu oleh beberapa section head.
Gambar 3.4 Struktur organisasi Production Department.
PT Prafa memproduksi dua macam produk. Produk yang pertama yaitu produk PT Prafa sendiri yang biasa disebut Original Product dan yang kedua adalah produk Toll Manufacturing, yaitu memproduksi produk untuk perusahaan farmasi lain (Principal) yang bekerja sama dengan PT Prafa. Prinsipal yang bekerja sama dengan PT Prafa seperti P&G, PT Actavis, PT Servier, PT Guardian, PT Ika Pharmindo, PT Meiji, PT Pyridam, PT Lapi, PT Novartis, PT Pharos, PT Novell, PT Nufarindo, dan PT Kalbe Farma.
Kegiatan departemen produksi berdasarkan forecast dari bagian marketing yang dituangkan dalam perencanaan produksi oleh PAC. Kemudian bagian PAC akan mengeluarkan perintah produksi (Production Order, PrO) yang dilengkapi dengan dokumen permintaan bahan baku dan bahan kemas ke gudang (Picking
List), bukti pengeluaran bahan baku dan bahan kemas dari gudang (Production Issue), catatan pengolahan bets (Batch Production Record, BPR) dari PAC.
Departemen produksi melaksanakan produksi di bawah pengawasan QC (IPC). Produk ruahan yang dihasilkan dikirim ke Central Packaging Departement untuk dilakukan pengemasan sekunder, yang selanjutnya dikirim ke gudang obat jadi untuk disalurkan ke distributor.
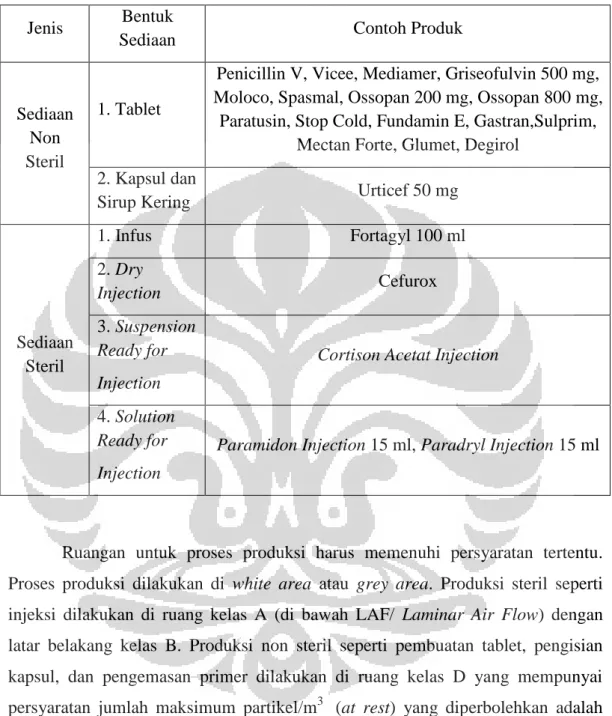
Tabel 3.1 Daftar contoh original product PT Prafa.
Jenis Bentuk
Sediaan Contoh Produk
Sediaan Non Steril
1. Tablet
Penicillin V, Vicee, Mediamer, Griseofulvin 500 mg, Moloco, Spasmal, Ossopan 200 mg, Ossopan 800 mg,
Paratusin, Stop Cold, Fundamin E, Gastran,Sulprim, Mectan Forte, Glumet, Degirol
2. Kapsul dan
Sirup Kering Urticef 50 mg
Sediaan Steril 1. Infus Fortagyl 100 ml 2. Dry Injection Cefurox 3. Suspension Ready for Injection
Cortison Acetat Injection
4. Solution
Ready for Injection
Paramidon Injection 15 ml, Paradryl Injection 15 ml
Ruangan untuk proses produksi harus memenuhi persyaratan tertentu. Proses produksi dilakukan di white area atau grey area. Produksi steril seperti injeksi dilakukan di ruang kelas A (di bawah LAF/ Laminar Air Flow) dengan latar belakang kelas B. Produksi non steril seperti pembuatan tablet, pengisian kapsul, dan pengemasan primer dilakukan di ruang kelas D yang mempunyai persyaratan jumlah maksimum partikel/m3 (at rest) yang diperbolehkan adalah 3.520.000 (ukuran partikel ≥0,5 μm) dan 29.000 (ukuran partikel ≥5,0 μm). Ruangan untuk pengemasan sentral, kantor, dan gudang termasuk ruang hitam (black area).
Dalam memasuki ruangan produksi ada persyaratan tertentu yang harus dipatuhi. Untuk memasuki ruang kelas D harus mengenakan pakaian dan sepatu
masker. Sedangkan ruang kelas A dan B harus memakai pakaian antistatis poliester dan sarung tangan yang sudah disterilkan serta safety google. Untuk membatasi pertukaran udara suatu ruangan dengan tingkat kebersihan tertentu dengan ruangan lain diperlukan suatu ruang antara sehingga ruangan yang mempunyai tingkat kebersihan lebih tinggi tidak terkontaminasi oleh ruangan dengan tingkat kebersihan lebih rendah. Tata udara produksi untuk produk steril dan nonsteril diatur dengan sistem HVAC (Heating, Ventilating and Air
Conditioning) yang berperan dalam pengaturan jumlah partikel dan mikroba,
suhu, kelembaban, tekanan serta sirkulasi udara yang disesuaikan dengan persyaratan CPOB.
Proses produksi dimulai dengan pemeriksaan line clearance untuk memastikan kesesuaian bahan baku, kesiapan peralatan, dan kondisi ruangan. Setelah proses produksi selesai, dilakukan pembersihan terhadap semua mesin yang dipakai dan diberi label “BERSIH” lengkap dengan nama pelaksana, tanggal pembersihan, masa daluarsa, dan produk terakhir yang diproses.
3.3.1. General Pharmacy (GP) Solid Production
Bagian produksi sediaan GP solid menangani produksi tablet, kaplet, tablet salut gula dan salut film, tablet hisap, tablet effervescent, dan kapsul non-betalaktam serta pengemasan primer seperti blistering dan stripping. Produksi GP
solid menggunakan metode granulasi basah (wet granulation) dan metode
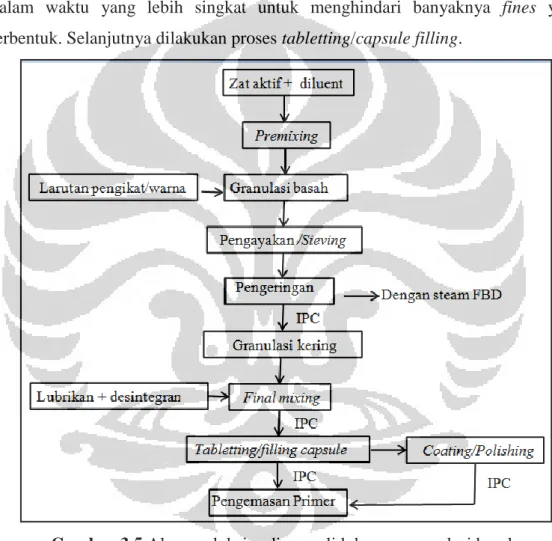
granulasi kering (dry granulation). 1. Granulasi Basah
Proses produksi tablet dimulai dengan proses premixing zat aktif dan filler menggunakan mixer. Premixing pada pengadukan basah dilakukan sebelum menambahkan pengikat dan zat warna. Selanjutnya dilakukan proses granulasi basah (mesh yang biasa digunakan adalah mesh 6 atau 8), kemudian dikeringkan dengan steam FBD. Pada tahap ini dilakukan pemeriksaan kadar air granul oleh bagian produksi. Nilai kadar air granul tergantung dari persyaratan yang ada pada dokumen pengolahan (Batch Production Record/BPR). Setelah dikeringkan,
granul dihaluskan (milling dengan powder mill) atau digranulasi kering dengan
comminutor. Penentuan mesh yang akan digunakan pada granulasi kering
bergantung pada diameter tablet yang akan dicetak. Apabila tablet yang akan dicetak berdiameter kecil, maka digunakan mesh yang lebih tinggi. Setelah dilakukan granulasi kering proses dilanjutkan pada tahap final mixing yaitu penambahan lubrikan dan disintegran. Pengadukan lubrikan dan granul dilakukan dalam waktu yang lebih singkat untuk menghindari banyaknya fines yang terbentuk. Selanjutnya dilakukan proses tabletting/capsule filling.
Gambar 3.5 Alur produksi sediaan solid dengan granulasi basah.
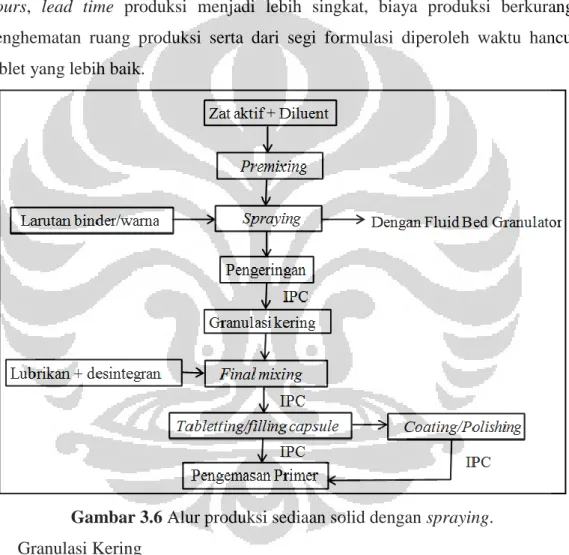
Pada metode granulasi basah ini terdapat metode/teknik spraying. Metode
spraying merupakan modifikasi dari granulasi basah sehingga proses produksi
lebih efisien, yaitu proses premixing dan pengadukan basah dilakukan menggunakan Fluid Bed Granulator. Larutan pengikat yang telah dibuat terlebih dahulu disemprotkan dengan menggunakan Premier mixer melalui sprayer
sesuai dengan spesifikasi yang diinginkan. Setelah dilakukan uji nilai kadar air granul, dilakukan granulasi kering dengan mesin comminutor, lalu dilakukan final
mixing dan pencetakan. Pada dasarnya semua bahan/konsistensi dan jenis yang
digunakan dalam proses spraying sama halnya dengan proses granulasi basah, namun jumlah pelarut/total binder yang diperlukan lebih banyak. Modifikasi prosedur ini memberikan beberapa keuntungan seperti adanya penghematan man
hours, lead time produksi menjadi lebih singkat, biaya produksi berkurang,
penghematan ruang produksi serta dari segi formulasi diperoleh waktu hancur tablet yang lebih baik.
Gambar 3.6 Alur produksi sediaan solid dengan spraying.
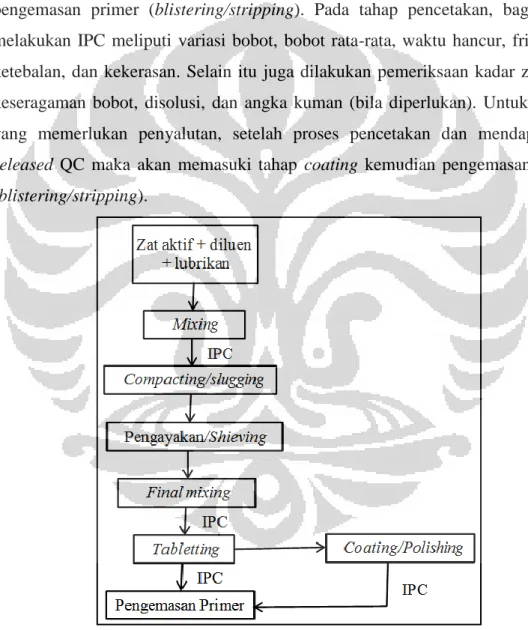
2. Granulasi Kering
Proses produksi tablet dimulai dengan mixing zat aktif, filler, dan lubrikan. Selanjutnya dilanjutkan dengan proses slugging. Setelah itu, dilakukan sieving, kemudian tahapan final mixing dan tabletting. Sebelum dimulai proses pengadukan basah, final mixing, tabletting (filling capsule), coating, dan
stripping maka dilakukan pemeriksaan line clearance dan ditandatangani oleh
Control (IPC). Bagian produksi akan melakukan IPC pada akhir pengeringan
dengan memeriksa kadar air granul (Loss On Drying/LOD), sedangkan bagian QC akan mengambil sampel pada tahap final mixing pada titik atas, tengah dan bawah untuk pemeriksaan homogenitas kadar. Proses produksi dapat dilanjutkan bila granul final mix sudah ada pernyataan released dari QC. Kemudian dilanjutkan dengan proses pencetakan tablet atau pengisian kapsul lalu dilakukan pengemasan primer (blistering/stripping). Pada tahap pencetakan, bagian QC melakukan IPC meliputi variasi bobot, bobot rata-rata, waktu hancur, friabilitas, ketebalan, dan kekerasan. Selain itu juga dilakukan pemeriksaan kadar zat aktif, keseragaman bobot, disolusi, dan angka kuman (bila diperlukan). Untuk produk yang memerlukan penyalutan, setelah proses pencetakan dan mendapat izin
released QC maka akan memasuki tahap coating kemudian pengemasan primer
(blistering/stripping).
Gambar 3.7 Alur produksi sediaan solid dengan
granulasi kering.
Terdapat dua jenis proses coating yang dilakukan, yaitu sugar coating dan
(seal coat), sub coat (dalam hal ini penambahan bobot banyak),
smoothing/colouring (dalam hal ini penambahan bobot sedikit), dan polishing.
Pada lapisan isolasi terdapat parameter kritis yaitu core harus tertutup sempurna dengan lapisan seal coat sehingga core tidak terkena dengan lapisan sub coat (gula hidrofilik) yang dapat menyebabkan tablet rusak. Pada proses film coating, material dilarutkan dengan bahan pelarut organik dan water soluble sebagai lapisan isolasi dan sebagai lapisan film digunakan Eudragit dan Pharmacoat. Proses film coating dimulai dengan pembuatan larutan, kemudian larutan dihomogenisasi lalu disaring. Cairan ini selanjutnya disemprotkan pada core melalui peristaltic pump.
Setelah melewati proses tabletting maupun coating, tablet kemudian dikemas primer (stripping/blistering). Selama proses stripping/blistering, dilakukan pemeriksaan secara visual, meliputi tampilan hasil sampling, penandaan nomor batch, dan tanggal kadaluarsa. Selain itu juga dilakukan uji kebocoran oleh petugas QC. Selanjutnya produk dapat dikirim ke bagian pengemasan sentral untuk dilakukan pengemasan sekunder.
3.3.2 Sterile Liquid Injection (SLI) Production
Sterile Liquid Injection (SLI) menangani produksi sediaan injeksi,
suspensi (vial), liquid (ampul), tetes mata, tetes telinga, dan infus (100 ml). Proses produksi SLI menggunakan dua cara yaitu aseptis dan sterilisasi akhir. Untuk bahan aktif yang tidak tahan panas dilakukan teknik aseptis sedangkan yang tahan panas dilakukan sterilisasi akhir. Proses pengisian untuk produk aseptis dilakukan pada ruangan kelas A di bawah LAF (Laminar Air Flow) dengan latar belakang kelas B.
Proses produksi sediaan SLI dimulai dengan pencucian wadah (ampul/vial/botol infus) yang dilakukan sehari sebelumnya dengan menggunakan WFI (Water For Injection). Setelah dicuci, wadah akan disterilisasi dengan menggunakan oven (suhu 215 oC selama 2 jam), sedangkan alat-alat non gelas
seperti baju steril, sarung tangan dan rubber stopper disterilisasi menggunakan autoklaf (121 oC selama 1 jam).
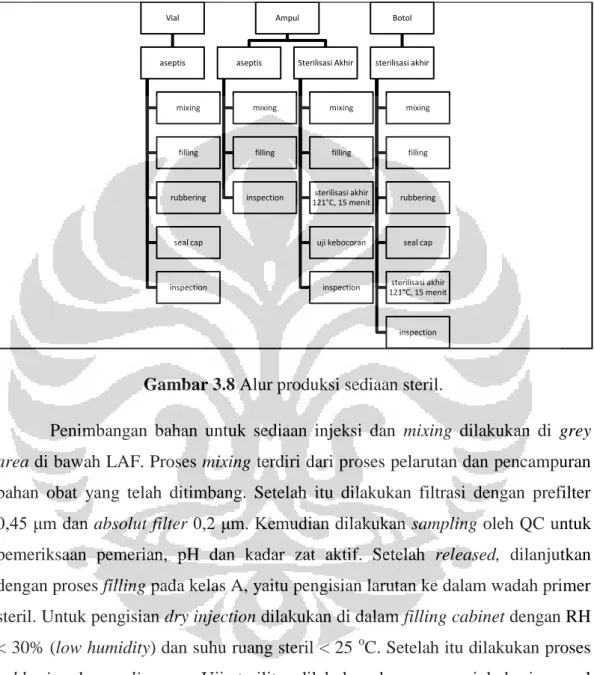
Gambar 3.8 Alur produksi sediaan steril.
Penimbangan bahan untuk sediaan injeksi dan mixing dilakukan di grey
area di bawah LAF. Proses mixing terdiri dari proses pelarutan dan pencampuran
bahan obat yang telah ditimbang. Setelah itu dilakukan filtrasi dengan prefilter 0,45 μm dan absolut filter 0,2 μm. Kemudian dilakukan sampling oleh QC untuk pemeriksaan pemerian, pH dan kadar zat aktif. Setelah released, dilanjutkan dengan proses filling pada kelas A, yaitu pengisian larutan ke dalam wadah primer steril. Untuk pengisian dry injection dilakukan di dalam filling cabinet dengan RH < 30% (low humidity) dan suhu ruang steril < 25 oC. Setelah itu dilakukan proses
rubbering dan sealing cap. Uji sterilitas dilakukan dengan menginkubasi sampel
produk pada media yang sesuai selama 14 hari.
Proses selanjutnya adalah inspeksi, yang dilakukan secara manual dengan melihat partikel-partikel pengotor berupa benang, pecahan kaca dan kotoran hitam. Inspeksi lain berupa penyeleksian terhadap seal-cap yang rusak, bocor,
Vial aseptis mixing filling rubbering seal cap inspection Ampul aseptis mixing filling inspection Sterilisasi Akhir mixing filling sterilisasi akhir 121°C, 15 menit uji kebocoran inspection Botol sterilisasi akhir mixing filling rubbering seal cap sterilisasi akhir 121°C, 15 menit inspection
mulut vial yang pecah ketika di-seal cap dan vial yang kotor sebelum dilakukan pengemasan sekunder.
3.3.3 Betalactam and Cephalosporin Production
Produksi sediaan betalaktam dan sefalosforin dilakukan pada bangunan yang terpisah dengan bangunan produksi lainnya. Unit produksi betalaktam dan sefalosforin dipisahkan oleh gudang kemas PT Prafa. Masing-masing unit produksi mempunyai gudang, ruang timbang, laundry, kantin, pengemasan (packaging), dan toilet yang hanya khusus digunakan oleh para karyawan yang bekerja pada produksi betalaktam dan sefalosforin.
Sediaan-sediaan yang diproduksi bagian betalaktam dan sefalosforin antara lain dry syrup, tablet, dry injection, dan kapsul. Proses produksi solid betalaktam dan non solid betalaktam hampir sama, yang membedakan adalah pada metode granulasi. Proses produksi solid betalaktam dan sefalosporin tidak menggunakan metode granulasi basah tetapi granulasi kering (dry granulation) dan cetak langsung. Hal ini disebabkan sifat bahan aktif golongan betalaktam yang mudah terhidrolisis.
Bangunan betalaktam- sefalosforin dirancang agar tekanan di koridor lebih tinggi dari ruang produksi sehingga udara mengalir masuk ke dalam ruang produksi serta alur masuk dan alur keluar karyawan yang terpisah. Hal ini dilakukan untuk mencegah terjadinya kontaminasi silang karena senyawa betalaktam dan sefalosporin dapat menyebabkan reaksi alergi hingga shock
anafilaksis pada orang yang hipersensitif terhadap antibiotik tersebut.
Pencegahan kontaminasi produk juga terlihat pada peraturan terhadap karyawan, yaitu setiap karyawan yang akan meninggalkan bangunan tersebut diharuskan mandi terlebih dahulu sebelum keluar area produksi. Selain itu, pengolahan limbah terhadap sisa produksi betalaktam juga terlebih dahulu mengalami proses pre-treatment untuk memecah cincin beta pada struktur betalaktam.
3.3.4 Central Packaging (Pengemasan Sentral)
Pengemasan merupakan tahap akhir proses produksi. Terdapat dua tahap proses pengemasan, yaitu :
1. Pengemasan primer : pengemasan yang berhubungan/kontak langsung dengan produk. Proses ini dilakukan oleh masing–masing sub bagian produksi dan dilakukan di grey area atau white area.
2. Pengemasan sekunder : pengemasan yang tidak berhubungan/kontak langsung dengan produk dan dilakukan di black area. Seluruh produk yang telah dikemas dengan kemasan primer dikirim ke pengemasan sentral untuk dilakukan pengemasan sekunder.
Bagian pengemasan sentral dibagi menjadi dua bagian, yaitu pengemasan produk non betalaktam dan pengemasan produk betalaktam dan sefalosforin. Bagian ini dikepalai oleh seorang supervisor.
Sebelum pengemasan sekunder, dilakukan sortir untuk memisahkan produk yang tidak memenuhi syarat untuk dilakukan pengemasan sekunder. Produk yang tidak memenuhi syarat dicatat dan dilaporkan oleh supervisor
pengemasan sentral, kemudian dikembalikan ke bagian produksi untuk dilakukan restripping.
Bagian kemas sentral memiliki dua kegiatan utama yaitu persiapan dan pengemasan. Line clearance dilakukan terlebih dahulu sebelum melaksanakan kegiatan utama. Alur proses pengemasan sekunder yaitu bagian PAC mengeluarkan PrO (untuk bagian proses produksi), PDRS (Packaging Direction
Record Secondary), dan Picking List yang ditujukan pada bagian pengemasan
sentral untuk mengambil material kemas dari gudang bahan kemas. PrO dan
Picking List dikirim ke bagian gudang bahan kemas tiga hari sebelum pengemasan
(H-3). Pada dua hari sebelum pengemasan, gudang akan mengirimkan bahan kemas ke bagian pengemasan sentral. Setelah bahan kemas datang disertai dengan PI dari bagian gudang, sehari sebelum pengemasan dilakukan penandaan (coding) (meliputi penomoran batch, manufacturing date, harga eceran tertinggi,
pemberian tanggal kadaluarsa pada label dan kemasan sekunder) menggunakan mesin coding dan folding (untuk pelipatan brosur dan leaflet). Cara coding yaitu satu kemasan di-coding terlebih dahulu kemudian dikoreksi lalu ditandatangani oleh group leader, petugas IPC, dan operatornya. Setelah itu, coding dapat dilanjutkan untuk semua kemasan. Kemasan kemudian dimasukkan ke dalam satu ruangan dan jika diambil harus dicatat oleh line leader sebagai bukti. Kemudian pengemasan dimulai dan dilakukan berdasarkan PDR.
Gambar 3.9 Alur pengemasan sekunder.
Pada saat pengemasan, IPC dilakukan tiap jam di setiap tahap dan inspeksi dilakukan setelah pengemasan selesai (sebelum dimasukkan ke shipper). Setelah itu, dilakukan penimbangan menggunakan alat timbang yang telah diverifikasi setiap hari seperti yang terdapat dalam SOP. Sebelum menimbang (tiap hari walau nomor batch sama), operator mengambil 10 box berikut isinya dan ditimbang, kemudian mengambil isinya dan hanya menimbang box saja untuk mengetahui variasi berat box yang digunakan. Penyimpangan penimbangan master box tidak boleh sama atau lebih dari berat 1 unit box. Setelah penimbangan selesai, bagian kemas sentral akan membuat dokumen PHP (Pengiriman Hasil Produksi) untuk diserahkan ke gudang obat jadi dan memasukan data ke sistem EXACT. Produk jadi tersebut belum released secara resmi. Produk jadi dinyatakan released apabila tiga dokumen telah terkumpul di QA, yaitu dispensary, produksi, dan pengemasan sentral serta tidak ada penyimpangan.
3.3.5 Line P&G
Line P&G terpisah dari produksi PT Prafa karena kegiatan produksinya dalam skala (batch size) besar sehingga untuk produk P&G memiliki jalur produksi sendiri. Terdapat tiga jenis produk yang diproduksi pada line P&G, yaitu:
1. Formula 44, ada 3 varian yaitu F44 adult, F44 anak-anak dan F44 DT (Day Time). Masing-masing ada dalam kemasan botol (ukuran 27 ml, 54 ml, 100 ml) dan dalam kemasan sachet (ukuran 7 ml) hanya untuk F44 DT.
2. Vicks Vaporub, dalam kemasan ukuran 10 gr dan 50 gr. 3. Vicks Inhaler.
Proses produksi di line P&G menggunakan sistem automatic line yaitu proses pembuatan produk mulai dari bahan awal, pengisian, pengemasan primer dan sekunder, secara langsung berurutan dan tidak terputus. Hal ini ditujukan untuk meningkatkan efektivitas dan efisiensi produk. Hal ini pulalah yang membedakannya dengan proses pengemasan produk Prafa, yaitu untuk produk Prafa setelah dilakukan pengemasan sekunder, produk harus dikirim ke pengemasan sentral untuk dilakukan pengemasan sekunder sedangkan untuk produk P&G langsung dikemas di area produksi P&G.
3.4. Quality Assurance Department
QA Department bertanggung jawab terhadap jaminan kualitas produk yang
dihasilkan. Kualitas produk harus diciptakan sejak awal mulai dari bahan baku, proses pembuatan, peralatan, bangunan, dan personalia yang terlibat dalam pembuatan. QA Departement dipimpin oleh seorang QA manager yang dibantu oleh beberapa supervisor untuk System Compliance, Product Integrity, dan
Validation and Calibration.
Gambar 3.10 Struktur organisasi Quality Assurance Department.
Tugas dari QA adalah membuat sistem panduan mutu, pengembangan manajemen kualitas, kontrol dokumen, training GMP, menangani program kalibrasi, mengkoordinasi program kualifikasi dan validasi, audit pemasok, audit internal dan eksternal, penanganan terhadap keluhan pelanggan, penanganan penyimpangan bets, pengendalian perubahan, penanganan penarikan kembali obat jadi, pelulusan obat jadi, dan mengkoordinasi peninjauan produk tahunan.