UJI AKTIVITAS ANTIOKSIDAN JUS BUAH NAGA MERAH (Hylocereus polyrhizus (Haw.) Britton & Rose) DAN BUAH NAGA PUTIH (Hylocereus undatus (Haw.) Britton & Rose)
DENGAN METODE DPPH
SKRIPSI
OLEH:
RIZKY PRATAMA NIM 141524064
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2017
UJI AKTIVITAS ANTIOKSIDAN JUS BUAH NAGA MERAH (Hylocereus polyrhizus (Haw.) Britton & Rose) DAN BUAH NAGA PUTIH (Hylocereus undatus (Haw.) Britton & Rose)
DENGAN METODE DPPH
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
RIZKY PRATAMA NIM 141524064
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2017
iii
PENGESAHAN SKRIPSI
UJI AKTIVITAS ANTIOKSIDAN JUS BUAH NAGA MERAH (Hylocereus polyrhizus (Haw.) Britton & Rose) DAN BUAH NAGA PUTIH (Hylocereus undatus (Haw.) Britton & Rose)
DENGAN METODE DPPH OLEH:
RIZKY PRATAMA NIM 141524064
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal: Juli 2017 Pembimbing I, Panitia Penguji,
Prof. Dr. Ginda Haro, M.Sc., Apt. Prof. Dr. Rosidah, M.Si., Apt.
NIP. 195108161980031002 NIP. 195103261978022001
Pembimbing II, Prof. Dr. Ginda Haro, M.Sc., Apt.
NIP. 195108161980031002
Drs. Fathur Rahman, M.Si., Apt. Dra. Herawaty Ginting, M.Si., Apt.
NIP. 195201041980031002 NIP. 195112231980032002
Drs. Fathur Rahman, M.Si., Apt.
NIP. 195201041980031002 Medan, Juli 2017
Fakultas Farmasi,
Universitas Sumatera Utara Dekan,
Prof. Dr. Masfria, M.S., Apt.
NIP. 195707231986012001
iv
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT yang telah memberikan karunia yang berlimpah sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul “Uji Aktivitas Antioksidan Jus Buah Naga Merah (Hylocereus polyrhizus (Haw.). Britton & Rose) dan Buah Naga Putih (Hylocereus undatus (Haw.) Britton & Rose) dengan Metode DPPH”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan terima kasih yang sebesar-besarnya kepada Ibu Prof. Dr. Masfria, M.S., Apt., selaku Dekan Fakultas Farmasi yang telah menyediakan fasilitas kepada penulis selama perkuliahan di Fakultas Farmasi. Penulis juga mengucapkan terima kasih kepada Bapak Prof. Ginda Haro, M.Sc., Apt., dan Bapak Drs. Fathur Rahman Harun, M.Si., Apt., yang telah meluangkan waktu dan tenaga dalam membimbing penulis dengan penuh kesabaran dan tanggung jawab, memberikan petunjuk dan saran-saran selama penelitian hingga selesainya skripsi ini. Ucapan terima kasih juga penulis sampaikan kepada Ibu Prof. Dr. Rosidah, M.Si., Apt., selaku ketua penguji, dan Ibu Dra. Herawaty Ginting, M.Si., Apt., selaku anggota penguji yang telah memberikan saran untuk menyempurnakan skripsi ini, dan Bapak Prof. Dr.
Muchlisyam M.Si., Apt., selaku dosen pembimbing akademik serta Bapak dan Ibu staf pengajar Fakultas Farmasi USU yang telah banyak membimbing penulis selama masa perkuliahan hingga selesai. Penulis juga mempersembahkan rasa terima kasih yang tak terhingga kepada keluarga, Bapak Jemirin, Ibu Ermawaty
v
dan kakak, serta adik-adikku tercinta atas limpahan kasih sayang, doa dan semangat yang tak ternilai dengan apa pun.
Terimakasih juga penulis ucapkan kepada teman-teman Farmasi Ekstensi angkatan 2014 untuk kebersamaan dan dorongan semangatnya, serta semua pihak yang tidak dapat disebutkan satu persatu yang telah banyak membantu hingga selesainya penulisan skripsi ini.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih belum sempurna, oleh karena itu penulis mengharapkan saran dan kritik yang membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Juli 2017 Penulis,
Rizky Pratama NIM 141524064
vi
SURAT PERNYATAAN BEBAS PLAGIAT Saya yang bertanda tangan dibawah ini :
Nama : Rizky Pratama
NIM : 141524064
Program Studi : S-1 Ekstensi Farmasi
Judul Skripsi : Uji Aktivitas Antioksidan Jus Buah Naga Merah (Hylocereus polyrhizus (Haw.) Britton & Rose) dan Buah Naga Putih (Hylocereus undatus (Haw.) Britton & Rose) dengan Metode DPPH.
Dengan ini menyatakan bahwa skripsi ini ditulis berdasarkan data dan hasil pekerjaan yang saya lakukan sendiri, dan belum pernah diajukan orang lain untuk memperoleh gelar kesarjanaan di perguruan tinggi lain, dan bukan plagiat karena kutipan yang ditulis setelah disebutkan sumbernya didalam daftar pustaka.
Apabila dikemudian hari ada pengaduan dari pihak lain karena di dalam skripsi ini ditemukan plagiat karena kesalahan saya sendiri, maka saya bersedia menerima sanksi apapun oleh Program Studi Farmasi Fakultas Farmasi Universitas Sumatera Utara, dan bukan menjadi tanggung jawab pembimbing.
Demikian surat pernyataan ini saya perbuat dengan sebenarnya untuk dapat digunakan jika diperlukan sebagai mana mestinya.
Medan, Juli 2017 Yang Membuat Pernyataan
Rizky Pratama NIM 141524064
vii
Uji Aktivitas Antioksidan Jus Buah Naga Merah (Hylocereus polyrhizus (Haw.) Britton & Rose) dan Buah Naga Putih (Hylocereus undatus (Haw.)
Britton & Rose) Dengan Metode DPPH ABSTRAK
Buah naga merupakan salah satu jenis buah tropis dengan kandungan vitamin C, vitamin E, vitamin A, dan senyawa polifenol yang berpotensi sebagai antioksidan. Radikal bebas merupakan salah satu bentuk senyawa oksigen reaktif yang secara umum diketahui sebagai senyawa yang memiliki elektron yang tidak berpasangan. Antioksidan adalah senyawa pemberi elektron (elektron donor) yang dapat menangkal atau meredam dampak negatif oksidan sehingga dapat melindungi tubuh dari serangan radikal bebas. Tujuan penelitian ini adalah untuk menentukan aktivitas antioksidan pada jus buah naga merah dan jus buah naga putih.
Metode yang dilakukan untuk uji aktivitas antioksidan adalah metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazyl) menggunakan spektrofotometer visible dan pengukuran dilakukan pada panjang gelombang maksimum 516 nm pada konsentrasi 40 μg/ml.
Hasil uji aktivitas antioksidan diperoleh nilai Inhibitory Concentration (IC50) masing-masing pada jus buah naga merah sebesar 128,3764 μg/ml dan termasuk dalam kategori sedang, sedangkan jus buah naga putih sebesar 94,7983 μg/ml dan termasuk dalam kategori kuat.
Kata kunci: Antioksidan, DPPH, jus buah naga merah dan jus buah naga putih.
viii
Antioxidant Activity Test at Red Dragon Fruit Juice (Hylocereus polyrhizus Haw.) Britton & Rose) and White Dragon Fruit (Hylocereus undatus Haw.)
Britton & Rose) by DPPH Method ABSTRACT
Dragon fruit is one kind of tropical fruit with vitamin C, vitamin E, vitamin A, and polyphenols that was potentially as an antioxidants. Free radicals are one form of reactive oxygen compounds, generally known as compounds that have unpaired electrons. Antioxidants are electron donor compounds that can counteract or reduced the negative effects of oxidants that can protected the body from free radical attack. The aim of this study was to determine the antioxidant activity in the meat of red dragon fruit juice and the meat of white dragon fruit juice.
The method used for the antioxidant activity test was the trapped of free radical of DPPH (1,1-diphenyl-2-picrylhydrazyl) used visible spectrophotometer and the measurement was performed at a maximum wavelength of 516 nm at a concentration of 40 μg / ml.
The result of antioxidant activity was obtained a value of Inhibitory Concentration (IC50) respectively in the meat of red dragon fruit juice was 128.3764 μg / ml and included in moderate category, while in the meat of white dragon fruit juice is 94.7983 μg / ml and included in the strong category.
Keywords: Antioxidant, DPPH red dragon fruit juice and white dragon fruit juice.
ix DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
SURAT PERNYATAAN BEBAS PLAGIAT ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikiran Penelitian ... 4
BAB II Tinjauan Pustaka ... 5
2.1 Uraian Tumbuhan ... 5
2.1.1 Daerah Tumbuh (habitat) ... 5
2.1.2 Sistematika Tumbuhan ... ... 6
x
2.1.3 Nama Asing ... 6
2.1.4 Morfologi Tumbuhan ... 6
2.1.5 Kandungan Gizi ... 7
2.1.6 Khasiat Buah Naga ... 7
2.2 Buah Naga Merah ... 8
2.3 Buah Naga Putih ... 8
2.4 Radikal Bebas ... 9
2.5 Antioksidan ... 10
2.6 Metode Pemerangkapan Radikal DPPH ... 10
2.7 Waktu Pengukuran ... 12
2.8 Penentuan Aktivitas Antioksidan dengan Metode DPPH ... 12
2.9 Pelarut ... 13
2.10 Pengukuran Absorbansi panjang gelombang ... 13
2.11 Spektrofotometer UV-Visible ... 14
BAB III METODE PENELITIAN ... 16
3.1 Alat ... 16
3.2 Bahan ... 16
3.3 Penyiapan Bahan Tumbuhan ... ... 17
3.3.1 Pengumpulan Bahan Tumbuhan ... 17
3.3.2 Identifikasi Tumbuhan ... 17
3.3.3 Pembuatan Jus Buah Naga Merah dan Jus Buah Naga Putih ... 17
3.4 Uji Aktivitas Antioksidan Metode DPPH ... 18
3.4.1 Prinsip metode DPPH ... 18
xi
3.4.2 Pembuatan Larutan DPPH 0,5 mM ... 18
3.4.3 Pengukuran Panjang gelombang Serapan Maksimum DPPH ... 18
3.4.4 Pengukuran Waktu Kerja ... 18
3.4.5 Pembuatan Larutan Induk Jus Buah Naga Merah (JBNM) dan Jus Buah Naga Putih (JBNP) ... 19
3.4.6 Pembuatan Larutan Uji Jus Buah Naga Merah (JBNM) dan Jus Buah Naga Putih (JBNP) ... 19
3.4.7 Analisis Persen Pemerangkapan Radikal Bebas ... 19
3.4.8 Analisis Nilai IC50 ... 20
BAB IV HASIL DAN PEMBAHASAN ... 21
4.1 Hasil Identifikasi Tumbuhan ... 21
4.2 Hasil Pengujian Aktivitas Antioksidan ... 21
4.2.1 Hasil Penentuan Panjang Gelombang Serapan Maksimum ... 21
4.2.2 Hasil Analisis Waktu Pengukuran (Operating Time) .. 22
4.2.3 Hasil Analisis Aktivitas Antioksidan (JBNM) dan (JBNP) ... 23
BAB V KESIMPULAN DAN SARAN ... 28
5.1 Kesimpulan ... 28
5.2 Saran ... ... 28
DAFTAR PUSTAKA ... 29
LAMPIRAN ... 31
xii
DAFTAR TABEL
Tabel Halaman
4.1 Penurunan Absorbansi dan Persen Pemerangkapan DPPH
oleh Masing-masing JBNM dan JBNP ... 23 4.2 Hasil Persamaan Regresi Linier dan Hasil Analisis IC50 yang
Diperoleh dari JBNM dan JBNP ... 26 4.3 Kandungan Gizi Buah Naga . ... 27 4.4 Kategori Nilai IC50 Sebagai Antioksidan ... 27
xiii
DAFTAR GAMBAR
Gambar Halaman
1.1 Skema Kerangka Pikir Penelitian ... 4
2.1 Struktur Kimia DPPH ... 10
2.2 Reaksi Antara DPPH dengan Atom H dari Senyawa Antioksidan .. 11
4.1 Kurva Serapan Maksimum Larutan DPPH 40 μg/ml Dalam Metanol Menggunakan Spektrofotometer UV-Visibel ... 21
4.2 Hasil Grafik Analisis Waktu Pengukuran (Operating Time) . .... 22
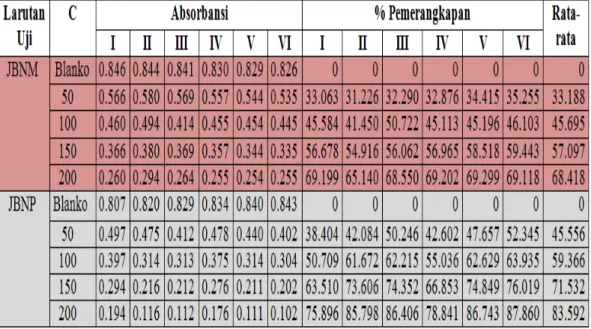
4.3 Grafik Hasil Uji Aktivitas Antioksidan JBNM ... 25
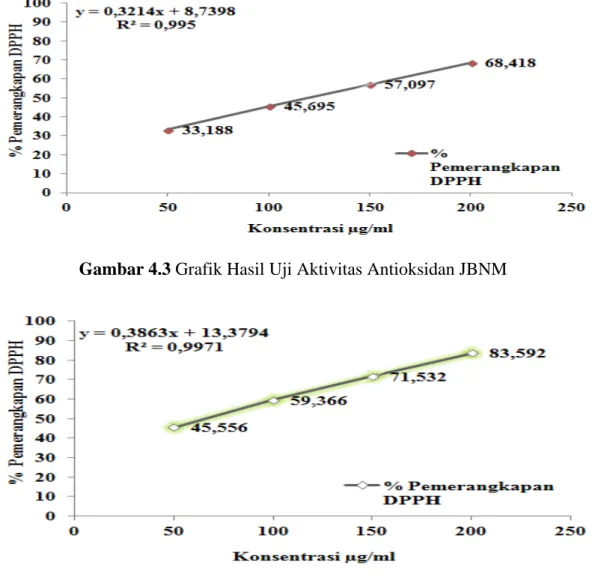
4.4 Grafik Hasil Uji Aktivitas Antioksidan JBNP ... 25
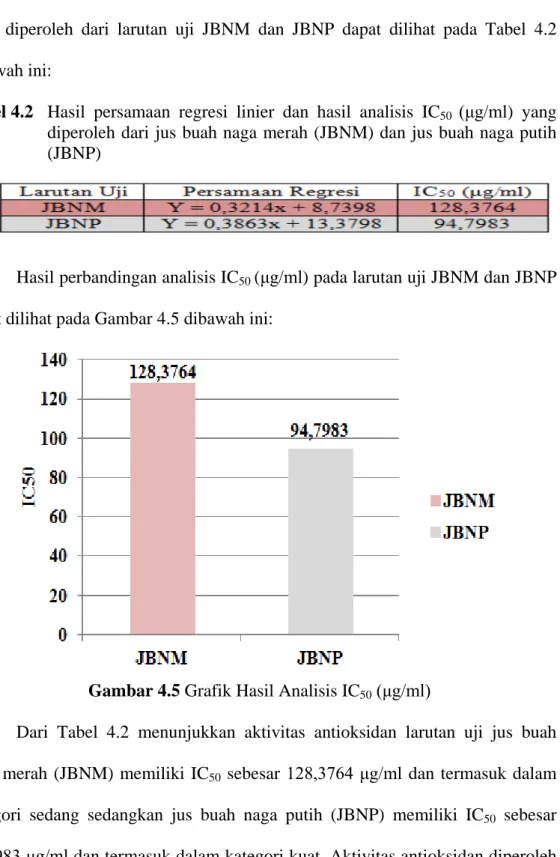
4.5 Grafik Hasil Analisis IC50(μg/ml) ... 26
xiv
DAFTAR LAMPIRAN
Lampiran Halaman
1 Bagan Kerja ... 31 2 Hasil Identifikasi Tumbuhan ... 32 3 Gambar Sampel ... 34 4 Gambar Seperangkat Alat Spektrofotometer UV-Visibel
(UV-1800 Shimadzu) ... 35 5 Hasil Pengukuran Operating Time ... 36 6 Hasil Uji Aktivitas Antioksidan ... 38 7 Contoh Perhitungan Persen Pemerangkapan dan
Perhitungan Nilai IC50 ... 39
xv
1 BAB I PENDAHULUAN
1.1 Latar Belakang
Buah naga merupakan salah satu jenis buah tropis dengan kandungan vitamin C, vitamin E, vitamin A, dan senyawa polifenol yang berpotensi sebagai antioksidan serta serat yang tinggi. Buah yang berasal dari meksiko ini berbeda dengan famili Cactacea lainnya, yakni memiliki rasa yang manis dan segar.
Kekhasan lain dari tanaman ini adalah pada tiap nodus batang terdapat duri (Umayah dan Amrun, 2007).
Radikal bebas merupakan salah satu bentuk senyawa oksigen reaktif, secara umum diketahui sebagai senyawa yang memiliki elektron yang tidak berpasangan. Adanya elektron yang tidak berpasangan menyebabkan senyawa tersebut sangat reaktif mencari pasangan, dengan cara menyerang dan mengikat elektron molekul yang berada di sekitarnya. Target utama radikal bebas adalah protein, asam lemak tak jenuh, lipoprotein, unsur DNA serta karbohidrat (Winarsi, 2007).
Adanya radikal bebas dalam tubuh menjadi penyebab dari berbagai penyakit kronis dan degeneratif. Radikal bebas dapat di tangkal oleh antioksidan.
Tubuh memiliki mekanisme pertahanan antioksidan (antioxidant defense) dalam bentuk enzim antioksidan dan zat antioksidan untuk menetralisir radikal bebas seperti enzim-enzim peroksidase, katalase, glutation, seringkali masih kurang akibat pengaruh lingkungan dan diet yang buruk (Umayah dan Amrun, 2007;
Silalahi, 2006).
2
Antioksidan adalah senyawa pemberi elektron yang dapat menangkal atau meredam dampak negatif oksidan sehingga dapat melindungi tubuh dari serangan radikal bebas. Antioksidan berdasarkan sumbernya dapat dibedakan menjadi antioksidan sintetik dan antioksidan alami. Antioksidan sintetik yang lebih populer digunakan adalah BHA (butil hidroksi anisol), BHT (butil hidroksi toluen) dan TBHQ (terbutil hydroquinon). Adanya kekhawatiran terhadap efek samping antioksidan sintetik berupa hepatomegali, mempengaruhi aktivitas enzim di hati serta karsinogenik. Penggunaan bahan antioksidan alami seperti vitamin A, Vitamin C, vitamin E, dan senyawa polifenol lebih aman digunakan daripada antioksidan sintesis, menyebabkan antioksidan alami menjadi alternatif yang terpilih sejak tahun 1980 (Pranata, dkk., 2015; Sayuti dan Yenrina, 2015).
Penelitian yang dilakukan Umayah dan Amrun (2007) terhadap aktivitas antioksidan dari ekstrak metanol dan ekstrak air buah naga dengan metode DPPH (1,1-diphenyl-2-picrylhydrazyl) diperoleh bahwa ekstrak air mempunyai aktivitas antioksidan lebih besar dari pada ekstrak metanol, hal ini disebabkan oleh kandungan vitamin C yang mudah larut ke dalam air dibanding dengan metanol.
Berdasarkan hal tersebut, maka peneliti tertarik untuk melakukan penelitian meliputi identifikasi tumbuhan dan uji aktivitas antioksidan jus buah naga merah (Hylocereus polyrhizus (Haw.) Britton & Rose) dan buah naga putih (Hylocereus undatus (Haw.) Britton & Rose) dengan menggunakan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazyl) dan IC50
sebagai parameter yang digunakan untuk menyatakan aktivitas antioksidan oleh suatu bahan uji dengan metode peredaman Radikal Bebas DPPH (1,1- diphenyl-2-picrylhydrazyl).
3
Metode aktivitas anti radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazyl) merupakan metode terpilih untuk menetukan aktivitas antioksidan bahan alam, yang terbukti akurat, reliabel dan praktis (Umayah dan Amrun, 2007; Sayuti dan Yenrina, 2015).
1.2 Perumusan Masalah
Berdasarkan uraian diatas, maka permasalahan dalam penelitian ini dapat dirumuskan sebagai berikut:
a. Apakah jus buah naga merah dan jus buah naga putih memiliki aktivitas antioksidan ?
b. Termasuk kategori apakah aktivitas antioksidan jus buah naga merah dan jus buah naga putih ?
1.3 Hipotesis
Berdasarkan uraian diatas, maka hipotesis dalam penelitian ini adalah:
a. Jus buah naga merah dan jus buah naga putih memiliki aktivitas antioksidan.
b. Jus buah naga merah dan jus buah naga putih memiliki aktivitas antioksidan yang termasuk dalam kategori sangat kuat.
1.4 Tujuan Penelitian
Berdasarkan uraian diatas, maka tujuan dari penelitian ini adalah:
a. Untuk mengetahui jus buah naga merah dan jus buah naga putih memiliki aktivitas antioksidan.
4
b. Untuk mengetahui kategori aktivitas antioksidan jus buah naga merah dan jus buah naga putih.
1.5 Manfaat Penelitian
Dari hasil penelitian ini, dapat diinformasikan kepada masyarakat bahwa jus buah naga merah dan jus buah naga putih mengandung antioksidan, sehingga masyarakat dapat menjadikan jus buah naga merah dan jus buah naga putih sebagai minuman sumber antioksidan.
1.6 Kerangka Pikiran Penelitian
Kerangka pikir penelitian dapat dilihat pada gambar 1.1
Variabel Bebas Variabel Terikat Parameter
Gambar 1.1 Skema Kerangka Pikir Penelitian Jus Buah Naga
Merah (JBNM) dan Jus Buah
Naga Putih (JBNP)
Uji Aktivitas Antioksidan
dengan Metode DPPH
Nilai IC50 JBNM & JBNP
5 BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi daerah tumbuh (habitat), sistematika tumbuhan, nama asing, morfologi tumbuhan, kandungan gizi dan khasiat dari tumbuhan.
2.1.1 Daerah Tumbuh (habitat)
Tumbuhan buah naga berasal dari daerah beriklim tropis kering. Habitat aslinya di Meksiko, Amerika Tengah dan Amerika Selatan bagian utara, di lingkungan hutan belantara yang tebduh, ia tumbuh mengikuti batang tanaman yang lain. Sekarang buah naga sudah dibudidayakan di Indonesia mulai tahun 2000-an yaitu di daerah Mojokerto, Pasuruan, Malang, Jember, Banyuangi, Ponorogo dan Batam (Cahyono, 2009).
Tumbuhan buah naga dapat tumbuh dan berbuah lebat dengan kualitas buah yang baik bila ditanam pada daearah yang keadaan lingkungan (iklim dan tanah) yang sesuai. Suhu udara untuk pertumbuhan buah naga 22°C-35°C, kelembaban udaranya 40%-60%, ketinggian tempat pada dataran rendah sampai medium 0-500 m dari permukaan laut, tekstur dan struktur tanah yaitu tanah liat dan berpasir atau berkrikil, keadaan tanah yang mengandung zat besi berlebihan dapat mengganggu pertumbuhannya dimana hal ini biasanya terjadi pada tanah basah, sifat tanah yang baik apabila tanah banyak mengandung bahan organik tanah (humus) dan organisme tanah (mikroba tanah) pengurai bahan organik tanah (Cahyono, 2009).
6 2.1.2 Sistematika Tumbuhan
Kingdom : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Dicotyledonae Ordo : Cactales Famili : Cactaceae Genus : Hylocereus
Spesies : Hylocereus polyrhizus (buah naga merah) Hylocereus undatus (buah naga putih)
(Cahyono, 2009).
2.1.3 Nama Asing
Nama asing buah naga adalah dragon fruit (Inggris), pitaya (Meksiko), Melano (Hawai), feu long kwa (Cina), thanh long (Vietnam), kaeo mangkon (Thailand), kaktus madu (Malaysia), rhino fruit (Australia) (Anonim, 2009).
2.1.4 Morfologi Tumbuhan
Tumbuhan buah naga memiliki ciri-ciri berupa tumbuhan terna dan memanjat. Akar serabut yang tumbuh dan berkembang dalam tanah pada kedalaman 30 cm - 40 cm dan akar gantung yang tumbuh pada batang, berwarna coklat kemerahan. Batang segi tiga, berlekuk atau bergerigi, berduri pendek, tidak tajam, lunak dan hijau. Bunga berumah satu, tersebar di ujung dan tengah batang, panjang 30 cm, mahkota berwarna putih bagian dalam dan krem bagian luar, benang sarinya kuning. Buah berbentuk bulat agak lonjong, panjang 7,5-12 cm, diameter 5,5-8 cm, lunak, kulitnya berwarna merah dan sisiknya berwarna hijau,
7
biji berbentuk bulat, kecil dan hitam (Cahyono, 2009).
2.1.5 Kandungan Gizi
Dalam 100 g buah naga merah , kandungan airnya cukup tinggi yaitu 82,5- 83 g, serat 0,7-0,9 g, betakaroten 0,005-0,012 g, kalsium 6,3-8,8 mg, zat besi 0,55-0,65 mg, fosfor 30,2-36,1 mg, protein 0,16-0,23 g, lemak 0,21-0,61 g, beragam vitamin seperti B1 sebanyak 0,28-0,30 mg, vitamin B2 0,043-0,045 mg, niasin 1,297-1,300 mg dan vitamin C 8-9 mg. Sedangkan dalam 100 g buah naga putih mengandung air 89,4 g, serat 0,3 g, kalsium 6 mg, zat besi 0,4 mg, fosfor 19 mg, protein 0,5 g, lemak 0,1 g, niasin 0,2 mg dan vitamin C 25 mg (Gunasena dan Pushpakumara, 2006).
2.1.6 Khasiat Buah Naga
Dari beberapa media massa disebutkan bahwa buah naga memiliki khasiat untuk kesehatan manusia, di antaranya ialah sebagai penyeimbang kadar gula darah, pencegah kanker usus, pelindung kesehatan mulut, serta pengurang kolesterol, pencegah pendarahan dan obat keluhan keputihan. Adanya khasiat- khasiat tersebut disebabkan oleh kandungan nutrisi dalam buahnya yang sangat mendukung kesehatan tubuh manusia.
Buah naga umumnya dikonsumsi dalam bentuk segar sebagai penghilang dahaga. Hal ini disebabkan oleh kandungan airnya sangat tinggi, sekitar 90,20%
dari berat buah. Rasanya cukup manis karena didukung oleh kadar gula yang mencapai 13-18 brix.
Selain dikonsumsi langsung, penyajian buah naga dapat berupa jus, es krim, sari buah, manisan, maupun selai. Dapat saja buah naga ini diolah menjadi beragam bentuk sesuai selera sehingga semakin memasyarakat (Kristanto, 2003).
8 2.2 Buah Naga Merah
Hylocereus polyrhizus yang lebih banyak dikembangkan di cina dan australia ini memiliki buah dengan kulit berwarna merah. Kulitnya terdapat sisik atau jumbai hijau. Rasa buah lebih manis dibandingkan Hylocereus undatus, kadar kemanisan mencapai 13-15 brix. Tanamanya lebih kekar dibanding Hylocereus undatus. Duri pada batang dan cabang berjarak lebih rapat. Tanaman ini tergolong jenis yang sangat rajin berbunga, bahkan cenderung berbunga sepanjang tahun. Sayangnya, tingkat keberhasilan bunga menjadi buah sangat kecil, hanya mencapai 50% sehingga produktivitas buahnya tergolong rendah.
Bahkan jenis ini termasuk jenis tanaman yang buahnya hanya berukuran kecil.
Rata-rata berat buahnya hanya sekitar 400 g. Lokasi penanaman yang ideal pada ketinggian rendah sampai sedang (Kristanto, 2003).
2.3 Buah Naga Putih
Hylocereus undatus yang lebih popular dengan sebutan white pitaya adalah buah naga yang kulitnya berwarna merah dan daging berwarna putih.
Warna merah buah ini sangat kontras dengan warna daging buah. Pada kulit buah terdapat sisik atau jumbai berwarna hijau. Di dalam buah terdapat banyak biji berwarna hitam. Berat buah rata-rata 400-500 g, bahkan ada yang dapat mencapai 650 g. Rasa buahnya masam bercampur manis. Dibanding jenis lainnya, kadar kemanisannya tergolong rendah, sekitar 10-13 brix. Batang tanamannya berwarna hijau tua. Daerah tumbuh yang ideal pada ketinggian kurang dari 400 m dari permukaan laut. Bila penanamannya dilakukan pada ketinggian di atas 400 m dari permukaan laut, produktivitasnya cenderung turun hingga sekitar 25% karena
9
akan lebih banyak bermunculan tunas dibanding bunga. Tanaman ini lebih banyak dikembangkan di negara-negara produsen utama buah naga dibanding jenis lainnya karena buahnya cenderung lebih banyak diekspor (Kristanto, 2003).
2.4 Radikal Bebas
Radikal bebas merupakan salah satu bentuk senyawa oksigen reaktif, secara umum diketahui sebagai senyawa yang memiliki elektron yang tidak berpasangan. Adanya elektron yang tidak berpasangan menyebabkan senyawa tersebut sangat reaktif mencari pasangan, dengan cara menyerang dan mengikat elektron molekul yang berada di sekitarnya. Target utama radikal bebas adalah protein, asam lemak tak jenuh, lipoprotein, unsur DNA serta karbohidrat (Winarsi, 2007).
Adanya radikal bebas dalam tubuh menjadi penyebab dari berbagai penyakit kronis dan degeneratif. Radikal bebas dapat di tangkal oleh antioksidan.
Tubuh memiliki mekanisme pertahanan antioksidan (antioxidant defense) dalam bentuk enzim antioksidan dan zat antioksidan untuk menetralisir radikal bebas seperti enzim-enzim peroksidase, katalase, glutation, seringkali masih kurang akibat pengaruh lingkungan dan diet yang buruk (Umayah dan Amrun, 2007;
Silalahi, 2006).
2.5 Antioksidan
Antioksidan adalah senyawa pemberi elektron (elektron donor) yang dapat menangkal atau meredam dampak negatif oksidan sehingga dapat melindungi tubuh dari serangan radikal bebas. Antioksidan berdasarkan sumbernya dapat
10
dibedakan menjadi antioksidan sintetik dan antioksidan alami. Antioksidan sintetik yang lebih populer digunakan adalah BHA (butil hidroksi anisol), BHT (butil hidroksi toluen) dan TBHQ (terbutil hydroquinon). Adanya kekhawatiran terhadap efek samping antioksidan sintetik berupa hepatomegali, mempengaruhi aktivitas enzim di hati serta karsinogenik. Penggunaan bahan antioksidan alami seperti vitamin A, Vitamin C, vitamin E, dan senyawa polifenol lebih sehat dan lebih aman digunakan daripada antioksidan sintesis, menyebabkan antioksidan alami menjadi alternatif yang terpilih sejak tahun 1980 (Pranata, dkk., 2015;
Sayuti dan Yenrina, 2015).
2.6 Metode Pemerangkapan Radikal DPPH (1,1-diphenyl-2-picrylhydrazyl) DPPH (1,1-diphenyl-2-picrylhydrazyl) pertama kali ditemukan pada tahun 1922 oleh Goldschmidt dan Renn. DPPH (1,1-diphenyl-2-picrylhydrazyl) berwarna ungu pekat seperti KMnO4, bersifat tidak larut dalam air. DPPH merupakan singkatan untuk senyawa kimia 1,1-diphenyl-2-picrylhydrazil. DPPH (1,1-diphenyl-2-picrylhydrazyl) berupa serbuk berwarna ungu gelap yang terdiri dari molekul radikal bebas yang stabil. DPPH (1,1-diphenyl-2-picrylhydrazyl) mempunyai berat molekul 394,32 dengan rumus bangun C18H12N5O6. Penyimpanannya dalam wadah tertutup baik pada suhu -20 °C (Ionita, 2005;
Molyneux, 2004).
Gambar 2.1 Struktur kimia DPPH (1,1-diphenyl-2-picrylhydrazyl)
11
Metode pemerangkap radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazyl) adalah suatu metode sederhana, cepat dan murah yang dapat digunakan untuk menguji kemampuan antioksidan yang terkandung dalam makanan. Metode ini dapat digunakan untuk sampel yang padat dan bentuk larutan. Prinsipnya adalah elektron ganjil pada molekul DPPH (1,1-diphenyl-2-picrylhydrazyl) memberikan serapan maksimum pada panjang gelombang tertentu, berwarna ungu. Warna akan berubah dari ungu menjadi kuning lemah apabila elektron ganjil tersebut berpasangan dengan atom hidrogen yang disumbangkan senyawa antioksidan.
Perubahan warna ini berdasarkan reaksi kesetimbangan kimia (Prakash, 2001).
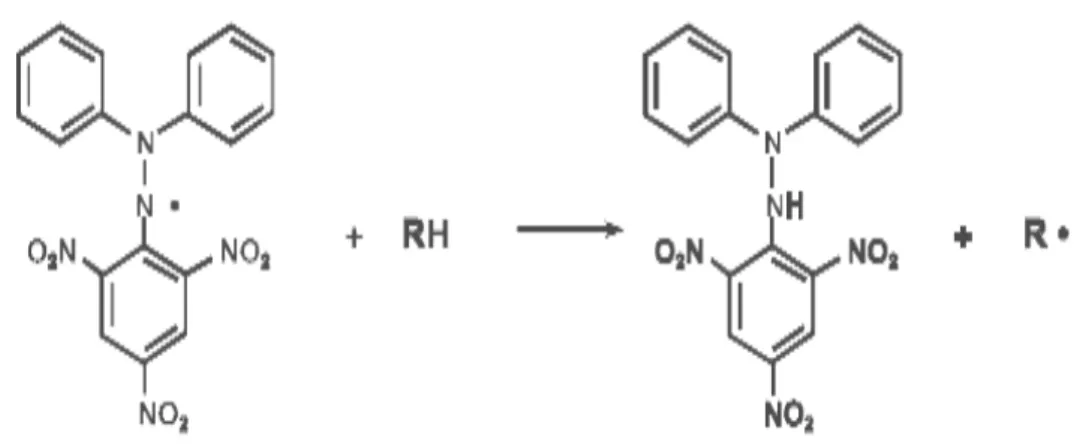
Gambar 2.2 Reaksi antara DPPH dengan atom H dari senyawa antioksidan
2.7 Waktu Pengukuran
Lamanya pengukuran menurut literatur yang direkomendasikan adalah selama 60 menit, tetapi dalam beberapa penelitian waktu yang digunakan sangat bervariasi yaitu 5 menit, 10 menit, 20 menit, 30 menit dan 60 menit. Waktu reaksi yang tepat adalah ketika reaksi sudah mencapai kesetimbangan. Kecepatan reaksi dipengaruhi oleh sifat dari aktivitas antioksidan yang terdapat di dalam sampel (Molyneux, 2004; Prakash, 2001; Rosidah, et al., 2008).
12
2.8 Penentuan Aktivitas Antioksidan dengan Metode DPPH
Aktivitas antioksidan dapat dilakukan dengan DPPH (1,1-diphenyl-2- picrylhydrazyl), karena merupakan radikal bebas yang stabil pada suhu kamar dan banyak digunakan untuk mengevaluasi aktivitas antioksidan dari senyawa atau ekstrak bahan alam. Interaksi antioksidan dengan DPPH (1,1-diphenyl-2- picrylhydrazyl) baik secara transfer elektron atau radikal hidrogen pada DPPH (1,1-diphenyl-2-picrylhydrazyl) akan menetralkan radikal bebas dari DPPH (1,1- diphenyl-2-picrylhydrazyl) dan membentuk DPPH tereduksi. Jika semua elektron pada radikal bebas pada DPPH (1,1-diphenyl-2-picrylhydrazyl) menjadi berpasangan, maka warna larutan berubah dari ungu menjadi kuning terang.
Perubahan ini dapat diukur sesuai dengan jumlah elektron atau atom hidrogen yang ditangkap oleh molekul DPPH (1,1-diphenyl-2-picrylhydrazyl) akibat adanya zat antioksidan (Winarsi, 2007).
Suatu senyawa menunjukkan efeknya sebagai antioksidan jika dapat menghambat reaksi peroksidasi lipid, yang secara in vitro dapat diketahui dari besarnya IC50 atau Inhibitor Concentration 50. Parameter yang dipakai untuk menunjukkan aktivitas antioksidan adalah harga konsentrasi efisiensi atau Efficient Concentration (EC50) atau Inhibitory Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat menyebabkan 50% DPPH (1,1- diphenyl-2-picrylhydrazyl) kehilangan karakter radikal atau konsentrasi suatu zat antioksidan yang memberikan persen peredaman sebesar 50%. Zat yang mempunyai aktivitas antioksidan tinggi, akan mempunyai harga EC50 atau IC50 yang rendah (Molyneux, 2004).
13
Aktivitas antioksidan didasarkan pada besarnya IC50, diklasifikasikan kedalam 4 kelompok yaitu sangat kuat (< 50 μg/ml), kuat (50-100 μg/ml), sedang (101-150 μg/ml) dan lemah (151-200 μg/ml). IC50 juga didefinisikan sebagai bilangan yang menunjukkan konsentrasi ekstrak (mikrogram/ mililiter) yang mampu menghambat 50% oksidasi. Semakin kecil nilai IC50 semakin tinggi aktivitas antioksidannya (Winarsi, 2014).
2.9 Pelarut
Metode ini akan bekerja dengan baik menggunakan pelarut metanol atau etanol karena kedua pelarut ini tidak mempengaruhi dalam reaksi antara sampel uji sebagai antioksidan dengan DPPH (1,1-diphenyl-2-picrylhydrazyl) sebagai radikal bebas (Molyneux, 2004).
2.10 Pengukuran Absorbansi Panjang Gelombang
Panjang gelombang maksimum (λ maks) yang digunakan dalam pengukuran sampel uji sangat bervariasi. Menurut beberapa literatur panjang gelombang maksimum untuk DPPH (1,1-diphenyl-2-picrylhydrazyl) antara lain 515-520 nm. Bagaimanapun dalam praktiknya hasil pengukuran yang memberikan peak maksimum itulah panjang gelombangnya yaitu sekitar panjang gelombang yang disebutkan diatas (Molyneux, 2004).
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal. Untuk memilih panjang gelombang maksimal, dilakukan dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku pada konsentrasi
14 tertentu (Gandjar dan Rohman, 2008).
Menurut Gandjar dan Rohman (2008), ada beberapa alasan mengapa harus menggunakan panjang gelombang maksimal, yaitu:
1. Pada panjang gelombang maksimal, kepekaannya juga maksimal karena pada panjang gelombang maksimal tersebut perubahan absorbansi untuk setiap satuan konsentrasi adalah yang paling besar.
2. Disekitar panjang gelombang maksimal, bentuk kurva absorbansi datar dan pada kondisi tersebut hukum lambert-Beer akan terpenuhi.
3. Jika dilakukan pengukuran ulang maka kesalahan yang disebabkan oleh pemasangan ulang panjang gelombang akan kecil sekali, ketika digunakan panjang gelombang maksimal.
2.11 Spektrofotometer UV- Visible
Metode spektrofotometri ultraviolet dan sinar tampak (visible) telah banyak diterapkan untuk penetapan senyawa-senyawa organik yang umumnya dipergunakan untuk penentuan senyawa dalam jumlah yang sangat kecil. Dalam suatu larutan, gugus molekul yang dapat mengabsorpsi cahaya dinamakan gugus kromofor. Molekul-molekul yang hanya mengandung satu gugus kromofor dapat mengalami perubahan pada panjang gelombang. Molekul yang mengandung dua gugus kromofor atau lebih akan mengabsorpsi cahaya pada panjang gelombang yang hampir sama dengan molekul yang hanya mempunyai satu gugus kromofor tertentu, tetapi intensitas absorpsinya adalah sebanding dengan jumlah kromofor yang ada (Triyati, 1985).
15
Spektrofotometri pada dasarnya terdiri dari sumber sinar, monokromator, sel untuk zat yang diperiksa, detektor, penguat arus dan alat ukur atau pencatat.
Spektrofotometri serapan merupakan metode pengukuran serapan radiasi elektromagnetik pada panjang gelombang tertentu yang diserap zat.
Spektrofotometri yang sering digunakan untuk mengukur serapan larutan atau zat yang diperiksa adalah spektrofotometri ultraviolet dengan panjang gelombang antara 200-400 nm dan visibel (cahaya tampak) dengan panjang gelombang antara 400-800 nm (Depkes RI, 1979; Gandjar dan Rohman, 2008).
16 BAB III
METODE PENELITIAN
Metode penelitian yang dilakukan adalah penelitian eksperimental.
Penelitian ini meliputi identifikasi bahan tumbuhan, pengumpulan bahan tumbuhan, pembuatan jus buah naga dan pengujian aktivitas antioksidan jus buah naga merah (Hylocereus polyrhizus (Haw.) Britton & Rose) dan buah naga putih (Hylocereus undatus (Haw.) Britton & Rose) dengan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazyl) secara spektrofotometri visible. Penelitian ini dilakukan di Laboratorium Penelitian Fakultas Farmasi, Universitas Sumatera Utara pada bulan September 2016 – November 2016.
3.1 Alat
Alat-alat yang digunakan pada penelitian ini terdiri dari alat-alat gelas laboratorium, aluminium foil, blender (Philips), neraca analitik (Boeco Germany), vortex, spektrofotometer UV-Visible (Shimadzu UV-1800), gunting, kertas saring, stopwatch, tissue dan pisau.
3.2 Bahan
Bahan yang digunakan pada penelitian ini adalah buah naga merah dan buah naga putih segar. Bahan-bahan kimia berkualitas pro analisis produksi Sigma: 1,1-diphenyl-2-picrylhydrazyl (DPPH); produksi E-Merck: metanol.
Bahan berkualitas teknis: Air suling.
17 3.3 Penyiapan Bahan Tumbuhan
Penyiapan bahan tumbuhan meliputi pengumpulan bahan tumbuhan, identifikasi tumbuhan, pembuatan jus buah naga merah dan jus buah naga putih.
3.3.1 Pengumpulan Bahan Tumbuhan
Metode pengumpulan bahan tumbuhan dilakukan secara purposif yaitu tanpa membandingkan dengan bahan tumbuhan yang sama dari daerah lain.
Bahan tumbuhan yang digunakan adalah buah naga segar merah (Hylocereus polyrhizus (Haw.) Britton & Rose) dan buah naga segar putih (Hylocereus undatus (Haw.) Britton & Rose) yang sudah matang, diperoleh dari Pasar Buah Berastagi, Jalan Jendral Gatot Subroto No. 288 Medan, Sumatera Utara.
3.3.2 Identifikasi Tumbuhan
Identifikasi buah naga merah (Hylocereus polyrhizus (Haw.) Britton &
Rose) dan buah naga putih (Hylocereus undatus (Haw.) Britton & Rose) dilakukan di Herbarium Medanense, Laboratorium Herbarium Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumtera Utara.
3.3.3 Pembuatan Jus Buah Naga Merah dan Jus Buah Naga Putih
Pembuatan jus buah naga merah dan jus buah naga putih dilakukan dengan menimbang buah naga 1,2 kg, dibersihkan dengan air mengalir lalu ditiriskan, dikeringkan menggunakan tisu, dipotong menjadi dua bagian, dipisahkan kulit dengan daging buahnya, dipotong kecil-kecil, lalu dihaluskan dengan blender, sampel yang telah dihaluskan dipisahkan dari biji-bijinya dengan cara disaring menggunakan kertas saring, sehingga diperoleh jus buah naga merah dan jus buah naga putih.
18
3.4 Uji Aktivitas Antioksidan Metode DPPH (1,1 Diphenyl-2-picrylhydrazyl) 3.4.1 Prinsip Metode DPPH (1,1 Diphenyl-2-picrylhydrazyl)
Kemampuan sampel uji dalam meredam proses oksidasi radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazyl) dalam larutan metanol (sehingga terjadi perubahan warna DPPH dari ungu menjadi kuning) dengan nilai IC50 (konsentrasi sampel uji yang mampu meredam radikal bebas 50%) sebagai parameter menentukan aktivitas antioksidan sampel (Molyneux, 2004).
3.4.2 Pembuatan Larutan DPPH 0,5 mM
Timbang 20 mg DPPH (1,1-diphenyl-2-picrylhydrazyl) kemudian di masukkan kedalam labu tentukur 100 ml, dilarutkan dengan metanol dan di cukupkan volumenya dengan metanol hingga garis tanda, maka diperoleh larutan DPPH 0,5 mM (konsentrasi 200 μg/ml). Larutan DPPH 0,5 mM dipipet sebanyak 5 ml, kemudian dimasukkan ke dalam labu tentukur 25 ml, lalu dicukupkan volumenya dengan metanol sampai garis tanda, maka diperoleh larutan blanko DPPH (konsentrasi 40 μg/ml).
3.4.3 Pengukuran Panjang Gelombang Serapan Maksimum DPPH
Larutan DPPH konsentrasi 40 μg/ml diukur serapannya pada panjang gelombang 400-800 nm yang merupakan panjang gelombang sinar tampak.
3.4.4 Pengukuran Waktu Kerja (Operating time)
Larutan DPPH konsentrasi 40 μg/ml dihomogenkan dan diukur absorbansi larutan pada panjang gelombang 516 nm selama 80 menit diamati waktu larutan tersebut mulai menghasilkan absorbansi yang stabil yang akan digunakan sebagai operating time.
19
3.4.5 Pembuatan Larutan Induk Jus Buah Naga Merah (JBNM) dan Jus Buah Naga Putih (JBNP)
Ditimbang sebanyak 25 mg jus buah naga merah dan jus buah naga putih, dimasukkan ke dalam labu tentukur 25 ml dilarutkan dengan air lalu volumenya dicukupkan dengan air sampai garis tanda (konsentrasi 1000 μg/ml).
3.4.6 Pembuatan Larutan Uji Jus Buah Naga Merah (JBNM) dan Jus Buah Naga Putih (JBNP)
Larutan induk dipipet sebanyak 1,25 ml; 2,5 ml; 3,75 ml; dan 5 ml kemudian dimasukkan masing-masing ke dalam labu tentukur 25 ml dicukupkan volumenya dengan metanol sampai garis tanda (untuk mendapatkan konsentrasi 50 μg/ml, 100 μg/ml, 150 μg/ml, dan 200 μg/ml), jus buah naga merah (JBNM) dan jus buah naga putih (JBNP) dengan berbagai konsentrasi masing-masing dipipet sebanyak 0,5 ml dimasukkan kedalam tabung reaksi dan ditambahkan 5 ml larutan DPPH (1,1-diphenyl-2-picrylhydrazyl) konsentrasi 40 μg/ml, dihomogenkan dengan vortex, sebagai kontrol digunakan larutan DPPH (1,1- diphenyl-2-picrylhydrazyl) tanpa penambahan larutan uji, didiamkan larutan ditempat gelap selama 60 menit lalu diukur serapannya dengan alat spektrofotometer UV-VIS pada panjang gelombang 516 nm.
3.4.7 Analisis Persen Pemerangkapan Radikal Bebas
Penentuan persen pemerangkapan radikal bebas dihitung dengan rumus sebagai berikut:
Aktivitas pemerangkapan radikal bebas (%) = x 100%
kontrol A
sampel A
- kontrol A
Keterangan: Akontrol = Absorbansi tidak mengandung sampel Asampel = Absorbansi sampel (Rosidah et al., 2008).
20 3.4.8 Analisis Nilai IC50
Perhitungan yang digunakan dalam penentuan aktivitas pemerangkapan radikal bebas adalah nilai IC50 (Inhibitory Concentration), nilai tersebut menggambarkan besarnya konsentrasi senyawa uji yang dapat memerangkap radikal bebas sebesar 50% (Molyneux, 2004).
Hasil perhitungan dimasukkan ke dalam persamaan regresi dengan konsentrasi sampel (μg/ml) sebagai absis (sumbu x) dan nilai % pemerangkapan (antioksidan) sebagai ordinatnya (sumbu y). Suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai IC50 < 50 μg/ml, kuat (50-100) μg/ml, sedang (100-150) μg/ml, dan lemah (151-200) μg/ml (Winarsi, 2014).
21
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi buah naga yang dilakukan di Herbarium Medanense, Laboratorium Herbarium Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumtera Utara, menunjukkan bahwa tumbuhan yang diteliti adalah Hylocereus polyrhizus (Haw.) Britton & Rose dan Hylocereus undatus (Haw.) Britton & Rose. Hasil pemeriksaan identifikasi tumbuhan tersebut dapat dilihat pada Lampiran 2 halaman 32-33.
4.2 Hasil Pengujian Aktivitas Antioksidan
4.2.1 Hasil Penentuan Panjang Gelombang Serapan Maksimum
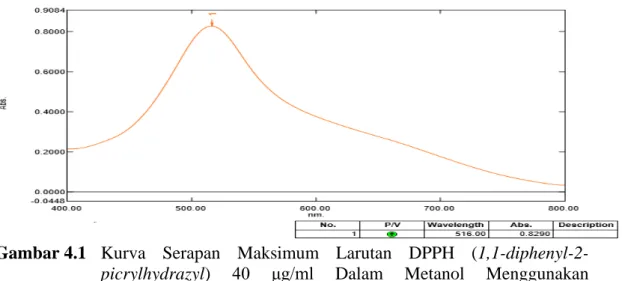
Pengukuran serapan maksimum larutan DPPH ( 1,1– diphenyl -2- picrylhydrazyl) 40 μg/ml dalam metanol dengan menggunakan spektrofotometer Visibel. Data hasil pengukuran panjang gelombang maksimum dapat dilihat pada Gambar 4.1 berikut ini:
Gambar 4.1 Kurva Serapan Maksimum Larutan DPPH (1,1-diphenyl-2- picrylhydrazyl) 40 μg/ml Dalam Metanol Menggunakan Spektrofotometer UV-Visible
22
Hasil pengukuran menunjukkan bahwa larutan DPPH (1,1-diphenyl-2- picrylhydrazyl) 40 μg/ml dalam metanol menghasilkan serapan maksimum pada panjang gelombang 516 nm. Panjang gelombang 516 nm, termasuk dalam kisaran panjang gelombang sinar tampak 400-800 nm, serta termasuk dalam rentang panjang gelombang DPPH (1,1-diphenyl-2-picrylhydrazyl) yang berkisar antara 515-520 nm (Gandjar dan Rohman, 2008; Molyneux, 2004).
4.2.2 Hasil Analisis Waktu Pengukuran (operating time)
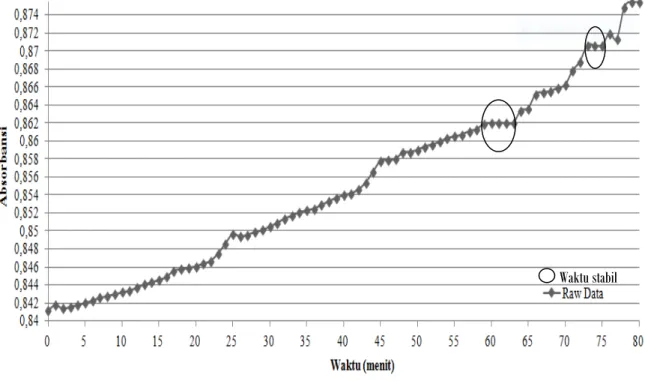
Waktu stabil
Gambar 4.2 Hasil Grafik Analisis Waktu Pengukuran (operating time).
Waktu kerja bertujuan untuk mengetahui waktu pengukuran yang stabil.
Ditentukan dengan mengukur hubungan antara waktu pengukuran dengan absorbansi larutan (Gandjar dan Rohman, 2007). Hasil analisis pengukuran waktu kerja (operating time) dengan menggunakan larutan DPPH 0,5 mM dalam metanol dengan konsentrasi 40 μg/ml diukur selama 80 menit, sudah menunjukkan kestabilan pada menit ke 60 sampai dengan menit ke 63. Lama pengukuran metode DPPH (1,1-diphenyl-2-picrylhydrazyl) menurut beberapa
23
literatur yang direkomendasikan adalah selama 60 menit, tetapi dalam beberapa penelitian waktu yang digunakan sangat bervariasi dari 1 menit hingga 240 menit (Marinova dan Batchvarov, 2011). Hasil analisis waktu pengukuran (operating time) dapat dilihat pada Lampiran 5 halaman 36-37.
4.2.3 Hasil Analisis Aktivitas Antioksidan Jus Buah Naga Merah (JBNM) dan jus Buah Naga Putih (JBNP)
Pada hasil analisis aktivitas antioksidan masing-masing konsentrasi larutan uji jus buah naga merah dan jus buah naga putih terlihat adanya penurunan nilai absorbansi DPPH (1,1-diphenyl-2-picrylhydrazyl) sebanding dengan peningkatan konsentrasi masing-masing jus buah naga merah dan jus buah naga putih.
Penurunan absorbansi DPPH (1,1-diphenyl-2-picrylhydrazyl) dan persen pemerangkapan dengan penambahan masing-masing jus buah naga merah dan jus buah naga putih dapat dilihat pada Tabel 4.1 berikut:
Tabel 4.1 Penurunan absorbansi dan persen pemerangkapan DPPH oleh masing masing jus buah naga merah (JBNM) dan jus buah naga putih (JBNP).
Penurunan nilai absorbansi menunjukkan peningkatan aktivitas antioksidan. Penurunan nilai absorbansi terjadi karena jus buah naga merah dan
24
jus buah naga putih mampu menetralisir DPPH (1,1-diphenyl-2-picrylhydrazyl) dengan memberikan elektron kepada DPPH (1,1-diphenyl-2-picrylhydrazyl) sehingga atom dengan elektron yang tidak berpasangan mendapat pasangan elektron dan tidak lagi menjadi radikal (Silalahi, 2006).
Penangkap radikal bebas menyebabkan elektron menjadi berpasangan yang kemudian menyebabkan penghilangan warna yang sebanding dengan jumlah elektron yang diambil. Setelah bereaksi dengan senyawa antioksidan DPPH (1,1- diphenyl-2-picrylhydrazyl) tersebut akan tereduksi dan warnanya akan berubah.
Perubahan tersebut dapat diukur dengan spektrofotometer dan diplotkan terhadap konsentrasi penurunan intensitas warna yang terjadi disebabkan oleh berkurangnya ikatan rangkap yang terkonjugasi pada DPPH (1,1-diphenyl-2- picrylhydrazyl). Hal ini dapat terjadi apabila adanya penangkapan satu elektron oleh zat antioksidan, menyebabkan tidak adanya kesempatan elektron tersebut untuk beresonansi. Peredaman warna DPPH (1,1-diphenyl-2-picrylhydrazyl) terjadi disebabkan oleh adanya senyawa yang bisa memberikan radikal hidrogen kepada radikal DPPH (1,1-diphenyl-2-picrylhydrazyl) sehingga direduksi menjadi DPPH-H (1,1-diphenyl-2-picrylhydrazin) (Sayuti dan Yenrina, 2015).
Pada metode ini absorbansi yang diukur adalah absorbansi larutan DPPH (1,1-diphenyl-2-picrylhydrazyl) yang tidak bereaksi dengan senyawa antioksidan, secara teoritis panjang gelombang maksimum untuk larutan DPPH (1,1-diphenyl- 2-picrylhydrazyl) dalam metanol adalah 515-517 nm. Untuk membuktikan bahwa absorbansi yang terukur adalah sisa DPPH (1,1-diphenyl-2-picrylhydrazyl) maka dilakukan pengukuran panjang gelombang maksimum larutan sampel tanpa DPPH (1,1-diphenyl-2-picrylhydrazyl) sehingga disimpulkan bahwa absorbansi yang
25
terukur adalah sisa DPPH (1,1-diphenyl-2-picrylhydrazyl) yang tidak ditangkap oleh senyawa uji (Salamah dan Widyasari, 2015).
Contoh perhitungan persen pemerangkapan dan nilai IC50 dapat dilihat pada Lampiran 7 halaman 39-52. Hubungan antara konsentrasi dengan persen pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazyl) oleh masing- masing jus buah naga merah dan jus buah naga putih dapat dilihat pada gambar berikut ini:
Gambar 4.3 Grafik Hasil Uji Aktivitas Antioksidan JBNM
Gambar 4.4 Grafik Hasil Uji Aktivitas Antioksidan JBNP
26
Hasil analisis persamaan regresi linier dan hasil analisis nilai IC50 (μg/ml) yang diperoleh dari larutan uji JBNM dan JBNP dapat dilihat pada Tabel 4.2 dibawah ini:
Tabel 4.2 Hasil persamaan regresi linier dan hasil analisis IC50 (μg/ml) yang diperoleh dari jus buah naga merah (JBNM) dan jus buah naga putih (JBNP)
Hasil perbandingan analisis IC50 (μg/ml) pada larutan uji JBNM dan JBNP dapat dilihat pada Gambar 4.5 dibawah ini:
Gambar 4.5 Grafik Hasil Analisis IC50 (μg/ml)
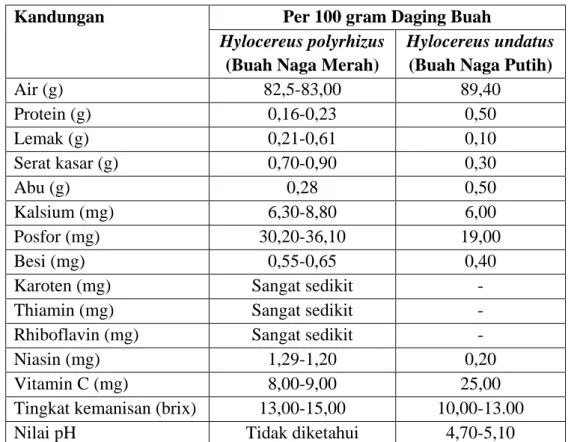
Dari Tabel 4.2 menunjukkan aktivitas antioksidan larutan uji jus buah naga merah (JBNM) memiliki IC50 sebesar 128,3764 μg/ml dan termasuk dalam kategori sedang sedangkan jus buah naga putih (JBNP) memiliki IC50 sebesar 94,7983 μg/ml dan termasuk dalam kategori kuat. Aktivitas antioksidan diperoleh berbeda karena kandungan gizi pada masing-masing buah naga yaitu vitamin C.
27
Perbedaannya dapat dilihat pada Tabel 4.3 dibawah ini:
Tabel 4.3 Kandungan Gizi Buah Naga
Kandungan Per 100 gram Daging Buah
Hylocereus polyrhizus (Buah Naga Merah)
Hylocereus undatus (Buah Naga Putih)
Air (g) 82,5-83,00 89,40
Protein (g) 0,16-0,23 0,50
Lemak (g) 0,21-0,61 0,10
Serat kasar (g) 0,70-0,90 0,30
Abu (g) 0,28 0,50
Kalsium (mg) 6,30-8,80 6,00
Posfor (mg) 30,20-36,10 19,00
Besi (mg) 0,55-0,65 0,40
Karoten (mg) Sangat sedikit -
Thiamin (mg) Sangat sedikit -
Rhiboflavin (mg) Sangat sedikit -
Niasin (mg) 1,29-1,20 0,20
Vitamin C (mg) 8,00-9,00 25,00
Tingkat kemanisan (brix) 13,00-15,00 10,00-13.00
Nilai pH Tidak diketahui 4,70-5,10
Sumber: Warisno dan Dahana, 2010.
Penelitian lain yang dilakukan oleh Umayah dan Amrun (2007), yaitu uji aktivitas antioksidan buah naga putih ekstrak metanol diperoleh IC50 sebesar 2,98
% dan pada ekstrak air 1,80 %, sedangkan pada penelitian yang dilakukan Nur Khaidah Siregar (2012), yaitu uji aktivitas antioksidan ekstrak etanol buah naga putih diperoleh IC50 sebesar 975,501 μg/ml dan sari buah naga putih sebesar 4751,427 μg/ml.
Tabel 4.4 Kategori nilai IC50 sebagai antioksidan
No. Kategori Konsentrasi (μg/ml)
1. Sangat kuat ≤50
2. Kuat 50 – 100
3. Sedang 101 – 150
4. Lemah 151 – 200
Sumber: Winarsi, 2014.
28 BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan:
a. Jus buah naga merah dan jus buah naga putih memiliki aktivitas antioksidan.
b. Kategori aktivitas antioksidan jus buah naga merah termasuk kategori yang sedang dengan IC50 sebesar 128,3764 μg/ml dan jus buah naga putih termasuk kategori kuat dengan IC50 sebesar 94,7983 μg/ml
5.2 Saran
a. Disarankan kepada masyarakat untuk mengkonsumsi jus buah naga sebagai minuman sumber antioksidan.
b. Disarankan kepada peneliti selanjutnya untuk melakukan pengujian aktivitas antioksidan dari buah lain dan metode selain metode pemerangkapan DPPH (1,1-diphenyl-2-picrylhydrazyl).
29
DAFTAR PUSTAKA
Anonim. (2009). Buah Naga. http://buahnaga.us/. Tanggal Akses: 20 Desember 2010.
Cahyono, B. (2009). Sukses Bertanam Buah Naga. Jakarta: Pustaka Mina.
Halaman 14-16, 22-32, 35-45.
Depkes RI. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan RI. Halaman 33.
Gandjar, I. G., dan Rohman, A. (2008). Kimia Farmasi Analisis. Cetakan Ketiga.
Yogyakarta: Pustaka Pelajar. Halaman 222, 254-255.
Gunasena, H.P.M., dan Pushpakumara, D.K.N.G. (2006). Dragon Fruit (Hylocereus undatus Haw. Britton and Rose). Halaman 118. Diakses:
http://www.worldagroforestry.org.
Ionita, P. (2005). Is DPPH Stable Free Radical a Good Scavenger for Oxygen Active Species?. Bucharest. Chemical Paper. 59(1): 11-16.
Kristanto, D. (2003). Buah Naga Pembudidayaan di Pot dan di Kebun. Cetakan Pertama. Jakarta: Penebar Swadaya. Halaman 10-15.
Marinova, G. dan V. Batchvarov. (2011). Evaluation of the Methods for Determination of the Free Radical Scavenging Activity by DPPH.
Bulgarian Journal of Agricultural Science. 17(1): 11-24.
Molyneux, P. (2004). The Use of the Stabl e Free Radical Diphenylpicrylhydrazyl (DPPH) for Estimating Antioxidant Activity. Songklanakarin J. Sci.
Technol. 26(2): 211-219.
Prakash, A. (2001). Antioxidant Activity. Analytical Progress. 19(2): 1-4.
Pranata, R., Wahdaningsih, S., dan Fahrurroji, A. (2016). Uji Aktivitas Antioksidan Fraksi kloroform Kulit Buah Naga Merah (Hylocereus lemairei Britton and Rose) Menggunakan Metode DPPH (1,1-diphenyl-2- picrylhydrazyl). Program Studi Farmasi Fakultas Kedokteran, Universitas Tanjungpura. Halaman 1-10.
Rosidah, Yam, M. F., Sadikun, A., dan Asmawi, M. Z. (2008). Antioxidant Potential of Gynura procumbens. Pharmaceutical Biology. 46(9): 616-625.
Salamah, N., dan Widyasari, E. (2015). Aktivitas Antioksidan Ekstrak Metanol Daun Kelengkeng (Euphoria longan (L) Steud.) Dengan Metode Penangkapan Radikal 2,2’-difenil-1-pikrilhidrazil. Fakultas Farmasi
30
Universitas Ahmad Dahlan, Yogyakarta. Pharmaciana, vol 5, No. 1, 2015:
25-34.
Sayuti, K., dan Yenrina, R. (2015). Antioksidan Alami dan Sintetik. Padang:
Andalas University Press. Halaman 38-47; 61-65; 76.
Silalahi, J. (2006). Makanan Fungsional. Yogyakarta: Kanisius. Halaman 41, 47- 48, 121.
Siregar, K. N. (2012) Karakterisasi Simplisia dan Skrining Fitokimia Serta Uji Aktivitas Antioksidan Ekstrak Etanol Buah Naga (Hylocereus undatus (Haw.) Britton & Rose). Skripsi. Medan: Fakultas Farmasi Universitas Sumatera Utara.
Triyati, E. (1985). Spektrofotometri Ultraviolet dan Sinar Tampak serta Aplikasinya dalam Oseanologi. Jurnal Oseana. 10(1): 1877.
Umayah, U. E., dan Amrun, H. M. (2007). Uji Aktivitas Antioksidan Ekstrak Buah Naga (Hylocereus Undatus (Haw.) Britt. & Rose) Staf Pengajar Program Studi Farmasi Universitas Jember. Jurnal Ilmu Dasar Vol. 8 No. 1.
Halaman 83-90.
Warisno, dan Dahana, K. (2010). Buku Pintar Bertanam Buah Naga Di Kebun, Pekarangan dan Dalam Pot. Jakarta: Gramedia Pustaka Utama. Halaman 3.
Winarsi, H. (2007). Antioksidan Alami dan Radikal Bebas. Yogyakarta: Kanisius.
Halaman 12, 17.
Winarsi, H. (2014). Antioksidan Daun Kapulaga. Yogyakarta: Graha Ilmu.
Halaman 38, 42-43.
31
Ditimbang 25 mg
Dimasukkan kedalam labu 25 ml
Dicukupkan volumenya dengan air sampai garis tanda
Dipipet sebanyak 1,25 ml, 2,5 ml, 3,75 ml, 5 ml
Dimasukkan masing-masing ke dalam labu tentukur 25 ml
Dicukupkan volumenya dengan metanol sampai garis tanda
Diperoleh konsentrasi 50 µg/ml, 100 µg/ml, 150 µg/ml, 200 µg/ml
Dipipet masing-masing konsentrasi sebanyak 0,5 ml
Dimasukkan kedalam tabung reaksi Ditambahkan 5 ml larutan DPPH 0,5 mM konsentrasi 40 µg/ml
Dihomogenkan dengan vortex
Digunakan larutan DPPH tanpa penambahan larutan uji sebagai kontrol Didiamkan selama 60 menit
Diukur menggunakan alat spektrofotometer UV-Visible dengan panjang gelombang 516 nm
Ditimbang ± 1,2 kg
Dibersihkan dengan air mengalir lalu ditiriskan
Dikeringan menggunakan tisu Dibagi menjadi dua bagian
Dipisahkan kulit dari daging buahnya Dipotong kecil-kecil
Dihaluskan dengan blender Lampiran 1. Bagan Kerja
Disaring
Buah Naga Segar
Filtrat Sampel yang telah dihaluskan
Larutan induk jus buah naga konsentrasi 1000 µg/ml
Hasil Residu
32 Lampiran 2. Hasil Identifikasi Tumbuhan
1. Buah Naga Merah (Hylocereus polyrhizus (Haw.) Britton & Rose)
33
2. Buah Naga Putih (Hylocereus undatus (Haw.) Britton & Rose)
34 Lampiran 3. Gambar Sampel Buah Naga
Gambar 1. Buah Naga Merah
Gambar 2. Buah Naga Putih
35
Lampiran 4. Gambar Seperangkat Alat Spektrofotometer UV-Visibel (UV 1800 - Shimadzu)
Gambar 3. Gambar seperangkat alat spektrofotometer UV - Visibel (UV 1800 - Shimadzu).
36 Lampiran 5. Hasil Pengukuran Operating Time
Time (Minute)
Raw Data..
0.0000 0.8412 1.0000 0.8418 2.0000 0.8414 3.0000 0.8416 4.0000 0.8418 5.0000 0.8420 6.0000 0.8423 7.0000 0.8426 8.0000 0.8428 9.0000 0.8430 10.0000 0.8432 11.0000 0.8434 12.0000 0.8437 13.0000 0.8441 14.0000 0.8443 15.0000 0.8446 16.0000 0.8449 17.0000 0.8456 18.0000 0.8458 19.0000 0.8459 20.0000 0.8461 21.0000 0.8464 22.0000 0.8467 23.0000 0.8475 24.0000 0.8486 25.0000 0.8497 26.0000 0.8494 27.0000 0.8496 28.0000 0.8499 29.0000 0.8501 30.0000 0.8505 31.0000 0.8509 32.0000 0.8514 33.0000 0.8517 34.0000 0.8521 35.0000 0.8523 36.0000 0.8525 37.0000 0.8529 38.0000 0.8533 39.0000 0.8537 40.0000 0.8540 41.0000 0.8542 42.0000 0.8546
37 43.0000 0.8554
44.0000 0.8566 45.0000 0.8578 46.0000 0.8579 47.0000 0.8580 48.0000 0.8587 49.0000 0.8588 50.0000 0.8590 51.0000 0.8594 52.0000 0.8596 53.0000 0.8599 54.0000 0.8603 55.0000 0.8605 56.0000 0.8607 57.0000 0.8611 58.0000 0.8613 59.0000 0.8619 60.0000 0.8620 61.0000 0.8620 62.0000 0.8620 63.0000 0.8620 64.0000 0.8634 65.0000 0.8636 66.0000 0.8652 67.0000 0.8654 68.0000 0.8655 69.0000 0.8659 70.0000 0.8662 71.0000 0.8678 72.0000 0.8688 73.0000 0.8706 74.0000 0.8706 75.0000 0.8706 76.0000 0.8719 77.0000 0.8743 78.0000 0.8748 79.0000 0.8755 80.0000 0.8754
38 Lampiran 6. Hasil Uji Aktivitas Antioksidan.
39
Lampiran 7. Contoh Perhitungan Persen Pemerangkapan dan Perhitungan Nilai IC50
7.1 Perhitungan persen pemerangkapan JBNM
• Tabel data absorbansi DPPH pengukuran 1
No. Konsentrasi Larutan Uji (μg/ml) Absorbansi
1 0 0,84691
2 50 0,56689
3 100 0,46085
4 150 0,36689
5 200 0,26085
Keterangan : Akontrol = Absorbansi tidak mengandung sampel Asampel = Absorbansi sampel
1. Konsentrasi 50 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,84691 0,56689 -
0,84691
= 33,0637
2. Konsentrasi 100 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,84691 0,46085 -
0,84691
= 45,5845
3. Konsentrasi 150 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,84691 0,36689 -
0,84691
= 56,6789
4. Konsentrasi 200 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,84691 0,26085 -
0,84691
= 69,1997
Aktivitas pemerangkapan (%) = x 100%
kontrol A
sampel A - kontrol A
40
• Tabel data absorbansi DPPH pengukuran 2
No. Konsentrasi Larutan Uji (µg/ml) Absorbansi
1 0 0,84422
2 50 0,58060
3 100 0,49429
4 150 0,38060
5 200 0,29429
Keterangan : Akontrol = Absorbansi tidak mengandung sampel Asampel = Absorbansi sampel
1. Konsentrasi 50 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,84422 0,58060 -
0,84422
= 31,2264
2. Konsentrasi 100 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,84422 0,49429 -
0,84422
= 41,4500
3. Konsentrasi 150 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,84422 0,38060 -
0,84422
= 54,9169
4. Konsentrasi 200 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,84422 0,29429 -
0,84422
= 65,1406
Aktivitas pemerangkapan (%) = x 100%
kontrol A
sampel A - kontrol A
41
• Tabel data absorbansi DPPH pengukuran 3
No. Konsentrasi Larutan Uji (μg/ml) Absorbansi
1 0 0,84135
2 50 0,56967
3 100 0,41460
4 150 0,36967
5 200 0,26460
Keterangan : Akontrol = Absorbansi tidak mengandung sampel Asampel = Absorbansi sampel
1. Konsentrasi 50 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,84135 0,56967 -
0,84135
= 32,2909
2. Konsentrasi 100 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,84135 0,41460 -
0,84135
= 50,7220
3. Konsentrasi 150 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,84135 0,36967 -
0,84135
= 56,0622
4. Konsentrasi 200 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,84135 0,26460 -
0,84135
= 68,5505
Aktivitas pemerangkapan (%) = x 100%
kontrol A
sampel A - kontrol A
42
• Tabel data absorbansi DPPH pengukuran 4
No. Konsentrasi Larutan Uji (μg/ml) Absorbansi
1 0 0,83026
2 50 0,55730
3 100 0,45570
4 150 0,35730
5 200 0,25570
Keterangan : Akontrol = Absorbansi tidak mengandung sampel Asampel = Absorbansi sampel
1. Konsentrasi 50 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,83026 0,55730 -
0,83026
= 32,8764
2. Konsentrasi 100 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,83026 0,45570 -
0,83026
= 45,1135
3. Konsentrasi 150 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,83026 0,35730 -
0,83026
= 56,9652
4. Konsentrasi 200 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,83026 0,25570 -
0,83026
= 69,2024
Aktivitas pemerangkapan (%) = x 100%
kontrol A
sampel A - kontrol A
43
• Tabel data absorbansi DPPH pengukuran 5
No. Konsentrasi Larutan Uji (μg/ml) Absorbansi
1 0 0,82977
2 50 0,54420
3 100 0,45474
4 150 0,34420
5 200 0,25474
Keterangan : Akontrol = Absorbansi tidak mengandung sampel Asampel = Absorbansi sampel
1 Konsentrasi 50 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,82977 0,54420 -
0,82977
= 34,4155
2. Konsentrasi 100 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,82977 0,45474 -
0,82977
= 45,1968
3. Konsentrasi 150 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,82977 0,34420 -
0,82977
= 58,5186
4. Konsentrasi 200 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,82977 0,25474 -
0,82977
= 69,2999
Aktivitas pemerangkapan (%) = x 100%
kontrol A
sampel A - kontrol A
44
• Tabel data absorbansi DPPH pengukuran 6
No. Konsentrasi Larutan Uji (μg/ml) Absorbansi
1 0 0,82687
2 50 0,53535
3 100 0,44565
4 150 0,33535
5 200 0,25535
Keterangan : Akontrol = Absorbansi tidak mengandung sampel Asampel = Absorbansi sampel
1. Konsentrasi 50 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,82687 0,53535 -
0,82687
= 35,2558
2. Konsentrasi 100 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,82687 0,44565 -
0,82687
= 46,1035
3. Konsentrasi 150 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,82687 0,33535 -
0,82687
= 59,4434
4. Konsentrasi 200 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,82687 0,25535 -
0,82687
= 69,1184
Aktivitas pemerangkapan (%) = x 100%
kontrol A
sampel A - kontrol A
45 Perhitungan nilai IC50
Tabel IC50 dari JBNM
X Y XY X2
0 0 0 0
50 33,1881 1659,405 2500
100 45,6950 4569,5 10000
150 57,0975 8564,625 22500
200 68,4185 13683,7 40000
ΣX = 500 X = 100
ΣY = 204,3991
Y = 40,8798
ΣXY = 28477,23 ΣX2 = 75000
Keterangan: X = Konsentrasi (μg/ml) Y = % Pemerangkapan
a =
n / X) ( ) X (
n / Y) X)(
( - XY) (
2
2 − ∑
∑
∑
∑
∑
= 0,3214
25000 8037,32 5
/ ) 500 ( ) 75000 (
5 / ) 204,3991 )(
500 ( ) 28477,23 (
2 = =
−
−
b = Y−aX
= 40,8798– (0,3214)(100) = 8,7398
Jadi, persamaan garis regresi Y = 0,3214x +8,7398 Nilai IC50 = Y = 0,3214x +8,7398
50 = 0,3214x +8,7398 X = 128,3764
IC50 = 128,3764 µg/ml
46 7.2 Perhitungan persen pemerangkapan JBNP
• Tabel data absorbansi DPPH pengukuran 1
No. Konsentrasi Larutan Uji (μg/ml) Absorbansi
1 0 0,80736
2 50 0,49730
3 100 0,39795
4 150 0,29460
5 200 0,19460
Keterangan : Akontrol = Absorbansi tidak mengandung sampel Asampel = Absorbansi sampel
1. Konsentrasi 50 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,80736 0,49730 -
0,80736
= 38,4041
2. Konsentrasi 100 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,80736 0,39795 -
0,80736
= 50,7097
3. Konsentrasi 150 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,80736 0,29460 -
0,80736
= 63,5107
4. Konsentrasi 200 µg/ml
Aktivitas pemerangkapan (%) = x 100%
0,80736 0,19460 -
0,80736
= 75,8967
Aktivitas pemerangkapan (%) = x 100%
kontrol A
sampel A - kontrol A