1 BAB I
PRAKTIKUM REAKSI PENGENALAN KATION GOLONGAN II
I. TUJUAN
a. Mahasiswa mengenal reaksi-reaksi identifikasi kation-kation golongan II zat anorganik.
b. Mahasiswa dapat menjelaskan perubahan-perubahan yang terjadi dalam setiap identifikasi kation golongan II.
c. Mahasiswa dapat menuliskan persamaan-persamaan reaksi yang terjadi. II. DASAR TEORI
Reagensia golongan : Hidrogen Sulfida ( H2S) (gas atau larutan air
jenuh)
Reaksi golongan : endapan-endapan dengan berbagai warna : merkurium (II)sulfida, HgS (hitam) ; timbel (II) sulfida, PbS (hitam) ; tembaga (II) sulfida , CuS (hitam); kadmiun sulfida, CdS (Kuning) ; bismuth (III) sulfida, Bi2S3 (coklat); arsenik (III) sulfida, As2S3 (kuning);
arsenik (V) sulfida (kuning) ; stibium (III) sulfida, Sb2S3 (jingga) ; stibium
(V) sulfida, Sb2S5 (jingga); timah (II) sulfida, SnS( coklat ) ; dan timah
(IV) sulfida , SnS2 (kuning).
Kation-kation golongan II menurut tradisi dibagi dua sub-golongan: sub-golongan tembaga dan sub-golongan arsenik. Dasar pembagian ini adalah kelarutan endapan sulfida dalam ammonium polisulfida. Sementara sulfida dari sub-golongan tembaga tak larut dalam reagensia ini, sulfida dari sub-grup arsenik melarut dengan membentuk garam tio.
Sub-golongan tembaga terdiri dari merkurim(II), timbel(II), bismut(III), tembaga(II) dan kadmium(II). Meskipun sebagian besar ion timbel(II)diendapkan dengan asam klorida encer bersama ion-ion lain dari golongan I, pengendapan ini kurang sempurna, disebabkan oleh kelarutan timbel(II)klorida yang relatif tinggi. Maka dalam pengejaan analisis
2 sistematik, ion-ion timbel masih akan tetap ada. Reaksi-reaksi ion timbel(II) sudah diuraikan bersama dengan reaksi-reaksi kation golongan pertama.
Klorida, nitrat, dan sulfat dari kation-kation sub-golongan tembaga, sangat mudah larut dalam air. Sulfida, hidroksida, dan karbonatnya tak larut. Beberapa kation dari sub-golongan tembaga (merkurium (II), tembaga(II) dan kadmium (II)) cendenrung membentuk kompleks (amonia, ion sianida dan seterusnya).
Sub-golongan arsenik terdiri dari ion arsenik(III) & (V), stibium (III) & (V), timah (II) & (IV). Ion-ion ini memiliki sifat amfoter : oksidanya membentuk garam baik dengan asam maupun basa. Jadi, arsenik(III) oksida dapat dilarutkan dalam asam klorida dapat dilarutkan dalam asam klorida dan terbentuk kation arsenik(III).
As2O3 + 6HCl → 2As3+ + 6Cl- + 3H2O
Disamping ini, arsenik(III) larut pula dalam natrium hidroksida, yang mana terbentuk ion arsenat.
As2O3 + 6OH- → 2As2O33- + 3H2O
Melarutnya sulfida dalam omonium polisulfida dapat dianggap sebagai pembentukan garam tio dari asam tio anhidrat. Jadi, melarutnya sulfida ( asam tio anhidrat mengakibatkan terbentuknya ion-ion amonium dan tioarsenit(amonium tioarsenit : suatu garam tio )
As2S3 + 3S2- → 2AsS33-
semua sulfida dari golongan arsenik larut dalam ammonium sulfida ( tak berwarna), kecuali timah(II) sulfida : untuk melarutkan yang terakhir ini, diperlukan ammonium polisulfida, yang bertindak sebagian sebagai zat pengoksid, sehingga terbentuk ion tiostanat
SnS + S22- → SnS32-
Perhatikan, bahwa sementara timah adalah bivalen dalam endapan timah (II) sulfida, ia adalah tetravalen dalam ion tiostanat.
Ion-ion arsenik(III), stibium(III) dan timah (II), dapat dioksidasikan menjadi ion arsenik(V), stibium(V) dan timah (IV). Di lain
3 pihak, ion yang trakhir ini dapat direduksi oleh zat-zat pereduksi yang sesuai. Besarnya potensial oksidasi-reduksi dari sistem arsenik (V) & (III), dan stibium(V) & (III), bergatung pH maka oksidasi atau reduksi ion yang bersangkutan dpat dibantu dengan memilih pH yang sesuai untuk reaksi tersebut.
III. PROSEDUR KERJA 1) Alat
1. Tabung reaksi
Gambar I.1 Tabung Reaksi 2. Rak tabung reaksi
Gambar I.2 Rak tabung reaksi 3. Pipet tetes
Gambar I.3 Pipet tetes 4. Corong
4 Gambar I.4 Corong
5. Spatula
Gambar I.5 Spatula 6. Kertas saring
Gambar I.6 Kertas saring 7. Kaca arloji
Gambar I.7 Kaca arloji 8. Botol reagen
Gambar I.8 Botol reagen 9. Penanga spiritus
5 10. Botol Aquades
Gambar I.10 Botol Aquades
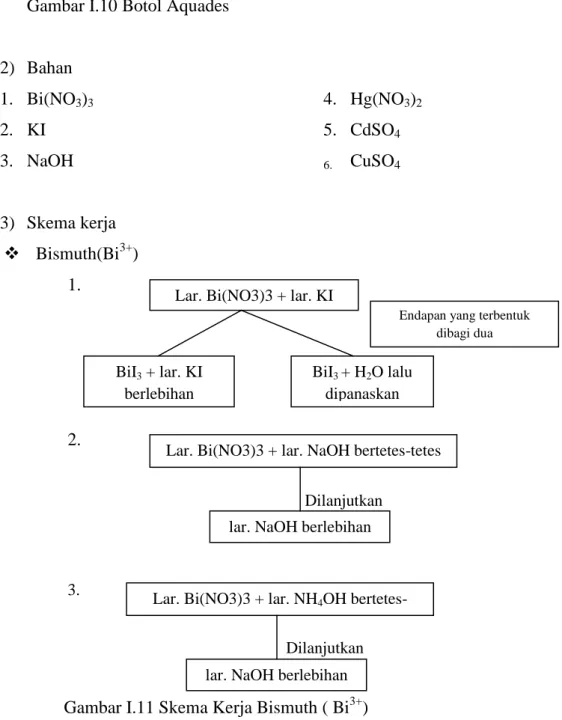
2) Bahan 1. Bi(NO3)3 2. KI 3. NaOH 4. Hg(NO3)2 5. CdSO4 6. CuSO4 3) Skema kerja Bismuth(Bi3+ ) 1. 2. Dilanjutkan 3. Dilanjutkan
Gambar I.11 Skema Kerja Bismuth ( Bi3+) Lar. Bi(NO3)3 + lar. KI
BiI3 + lar. KI berlebihan
BiI3 + H2O lalu dipanaskan
Endapan yang terbentuk dibagi dua
Lar. Bi(NO3)3 + lar. NaOH bertetes-tetes
lar. NaOH berlebihan
Lar. Bi(NO3)3 + lar. NH4OH bertetes-tetes
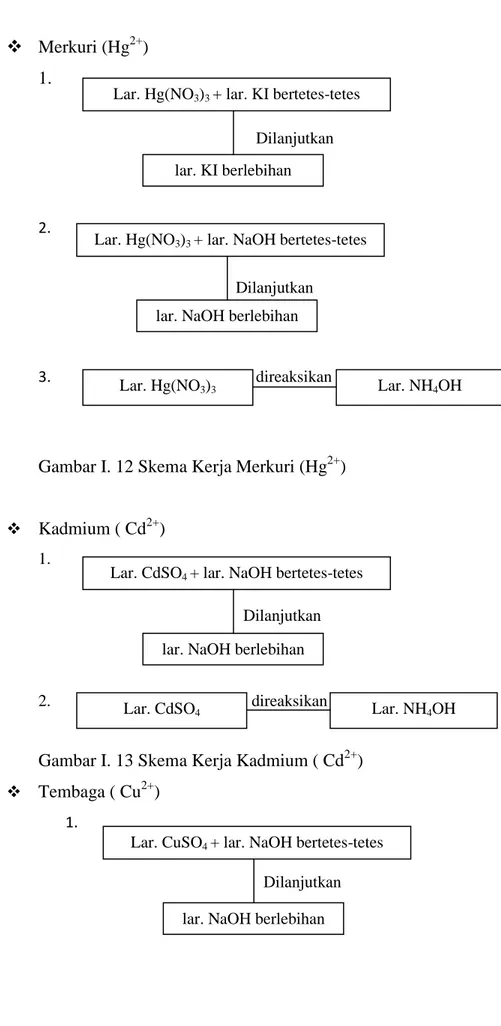
6 Merkuri (Hg2+ ) 1. Dilanjutkan 2. Dilanjutkan 3. direaksikan
Gambar I. 12 Skema KerjaMerkuri (Hg2+)
Kadmium ( Cd2+) 1.
Dilanjutkan
2. direaksikan
Gambar I. 13 Skema Kerja Kadmium ( Cd2+) Tembaga ( Cu2+)
1.
Dilanjutkan
Lar. Hg(NO3)3 + lar. KI bertetes-tetes
lar. KI berlebihan
Lar. Hg(NO3)3 + lar. NaOH bertetes-tetes
lar. NaOH berlebihan
Lar. Hg(NO3)3 Lar. NH4OH
Lar. CdSO4 + lar. NaOH bertetes-tetes
lar. NaOH berlebihan
Lar. CdSO4 Lar. NH4OH
Lar. CuSO4 + lar. NaOH bertetes-tetes
7 2.
Dilanjutkan
3. direaksikan
Gambar I. 14 Skema Kerja Tembaga ( Cu2+)
IV. HASIL DAN PEMBAHASAN a. Hasil Percobaan
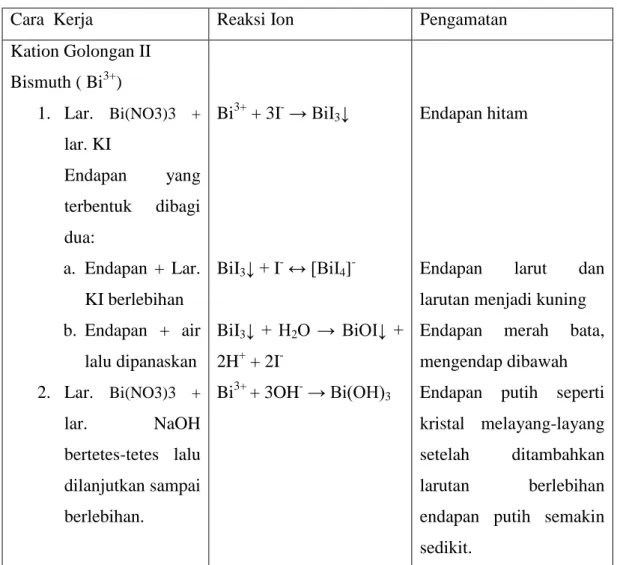
Tabel I.1 Cara Kerja Kation Golongan II
Cara Kerja Reaksi Ion Pengamatan
Kation Golongan II Bismuth ( Bi3+) 1. Lar. Bi(NO3)3 + lar. KI Endapan yang terbentuk dibagi dua: a. Endapan + Lar. KI berlebihan b. Endapan + air lalu dipanaskan 2. Lar. Bi(NO3)3 + lar. NaOH bertetes-tetes lalu dilanjutkan sampai berlebihan. Bi3+ + 3I- → BiI3↓ BiI3↓ + I- ↔ [BiI4] -BiI3↓ + H2O → BiOI↓ + 2H+ + 2I -Bi3+ + 3OH- → Bi(OH)3 Endapan hitam
Endapan larut dan larutan menjadi kuning Endapan merah bata, mengendap dibawah Endapan putih seperti kristal melayang-layang setelah ditambahkan larutan berlebihan endapan putih semakin sedikit.
Lar. CuSO4 + lar. NH4OH bertetes-tetes
lar. NH4OH berlebihan
8 3. Lar. Bi(NO3)3 + Lar. NH3 bertetes-tetes lalu dialanjutkan sampai berlebihan. Bi3+ + 2NH3 + NO3- 2H2O→ Bi(OH)2NO3↓ + 2NH4+
Endapan putih seperti kristal-kristal Merkuri (Hg2+) 1. Lar. Hg(NO3)3 + lar. KI bertetes-tetes lalu dilanjutkan sampai berlebihan. 2. Lar. Hg(NO3)3 + lar. NaOH bertetes-tetes lalu dilanjutkan sampai berlebihan. 3. Lar. Hg(NO3)3 + lar. NH3 Hg2+ + 2I- → HgI2↓ HgI2↓+ 2I- → [ HgI4] 2-Hg2+ 2OH- → HgO↓ + H2O 2Hg2+ +4 NH3+ NO3- + H2O →HgO.Hg(NH)2NO3↓ + 3NH4+ Endapan merah
Endapan terpisah dengan larutan , endapan mngendap dibawah
Endapan coklat,
Endapan coklat semakin pekat
Endapan putih
Kadmium ( Cd2+)
1.
Lar. CdSO4 + lar.NaOH
bertetes-tetes lalu
dilanjutkan sampai berlebihan.
2.
Lar. CdSO4 + lar.NH4OH bertetes-tetes
Cd2+ 2OH- → Cd(OH)2↓
Cd2+ + 2NH3 + 2H2O ↔
Cd(OH)2 + 2NH4+
Endapan putih melayang-layang dan menyebar dilarutan,
Endapan memisah dan mengendap dibawah Endapan putih
9 Tembaga ( Cu2+) 1. Lar. Cu SO4 + lar. NaOH bertetes-tetes lalu dilanjutkan sampai berlebihan 2. Lar. Cu SO4 + lar. NH3 bertetes-tetes lalu dilanjutkan sampai berlebihan 3. Lar. Cu SO4 + lar. KI Cu2+ + 2OH- → Cu(OH)2↓ 2Cu2+ +SO42- + 2NH3 + 2H2O→ Cu(OH)2CuSO4↓ + 2NH4+ 2 Cu2+ + 5I- → 2CuI + I 3-Endapan biru + hijau,larutan memisah dengan endapan
Endapan biru muda, larutan biru
Endapan semakin banyak
Endapan putih, larutan coklat
b. Pembahasan 1) Bismuth ( Bi3+)
1. Bi3+ + 3I- → BiI3↓
Reaksi dengan larutan KI akan menghasilkan endapan hitam (BiI3↓). Jika endapan (BiI3↓) ditambahkan dengan larutan KI
berlebih maka endapan (BiI3↓) larut dan endapan berwarna kuning.
BiI3↓ + I- ↔ [BiI4]
-Kemudian apabila endapan (BiI3↓) ditambahkan dengan air
endapan berwarna hitam lalu dipanaskan akan menghasilkan endapan merah bata dan endapan mengendap dibawah
2. Bi3+ + 3OH- → Bi(OH)3
Apabila lar. Bi(NO3)3 direaksikan dengan NaOH bertetes-tetes akan menghasilkan endapan endapan putih seperti kristal
10 melayang-layang, kemudian jika dilanjutkan sampai berlebihan maka tidak ada perubahan.
3. Bi3+ + 2NH3 + NO3- 2H2O→ Bi(OH)2NO3↓ + 2NH4+
Jika lar. Bi(NO3)3 direaksikan dengan larutan ammonia bertetes-tetes maka akan menghasilkan endapan putih seperti kristal-kristal ,lalu dilanjutkan sampai berlebih maka akan membentuk kristal putih.
2) Merkuri (Hg2+)
1. Hg2+ + 2I- → HgI2↓
Merkuri direaksikan dengan larutan KI bertetes-tetes akan menghasilkan endapan merah ,lalu dilanjutkan akan sampai berlebih maka akan menghasilkan endapan yang terpisah dengan larutan dan endapan mengendap dibawah.
2. Hg2+ 2OH- → HgO↓ + H2O
Apabila merkuri ditambahkan larutan NaOH bertetes-tetes maka akan menghasilkan endapan coklat, lalu dilanjutkan sampai penambahan NaOH berlebihan akan menghasilkan endapan coklat yang semakin pekat.
3. 2Hg2+ +4 NH3+ NO3- + H2O→HgO.Hg(NH)2NO3↓ + 3NH4+
Apabila merkuri ditambahkan dengan ammonia (NH3) maka
akan menghasilkan endapan putih . 3) Kadmium ( Cd2+)
1. Cd2+ 2OH- → Cd(OH)2↓
Apabila kadmium ( Cd2+) direaksikan dengan larutan NaOH bertetes-tetes akan menghasilkan endapan putih melayang-layang dan menyebar dari larutan, lalu jika dilanjutkan dengan penambahan larutan NaOH berlebihan maka akan menghasilkan endapan yang memisah dari larutan dan endapan mengandap dibawah,
11 Apabila kadmium ( Cd2+) direaksikan dengan larutan ammonia(NH3) bertetes-tetes akan menghasilkan endapan putih.
4) Tembaga ( Cu2+)
1. Cu2+ + 2OH- → Cu(OH)2↓
Apabila tembaga ( Cu2+) direaksikan dengan larutan NaOH bertetes-tetes maka akan menghsilkan endapan biru, lalu dilanjutkan dengan penambahan secara berlebihan akan menghasilkan endapan biru muda + hijau dan larutan terpisah dengan endapan.
2. 2Cu2+ +SO42- + 2NH3 + 2H2O→ Cu(OH)2CuSO4↓ + 2NH4+
Apabila tembaga ( Cu2+) direaksikan dengan larutan NH3
bertets-tetes akan menghasilkan endapan biru muda dan larutan berwarna biru, lalu dilanjutkan dengan penambahan NH3 berlebihan maka tidak ada perubahan.
3. 2 Cu2+ + 5I- → 2CuI + I
3-Apabila tembaga (Cu2+) diraksikan dengan larutan KI akan menghasilkan endapan putih sedangkan larutan berwarna coklat.
V. SIMPULAN DAN SARAN
1) Simpulan
Dari hasil percobaan yang telah dilakukan bahwa kation golongan II diantaranya Bismuth ( Bi3+), Merkuri (Hg2+), Kadmium ( Cd2+), Tembaga ( Cu2+) dan Stibium(Sb2+).
12 2) Saran
a. Sebelum tabung reaksi digunakan kembali, cucilah agar benar-benar bersih agar tidak terjadi percampuran zat sisa dan menimbulkan perubahan warna.
b. Menggunakan perbandingan yang seimbang dalam penambahan reagen kesetiap larutan dengan perbandingan rasio 1:1
VI. DAFTAR PUSTAKA
SVEHLA G.1990.Vogel Bagian Satu Buku Teks Analisis Anorganik
Kulitatif Makro dan Semi mikro edisi ke lima.Jakarta: PT. Kalman Media
Pustaka.
13 Tim Dosen Praktikum Kimia Analisa 2013 Buku Petunjuk Praktikum Kimia Analisa Teknik Kimia FT UNNES Semarang.
Semarang, 13 april 2013
Mengetahui, Dosen Pengampu
Catur Rini Widiyastuti NIP.
Praktikan I Praktikan II Praktikan III
Fitriyatun Nur Jannah Ami Ridowati Mahfud Fauzi
NIM. 5213412006 NIM. 5213412034 NIM. 5213412029