SUSKANDARI KARTIKANINGRUM
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
2012
SUSKANDARI KARTIKANINGRUM
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
2012
SUSKANDARI KARTIKANINGRUM
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Haploidisasi Melalui Androgenesis dan Ginogenesis pada Anyelir (Dianthus sp.) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pusaka di bagian akhir disertasi ini
SUSKANDARI KARTIKANINGRUM. Haploidization through Androgenesis and Gynogenesis on Carnation (Dianthus sp.). Under supervisor of AGUS PURWITO, GUSTAAF ADOLF WATTIMENA, BUDI MARWOTO and DEWI SUKMA .
Haploidization technology ensures important advantages in obtaining pure lines by rapid fixation of homozygosity. Anther culture, ovule culture, ovary culture and irradiated pollen technique were used in this study. The objective of the research was to develop appropriate haploid technology in order to obtain haploid plants through androgenesis, gynogenesis by ovule culture and ovary culture and pseudofertilization on Dianthus chienesis. Androgenic callus was induced in four WT basic medium inductions supplemented with 2.4D, NAA, TDZ and BA. Four explants originated from ovule and ovary cultures of six genotypes of D. chinensis (Dchi-11, Dchi-12, Dchi-13, Dchi-14, Dchi-15 and Dchi-16) were applied in five media. For the parthenogenesis induction, 100-200 Gray gamma irradiations were applied to the Dchi-14 pollens and pollinated to the Dchi-11. Pollinations were conducted on the day after irradiation. Eight media were selected to obtain regenerated plants. Results showed that androgenic callus formation needed high auxin and sitokinin ratio, while regenerated callus required lower auxin and sitokinin ratio. 2,4-D was better than NAA in callus induction. Callus originated from anther culture, multi ovule slice culture, ovule culture and ovary slice culture regenerated producing early flowering plants and expressed of abnormal flowering mutant. Regeneran from anther culture was diploid, but two putative double haploids came up from multi ovule slice culture and ovary culture. Cytology and flow cytometry observations showed that seven haploid plants were obtained from pseudofertilization. Spontaneous chromosome doubling was inferred to have occurred during the callus culture period. In conclusion, gynogenesis through multiovule culture, ovary slice culture and pseudofertilization was more effective in inducing haploid and double haploid plants than androgenesis.
Ginogenesis pada Anyelir (Dianthus sp.) Dibimbing oleh AGUS PURWITO sebagai ketua, GUSTAAF ADOLF WATTIMENA, BUDI MARWOTO dan DEWI SUKMA sebagai anggota komisi pembimbing
Tanaman homosigot dapat diperoleh secara konvensional melalui selfing secara terus menerus sampai lebih dari enam generasi. Namun cara ini memerlukan waktu lama dan pada akhir generasi selfing masih ditemukan residu heterosigositas. Androgenesis, ginogenesis dan pseudofertilisasi sudah secara luas digunakan untuk program pemuliaan sebagai metode untuk menghasilkan tanaman haploid. Melalui teknologi haploidisasi, pembuatan tanaman homosigot murni dapat diperoleh hanya dalam satu generasi. Tanaman haploid ganda dapat digunakan untuk membentuk tanaman hibrida F1. Teknologi haploidisasi pada tanaman hias yang diperbanyak secara vegetatif, menawarkan peluang perdagangan benih dalam bentuk biji (true seed), dan bukan dalam bentuk stek yang tidak dapat disimpan lama.
Salah satu kendala dalam sistem usahatani anyelir domestik yaitu ketergantungan benih dari luar negeri. Untuk mengatasi masalah ketergantungan terhadap penggunaan benih impor, maka perlu upaya untuk merakit kultivar unggul yang memiliki nilai kompetisi yang tinggi di pasaran. Serangkaian penelitian dilakukan untuk mempercepat diperolehnya varietas-varietas baru anyelir, dengan menyediakan tetua-tetua yang diperoleh dari teknologi haploid. Tiga metode haploidisasi yaitu androgenesis, ginogenesis dan pseudofertilisasi diaplikasikan untuk mendapatkan tanaman haploid, yang selanjutnya dapat digandakan atau mengganda secara spontan untuk mendapatkan tanaman haploid ganda yang bersifat homosigot untuk seluruh lokus.
Berdasarkan studi biologi bunga dan dikaitkan dengan studi rasio perkembangan mikrospora diketahui bahwa variabel panjang kuncup merupakan indikator penanda kapan kuncup bunga dipanen untuk sumber eksplan. Induksi kalus androgenik dicoba pada empat jenis media yang mengandung media dasar WT yang berbeda rasio auksin dan sitokinin. Delapan jenis media regenerasi diseleksi untuk mendapatkan media yang sesuai untuk regenerasi. Penelitian ginogenesis terdiri atas empat percobaan berdasarkan pada kemampuan eksplan membentuk kalus/embrio. Empat eksplan tersebut ialah irisan multi ovul, multi ovul, irisan ovari dan ovari.
Percobaan pseudofertilisasi dilakukan dalam dua unit. Percobaan pertama, dosis iradiasi sinar gamma 100 Gy diaplikasikan pada serbuk sari dua genotipe Dianthus chinensis yaitu Dchi-14 dan Dchi-13. Percobaan kedua dosis iradiasi diperluas mulai 100-300 Gy yang diaplikasikan pada serbuk sari Dchi-14.
Hasil penelitian menunjukkan bahwa lima genotipe Dianthus chinensis yang diuji memiliki kecepatan antesis yang relatif sama, yaitu berkisar 14-16 hari, memiliki ciri-ciri spesifik yaitu adanya perubahan warna pada antera sesuai dengan fase perkembangan kuncup bunga, variasi jumlah mikrospora berkisar
viii
Media terbaik untuk menginduksi kalus pada androgenesis ialah medium padat AD4 (WT + 9,04 µM 2,4-D+ 5,71 µM NAA + 2,27 µM TDZ ). Media terbaik untuk menginduksi kalus pada ginogenesis ialah media M10 (MS + 4,52 µM 2,4-D + 4,44 µM BAP + 20 g L-1sukrosa). Media untuk menginduksi embrio langsung dari kultur ovari medium M6 (WT + 0.25 mgL-1 2,4-D+ 0.01 mgL-1 NAA + 0,5 mgL-1 TDZ + 30 g L-1 sukrosa). Medium regenerasi kalus yang terbaik ialah medium R11 (WT + 0,06 µM NAA + 2,22 µM BAP + 30 g L-1 sukrosa).
Penelitian androgenesis belum mengasilkan tanaman haploid. Sampel kalus androgenik yang dianalisis memiliki tingkat ploidi diploid, sedang dari penelitian ginogenesis telah dihasilkan tanaman putatif haploid ganda melalui kultur irisan multi ovul dan kultur ovari. Satu tanaman haploid ganda hasil kultur irisan multi ovul telah di uji melaluiselfingatausibling(penyerbukan sendiri) dan diperoleh keturunan yang seragam. Kultur irisan multi ovul menghasilkan mutan-mutan abnormalitas pembungaan.
Penyerbukan menggunakan serbuk sari yang diradiasi 100 200 Gy dapat menginduksi partenogenesis Dianthus sp. dan menghasilkan tujuh tanaman haploid (PF69.1, PF69.2; C11; D231, D9.1; D9.2 dan D19.1). Pengandaan kromosom spontan terjadi pada D9.1. Frekuensi tanaman haploid yang diperoleh pada percobaan pseudofertilisasi adalah 5,10%.
Berdasarkan hasil penelitian dapat disimpulkan bahwa ginogenesis melalui kultur irisan multi ovul, kultur irisan ovary, kultur ovari dan pseudofertilisasi lebih efektif untuk menginduksi tanaman haploid dan haploid ganda dibandingkan androgenesis. Dari ginogenesis melalui kultur irisan multi ovul dan kultur ovari diperoleh dua putatif tanaman haploid ganda, sedang dari kultur irisan ovari diperoleh satu putatif tanaman haploid. Ginogenesis melalui pseudofertilisasi menghasilkan tujuh tanaman haploid
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
SUSKANDARI KARTIKANINGRUM
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada Program Studi Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
xii Penguji Luar Komisi
Penguji pada Ujian Tertutup : Dr. Ir. Ence Darmo Jaya Supena, MS.
(Staf Pengajar Departemen Biologi, Fakultas MIPA, IPB) Dr. Ir. Endah Retno Palupi, MSc.
(Staf Pengajar Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB)
Penguji pada Ujian Terbuka: Dr. Ir. Yusdar Hilman, MS, APU
(Kepala Pusat Penelitian dan Pengembangan Hortikultura, Kementrian Pertanian) Dr. Ir Syarifah Iis Aisyah, MSi.
Nama : Suskandari Kartikaningrum
NRP : A 263080031
Disetujui Komisi Pembimbing
Dr. Ir. Agus Purwito, MSc. Agr. Ketua
Prof. Dr. Ir. G.A. Wattimena, MSc. Dr. Ir. Budi Marwoto, MS Dr. Ir. Dewi Sukma, SP, MSi
Anggota Anggota Anggota
Diketahui
Ketua Program Studi Pemuliaan Dekan Sekolah Pascasarjana Dan Bioteknologi Tanaman
Dr. Ir. Trikoesoemaningtyas, MSc Dr. Ir. Dahrul Syah, MSc. Agr
rahmat dan karunia Nya sehingga penulis berhasil menyelesaikan disertasi ini dengan judul Haploidisasi melalui Androgenesis dan Ginogenesis pada Anyelir (Dianthussp.).
Terima kasih yang mendalam penulis ucapkan kepada Dr. Ir. Agus Purwito, M.Sc Agr, selaku Ketua Komisi Pembimbing, Prof. Dr. Ir. Gustaaf Adolf Wattimena MSc., Dr. Ir Budi Marwoto, MS APU, dan Dr. Dewi Sukma, SP. MSi, selaku anggota Komisi Pembimbing yang telah memberikan bimbingan, kritikan, saran dan masukan yang sangat berharga sejak persiapan, pelaksanaan penelitian hingga selesainya penulisan disertasi ini. Penulis juga mengucapkan terima kasih kepada Prof. (Riset) Dr. Ika Mariska, MSc dan Dr. Muhamad Syukur, SP, Msi. selaku penguji pada saat ujian pra kualifikasi, Dr. Ir. Ence Darmo Jaya Supena MS dan Dr. Ir. Endah Retno Palupi MSc. selaku penguji luar komisi pada ujian tertutup, serta Dr. Ir. Yusdar Hilman, MSc. dan Dr. Ir. Syarifah Iis Aisyah, MSi selaku penguji luar komisi pada ujian terbuka.
Terima kasih juga penulis ucapkan kepada Kepala Badan Penelitian dan Pengembangan Pertanian, Kementrian Pertanian melalui Bagian Pembinaan Tenaga serta Kepala Pusat Penelitian dan Pengembangan Hortikultura yang telah memberikan kesempatan, kepercayaan dan dukungan biaya selama masa tugas belajar S3 ini berlangsung. Penghargaan dan terima kasih, penulis ucapkan kepada Kepala Balai Penelitian Tanaman Hias atas fasilitas kebun dan laboratorium serta materi yang disediakan.
Kepada teman-teman peneliti Dr. Drs Budi Winarto, Ir. Minangsari Dewanti, MP, Dr. Dra. Sri Rianawati, MSi., Ir. Dedeh Siti Badriah, Msi., Ridho Kurniati, SP MSi, Dra. Dyah Widiastoety, MS dan Dr. Ir. Marcia Bunga Pabendon, MP yang telah memberikan bantuan dan dukungan yang berharga. Terima kasih juga penulis ucpakan kepada rekan-rekan peneliti dan teknisi di Segunung, Cipanas dan Pasar Minggu yang telah banyak membantu di lapang dan laboratorium, serta teman seperjuangan dari Badan Litbang Ir. Sesanti Basuki M Phil., Ir. Agus Sutanto MSc. dan Dr. Ir. Ika Roostika, MSi untuk dorongan semangat dan persahabatannya. Tak lupa pula penulis ucapkan terima kasih kepada Pak Joko Marwanto (Faperta IPB), Pak Fajar (LIPI), Pak Ujang Hafid (LIPI), Pak Pras (PPSHB IPB), Pak Iwan (FKH IPB) dan Pak Muryanto (Ewindo, Purwakarta) yang telah membantu analisis laboratorium, serta semua pihak yang telah membantu pelaksanaan penelitian ini.
Ucapan terimakasih khusus atas doa, dorongan dan kasih sayang yang tiada putus dari ayahanda Wiryawan (almarhum) dan ibunda Sri Anitah serta semua keluarga, kakak dan adik yang telah mendukung dan menguatkan penulis dalam melaksanakan penelitian hingga penulisan disertasi ini.
Penulis menyadari bahwa tiada yang sempurna pada karya manusia, sehingga besar harapan penulis atas saran dan kritik membangun demi penyempurnaan disertasi ini. Akhir kata penulis berharap semoga disertasi ini bermanfaat dan menjadi acuan dalam pengembangan teknologi haploid demi kemajuan florikultura khususnya di Indonesia.
Bogor, Desember
dari tiga bersaudara pasangan suami-istri Wiryawan dan Sri Anitah. Pendidikan S1 Agronomi diselesaikannya di Universitas Sebelas Maret Surakarta pada tahun 1989. Pada tahun 1999, penulis mendapatkan kesempatan melanjutkan studi S2 di Universitas Padjadjaran Bandung bidang Ilmu Tanaman, Bidang Kajian Utama Ilmu Pemuliaan Tanaman, Fakultas Pertanian yang diselesaikan pada tahun 2002. Tahun 2008 penulis mendapat kesempatan untuk melanjutkan studi S3 di Sekolah Pasca Sarjana, Program Studi Pemuliaan dan Bioteknologi Tanaman, Departemen Agronomi dan Hortikultura, Fakultuas Pertanian IPB.
Sejak bulan Maret 1994 penulis bekerja di Balai Penelitian Tanaman Hias, Departemen Pertanian, tergabung dalam kelompok peneliti Pemuliaan dan Plasma Nutfah Tanaman Hias. Tugas yang diemban ialah manajemen koleksi plasma nutfah anggrek dan pemulia tanaman anggrek. Sejak tahun 2003 sampai 2009 penulis telah melepas delapan varietas anggrek Spathoglottis dan Phalaenopsis serta anggota tim pelepas lima varietas anggrek Spathoglottis dan Phalaenopsis Balithi.
DAFTAR ISI xix
STUDI TAHAP PERKEMBANGAN KUNCUP BUNGA,
MIKROSPORA DAN OVULDianthus chinensisL.
Abstrak . 17
INDUKSI HAPLOID Dianthus chinensis MELALUI
ANDROGENESIS SECARAIN VITRO
INDUKSI HAPLOID Dianthus chinensisMELALUI GINOGENESIS SECARAIN VITRO
INDUKSI TANAMAN HAPLOID Dianthus chinensis MELALUI PSEUDOFERTILISASI
Abstrak . 81
xx
Pendahuluan .. 83
Bahan dan Metode . 84
Hasil .. 89
Pembahasan 106
Simpulan 110
PEMBAHASAN UMUM . 111
SIMPULAN DAN SARAN . 119
DAFTAR PUSTAKA 121
1 Rata-rata jumlah antera dan warna antera pada setiap fase pertumbuhan lima genotipeDianthus chinensis...
26
2 Jumlah mikrospora per antera lima genotipe dari spesies Dianthus chinensis...
28
3 Frekuensi tahap perkembangan serbuk sari D. chinensis Dchi-11 berdasarkan ukuran kuncup bunga dan warna antera ..
29
4 Viabilitas serbuk sari pada lima genotipe dari spesies Dianthus chinensis...
39
5 Respon empat tahap perkembangan mikrospora genotipe Dchi-11 pada berbagai media induksi embrio/kalus .. ..
31
6 Pengaruh tahap kuncup terhadap terbentuknya kalus pada ovula atau ovari Dchi-11, 8 minggu setelah tanam .. ..
34
7 Respon dua genotipe D. chinensis (rataan persentase terbentuknya kalus dan waktu terbentuknya kalus) pada media induksi kalus
48
8 Pengaruh media terhadap persentase antera membentuk kalus dan waktu terbentuknya kalus pada genotypeD. chinensis ..
48
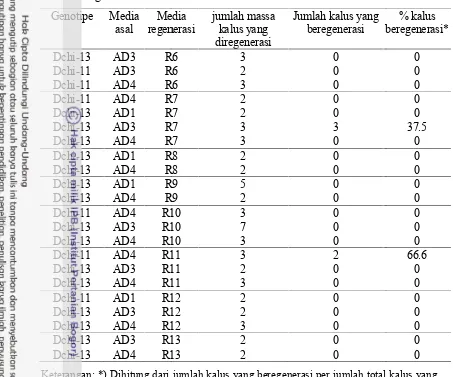
9 Jumlah massa kalus yang diregenerasi, jumlah kalus dan persen kalus yang beregenerasi pada dua genotype, berdasarkan media asal
dan media regenerasi .
50
10 Interaksi media dengan genotipe terhadap persen hasil pembentukan kalus pada kultur irisan multi ovul pada umur 4 MSI (minggu setelah inisiasi)
65
11 Regenerasi kalus empat genotipe Dianthus chinensis hasil kultur irisan multi ovul
66
12 Organogenesis kalus dan saat munculnya tunas genotipe D. chinensis Dchi-11 pada media regenerasi R7 dan Dchi-15 pada media regenerasi R11 dari media asal M10 .. ..
69
13 Interaksi media dengan genotipe terhadap persentase pembentukan kalus pada kultur irisan ovari umur 4 minggu setelah inisiasi
..
74
14 Organogenesis dari kalus pada genotipe dari jenis eksplan irisan ovari, genotipe dan media asal pada kultur irisan ovari . ..
75
15 Pengaruh media terhadap jumlah buah yang berhasil tumbuh dari ovari hasil pseudofertilisasi dengan serbuk sari yang diiradiasi
dengan sinar gamma .
90
16 Jumlah biji yang tumbuh setiap ovari hasil pseudofertilisasi 91 17 Rata-rata dan kisaran jumlah kloroplas pada sel penjaga stomata
enam genotipe Dianthus chinensis hasil pseudofertilisasi dengan
polen yang diiradiasi sinar gamma ...
92
18 Jumlah dan karakteristik buah yang dipanen dan biji yang diperoleh setelah penyerbukan D. chinensis Dchi-11 dengan serbuk sari D. chinensisDchi-14 yang diradiasi dengan sinar gamma ...
98
19 Pengaruh dosis iradiasi sinar gamma terhadap perkecambahan biji dan kualitas planlet setelah 4 bulan dan 7 bulan hasil
pseudofertilisasi ..
99
1 Bagan alir kegiatan penelitian . 7 2 Morfologi bunga lima genotipeDianthus chinensis(A) Dchi-11,
(B) Dchi-12, (C) Dchi-13, (D) Dchi-14 dan (E) Dchi-15
20
3 Perkembangan kuncup bunga, ovari dan antera Dianthus chinensis Dchi-11. T1 sampai T10 adalah 4 sampai 13 hari setelah inisiasi bunga ...
25
4 Tahap perkembangan serbuk sari. 27
5 Karakteristik kuncup bunga dan antera pada 5 tahap perkembangan bungaDianthus chinensis.
28
6 Hubungan antara panjang kuncup dengan umur kuncup dan tahap perkembangan serbuk sariDianthus chinensisDchi-11.
29
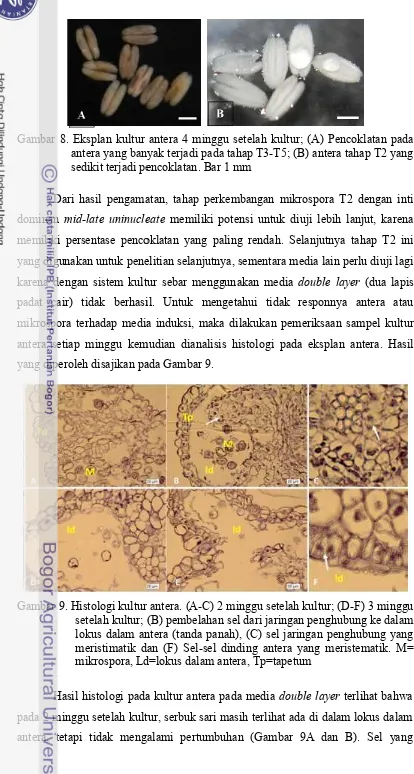
7 Hasil pewarnaan serbuk sari dengan FDA Dchi-15... 30 8 Eksplan kultur antera 4 minggu setelah kultur ... 32
9 Histologi kultur antera . 32
10 Irisan melintang dan membujur kuncup bunga dan ovul .... 33 11 Perkembangan pembentukan kalus pada antera Dianthus
chinensis ..
47
12 Verifikasi media AD4 kultur antera 49
13 Regenerasi kalus hasil kultur antera .. . 50
14 Histogram DNA hasil analisis flow cytometry . 52
15 Eksplan ovul dan ovari .. 59
16 Pembentukan kalus eksplan irisan multi ovul .. 64 17 regenerasi dari kalus yang terinduksi membentuk bunga tidak lengkap 66 18 Morfologi tanaman dan bunga hasil kultur irisan multi ovul .. 67
19 Hasil analisis isozim dengan enzim . 68
20 Diagram persentase pembentukan kalus genotipe Dchi-11 dan Dchi-15 pada media M10 dan M11 pada kultur multi ovul ..
68
21 Pembentukan kalus dan regenerasi kalus menjadi tunas pada genotype Dchi-11 dan Dchi-15 dari media asal M10 .
70
22 Histogram DNA hasil analisisflow cytometry 70
23 Kultur ovary .. 71
24 Analisis ploidi pada regeneran Dchi-15 hasil kultur ovari .. 72 25 Variasi warna dan bentuk bunga dan ketebalan warna putih pada
tepi bunga tanaman donor dan hasil kultur ovari Dchi-15 .
72
26 Hasil analisis isozim dengan enzim . 73
27 Pembentukan kalus pada eksplan irisan ovari setiap genotipe
pada media induksi .
74
28 Persentase pembentukan kalus yang berasal dari eksplan irisan ovari genotipe Dchi-11dan Dchi-13 pada 3 macam media
..
75
xxiv
31 Pengaruh iradiasi terhadap aktifitas serbuk sari yang dikecambahkan pada larutan sukrosa 15%. ..
89
32 Embrio yang berhasil tumbuh dari enam ovari .. 90 33 Kloroplas dalam sel penjaga stomata tanaman Dianthus
chinensishasil pseudofertilisasi ...
92
34 Kromosom tanaman PF79 hasil pseudofertilisasi: terdapat dua sel dengan jumlah kromosom berlainan. Jumlah kromosom 30 (panah hitam), jumlah kromosom 15 (panah merah)
92
35 Histogram DNA hasil analisis flow cytometer pada tanaman PF69.1 dan PF69.2 hasil pseudofertilisasi ..
93
36 Histogram DNA hasil analisis flow cytometer pada tanaman PF89 hasil pseudofertilisasi
94
37 Histogram DNA hasil analisis flow cytometry pada tanaman
PF35.1 hasil pseudofertilisasi ..
94
38 Pertumbuhan planletin vitrodan tanaman hasil pseudofertilisasi 95
39 Hasil analisis isozim dengan enzim . 96
40 PF42 dan progeni hasil penyerbukan sendiri tanaman PF42 hasil
pseudofertilisasi ..
97
41 Persentase perkecambahan serbuk sari D. chinensisDchi-14, 24
jam setelah iradiasi sinar gamma ..
97
42 Persentase pembentukan buah pada D. chinensis yang diseerbuki dengan serbuk sari yang diradiasi dengan berbagai
dosis sinar gamma ..
98
43 Grafik hubungan antara dosis iradiasi sinar gama terhadap persentase abnormal planlet D. chinensis setelah 4 bulan dan 7
bulan ..
99
44 Planlet hasil penyerbukan dengan serbuk sari yang diirradiasi dengan sinar gamma pada dosis 100-300 Gy .
100
45 Pertumbuhan planlet normal dan planlet yang diduga haploid, bentuk daun variegata serta jumlah kloroplas di sel penjaga
stomata ..
101
46 Histogram DNA hasil analisis dengan flow cytometer pada tanaman D9.2 hasil pseudofertilisasi
102
47 Histogram DNA hasil analisis dengan flow cytometer pada
tanaman C11, D9.1, D19.1, D231 ..
102
48 Empat genotipe haploid dan haploid ganda hasil pseudofertilisasi yang sudah berbunga ...
104
49 Tanaman hasil pseudofertilisasi E30d-1, hasil penyerbukan dengan serbuk sari yang diirdiasi dengan sinar gamma 300 Gy.
105
50 Bunga dari tanaman donor dan bunga dari tanaman hasil pseudofertilisasi dengan serbuk sari yang diradiasi dengan sinar gamma pada dosis 100-200 Gy
1 Rata-rata ukuran bagian-bagian bunga pada lima genotipe 130
2 Tabel komposisi media dasar yang digunakan 131
Androgenesis adalah proses terbentuknya tanaman yang diinisiasi dari gamet jantan
Binucleateadalah tahap mikrospora berinti dua (inti vegetatif dan generatif) Dediferensiasi adalah proses berubah kembalinya eksplan yang tadinya sudah terspesialisasi dan kembali ke kondisi meristematik.
Dihaploid adalah tanaman haploid (n=2x) yang mengandung dua set kromosom yang berasal dari tanaman tetraploid (2n=4x)
Diploid adalah sel yang mengandung dua set kromosom (2n = 2x)
Double haploid adalah penggandaan kromosom haploid menjadi diploid yang homosigot
Embryo rescue adalah penyelamatan embrio muda yang tidak dapat berkembang menjadi embrio dewasa
Endoreduplikasi adalah penggandaan kromosom tanpa sitokinesis. Gametofitik adalah generasi seksual (proses pembentukan gamet)
Gynogenesis adalah proses terbentuknya tanaman yang diinisiasi dari gamet betina
Haploid adalah tanaman (sporofitik) yang mengandung jumlah kromosom gamet (n)
Haploidisasi adalah proses mendapatkan tanaman haploid
Kultur irisan multi ovul adalah kultur dengan eksplan yang berasal dari irisan poros bunga yang berisi ovul lebih dari satu
Kultur irisan ovary (ovary slice) adalah kultur dengan eksplan yang berasal dari irisan ovari yang mengandung lebih dari satu ovul secara melintang
Meiotic sieve adalahpengaturan kembali kromosom setelah mengalami radiasi Kultur multi ovul adalah eksplan dalam bentuk poros bunga utuh berisi banyak ovul
Organogenesis adalah proses pembentukan organ-organ tanaman seperti akar, batang, daun dan bunga
Kulturovari adalah kultur dengan eksplan dalam bentuk ovari yang mengandung banyak ovul di dalamnya
Partenogenesis adalah proses berkembangnya embrio haploid dari sel telur tanpa proses fertilisasi
Polihaploid adalah gamet (n) yang memiliki lebih dari satu set kromosom Pseudofertilisasi adalah proses penyerbukan (polinasi) tanpa fetilisasi
Regenerasi adalah proses pertumbuhan dan perkembangan sel yang bertujuan untuk mengisi ruang tertentu pada jaringan atau mempebaiki bagian yang rusak Semigami adalah inti sperma memasuki sel telur tetapi tidak berfusi dengan inti sel telur. Setiap inti masing-masing membelah membentuk embrio haploid yang mengandung sektor asal jantan dan betina
Sporofitik adalah generasi aseksual
✁✂✄☎✆ ✝✞✝☎✂
✟ ✠✡ ✠☛☞elakang
Anyelir atau✌✍ ✎✏✍ ✑ion (✒✍✏ ✑✓ ✔✕i sp .) merupakan salah satu tanaman hias penting (Leshem 1990; Fisher ✖t ✍ ✗ ✘ 1993). Menurut Plasmeijer & Yanai (2006) dalam laporan ✙✍ ✎✚✖t ✛✖ws ✜✖✌ ✖rvi di Asia dan Eropa, pasar anyelir menduduki ranking ke 4 setelah mawar, krisan dan garbera. Sementara di Indonesia menurut data Biro Pusat Statistik 2012 produksi tanaman anyelir di Indonesia masih sangat rendah, menempati urutan ke enam setelah krisan, mawar, sedap malam, gladiol dan gerbera.
Salah satu kendala dalam sistem usaha tani anyelir domestik adalah ketergantungan benih dari luar negeri. Benih sangat penting dalam budidaya anyelir, karena 30-35% biaya produksi digunakan untuk pembelian benih (BI 2004). Benih anyelir didatangkan dari Belanda, Spanyol dan Vietnam (Satsijati✖t ✍✗. 2004). Untuk mengatasi masalah ketergantungan penggunaan benih impor, maka perlu upaya untuk merakit kultivar unggul yang memiliki nilai kompetisi yang tinggi di pasaran. Hal ini penting untuk mengoptimalkan keuntungan yang diterima petani. Optimasi keuntungan dapat diperoleh melalui peningkatan efisiensi produksi. Situasi ini akan menjadi tantangan serius bagi para pemulia untuk saling berlomba mendapatkan kultivar unggul baru, agar industri tanaman hias menjadi tangguh (Marwoto✖t ✍ ✗. 1995).
Tanaman haploid menarik perhatian utama para ahli genetika dan pemulia tanaman, karena melalui penggandaan kromosom akan diperoleh tanaman haploid ganda yang homosigot. Tanaman homosigot dapat diperoleh secara konvensional, tetapi diperlukan prosedur lebih dari enam kali generasi ✏✢✎✖✖✣✤✏✥i ✦ sedangkan melalui teknologi haploid dapat dicapai dalam satu kali generasi.
kromosom terseleksi dari empat set dalam autotetraploid, sedangkan haploid ganda dari monoploid atau suatu allohaploid pasti homosigus lengkap (Kasha 2005).
Tanaman haploid ganda memiliki beberapa kegunaan dalam program pemuliaan, yaitu digunakan sebagai tetua dalam pembentukan varietas hibrida F1 dan untuk studi pewarisan karakter. Haploid ganda juga bermanfaat dalam proses seleksi, terutama untuk karakter-karakter poligenik, karena rasio genetiknya menjadi lebih sederhana. Kegunaan lain yaitu untuk mendapatkan genotipe tertentu dan jumlah tanaman yang ditapis lebih sedikit. Selain itu tanaman haploid ganda berguna untuk studi yang terkait dengan karakter resesif, karena sifat resesif dapat terekspresi pada fenotipe tanaman. Menurut Reinert ✩t ✪ ✫✬ (1975) tanaman haploid berguna untuk studi mutasi dan seleksi.
Proses untuk mendapatkan tanaman haploid yang biasanya berasal dari sel diploid (2n) dikenal dengan nama haploidisasi. Beberapa upaya telah dilakukan untuk memproduksi tanaman haploid, diantaranya ialah persilangan tanaman kerabat jauh, perlakuan fisik dan kimiawi, penggunaan serbuk sari yang diiradiasi dan penundaan penyerbukan. Dengan makin banyaknya teknik yang dikembangkan untuk menginduksi tanaman haploid, maka penelitian untuk mendapatkan tanaman haploid juga makin berkembang.
Pengembangan teknologi haploidisasi merupakan salah satu terobosan teknologi yang dapat diharapkan untuk membangun dan mendorong kebangkitan florikultura di Indonesia. Melalui teknologi ini, tanaman homozigot murni akan dihasilkan. Persilangan antara tanaman homozigot akan dihasilkan tanaman hibrida baru dan benih berkualitas dalam jumlah yang besar, stabil dan seragam. Ini berarti keberhasilan pengembangan teknologi pada tanaman hias secara langsung akan bermanfaat dalam penyediaan benih yang berkualitas melalui persilangan konvensional sekaligus menghasilkan varietas unggul baru.
3
melainkan membentuk embrio. Induksi perkembangan sel sporofitik hanya mungkin dilakukan pada tahap awal perkembangan serbuk sari, pada saat serbuk sari memperlihatkan totipotensi (Toraev✭t ✮ ✯. 2001).
Aplikasi kultur antera atau serbuk sari pada tanaman hias sampai saat ini masih terbatas. Beberapa tanaman yang telah dilaporkan menggunakan teknik ini, di antaranya Lilium sp. (van den Bulk et al. 1992; Han et al. 1997), Tulipa sp. (van den Bulk et al. 1994), Helianthus sp. (Coumans & Zhon, 1995), Petunia (Mohan & Bhalla-Shari, 1997), dan Camelia japonica (Pedroso & Pai, 1997). Meskipun kultur antera di beberapa spesies telah dilakukan untuk induksi embriogenesis somatik (Achar 2002; Germanà 2003; Kikkert et al. 2005; Rimberia et al. 2005), tetapi hanya sedikit laporan hasil penelitian mengenai kultur antera anyelir (Dolcet-Sanjuanet al.2001).
Upaya untuk mendapatkan tanaman haploid pada tanaman anyelir sudah dilakukan oleh Fu et al. (2008) melalui kultur antera. Namun tidak diperoleh tanaman haploid maupun haploid ganda. Hasil analisis histologi menunjukkan bahwa tanaman berasal dari dinding sel antera, dengan konstitusi genetik diploid dan tetraploid. Ketidakberhasilan induksi tanaman haploid dari antera ini kemungkinan disebabkan oleh belum tepatnya stadia mikrospora, belum tepatnya media yang digunakan, praperlakuan dan kombinasinya yang belum sesuai atau kemungkinan penggunaan metode androgenesis tidak tepat. Untuk mendapatkan tanaman haploid, metode lain seperti ginogenesis dan penggunaan serbuk sari yang diiradiasi untuk pseudofertilisasi perlu dipelajari.
et al. 1982), Hordeum vulgare (Huang et al. 1982), Melandrium album (Mol 1992) danNicotiana tabacum(Wu & Chen 1982).
Partenogenesis yang diinduksi dengan serbuk sari yang diiradiasi juga dapat menghasilkan tanaman haploid. Pseudofertilisasi dengan memanfaatkan serbuk sari yang diradiasi diikuti dengan penyelamatan embrio yang menghasilkan tanaman haploid telah banyak diterapkan pada beberapa tanaman buah-buahan yaitu plum (Peixe et al. 2000), kiwi (Chalak and Legave, 1997, Musial et al. 1998), melon ( Katohet al. 1993), jeruk (Bermejoet al. 2011). Pada tanaman hias telah dilakukan pada primula (Carraro et al. 1990), bunga matahari (Todorova et al. 2004), mawar (Meynet et al. 1994), anyelir (Dianthus caryophillus) (Sato et al. 2000) dan tanaman lain seperti kapas (Aslam 2000; Savaskan 2002).
Teknologi haploidisasi ini penting dilakukan pada anyelir karena perkembangan pemuliaan anyelir di Indonesia yang masih lambat dibandingkan dengan tanaman hias lain. Seperti yang telah disebutkan di atas, bahwa selain benihnya yang masih impor dengan informasi tetua persilangan yang terbatas, maka hasil pemuliaan hanya tertuju pada menghasilkan varietas baru yang memiliki warna bunga yang berbeda-beda saja. Karakter-karakter penting lain seperti ketahanan simpan, ketahanan terhadap cekaman biotik dan abiotik belum menjadi penelitian utama. Penelitian radiasi pada anyelir juga belum dapat meningkatkan variasi pada anyelir. Banyak pola pewarisan karakter pada anyelir yang belum terungkap karena bersifat resesif, sehingga dengan teknologi haploid ini akan diperoleh karakter-karakter lain yang selama ini tertutupi oleh karakter yang dominan.
5
✰ujuan Penelitian
Tujuan umum penelitian ialah mendapatkan teknologi haploidisasi yang sesuai untuk pembentukan tanaman haploid dan mendapatkan tanaman homozigot murni tanaman Dianthus chinensis yang dapat digunakan dalam pembentukan varietas baru dan pembuatan benih hibrida. Tujuan utama tersebut dijabarkan dalam setiap percobaan dengan tujuan khusus:
1. Menentukan indikator morfologi dari tahap perkembangan kuncup, stadia perkembangan serbuk sari late uninukleat dominan serta stadia ovul yang tepat untuk digunakan dalam kultur antera, ovul dan pseudofertilisasi.
2. Mendapatkan media yang sesuai untuk menginduksi androgenesis dan mendapatkan tanaman haploid melalui androgenesis.
3. Mendapatkan metode kultur ovul atau ovari untuk menghasilkan tanaman haploid, media yang sesuai untuk menginduksi ginogenesis, dan tanaman haploid melalui ginogenesis.
4. Mendapatkan dosis iradiasi sinar gamma yang dapat menonaktifkan serbuk sari untuk pseudofertilisasi dan mendapatkan tanaman haploid melalui penyerbukan dengan serbuk sari yang diiradiasi dengan sinar gamma.
Hipotesis
1. Stadia kuncup bunga dengan serbuk sari pada stadialateuninukleat dan ovul pada stadia setelah meiosis merupakan fase terbaik untuk menginduksi pembentukan embrio kalus
2. Media dengan perbandingan auksin dan sitokinin yang tinggi akan menghasilkan embrio atau kalus yang dapat beregenerasi menjadi tanaman haploid.
3. Metode isolasi kultur ovul atau ovari pada media yang mampu menginduksi kalus ginogenik yang tepat akan dapat menghasilkan tanaman haploid.
4. Dosis iradiasi sinar gamma yang mampu menonaktifkan serbuk sari akan mampu menginduksi embrio partenogenik yang akan menghasilkan tanaman haploid.
Manfaat Penelitian
1. Protokol kultur ovul dan pseudofertilisasi dapat digunakan untuk memproduksi tanaman haploid dan haploid ganda pada tanaman Dianthus yang lain.
2. Tanaman haploid ganda dapat langsung dimanfaatkan sebagai tetua dalam persilangan konvensional untuk menghasilkan kultivar hibrida F1.
3. Tanaman haploid yang membawa satu alel setiap gen dapat digunakan untuk mempelajari mutasi dan pewarisan karakter
✱u✲✳✴✵✶✴ ✷n up✸enelitian
7
✹✺ ✻✺ ✼✺ ✽✾r penelitian
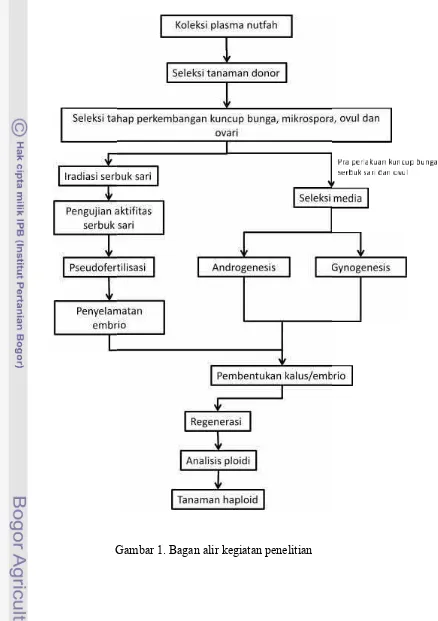
Gambar 1. Bagan alir kegiatan penelitian
7
Bagan alir penelitian
Gambar 1. Bagan alir kegiatan penelitian
7
Bagan alir penelitian
✿❀ ❁❂ ❃❄❃❁❅❄❆✿❃❇❃
Dianthus chinensis❈ ❉
Dianthus termasuk dalam tanaman dikotil dari family Caryophyllaceae (Bunt & Cockshull 1985). Famili Caryophyllaceae terdiri atas 80 genera dan 2000 spesies baik tanaman annual ataupun perennial, sebagian besar berbentuk herba yang tumbuh di belahan bumi bagian utara. Genus Dianthus memiliki dua kelompok yaitucarnationdanpinks. Di Indonesiacarnationdikenal dengan nama anyelir, sedangkanpinks adalah nama lain dari species chinensis. Pada penelitian ini nama anyelir digunakan untuk memberi nama Dianthus chinensis agar lebih dikenal dibandingkan dengan nama pink. Anyelir komersial yang ada sekarang merupakan turunan dari spesies nenek moyang dari Dianthus caryophyllus, yang berasal dari Eropa bagian selatan dan Asia bagian barat (Mii et al. 1990). Berdasarkan informasi dari Germplasm Resources Information Network (GRIN),
Dianthus chinensis berasal dari China (Gangsu, Henan, Qinghai, Shandong) dan India (Uttar Pradesh), dan Nepal.
Daerah tumbuh anyelir adalah daerah subtropik yang terletak pada 30oLU atau LS yang beriklim sejuk. Di daerah tropik anyelir dapat ditanam di daerah pegunungan. Suhu optimum untuk pertumbuhan anyelir adalah 10 22oC. Suhu udara berperan penting dalam perkembangan masa generatif tanaman anyelir. Pada suhu tinggi bakal bunga akan berkembang lebih cepat, tetapi bunga yang dihasilkan kecil serta tangkainya kurus dan lemas (Hardjoko, 1999).
Di Indonesia anyelir cocok ditanam di daerah dengan ketinggian di atas 1000 m dpl, yang pada malam hari suhu udara dapat mencapai di bawah 16 oC, sedangkan suhu pada siang hari dapat mencapai di bawah 30 oC. Suhu optimal untuk produksi serbuk sari yaitu 23 oC dan suhu di bawah 17 oC akan menghambat pembentukan stamen (Kho & Baer 1973). Sentra produksi bunga potong anyelir di Indonesia adalah Cipanas (Jawa Barat) dan Bandungan (Jawa Tengah) (Satsijatiet al. 2004).
dapat dibagi menjadi dua kelompok, yaitu semusim (6-12 months) dan dua musim/tahunan (2-4 tahun) (Crockett 1972). Pada umumnya anyelir tumbuh selama dua tahun dengan periode tanam 18-20 bulan (Salinger 1985).
Dianthus chinensis atau lebih dikenal dengan nama Chinese pink, Indian pink, Japanese pink, Rainbow pink merupakan kerabat Dianthus caryophyllus yang telah digunakan sebagai materi pemuliaan untuk karakter-karakter unik seperti ketahanan terhadap penyakit, laju pertumbuhan yang cepat, adaptasi luas, dan hasil yang tinggi (Tejaswini 2002). Dianthus chinensis termasuk tanaman biennial, bentuk tanaman semak, berasal dari Asia Timur. Bunga bervariasi dalam warna pink atau putih, dengan ujung zig-zag pada bagian tepi. Di Cina D.
chinensis biasanya digunakan sebagai tanaman obat. Beberapa kultivar modern merupakan keturunan dari persilangan interspesifik antaraD. caryophyllusdanD.
chinensisatau kerabat lain (Miiet al. 1990). Menurut Sparnaaij dan Koehorst-van Putten (1990) spesies-spesies komersial seperti D. barbatus, D. japonicus, D.
chienensis dan D. superbus merupakan spesies-spesies yang sering digunakan untuk transfer karakter kegenjahan ke tanaman anyelir. Dianthus chinensis merupakan spesies yang paling adaptif baik pada hari pendek dan hari panjang serta paling genjah di antara spesies yang lain. Persilangan antaraD. caryophyllus dan D. chinensis menghasilkan varietas yang berbunga lebih awal dan terus menerus (Sparnaaij & Koehorst-van Putten 1990).
❊roduksi Haploid dan Haploid Ganda
Aspek yang penting dalam pemuliaan adalah induksi keragaman yang maksimum dari sumber plasma nutfah untuk efektifitas seleksi dan introduksi karakter yang lebih baik pada spesies tanaman yang ada. Sejak Bergener menemukan tanaman haploid pada Datura starmoniumpada tahun 1921, pemulia tanaman mulai bekerja ekstensif untuk mendapatkan tanaman haploid baik secara
in vivo maupun in vitro. Secara alami haploid muncul sebagai hasil dari parthenogenesis (Wedzonyet al. 2009)
11
Ranunculaceae dan famili lainnya, memungkinkan untuk diinduksi juga melalui kultur antera untuk mendapatkan tanaman haploid .
Teknik kultur antera pertama kali diperkenalkan oleh Guha dan Maheshwari (1964, 1966) padaDatura innoxiaMill, kemudian berkembang pesat dan diaplikasikan pada berbagai jenis tanaman (Maluszynski et al., 2003). Sifat totipotensi pada sel mikrospora berpengaruh terhadap diperolehnya tanaman haploid. Pada kondisi yang sesuai, perkembangan sel polen dapat diubah dari pembentukan polen (jalur gametofitik) ke pembentukan embrio (jalur sporofitik), tanaman haploid dan/atau haploid ganda (Supena, 2004). Tanaman haploid ganda terbentuk akibat terjadinya penggandaan spontan atau melalui proses penggandaan kromosom tanaman haploid.
❋● ❍t us ■eknologi Haploid pada Anyelir
Penelitian tentang haploidisasi tanaman anyelir (Dianthus caryophillus) masih jarang dilakukan. Penelitian androgenesis melalui kultur antera pada tanamanDianthus sp sebagian besar melalui tahap kalus (Mosquera et al. 1999). Kultur antera pada anyelir pertama kali dilakukan oleh Mosquera et al. (1999), dan dihasilkan kalus embriogenik, tetapi hanya diperoleh satu planlet yang dapat diregenerasi dan tidak dijelaskan apakah diperoleh tanaman haploid atau haploid ganda.
Perkembangan penelitian haploidisasi pada anyelir menjanjikan setelah Sato et al. (2000) mendapatkan tanaman haploid ganda melalui pseudofertilisasi menggunakan serbuk sari yang diiradiasi dengan sinar X sebagai sumber gamet jantan. Kemudian dengan metode yang sama Dolcet-Sanjuan et al. (2001) mendapatkan haploid ganda tanaman anyelir yang tahan terhadap Fusarium
yang akan dilakukan yaitu dengan mengkombinasikan prosedur-prosedur dari penelitian sebelumnya.
❏❑ ▲tor yang mempengaruhi induksi haploid/haploid ganda
Menurut Wedzonyet al. (2009) faktor-faktor yang mempengaruhi induksi haploid/haploid ganda ialah (1) genotipe dari tanaman donor, (2) kondisi fisiologis tanaman donor (contoh pertumbuhan pada suhu lebih rendah dan pencahayaan yang tinggi), (3) tahap perkembangan serbuk sari dan ovul, (4) praperlakuan (contoh perlakuan suhu rendah pada bunga untuk dikultur, perlakuan panas pada kultur serbuk sari), (5) komposisi media kultur (termasuk perlakuan cekaman karbohidrat atau starvasi atau elemen makro diikuti dengan subkultur pada media regenerasi) dan (6) faktor fisik selama kultur (cahaya, suhu).
Induksi Haploid dan Haploid Ganda
1. Induksiin vitrohaploid melalui Androgenesis
Androgenesis ialah proses induksi dan regenerasi haploid dan haploid ganda yang berasal dari sel gamet jantan (Bohanec 2009, Wedzony et al. 2009). Metode ini banyak digunakan dan efektif pada beberapa spesies tanaman dan berpotensi untuk eksploitasi pada tanaman-tanaman komersial (Murovec & Bohanec 2012). Metode ini berdasar pada kemampuan serbuk sari dan serbuk sari yang belum masak mengubah lintasan perkembangannya dari gametofitik (pembentukan serbuk sari masak) ke sporofitik menghasilkan pembelahan sel pada level haploid diikuti pembentukan kalus atau embrio pada media kultur (Murovec & Bohanec 2012).
13
▼◆ ❖ P◗u❘❙ ❚ in vitro❯❱❲loid melalui Ginogenesis
Induksi secarain vitro haploid maternal yang dikenal dengan ginogenesis merupakan lintasan lain untuk memproduksi embrio haploid dari gamet betina. Metode ini dapat dilakukan melalui kultur in vitro bagian-bagian bunga yang tidak diserbuki, seperti ovul, plasenta di mana ovul melekat, ovari. Meskipun regeneran ginogenik menunjukkan stabilitas genetik yang lebih tinggi dan laju tanaman albino yang lebih rendah dibandingkan dengan regeneran androgenik, namun metode ginogenesis digunakan pada tanaman yang sulit diinduksi dengan metode lain seperti androgenesis dan metode penyerbukan lain (Bohanec 2009). Induksi ginogenesis menggunakan bagian bunga yang belum diserbuki telah berhasil pada beberapa tanaman seperti bawang, gula bit, mentimun, labu, gerbera, bunga matahari, gandum, barley dan lain-lain. Namun hanya bawang dan gula bit yang telah diaplikasikan dalam program pemuliaan (Murovec & Bohanec 2012).
Kantong embrio yang masak berisi beberapa sel haploid seperti sel telur, sinergid, antipodal dan inti polar yang tidak dibuahi, secara teori mampu membentuk embrio haploid. Pada kondisi optimal, sel telur di ovul pada spesies yang responsif mengalami perkembangan sporofitik dan dapat mengalami perkembangan menjadi tanaman haploid (Bohanec 2009).
Pada tanaman bawang rata-rata frekuensi embrio yang dapat diinduksi bervariasi antara 0% (aksesi yang tidak respon) sampai 18,6-22% (aksesi yang sangat respon), di mana tanaman donor individu memproduksi lebih dari 51,7% embrio. Tingginya frekuensi produksi haploid diuji dalam dua tahun berturut-turut dan menunjukkan kestabilan dari tahun ke tahun (Bohanec & Jakse 1999).
3. Induksi in situ haploid melalui penyerbukan dengan serbuk sari yang
diiradiasi
Penyerbukan dengan serbuk sari yang diiradiasi merupakan metode lain untuk menginduksi haploid maternal menggunakan penyerbukan intraspesifik. Namun cara ini sangat rumit karena harus mengisolasi ovul yang telah distimulasi dengan polen yang dinonaktifkan dengan iradiasi sinar x atau sinar gamma, diikuti dengan penyelamatan embrio. Perkembangan embrio distimulasi oleh perkecambahan serbuk sari pada stigma dan pertumbuhan dari tabung serbuk sari di dalam stilus, meskipun serbuk sari yang telah diiradiasi tidak dapat membuahi sel telur. Metode ini telah berhasil dilakukan pada spesies-spesies tanaman buah-buahan, tanaman hias dan tanaman industri seperti kapas (Aslam 2000; Savaskan 2002; Murovec dan Bohanec 2012).
Produksi haploid maternal dengan penyerbukan menggunakan serbuk sari yang diiradiasi memerlukan pekerjaan emaskulasi, dan dalam kasus tertentu menunjukkan keterbatasan karena pengerjaannya yang memerlukan banyak tenaga. Selain itu dosis radiasi juga berpengaruh terhadap produksi tanaman haploid. Pada dosis yang rendah inti generatif hanya sebagian yang rusak sehingga masih mampu membuahi sel telur dan menghasilkan embrio yang banyak tetapi membawa karakter mutant. Peningkatan dosis iradiasi menyebabkan penurunan jumlah embrio, tetapi diperoleh regeneran yang sebagian besar haploid (Murovec dan Bohanec 2012).
❳enomena yang muncul dalam kultur antera dan ovul secarain vitro
Teknologi haploid dengan kultur antera dan kultur ovul (tanpa fertilisasi dan fertilisasi dengan serbuk sari yang dinonaktifkan) ditujukan untuk menghasilkan tanaman haploid. Mutasi mudah terjadi dalam kultur antera, dalam bentuk variasi somaklonal akibat dari aplikasi kultur jaringan secara in vitro. Keragaman somaklonal didefinisikan sebagai keragaman genetik dari tanaman yang dihasilkan oleh sel somatik tanaman yang ditumbuhkan secara in vitro (Larkin & Scowcroft 1981)
Dalam kultur antera sering timbul masalah seperti munculnya tanaman albino dan mutasi dengan frekuensi kejadian bervariasi tergantung tanaman donor dan kondisi kulturin vitro. Salah satu kejadian yang penting adalah metilasi yang tidak normal pada DNA tanaman hasil kultur jaringan. Metilasi merupakan proses penambahan group metil pada cincin sitosin oleh enzim methyltransferase (Antequera & Bird 1988).
15
protein MADS-box ialah gen yang berperan sebagairepressorpembungaan. Pada suhu dingin ekspresi gen sangat rendah dan terjadi demetilasi, sehingga proses pembungaan dapat berlangsung (Finnegan et al. 1998). Abormalitas juga terjadi pada penentuan identitas organ bunga yang terbentuk karena ketidakseimbangan dari kelompok gen identitas organ pembungaan yang terkait dengan model ABC dalam perkembangan bunga. Meristem pembungaan dibagi menjadi tiga kelompok aktivitas gen yang saling overlapping, yang setiap kelompok merupakan dua lingkaran (whorl) yang berdampingan. Kelompok gen A bekerja untuk perkembangan sepal dan petal. Ketidakhadiran APETALA1 (AP1) dan
APETALA2 (AP2) menyebabkan sepal dan petal gagal berkembang, sehingga membentuk mutan ap1 dan ap2. Kelompok gen B bekerja untuk perkembangan petal dan stamen yang secara normal ditemukan pada lingkaran bunga ke 2 dan 3. Produk MADS-box gen APETALA3 (AP3), PISTILATA (PI) dan SEPALATA3 (SEP3) berinteraksi menentukan fungsi gen B dan mutan dari kedua gen ini ialah
ap3, pidan sep3. Sedangkan kelompok gen C untuk perkembangan stamen dan karpel yang ditemukan pada lingkaran bunga ke 3 dan 4. Aktivitas AGAMOUS
17
❨❩❬❭❪❩ ❫❴ ❫❵❵❛ ❜❝❛ ❞❡❫❢❣❫❢ ❝❬❢❤❬❵❡❬❢❣❫✐
❞❪❝ ❜❥ ❨❵ ❥❜❫
❭ ❫❢❥ ❦❬ ❧
Dianthus chinensis
❧♠♥bstrak
Stadia perkembangan mikrospora dan ovul yang tepat sangat menentukan keberhasilan mendapat tanaman haploid melalui androgenesis dan ginogenesis. Tujuan penelitian ialah mendapatkan penanda morfologi bunga dan stadia yang tepat dari perkembangan mikrospora dan ovu. Studi biologi bunga meliputi studi tahap perkembangan bunga, penghitungan jumlah dan ukuran mikrospora, rasio tahap perkembangan mikrospora, viabilitas mikrospora dan seleksi stadia mikrospora dan ovul yang tepat untuk inisiasi kultur mikrospora dan ovul.. Hasil penelitian menunjukkan bahwa ukuran kuncup bunga dan warna antera merupakan indikator waktu dilakukan pengambilan donor eksplan. D. chinensis Dchi-11 memiliki jumlah dan viabilitas mikrospora tertinggi (60,36%). Tahap perkembangan mikrospora dengan persentaselate-uninucleate tertinggi (44,64%) pada saat ukuran kuncup bunga T2 (ukuran kuncup antara 1,31 1,50 cm, warna antera putih, umur 5 hari, pencoklatan antera paling rendah). Tahap perkembangan ovul T7 (ukuran kuncup antara 1,81 2.00 cm, panjang petal 30% lebih panjang dari panjang sepal, umur 10 hari) merupakan tahap yang tepat untuk induksi kultur ovul berdasarkan persentase pembentukan kalus (59,375%) dengan tipe kalus remah dan agak remah dan berwarna hijau.
♦♣ qrs t ✉✉✈ t ✇①② ③ qrr①④①✈ t⑤⑥①⑦♣ ⑧⑥⑨⑩② t♦ ⑤t②①
❶⑦ rt④q✈① t ✉
Dianthus chinensis
✈❷❸bstract
The study of anther or microspore and ovule critical development were important to determine the successfull of obtaining haploid plants through androgenesis and gynogenesis. The aim of the research was to determine mophological indicator of bud, dominan uninucleate microspore and the right ovule development stage for. Flower biological study comprised study of flower development, the number and size of microspore, ratio of microspore development stage, microspore viability and selection of the right microspore and ovule stage for culture initiation of microspore and ovul. The research showed that bud size and anther color are indicators for isolating donor explants. D. chinensis Dchi-11 has the highest microspore number and viability (60.36%). Bud size of T2 stage (44,64%, 1.31 1.50 cm, white anther color, 5 days old, and the lowest browning anther) produce the highest late uninucleate microspore. Ovule development of T7 (1.81 2,00 cm, the length of petals are 30% longer than sepals length, 10 days old) was the right stage for ovule culture based on percentage of callus formation ((59,375%) and friable green callus.
19
❹endahuluan
Aplikasi teknologi kultur antera dan ovul pada tanaman anyelir masih jarang, oleh karena itu pengembangan penelitian ini dimulai dari studi tanaman donor, kajian khusus mengenai biologi bunga dan perkembangannya (morfologi maupun mikroskopi), studi perkembangan mikrospora, metode kultur; pemilihan pra-perlakuan yang optimal; pengembangan media inisiasi, regenerasi dan pemasakan embrio; analisis ploidi; penggandaan kromosom yang menjadi bagian penting dalam pengembangan teknologi haploid pada anyelir. Dari berbagai kajian mendasar tersebut pada akhir studi diharapkan dapat ditemukan teknologi haploid anyelir yang efektif, efisien, mudah diproduksi (reproducible) dan mudah diulang (repeatable).
Induksi tanaman haploid melalui kultur in vitro antera, ovul dan ovari yang tidak diserbuki menjadi pendekatan yang biasa dilakukan untuk mendapatkan tanaman haploid pada beberapa tanaman. Pada beberapa spesies tanaman, efisiensi induksi haploid sangat bervariasi dan terdapat banyak kendala yang dapat mengurangi keberhasilan protokol yang telah dihasilkan (Musialet al. 2005). Tahap perkembangan eksplan merupakan salah satu faktor penting yang mempengaruhi induksi haploid (Yang & Zhou 1982). Namun studi yang berkaitan dengan tahap perkembangan eksplan sedikit dipublikasi. Pada androgenesis tahap perkembangan serbuk sarinya mudah diamati, sedangkan pada ginogenik tahap perkembangan dalam kantong embrio lebih sulit diamati. Hasil-hasil penelitian yang telah dilakukan pada umumnya tahap perkembangan megagametofit yang digunakan untuk induksi ginogenik ialah pada tahap kantong embrio masak (Musial et al.2005). Namun menurut Bhojwani dan Thomas (2001) pada tahap kantong embrio muda lebih sesuai untuk diinduksi karena sel gamet betina melanjutkan perkembangannya sampai sel-sel yang ada dalam kantong embrio telah berdiferensiasi.
Tahap perkembangan polen merupakan faktor yang penting untuk androgenesis in vitro, maka pemilihan tanaman donor untuk studi ini sangat penting. Berkenaan dengan hal tersebut korelasi antara tahap perkembangan polen dan morfologi kuncup (panjang petal, munculnya petal dari kelopak dan lain-lain), bervariasi antara spesies dan umur tanaman donor. Antera yang paling responsif biasanya pada tahap perkembangan serbuk sari uninukleat yaitu pada tahap antara tetrad dan mitosis polen pertama (Heberle-Bors 1985). Sementara pada ginogenesis meskipun gametofit betina melanjutkan perkembangannya selama kultur in vitro, perkembangan tahap awal kantong embrio sampai tahap masak perlu diuji untuk melihat potensi perkembangan masing-masing tahap perkembangannya. Tujuan penelitian adalah menentukan indikator morfologi dari tahap perkembangan kuncup, stadia perkembangan serbuk sari uninukleat dominan serta stadia ovul yang tepat untuk digunakan dalam kultur antera, ovul dan pseudofertilisasi
n etode
Penelitian dilakukan di Laboratorium Kultur Jaringan dan Rumah Sere Anyelir, Balai Penelitian Tanaman Hias Segunung, Laboratorium Mikroteknik, Departemen Agronomi dan Hortikultura, Institut Pertanian Bogor, dan Laboratorium Anatomi dan Sitologi Puslitbang Biologi LIPI, Cibonong mulai April 2009 Maret 2010. Bahan tanaman yang digunakan ialah kuncup dari lima genotipe Dianthus chinensis Dchi-11, Dchi-12, Dchi-13, Dchi-14 dan Dchi-15 (Gambar 2).
Gambar 2. Morfologi bunga lima genotype Dianthus chinensis (A) Dchi-11, (B) Dchi-12, (C) Dchi-13, (D) Dchi-14 dan (E) Dchi-15
Perkembangan kuncup bunga
Studi biologi ini difokuskan untuk melihat perkembangan bunga sejak kuncup bunga terlihat hingga bunga mekar sempurna. Berbagai peubah yang menyangkut ukuran kuncup bunga: panjang, lebar, diameter dan pengamatan
21
antera, serbuk sari dan ovul dari tanaman donor, diamati dan diukur. Studi biologi ini melibatkan aplikasi anatomi sederhana (baik irisan lintang maupun membujur) dan pewarnaan (haematoxilin, fuchsin, Metilen-blue, orcein dan aceto-carmin) untuk membantu memperjelas pengamatan. Studi ini akan dibandingkan langsung dengan studi tahap perkembangan serbuk sari dan ovul untuk menentukan tahap yang tepat untuk pengambilan tanaman donor.
Perkembangan antera dan serbuk sari
Penghitungan jumlah dan ukuran serbuk sari
Untuk penghitungan jumlah serbuk sari, 2-3 antera dipanen, seluruh serbuk sarinya dikeluarkan dari kotak spora, kemudian dilarutkan dalam 1 ml media cair embriogenesis. Suspensi serbuk sari dibuat sehomogen mungkin melalui pengocokan menggunakan vortex. Setelah dirasa cukup homogen, sampel dipipet dan diletakkan di atas haemacytometer, dan ditutup dengan gelas penutup, diamati di bawah mikroskop. Serbuk sari dihitung menggunakan rumus A = (n x B)/N (Godini 1979), n : jumlah serbuk sari dalam setiap kotak, B = 10.000/jumlah kotak yang dihitung dan N = jumlah antera yang digunakan. Ukuran serbuk sari diukur menggunakan mikrometer okuler yang telah dikalibrasi. Pengukuran dilakukan sebanyak mungkin mewakili jumlah serbuk sari secara keseluruhan. Hasil penghitungan dan pengukuran selanjutnya ditampilkan dalam bentuk data rata-rata dan standar deviasinya untuk setiap tanaman donor.
Studi rasio tahap perkembangan serbuk sari
sel yang diamati dikalikan 100 untuk mengetahui persentasenya. Rasio perkembangan dihitung dengan membandingkan frekuensi perkembangan serbuk sari early uninucleate,mid uninucleate, late uninucleate, early binucleate dan
binucleate yang ada dalam satu bidang pandang pengamatan. Frekuensi setiap tahap perkembangan serbuk sari dihitung dan dibagi total serbuk sari yang diamati pada tahap kuncup yang sama. Pengamatan dilakukan minimal pada 5 bidang pandang dan diulang minimal 5 kali untuk mendapatkan data yang valid.
Uji viabilitas serbuk sari
Pengujian viabilitas atau vitalitas sel serbuk sari atau polen menggunakan larutan kerja 10 µM fluorescein diacetate (FDA) (Custers et al. 2001). Larutan serbuk sari (90 µl) ditempatkan dalam Eppendorf yang telah dibungkus dengan aluminium ditambah 10 µl larutan stok FDA ke dalam larutan kultur serbuk sari dan diaduk rata, ditempatkan dalam gelap 10 menit. Sebanyak 50-100µl kultur serbuk sari yang telah diberi perlakuan FDA dipipet dan ditetes di atas kaca obyek dan ditutup dengan kaca penutup, dan segera dilakukan pengamatan di bawah mikroskop fluoresen. Jumlah serbuk sari yang memendarkan warna hijau diamati dan dihitung. Pengamatan diulang minimal pada 5 bidang pandang pengamatan. Viabilitas atau vitalitas sel (%) dihitung dengan membagi jumlah total sel yang fluoresen dengan jumlah total sel yang diamati pada satu bidang pandang dikalikan dengan 100%.
Seleksi tahap perkembangan kuncup bunga pada berbagai media inisiasi double layer untuk kultur antera
23
1999), (4) M4 (Satoet al,2000) dan (5) M5 (Fuet al. 2008). Setiap unit perlakuan diulang 10 kali. Setiap ulangan terdiri atas 1 cawan petri yang berisi 10 antera.
Isolasi antera dilakukan dengan cara membersihkan kuncup bunga dengan kapas yang dibasahi alkohol 70%, kemudian dilewatkan di atas api sekilas. Antera diisolasi dengan cara membuka kuncup bunga, kemudian antera dan filament dipisahkan, dan ditanam dalam media induksi. Metode kultur sebar mikrospora antera (anther shed microspore culture) pada media double layer digunakan dalam penelitian ini. Prosedur penelitian menggunakan prosedur standard dari Dolcet-Sanjuanet al. 1997.Media embriogenesis yang digunakan disusun dengan sistem double layer yang tersusun atas dua lapisan yaitu lapisan padat di bawah dan cair di atas. Media padat ditambahkan 0,5% arang aktif , dengan pH 5,8. Pengamatan dilakukan terhadap persentase pencoklatan dan kontaminasi.
Perkembangan ovari atau ovul
Pembuatan sayatan kuncup bunga D. chinensis
Bahan difiksasi di dalam larutan FAA (formali : asam asetat glasial : alkohol 70% (v/v) = 5 :5 :90) selama 24 jam. Selanjutnya didehidrasi secara bertahap menggunakan alkohol 50% 100% masing-masing selama 30 menit. Kemudian dilakukan dealkoholisasi secara bertahap menggunakan campuran alkohol-xylol, dilanjutkan dengan xylol murni 1 dan 2 masing-masing 30 menit. Parafin diinfiltrasi sedikit demi sedikit sampai jenuh dan disimpan dalam oven dengan suhu 60oC selama 3 jam. Parafin diganti dengan parafin baru dan disimpan dalam oven dengan suhu 50-60oC selama 3 hari. Sampel dimasukkan dalam parafin, kemudian blok sampel disayat dengan ketebalan 15-17 µm menggunakan mikrotom putan (Yamato RV-240). Sayatan parafin yang berrbentuk pita di rekatkan pada gelas objek yang telah diolesi dengan larutan albumin-gliserin dan dikeringkan di atas hot plate dengan suhu 40oC selama 3-5 jam. Sampel diwarnai dengan safranin 2% (b/v) dan fastgreen 0,5% (b/v).
Seleksi tahap perkembangan kuncup bunga untuk kultur ovula tau ovari
sebelum diisolasi. Masing-masing tahap tersebut ditanam dalam media MS + 4,52 µM 2,4-D+ 4.44 µM BAP + 20 g L-1sukrosa (Mosquera et al. 1999), yang diuji responnya dalam induksi pembentukan kalus. Setiap unit perlakuan diulang 8 kali. Setiap ulangan terdiri atas 1 cawan petri yang berisi 4 potongan ovul. Semua kultur diinkubasi pada kondisi gelap ± selama 7 hari pada suhu 4 oC dilanjutkan dengan inkubasi terang pada suhu 25oC dengan lama penyinaran 16 jam di bawah lampu fluoresen (13 µmol.m-2.s-1) hingga kalus terbentuk. Peubah yang diamati dalam percobaan ini ialah persentase eksplan membentuk kalus (%), dan pengamatan kalus secara visual. Pengamatan dilakukan 1 bulan setelah inisiasi kultur.
Analisis statistik
Data pengamatan yang diperoleh dari hasil seleksi tahap perkembangan kuncup bunga untuk kultur ovul atau ovari, dianalisis menggunakan analisis ragam (ANOVA) dengan program SAS Release window 9.1. Data dalam bentuk persen ditransformasi ke dalam Arcsin. Untuk nilai 0% sebelum ditransformasi diganti dengan 1/4n, di mana n adalah jumlah satuan percobaan dari data persentase yang diperoleh. Jika terdapat perbedaan nilai rata-rata perlakuan maka dilakukan uji lanjutan menggunakan uji jarak berganda Duncan pada taraf kepercayaan 5%.
❺ ❻❼ ❽l
Perkembangan kuncup bunga
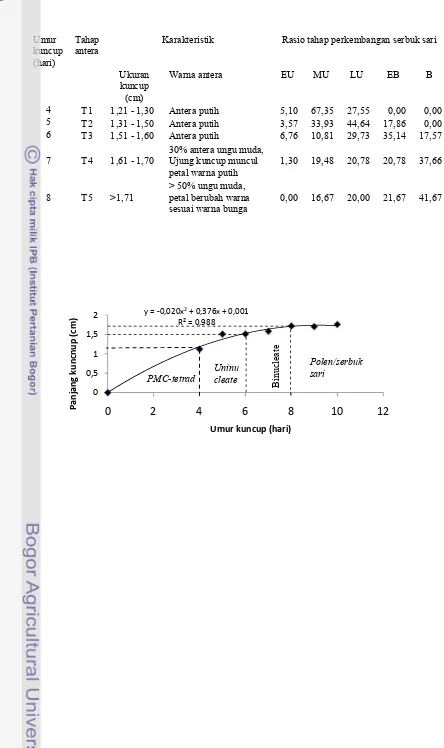
Inisiasi bunga ditandai dengan munculnya daun-daun kecil pada ujung tunas. Hari ke empat setelah inisiasi bunga ditentukan sebagai tahap perkembangan kuncup bunga T1. Pada tahap tersebut mikrospora didominasi oleh
pollen mother cell (PMC) dan tetrad. Hari ke lima setelah inisiasi bunga ditentukan sebagai tahap perkembangan kuncup bunga T2 yang didominasi oleh mikrospora mid uninukleat. Tahap T3 yang didominasi oleh mikrospora late uninukleat pada hari ke enam setelah inisiasi bunga dan seterusnya sampai bunga mekar sebagai tahap T10 pada hari ke 13 setelah inisiasi kuncup bunga.
25
kelihatan, dan tahap T5 ujung petal berubah warna menjadi pink. Tahap selanjutnya warna petal berubah menjadi kemerahan (Gambar 3). Ukuran panjang kuncup bunga setiap genotipe berbeda-beda. Panjang kuncup D. chinensis merupakan ukuran panjang kelopak, dan tidak berubah sampai bunga mekar. Pada tahap T2 berkisar 1,295 cm pada Dchi-13 sampai 1,535 cm pada Dchi-15 (Lampiran 1).
Gambar 3. Perkembangan kuncup bunga, ovari dan antera Dianthus chinensis Dchi-11. T1 sampai T10 adalah 4 sampai 13 hari setelah inisiasi bunga. Bar = 0,5 cm
Perkembangan antera dan serbuk Sari
Pengamatan antera dan serbuk sari
Masa reseptif putik dan kemasakan polen D. chinenesis tidak terjadi secara bersamaan. Serbuk sari D. chinenesis masak lebih dahulu dibandingkan putik. Antera terbuka dan mengeluarkan polen pada umur 14 16 hari setelah inisiasi bunga. Pengamatan antera dilakukan dari T1 sampai T7. Pengamatan tahap terakhir pada tahap T7 karena pada tahap tersebut 100% antera dalam satu kuncup sudah berwarna ungu tua.
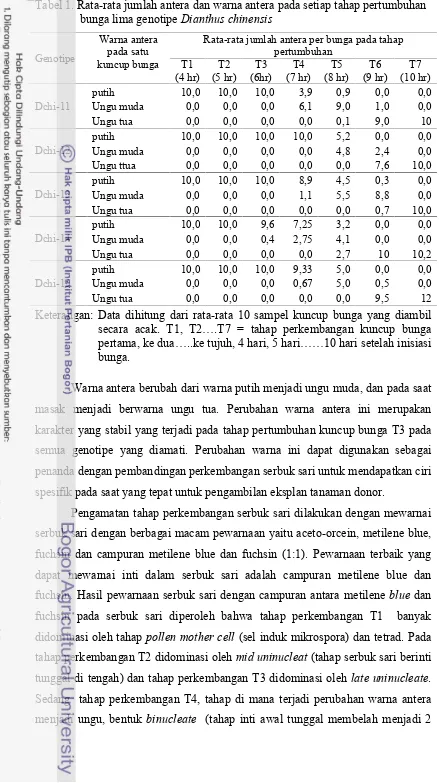
Tabel 1. Rata-rata jumlah antera dan warna antera pada setiap tahap pertumbuhan
Rata-rata jumlah antera per bunga pada tahap pertumbuhan
Keterangan: Data dihitung dari rata-rata 10 sampel kuncup bunga yang diambil secara acak. T1, T2 .T7 = tahap perkembangan kuncup bunga pertama, ke dua ..ke tujuh, 4 hari, 5 hari 10 hari setelah inisiasi bunga.
Warna antera berubah dari warna putih menjadi ungu muda, dan pada saat masak menjadi berwarna ungu tua. Perubahan warna antera ini merupakan karakter yang stabil yang terjadi pada tahap pertumbuhan kuncup bunga T3 pada semua genotipe yang diamati. Perubahan warna ini dapat digunakan sebagai penanda dengan pembandingan perkembangan serbuk sari untuk mendapatkan ciri spesifik pada saat yang tepat untuk pengambilan eksplan tanaman donor.
27
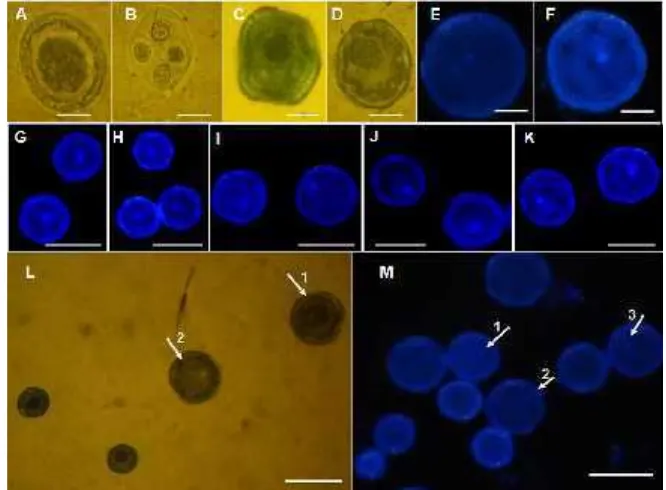
yaitu inti generatif dan vegetatif) mulai muncul (Gambar 4A-D). Tahap inti
binucleateini hanya dapat dilihat dengan pewarnaan DAPI (Gambar 4F) dan tidak dapat dilihat dengan pewarnaan campuran metilene blue dan fuchsin (Gambar 4L1).
Gambar 4. Tahap perkembangan serbuk sari. Pewarnaan mikrospora dengan Fuchsin + Metilen-blue (A-D dan L) dan DAPI (E-K, M). (A) PMC (pollen mother cell); (B) tetrad; (C, G) early uninucleate; (H) mid uninucleate; (D, I) late uninucleate; (E) serbuk sari dengan dua inti identik (F) serbuk sari tahap binucleate dengan inti vegetatif (warna pudar) dan inti generatif (warna terang). (L, M) Serbuk sari dengan ukuran yang berbeda: (1) serbuk sari berinti 1, (2) serbuk sari tanpa inti, (3) serbuk sari berinti 2, (A D) bar = 10 µm; (G-K) bar = 15 µm (L-M) bar = 25 µm
Jumlah serbuk sari dan ukurannya
Hasil pengamatan yang dilakukan pada lima genotipe menunjukkan bahwa rata-rata jumlah serbuk sari per antera berkisar 4000 64000 (Tabel 2). Jumlah serbuk sari yang terkandung dalam antera akan berpengaruh terhadap jumlah antera yang harus diisolasi, dan terkait dengan kepadatan antera dalam kultur. Kepadatan antera memiliki pengaruh fisik dan biokimia pada pembentukan embrio. Pada kepadatan yang rendah antera akan memisah pada media, sedangkan pada kepadatan yang tinggi akan cenderung mengelompok.