Lampiran 2. Gambar tanaman, Rimpang, dan simplisia temulawak (Curcuma xanthorrhiza Roxb.)
(a) (b)
(c) (d)
(e)
Keterangan :
a : Tanaman temulawak b : Rimpang temulawak
c : Rimpang temulawak yang dikeringkan
d : Simplisia temulawak
Lampiran 3. Bagan pembuatan simplisia
Skrining Fitokimia
Dikeringkan di lemari pengering
Disimpan dalam wadah yang tertutup rapat sebelum digunakan Ditiriskan, diiris tipis setebal 3-5 mm
Ditimbang berat keringnya
Dihaluskan dengan blender Dicuci dari pengotor
Ditimbang berat basahnya
Serbuk Simplisia Simplisia Rimpang temulawak
Pembuatan ekstrak
Senyawa golongan :
• Alkaloid
• Glikosida
• Flavonoid
• Steroid/Triterpenoid
• Saponin
• Tanin Karakterisasi
• Makroksopik
• Mikroskopik
• Penetapan Kadar Air
• Penetapan Kadar Sari Larut Air
• Penetapan Kadar sari Larut Etanol
• Penetapan Kadar Abu Total
Lampiran 4. Gambar mikroskopik rimpang temulawak
Keterangan:
1 = Fragmen parenkim korteks
2 = Fragmen pembuluh angkut xylem dengan penebalan tangga 3 = rambut penutup
4 = serabut sklerenkim
5 = fragmen jaringan gabus poligonal 6 = butir pati diperbesar
1
4 3 6
Lampiran 6. Perhitungan hasil karakterisasi simplisia 1. Penetapan kadar air
Kadar air = Volume air (mL)
Berat sampel (g) × 100%
No Berat sampel Volume air (mL) Kadar air (%) 1 2 3 2,07 2,05 2,00 0,15 0,15 0,14 7,25 % 7,32% 7,00 % Kadar air I = 0,15
2,07 × 100% = 7,25%
Kadar air II = 0,15
2,05 × 100% = 7,32%
Kadar air III = 0,14
2,00 × 100% = 7,00%
Kadar air rata-rata = 7,25 %+7,32 %+7,00 %
3 = 7,19 %
2. Penetapan kadar sari larut etanol
Kadar sari larut etanol = Berat sari (g)
Berat sampel (g) ×
100
20 × 100%
Lampiran 6 (Lanjutan)
Kadar sari larut etanol I = 0,1572
5,00 × 100
20
× 100% = 15,72%
Kadar sari larut etanol II = 0,2578
5,00 × 100
20 × 100% = 25,78%
Kadar sari larut etanol III = 0,2517
5,00 × 100
20
× 100% = 25,17%
Kadar sari larut etanol rata-rata = 15,72%+25,78%+25,17%
3
= 22,23%
3. Penetapan kadar sari larut air
Kadar sari larut air = Berat sari (g)
Berat sampel (g) ×
100
20 × 100%
No Berat sampel Berat sari (g) Kadar sari larut air (%) 1 2 3 5,00 5,00 5,00 0,2867 0,2857 0,2873 28,67% 28,57% 28,73%
Kadar sari larut air I = 0,2867
5,00 ×
100
20 × 100% = 28,67%
Kadar sari larut air II = 0,2857
5,00 ×
100
20 × 100% = 28,57%
Kadar sari larut air III = 0,2873
5,00 ×
100
20 × 100% = 28,73%
Kadar sari larut air rata-rata = 28,67%+28,57%+28,73%
Lampiran 6 (Lanjutan) 4. Penetapan kadar abu total
Kadar abu total = Berat abu (g)
Berat sampel (g) × 100%
No Berat sampel Berat abu (g) Kadar abu total (%) 1 2 3 2,0004 2,0009 2,0004 0,2794 0,2814 0,2794 13,96 14,06 13,96
Kadar abu total I = 0,2794
2,0004 × 100% = 13,96%
Kadar abu total II = 0,2814
2,0009 × 100% = 14,06%
Kadar abu total III = 0,2694
2,0004× 100% = 13,96%
Kadar abu total rata-rata = 5,56%+4,01%+4,4%
3 = 13,99%
5. Penetapan kadar abu tidak larut asam
Kadar abu tidak larut asam = Berat abu (g)
Berat sampel (g) × 100%
No Berat sampel Berat abu (g) Kadar abu tidak larut asam (%) 1 2 3 2,0004 2,0009 2,0004 0,0135 0,0156 0,0135 0,67 0,77 0,67 Kadar abu tidak larut asam I = 0,0135
2,0004 × 100% = 0,67%
Kadar abu tidak larut asam II = 0,0156
2,0009 × 100% = 0,77%
Kadar abu tidak larut asam III = 0,0135
2,0004 × 100% = 0,67%
Kadar abu tidak larut asam rata-rata = 0,67%+0,77%+0,67%
Lampiran 7 Contoh perhitungan bahan tablet dengan bahan pengikat amilum, Na CMC, PVP
Formula 1 (Amilum 10%)
R/ Ekstrak kering rimpang temulawak 375 mg Pasta amilum manihot 10% b/b 30%
Talkum 1%
Mg Stearat 1%
Laktosa q.s ad 625 mg
m.f tab dtd No C
I. Rencana Kerja
1. Bobot tablet = 625 mg 2. Diameter tablet = 13 mm
3. Metode = granulasi basah 4. Bentuk tablet = bulat pipih
II. Perhitungan Bahan tiap tablet
1. Ekstrak rimpang temulawak = 375 mg
2. Pasta amilum manihot 10%
Pasta amilum manihot terpakai 30% dari berat total maka :
30/100 x 625 mg = 187,5 mg
mengandung amilum manihot sebanyak:
10/100 x 187,5 mg = 18,75 mg
Aquadest yang ditambahkan sebanyak:
187,5 – 18,75 = 168,75 mg
3. Talkum = 1/100 x 625mg = 6,25 mg
4. Mg Stearat = 1/100 x 625mg = 6,25 mg
5. Laktosa =
Lampiran 7. (Lanjutan) Formula 4 (Na CMC 2%)
R/ Ekstrak kering rimpang temulawak 375 mg
Na CMC 2 % b/b 30%
Talkum 1%
Mg Stearat 1%
Laktosa q.s ad 625 mg
m.f tab dtd No C
I. Rencana Kerja
1. Bobot tablet = 625 mg 2. Diameter tablet = 13 mm
3. Metode = granulasi basah 4. Bentuk tablet = bulat pipih II. Perhitungan Bahan
1. Ekstrak rimpang temulawak = 375 mg
2. Pasta Na CMC 2%
Pasta Na CMC terpakai 30% dari berat total maka :
30/100 x 625 mg = 187,5 mg
mengandung Na CMC sebanyak:
2/100 x 187,5 = 3,75 mg
Aquadest yang digunakan sebanyak:
187,5 – 3,75 = 183,75 mg
3. Talkum = 1/100 x 625 mg = 6,25 mg
4. Mg Stearat = 1/100 x 625 mg = 6,25 mg
5. Laktosa =
Lampiran 7. (Lanjutan) Formula 7 (PVP 4%)
R/ Ekstrak kering rimpang temulawak 375 mg
PVP 4 %
Talkum 1%
Mg Stearat 1%
Laktosa q.s ad 625 mg
m.f tab dtd No C
I. Rencana Kerja
1. Bobot tablet = 625 mg 1. Diameter tablet = 13 mm
2. Metode = granulasi basah 3. Bentuk tablet = bulat pipih II. Perhitungan Bahan
1. Ekstrak rimpang temulawak = 375 mg
2. PVP 4% = 4/100 x 625 = 25 mg
3. Talkum = 1/100 x 625 mg = 6,25 mg
4. Mg Stearat = 1/100 x 625 mg = 6,25 mg
5. Laktosa =
Lampiran 8. Hasil uji preformulasi granul
Formula Waktu Alir Lebar Tinggi
1 4,5 12,3 5,08
2 4,4 11,5 4,78
3 4,2 11,6 3,13
4 3,27 12 6,34
5 3 11,67 4,23
6 2,8 11,5 3,67
7 2,87 11,5 3,59
8 3,2 11,75 4,14
9 3,2 11,25 3,65
I. Sudut Diam :
Sudut diam = Tg ɵ= 2H D F1 : Tg ɵ = 2X 4,5
12,3 ɵ= 36,13
F2 : Tg ɵ = 2X 4,4
11,5 ɵ= 37,23
F3 : Tg ɵ = 2X 4,2
11,5 ɵ= 35,75
F4 : Tg ɵ = 2X 3,27
12 ɵ= 28,37
F5 : Tg ɵ = 2X 3
11,67 ɵ= 27,02
F6 : Tg ɵ = 2X 2,8
11,5 ɵ= 25,64
F7 : Tg ɵ = 2X 2,87
11,5 ɵ= 26,10
F8 : Tg ɵ = 2X 3,2
11,75 ɵ= 28,81
F9 : Tg ɵ = 2X 3,2
Lampiran 8. (Lanjutan) II. Indeks tap
Indeks tap = V1-V2
V1 X 100%
Indeks tap rata-rata = Indeks tap 1 + indeks tap 2 + indeks tap 3 3
F1 :
100-85 100
+
100-79 100
+
100-78 100
3
= 21,4 %F2 :
100-87 100
+
100-80 100
+
100-80 100
3
= 19,33 %F3 :
100-81 100
+
100-84 100
+
100-86 100
3
= 16,33 %F4 :
100-81 100
+
100- 82 100
+
100-83 100
3
= 18,00 %F5:
100-86 100
+
100-87 100
+
100-86 100
3
= 13,67 %F6:
100-91 100
+
100-93 100
+
100-94 100
3
= 7,33 %F7 :
100-81 100
+
100-84 100
+
100-85 100
3
= 16,17 %F8:
100-87,5 100
+
100- 86,5 100
+
100- 86 100
3
= 13,33 %F9:
100-92 100
+
100-93 100
+
100-87,5 100
Lampiran 9. Gambar tablet ekstrak temulawak
Keterangan :
Lampiran 10. Hasil uji evaluasi tablet Uji Evaluasi (Formula 1)
Waktu hancur : 3 menit 25 detik Kekerasan :
No. Kekerasan (Kg)
1 0,40
2 0,50
3 0,32
4 0,32
5 0,47
Rata-rata 0,41
Friabilitas : 12,073-11,971
11,971 X 100 % = 0,85 %
Keseragaman Bobot :
A1 = 2,84 %, A2 = 2,00% A3= 2,17% B= memenuhi persyaratan No. Bobot
(gram)
Deviasi No. Bobot (gram)
Deviasi
1 595 -3 11 600 2
2 600 2 12 610 12
3 590 -8 13 610 12
4 605 7 14 615 17
5 590 -8 15 590 -8
6 590 -8 16 585 -13
7 590 -8 17 590 -8
8 605 7 18 595 -3
9 610 12 19 605 7
10 600 2 20 585 -13
Lampiran 10. (Lanjutan) Uji Evaluasi (Formula 2) Waktu hancur : 4 menit 27 detik Kekerasan :
No. Kekerasan (Kg)
1 0,71
2 0,68
3 0,70
4 0,69
5 0,72
Rata-rata 0,70
Friabilitas : 11,980-11,880
11,880 x 100 % = 0,84 %
Keseragaman Bobot :
A1 = 2,75 %, A2 = 0,019 % A3= 2,25%
B= memenuhi persyaratan
No. Bobot (gram)
deviasi No. Bobot (gram)
Deviasi
1 585 -13,5 11 610 11,5
2 605 6,5 12 600 1,5
3 590 -8,5 13 595 -3,5
4 590 -8,5 14 600 1,5
5 600 1,5 15 610 11,5
6 610 11,5 16 605 6,5
7 595 -3,5 17 585 -13,5
8 615 16,5 18 595 -3,5
9 595 -3,5 19 585 -13,5
10 615 16,5 20 595 -3,5
Lampiran 10. (Lanjutan) Uji Evaluasi (Formula 3) Waktu hancur : 4 menit 55 detik Kekerasan :
No. Kekerasan (Kg)
1 0,91
2 0,94
3 1,63
4 0,92
5 0,95
Rata-rata 1,07
Friabilitas : 12,036-11,940
11,940 x 100 % = 0,81 %
Keseragaman Bobot :
A1 = 1,46 %, A2 = 2,04 % A3= 3,67 %
B= memenuhi persyaratan
No. Bobot (gram)
Deviasi No. Bobot (gram)
Deviasi
1 590 -22,5 11 600 -12,5
2 590 -22,5 12 585 -27,5
3 595 -17,5 13 625 12,5
4 590 -22,5 14 625 12,5
5 590 -22,5 15 625 12,5
6 625 12,5 16 635 22,5
7 620 7,5 17 640 27,5
8 615 2,5 18 640 27,5
9 625 12,5 19 640 27,5
10 590 -22,5 20 605 -7,5
Lampiran 10. (Lanjutan) Uji Evaluasi (Formula 4) Waktu hancur : 15 menit 48 detik Kekerasan :
No. Kekerasan (Kg)
1 0,79
2 0,78
3 0,81
4 0,82
5 0,80
Rata-rata 0,80
Friabilitas : 12,228-12,220
12,220 x 100 % = 0,06 %
Keseragaman Bobot :
A1 = 2,45 %, A2 = 1,63 % A3= 4,09 % B= memenuhi persyaratan No. Bobot
(gram)
Deviasi No. Bobot (gram)
Deviasi
1 625 15 11 600 -10
2 625 15 12 620 10
3 620 10 13 620 10
4 595 -15 14 600 -10
5 610 0 15 605 -5
6 595 -15 16 615 5
7 610 0 17 625 15
8 600 -10 18 615 5
9 585 -25 19 605 -5
10 625 15 20 605 -5
Lampiran 10. (Lanjutan) Uji Evaluasi (Formula 5) Waktu hancur : 16 menit 00 detik Kekerasan :
No. Kekerasan (Kg)
1 0,97
2 0,91
3 0,92
4 0,93
5 0,92
Rata-rata 0,93
Friabilitas : 12,225-12,220
12,220 X 100 % = 0,04 %
Keseragaman Bobot :
A1 = 3,03 %, A2 = 2,20 % A3= 3,61 %
B= memenuhi persyaratan
No. Bobot (gram)
Deviasi No. Bobot (gram)
Deviasi
1 615 13,25 11 605 3,25
2 580 -21,75 12 595 -6,75
3 590 -11,75 13 605 3,25
4 580 -21,75 14 620 18,25
5 610 8,25 15 615 13,25
6 600 -1,75 16 620 18,25
7 605 3,25 17 605 3,25
8 605 3,25 18 600 -1,75
9 590 -11,75 19 580 -21,75
10 620 18,25 20 595 -6,75
Lampiran 10. (Lanjutan) Uji Evaluasi (Formula 6) Waktu hancur : 16 menit 25 detik Kekerasan :
No. Kekerasan (Kg)
1 1,04
2 1,07
3 1,10
4 1,02
5 1,02
Rata-rata 1,05
Friabilitas : 12,223-12,220
12,220
x 100 % = 0,02 %
Keseragaman Bobot :
A1 = 2,99 %, A2 = 2,15 % A3= 3,65 %
B= memenuhi persyaratan
No. Bobot (gram)
Deviasi No. Bobot (gram)
Deviasi
1 590 -12 11 590 -12
2 595 -7 12 595 -7
3 615 13 13 605 3
4 580 -22 14 600 -2
5 610 8 15 615 13
6 615 13 16 620 18
7 605 3 17 610 8
8 605 3 18 600 -2
9 605 3 19 580 -22
10 620 18 20 595 -7
Lampiran 10. (Lanjutan) Uji Evaluasi (Formula 7) Waktu hancur : 5 menit 92 detik Kekerasan :
No. Kekerasan (Kg)
1 1,90
2 2,31
3 1,84
4 0,87
5 0,84
Rata-rata 1,55
Friabilitas : 12,073-12,070
12,070 x 100 % = 0,02 %
Keseragaman Bobot :
A1 = 3,79% A2 = 2,04 % A3= 2,31 %
B= memenuhi persyaratan
No. Bobot (gram)
Deviasi No. Bobot (gram)
Deviasi
1 565 -8,25 11 570 -3,25
2 595 21,75 12 575 1,75
3 565 -8,25 13 570 -3,25
4 580 6,75 14 575 1,75
5 565 -8,25 15 570 -3,25
6 565 -8,25 16 570 -3,25
7 570 -3,25 17 570 -3,25
8 560 -13,25 18 575 1,75
9 570 -3,25 19 585 11,75
10 575 1,75 20 595 21,75
Lampiran 10. (Lanjutan) Uji Evaluasi (Formula 8) Waktu hancur : 6 menit 13 detik Kekerasan :
No. Kekerasan (Kg)
1 1,92
2 2,31
3 2,83
4 2,74
5 2,85
Rata-rata 2,53
Friabilitas : 12,300-12,260
12,260 x 100 % = 0,3 %
Keseragaman Bobot :
A1 = 1,54% A2 = 0,73 % A3= 0,89 %
B= memenuhi persyaratan
No. Bobot (gram)
Deviasi No. Bobot (gram)
Deviasi
1 615 -0,5 11 625 9,5
2 625 9,5 12 625 9,5
3 605 -10,5 13 610 -5,5
4 600 -15,5 14 625 9,5
5 625 9,5 15 625 9,5
6 605 -10,5 16 620 4,5
7 600 -15,5 17 615 -0,5
8 610 -5,5 18 610 -5,5
9 620 4,5 19 610 -5,5
10 620 4,5 20 620 4,5
Lampiran 10. (Lanjutan) Uji Evaluasi (Formula 9) Waktu hancur : 8 menit 41 detik Kekerasan :
No. Kekerasan (Kg)
1 3,11
2 2,74
3 3,02
4 2,17
5 4,63
Rata-rata 3,13
Friabilitas : 11,344-11,340
11,340
X 100 % = 0,04 %
Keseragaman Bobot :
A1 = 2,47% A2 = 1,59 % A3= 1,94 %
B= memenuhi persyaratan
No. Bobot (gram)
Deviasi No. Bobot (gram)
Deviasi
1 575 9 11 565 -1
2 575 9 12 570 4
3 565 -1 13 580 14
4 560 -6 14 560 -6
5 560 -6 15 580 14
6 555 -11 16 560 -6
7 560 -6 17 575 9
8 565 -1 18 565 -1
9 560 -6 19 560 -6
10 575 9 20 555 -11
Lampiran 11. Alat alat yang digunakan
(a) (b)
(d)
(c) Keterangan:
a: Alat Rotary Evaporator
b: Alat uji waktu alir dan sudut diam c: Alat uji indeks tap
Lampiran 11. Alat alat yang digunakan
(e)
(e)
(f)
Keterangan:
DAFTAR PUSTAKA
Abu-izza dan Matthew, K. (2004). Fast Dissolving Tablet. USA: US patent. Halaman 790-798.
Afifah, E. (2003). Khasiat dan Manfaat Temulawak : Rimpang Penyembuh Aneka Penyakit. Jakarta : Agromedia Pustaka. Halaman 1-3, 12-13.
Ahmad, S. (2007). Khasiat dan Manfaat Temulawak. Penerbit PT. Sinar Waja Lestari. Halaman 4
Anief, M. (1993). Farmasetika. Yogyakarta: Penerbit Gadjah Mada University Press. Halaman 107.
Ansel, H .C. (1989). Pengantar Bentuk Sediaan Farmasi. Edisi IV. Jakarta: UI Press. Halaman 96.
Ariswati, W., Siswanto, A., Hartanti., D., (2010). Pengaruh Gelatin, Amilum dan PVP Sebagai Bahan Pengikat Terhadap Sifat Fisik Tablet Ekstrak Temulawak. Journal Pharmacy. 7(2): 58-59.
Banker, G. S., Anderson N. R. (1994). Tablet. Edisi III, Jilid II. Jakarta: UI-Press. Halaman 643-703.
Cartensen, J.T. (1977). Pharmaceutical of Solids and Dosage Forms. A Willey Interscience Publication. New York: John Willey and Sons. Halaman 133-135, 209-214, 216-218 dan 342.
Dalimartha, S. (2006). Atlas Tumbuhan Obat. Jilid 2. Penerbit Trubus Agriwidya (Anggota IKAPI), Jakarta. Halaman 182, 184
Depkes RI. (1995). Materia Medika Indonesia. Jilid Keempat. Jakarta: Departemen Kesehatan Republik Indonesia. Halaman 333-337.
Depkes RI. (2000). Parameter Standart Umum Ekstrak Tumbuhan Obat. Jakarta : Departemen Kesehatan RI. Halaman 9-12
Ditjen POM RI, (1979). Farmakope Indonesia. Edisi III. Jakarta:. Halaman 32, 896.
Ditjen POM RI, (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. Halaman 5, 1035.
Farnsworth, N.R. (1966). Biologycal and Phytochemical Screening of Plants. Journal of Pharmaceutical Science. 55(3): 225-276.
Hayani, E, (2006). Analisis Kandungan Kimia Rimpang Temulawak. Temu Teknis Nasional Tenaga Fungsional Pertanian. Halaman 309.
Kholidah, S., Yuliet, Khumaidi, A., (2014). Formulasi Tablet Effervescent Jahe dengan Variasi Konsentrasi Sumber Asam Basa. Online Journal of Natural Sciensce. 3(3): 216-229.
Lachman, L., Lieberman, H.A., Kanig, J.L. (1994). Teori dan Praktek Farmasi Industri. Edisi III. Jakarta: UI Press. Halaman 654.
Meilisa. (2009). Uji Aktivitas Antibakteri dan Formulasi Dalam Sediaan Kapsul dari Ekstrak Etanol Rimpang Tumbuhan Temulawak (Curcuma xanthorrhiza Roxb.) Terhadap Beberapa Bakteri. Skripsi. Medan: Fakultas Farmasi USU. Halaman. 1-3, 16-23.
Munir, M.B. (2012). Formulasi Tablet Effervescent Ekstrak Temulawak (Curcuma xanthorrhiza Roxb.). Skripsi. Depok: Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia. Halaman. 1, 25-35.
Novia, Y., Embit K., Darusman F. (2015). Pengaruh Bahan Pengikat Na CMC dan Amilum Manihot Terhadap Karakteristik Sediaan Tablet yang Mengandung Ekstrak Air dan Etanol Rimpang Kunyit (Curcuma longa L.). Skripsi. Bandung : FMIPA Unisba. Halaman 465
Parrot, L.(1971). Pharmaceutical Technology. Amerika: Burges Publishing Company. United Stated of America.Halaman 82.
Permata, N., Embit, K., Amila., G. (2015). Pengaruh Pengikat PVP Dan Amilum Manihot Serta Perbedaan Metode Ekstraksi Terhadap Karakteristik Sediaan Tablet Mengandung Ekstrak Daun Kersen (Muntingia calabura L.). Journal SPeSIA. 1(1):147.
Rowe, R., Paul J.S., Marian E.Q. (2009). Handbook of Pharmaceutical Excipients. Edisi VI. Pharmaceutical Press. USA. Halaman 118, 196, 685.
Rukmana, R. (2006). Temulawak Tanaman Rempah Dan Obat. Penerbit Kanisius (Anggota IKAPI), Yogyakarta. Halaman 14.
Sahoo, P.K. (2007). Pharmaceutical Technology: Tablets. New Delhi: Delhi Institute of Pharmaceutical Sciences and Research. Halaman 5-10.
Sharma, R., Rajput, M., Prakash, P., Sharma, S. (2011). Fast Disolving Delivery System On review. International Journal of Pharmacy. 2(10): 21-29. Siregar, C.J.P., Wikarsa, S. (2010). Teknologi Farmasi Sediian Tablet
Dasar-Dasar Praktis. Cetakan II. Penerbit Buku Kedokteran EGC. Jakarta. Halaman 1-2,8,416-418.
Soekemi, R.A., Tanuwijaya, Y., Aminah, F., dan Usman, S. (1987). Tablet. Medan: PT. Mayang Kencana. Halaman 5 dan 54.
Suharjo, J.B. (2010). Hepatitis B: Cegah Kanker Hati. Yogyakarta: Kanisius. Halaman 51.
Voight, R. (1995). Buku Pelajaran Teknologi Farmasi. Cetakam II. Penerjemah: Soedani N. S. UGM-Press. Yogyakarta. Halaman 159.
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode eksperimental yang meliputi tahap penyiapan sampel, indentifikasi sampel, pembuatan simplisia, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak, uji preformulasi massa cetak tablet, pencetakan tablet dan evaluasi tablet. Penelitian ini dilaksanakan di laboratorium Teknologi Sediaan Farmasi II dan Laboratorium Farmakognosi Fakultas Farmasi Universitas Sumatera Utara pada bulan Februari hingga Juni 2016.
3.1 Alat- alat yang digunakan
Alat-alat yang digunakan pada penelitian ini adalah Blender (Philips), corong pisah, cawan porselen, penjepit tabung, cawan porselen berdasar rata, desikator, rotary evaporator (Haake D), mikroskop, kertas saring, oven (Memmert), pipet tetes, neraca kasar, penangas air, ayakan mesh 12, mesh 20, mesh 100, batang pengaduk, hardness tester (Copley), lemari pengering, mesin cetak tablet single punch (Erweka), lumpang dan alu, kertas perkamen, neraca analitis (Ohaus), Roche friabilator (Erweka), spatula, spatel, stopwatch dan sejumlah alat gelas lainnya.
3.2 Bahan-bahan yang digunakan
polivinilpirolidon (PVP), amilum manihot, natrium karboksimetil selulosa (Na CMC), talkum, Magnesium stearat dan bahan-bahan berkualitas proanalisa : α -naftol, amil alkohol, asam nitrat pekat, asam asetat anhidrat, asam klorida pekat, asam sulfat pekat, besi (III) klorida, bismuth nitrat, iodium, isopropanol, kalium iodida, kloroform, metanol, natrium hidroksida, natrium klorida, n-heksana, raksa (II) klorida, serbuk magnesium, timbal (II) asetat dan toluen.
3.3 Pembuatan Larutan Pereaksi 3.3.1 Pereaksi Mayer
Sebanyak 2,266 g raksa (II) klorida dilarutkan dalam air suling hingga 100 ml dan pada wadah lain dilarutkan 50 g kalium iodida dalam 100 ml air suling. 60 ml larutan I dicampurkan dengan 10 ml larutan II dan ditambahkan air suling hingga 100 ml (Ditjen POM RI, 1995).
3.3.2 Pereaksi natrium hidroksida 2 N
Sebanyak 8,002 g natrium hidroksida ditimbang, kemudian dilarutkan dalam air suling hingga 100 ml (Ditjen POM RI, 1979).
3.3.3 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dan 2 g iodium dilarutkan dalam air suling secukupnya hingga 100 ml (Ditjen POM RI, 1995).
3.3.4 Pereaksi Dragendorff
3.3.5 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, kemudian dilarutkan dalam air suling hingga 100 ml, lalu disaring (Ditjen POM RI, 1979).
3.3.6 Pereaksi asam klorida 2 N
Asam klorida pekat sebanyak 16,6 ml ditambahkan air suling sampai 100 ml (Ditjen POM RI, 1979).
3.3.7 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal asetat ditimbang, kemudian dilarutkan dalam air suling bebas karbon dioksida hingga 100 ml (Ditjen POM RI, 1995).
3.3.8 Pereaksi Liebermann-Burchard
Sebanyak 10 tetes asam asetat anhidrat dicampur dengan 1 tetes asam sulfat pekat. Ditambahkan dengan hati-hati asetat anhidrida ke dalam campuran tersebut, didinginkan (Ditjen POM RI, 1995)
3.3.9 Pereaksi Molisch
Sebanyak 3 g alfa naftol dilarutkan dalam 15 ml etanol 95 % ditambahkan dengan asam nitrat 0,5 N secukupnya hingga diperoleh larutan 100 ml (Ditjen POM RI, 1995).
3.3.10 Pereaksi kloralhidrat
Pereaksi kloralhidrat dibuat dengan cara melarutkan kloralhidrat sebanyak 50 g dalam 20 ml air (Ditjen POM RI, 1995).
3.4 Pembuatan Bahan Pengikat 3.4.1 Pasta amilum manihot
kedalam beaker glass ditambahkan sama banyak air suling sehingga terbentuk seperti suspensi. Kemudian dipanaskan langsung dengan api sambil diaduk-aduk sampai mendidih hingga terbentuk pasta. Ditimbang dan dicek bobotnya, dicukupkan dengan air suling panas sehingga diperoleh massa amilum manihot yang dibutuhkan (Cartensen, 1977).
3.4.2 Pasta Na CMC
Na CMC ditimbang sesuai jumlah yang dibutuhkan, dikembangkan CMC dengan cara ditabur merata diatas permukaan air suling yang telah dipanaskan, setelah semua CMC terbasahi lalu di aduk dengan cepat hingga terbentuk suspensi yang homogen (Setiadi, 2013).
3.4.3 PVP (polivinilpirolidon)
PVP ditimbang sesuai jumlah yang dibutuhkan dimasukkan kedalam beaker glass ditambahkan sama banyak etanol 96% sehingga PVP terlarut.
Diaduk perlahan-lahan hingga etanol menguap.
3.5 Prosedur kerja
3.5.1 Pengumpulan bahan tanaman
Pengambilan bahan tanaman dilakukan secara purposif yaitu tanpa membandingkan tanaman yang sama dengan daerah lain. Bahan tanaman yang digunakan adalah rimpang temulawak yang diperoleh dari daerah Pematang Raya, Kabupaten Simalungun, Provinsi Sumatera Utara.
3.5.2 Identifikasi tanaman
3.5.3 Pembuatan simplisia
Rimpang temulawak yang masih segar di sortasi dan ditimbang, dicuci bersih dari pengotor dengan air dan ditiriskan, selanjutnya rimpang diiris melintang dengan ketebalan 2-5 mm, kemudian dikeringkan di lemari pengering dengan suhu ±40o, irisan rimpang temulawak yang telah kering ditandai dengan rapuh saat dipatahkan. Kemudian simplisia diserbuk menggunakan blender sehingga diperoleh serbuk simplisia dan disimpan dalam wadah yang tertutup rapat (Meilisa, 2009). Gambar simplisia dan serbuk simplisia dapat dilihat pada Lampiran 2.
3.6 Karakterisasi Simplisia 3.6.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan terhadap serbuk simplisia rimpang temulawak dengan mengamati bentuk, bau, rasa dan warna.
3.6.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia rimpang ekstrak temulawak. Serbuk simplisia ditaburkan di atas kaca objek yang telah ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian diamati di bawah mikroskop. Untuk pati dilihat dalam air (Meilisa, 2009). (Hasil dapat dilihat pada Lampiran 3).
3.6.3 Penetapan kadar air a. Penjenuhan toluen
selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama ± 30 menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml. b. Penetapan kadar air simplisia
Labu berisi toluen tersebut dimasukkan 5 g serbuk simplisia yang telah ditimbang seksama, dipanaskan hati-hati selama 15 menit, setelah toluene mendidih, kecepatan toluen diatur 2 tetes per detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes per detik dan setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kadar air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO., 1998).
3.6.4 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml air-kloroform dalam air suling sampai 1 liter) dengan menggunakan botol bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam dan disaring. Sebanyak 20 ml filtrat diuapkan hingga kering dalam cawan yang berdasar rata yang telah dipanaskan dan ditara. Residu dipanaskan dalam oven pada suhu 105oC sampai diperoleh bobot tetap. Kadar sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes RI., 1995).
3.6.5 Penetapan kadar sari larut dalam etanol
etanol 96 % dengan menggunakan botol bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam dan disaring. Sebanyak 20 ml filtrat diuapkan hingga kering dalam cawan yang berdasar rata yang telah dipanaskan dan ditara. Residu dipanaskan dalam oven pada suhu 105oC sampai diperoleh bobot tetap. Kadar sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes RI., 1995).
3.6.6 Penetapan kadar abu total
Sebanyak 2,5 g serbuk simplisia yang telah digerus dan ditimbang seksama, dimasukkan ke dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Kurs porselin bersama isinya dipijarkan perlahan hingga arang habis, didinginkan, ditimbang sampai diperoleh bobot yang tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM RI, 1995).
3.6.7 Penetapan kadar abu yang tidak larut asam
Abu yang diperoleh pada penetapan kadar abu total dididihkan dengan 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut asam dikumpulkan, disaring dengan kertas saring, lalu cuci dengan air panas. Residu dan kertas saring dipijarkan sampai diperoleh bobot yang tetap, dinginkan, dan ditimbang beratnya. Kadar abu yang tidak larut asam dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM RI, 1995).
3.7 Pembuatan Ekstrak
Sebanyak 900 g serbuk simplisia dimaserasi dengan 75 bagian pelarut (6,75 liter ) etanol 96%, dimasukkan ke dalam bejana bertutup dan dibiarkan pada suhu kamar selama 5 hari terlindung dari cahaya sambil sering diaduk, kemudian setelah 5 hari hasil maserasi disaring dan diperas. Ampas ditambah dengan cairan penyari etanol 96% hingga diperoleh 100 bagian (9 liter) maserat kemudian dibiarkan di tempat sejuk dan terlindung dari cahaya selama 2 hari dan dienaptuangkan atau saring (Ditjen POM RI, 1979). Seluruh maserat digabungkan lalu diuapkan dengan alat rotary evaporator pada temperatur kurang lebih 40o C dan diperoleh ekstrak etanol kental Bagan pembuatan ekstrak etanol secara maserasi dapat dilihat pada Lampiran 4.
Rendemen dari ektrak kemudian dihitung dengan rumus:
% Rendemen = berat ekstrak yang diperoleh
berat bahan yang diekstrak x 100%
3.8 Skrining Fitokimia Ekstrak Temulawak
Skrining fitokimia dilakukan untuk mengetahui golongan senyawa kimia yang terkandung di dalam ekstrak rimpang temulawak (Curcuma xanthorriza). Golongan senyawa kimia yang diperiksa meliputi senyawa alkaloid, flavonoid, glikosida, tanin dan steroid/triterpenoid.
3.8.1 Pemeriksaan alkaloida
b. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Bouchardat, akan terbentuk endapan berwarna coklat sampai hitam.
c. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Dragendorff, akan terbentuk endapan merah atau jingga.
Ekstrak mengandung alkaloida jika sekurang-kurangnya terbentuk endapan dengan menggunakan dua golongan larutan percobaan yang digunakan. Tetapi jika reaksi 1 dan 2 hanya terjadi kekeruhan dilanjutkan pemeriksaan berikut:
Sebanyak 8 ml filtrat ditambahkan 2 ml ammonia pekat dan dikocok dengan 5 ml campuran kloroform (3:1) dan dibiarkan memisah, diambil lapisan eter-kloroform, ditambahkan sedikit natrium sulfat anhidrat, disaring dan diuapkan filtrat di dalam gelas arloji di atas penangas air, dilarutkan residunya dengan sedikit HCl 2N. Alkaloid positif jika terjadi endapan atau kekeruhan paling banyak dua dari tiga percobaan di atas (Farnsworth, 1966).
3.8.2 Pemeriksaan flavonoida
Sebanyak 0,5 g ekstrak ditambahkan 20 ml air panas, dididihkan selama 10 menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah, kuning, jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.8.3 Pemeriksaan saponin
hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya saponin (Ditjen POM RI, 1995).
2.8.4 Pemeriksaan tanin
Sebanyak 0,5 g ekstrak disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida 1 %. Jika terjadi warna hijau, biru, atau kehitaman menunjukkan adanya tanin (Farnsworth, 1966). 3.8.5 Pemeriksaan glikosida
Sebanyak 3 gram ekstrak disari dengn 30 ml campuran etanol 95% dengan air suling (7:3), fitambahkan asam sulfat pekat hingga diperoleh pH 2, kemudian direfluks selama 10 menit, didinginkan dan disaring. Sebanyak 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3), dilakukan berulang sebanyak 3 kali. Kumpulan sari air diuapkan dengan temperatur tidak lebih dari 50 oC. Sisanya dilarutkan dalam 2 ml metanol.
Larutan sisa dipakai untuk percobaan berikut:
a. Larutan sisa dimasukkan ke dalam tabung reaksi selanjutnya diuapkan di atas penangas air, pada sisa ditambahkan 2 ml air dan 5 tetes pereaksi Molish. Tambahkan hati-hati 2 ml asam sulfat pekat melalui dinding tabung, terbentuk cincin ungu pada batas kedua cairan, menunjukkan adanya ikatan gula.
3.8.6 Pemeriksaan steroida/triterpenoida
Sebanyak 1 g sampel dimaserasi dengan n-heksana selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 2 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat. Timbul warna biru atau hijau menunjukkan adanya steroid dan timbul warna merah, pink atau ungu menunjukkan adanya triterpenoid (Farnsworth, 1966).
3.9 Formula Sediaan Tablet
Tablet dibuat dengan menggunakan metode granulasi basah sebanyak 9 formula berbeda yang masing terdiri dari 100 tablet. Perbedan masing-masing formula terdapat pada jenis serta konsentrasi bahan pengikat pada setiap formula, yaitu: mucillago amilum (10, 12, 14)%, Natrium CMC (2, 4, 6)%, dan PVP (4, 5, 6)%. Masing-masing tablet dibuat dengan bobot 625 mg dan diameter tablet sebesar 13 mm.
3.9.1 Formula tablet ekstrak rimpang temulawak
R/ Ekstrak kering rimpang temulawak 375 mg
Pengikat x
Talk 1%
Magnesium stearat 1%
Laktosa ad 625 mg
m.f tab dtd No C Keterangan x :
Formula tablet ekstrak rimpang temulawak dapat dilihat pada Tabel 2.1 berikut :
Tabel 3.1 Formula tablet esktrak rimpang temulawak per satuan tablet
Bahan Jumlah (mg)
F1 F2 F3 F4 F5 F6 F7 F8 F9
Ekstrak
kering 375 375 375 375 375 375 375 375 375
PVP - - - 25 31,25 37,5
CMC - - - 3,75 7,5 11,25 - - -
Amilum 18,75 22,5 26,25 - - - -
Talkum 6,25 6,25 6,25 6,25 6,25 6,25 6,25 6,25 6,25
Mg stearat 6,25 6,25 6,25 6,25 6,25 6,25 6,25 6,25 6,25
Laktosa 218,75 215 211,25 233,75 230 226,25 212,5 206,25 200
Jumlah 625 625 625 625 625 625 625 625 625
3.9.2 Pembuatan ekstrak kering temulawak
Ekstrak kental temulawak dikeringkan dengan menambahkan sedikit demi sedikit amilum manihot perbandingan 1:2 hingga diperoleh ekstrak kering, lalu disimpan dalam lemari pengering.
3.9.3 Pembuatan tablet ekstrak temulawak
Massa granul diuji preformulasi meliputi waktu alir, sudut diam dan indeks tap. Dicetak menjadi tablet dengan bobot tablet 625 mg dan diameter 13 mm.
3.10 Uji Preformulasi 3.10.1 Sudut diam granul
Penentuan sudut diam granul dilakukan dengan cara:
Ditimbang 100 g granul kemudian dimasukkan ke dalam corong alir yang telah dirangkai, permukaan granul diratakan, lalu penutup corong dibuka, sehingga granul mengalir sampai habis. Tinggi tumpukan granul yang terbentuk diukur. Sudut diam dapat dihitung dengan menggunakan rumus:
Tg θ= 2H D
Granul yang mempunyai daya alir bebas akan mempunyai sudut diam antara 20° sampai 40° (Banker dan Anderson, 1994).
3.10.2 Waktu alir granul
Penentuan waktu alir granul dilakukan dengan cara: Ditimbang 100 g granul, kemudian dimasukkan ke dalam corong yang telah dirangkai kemudian permukaanya diratakan. Penutup bawah dibuka bersamaan dengan dihidupkan stopwatch. Stopwatch dihentikan tepat pada saat garnul habis melewati corong dan dicatat waktu alirnya. Syarat waktu alir granul lebih kecil dari 10 detik (Voight, 1995).
3.10.3 Indeks tap granul
Penentuan indeks tap dilakukan dengan cara: Dimasukkan granul ke dalam gelas ukur sampai garis tanda dan dinyatakan sebagai volume awalnya (V
0),
kemudian gelas ukur dihentakkan sebanyak 20 kali dengan alat yang dimodifikasi Keterangan :
θ = sudut diam
sehingga diperoleh volume akhir (V
1). Syarat indeks tap lebih kecil dari 20 % (Voight, 1995).
Indeks tap dapat dihitung dengan rumus :
Indeks Tap= V1-V0 V
0
X 100%
3.11 Uji Evaluasi Tablet
Evaluasi tablet yang dilakukan adalah pemeriksaan kekerasan, kerapuhan, waktu hancur , serta keseragaman bobot tablet.
3.11.1 Uji kekerasan tablet
Penetapan kekerasan tablet menggunakan alat hardness tester (Copley). Cara: Diambil tablet, masing-masing diletakkan pada tempat yang tersedia pada alat dengan posisi tidur, alat diatur, kemudian ditekan tombol start. Pada saat tablet pecah angka yang tertera pada layar digital dicatat. Percobaan ini dilakukan untuk 5 tablet. Syarat kekerasan tablet yaitu: 4-8 kg (Abu-Izza dan Matthew, 2004)
3.11.2 Uji friabilitas tablet
Penetapan friabilitas tablet menggunakan alat Roche friabilator. Cara: ditimbang 20 tablet yang telah dibersihkan dari, dimasukkan ke dalam alat dan diputar selama 4 menit (100 kali putaran). Setelah batas waktu yang ditentukan tablet dikeluarkan dan dibersihkan dari debu kemudian ditimbang (Banker dan Anderson, 1994). Siregar dan Wikarsa (2010) menjelaskan bahwa persyaratan friabilitas yaitu maksimal 1% untuk tablet konvensional.
Friabilitas dapat dihitung dengan rumus:
Keterangan :
V0= volume sebelum hentakan
Friabilitas= A -B
B x 100% 3.11.3 Uji waktu hancur
Penetapan waktu hancur tablet menggunakan alat Disintegration tester. Alat ini terdiri rangkaian keranjang, gelas piala 1000 ml thermostat dengan suhu 35-39°C dan alat untuk menaik turunkan keranjang dengan frekuensi 29-32 kali per menit. Cara : masukkan 1 tablet pada masing-masing tabung dan keranjang, masukkan 1 cakram pada tiap tabung dan alat, gunakan air bersuhu 37°±2°C, pada akhir batas waktu angkat keranjang dan amati semua tablet: semua tablet harus hancur sempurna, ulangi pengujian dengan 12 tablet lainnya: tidak kurang dari 16 dari 18 tablet yang diuji harus hancur sempurna (Ditjen POM RI, 1995).
3.11.4 Uji keseragaman bobot
Ditimbang 20 tablet, kmudian dihitung bobot rata-rata pada tiap tablet, lalu ditimbang tablet satu persatu.
Deviasi = Bobot tablet – bobot rata-rata
bobot rata-rata
x 100%
Persyaratan tidak boleh lebih dari 2 tablet yang masing-masing bobotnya menyimpang dari bobot rata-rata dari harga yang ditetapkan pada kolom A dan tidak boleh satu tablet yang menyimpang dari bobot rata-rata dari harga yang ditetapkan pada kolom B. Jika tidak mencukupi 20 tablet, dapat digunakan 10 tablet dengan persyaratan: Tidak satu tabletpun yang bobotnya menyimpang lebih besar dari bobot rata-rata yang ditetapkan pada kolom A dan kolom B (Ditjen POM RI, 1979).
Keterangan : A = bobot sebelum
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Sampel
Hasil identifikasi tanaman yang dikirim ke Laboratorium Herbarium Medanese, Universitas Sumatera Utara, menyatakan bahwa tumbuhan yang digunakan adalah rimpang temulawak (Curcuma xanthorrhiza Roxb,) dari famili Zingiberaceae.
4.2 Hasil Pemeriksaan Karakterisasi
Hasil pemeriksaan makroskopik simplisia rimpang temulawak yang meliputi hasil uji organoleptis dan makroskopik rimpang temulawak (Curcuma xanthorriza Roxb.) menunjukkan bahwa rimpang berbentuk bulat memanjang, warna kuning di bagian luar, warna daging kuning kecoklatan, dengan panjang rimpang kurang lebih 5-9 cm. Hasil pemeriksaan makroskopik simplisia diperoleh bentuk rajangan warna kuning kecoklatan, berbau khas, rasa pahit, getir dan sedikit pedas, serta permukaan luar berkerut.
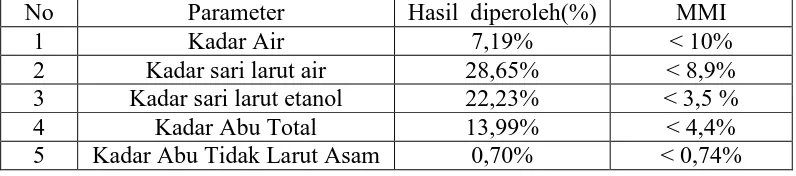
[image:44.595.113.511.629.717.2]Hasil pemeriksaan karakterisasi serbuk simplisia rimpang temulawak dapat dilihat pada Tabel 4.1.
Tabel 4.1 Hasil pemeriksaan karakterisasi serbuk simplisia rimpang temulawak
No Parameter Hasil diperoleh(%) MMI
1 Kadar Air 7,19% < 10%
2 Kadar sari larut air 28,65% < 8,9%
3 Kadar sari larut etanol 22,23% < 3,5 %
4 Kadar Abu Total 13,99% < 4,4%
Penetapan kadar air pada simplisia temuulawak dilakukan untuk mengetahui jumlah air yang terkandung dalam simplisia yang digunakan. Kadar air simplisia ditetapkan untuk menjaga kualitas simplisia karena kadar air berkaitan dengan kemungkinan pertumbuhan jamur/kapang. Hasil penetapan kadar air diperoleh lebih kecil dari 10% yaitu 7,19%. Kadar air yang melebihi 10% dapat menjadi media yang baik untuk pertumbuhan mikroba, keberadaan jamur atau serangga, serta mendorong kerusakan mutu simplisia (WHO., 1998).
Penetapan kadar sari dilakukan menggunakan dua pelarut, yaitu air dan etanol. Penetapan kadar sari larut air adalah untuk mengetahui kadar senyawa kimia bersifat polar yang terkandung di dalam simplisia, sedangkan kadar sari larut dalam etanol dilakukan untuk mengetahui kadar senyawa larut dalam etanol, baik senyawa polar maupun non polar. Hasil karakterisasi simplisia rimpang temulawak menunjukkan kadar sari yang larut dalam air sebesar 28,65%, sedangkan kadar sari yang larut dalam etanol sebesar 22,23 %. Menurut pesryaratan kadar sari yang larut dalam air tidak kurang dari 8,9% dan kadar sari yang larut dalam etanol tidak kurang dari 3,5% (Depkes RI., 2000).
0,70%. Hasil diatas menunjukkan bahwa kadar abu total yang ada tidak memenuhi persyaratan yang tertera pada Materia Medika Indonesia yaitu tidak lebih dari 4,4%, sedangkan untuk kadar abu tidak larut asam memenuhi persyaratan yaitu tidak lebih dari 0,74% (Depkes RI., 2000).
Hasil perhitungan karakterisasi simplisia rimpang temulawak meliputi penetapan kadar air, kadar sari larut air, kadar sari larut etanol, kadar abu dan kadar abu tidak larut asam dapat dilihat pada Lampiran 5.
4.3 Hasil Pembuatan ekstrak
Ekstrak kental yang diperoleh dari jumlah total rimpang segar 900 g sebesar 132,395 g, sehingga rendemen hasil yang diperoleh sebesar 14,71% :
Rendemen = 132, 395
900 x 100% = 14,71 %
4.4 Skrining Fitokimia
Uji skrining fitokimia dilakukan untuk mengetahui golongan senyawa kimia yang terkandung di dalam ekstrak rimpang temulawak (Curcuma xanthorriza Roxb,). Hasil skrining fitokimia terhadap rimpang temulawak
[image:46.595.114.511.618.731.2](Curcuma xanthorriza Roxb,) dapat dilihat pada Tabel 4.2 di bawah ini : Tabel 4.2 Hasil Skrining Fitokimia Ekstrak Rimpang temulawak
No. Golongan senyawa kimia Ekstrak Rimpang
Temulawak 1.
2. 3. 4. 5. 6.
Alkaloid Flavonoid
Glikosida Tanin Saponin Triterpenoid
Keterangan : (+) = Mengandung senyawa (–) = Tidak mengandung senyawa
Hasil diatas menunjukkan ekstrak temulawak (Curcuma xanthorriza Roxb,) mengandung golongan senyawa kimia yaitu flavonoid, glikosida, saponin, alkaloid dan steroid/ triterpenoid.
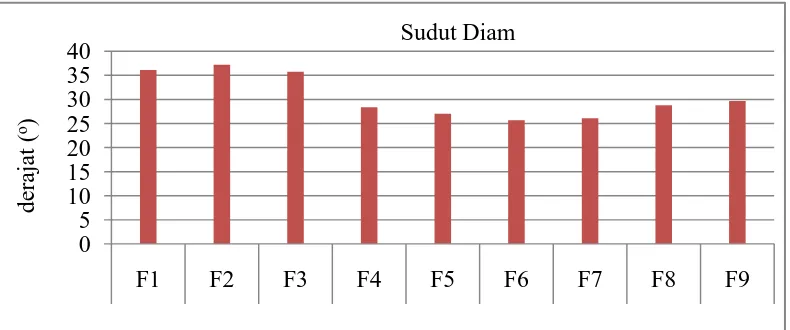
4.5 Uji Preformulasi Granul 4.5.1 Sudut diam granul
[image:47.595.112.513.373.447.2]Berikut ini adalah hasil uji sudut diam dari berbagai variasi konsentrasi granul ekstrak rimpang temulawak (Curcuma xanthorriza Roxb.)
Tabel 4.3 Hasil uji sudut diam granul Uji
pre-formulasi
Formula Persyar
atan
F1 F2 F3 F4 F5 F6 F7 F8 F9
Sudut diam
( o )
36,13 37,23 35,75 28,37 27,02 25,64 26,10 28,81 29,69 20o-40o
Berikut merupakan histogram yang menunjukkan perbandingan uji preformulasi sudut diam granul ekstrak temulawak dari kesembilan formula :
Gambar 4.1 Histogram sudut diam massa granul 0
5 10 15 20 25 30 35 40
F1 F2 F3 F4 F5 F6 F7 F8 F9
Sudut Diam
de
raj
at
(
[image:47.595.114.509.516.681.2]Gambar 4.1 diatas menunjukkan bahwa sudut diam dari kesembilan formula tersebut memenuhi persyaratan. Dari kesembilan formula, formula dengan amilum sebagai pengikat terutama F2 memberikan hasil sudut diam yang paling tinggi namun masih memenuhi persyaratan dan formula dengan Na CMC sebagai pengikat terutama F6 memberikan hasil terendah dan juga masih memenuhi persyaratan. Penambahan konsentrasi pada tiap bahan pengikat berbanding terbalik dengan hasil nilai sudut diam granulnya.
Semakin kecil sudut diam semakin baik sifat alir granul. Sudut diam lebih kecil atau sama dengan 30° biasanya bahan dapat mengalir bebas. Daya alir pada granul mempengaruhi proses pengisian atau penenmpatan granul pada mesin cetak tablet, sehingga dengan waktu alir yang baik diharapkan bobot yang dihasilkan dapat seragam serta tidak memberikan celah kosong pada massa tablet yang akan mempengaruhi mutu sediaan tablet tersebut (Banker dan Anderson, 1994; Sharma, dkk., 2011).
4.5.2 Waktu alir granul
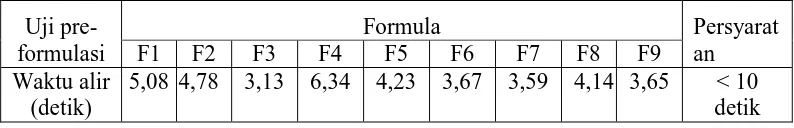
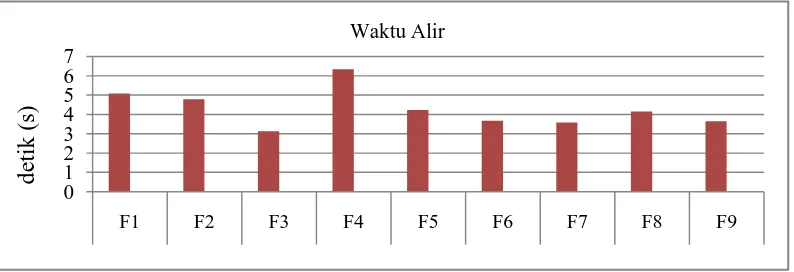
[image:48.595.113.510.609.673.2]Hasil waktu alir granul dapat dilihat pada Tabel 4.4 yang menunjukkan hasil uji waktu alir dari berbagai variasi konsentrasi pengikat granul ekstrak rimpang temulawak (Curcuma xanthorrhiza Roxb.) pada formula yang dibuat. Tabel 4.4 Hasil uji waktu alir granul
Uji pre-formulasi
Formula Persyarat
an
F1 F2 F3 F4 F5 F6 F7 F8 F9
Waktu alir (detik)
5,08 4,78 3,13 6,34 4,23 3,67 3,59 4,14 3,65 < 10
detik
waktu alir granul. Sedangkan untuk histogram yang menunjukkan perbandingan uji preformulasi waktu alir granul ekstrak rimpang temulawak dari kesembilan formula dapat dilihat pada Gambar 4.2. Terlihat bahwa formula yang memiliki
[image:49.595.115.512.242.378.2]bahan pengikat PVP yang memberikan hsil uji waktu alir yang rendah sedangkan formula dengan Na CMC sebagai bahan pengikat menunjukkan nilai tertinggi.
Gambar 4.2 Histogram waktu alir massa granul
Menurut (Voight, 1995) syarat waktu yang diperlukan granul untuk mengalir yaitu lebih kecil dari 10 detik. Waktu alir yang baik pada granul mempengaruhi pengisian yang seragam pada proses pencetakan tablet. Proses pengisian lubang kempa didasarkan pada aliran granul yang kontiniu dan seragam dari corong. Apabila granul tidak mudah mengalir, maka granul yang cenderung bergerak tak teratur melalui bingkai pengisi menyebabkan beberapa lubang kempa tidak terisi sempurna, hal ini tentu dapat mempengaruhi bobot tablet bahkan kerapuhan tablet itu sendiri (Lachman, dkk., 1994).
4.5.3 Indeks tap granul
Hasil indeks tap granul dari berbagai variasi konsentrasi pengikat granul ekstrak rimpang temulawak (Curcuma xanthorriza Roxb,) pada kesembilan formula yang dibuat dapat dilihat pada Tabel 4.5.
Tabel 4.5 Hasil uji indeks tap granul
0 1 2 3 4 5 6 7
F1 F2 F3 F4 F5 F6 F7 F8 F9
Waktu Alir
de
tik
(s
Uji pre-formulasi
Formula Persyarat
an
F1 F2 F3 F4 F5 F6 F7 F8 F9
Indeks tap (%)
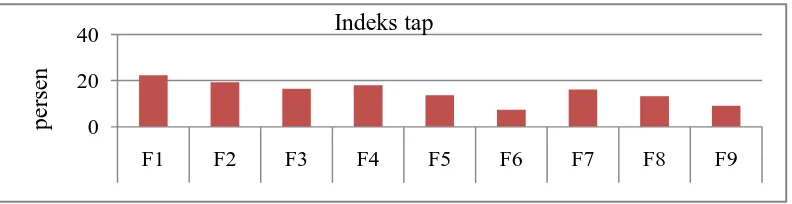
21,4 19,33 16,33 18,00 13,67 7,33 16,17 13,33 9,17 ≤ 20%
[image:50.595.112.514.85.158.2]Histogram hasil uji preformulsi indeks tap granul temulawak dapat dilihat pada gambar yang menunjukkan perbandingan uji preformulasi Indeks tap granul ekstrak temulawak dari kesembilan formula :
Gambar 4.3 Histogram indeks tap massa granul
Gambar 4.3 menunjukkan nilai indeks tap yang bervariasi, 8 formula memenuhi persyaratan indeks tap yaitu lebih kecil dari 20%, namun formula satu tidak memenuhi persyaratan. Semakin tinggi nilai indeks tap maka akan berpengaruh terhadap proses pencetakan tablet, semakin kecil nilai dari indeks tap granul maka penyusutan volume yang terjadi akan semakin rendah sehingga semakin seragam pengisian lesung tablet pada proses pencetakan dan semakin seragam juga bobot tablet dan zat berkhasiat yang terkandung dalam tablet. (Voight, 1995).
4.6 Uji Evaluasi Tablet 4.6.1 Uji Kekerasan Tablet
Hasil kekerasan tablet ekstrak temulawak dapat dilihat pada Tabel 4.6. 0
20 40
F1 F2 F3 F4 F5 F6 F7 F8 F9
Indeks tap
pe
rs
[image:50.595.116.512.249.351.2]Tabel 4.6 Hasil Uji Evaluasi Kekerasan Tablet
Uji evaluasi Formula Persyaratan
F1 F2 F3 F4 F5 F6 F7 F8 F9
Kekerasan tablet (Kg)
0,41 0,70 1,07 0,80 0,93 1,05 1,55 2,53 3,13 4-8 kg
[image:51.595.116.515.237.383.2]Berikut merupakan histogram yang menunjukkan perbandingan uji evaluasi kekerasan tablet ekstrak temulawak dari kesembilan formula :
Gambar 4.4 Histogram kekerasan tablet
Gambar 4.4 menunjukkan bahwa kesembilan formula tablet ini mempunyai kekerasan yang berbeda, namun tidak ada satupun tablet yang memenuhi persyaratan dimana menurut Parrot (1971) syarat kekerasan tablet yaitu 4-8 kg. Setiap granul tablet, baik dibuat dengan metode granulasi basah atau dengan metode kempa langsung, harus memenuhi persyaratan tertentu, yaitu granul tersebut harus dapat terikat bersama-sama bila diberi tekanan. Granulasi dikatakan ideal apabila menghasilkan granul yang akan terikat bila diberikan tekanan minimum untuk waktu tersingkat. Apabila gaya ikatan partikel makin besar, kekerasan yang dicapai makin mendekati optimum (Lachman, dkk, 1994). Perbedaan kekerasan pada tablet dapat disebabkan oleh celah antara puch atas dan punch bawah yang bervariasi pada saat pencetakan tablet. Menurut Siregar dan Wikarsa (2010), kekerasan tablet tergantung pada bobot bahan dan celah antara
0 1 2 3 4
F1 F2 F3 F4 F5 F6 F7 F8 F9
Kekerasan tablet
K
ilog
ra
m
(K
punch atas dan punch bawah pada waktu pengempakan tablet. Jika volume bahan
atau jarak antara punch atas dan punch bawah bervariasi, maka kekerasan dari sediaan tablet juga bervariasi. Dapat dilihat formula dengan bahan pengikat amilum memiliki kekerasan yang paling kecil dari kesembilan formula sedangkan PVP memiliki nilai kekerasan yang tertinggi dibandingkan formula lainnya. 4.6.2 Uji friabilitas tablet
[image:52.595.113.511.362.416.2]Hasil friabilitas dapat dilihat pada Tabel 4.7, berikut ini adalah hasil uji friabilitas tablet dari berbagai variasi konsentrasi granul ekstrak rimpang temulawak pada formula yang dibuat.
Tabel 4.7 Hasil uji evaluasi friabilitas tablet Uji evaluasi
(%)
Formula Persyar
atan
F1 F2 F3 F4 F5 F6 F7 F8 F9
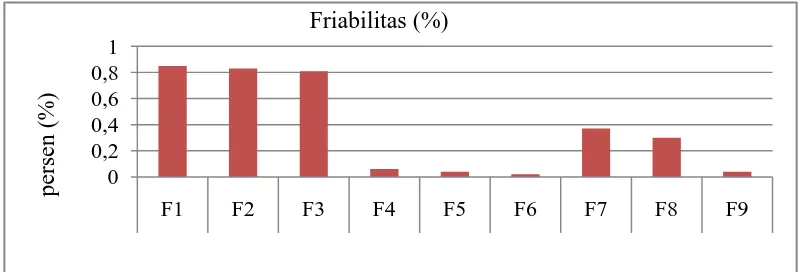
Friabilitas 0,85 0,84 0,81 0,06 0,04 0,02 0,37 0,30 0,04 ≤ 1%
Berikut merupakan histogram yang menunjukkan perbandingan uji evaluasi friabilitas (kerapuhan) tablet ekstrak temulawak dari kesembilan formula:
[image:52.595.111.511.498.634.2]
Gambar 4.5 Histogram friabilitas tablet
Gambar 4.5 menunjukkan bahwa kesembilan tablet memenuhi persyaratan. Menurut Siregar (2010), friabilitas maksimal 1% untuk tablet
0 0,2 0,4 0,6 0,8 1
F1 F2 F3 F4 F5 F6 F7 F8 F9
Friabilitas (%)
pe
rs
en
konvensional. Uji ini dilakukan untuk ketahanan tablet terhadap guncangan selama pembuatan, pengemasan dan pendistribusian (Lachman dkk., 1994).
4.6.3 Uji waktu hancur tablet
[image:53.595.114.515.291.367.2]Hasil waktu hancur tablet dapat dilihat pada Tabel 3.8, yang menunjukkan hasil uji waktu hancur tablet dari berbagai variasi konsentrasi granul ekstrak rimpang temulawak pada kesembilan formula yang dibuat.
Tabel 4.8 Hasil uji evaluasi waktu hancur tablet Waktu
hancur
Formula Persya
ratan
F1 F2 F3 F4 F5 F6 F7 F8 F9
dengan cakram (menit)
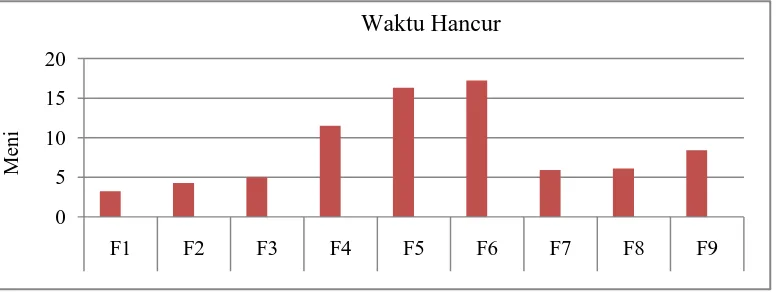
3,25 4,27 4,55 11,52 16,29 17,24 5,92 6,13 8,41 ≤ 15
menit
[image:53.595.124.512.547.693.2]Histogram yang menunjukkan perbandingan uji evaluasi waktu hancur tablet ekstrak temulawak dari kesembilan formula dapat dilihat pada Gambar 4.6. Gambar 4.6 menunjukkan bahwa tiga dari sembilan formula memiliki hasil yang tidak memenuhi persyaratan waktu hancur yaitu pada formula yang menggunakan Na CMC sebagai pengikat, berdasarkan Ditjen POM RI (1995) persyaratan waktu hancur tablet tidak bersalut yaitu tidak lebih dari 15 menit.
Gambar 4.6 Histogram waktu hancur tablet
0 5 10 15 20
F1 F2 F3 F4 F5 F6 F7 F8 F9
Waktu Hancur
Me
Na-CMC kemudian akan terdispersi kedalam air, lalu kemudian butir-butir Na-CMC yang bersifat hidrofilik akan menyerap air dan kemudian akan terjadi pembengkakan pada proses ini. Air yang sebelumnya ada di luar granula dan bebas bergerak, tidak dapat bergerak lagi dengan bebas sehingga keadaan larutan lebih mantap dan terjadi peningkatan viskositas (Fennema, dkk, 1996). Hal ini akan menyebabkan partikel-partikel pembentuk tablet terperangkap dalam sistem tersebut dan memperlambat proses pengendapan karena adanya pengaruh gaya gravitasi. Menurut Lachman, dkk (1994) Na CMC memiliki waktu desintegrasi yang lebih lama dari bahan pengikat lainnya, hal inilah yang meyebabkan tablet dengan bahan pengikat Na CMC memiliki waktu hancur terlama.
4.6.4 Uji keseragaman bobot
paling banyak memenuhi persyaratan evaluasi tablet dan uji preformulasi tablet dimana tablet dengan formula 9 memberikan hasil yang paling optimal dari kesembilan formula. Hal ini disebabkan karena kelarutan PVP yang baik, granulasi yang menggunakan sistem PVP-alkohol dapat diproses dengan baik, cepat kering serta sifat kempa yang sangat baik.
Tabel 4.9 Hasil Uji Keragaman Bobot Formula Bobot rata – rata
(%)
A1 (%) A2 (%) B(%)
F1 598 2,84 2,17 2,84
F2 598,5 2,75 2,25 2,75
F3 612, 5 1,46 3,67 3,67
F4 610 2,45 4,09 4,09
F5 601,75 3,03 3,61 3,61
F6 602 2,99 3,65 3,65
F7 573,25 3,79 2,31 3,79
F8 615,5 1,54 0,89 1,54
F9 566 2,47 1,94 2,47
Keterangan x :
F1 = Formula tablet ekstrak temulawak dengan konsentrasi amilum 10% F2 = Formula tablet ekstrak temulawak dengan konsentrasi amilum 12% F3 = Formula tablet ekstrak temulawak dengan konsentrasi amilum 14% F4 = Formula tablet ekstrak temulawak dengan konsentrasi Na CMC 2% F5 = Formula tablet ekstrak temulawak dengan konsentrasi Na CMC 4% F6 = Formula tablet ekstrak temulawak dengan konsentrasi Na CMC 6% F7 = Formula tablet ekstrak temulawak dengan konsentrasi PVP 4% F8 = Formula tablet ekstrak temulawak dengan konsentrasi PVP 5% F9 = Formula tablet ekstrak temulawak dengan konsentrasi PVP 6%
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Perbedaan jenis dan kadar bahan pengikat mempengaruhi sifat fisik granul dan tablet ekstrak temulawak (Curcuma xanthoriza Roxb.) yaitu waktu alir, sudut diam, indeks tap, kekerasan, friabilitas, waktu hancur dan keseragaman bobot. Amilum manihot sebagai bahan pengikat menghasilkan tablet dengan rentang kekerasan 0,40-1,07 kg, kerapuhan 0,81-0,84% dan waktu hancur 3,25-4,55 menit. Na CMC sebagai bahan pengikat menghasilkan kekerasan 0,80-1,05 kg, kerapuhan 0,02-0,06%, waktu hancur 11,52-17,24 menit. PVP sebagai bahan pengikat menghasilkan tablet dengan kekerasan 1,55-3,13 kg, kerapuhan 0,04-0,37% dan waktu hancur 5,92-8,41 menit.
b. Dari hasil penelitian Formula 9 (PVP 6%) memberikan hasil yang paling memenuhi persyratan evaluasi tablet yaitu sudut diam 29,69°, waktu alir 3,65 detik, indeks tap 9,17%, kekerasan 3,13 kg, friabilitas 0,04%, waktu hancur 8,41 menit dan keseragaman bobot
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tanaman
Temulawak berasal dari kawasan Indonesia dan telah tersebar diseluruh nusantara. Banyak dimanfaatkan masyarakat dalam bentuk jamu dan obat lainnya. Temulawak hanya bisa tumbuh dan berproduksi dengan baik di daratan rendah sampai pegunungan (daratan tinggi) yakni mulai 5–1200 m di atas permukaan laut, tumbuh liar di tempat yang agak terlindung, seperti di bawah naungan hutan jati juga cocok dibudidayakan di lahan perkarangan dan dikebun. Tumbuhan ini hidup pada berbagai jenis tanah seperti tanah liat, berpasir, tetapi untuk mendapatkan rimpang yang berkualitas baik diperlukan tanah yang subur yang mengandung banyak unsur hara (Rukmana, 2006).
2.1.1 Klasifikasi tanaman
Klasifikasi tanaman temulawak menurut Rukmana (2006) adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Monocotyledoneae Ordo : Zingiberales
Famili : Zingiberaceae Genus : Curcuma
2.1.2 Sinonim tanaman
Sinonim tanaman temulawak menurut Dalimartha (2006) adalah C. Zerumbed majus Rumph.
2.1.3 Nama asing tanaman
Kiang huang (China), harida; haldi (India Pakistan), halud (Bengali), kurkum (Arab), zardcchobacch (Persia), menjal (Tamil), kunong-huyung (Indochina) (Dalimartha, 2006).
2.1.4 Nama daerah tanaman
Nama daerah tumbuhan temulawak adalah koneng gede (Jawa Barat), temulabak (Jawa tengah), tetemulawak (Sumatera) dan kunyit ketumbu (Aceh) (Tommo (Bali), tommon (Sulawesi Selatan), karbanga (Ternate), temolobak (madura) (Afifah, 2003; Dalimartha, 2006).
2.1.5 Morfologi tanaman
Temulawak merupakan tanaman tahunan, berbatang semu, berwarna hijau dan cokelat gelap. Tinggi batangnya antara 1,5 cm sampai 2 cm, paling tinggi dibanding kerabat-kerabat semarganya. Batangnya tersusun atas upih-upih daun, seperti halnya upih-upih daun yang ada dalam pisang tegak lurus dan berumpun. Daunnya berbentuk seperti mata lembing jorong agak melonjong (oblong elliptic). Telapak daunnya berwarna hijau tua, bergaris-garis cokelat, lebarnya antara 1 cm sampai 2,5 cm dan berbintik-bintik jernih hijau muda (Ahmad, 2007).
temulawak berukuran paling besar diantara semua rimpang genus Curcuma. Oleh karena itu walau nama daerah temulawak bermacam-macam tetap mengandung arti yang sama, yaitu temu yang besar (Ahmad, 2007).
Rimpang temulawak terdiri atas rimpang induk (empu) dan rimpang anakan (cabang). Rimpang induknya berbentuk bulat seperti telur dan berwarna kuning tua atau cokelat kemerahan. Bagian dalamnya berwarna jingga kecokelatan. Dari rimpang induk ini, keluar rimpang kedua yang lebih kecil. Arah pertumbuhannya ke samping, berwarna lebih muda dengan bentuk bermacam-macam dan jumlahnya sekitar 3-7 buah. Jika dibiarkan tumbuh lebih dari satu tahun, akan tumbuh banyak rimpang lagi. Ujung rimpang cabang membengkak menjadi umbi kecil. Rimpang ini baunya harum dan rasanya agak pahit agak pedas (Ahmad, 2007).
Bunga temulawak pendek dan lebar, berkembang secara teratur, berwarna putih kuning atau kuning muda bercampur warna merah di puncaknya. Bunga mekar satu persatu secara bergiliran dari kantung-kantung daun pelindung yang memiliki 3-5 kuntum bunga (Ahmad, 2007).
2.1.6 Kandungan kimia
Kandungan kimia rimpang temulawak menurut Hayani (2006) adalah sebagai berikut zat warna kuning (kurkumin), serat, pati, kalsium oksalat, minyak atsiri, pati, alkaloid, flavonoid, triterpenoid dan glikosida lebih dominan dibanding tannin, saponin dan steroid.
2.1.7 Manfaat tanaman temulawak
penambah nafsu makan, pereda batuk, asma, sariawan, diare, rematik, lelah, penghilang rasa sakit, anti bakteri/jamur, antidiabetes, antidiare, anti oksidan, anti tumor, diuretik, depresi dan lain sebagainya. Minyak atsiri temulawak berkhasiat sebagai fungistatik pada beberapa jenis jamur dan bakteriostatik pada mikroba Staphyllococcus sp. dan Salmonella sp, mengurangi perut kembung akibat
metabolisme lemak dan menurunkan kadar kolesterol darah yang tinggi dan antitumor (Dalimartha, 2006).
Konsumsi temulawak pada orang sehat juga sangat penting untuk memelihara kesehatan fungsi hati dan menjaga stamina tubuh. Usia antara 20-60 tahun merupakan usia produktif untuk melakukan berbagai aktivitas yang berat dan melelahkan. Salah satu penyebab menurunnya fungsi hati adalah faktor kelelahan sehingga kerja hati menjadi bertambah berat. Hal ini menyebabkan tubuh rentan untuk tertular virus hepatitis yang berbahaya karena virus ini mampu bertahan dan menetap di dalam tubuh, bersifat kronis serta dalam perjalanan selanjutnya berpotensi merusak hati, ukurannya mengecil dan mengeras (sirosis hati) dan dapat berakhir menjadi kanker hati (Suharjo, 2010).
2.2 Ekstraksi
diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan (Depkes RI, 2000).
Menurut Departemen Kesehatan RI (2000), beberapa metode ekstraksi dengan menggunakan pelarut yaitu:
a. Cara dingin
1. Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruang (kamar). Secara teknologi termasuk ekstraksi dengan prinsip metode pencapaian konsentrasi pada keseimbangan. Maserasi kinetik berarti dilakukan pengadukan yang kontinu (terus menerus). Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya.
2. Perkolasi adalah ekstraksi dengan pelarut yang selalu baru samai sempurna
(exhaustive extraction) yang umumnya dilakukan pada temperatur ruangan. Proses terdiri dari tahaan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak), terus menerus sampai diperoleh ekstrak (perklorat) yang jumlahnya 1–5 kali bahan.
b. Cara panas
pada residu pertama samai 3-5 kali sehingga dapat termasuk proses ekstraksi semurna.
2. Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik. 3. Digesti adalah maserasi kinetik atau dengan pengadukan yang kontinu
pada temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur 40-50 oC.
4. Infus adalah ekstraksi dengan pelarut air pada temperatur penangas (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-98 oC) selama waktu tertentu (15-20 menit).
5. Dekoktasi adalah infus pada waktu yang lebih lama (≥30 menit) dan temperatur sampai titik didih air.
2.3 Uraian Sediaan Tablet 2.3.1 Pengertian tablet
Definisi tablet menurut Farmakope Indonesia edisi III adalah sediaan padat
edisi IV tablet adalah sediaan padat mengandung bahan obat dengan atau tanpa bahan pengisi.
Tablet merupakan jenis sediaan yang banyak digunakan sampai sekarang karena memberikan dosis yang tepat pada pemakaiannya, mudah pemakaiannya, mudah pengemasannya, stabilitas kimia dan aktifitas fisiologis dari bahan-bahan obat cukup baik, sebagai bentuk sediaan solid yang mengandung satu atau lebih zat aktif dengan atau tanpa berbagai eksipien (yang meningkatkan mutu sediaan tablet, kelancaran sifat aliran bebas, sifat kohesifitas, kecepatan disintegrasi dan sifat antilekat) dan dibuat dengan mengempa campuran serbuk dalam mesin tablet. Tablet kempa adalah unit bentuk sediaan solid, dibuat dengan mengempa suatu campuran serbuk yang mengandung zat aktif dengan atau tanpa bahan tanbahan atau bahan tertentu yang dipilih guna membantu dalam proses pembuatan dan untuk menciptakan sifat-sifat sediaan tablet yang dikehendaki (Banker dan Anderson, 1994; Siregar dan Wikarsa, 2010).
Menurut Banker dan Anderson (1994), tablet yang dinyatakan baik harus memenuhi syarat, yaitu:
a. Memiliki kemampuan dan daya tahan terhadap pengaruh mekanis selama proses produksi, pengemasan dan distribusi.
b. Bebas dari kerusakan seperti pecah pada permukaan dari sisi-sisi tablet.
c. Dapat menjamin kestabilan fisik maupun kimia dari zat berkhasiat yang terkandung didalamnya.
d. Dapat membebaskan zat berkhasiat dengan baik sehingga memberikan efek pengobatan seperti yang dikehendaki.
Menurut Ansel (1989), ada tiga metode pembuatan tablet kompresi yang berlaku yaitu metode granulasi basah, metode granulasi kering dan cetak langsung.
a. Granulasi basah
Metode ini merupakan metode pembuatan yang paling banyak digunakan dalam memproduksi tablet kompresi. Langkah-langkah yang diperlukan dalam pembuatan tablet dengan metode ini dapat dibagi sebagai berikut: menimbang dan mencampur bahan-bahan, pembuatan granulasi basah, pengayakan granul basah, pengeringan, pengayakan granul kering, pencampuran bahan pelicin dan bahan penghancur, pembuatan tablet dengan kompresi (Ansel, 1989).
Bahan aktif, pengisi dan disintegran dicampur hingga homogen. Bahan pengikat ditambahkan untuk mencampur serbuk dengan cara pengadukan. Massa serbuk terbasahi oleh bahan pengikat hingga massa tersebut mempunyai konsistensi lembab. Kemudian massa lembab tersebut dilewatkan pada mesh. Setelah itu ditempatkan pada wadah yang sesuai dan dimasukkan dalam lemari pengering. Setelah kering, granul tersebut dikurangi ukuran partikelnya dengan melewatkannya pada pengayakan mesh yang ukurannya lebih kecil. Ukuran ayakan tergantung pada diameter punch. Kemudian ke dalam granul kering ditambahkan lubrikan atau glidan sebagai serbuk fine untuk meningkatkan aliran granul, kemudian dicetak menjadi tablet (Sahoo, 2007).
b. Granulasi kering
menghasilkan partikel yang berukuran lebih besar (granul). Dengan metode ini, baik bahan aktif ataupun bahan pengisi harus memiliki sifat kohesif supaya massa yang jumlahnya besar dapat dibentuk. Metode ini khususnya untuk bahan-bahan yang tidak dapat diolah dengan metode granulasi basah, karena kepekaannya terhadap uap air atau karena tidak tahan terhadap pemanasan (Ansel, 1989).
c. Kompresi/cetak langsung
Cetak langsung berarti mengompres tablet secara langsung dari bahan bubuk tanpa memodifikasi sifat fisik bahan tablet tersebut. Metode ini berlaku untuk bahan kimia berbentuk kristal yang memiliki karakteristik kompresibilitas dan sifat alir yang baik seperti: garam kalium (klorat, klorida, bromida), natrium klorida, amonium klorida, methenamine, kalsium laktat, asetosal dan lain-lain (Sahoo, 2007).
2.3.3 Uraian bahan pengikat 2.3.3.1 Amilum manihot
Amilum manihot berbentuk serbuk, tidak berbau dan tidak berasa berwarna putih atau sedikit putih dengan pH 4,5-7,0 dan mengandung 17-20% amilosa. Tidak larut dalam etanol 96% dan air dingin, amilum mengembang secara langsung dalam air pada suhu 37°C. Larut dalam pelarut dimetilsulfoksida dan dimetilformamida. Amilum mengandung amilosa linear dan amilopektin bercabang, yaitu dua polisakarida dengan dasar a-(D)-glukosa. Amilum manihot juga disebut tapioka (Rowe, dkk., 2009).
Amilum merupakan suatu bahan tambahan farmasi yang biasa digunakan sebagai bahan pengembang, pengering(diluen), serta bahan pengikat pada tablet maupun kapsul. Pada penggunaannya sebagai diluen pati digunakan untuk persiapan pada ekstrak herbal dan memfasilitasi pencampuran pada proses formulasi. Penggunaanya sebagai lubrikan jumlah amilum yang digunakan biasanya 3-10%, sedangkan pada pembuatan pasta amilum sebagai pengikat granulasi basah tablet biasanya digunakan pada konsentrasi 3-20% (tergantung pada tipe amilum) dan sebagai desintegran biasanya digunakan pada konentrasi 3-25%. Amilum sangat baik jika digunakan sebagai bahan penghancur, namun pada penggunaan konsentrasi yang terlalu tinggi dapat meningkatkan friabilitas serta capping pada tablet (Rowe, dkk., 2009).
2.3.3.2 Polivinilpirolidon (PVP)
berwarna putih kekuningan, tidak berbau dan hampir tidak berasa dan merupakan serbuk yang higroskopis (Rowe, dkk., 2009).
PVP merupakan salah satu bahan tambahan farmasi yang biasanya digunakan sebagai desintegran, agen pensuspensi, bahan tambahan granulasi dan sebagai bahan pengikat tablet baik dalam cetak langsung maupun granulasi basah. Povidon di tambahkan pada campuran serbuk pada bentuk kering ataupun digranulasi dengan penambahan alkohol atau larutan hidroalkoholik. Obat atau zat aktif dengan kelarutan rendah dapat meningkat apabila dicampur dengan povidon. Sebagai bahan pengikat konsentrasi yang digunakan adalah 0,5-5% Povidon biasanya menghasilkan sifat adesi, elastisitas dan kekerasan yang baik . Povidon larut dalam asam, kloroform, etanol, keton, metanol dan air; praktis tidak larut dalam eter, hidrokarbon dan minyakk mineral (Rowe, dkk., 2009).