SELEKSI DAN KARAKTERISASI KHAMIR ISOLAT LOKAL
UNTUK PRODUKSI ETANOL
UKIT
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis “Seleksi dan Karakterisasi Khamir Isolat Lokal untuk Produksi Etanol” adalah karya saya bersama komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2013
Ukit
NRP. G351100241
ABSTRACT
UKIT. Selection and Characterization of Local Yeast Isolates for Ethanol Production. Supervised by ANJA MERYANDINI and TITI CANDRA SUNARTI.
Production of ethanol can utilize carbohydrate biomass such as simple sugar, starch and lignocelluloses. Yeast can directly used the simple sugars and lignocelluloses convert it into ethanol. Starch cellulose should be hydrolyzed before used as fermentable sugar in bioethanol production. The objectives of this study were to select yeast based on its capability to produce ethanol from various kinds of sugar. Five local isolates from rotten fruts and Saccharomycers cerevisae and Saccharomycers ellipsoids were examined its capability to metabolize and to produce ethanol from there sugars. The result showed that highest yield of bioethanol obtained from R isolate (31.04 g/l of ethanol) by using glucose as substrate, T isolate in mannose (20.80 g/l) end E isolate (6.67 g/l) in xylose, lower compared to Saccharomycers ellipsoids in maltose (33,62g/l) and by using maltodextrin (4.70 g/l) as sole carbon sources.
RINGKASAN
UKIT. Seleksi dan Karakterisasi Khamir Isolat Lokal untuk produksi Etanol. Dibimbing oleh ANJA MERYANDINI dan TITI CANDRA SUNARTI.
Produksi etanol dapat menggunakan biomassa karbohidrat berupa gula sederhana, pati dan lignoselulosa. Pati tersusun atas beberapa komponen oligosakarida salah satunya ialah maltodekstrin yang dapat dihidrolisis dengan bantuan enzim menjadi maltosa dan glukosa. Biomassa lignoselulosa merupakan senyawa kompleks, terdiri atas tiga komponen utama yaitu, selulosa, hemiselulosa dan lignin. Khamir dapat mengkonversi gula sederhana menjadi etanol, sedangkan pati harus dikonversi dulu menjadi glukosa secara enzimatik atau kimiawi, kemudian difermentasi oleh khamir menjadi etanol.
Penelitian ini bertujuan menyeleksi khamir berdasarkan kemampuannya menghasilkan etanol pada berbagai jenis gula. Pada penelitian ini digunakan 5 isolat Pichia spp. (isolat R, P, G, T dan E) dan 2 isolat Saccharomyces spp. (isolat Saccharomyces cerevisiae/Sc dan Saccharomyces ellipsoids/Se) sebagai isolat pembanding. Khamir terseleksi mampu menghasilkan etanol dari sumber gula sederhana (glukosa, manosa, dan xilosa) yang merupakan sebagian besar gula hasil hidrolisat lignoselulosa, serta maltosa dan maltodekstrin yang merupakan hasil hidrolisat pati. Karakterisasi isolat lokal dilakukan dengan melihat pertumbuhan pada media Oxidative Fermentative (OF) dan kurva pertumbuhan khamir. Seleksi khamir dilakukan dengan melihat pertumbuhan pada substrat yang terdiri atas glukosa, manosa, xilosa, maltosa dan maltodekstrin. Pengamatan dilakukan dengan mengukur produksi bioetanol oleh khamir potensial pada berbagai substrat menggunakan alkohol meter, piknometer dan Gas Chromatography.
Berdasarkan hasil penelitian ini diketahui bahwa Pichia spp. dan Saccharomyces spp. yang ditumbuhkan pada media PDB secara umum menunjukkan massa sel tertinggi pada jam ke-18 dan mulai turun jam pada ke-21, namun laju pertumbuhan spesifik tertinggi dicapai antara jam ke-6 (isolat P, G dan Se) dan jam ke-12 (isolat R, T, E dan Sc ). Kemampuan fermentasi dengan menggunakan media oxidative fermentative (OF) memperlihatkan pemanfaatan berbagai macam gula selama 72 jam oleh isolat Pichia spp. dan Saccharomyces spp. Isolat Pichia spp. dan Saccharomyces spp. dapat menggunakan substrat glukosa dan manosa untuk proses fermentasi. Maltodekstrin dimanfaatkan hanya oleh Se. Substrat xilosa dan maltosa tidak dapat dimanfaatkan oleh Saccharomyces spp dan Pichia spp dalam proses fermentasi
0.6 g/l. Etanol tertinggi dihasilkan oleh isolat R pada substrat glukosa sebesar 39.930 g/l. Etanol tertinggi dari substrat manosa dihasilkan oleh isolat T sebesar 39.05 g/l sedangkan dari substrat xilosa kadar etanol tertinggi dihasilkan oleh isolat E sebesar 1.05 g/l dan isolat Se memiliki kadar tertinggi pada substrat maltosa dan maltodekstrin sebesar 30.270 dan 3.30 g/l. Total asam tertinggi diperoleh dari isolat T pada substrat glukosa. Nilai yield fermentasi terdiri atas (∆S/S), Yp/s, Yx/s dan Yp/x. Efisiensi pemanfaatan substrat (∆S/S) tertinggi terjadi pada fermentasi menggunakan substrat glukosa sebesar 0.819 pada isolat R. Yield produk tertinggi didapat dari substrat glukosa dengan nilai 0.525 pada isolat R yang menunjukkan isolat R lebih memanfaatkan substrat menjadi etanol daripada biomassa. Nilai Yx/s terendah pada substrat glukosa pada isolat G sebesar 0.049 yang menunjukkan bahwa isolate G lebih memanfaatkan substrat menjadi etanol daripada pembentukan biomassa. Nilai yield produk perbiomassa (Yp/x) tertinggi menggunakan substrat glukosa pada isolat R sebesar 0.993, hal ini menunjukkan substrat glukosa efisien digunakan dalam pembuatan etanol.
Produksi bioetanol khamir potensial pada berbagai substrat sumber karbon memiliki kadar etanol tertinggi dari isolat R pada glukosa sebesar (31.04 g/l), isolat T pada manosa sebesar (20.80 g/l), isolat E dari xilosa sebesar (6.67 g/l) dan isolat Se pada maltosa dan maltodekstrin sebesar (33.62 g/l dan 4.70 g/l).
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
SELEKSI DAN KARAKTERISASI KHAMIR ISOLAT LOKAL
UNTUK PRODUKSI ETANOL
UKIT
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Seleksi dan Karakterisasi Khamir Isolat Lokal untuk Produksi Etanol
Nama : Ukit
NIM : G351100241
Disetujui oleh Komisi Pembimbing
Prof. Dr. Anja Meryandini, M.S. Dr. Titi Candra Sunarti, M. Si. Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana IPB
Mikrobiologi
Prof. Dr. Anja Meryandini, M.S. Dr. Ir. Dahrul Syah, M.Sc. Agr.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini berjudul ”Seleksi dan Karakterisasi Khamir Isolat Lokal untuk Produksi Etanol” Penulis mengucapkan terimakasih kepada Ibu Prof. Dr. Anja Meryandini, M.S dan Ibu Dr.Titi Candra Sunarti, M. Si selaku pembimbing yang telah meluangkan waktu, pikiran, tenaga, semangat dan motivasi dalam membimbing penyelesaian karya ilmiah ini. Ucapan yang sama penulis tujukan kepada Ketua dan staf Program Studi Mikrobiologi FMIPA IPB yang telah membantu proses pendidikan dan berlangsungnya penelitian. Penghargaan dan ucapan terimakasih penulis sampaikan kepada Departemen Agama dalam program beasiswa yang dilaksanakan oleh Direktorat Pendidikan Tinggi Islam, Bapak Rektor dan Bapak Dekan Fakultas Sains dan Teknologi UIN Sunan Gunung Djati Bandung yang telah memberikan kesempatan untuk melanjutkan pendidikan Pascasarjana. Penghargaan penulis sampaikan kepada staf laboran di laboratorium Mikrobiologi IPB, laboratorium Bioteknologi Hewan dan Biomedis (PPSHB-IPB), laboratorium Bioindustri TIN (Fateta-IPB), Mikrotropisian 2010 dan 2009, teman-teman seperjuangan di laboratoirum Bioteknologi Hewan dan Biomedis. yang telah banyak membantu dalam pelaksanaan penelitian. Rasa terimakasih juga disampaikan kepada suami tercinta Iwan Ridwan Yusup, M.Pd serta Bapak Dadang Rosita dan Mama Nani Eli, serta kakak Dr. Aep Patah dan Dr. Lamona Bernawis, adik-adik tercinta Deden Sutardi, S.Si, Neng Leni dan Zelpa, Asep Karnida dan neng Tika, serta seluruh keluarga atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
RIWAYAT HIDUP
Halaman
1 Macam-macam mikroorganisme penghasil etanol 4
2 Pemanfaatan berbagai macam gula selama 72 jam oleh isolat
Pichia spp. dan Saccharomyces spp. 18
Halaman
1 Struktur amilosa dan amilopektin 5
2 Jalur pemanfaatan maltosa dan maltodekstrin 5
3 Stuktur lignoselulosa yang mengalami peluruhan oleh pendahuluan 6
4 Hidrolisis selulosa oleh tiga jenis enzim 7
5 Komponen monomer dari hemiselulosa 8
6 Metabolisme hexosa melalui jalur EMP 9
7 Jalur fermentasi etanol 10
8 Kurva tumbuh Pichia spp. dan Saccharomyces spp. media PDB Dengan agitasi 100 rpm selama 72 jam 17
9 pH akhir medium pada ketujuh isolat pada berbagai substrat gula 19
10 Biomassa sel pada ketujuh isolat dalam berbagai substrat gula 19
11 Kadar etanol oleh ketujuh isolat (g/l) 20
12 Total asam ketujuh isolat pada berbagai substrat gula (g/l) 21
13 Efisiensi pemanfatan substrat oleh ketujuh isolat (∆S/ S) 22
14 Yield produk (Yp/s) oleh ketujuh isolat 23
15 Yield Biomassa (Ys/x) ketujuh isolat 24
Halaman
1 Prosedur analisis parameter 41
2 Penentuan kadar total gula Metode Phenol H2SO4, (Dubois 1956) 43
3 Karakterisasi fermentasi 47
Latar Belakang
Semakin meningkatnya jumlah penduduk di dunia mengakibatkan peningkatan kebutuhan penggunaan bahan bakar khususnya bahan bakar fosil. Penggunaan bahan bakar fosil tersebut menimbulkan dampak negatif terhadap degradasi ketersediaan bahan bakar fosil. Salah satu alternatif untuk mengatasi permasalahan tersebut adalah dengan memanfaatkan biomassa dalam pembuatan biofuel, diantaranya etanol (Kent 2009). Produksi etanol dapat menggunakan biomassa karbohidrat berupa gula sederhana (nira dan molas), pati (ubi, sagu dan gandum) dan lignoselulosa (tongkol jagung dan tandan kosong kelapa sawit) (Naik et al. 2010).
Gula sederhana dapat dikonversi langsung oleh khamir menjadi etanol, namun pati harus dihidrolisis oleh enzim α-amilase menghasilkan produk yang beragam diantaranya maltosa, maltodekstrin, dan oligosakarida. Organisme tertentu dapat menggunakan substrat maltosa, maltodekstrin atau oligosakarida yang kemudian diubahnya menjadi glukosa.
Lignoselulosa adalah komponen organik di alam dan terdiri atas tiga tipe polimer, yaitu, selulosa (35-50%), hemiselulosa (20-35%) dan lignin (12-20%) (Wyman 1994). Thalagala et al. (2009) melaporkan komponen monomer hemiselulosa pada kayu keras, lunak dan bagase terdiri atas L-arabinosa (2.2, 8.4 dan 6.3 %), xilosa (76.4, 37.3 dan 84.6%), manosa (0.5, 29.0, dan 2.0%), D-galaktosa (8.3, 5.5%, tt= tidak terdekteksi) dan D-glukosa (21.6, 19.8 dan 7.1%)
sedangkan monomer selulosa komponen kayu keras, lunak dan bagase terdiri atas L-Arabinosa (tt, tt dan 0.3%, D-Xilosa (2.5, 3.5 dan 4.3%,), D-manosa (tt, 3.7%
dan tt) dan D-glukosa ( 97.5, 92,8 dan 95.4%).
Penyiapan gula sederhana menjadi cairan gula untuk proses fermentasi dalam produksi etanol saat ini dilakukan secara kimiawi dan enzimatis. Dalam hidrolisis biomassa pati maupun lignoselulosa, reaksi hidrolisis kimia dapat mengakibatkan produksi etanol tidak optimal karena terjadinya pembentukan senyawa inhibitor yang terakumulasi dalam substrat, sedangkan penggunaan enzim untuk hidrolisis yang bersifat ramah lingkungan diperlukan biaya yang tinggi.
Pemanfaatan khamir yang mampu mengkonversi berbagai gula sederhana berupa monosakarida dan atau disakarida menjadi etanol dapat dijadikan alternatif teknologi baru yang lebih efisien dan ramah lingkungan. Efisiensi produksi etanol ditentukan oleh kualitas bahan baku, jumlah gula hasil konversi bahan baku dan kemampuan khamir dalam memfermentasi gula menjadi etanol.
Pichia anomala, Wickerhamomyces anomalus, P. guilliermondii, Candida spp., Kodamaea ohmeri dan Metschnikowia spp. (Lee et al. 2011).
Saccharomyces cerevisiae adalah jenis khamir yang paling umum digunakan untuk produksi etanol tapi tidak dapat mengkonversi gula pentosa yang merupakan 45% dari bahan baku biomassa lignoselulosa. Khamir Pichia stipitis memiliki potensial yang tinggi karenadapat memfermentasi gula heksosa dan xilosa menghasilkan etanol yang tinggi (Kumar et al. 2009). Yuliana (2011) dan Ruriani (2012) juga telah berhasil mengisolasi khamir dari berbagai buah-buahan busuk yang mampu memproduksi etanol.
Tujuan Penelitian
TINJAUAN PUSTAKA
Bioetanol
Bioetanol adalah etanol (C2H5OH) yang dihasilkan dari proses fermentasi gula yang berasal dari biomassa (pati dan lignoselulosa) dengan menggunakan bantuan mikroorganisme. Etanol dapat diproduksi dengan menggunakan bahan baku gula, pati dan lignoselulosa melalui beberapa cara, yaitu secara enzimatis maupun kimiawi. Biomassa lignoselulosa adalah biomassa yang digunakan untuk produksi biofuel terbarukan dan disebut sebagai biofuel generasi kedua (Zabaniotou et al. 2008). Etanol adalah cairan tak berwarna yang mudah menguap dengan aroma yang khas dan mudah terbakar. Etanol termasuk ke dalam alkohol rantai tunggal, dengan rumus kimia C2H5OH dan rumus empiris C2H6O. Etanol sering disingkat menjadi EtOH, dengan "Et" merupakan singkatan dari gugus etil (C2H5) dan mempunyai berat molekul 46,07 g/mol. Organisme fermentasi harus mampu memfermentasi semua monosakarida yang tersedia dan tahan terhadap inhibitor dalam hidrolisat. Saccharomyces cerevisiae adalah jenis khamir yang paling umum digunakan untuk produksi etanol tapi tidak dapat mengkonversi gula pentosa yang merupakan 45% dari bahan baku. Khamir Pichia stipitis memiliki potensial yang tinggi karena dapat memfermentasi xilosa menghasilkan etanol (Kumar et al. 2009). Bellido et al. (2011) melaporkan bahwa khamir Pichia stipitis akan terhambat dalam mengkonversi xilosa ke etanol bila terdapat kandungan asam asetat 1,5 g/L, 0,15 g furfural/L dan 0,05 g/L 5-Hydroxymethylfurfur (HMF) dalam media.
Penggunaan spesies khamir yang berbeda dalam produksi bioetanol sangat berpengaruh terhadap konsentrasi bioetanol yang dihasilkan. Selain itu, konsentrasi bioetanol yang dihasilkan sangat dipengaruhi oleh suhu, pH, sumber karbon dan sumber nitrogen (Silva et al. 2011).
Khamir untuk Produksi Etanol
Khamir maupun bakteri dapat digunakan untuk memproduksi etanol. Khamir Pichia spp. mampu mengkonversi xilosa menjadi etanol dalam jumlah tinggi. Khamir lain yang diketahui merupakan penghasil etanol yang potensial dapat dilihat pada Tabel 1.
Khamir memerlukan media dan lingkungan yang sesuai untuk pertumbuhan dan perkembangan. Unsur-unsur yang dibutuhkan adalah sumber asam amino, vitamin, magnesium yang dapat dipenuhi oleh ekstrak khamir, karbon, urea dan oksigen (Silva et al, 2012). Menurut Taniguchi et al. (1997) khamir Pichia stipitis atau Saccharomyces cerevisiae pada kondisi anaerobik atau semi aerobik dapat menghasilkan etanol. Pada kondisi aerobik dengan pengaturan oksigen sesuai dengan konsentrasi sel untuk peningkatan etanol pada proses fermentasi menggunakan xilosa dan glukosa oleh Pichia stipitis didapat nilai optimum qO2 adalah 14.3 dan 66.7 mg. (g sel)/jam.
mikroorganisme penghasil etanol dalam mengunakan bahan lignoselulosa dapat dilihat pada Tabel 1.
Tabel 1 Macam-macam mikroorganisme penghasil etanol
Organisme Kemampuan Referensi
Konsumsi
Pati adalah bentuk penyimpanan bahan makanan yang paling umum pada tanaman. Pati merupakan polimer glukosa yang terdiri atas amilosa dan amilopektin. Banyak prokariota menghasilkan amilase untuk memanfaatkan pati sebagai energi dan sumber karbon. Kennedy et al. (1995) menyatakan maltodekstrin didefinisikan sebagai produk hidrolisis pati yang mengandung unit
α-D-glukosa yang sebagian besar terikat melalui ikatan 1,4 glikosidik dengan Ekivalen Dekstrosa (DE) kurang dari 20, berwarna putih sampai bening. Rumus umum maltodekstrin adalah [(C6H10O5)nH2O)]. α-amilase adalah suatu endoglukanase yang menghidrolisis secara acak ikatan α-1,4-glikosidik pati untuk menghasilkan campuran maltodekstrin, dekstrin, maltosa dan glukosa. Banyak bakteri, termasuk spesies Bacillus, Pseudomonas dan Clostridium, menghasilkan enzim ini (Kim & Gadd 2008).
(Roder et al. 2005). Struktur kimiawi dari amilosa dan amilopektin dapat dilihat pada Gambar1.
Amilosa
Amilopektin
Gambar 1 Struktur amilosa dan amilopektin (Moat et al. 2002)
Pati dihidrolisis dengan enzim α-amilase menghasilkan produk yang beragam diantaranya glukosa, maltosa, maltodekstrin, dan oligosakarida. Organisme tertentu memiliki amilomaltase sehingga dapat memanfaatkan substrat berupa maltosa atau maltodekstrin (Gambar 2). Maltosa dibawa ke dalam sel oleh maltosa permease dan kemudian dikonversi menjadi D-glukosa dan maltodekstrin oleh amilomaltase. D-glukosa dikonversi menjadi glukosa-6-fosfat oleh heksokinase. Glukosa-6-fosfat akan mengikuti jalur EMP.
Gambar 2 Jalur pemanfaatan maltosa dan maltodekstrin sebagai sumber karbon (Moat et al. 2002).
Maltosa diluar
Maltosa didalam
glikolisis maltodekstrin D-glukosa
Heksokinase Glukosa-1-P Glukosa-6-P Maltodekstrin
fosforilase
isomerase
Maltosa permease
Lignoselulosa
Lignoselulosa adalah komponen organik di alam dan terdiri atas tiga tipe polimer, yaitu selulosa, hemiselulosa dan lignin. Selulosa secara alami diikat oleh hemiselulosa dan dilindungi oleh lignin. Ketiga komponen tersebut saling terikat kuat akibat dari struktur amorf dan ikatan β-1,4 pada selulosa serta adanya lignin diantara rantai selulosa. Pengaruh perlakuan pendahuluan dapat meluruhkan lignin (Gambar 3).
Gambar 3 Struktur lignoselulosa yang mengalami peluruhan oleh pendahuluan (Kumar et al. 2009).
Lignoselulosa bisa diperoleh dari jerami, rumput-rumputan, limbah pertanian/hutan, limbah industri dan bahan berserat. Kandungan dari ketiga komponen pada lignoselulosa bervariasi tergantung dari jenis bahannya. Selulosa yang merupakan komponen utama tumbuhan sangat erat berasosiasi dengan hemiselulosa dan lignin (Perez et al. 2002).
Selulosa adalah polimer glukosa yang saling berikatan melalui ikatan β -1,4. Selulosa mengandung bagian berkristal dan amorf, biasanya ditemukan bersama dengan oligosakarida pada dinding tanaman dan jamur (Moat et al. 2002). Selulosa dihidrolisis menjadi glukosa dengan menggunakan tiga jenis enzim (Gambar 4).
Gambar 4 Hidrolisis selulosa oleh tiga jenis enzim (Moat et al. 2002)
Hemiselulosa merupakan suatu heteropolisakarida terdiri atas pentosa dan berbagai heksosa. Hemiselulosa adalah suatu rantai yang amorf dari campuran gula, biasanya berupa arabinosa, galaktosa, glukosa, manosa, xilosa dan juga komponen lain dalam kadar rendah seperti asam asetat. Banyak mikroorganisme, yang termasuk selulolitik, dapat menggunakan heteropolisakarida ini sebagai sumber karbon dan energi dengan enzim ekstraseluler kolektif yang disebut hemiselulase. Xilosa adalah monosakarida yang paling melimpah di hemiselulosa (Moat et al. 2002). Monomer hemiselulosa dapat dilihat pada Gambar 5.
Perlakuan pendahuluan bertujuan memecah ikatan lignin, mengurai hemisellulosa dan merusak struktur kristal dari selulosa. Rusaknya struktur kristal selulosa dan penambahan enzim akan mempermudah terurainya selulosa menjadi glukosa. Selain itu, hemisellulosa turut terurai menjadi senyawa gula sederhana dengan bantuan enzim menjadi glukosa, galaktosa, manosa, xilosa dan arabinosa. Selanjutnya senyawa-senyawa gula sederhana tersebut yang akan difermentasi oleh mikroorganisme menghasilkan etanol.
Glukosa selobiosa
Rantai menengah dan pendek oligosakarida dengan ujung bebas Rantai panjang oligosakarida dari β-1,4 terkait unit glukosa
selulosa
β-glucosidase
exo-β1,4 glucanase
Gambar 5 Komponen monomer dari hemiselulosa (Rowell et al. 2005).
Metabolisme Gula pada Khamir
Menurut Silva et al. (2012) Pichia stipitis merupakan salah satu spesies khamir yang memiliki kemampuan mengkonversi gula xilosa menjadi etanol dengan hasil yang tinggi. Selain itu, khamir ini dapat memfermentasi gula lainnya diantaranya glukosa, manosa, galaktosa dan selobiosa dan oligomer xilan. Khamir bersifat fakultatif anaerobik, produk metabolik utama adalah etanol, CO2 dan air, khamir ini bersifat fakultatif anaerobik. Pichia stipitis memerlukan suhu 30 0C dan pH 5.0 untuk pertumbuhannya.
Pichia stipitis merupakan salah satu khamir yang mampu memfermentasikan xilosa dengan baik. Khamir ini mampu mengubah xilosa dan semua senyawa gula sederhana menjadi etanol (Cho et al. 2011). Proses fermentasi oleh Pichia stipitis adalah proses pengubahan sebagian besar energi dari gula ke dalam bentuk etanol. Pichia stipitis memiliki lintasan Embden Meyerhof Parnas (EMP) dan Pentosa Phosphat (PP) sehingga dapat mengkonversi gula heksosa dan pentose menjadi etanol.
Gambar 6 Metabolisme heksosa melalui jalur EMP. (1) heksokinase, (2) sistem translokasi group atau ketoheksokinase, (3) 1-fosfofruktokinase, (4) galaktokinase, (5) glukosa, galaktosa-1-fosfat uridililtransferase, (6) uridine difosfat glukose epimerase, (7) manosa-6-fosfat isomerase (Kim & Gadd 2008).
Manosa secara aktif diangkut ke dalam sel setelah dikonversi oleh heksokinase menjadi manosa-6-fosfat. Manosa-6-fosfat diubah menjadi fruktosa-6-fosfat oleh mannose-fruktosa-6-fosfat isomerase (Kim & Gadd 2008) (Gambar 6). Semua gula heksosa diubah menjadi gliseraldehid-3-fosfat dan kemudian menjadi piruvat. Setelah melalui tahapan glikolisis, piruvat yang terbentuk kemudian diubah menjadi asetaldehid dan CO2 oleh enzim piruvat dekarboksilase, setelah itu enzim alkohol dehidrogenase mengubah asetaldehid menjadi etanol.
Saccharomyces cerevisiae dan Pichia stipitis memfermentasi karbohidrat melalui jalur EMP untuk menjadi etanol. Piruvat didekarboksilasi menjadi asetaldehida, yang digunakan sebagai akseptor elektron. Asetaldehida direduksi menjadi etanol. Elektron yang dipakai dihasilkan selama proses glikolisis dimana ATP dihasilkan (Gambar 7).
Gliseraldehid-3-fosfat fuktosa-1,6-bisfosfat fuktosa-1-fosfat
fuktosa-6-fosfat
manosa-6-fosfat glukosa-6-fosfat
glukosa-1-fosfat glikogen
Gambar 7 Jalur fermentasi etanol (Kim & Gadd 2008) 1–6, lintasan EMP, 7 piruvat dekarboxilase; 8, alkohol dehidrogenase.
Fermentasi etanol terdiri atas dua lintasan. Lintasan yang pertama adalah lintasan fermentasi etanol melalui piruvat dekarboksilase, lintasan ini menghasilkan etanol, CO2 dan air. Lintasan kedua, fermentasi etanol melalui asetil-CoA dimana pada lintasan bercabang dan menghasilkan berbagai produk seperti etanol, laktat, asetat dan H2. Pada lintasan fermentasi secara anaerobik dan termofil berbagai karbohidrat termasuk selulosa dan pentosa dikonversi melalui asetil-CoA untuk menjadi etanol.
Karakterisasi Khamir dengan Media Oxidative Fermentative (OF)
Fermentasi dan oksidasi adalah dua proses penting dalam metabolisme mikroorganisme, dimana tujuan akhirnya adalah akumulasi energi, baik untuk aktivitas mikroorganisme maupun untuk proses-proses biologis lain. Proses oksidasi umumnya dilakukan pada respirasi aerobik menghasilkan CO2 dan H2O, sedangkan fermentasi dilakukan pada kondisi anaerobik menghasilkan asam, etanol dan gas. Uji fermentasi dengan media Oxidative Fermentative (OF) dilakukan untuk mengetahui kemampuan khamir dalam menggunakan karbohidrat.
Hugh dan Leifson (1958) melaporkan beberapa bakteri diantaranya Shigella sonnei dan E. coli mampu melakukan fermentasi karbohidrat dengan substrat glukosa dan laktosa. Fermentasi karbohidrat akan menyebabkan pH media fermentasi menurun sehingga indikator bromothymol biru yang terdapat
pada media berubah dari biru menjadi kuning. Perubahan warna medium menjadi kuning disebabkan terdapatnya indikator Brom Timol Blue (BTB) dalam medium. Bromothymol biru dikenal sebagai phthalein sulfon bromothymol. Bromthymol blue bertindak sebagai asam lemah dalam medium. Bromthymol blue dapat terprotonasi sehingga mengakibatkan berwarna kuning dan warna hijau kebiruan dalam larutan netral. Indikator BTB akan mengubah medium menjadi kuning dikarenakan pH media menurun. Medium yang mengalami fermentasi gula akan menjadi asam dalam keadaan anaerob.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Desember 2011 hingga Agustus 2012, bertempat di Laboratorium Bioteknologi Hewan dan Biomedis, PPSHB-IPB, Laboratorium Mikrobiologi, Departemen Biologi, FMIPA-IPB dan Laboratorium Bioindustri, Departemen TIN, Fateta-IPB.
Bahan
Mikrob yang digunakan dalam penelitian ini ialah 7 isolat khamir yang terdiri atas dua kelompok yaitu, 5 isolat lokal hasil isolasi dari buah-buahan busuk oleh Yuliana (2011) dan Ruriani (2009) yang telah diidentifikasi sebagai Pichia spp., yaitu (R, P,G, T dan E) dan 2 isolat khamir sebagai pembanding, yaitu: Saccharomyces cerevisiae (Sc)dan Saccharomyces ellipsoides (Se).
Alat
Peralatan yang digunakan antara lain spektrofotometer, sentrifuse, laminar air flow, alkoholmeter, piknometer, Gas Chromatography (GC) serta peralatan instrument dan peralatan gelas.
Metode Penelitian
Penelitian ini dilaksanakan dalam tiga tahap yang meliputi (1) penentuan kurva pertumbuhan, (2) seleksi dan karakterisasi khamir untuk produksi etanol, (3) produksi etanol oleh khamir potensial pada berbagai substrat.
Penentuan Kurva Pertumbuhan
pengambilan kultur sebanyak 5 ml untuk dilakukan pengukuran Optical Density (OD) sel pada panjang gelombang 600 nm dan berlangsung sampai 72 jam.
Seleksi dan Karakterisasi Khamir untuk Produksi Etanol
Uji Fermentasi dengan Media oxidative fermentative
Uji fermentasi dengan media oxidative fermentative ditujukan untuk mengetahui kemampuan isolat-isolat memfermentasi berbagai jenis substrat. Pichia spp. dan Saccharomyces spp. diinokulasi dan diinkubasi pada berbagai substrat gula pada suhu ruang pada medium Oxidative Fermentative (OF) dengan komposisi dalam 1 l terdiri atas gula tunggal 10% (glukosa, manosa, xilosa, maltosa atau maltodekstrin), 5 g NaCl, 3 g pepton, 0.3 K2HPO4, 3 g agar, 15 ml bromthymol blue 0.2% pada pH 7.1. Pengamatan dilakukan setelah inokulasi dan inkubasi 24 jam dengan mengamati perubahan warna media dari biru menjadi kuning yang menunjukkan terjadi penurunan pH pada medium (Hugh dan Leifson 1958). Hasil uji fermentasi diperlihatkan dengan adanya indikator perubahan warna dari biru menjadi hijau, hijau kebiruan dan kuning dengan tanda (+). Semakin banyak tanda (+) menunjukkan warna semakin kuning dan terjadi proses fermentasi dan tanda (-) kontrol.
Seleksi Berdasarkan Kemampuan Menghasilkan Etanol
Pada tahap ini produksi etanol dilakukan pada berbagai gula dengan metode Silva et al. (2012) yang dimodifikasi komposisi gula (glukosa, manosa, xilosa, maltosa atau maltodekstrin) dengan komposisi dalam 1 l terdiri atas 90 g gula, 2.3 g urea, 3 ekstrak khamir, MgSO4.7H2O dengan pH 5. Inokulum khamir diberikan sebanyak 10% volume substrat. Setelah sterilisasi kultur diinkubasi pada suhu 30 0C sambil dikocok dengan kecepatan 100 rpm selama 96 jam. Pembuatan inolukum dilakukan dengan cara mengambil 2 ose penuh khamir dari cawan Petri, kemudian dimasukkan pada media inokulum dengan komposisi dalam 1 l terdiri atas 1% glukosa serta masing-masing gula (glukosa, manosa, xilosa, maltosa atau maltodekstrin), dengan komposisi 50 g gula, 3 g ekstrak khamir, 3 g ekstrak malt, 5 g pepton dengan pH 5 diinkubasi pada suhu 30 0C sambil dikocok dengan kecepatan 100 rpm selama 12 jam. Fermentasi berlangsung pada sistem tertutup dalam inkubator bergoyang pada suhu 30 0C selama 96 jam. Kadar etanol dihitung pada akhir proses fermentasi dengan menggunakan alkoholmeter dan piknometer yang didahului proses destilasi cairan hasil fermentasi. Untuk produksi bioetanol oleh khamir potensial pada berbagai substrat, kadar etanol dihitung dengan menggunakan Gas Chromatography (GC).
dikeringkan dengan menggunakan oven bersuhu 70 0C selama 24 jam dan ditimbang hingga bobotnya konstan. Penentuan kadar etanol dengan metode alkoholmeter, piknometer dan Gas Chromatography (GC). Total asam dengan metode titrasi (AOAC 1999). Prosedur analisis selengkapnya disajikan pada Lampiran 1. Perubahan kadar gula diamati dengan uji total gula dengan metode fenol-H2SO4 (Dubois 1959) pada Lampiran 2.
Pertumbuhan sel dan adanya metabolit merupakan hasil reaksi pada proses metabolisme yang dapat diukur melalui persamaan reaksi (Doran 1995). Yield fermentasi untuk masing-masing khamir dan gula dihitung berdasarkan nilai efisiensi pemanfaatan substrat (∆S/S), yield biomassa (Yx/s), yield produk (Yp/s) dan yield produk per biomassa (Yp/x) dimana ΔS: jumlah substrat yang dikonsumsi; ΔP: hasil yang terbentuk; Δx: biomassa sel kering.
Produksi Etanol oleh Khamir Potensial pada Substrat
HASIL
Kurva Pertumbuhan
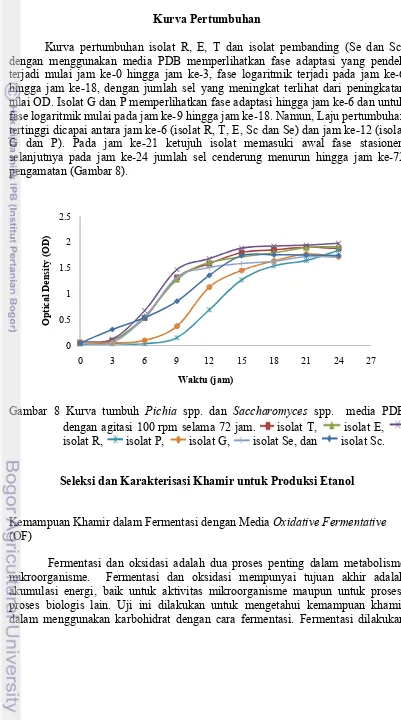
Kurva pertumbuhan isolat R, E, T dan isolat pembanding (Se dan Sc) dengan menggunakan media PDB memperlihatkan fase adaptasi yang pendek terjadi mulai jam ke-0 hingga jam ke-3, fase logaritmik terjadi pada jam ke-6 hingga jam ke-18, dengan jumlah sel yang meningkat terlihat dari peningkatan nilai OD. Isolat G dan P memperlihatkan fase adaptasi hingga jam ke-6 dan untuk fase logaritmik mulai pada jam ke-9 hingga jam ke-18. Namun, Laju pertumbuhan tertinggi dicapai antara jam ke-6 (isolat R, T, E, Sc dan Se) dan jam ke-12 (isolat G dan P). Pada jam ke-21 ketujuh isolat memasuki awal fase stasioner, selanjutnya pada jam ke-24 jumlah sel cenderung menurun hingga jam ke-72 pengamatan (Gambar 8).
Gambar 8 Kurva tumbuh Pichia spp. dan Saccharomyces spp. media PDB dengan agitasi 100 rpm selama 72 jam. isolat T, isolat E, isolat R, isolat P, isolat G, isolat Se, dan isolat Sc.
Seleksi dan Karakterisasi Khamir untuk Produksi Etanol
Kemampuan Khamir dalam Fermentasi dengan Media Oxidative Fermentative (OF)
Fermentasi dan oksidasi adalah dua proses penting dalam metabolisme mikroorganisme. Fermentasi dan oksidasi mempunyai tujuan akhir adalah akumulasi energi, baik untuk aktivitas mikroorganisme maupun untuk proses-proses biologis lain. Uji ini dilakukan untuk mengetahui kemampuan khamir dalam menggunakan karbohidrat dengan cara fermentasi. Fermentasi dilakukan
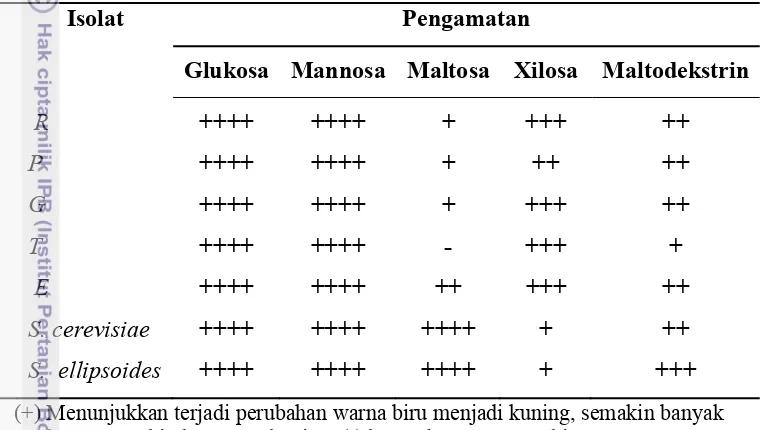
pada kondisi anaerobik dan dihasilkan asam, etanol dan gas. Hal ini menyebabkan penurunan pH pada media sehingga terjadinya perubahan warna media dari biru menjadi kuning. Substrat glukosa, manosa, xilosa, maltosa dan maltodekstrin dapat difermentasi oleh beberapa khamir uji. Hal ini ditunjukkan dengan terjadinya perubahan warna indikator dari biru menjadi kuning (Tabel 2).
Tabel 2 Pemanfaatan berbagai macam gula selama 72 jam oleh isolat Pichia spp. dan Saccharomyces spp. pada media OF.
Isolat Pengamatan
Glukosa Mannosa Maltosa Xilosa Maltodekstrin
R ++++ ++++ + +++ ++
(+) Menunjukkan terjadi perubahan warna biru menjadi kuning, semakin banyak tanda ++ semakin berwarna kuning. (-) kontrol, warna tetap biru.
Seleksi Berdasarkan Kemampuan Menghasilkan Etanol
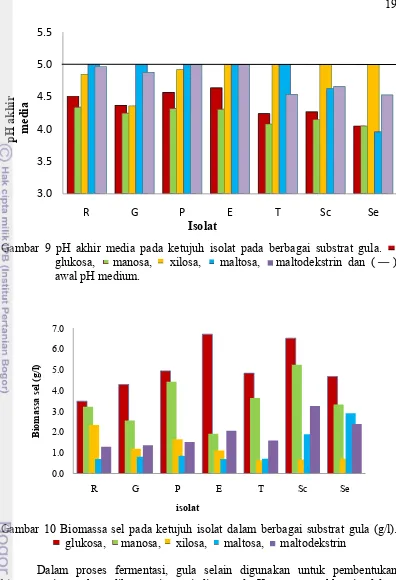
Karakterisasi cairan hasil fermentasi terdiri atas pengukuran pH awal, pH akhir fermentasi, total asam, biomassa dan kadar alkohol serta yield fermentasi, pemanfaatan substrat dan koefisien produk (Yp/s). Keasaman (pH) awal fermentasi ditetapkan dengan nilai pH 5.0. Hasil fermentasi menunjukkan bahwa hampir semua pH akhir media fermentasi mengalami penurunan nilai pH kecuali pada substrat maltosa oleh Pichia spp. dan Saccharomyces spp dan substrat maltodekstrin oleh isolat P dan E serta substrat xilosa oleh isolat E, T, Sc dan Se (Gambar 9).
Gambar 9 pH akhir media pada ketujuh isolat pada berbagai substrat gula. glukosa, manosa, xilosa, maltosa, maltodekstrin dan ( ) awal pH medium.
Gambar 10 Biomassa sel pada ketujuh isolat dalam berbagai substrat gula (g/l). glukosa, manosa, xilosa, maltosa, maltodekstrin
Dalam proses fermentasi, gula selain digunakan untuk pembentukan biomassa juga akan dikonversi menjadi etanol. Kemampuan khamir dalam menghasilkan etanol sangat dipengaruhi oleh jenis khamir dan substrat gula yang digunakan. Kadar etanol tertinggi dihasilkan oleh isolat R pada substrat glukosa sebesar 47.6 g/l, sedangkan dari substrat manosa dihasilkan oleh isolat T sebesar 41.5 g/l. Dengan substrat xilosa, kadar etanol tertinggi dihasilkan oleh isolat E sebesar 1.05 g/l. Pada substrat maltosa dan maltodekstrin, kadar etanol tertinggi dihasilkan oleh isolat Se sebesar 30.9 dan 3.3 g/l (Gambar 11). Etanol tidak dihasilkan pada beberapa substrat seperti xilosa, maltosa dan maltodekstrin oleh
Gambar 12 Total asam ketujuh isolat pada berbagai substrat gula. glukosa, manosa, xilosa, maltosa, maltodekstrin.
Pertumbuhan dan pembentukan produk oleh mikroba merupakan proses biokonversi nutrisi dalam fermentasi menjadi massa sel dan atau produk metabolit. Parameter-parameter penting yang menggambarkan efisiensi konversi substrat menjadi biomassa atau produk diantaranya P (produk), efisiensi substrat (∆S/S), yield biomassa (Yx/s), yield produk (Yp/s) dan yield produk per biomassa (Yp/x).
Efisiensi pemanfaatan substrat memperlihatkan substrat yang dikonsumsi oleh khamir memiliki kemampuan untuk menggunakan substrat untuk pembentukan biomassa dan produk. Substrat glukosa, manosa, xilosa, maltosa dan maltodekstrin dapat dimanfaatkan oleh berbagai isolat. Isolat R memiliki efisiensi pemanfaatan substrat tertinggi pada substrat glukosa yang ditunjukkan pada Gambar 13.
Isolat Pichia spp memiliki efisiensi pemanfaatan substrat terendah pada substrat xilosa, maltosa dan maltodekstrin. Isolat pembanding memiliki efisiensi pemanfaatan substrat terendah, substrat xilosa. Substrat glukosa dan manosa memiliki efisiensi pemanfaatan substrat tinggi. Hal ini dikarenakan glukosa dan manosa substrat yang cocok untuk dimanfaatkan oleh khamir untuk pembentukan biomassa maupun produk dibanding substrat yang lain.
Yield produk memperlihatkan substrat yang dikonversi menjadi produk. Membandingkan nilai yield produk dengan nilai yield biomassa, maka dapat dilihat pemanfaatan substrat untuk pembentukan produk atau biomassa. Bila nilai yield produk lebih tinggi dari nilai yield biomassa maka substrat dikonversi menjadi produk.
Nilai Yp/s lebih tinggi daripada nilai Yx/s menunjukkan bahwa substrat dimanfaatkan oleh khamir untuk membentuk etanol daripada membentuk biomassa. Kemampuan isolat menghasilkan yield produk dari setiap gram substrat yang terpakai oleh ketujuh isolat (Yp/s) dapat dilihat pada (Gambar 14). Nilai Yp/s sebesar 0.986 dan nilai Yx/s yang rendah memperlihatkan biomassa yang rendah, namun menghasilkan etanol yang tinggi. Isolat Se memanfaatkan substrat maltosa menjadi etanol daripada membentuk biomassa.
Gambar 14 Yield produk (Yp/s) oleh ketujuh isolat. glukosa, manosa, xilosa, maltosa, maltodekstrin.
Pada substrat xilosa hanya isolat E dan T yang memiliki nilai yield produk. Isolat E memiliki nilai yield produk tertinggi, namun memiliki nilai yield biomassa yang lebih tinggi. Hal ini menunjukkan bahwa isolat E lebih banyak menghasilkan biomassa daripada etanol.
Nilai yield biomassa (Yx/s) memperlihatkan konversi pemanfaatan substrat menjadi pembentukan sel. Nilai yield biomassa tinggi berarti substrat dikonversi menjadi biomassa dan nilai yield rendah menunjukkan substrat dikonversi menjadi etanol.
Yield biomassa menunjukkan rendeman pemakaian substrat terhadap pembentukan sel, nilai Yx/s yang rendah menunjukkan bahwa isolat R dengan
nilai 0.041 lebih memanfaatkan substrat glukosa untuk membentuk etanol daripada membentuk biomassa dan substrat maltodektrin lebih dimanfaatkan menjadi biomassa daripada etanol. Pada substrat manosa isolat E memberikan nilai Yx/s 0.026 lebih rendah daripada nilai Yp/s maka menunjukkan pemanfaatan substrat ke etanol (Gambar 15). Pada beberapa substrat seperti maltose dan maltodekstrin pada isolat Sc dan R memperlihatkan tidak dihasilkan etanol karena substrat lebih dimanfaatkan menjadi biomassa sel.
Gambar 15 Yield biomassa ketujuh isolat (Yx/s). glukosa, manosa, xilosa, maltosa, maltodekstrin.
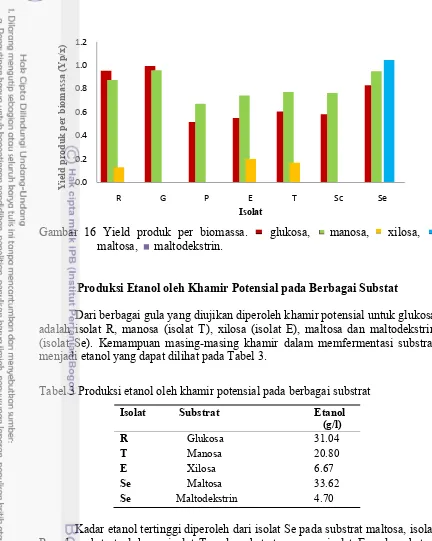
Nilai yield produk per biomassa (Yp/x) yang tinggi pada berbagai substrat oleh khamir menunjukkan bahwa pemanfaatan berbagai substrat untuk membentuk etanol lebih efisien oleh khamir. Nilai Yp/x terendah diperoleh dari isolat R pada substrat xilosa dengan nilai 0.215. Beberapa isolat tidak menghasilkan nilai yield produk perbiomassa diantaranya isolat R, E dan T pada substrat maltosa dan maltodekstrin. Isolat G, P dan Sc tidak menghasilkan yield perbiomassa pada substrat xilosa, maltosa dan maltodekstrin. Se tidak menghasilkan yield per biomassa pada substrat xilosa. Hal ini menunjukkan bahwa substrat tersebut tidak efisien dalam pembuatan etanol (Gambar 16).
Substrat glukosa dan manosa dapat digunakan oleh semua isolat membentuk biomassa dan menghasilkan produk. Hal ini menunjukkan bahwa substrat glukosa dan manosa lebih efisien bila dibanding dengan substrat lainnya.
Gambar 16 Yield produk per biomassa. glukosa, manosa, xilosa, maltosa, maltodekstrin.
Produksi Etanol oleh Khamir Potensial pada Berbagai Substat
Dari berbagai gula yang diujikan diperoleh khamir potensial untuk glukosa adalah isolat R, manosa (isolat T), xilosa (isolat E), maltosa dan maltodekstrin (isolat Se). Kemampuan masing-masing khamir dalam memfermentasi substrat menjadi etanol yang dapat dilihat pada Tabel 3.
Tabel 3 Produksi etanol oleh khamir potensial pada berbagai substrat
Isolat Substrat Etanol
(g/l)
R Glukosa 31.04
T Manosa 20.80
E Xilosa 6.67
Se Maltosa 33.62 Se Maltodekstrin 4.70
Kadar etanol tertinggi diperoleh dari isolat Se pada substrat maltosa, isolat R pada substrat glukosa, isolat T pada substrat manosa, isolat E pada substrat xilosa dan isolat Se pada substrat maltodekstrin.
0.0 0.2 0.4 0.6 0.8 1.0 1.2
R G P E T Sc Se
Yield produk per
biomassa (Yp/x)
PEMBAHASAN
Penggunaan etanol di dunia sebagai bahan bakar meningkat karena cadangan minyak bumi yang makin menipis, harga yang cenderung meningkat dan sebagai upaya untuk mereduksi emisi gas rumah kaca. Bioetanol adalah energi alternatif yang banyak diproduksi di dunia sampai saat ini. Henniges dan Zeddies (2006) melaporkan bahwa produksi bioetanol dunia meningkat pada dekade terakhir dimana Brazil merupakan negara penghasil bioetanol terbesar di dunia, walaupun produksi etanol Amerika Serikat saat ini mulai mendekati produksi Brazil. Perbedaan utamanya adalah biaya produksi di Brazil lebih rendah karena menggunakan bahan baku nira tebu, sedangkan di Amerika Serikat lebih banyak menggunakan bahan baku jagung. Saat ini pengunaan bahan baku berpati dan berlignoselulosa untuk produksi bioetanol sebagai pengembangan energi terbarukan mulai meningkat karena harga murah dan ketersediaan yang melimpah sehingga menekan biaya produksi.
Penggunaan nira tebu memiliki keunggulan karena karbohidrat berada dalam bentuk gula sederhana, sedangkan bahan berpati dan lignoselulosa harus dihidrolisis terlebih dahulu sebelum digunakan oleh khamir untuk dikonversi menjadi etanol.
Bahan baku berpati seperti sagu, ubi kayu dapat dihidrolisis menggunakan enzim maupun asam menjadi maltodektrin, maltosa dan glukosa. Bahan lignoselulosa dapat berasal dari limbah pertanian seperti bagase, tongkol jagung dan residu kehutanan. Komponen utama dari bahan lignoselulosa adalah selulosa, hemiselulosa dan lignin. Dengan bantuan perlakuan pendahuluan untuk penghilangan lignin, maka hidrolisis selulosa dan hemiselulosa dapat menghasilkan monomer-monomer gula. Hidrolisis merupakan proses pemecahan polisakarida di dalam biomassa menjadi monomer gula yang dapat dilakukan secara kimiawi ataupun enzimatis. Selulosa merupakan polimer linier glukan dengan struktur rantai yang seragam, sedangkan hemiselulosa terdiri atas monomer gula yaitu glukosa, manosa, galaktosa, xilosa dan arabinosa
Produksi bioetanol sangat dipengaruhi oleh faktor-faktor seperti jenis mikroorganisme, komposisi bahan baku dan kondisi proses fermentasi. Proses fermentasi dapat dilakukan dengan menggunakan khamir dari berbagai spesies seperti Saccharomyces cerevisiae, Saccharomyces ellipsoides dan Pichia stipitis. Saccharomyces secara umum hanya dapat menggunakan glukosa. Hasil hidrolisis komponen hemiselulosa seperti xilosa menjadi etanol dapat menggunakan khamir Pichia stipitis. Khamir memerlukan media dan lingkungan yang sesuai untuk pertumbuhan dan perkembangan.
optimal. Selama fase eksponensial isolat tumbuh pada laju pertumbuhan tertinggi diharapkan berguna untuk penetapan waktu panen inokulum pada proses fermentasi menggunakan substrat spesifik. Khamir memiliki pola pertumbuhan yang beragam bergantung pada spesiesnya dan jenis mediumnya. Hasil yang sama juga diperlihatkan dari hasil penelitian Cho et al. (2011) untuk khamir P. stipitis pada media YM yang mengandung glukosa laju pertumbuhan tertinggi tercapai pada jam ke-12, sedangkan S. cereviseae pada media yang sama memiliki laju pertumbuhan tertinggi pada jam ke-6 (Taniguchi et al. 1997). Shin (2002) melaporkan bahwa khamir Issactchenkia orientalis memperlihatkan massa sel tertinggi pada jam ke-6 masa inkubasi dengan menggunakan media glukosa.
Khamir yang akan digunakan untuk produksi bioetanol harus memiliki kemampuan dalam memfermentasi substrat sumber karbon. Hal ini diuji dengan menggunakan media Oxidative Fermentative (Tabel 1). Kemampuan khamir sangat bervariasi tergantung pada lintasan metabolisme setiap isolat. Chandel et al. (2011) melaporkan bahwa kemampuan mikroorganisme mengggunakan substrat untuk pertumbuhan dan pembentukan produk sangat spesifik untuk masing-masing spesies. Mikroorganisme seperti kapang, khamir dan bakteri memanfaatkan sumber gula yang beragam dan spesifik seperti glukosa, xilosa, arabinosa, manosa dan selulosa secara berbeda-beda untuk melakukan pertumbuhan dan proses fermentasi. Substrat glukosa dan manosa dapat digunakan oleh ketujuh isolat namun substrat maltodekstrin hanya dapat digunakan oleh isolat Se. Substrat maltosa hanya dapat digunakan oleh isolat Sc dan Se, sedangkan substrat xilosa hanya digunakan oleh isolat Pichia spp. Hal ini menunjukkan bahwa masing-masing isolat memiliki kemampuan yang berbeda dalam menggunakan substrat dalam proses fermentasi. Namun Rouhollah et al. (2007) melaporkan bahwa P. stipitis dan K. marxianus bisa memfermentasi glukosa, xilosa, manosa dan galaktosa, S. cerevisiaea tidak mampu menggunakan xilosa.
Proses fermentasi etanol secara umum dipengaruhi oleh konsentrasi substrat, suhu, nutrisi dan pH media. Pada umumnya pH fermentasi etanol menggunakan Pichia stipitis dan Saccharomyces spp berlangsung pada pH 5.0 dan suhu fermentasi 30 0C (Silva et al. 2011). Selama berlangsung proses fermentasi, pH media cenderung mengalami perubahan karena setiap satu mol glukosa akan dipecah menjadi dua mol asam piruvat dan melepaskan dua mol ion H+. Adanya ion H+ berpengaruh terhadap penurunan pH medium (Gambar 9). Kemampuan khamir mengasimilasi substrat sumber karbon menyebabkan akumulasi ion H+ sehingga tingkat keasamaan semakin tinggi. Elevri & Putra (2006) menyatakan bahwa nilai pH awal 4.5 pada media fermentasi sangat mempengaruhi kadar etanol yang dihasilkan karena proton-proton mempengaruhi kinerja enzim-enzim dalam lintasan glikolisis diantaranya fosfofruktokinase. Sumber nitrogen yang digunakan dalam fermentasi juga akan mempengaruhi keasaman media. Bila digunakan ammonia sebagai sumber nitrogen, maka pH cenderung mengalami penurunan. Jika ion-ion nitrogen dalam bentuk NH3+ maka akan menyisakan ion H+ yang tidak dimanfaatkan dan tertinggal dalam substrat. Penambahan ion H+ menyebabkan kenaikan tingkat keasaman dalam subsrat dan mengakibatkan pH turun (Wang et al. 1978).
kondisi proses aerobik). Medium harus mengandung sumber-sumber nutrient untuk menciptakan media fermentasi yang memenuhi kriteria: menghasilkan konsentrasi maksimum dari biomassa atau produk, mampu menghasilkan laju pembentukan produk maksimum (Stanbury & Whitaker 1984). Hal ini dapat dilihat dari kadar biomassa dan kadar etanol yang dihasilkan (Gambar 10, 11). Produksi biomassa dipengaruhi oleh sumber karbon, nitrogen, oksigen. Penambahan ekstrak khamir dapat memenuhi kebutuhan akan asam amino, vitamin dan magnesium. Penambahan urea dan MgSO4.7H2O dilakukan untuk meningkatkan kinerja khamir untuk produksi etanol (Sliva et al. 2012).
Jenis substrat yang digunakan akan mempengaruhi kinerja khamir selama fermentasi. Penggunaan substrat glukosa meningkatkan pertumbuhan biomassa sel tertinggi dibanding substrat lain. Hal ini dapat dilihat pada Isolat E kemudian diikuti oleh isolat T pada manosa, sedangkan isolat pada substrat maltosa dan xilosa memiliki kadar biomassa sel rendah (Gambar 10). Kadar biomassa sel yang dihasilkan dipengaruhi oleh kemampuan khamir mengkonsumsi substrat. Hal ini diduga karena khamir secara umum lebih mudah menggunakan glukosa dibandingkan dengan maltosa dan xilosa berkaitan dengan kompleksitas struktur gula dan lintasan metabolismenya. Khamir tidak memiliki enzim maltosa permease, yang akan membawa maltosa ke dalam sel dan maltase yang akan menghidrolisisnya menjadi dua D-glukosa di dalam sel (Subtil & Boles 2012).
Kandungan oksigen yang melimpah juga mendorong untuk pembentukan massa sel oleh khamir dan bukan untuk produksi etanol. Penggunaan aerasi pada proses fermentasi khamir menghasilkan penambahan biomassa sel dan etanol (Taniguchi et al. 2007). Kondisi ini sesuai dengan sifat khamir yang anaerobik fakultatif, dimana pada kondisi tersedianya oksigen, khamir melakukan respirasi dan mengubah gula menjadi CO2 dan H2O. Pada kondisi oksigen yang terbatas, sel khamir akan melakukan proses fermentasi dan akan terjadi konversi gula menjadi etanol dan CO2.
menggunakan substrat xilosa. Hal ini didukung oleh hasil penelitian Rouhollah et al. (2007) yang melaporkan khamir Saccharomyces cerevisiae juga tidak dapat mengkonversi substrat xilosa menjadi etanol.
Ketujuh isolat yang diuji mampu menggunakan substrat glukosa dan manosa menjadi etanol, namun isolat R, P, G, E dan T tidak mampu menggunakan substrat maltosa dan maltodekstrin menjadi etanol. Maltosa dan maltodekstrin adalah dimer dan oligomer dari glukosa. Dimer tidak dapat langsung diangkut ke dalam sel mikroba melainkan harus dihidrolisis menjadi monomer oleh enzim ekstraselular sebelum diangkut ke dalam sel. Untuk dapat memanfaatkan substrat maltosa dan maltodekstrin diperlukan enzim amilomaltase dan maltodekstrin fosforilase di dalam sel khamir (Moat et al. 2002). Isolat Se mampu melakukan fermentasi dengan substrat maltosa dan maltodekstrin, namun pemanfatan substrat maltosa dan maltodekstrin membutuhkan ekspresi gen yang berkaitan dengan maltosa dan maltodekstrin serta adanya induksi dari amilomaltase dan maltodekstrin fosforilase. Maltosa dihidrolisis oleh amilomaltase menjadi D-glukosa sedangkan maltodekstrin dikonversi ke glukosa-1-fosfat oleh maltodekstrin fosforilase. Isomerasi glukosa-1- fosfat ke glukosa-6-fosfat oleh fosfoglukomutase. Kedua produk tersebut digunakan melalui lintasan glikolisis (Moat et al. 2002). Penapisan khamir dari berbagai buah-buahan menghasilkan tiga isolat yaitu W. animalus, Pichia anomala dan S. cerevisiae yang dapat tahan terhadap konsentrasi yang tinggi dari glukosa dan alkohol serta dapat memanfaatkan maltosa dan dektrin sebagai sumber karbon (Lee et al. 2011).
g/l asam asetat, furfural dan HMF dalam media dapat menghambat pertumbuhan khamir dan proses fermentasi. Cho et al. (2010) memperlihatkan bahwa dengan adanya asam asetat 0.7 g/l pada media menghambat pertumbuhan sel sebanyak 24% tetapi tidak mempengaruhi produksi etanol.
Pada fermentasi, pertumbuhan dan pembentukan produk oleh mikroba merupakan proses biokonversi nutrisi dalam fermentasi menjadi massa sel dan atau produk metabolit. Parameter-parameter penting yang menggambarkan kinerja fermentasi atau efisiensi konversi substrat menjadi biomassa atau produk diantaranya jumlah P (produk), efisiensi substrat (∆S/S), yield biomassa (Yx/s), yield produk (Yp/s) dan yield poduk perbiomassa (Yp/x).
Ketujuh isolat memiliki efisiensi pemanfaatan substrat tertinggi dari substrat glukosa dan manosa. Glukosa dan manosa memiliki nilai efisiensi lebih tinggi bila dibanding dengan substrat yang lain. Isolat R memiliki efisiensi pemanfaatan substrat yang tertinggi pada substrat glukosa dan isolat E pada manosa. Hal ini menunjukkan bahwa substrat glukosa dan manosa dimanfaatkan dengan maksimal oleh isolat R dan E baik untuk membentuk sel maupun pembentukan produk (Gambar 13).
Monosakarida umumnya memiliki rumus molekul yang merupakan beberapa kelipatan CH2O. Glukosa (C6H12O6), monosakarida yang paling umum, memiliki peran penting yang utama dalam kimia kehidupan. Fruktosa isomer struktural glukosa adalah ketosa sedangkan glukosa, manosa, galaktosa adalah aldosa yang hanya berbeda dalam penempatan bagian-bagian disekitar karbon asimetrik (Campbell et al. 2002).
Organisme untuk dapat hidup dan berkembang harus makan. Makanan menyediakan sumber energi dan sumber karbon untuk biosintesis komponen sel. Karbohidrat merupakan sumber energi dapat berupa monosakarida, oligosakarida maupun polisakarida.
Glikolisis merupakan proses pemecahan glukosa menjadi senyawa triosa (C3), yaitu piruvat. Piruvat akan melewati lintasan siklus Krebs jika terdapat oksigen dan mengalami proses fermentasi jika tidak terdapat oksigen. Siklus Krebs merupakan proses oksidasi senyawa trikarboksilat menjadi sumber energi untuk pembentukan sel sedangkan pada proses fermentasi akan dihasilkan energi dan produk.
Substrat maltodekstrin harus dihidrolisis menjadi glukosa dengan bantuan enzim α-amilase sehingga menjadi maltosa. Hidrolisis maltosa memerlukan enzim amilase menjadi 2 glukosa, glukosa kemudian memasuki lintasan EMP menghasilkan piruvat. Substrat manosa memerlukan enzim heksokinase dan manosa 6-fosfatisomerase untuk menjadi glukosa 6-fosfat sehingga dapat memasuki lintasan EMP. Substrat xilosa memiliki lintasan yang berbeda yaitu Pentosa Phosphat (PP) dan pada pertengahan lintasan akan memasuki lintasan
Fruktosa‐6‐fosfat
Fruktosa‐1,6‐fosfat
Gliseraldehid‐3‐fosfat (G3P)
Fosfoenol piruvat
EMP yaitu pada fruktosa 6-fosfat atau Gliseraldehid 3-fosfat sehingga menghasilkan piruvat kemudian menjadi etanol.
Kesesuaian substrat oleh mikroorganisme juga ditentukan oleh ∆G (energi bebas). Campbell et al. (2002) menyatakan bahwa energi bebas adalah suatu kriteria untuk perubahan spontan. Energi bebas adalah bagian dari energi suatu sistem yang dapat melakukan kerja ketika suhu diseluruh sistem itu betul-betul seragam, seperti pada sel hidup. Suatu proses dapat terjadi secara spontan, sistem itu harus membebaskan energi, ∆G harus bernilai negatif. Semakin besar penurunan energi bebas, semakin besar jumlah kerja maksimum yang dapat dilakukan oleh proses spontan.
Pemecahan glukosa dan fruktosa ini bersifat eksergonik, dengan menghasilkan ∆G (perubahan energi bebas) sebesar -235.08 dan -200.92 kJ (Lampiran 4) untuk glukosa dan fruktosa. Glukosa memiliki nilai ∆G lebih negatif dibanding dengan isomernya. Hal ini menunjukkan bahwa proses spontan dapat dilakukan dengan kerja maksimum sehingga menghasilkan penurunan energi bebas yang besar sehingga dapat menyerap energi bebas yang terkandung dalam glukosa (Campbell et al. 2002). Hal ini menunjukkan bahwa substrat glukosa lebih efisien dibanding dengan substrat manosa, xilosa, maltosa dan maltodekstrin. Semakin komplek struktur memerlukan enzim dan lintasan yang berbeda sehingga memerlukan energi yang lebih banyak. Hal ini terlihat dari efisiensi yang rendah pada substrat xilosa dan maltodektrin.
Media untuk fermentasi yang baik harus memiliki kriteria dimana khamir mampu menghasilkan yield maksimum dari produk atau biomassa per g substrat yang digunakan dalam proses fermentasi. Hal ini dapat dilihat pada yield biomassa (Yx/s) dan yield produk (Yx/s) (Gambar 14, 15). Dimana Nilai yield biomassa (Yx/s) menunjukkan rendeman pemakaian substrat terhadap pembentukan sel. Nilai Yx/s yang rendah pada isolat R, menunjukkan bahwa isolat R lebih memanfaatkan substrat glukosa untuk membentuk produk etanol daripada pembentukan biomassa. Chandel et al. (2011) melaporkan bahwa Pichia stipitis hanya sedikit mengkonversi substrat menjadi biomassa dan lebih banyak dikonversi menjadi etanol. Nilai yield biomassa (Yx/s) tertinggi diperoleh dari substrat xilosa, maltosa dan maltodekstrin pada Pichia spp. Hal ini menunjukkan bahwa substrat lebih dimanfaatkan menjadi biomassa daripada produk. Isolat pembanding pada substrat xilosa tidak menghasilkan biomassa sehingga nilai Yx/s mendekati nol/ tidak ada. Hal ini disebabkan isolat tersebut tidak mampu hidup pada substrat tersebut.
Kemampuan isolat mengkonversi substrat menjadi produk (Yp/s) dimiliki oleh ketujuh isolat. Membandingkan nilai Yp/s pada substrat maltosa dari ketujuh isolat, maka terlihat bahwa nilai Yp/s tertinggi dimiliki oleh isolat Se. Hal ini menunjukkan bahwa substrat yang dimanfaatkan oleh isolat Se digunakan untuk membentuk etanol. Beberapa isolat memiliki nilai Yp/s yang sangat rendah bahkan tidak ada. Hal ini menunjukkan bahwa substrat tidak sepenuhnya dikonversi menjadi etanol dan substrat tidak pula dikonversi menjadi biomassa.
tersebut tidak efisien dalam pembuatan etanol. Ketujuh isolat memiliki nilai yield produk perbiomassa (Yp/x) yang tinggi pada substrat glukosa dan manosa sedangkan Se pada maltosa. Hal ini menunjukan bahwa substrat glukosa dana manosa lebih efisien bila dibanding dengan substrat lainya.
Secara umum substrat gula yang diuji merupakan monomer dari hidrolisat selulosa, hemiselulosa dan pati yang dapat digunakan sebagai substrat untuk menghasilkan etanol. Namun tidak semua khamir mampu menghasilkan etanol pada semua substrat gula tersebut. Isolat Pichia spp. tidak dapat menghasilkan etanol dari substrat maltosa dan maltodekstrin. Hal ini disebabkan tidak adanya enzim sebagai penghidrolisis pada substrat yang bersifat oligosakarida pada isolat Pichia spp. Khamir dapat langsung mengkonversi monomer glukosa menjadi etanol, sedangkan pati harus dikonversi/depolimerisasi dulu menjadi glukosa oleh enzim atau asam, kemudian difermentasi oleh khamir menjadi etanol. Isolat Saccharomyces spp. tidak menghasilkan etanol dari substrat xilosa. Hal ini diduga karena Saccharomyces spp. memiliki lintasan Embden Meyerhof Parnas (EMP) dan tidak memiliki lintasan Pentosa Phosphat (PP) sehingga tidak dapat mengkonversi xilosa sedangkan pada Pichia spp. memiliki lintasan metabolisme Embden Meyerhof Parnas (EMP) dan Pentosa Phosphat (PP) sehingga dapat menggunakan gula pentosa dan heksosa..
Berdasarkan hasil etanol yang dihasilkan oleh khamir potensial pada berbagai substrat (Tabel 3), isolat Se memiliki nilai etanol yang tertinggi pada substrat maltosa. Hal ini menunjukkan bahwa isolat Se memiliki enzim maltase yang dapat menghidrolisis maltosa menjadi dua molekul glukosa. Subtil & Boles (2012) melaporkan bahwa pada rekombinan S. cerevisiae maltosa dihidrolisis di dalam sel oleh enzim maltase menghasilkan dua molekul glukosa.
SIMPULAN DAN SARAN
Simpulan
Isolat khamir lokal yang berasal dari buah-buahan busuk ( isolat R, T dan E) memiliki kemampuan untuk memanfaatkan substrat glukosa, manosa dan xilosa, sedangkan isolat P dan G memiliki kemampuan untuk memanfaatkan substrat glukosa dan manosa. Ketujuh isolat mampu mengkonversi gula-gula tersebut menjadi etanol.
Produksi bioetanol menggunakan isolat khamir potensial mampu memproduksi etanol tertinggi oleh isolat R pada substrat glukosa sebesar 31.04 g/l, isolat T pada manosa sebesar 20.80 g/l, isolat E dari xilosa sebesar 6.67 g/l dan isolat Se pada maltosa dan maltodekstrin sebesar 33.62 g/l dan 4.70 g/l.
Saran
DAFTAR PUSTAKA
[AOAC]. 1999. Official Methods Analysis the Association of Official Analytical Chemist. New York.
Bandaru VVR, Somalanka SR, Mendu DR, Madicherla NR, Chityala A. 2006. Optimization of fermentation conditions for the production of ethanol from dago starch by co-immobilized amyloglucosidase and cells of Zymomonas mobilis using response surface methodology. Enzyme Microbial Technol 38: 209-214.
Bellido C, Bolado S, Coca M, Lucas S, Benito GG, Cubero MTG. 2011. Effect of inhibitors formed during wheat straw pretreatment on ethanol fermentation by Pichia stipitis. Biores Technol 102:10868–10874.
Campbell NA, Reece JB, Mitchell LG. 2002. Biologi. Ed ke-5 Volume ke-1. Lestari R, penerjemah; Amalia S, Lemeda S, Hilarius W, Hardani, editor. Jakarta: Erlangga. Terjemahan dari: Biology.
Chandel AK, Chandrasekhar G, Radhika K, Ravinder R and Ravindra P. 2011. Bioconversion of pentose sugars into ethanol: A review and future directions. Biotechnol Molec BiolRev 1:08-20.
Cho DH, Shin SJ, Bae Y, Park C, Kim YH. 2011. Ethanol production from acid hydrolysates based on the construction and demolition wood waste using Pichia stipitis. Biores Technol 102:4439–4443.
Dubois M, Gilles KA, Hamilton JK, Rebers PA, Smith F. 1956. Colorimetric method for determination of sugars and related substances. J Anal Chem. 3:350-356.
Doran PM. 1995. Bioprocess Engineering Principles. New York: Elsevier Science & Technology Book.
Fernandes L, Real MC, Loureiro V, Loureiro MC, Leeao C. 1997. Glucose respiration and fermentation in Zigosaccharomyces bailii and Saccharomyces cerevisiae different sensitivity patterns to ethanol and acetic acid. Appl Microbiol 25:249-253.
Henniges, Zeddies. 2006. Bioengineering and agriculture: Promises and challenges. Internasional Food Policy Research Institute. http://www.ifpri.org/2020/focus/focus14/focus1409. pdf [1 Desember 2012]
Hugh R, Leifson E. 1953. The taxonomic significance of fermentative versus
oxidative metabolism of carbohydrates by various Gram negative bacteria. J Bacteriol 66:24-26.
Kent HS. 2009. Biofuels in the US challenges and opportunities. J Renew Energy 34: 14-22.
Kennedy JF, Knill CJ, Taylor DW. 1995. Maltodextrins. Di dalam: Kearsley MWJ dan Dziedzic SZ (eds) Handbook of Starch Hydrolysis Product and Their Derivatives. Blackie Academic & Professionsl, London. Chapter 3. Pp 65-83.
Kumar A, Singh LK, Ghosh S. 2009. Bioconversion of lignocellulosic fraction of water-hyacinth (Eichhornia crassipes) hemicellulose acid hydrolysate to ethanol by Pichia stipitis. Biores Technol 100:3293–3297.
Kumar P, Barrett DM, Delwiche MJ, Stroeve. 2009. Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production. Ind Eng Chem 48:3713–3729.
Lee YJ, Choi YR, Lee SY, Park JT, Shim JH, Park KH, Kim JW. 2011. Screening wild yeast strains for alcohol fermentation from various fruits. Mycobiol 39:33-39.
Li Y, Park JY, Shiroma R, Tokuyasu K. 2011. Bioethanol production from rice straw by a sequential use of Saccharomyces cerevisiae and Pichia stipitis with heat inactivation of Saccharomyces cerevisiae cells prior to xylose fermentation. J Biosci Bioeng 111:682–686.
Madigan MT, Martinko JM, Stahl DA, Clark DP. 2012. Brock: Biology of Microorganims. San Francisco: Benjamin Cummings.
Meyrial V, Delgenes JP, Romieu C, Moletta R, Gounot AM. 1995. Ethanol tolerance and activity of plasma membrane ATPase in Pichia stipitis grown on D-xylose or on D-glucose. Enzyme Microbial Technol 17:535-540.
Moat AG, Foster JW, Spector MP. 2002. Microbial Physiology. New York: Inc, Wiley Liss.
Naik SN, Goud VV, Rout PK, Dalai AK 2010. Production of first and second generation biofuels. Renew Sustain EnergyRev 14:578-597.
Nigam JN. 2001. Ethanol production from wheat straw hemicelluloses hydrolysate by Pichia stipitis.J Biotechnol 87:17-27.
Peres EJ, Dorado JM, Rubia TD, Martınes J. 2002. Biodegradation and biological treatments of cellulose, hemicelluloses and lignin. Int Microbiol 5: 53–63. Roder N, Ellis PR, Butterworth PJ. 2005. Starch molecular and nutritional
properties. Adv Mol Med 1: 5-14.
Rouhollah H, Iraj N, Giti E, Sorah A. 2007. Mixed sugar fermentation by Pichia stipitis, Sacharomyces cerevisiaea, and an isolated xylose fermenting Kluyveromyces marxianus and their co-cultures. Afr J Biotechnol 9:1110-1114.
Rowell RM, Pettersen R, Han JS, Rowell JS, Tshhalabala MA. 2005. Cell wall chemistry. In Handbook of wood chemistry and wood composites. New York. CRC press.
Ruriani E, Sunarti TC, Meryandini A. 2012. Yeast isolation for bioethanol production. Hayati J Biosci 3:15-149.
Shin HT, Lim YB, Koh JH, Kim JY, Baig SY, Lee JH. 2002. Growth of Issatchenkia orientalis in aerobic batch and fed-batch cultures. JMicrobiol 1:82-85.
Silva JPA, Solange IM, Ines C. Roberto, Jose AT. 2012. Fermentation medium and oxygen transfer conditions that maximize the xylose conversion to ethanol by Pichia stipitis. Renew Energy 37:259-265.
Subtil Thorsten, Boles Eckhard. 2012. Competition between pentoses and glucose during uptake and catabolism in recombinant Saccharomyces cerevisiae. Biofuels 5:14.
Taniguchi M, Tohmat T, Itaya T, Fuji M. 2007. Ethanol production from a mixture of glucose and xylose by co-culture of Pichia stipitis and a respiratory deficient mutant of Saccharomyces cerevisiae. J Biotechnol 4:364-370.
Thalagala TATP, Kodama S, Mishima T, Isono N, Furujyo A, Kawasaki Y, Hisamatsu M, 2009. Study on ethanol fermentation using D-glucosa rich fractions obtained from lignocelluloses by a two-step extraction with sulfur acid and Issatchenkia orientalis MF 121. J Appl Glycosci 56: 7-11. Wang DIC, Cooney CL, Demain AL, Dunnil P, Humphrey AE, Lolly MD. 10979.
Fermentation and Enzyme Technology. New York: John Wiley & Sons. White, D. 2000. The Physiology and Biochemistry of Prokaryotes. New York:
Oxford University Press.
Wyman CE. 1994. Ethanol from lignocellulosic biomass. Biores Technol 50:3-16.
Yuliana E. 2011. Produksi bioetanol dari empulur sagu menggunakan enzim dan khamir dari isolat lokal [tesis]. Bogor: Program Studi Bioteknologi, Sekolah Pascasarjana Institut Pertanian Bogor.
Pengukuran pH dilakukan dengan menggunakan pH-meter. Setelah dicuci dengan akuades, elektroda dapat dimasukkan ke dalam contoh yang akan diukur pH-nya. Nilai pH adalah nilai yang ditampilkan setelah menunjukkan nilai konstan.
2. Total biomassa
Pengukuran biomassa dilakukan dengan penyaringan cairan fermentasi menggunakan kertas saring berpori kecil (Whatman No. 42). Biomassa yang tertahan pada kertas saring kemudian dikeringkan dengan menggunakan oven bersuhu 70 0C selama 24 jam dan ditimbang hingga bobotnya konstan.
Biomassa (g/l) = (Bobot kertas saring + sampel) – bobot kertas saring
3. Total Asam
Total asam ditentukan dengan cara titrasi dan dinyatakan sebagai asam laktat. Sebanyak 1 ml contoh dipipet ke dalam labu Erlenmeyer 50 ml, ditambahkan dengan 9 ml destilata, kemudian dipanaskan untuk menghilangkan CO2 yang ada. Campuran kemudian dititrasi dengan NaOH 0.1 N dengan indikator fenolftalein.
Total asam (g/l) = ml NaOH x N NaOH x 9 x faktor pengenceran ml contoh
4. Kadar Etanol (AOAC 1999)
Penentuan kadar etanol dilakukan dengan metode Gas Chromatography (GC). Penentuan kadar etanol dengan metode GC dilakukan dengan membandingkan waktu retensi contoh dengan waktu retensi standar etanol. Kondisi pengujian GC adalah sebagai berikut:
Instrument : Agilent Technologies 6890N Detektor : Flame Ionisation Detector (FID) Kolom : HP-5 Capilarry Coloumm
Suhu oven : Length (m) 30 X 0.32 (mm) I.D X 0.25 (µm) Film Thickness
Suhu injection port : Initial Temperature at 30 0C hold for 13 minute Gas pembawa : 250 0C
Mode kolom : 200 0C Volume injeksi : Helium
Split : Constant Flow
Sebelum dilakukan pengukuran kadar etanol sampel terlebih dahulu dibuat kurva standar menggunakan etanol murni dengan pelarut methanol. Kadar etanol sampel diperoleh dari persamaan kurva standar berikut:
y = 1089.05x dengan R2 = 0.9998
dimana y adalah luas area kurva (%) dan konsentrasi etanol (% v/v).
Pengukuran kadar etanol dilakukan dengan pemisahan cairan fermentasi dengan massa selnya. Pemisahan cairan fermentasi dengan massa sel dilakukan dengan menggunakan sentrifuse selama 15 menit dengan kecepatan 2800 rpm. Cairan fermentasi didistilasi kemudian diukur menggunakan alkoholmeter.
6. Kadar etanol berdasarkan berat massa jenis (Piknometer)
Pengukuran kadar etanol berdasarkan berat massa jenis (piknometer) mula-mula dilakukan dengan menimbang piknometer kosong dalam keadaan bersih dan kering ( a g). Pada tahap kedua dilakukan dengan mengisi piknometer dengan aquades yang telah dketahui berat jenisnya (ρ) kemudian menimbang piknometer yang telah diisi aquades (b g). Volume piknometer yang sebenarnya dapat dihitung dengan rumus dibawah ini.
Lampiran 2. Penentuan kadar total gula (Metode Phenol H2SO4, (Dubois
1956)
1. Penentuan Total Gula
- Pembuatan kurva standar glukosa
Pembuatan kurva standar total gula diperoleh dari pengukuran absorbansi gula (glukosa, manosa, xilosa, maltosa dan maltodekstrin) pada berbagai konsentrasi (disajikan pada Tabel di bawah). Larutan standar 1 ml dimasukkan ke dalam tabung reaksi, kemudian ditambahkan 0.5 ml larutan fenol 5% dan divortex. Setelah itu ditambahkan 2.5 ml H2SO4 pekat secara cepat, divortex dan didinginkan selama 20 menit. Setelah dingin larutan divortex dan diukur absorbansinya pada panjang gelombang 490 nm.
Konsentrasi glukosa
- Pembuatan kurva standar manosa Konsentrasi glukosa
0.00 0.02 0.04 0.06 0.08 0.10 0.12
Absorbansi
Kurva Standar Manosa
- Pembuatan kurva standar xilosa Konsentrasi glukosa
0.00 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08
Absorbansi
- Pembuatan kurva standar maltosa Konsentrasi glukosa
- Pembuatan kurva standar maltodekstrin Konsentrasi glukosa
0.00 0.02 0.04 0.06 0.08 0.10 0.12 0.14 0.16
Absorbansi
Kurva standar maltodekstrin
- Penentuan total gula sampel
Metode pengujian sampel sama dengan pembuatan kurva standar total gula, tetapi 1 ml larutan gula standar diganti dengan 1 ml sampel. Kadar total gula sampel diperoleh dari persamaan kurva standar dengan y sebagai nilai absorbansi dan x sebagai total gula (mg/ml).
y = 12.53x + 0.008 R² = 0.992
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
0.00 0.02 0.04 0.06 0.08
Absorbansi
Lampiran 3. Karakterisasi fermentasi
1. pH akhir media pada ketujuh isolat pada berbagai substrat gula (g/l) Isolat Awal Glukosa Manosa Xilosa Maltosa Maltodektrin
Rataan
2.Biomassa sel pada ketujuh isolat pada berbagai substrat gula (g/l) Isolat Glukosa Manosa Xilosa Maltosa Maltodektrin
Rataan
3. Kadar etanol oleh ketujuh isolat pada berbagai substrat gula (g/l) solat Glukosa manosa xilosa maltosa Maltodekstrin
4. Total asam ketujuh isolat pada berbagai substrat gula (g/l)
Isolat Glukosa Manosa Xilosa Maltosa Maltodektrin
Rataan
5. Efisiensi pemanfaatan substrat (∆S/S) oleh ketujuh isolat pada berbagai substrat gula
Isolat Glukosa manosa xilosa maltosa Maltodekstrin
Rataan
6. Yield produk (Yp/s) oleh ketujuh isolat pada berbagai substrat gula Isolat Glukosa manosa xilosa maltosa Maltodekstrin