YANG DIHASILKAN OLEH AKTINOMISETES LAUT
ROFIQ SUNARYANTO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi dengan judul ”Isolasi, Purifikasi, Identifikasi, dan Optimasi Medium Fermentasi Antibiotik yang Dihasilkan oleh Aktinomisetes Laut” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Juli 2011
Fermentation Medium Optimization of Antibiotic Produced by Marine Actinomycetes. Under direction of TUN TEDJA IRAWADI, ZAINAL ALIM MAS’UD, LIESBETINI HARTOTO, BAMBANG MARWOTO.
Isolation and purification of active compounds produced by marine actinomycetes has been carried out. Marine sediment samples were obtained from 3 different places in Banten West Coast, Cirebon North Coast, and Yogyakarta South Coasts. A total of 40 actinomycetes isolates were obtained 4 isolates were active against Escherichia coli ATCC 25922, 5 isolates were active against Staphylococcus aureus ATCC25923, 4 isolates were active against Bacillus subtilis ATCC 66923, 4 isolates were active against Pseudomonas aeroginosa ATCC27853, 4 isolates were active against Candida albican BIOMCC00122, and 4 isolates were active against Aspergillus niger BIOMCC00134. A11 isolate showed the most active to Gram-positive and Gram-negative bacteria. Species identification using 16S rRNA gene sequencing showed that A11 isolate is Streptomyces sp.
Elucidation of its molecular formula and structure using LC-MS, 1H NMR, 13
C NMR, and 13C DEPT NMR showed the antibiotic was cyclo(tyrosyl-prolyl), molecule formula was C14H16N2O3 which has a melting point of 140 °C. Minimum Inhibitory Concentration (MIC) of the antibiotic was determined against 4 bacterial test strains, namely Escherichia coli ATCC 25922, Pseudomonas aeruginosa ATCC 27853, Staphylococcus aureus ATCC 25923, and Bacillus subtilis ATCC 66923, which were inhibited at 27, 69, 80, and 74 µg mL-1, respectively.
Fermentation profile of Streptomyces sp. A11 showed a lag phase which occurred until 8 hours, a log phase from 9 until 48 hours and a stationary phase from 48 until 144 hours. The growth phase showed maximum specific growth rate (μmax) of 0.04 hour and the rate of substrate conversion into biomass (Y ) of 0.6 -1 x/s gram biomass per gram substrate. The optimum temperature and pH of cyclo(tyrosyl-prolyl) fermentation were 30 °C and 6.5-7.5, respectively.
Optimum composition of fermentation medium was determined with three independent variables: dextrin as a carbon source, peptone as nitrogen source, and a mixture of mineral salts using Response Surface Methodology. The results showed that the three variables significantly affected the activity of cyclo(tyrosyl-prolyl). Peptone gave the strongest effect compared to dextrin and mineral salts. Interaction was found between dextrin and peptone. On the contrary, no interaction was observed between peptone and mineral salts, and between dextrin and mineral salts. Using a mathematical model, the most optimum composition of the medium were found to be dextrin (32.55 g L ), peptone (11.22 g L ), and -1 -1 mineral salt (8.65 mL), in which 51.54 g L cyclo(tyrosyl-prolyl) was produced. -1 Verification of the model in laboratory showed the cyclo(tyrosyl-prolyl) activity to be 50.04 mg L . Thus, the difference between the result of the experiment and -1 the expected response value was 2.9%.
ROFIQ SUNARYANTO. Isolasi, Pemurnian, Identifikasi, dan Optimasi Medium Fermentasi Antibiotik yang Dihasilkan oleh Aktinomisetes Laut. Dibawah bimbingan TUN TEDJA IRAWADI, ZAINAL ALIM MAS’UD, LIESBETINI HARTOTO, BAMBANG MARWOTO
Kebutuhan antibiotik, anti fungal, maupun anti kanker baru masih sangat diperlukan, terutama yang efektif melawan bakteri resisten, virus, protozoa, fungi atau kanker. Untuk mendapatkan antibiotik baru, para peneliti telah banyak melakukan berbagai cara seperti eksplorasi senyawa aktif dari mikroba, tumbuhan, maupun sintesis secara kimia. Salah satu mikroba yang banyak diteliti untuk diambil senyawa aktifnya adalah aktinomisetes.
Indonesia merupakan negara kepulauan yang memiliki bentangan laut yang luas, kurang lebih 3,1 juta km2 atau hampir 2 kali lipat dibandingkan luas daratannya. Karakteristik laut yang bermacam-macam mengindikasikan biodiversitas hayati yang besar, khususnya biodiversitas mikroba laut. Namun demikian potensi ini belum banyak dimanfaatkan. Penelitian ini bertujuan untuk mendapatkan senyawa aktif yang berpotensi sebagai antibiotik dan memproduksinya dalam skala laboratorium yang dihasilkan oleh aktinomisetes laut melalui isolasi, penapisan, pemurnian, identifikasi dan optimasi medium fermentasi.
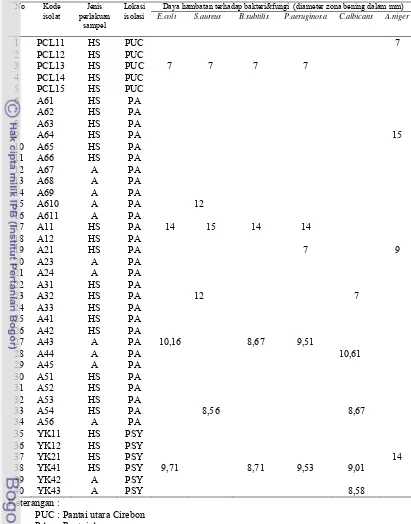
Telah dilakukan isolasi dan penapisan aktinomisetes laut yang mampu menghasilkan senyawa antibakteri. Sampel sedimen laut diambil dari 3 tempat berbeda yaitu di Pantai Barat Banten, Pantai Utara Cirebon, dan Pantai Selatan Yogyakarta. Hasil percobaan menunjukkan bahwa pra-perlakuan dengan pemanasan dan pengasaman sampel serta penambahan sikloheksimid 100 μg mL -1, nistatin 25 μg mL-1, asam nalidiksat 20 μg mL-1, dan rifampisin 5 μg mL-1 mampu menekan pertumbuhan bakteri dan kapang kontaminan. Total hasil isolasi diperoleh dari sampel sedimen laut sebanyak 40 isolat aktinomisetes. Penapisan dengan menggunakan 6 macam mikroba uji diperoleh 4 isolat yang mampu menghambat pertumbuhan Escherichia coli ATCC 25922, 5 isolat menghambat Staphylococcus aureus ATCC25923, 4 isolat menghambat Bacillus subtilis ATCC 66923, 4 isolat menghambat Pseudomonas aeroginosa ATCC27853, 4 isolat menghambat Candida albican BIOMCC00122, dan 4 isolat menghambat Aspergillus niger BIOMCC00134.
Isolat A11 menunjukkan isolat yang memiliki daya hambat paling kuat terhadap bakteri Gram-positif dan Gram-negatif sehingga isolat tersebut dipilih untuk penelitian selanjutnya. Hasil identifikasi menggunakan 16S rRNA menunjukkan bahwa isolat A11 adalah Streptomyces sp. (homology 100%) kelas Actinobacteria, ordo Actinomycetales, famili Streptomycetaceae, dan genus Streptomyces.
preparatif, selanjutnya dilakukan elusidasi struktur molekulnya. Hasil analisis menggunakan LC-MS diketahui senyawa aktif yang dihasilkan oleh isolat A11 memiliki bobot molekul sebesar 260 g mol-1, rumus molekul C14H16N2O3. Hasil elusidasi struktur molekul menggunakan 1HNMR, 13C NMR, DEPT 13C NMR, dan FTIR diketahui senyawa aktif yang dihasilkan oleh Streptomyces sp.A11 adalah siklo(tirosil-prolil). Senyawa aktif ini memiliki titik leleh sebesar 140 oC.
Minimum Inhibitory Concentration (MIC) ditentukan menggunakan 4 mikroba uji dengan metode difusi agar kertas cakram. Hasil percobaan menunjukkan bahwa senyawa aktif yang dihasilkan oleh Streptomyces sp.A11 memiliki MIC terhadap Escherichia coli ATCC 25922 sebesar 27 μg mL-1, Pseudomonas aeruginosa ATCC 27853 sebesar 69 μg mL-1
, Staphylococcus aureus ATCC 25923 sebesar 80 μg mL-1, and Bacillus subtilis ATCC 66923 sebesar 74 μg mL-1
.
Profil fermentasi isolat Streptomyces sp. menunjukkan fase lag terjadi sampai dengan jam ke-8, fase pertumbuhan cepat (fase logaritma) terjadi pada selang waktu jam ke-9 sampai dengan jam ke-48, dan fase stasioner terjadi pada selang waktu jam ke-48 sampai dengan jam ke-144. Pada fase pertumbuhan cepat (fase logaritma) laju pertumbuhan maksimum (μmaks) sebesar 0,04 jam dan -1 rendemen pembentukan biomassa per massa substrat (Y ) sebesar 0,6 g biomassa x/s per massa substrat. Senyawa aktif diproduksi setelah memasuki fase stasioner yaitu mulai jam ke-60 yang menunjukkan bahwa senyawa aktif yang dihasilkan tergolong dalam metabolit sekunder.
Penentuan suhu optimum pada proses fermentasi untuk menghasilkan siklo(tirosil-prolil) dilakukan dalam rentang suhu 26 sampai dengan 34 °C. Hasil percobaan menunjukkan bahwa suhu 30 °C merupakan suhu terbaik untuk proses fermentasi siklo(tirosil-prolil). Penentuan pH optimum proses fermentasi siklo(tirosil-prolil) dilakukan pada rentang pH 4 sampai dengan pH 8. Hasil percobaan menunjukkan bahwa kisaran pH 6,5 sampai dengan pH 7,5 adalah kisaran pH terbaik untuk proses fermentasi siklo(tirosil-prolil).
Optimasi medium fermentasi dilakukan dengan menggunakan Response Surface Methodology. Variabel bebas yang digunakan adalah dekstrin sebagai sumber karbon, pepton sebagai sumber nitrogen, dan mineral. Respon yang ditentukan adalah konsentrasi siklo(tirosil-prolil). Hasil penelitian menunjukkan bahwa ketiga variabel bebas yang digunakan dalam proses optimasi medium fermentasi ini menunjukkan pengaruh nyata terhadap siklo(tirosil-prolil). Model matematik yang diperoleh dalam optimasi medium fermentasi ini menghasilkan variabel bebas optimum sebagai berikut; konsentrasi dekstrin, pepton, dan mineral berturut-turut sebesar 32,55 g L , 11,22 g L dan 8,65 mL, dengan dugaan respon -1 -1 yang diperoleh sebesar 51,54 g L . Hasil validasi model yang dilakukan di -1 laboratorium menunjukkan konsentrasi siklo(tirosil-prolil) yang dihasilkan pada proses fermentasi selama 144 jam sebesar 50,04 g L . Perbedaan respon dugaan -1 yang diperoleh dari model dengan nilai hasil percobaan sebesar 2,9% menunjukkan bahwa model yang digunakan telah sesuai.
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
OPTIMASI MEDIUM FERMENTASI ANTIBIOTIK
YANG DIHASILKAN OLEH AKTINOMISETES LAUT
ROFIQ SUNARYANTO
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada Program Studi Teknologi Industri Pertanian
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Isolasi, Purifikasi, Identifikasi, dan Optimasi Medium Fermentasi Antibiotik yang Dihasilkan oleh
Aktinomisetes Laut Nama Mahasiswa : Rofiq Sunaryanto
NIM : F361070142
Program Studi : Teknologi Industri Pertanian
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Tun Tedja Irawadi, MS. Ketua
Dr. Ir. Zainal Alim Mas’ud, DEA Anggota
Dr. Ir. Liesbetini Hartoto, MS Anggota
Dr. Bambang Marwoto., Apt, MEng Anggota
Diketahui
Ketua Program Studi Teknologi Industri Pertanian
Dr. Ir. Machfud, MS
Dekan Sekolah Pascasarjana Institut Pertanian Bogor
Dr. Ir. Dahrul Syah, M.Sc, Agr
Ujian tertutup pada :
Hari/tanggal : Kamis, 9 Juni 2011 Penguji luar komisi pada ujian tertutup:
: Dr. Ir. Mulyorini Rahayuningsih, MS
(Dosen Pengajar Departement Teknologi Industri Pertanian, Institut Pertanian Bogor)
: Dr. Ir. Dyah Iswanti Pradono. M.Agr
(Dosen Pengajar Departement Kimia, Institut Pertanian Bogor)
Ujian terbuka pada : 28 Juli 2011
Hari/tanggal : Kamis, 28 Juli 2011 Penguji luar komisi pada ujian terbuka :
: Prof. Dr. Ir. Ani Suryani, DEA
(Guru Besar Fakultas Teknologi Pertanian) : Dr.Ir. Listyani Wijayanti
Puji Syukur kehadirat Allah SWT karena berkat rahmat dan hidayah-Nya karya ilmiah yang berjudul “Isolasi, Purifikasi, Identifikasi, Dan Optimasi Medium Fermentasi Antibiotik Yang Dihasilkan Oleh Aktinomisetes Laut” berhasil diselesaikan dengan baik. Karya ilmiah ini disusun sebagai salah satu syarat menyelesaikan studi program doktor di Sekolah Pascasarjana Institut Pertanian Bogor. Penelitian yang telah dilakukan selama 3 (tiga) tahun bertujuan secara umum untuk mendapatkan senyawa aktif yang memiliki sifat antibakteri atau antifungi yang dihasilkan oleh aktinomisetes laut.
Penulis mengucapkan terimakasih kepada Ibu Prof. Dr. Ir. Tun Tedja Irawadi, MS selaku ketua komisi pembimbing, Bapak Dr. Ir. Zainal Alim Mas’ud, DEA, Bapak Dr. Bambang Marwoto, M.Eng dan Ibu Dr. Ir. Liesbetini Hartoto, MS selaku anggota komisi pembimbing atas bimbingan dan pengarahannya sehingga penulis dapat menyelesaikan penelitian ini. Ucapan terima kasih juga saya sampaikan kepada Bapak Dr. Ir. Machfud, MS sebagai Ketua Program Studi Teknologi Industri Pertanian, Institut Pertanian Bogor yang telah memberikan saran pada proses penyelesaian penulisan disertasi ini. Penulis ucapkan terima kasih kepada Kepala Badan Pengkajian dan Penerapan Teknologi, Deputi Kepala Bidang Agroindustri dan Bioteknologi BPPT, Kepala Balai Pengkajian Bioteknologi BPPT, dan Kepala Seksi Bioteknologi Industri Balai Pengkajian Bioteknologi BPPT yang telah memberikan ijin untuk melanjutkan studi S3 dan memberikan fasilitas penelitian untuk disertasi penulis. Demikian juga penulis mengucapkan terima kasih kepada rekan-rekan peneliti dan teknisi di Laboratorium Mikrobiologi, Teknologi Gen, Proses Hilir, dan Laboratorium Analitik. Penulis mengucapkan terima kasih kepada Mercian Co.Jp dan segenap penelitinya yang telah membantu dalam proses analisis menggunakan LC-MS, 1
HNMR, 13C NMR, dan DEPT 13C NMR. Penulis mengucapkan terima kasih kepada rekan-rekan mahasiswa Teknologi industri Pertanian, Institut Pertanian Bogor atas bantuan dan peran serta dalam penyelesaian disertasi ini.
Farrastya Kamil yang tidak henti-hentinya memberikan semangat dalam penyelesaian studi penulis.
Penulis menyadari bahwa karya ilmiah ini masih mempunyai keterbatasan. Kritik dan saran penulis harapkan dari semua pihak untuk perbaikan, dan semoga hasil penelitian ini dapat berguna bagi yang membutuhkan.
Bogor, Juli 2011
Penulis dilahirkan di Gunung Kidul pada tanggal 25 September 1971 dari ayah Sutarto (Alm) dan Ibu Hj. Sudarti. Penulis merupakan anak ke-5 dari lima bersaudara.
Tahun 1990 penulis lulus dari SMA Negeri I Wonosari, Gunung Kidul, Yogyakarta dan pada tahun yang sama lulus seleksi masuk UMPTN di Jurusan Kimia, Fakultas MIPA, Universitas Gadjah Mada. Pada bulan Januari 1997 penulis diterima sebagai pegawai negeri di Badan Pengkajian dan Penerapan Teknologi (BPPT) dan ditempatkan di Pusat Pengkajian dan Penerapan Bioteknologi. Pada Tahun 2000 penulis mendapatkan beasiswa dari STAID untuk melanjutkan studi program S2. Pada tahun tersebut penulis melanjutkan studi program S2 di Program Studi Teknologi Industri Pertanian, Institut Pertanian Bogor. Pada tahun 2003 penulis menyelesaikan studi S2 di Teknologi Industri Pertanian Bogor. Pada tahun 2007 penulis mendapatkan beasiswa dari Islamic Development Bank untuk melanjutkan studi S3, dan mengambil studi di Program Studi Teknologi Industri Pertanian, Institut Pertanian Bogor.
diselenggarakan oleh Indonesian Microbiology Society (IMS) dan International Union of Microbiological Societies (IUMS), tanggal 22-24 Juni 2011 di Denpasar Bali. Seminar Internasional “5th Conference of AASP (Asian Association of Schools of Pharmacy), yang diselenggarakan oleh sekolah farmasi Institut Teknologi Bandung dan AASP tanggal 16-19 Juni 2011.
Isolasi Penapisan Aktinomisetes Laut Penghasil Antimikroba. Indonesia Journal of Marine Science (IJMS). Volume 14 No.2. Juni 2009, halaman 98-101. Diterbitkan oleh Jurusan Ilmu Kelautan Universitas Diponegoro.
Isolation and Characterization of Antimicrobial Substance from Marine Streptomyces sp. Journal of Microbiology Indonesia. Volume 4. No.2. Agustus 2010, halaman 84-89. Diterbitkan oleh The Indonesian Society for Microbiology.
Antibiotic Compound from Marine Actinomycetes (Streptomyces sp. A11); Isolation and Structure Elucidation. Indonesia Journal of Chemistry, Volume 10. No. 2. July 2010, halaman 219-225. Diterbitkan oleh Department of Chemistry, Universitas Gadjah Mada.
Isolasi dan Elusidasi Struktur Kimia Antimikroba yang Dihasilkan oleh Aktinomisetes Laut (senyawa aktif Madumycin I oleh isolat A32), halaman 11-18. Jurnal Pasca Panen dan Bioteknologi Kelautan dan Perikanan. Volume 5 No. 1 Juni 2010.
Halaman
HALAMAN JUDUL.……..……… i
HALAMAN PENGESAHAN….……… ii
KATA PENGANTAR ………... iii
DAFTAR ISI... ...……..………..……… iv
DAFTAR TABEL ...……..……… v
DAFTAR GAMBAR ……… vi
DAFTAR LAMPIRAN ….……… vii
I PENDAHULUAN...………... 1
I.1. Latar Belakang Masalah………..……...……… 1
I.2. Tujuan Penelitian ………...……...……… 4
I.3. Hipotesis ………...………... 5
I.4. Ruang Lingkup Penelitian...…….……… 6
II TINJAUAN PUSTAKA ………... 7
II.1. Aktinomisetes.………....………... 7
II.2. Isolasi Aktinomisetes ... 9
II.3. Antibiotik .………... 13
II.4. Metabolit Mikroba ………... 14
II.5. Pertumbuhan Mikrobial ……… 16
II.6. Identifikasi Mikroba Menggunakan 16S rRNA ... 21
II.7. Response Surface Methodology ... 23
III METODOLOGI PENELITIAN ...………. 29
III.1. Kerangka Pemikiran………... 29
III.2.Tempat dan Waktu Penelitian ……….………... 32
III.3. Bahan dan Peralatan Penelitian ... 33
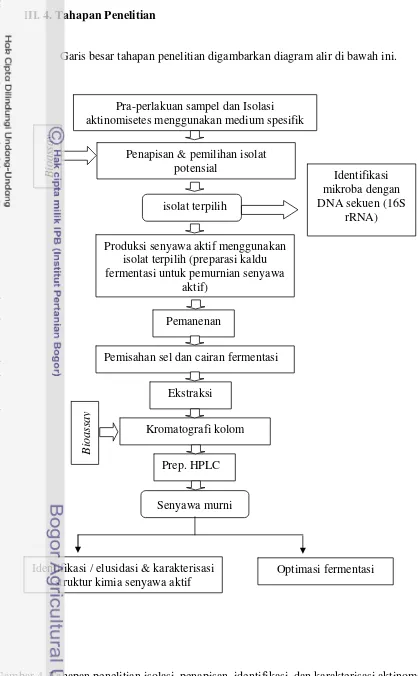
III.4.Tahapan Penelitian .……….. 34
III.4.1. Pra-perlakuan Sampel dan Isolasi Aktinomisetes... 36
III.4.2. Kultur Vegetatif dan Fermentatif pada Proses Penapisan dan Penggandaan Skala Untuk Preparasi Ekstrak Fermentasi ... 37
III.4.3. Uji Aktivitas Antimikroba (Bioassay) ... 38
III.4.4. Analisis Sekuen Gen 16S rRNA... 39
III.4.5. Pemisahan dan Pemurnian Senyawa Aktif Kaldu Fermentasi ... 39
III.4.7. Identifikasi Struktur Kimia Senyawa Aktif ... 40
III.4.8. HPLC Preparatif... 40
III.4.9. HPLC Analitik ... 41
III.4.13.Penentuan Suhu dan pH Awal Terbaik pada Proses
Fermentasi ... 43
III.4.14.Proses Optimasi Medium Fermentasi ... 44
IV HASIL DAN PEMBAHASAN ...………...…………. 49
IV.1. Perlakuan Sampel untuk Isolasi Aktinomisetes ..……... 49
IV.2.Isolasi Aktinomisetes ...……... 52
IV.3. Penapisan Aktinomisetes Penghasil Antimikroba ... 53
IV.4. Pemurnian dan Identifikasi Senyawa Aktif yang Dihasilkan Oleh Streptomyces sp.A11 ... 59
IV.5. Penentuan Minimum Inhibitory Concentration (MIC) Senyawa Aktif Siklo(tirosil-prolil) ... 66
IV.6. Penentuan Kurva Pertumbuhan Vegetatif Isolat Streptomyces sp A11 ... 68
IV.7. Penentuan Profil Fermentasi Isolat Streptomyces sp.A11... 69
IV.8. Penentuan Suhu dan pH Awal Terbaik pada Proses Fermentasi ... 74
IV.9. Penentuan Sumber Karbon Terbaik pada Proses Fermentasi ... 78
IV.10. Penentuan Sumber Nitrogen Terbaik pada Proses Fermentasi ... 85
IV.11. Penentuan Mineral Terbaik untuk Produksi Siklo(tirosil-prolil).. 90
IV.12. Optimasi Medium Fermentasi ... 92
IV.13. Formulasi Medium dan Validasi Model ... 105
V KESIMPULAN DAN SARAN ... 107
V.1. Kesimpulan ... 107
V.2. Saran ... 108
DAFTAR PUSTAKA ….……….. 111
1 Distribusi senyawa aktif dan tidak aktif yang telah diketahui... 14
2 Komposisi mineral yang digunakan dalam medium fermentasi ... 45
3 Kisaran dan taraf variabel yang diuji pada optimasi komposisi medium... 46
4 Matrik Central Composite Design yang mengandung 20 percobaan
dengan 3 faktor variabel percoban dalam kode unit... 47
5 Hasil pra-perlakuan sampel pada proses isolasi aktinomisetes………. 50
6 Hasil isolasi dan penapisan aktinomisetes penghasil antimikroba... 55
7 Uji aktivitas antimikroba ekstrak supernatan dan biomasa hasil fermentasi isolat Streptomyces sp.A11 ... 58
8 Data spektrum 13C NMR dan 1H NMR yang menujukkan posisi atom
C dan H pada gugus fungsionalnya ... 66
9. Konsentrasi hambatan minimum (MIC) siklo(tirosil-prolil)... 67
10. Aktivitas antibiotik yang dihasilkan adanya perlakuan sumber karbon... 82
11. Pengaruh perlakuan sumber nitrogen terhadap aktivitas siklo(tirosil-prolil) 87
12. Kandungan prolin dan tirosin dalam pepton, kasein, dan ekstrak khamir.... 89
13 Kisaran dan taraf variabel yang diuji pada optimasi komposisi medium... 93
14 Data hasil percobaan optimasi medium kultivasi Streptomyces sp.A11 menggunakan rancangan model komposit terpusat (CCD) ... 93
15 Jumlah kuadrat beberapa model yang dicobakan untuk proses optimasi
medium fermentasi ... 94
16 Data hasil analisis beberapa model yang dicobakan dalam optimasi medium fermentasi... 94
17 Model koefisien regresi pada proses optimasi medium fermentasi untuk
produksi siklo(tirosil-prolil)... 95
18 Analisiskeragaman pada proses optimasi medium fermentasi untuk
Halaman
1 Morfologi miselium Streptomyces ... 9
2 Pola pertumbuhan sel selama fase lag, fase log, dan fase stasioner ………. 18
3 Pengaruh konsentrasi substrat (S) terhadap laju pertumbuhan spesifik ... 19
4 Tahapan penelitian isolasi, skrining, identifikasi, dan karakterisasi aktinomisetes ... 34
5 Aktivitas dan ruang lingkup penelitian ... 35
6 Morfologi isolat Streptomyces sp.A11 ... 56
7 Pohon filogenik isolat A11 yang didentifikasi sebagai Streptomyces sp... 57
8 Daya hambat senyawa aktif terhadap Bacillus subtilis ATCC 66923, Escherichia coli ATCC 25922, Staphylococcus aureus ATCC25923, Pseudomonas aeruginosa ATCC27853 ... 58
9 Kromatogram hasil analisis ekstrak supernatan dan biomassa yang dihasilkan oleh isolat Streptomyces sp.A11 ... 59
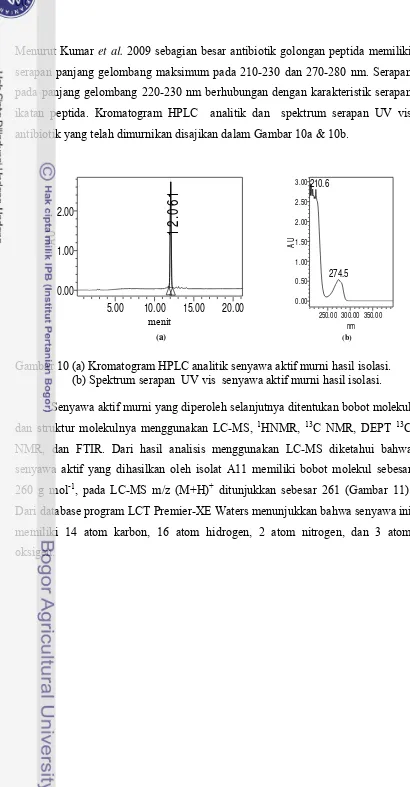
10. Kromatogram analisis HPLC senyawa aktif murni hasil isolasi dan Spektrum serapan UV vis senyawa aktif murni hasil isolasi... 60
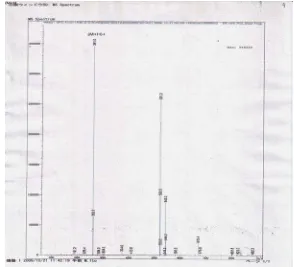
11. Spektrum LC-MS m/z 261 (M+H)+ senyawa aktif yang dihasilkan oleh isolat Streptomyces sp.A11 ... 61
12 Spektrum 1HNMR dan spektrum 13CNMR senyawa aktif yang dihasilkan oleh isolat Streptomyces sp.A11... 62
13 Struktur molekul senyawa aktif yang dihasilkan oleh isolat A11 ... 63
14 Spektrum DEPT 13 C NMR senyawa aktif yang dihasilkan oleh isolat Streptomyces sp.A11... 64
15 Spektrum inframerah senyawa aktif yang dihasilkan oleh isolat A11 ... 65
16 Kurva pertumbuhan vegetatif Streptomyces sp.A11 ... 69
17 Profil fermentasi isolat Streptomyces sp.A11 ... 71
20 Lintasan metabolisme glukosa, maltosa, sukrosa, laktosa sampai menjadi
asam piruvat ... 80
21 Pengaruh beberapa sumber karbon terhadap aktivitas siklo(tirosil-prolil) .. 81
22 Pengaruh sumber nitrogen terhadap aktivitas siklo(tirosil-prolil) ... 86
23 Reaksi pembentukan siklo(tirosil-prolil) ... 88
24 Biosintesis prolin melalui lintasan asam glutamat ... 89
25 Biosintesis tirosin melalui transaminase p-hydroxyphenylpyruvate... 90
26 Pengaruh campuran mineral terhadap aktivitas siklo(tirosil-prolil) ... 91
27 Plot probabilitas normal galat model produktivitas siklo(tirosil-prolil) yang dihasilkan oleh isolat Streptomyces sp.A11... 97
28 Plot urutan percobaan versus galat model pada produktivitas siklo(tirosil-prolil) yang dihasilkan oleh isolat Streptomyces sp.A11 ... 98
29 Plot nilai dugaan versus galat model pada produktivitas siklo(tirosil-prolil) yang dihasilkan oleh isolat Streptomyces sp.A11 ... 98
30 Permukaan respon dan plot kontur produksi siklo(tirosil-prolil) sebagai pengaruh dekstrin dan pepton ... 99
31 Pola pengaruh dekstrin dan pepton terhadap produksi siklo(tirosil-prolil).. 101
32 Permukaan respon dan plot kontur produksi siklo(tirosil-prolil) sebagai pengaruh dekstrin dan mineral ... 102
1 Kurva standar analisis HPLC untuk penentuan konsentrasi
siklo(tirosil-prolil) ……… 121
2 Metode penentuan konsentrasi gula reduksi ... 122
3 Metode penentuan konsentrasi nitrogen total ... 123
4 Metode penentuan bobot kering sel ... 124
5 Penentuan nitrogen total dan bobot bahan dari masing-masing sumber nitrogen yang digunakan untuk optimalisasi medium fermentasi ... 125
6 Urutan nukleotida fragmen gen isolat terpilih (Streptomyces sp.A11) dan kedekatan (homology) yang dibandingkan dengan gen spesies lainnya ... 126
7 Kurva penentuan MIC senyawa aktif siklo(tirosil-prolil) terhadap 4 bakteri uji ... 128
7a. Kurva penentuan MIC senyawa aktif siklo(tirosil-prolil) terhadap Escherichia coli ATCC 25922 ... 128
7b. Kurva penentuan MIC senyawa aktif siklo(tirosil-prolil) terhadap Staphylococcus aureus ATCC 25923 ... 129
7c. Kurva penentuan MIC senyawa aktif siklo(tirosil-prolil) terhadap Bacillus subtilis ATCC 66923 ... 130
7.d Kurva penentuan MIC senyawa aktif siklo(tirosil-prolil) terhadap Pseudomonas aeruginosa ATCC 27853 ... 131
7.e Kurva penentuan MIC tetrasiklin terhadap Escherichia coli ATCC 25922... 132
7.f Kurva penentuan MIC tetrasiklin terhadap Staphylococcus aureus ATCC 25923 ... 133
7.g Kurva penentuan MIC tetrasiklin terhadap Bacillus subtilis ATCC 66923 ... 134
7.h Kurva penentuan MIC tetrasiklin terhadap Pseudomonas aeruginosa ATCC 27853 ... 135
9 Data perubahan parameter pH, gula reduksi, nitrogen total, berat kering sel, dan konsentrasi siklo(tirosil-prolil) pada proses fermentasi
menggunakan isolat Streptomyces sp.A11... 137
10 Penentuan laju pertumbuhan spesifik maksimal (µmaks) dan rendemen
pembentukan biomassa per massa substrat (Yx/s) ... 138
10a. Penentuan laju pertumbuhan spesifik maksimal (µmaks) ... 138
10b. Penentuan rendemen pembentukan biomassa per massa substrat
(Yx/s) ... 139
11 Analisis ragam dan uji lanjut Duncan perlakuan suhu fermentasi terhadap aktivitas siklo(tirosil-prolil) yang dihasilkan ... 140
12 Analisis ragam dan uji lanjut Duncan perlakuan pH awal medum fermentasi terhadap aktivitas siklo(tirosil-prolil) yang dihasilkan 141
13 Analisis ragam dan uji lanjut Duncan penentuan sumber karbon terbaik pada proses fermentasi produksi siklo(tirosil-prolil) dan hasil analisis
gula total sebelum dan sesudah fermentasi. ... 142
13a Analisis ragam dan uji lanjut Duncan penentuan sumber karbon
terbaik pada proses fermentasi produksi siklo(tirosil-prolil) ... 142
13b Hasil analisis gula total dari beberapa sumber karbon sebelum dan
sesudah fermentasi……… 143
14 Analisis ragam dan uji lanjut Duncan penentuan sumber nitrogen terbaik pada proses fermentasi produksi siklo(tirosil-prolil) dan hasil
analisis nitrogen total sebelum dan sesudah fermentasi... 144
14a. Analisis ragam dan uji lanjut Duncan penentuan sumber nitrogen
terbaik pada proses fermentasi produksi siklo(tirosil-prolil)... 144
14b. Hasil analisis nitrogen total dari beberapa sumber nitrogen sebelum dan sesudah fermentasi ... 145
15 Analisis ragam dan uji lanjut Duncan penentuan mineral terbaik pada
proses fermentasi siklo(tirosil-prolil)……… 146
16 Respon hasil percobaan optimalisasi proses produksi siklo(tirosil-prolil)
17a. Keluaran model yang digunakan dan respon yang diperoleh dari
Design Expert 7 ... 148
17b. Keluaran design summary dan respon yang diperoleh dari Design
Expert 7 ... 149
17c. Keluaran hasil analisis fit summary dari Design Expert 7 ………. 150
17d. Keluaran hasil analisis variansi (ANOVA) dari Design Expert 7 ... 151
17e . Keluaran variabel hasil optimasi menggunakan DesignExpert 7 … 152
18 Data pengamatan konsentrasi siklo(tirosil-prolil) dan konsumsi gula
I.1. Latar Belakang Masalah
Kebutuhan antibiotik, anti fungal, maupun anti kanker baru masih sangat
diperlukan, terutama yang efektif melawan bakteri, virus, protozoa, fungi atau
kanker. Untuk mendapatkan antibiotik baru, para peneliti telah banyak melakukan
berbagai cara seperti eksplorasi senyawa dari bahan alam seperti mikroba,
tumbuhan, dan hewan laut. Disamping itu para peneliti juga melakukan
biotransformasi senyawa-senyawa tertentu dengan bantuan mikroba atau membuat
derivat antibiotik semisintetik secara kimiawi.
Pada saat ini sebagian besar antibiotik yang diperkenalkan dan beredar di
pasaran merupakan antibiotik semisintetik yaitu senyawa induknya adalah produk
alami (natural product), misalnya derivat penisilin (ampisilin, amoksisilin), sefalosporin (sefotaksim), kanamisin (amikasin, dibekasin) dan sebagainya.
Keberhasilan ini telah mendorong para peneliti untuk membuat derivat kelompok
antibiotik yang lain seperti makrolid, poliena antifungi atau antrasiklin anti-tumor.
Menurut Pelaez (2006), 70 dari 90 antibiotik yang berada di pasaran dari tahun
1982-2002 adalah turunan dari antibiotik alami (natural product). Walaupun
derivatisasi atau biokonversi menjanjikan antibiotik baru yang berguna, namun
senyawa antibiotik baru yang alami masih terus dicari dan sangat diharapkan.
Keberhasilan mendapatkan antibiotik baru dari sumber alami seperti metabolit
sekunder dari mikroba telah menimbulkan asumsi bahwa mikroba merupakan
sumber senyawa baru yang tidak pernah habis. Bahkan selain aktivitas antibiotik,
metabolit mikroba juga menjadi sumber senyawa aktif farmakologis atau
fisiologis yang berguna dibidang medis atau digunakan dalam pertanian (Omura
1986).
Pada saat ini antibiotik masih memiliki nilai yang tinggi dan masih sangat
dibutuhkan oleh manusia. Menurut Strohl (1999) ada beberapa alasan pentingnya
eksplorasi antibiotik baru. Pertama: seiring dengan perkembangan metode
pengobatan yang menggunakan berbagai macam antibiotik, telah menimbulkan
yang berkaitan dengan penggunaan antibiotik tersebut. Sebagai contoh timbulnya
mikroba patogen yang tahan terhadap penisilin, kasus Methicillin-Resistant
Staphylococcus aureus (MRSA), Vancomycin-Resistant Enterococci (VRE) khususnya Enterococcus faecium dan Enterococcus faecalis, dan β -lactam-resistant Streptococcus pneumoniae. Kedua: munculnya mikroba atau virus baru yang belum diketahui penyebabnya seperti HIV AIDS, ebola, SARS, flu burung,
flu babi dan lain-lain. Ketiga: dalam beberapa kasus antibiotik yang memiliki
aktivitas biologi yang sangat tinggi tetap mampu dilawan dan dikalahkan oleh
bakteri patogen. Sebagai contoh kasus infeksi yang disebabkan oleh Pseudomonas aeruginosa pada seseorang yang menderita cystic fibrosis pernah menjadi permasalahan serius pada dunia kedokteran. Keempat: antibiotik memiliki
keterbatasan pada sistem organ tubuh, yaitu pada kasus tertentu beberapa
antibiotik memiliki sifat toksik terhadap salah satu organ yang peka terhadap
antibiotik tersebut. Sebagai contoh pada kasus penggunaan gentamisin dan
aminoglikosida akan dibatasi efektivitasnya karena mereka berhubungan dengan
nephrotoxicity dan ototoxicity.
Indonesia mempunyai keragaman hayati khususnya perairan yang sangat
besar, termasuk didalamnya mikroba, tumbuhan maupun hewan. Kondisi wilayah
Indonesia yang berbentuk kepulauan, maritim, dan iklim tropis yang mendukung,
menjadikannya Indonesia kaya akan sumber daya hayati yang beragam. Dua
pertiga wilayah Indonesia merupakan daerah perairan. Menurut Kelecom (2002)
biodiversitas mikroba laut sangat besar dan menjanjikan, hal yang sama
disampaikan oleh Das et al.(2006), bahwa populasi mikroba laut sangat bervariasi, karakteristik mikroba yang hidup dipermukaan air laut, di dasar laut dalam, batu
karang dasar laut, dan sedimen atau batu karang juga sangat bervariasi. Namun
demikian sampai saat ini pemanfaatan keragaman hayati khususnya mikroba
belum secara optimal dilakukan (Desriani 2003).
Meskipun penelitian mengenai eksplorasi senyawa aktif dari
aktinomisetes laut belum intensif dilakukan sepertihalnya aktinomisetes tanah,
namun demikian ada sejumlah senyawa aktif baru yang dihasilkan oleh
2006). Abyssomycin C yang merupakan antibiotik polisiklik poliketida dihasilkan
aktinomisetes laut strain Verrucosispora (Riegdlinger et al. 2004). Abyssomycin C memiliki aktivitas mampu menghambat pertumbuhan bakteri Gram-positif.
Diazepinomicin yang dihasilkan oleh strain Micromonospora laut yang memiliki
aktivitas antibakteri, antiperadangan, dan antitumor (Charan et al. 2004).
Salinosporamide A merupakan senyawa lakton-γ-laktam yang diisolasi dari
aktinomistes laut Salinispora tropical (Feling et al. 2003).
Industri farmasi di Indonesia adalah terbesar dibandingkan dengan
negara-negara di Asia Tenggara. Namun demikian sampai saat ini Indonesia belum
sepenuhnya dapat memenuhi kebutuhan bahan-baku obat untuk industri
farmasinya. Kurang lebih 90% bahan baku antibiotik yang dibutuhkan oleh
industri farmasi di Indonesia masih diimpor dari Cina, India, Jepang, dan
Amerika. Ketergantungan bahan baku antibiotik dari luar negeri berpengaruh
terhadap kestabilan harga obat. Ketergantungan bahan baku obat dapat dikurangi
dengan mendorong kemandirian ketersediaan bahan baku obat lokal khususnya
antibiotik. Berdasarkan data Pharma Materials Management Clubs (PMMC)
dalam PT.Data Consult (2004) nilai impor bahan baku obat pada tahun 2001
mencapai Rp.2,4 triliun dan naik 8,9% pada tahun 2003 menjadi Rp. 2,69 triliun.
Menurut Demain (2000) pasar antibiotik di seluruh dunia mencapai US$ 30
milyar. Kebutuhan antibiotik di dunia merupakan urutan tertinggi dibandingkan
bahan baku obat lainnya.
Aktinomisetes merupakan kelompok mikroba penghasil antibiotik
terbanyak. Sekitar 70% antibiotik yang telah ditemukan dihasilkan oleh
aktinomisetes terutama Streptomyces, sehingga sasaran penapisan mikroba
penghasil antibiotik ditujukan pada kelompok aktinomisetes (Alcamo 1996).
Selain Streptomyces, penapisan juga diarahkan untuk mendapatkan anggota
aktinomisetes yang lain, terutama aktinomisetes langka seperti actinoplanes, micromonospora, saccharopolyspora, actinomodura, dactylosporangium, dan sebagainya. Mikroba tersebut telah menghasilkan metabolit yang berpotensi
termasuk antibiotik dan antitumor (Bardy 2005).
Proses isolasi dan penapisan mikroba penghasil senyawa aktif merupakan
prinsipnya penapisan mikroba penghasil antibiotik terbagi dalam beberapa tahap,
dan masing-masing tahap bertujuan mengeliminasi mikroba yang tak dikehendaki
dan meningkatkan pertumbuhan organisme yang diinginkan, misalnya
aktinomisetes. Menurut Cross (1982), ada 5 kriteria utama yang harus
diperhatikan dalam proses isolasi dan penapisan mikroba, antara lain: (1)
pemilihan target sampel, (2) komposisi medium isolasi, (3) perlakuan
pendahuluan sampel, (4) kondisi inkubasi, (5) pemilihan koloni.
Pada penelitian ini, telah dilakukan isolasi aktinomisetes laut dari beberapa
lokasi di Pantai Anyer Provinsi Banten, Pantai Selatan Gunung Kidul, dan Pantai
Utara Cirebon. Pemilihan ketiga lokasi ini didasarkan pada karakteristik pantai
yang berbeda-beda. Diharapkan dari karakteristik pantai yang berbeda akan
diperoleh mikroba dengan karakteristik yang berbeda pula. Aktinomisetes yang
diperoleh selanjutnya pilih dengan cara penapisan (screening) aktivitas antibakteri dan antifungi.
Proses optimasi fermentasi diperlukan untuk mendapatkan produktivitas
senyawa aktif yang tinggi. Dalam penelitian ini dilakukan optimasi medium
fermentasi dalam labu kocok menggunakan Response Surface Methodology
(RSM). Optimasi medium dilakukan tiga variabel bebas yaitu sumber karbon,
sumber nitrogen dan mineral.
I.2. Tujuan Penelitian
Penelitian ini bertujuan untuk menghasilkan senyawa aktif dari
aktinomisetes laut yang berpotensi sebagai antibiotik. Tujuan ini secara spesifik
dijabarkan sebagai berikut;
• Mendapatkan beberapa isolat aktinomisetes yang berasal dari sedimen
laut.
• Mendapatkan isolat aktinomisetes yang berpotensi sebagai penghasil
antibiotik.
• Mendapatkan informasi struktur kimia antibiotik yang dihasilkan oleh
• Mendapatkan komposisi medium fermentasi yang paling optimum dan profil fermentasi untuk produksi antibiotik.
I.3. Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah sebagai berikut;
1. Aktinomisetes laut dapat diisolasi dengan menggunakan medium
starch-casein agar yang dikombinasikan dengan antibiotik dan perlakuan sampel. Aktinomisetes memiliki kemampuan untuk tumbuh pada medium
dengan kandungan gula reduksi rendah. Hal ini dikarenakan aktinomisetes
memiliki kemampuan menghidrolisis beberapa sumber karbon seperti pati
menjadi glukosa yang dapat digunakan untuk metabolisme. Disamping itu
aktinomisetes mampu bertahan terhadap beberapa antibiotik dengan
konsentrasi tertentu dan kondisi pemanasan pada rentang suhu 60 °C
sampai dengan 70 °C, serta tahan terhadap kondisi medium dengan pH
rendah. Pada kondisi seperti ini bakteri kontaminan maupun kapang dapat
ditekan pertumbuhannya dengan baik.
2. Pada proses fermentasi antibiotik dengan menggunakan isolat
Streptomyces sp. A11, sumber nitrogen kompleks pepton dan kasein diduga mampu menghasilkan antibiotik golongan peptida lebih tinggi
dibandingkan dengan sumber nitrogen lainnya. Pepton dan kasein
memiliki kandungan asam amino yang dapat berfungsi sebagai sumber
nitrogen dalam medium fermentasi sekaligus sebagai prekursor pada
proses pembentukan antibiotik golongan peptida. Beberapa antibiotik
peptida disintesis melalui lintasan penggabungan beberapa asam amino
secara langsung yang sebelumnya terjadi proses aktivasi asam amino
I.4. Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah sebagai berikut;
1. Penentuan pra-perlakuan sampel dari sedimen laut untuk isolasi
aktinomisetes.
2. Isolasi aktinomisetes dengan menggunakan medium starch agar yang
dikombinasikan dengan antibiotik dan pra-perlakuan sampel.
3. Identifikasi aktinomisetes terpilih yang memiliki potensi penghasil
antibiotik menggunakan 16S rRNA.
4. Pemisahan dan pemurnian senyawa aktif dari kaldu fermentasi yang
meliputi ekstraksi menggunakan pelarut organik, pemurnian dengan
kromatografi kolom dan HPLC preparatif.
5. Identifikasi struktur molekul senyawa aktif dengan menggunakan H1
NMR, C13 NMR, DEPT, Infra Red Spectrofotometry, dan LCMS.
6. Penentuan Minimum Inhibitory Concentration (MIC) dan profil fermentasi isolat terpilih.
7. Penentuan kombinasi konsentrasi sumber karbon, sumber nitrogen, dan
II.1. Aktinomisetes
Pada awalnya aktinomisetes digolongkan dalam kelompok fungi, sebab penampakan morfologi dan perkembangannya yang mirip dengan fungi yang dilihat dari miseliumnya, sehingga aktinomisetes juga disebut ray fungi (Kuster 1958). Namun demikian dengan berkembangnya ilmu pengetahuan, morfologi aktinomisetes lebih dekat dengan bakteri. Dilihat dari ukuran sel, spora serta miselianya aktinomisetes dikategorikan sebagai bakteri yang memiliki nukleod yang sama dengan bakteri. Chitin dan selulosa sebagai penyusun dinding sel fungi tidak terdapat pada aktinomisetes. Penyusun dinding sel aktinomisetes adalah polimer gula, gula amino, dan beberapa asam amino seperti halnya bakteri gram positif. Sensitifitas terhadap beberapa antibiotik menempatkan aktinomisetes termasuk dalam golongan bakteri gram positif. Aktinomisetes biasanya dipandang sebagai kelompok bakteri Gram-positif yang memiliki kandungan Guanin (G) dan Citosin (C) yang tinggi di dalam DNA-nya (>55%) dengan kemampuan membentuk cabang-cabang hifa pada tahap-tahap pengembangannya (Locci et al. 1983).
Aktinomisetes memiliki morfologi yang sangat bervariasi, dari bentuk sel bulat/coccus (Micrococcus) dan rod-coccus cycle (Arthrobacter), bentuk hifa berfragmen (Nocardia, Rothia), sampai dengan jenis dengan miselium bercabang yang berbeda-beda (Micromonospora dan Streptomyces). Actinnobacteria, Actinoplanetes, Nocardioforms, dan Streptomyces memiliki filogenik yang berbeda dan heterogen. Aktinomisetes ada yang bersifat saprofit namun ada yang bersifat parasit atau bersimbiosis mutualisme dengan tumbuhan dan hewan (Goodfellow 1983).
koloni yang belum tumbuh miselianya, permukaan koloni terlihat mengkilap. Pada genus Streptomyces, miselium tumbuh secara luas menempel pada medium padat dan keseluruhan unit mudah diambil dengan kawat Ose (Cross 1982). Dilain pihak koloni yang dibentuk oleh Nocardia cenderung mudah terpisah setiap hifanya dan cenderung mudah pecah seperti tepung. Apabila miselium berkembang, permukaannya cenderung seperti tepung dan halus. Struktur, bentuk, ukuran dan warna dari koloni sangat bervariasi dan dapat berubah sesuai dengan kondisi kulturnya. Kebanyakan Streptomyces mengeluarkan bau yang khas seperti tanah. Asam asetat, acetaldehida, etanol, isobutanol, dan isobutil asetat sekarang ini sudah diidentifikasi sebagai aroma senyawa utama yang dihasilkan oleh Streptomyces. Bahkan hidrogen sulfida dipercaya berperan dalam pembentukan aroma tanah yang dikeluarkannya (Goodfellow 1983).
Miselium vegetatif aktinomisetes berbentuk hifa non-septat yang panjang. Beberapa hifa membentang dan panjangnya lebih dari 600 μm, bercabang,
melengkung/meliuk-liuk, dan cabangnya berbentuk monopodial. Miselium vegetatif memiliki karakteristik berwarna, seperti kuning, oranye, merah, hijau, coklat, atau hitam. Apabila terlarut dalam air, pigmen akan dikeluarkan dalam medium (Cross 1982).
http://www.microbiologyprocedure.com/
Gambar 1 Morfologi aerial micellium Streptomyces
Spora tumbuh berawal dari ujung hifa sporogenous dan terbentuk oleh proses fragmentasi atau segmentasi. Pada proses fragmentasi sitoplasma pecah dan membentuk bagian-bagian kecil yang seragam, yang pada akhirnya lepas dan memisah dari dinding sel. (Cross 1982).
II.2. Isolasi Aktinomisetes
tergantung dari kandungan airnya untuk mengurangi populasi bakteri (Hayakawa dan Hideo 1987). Untuk memperbesar kemungkinan isolasi aktinomisetes dari sampel air, misalnya Rhodococcus dan Micromonospora dapat dilakukan pemanasan sampel 55 °C selama beberapa menit (Goodfellow et al. 1988).
Untuk mendapatkan Streptomyces telah digunakan medium khusus yaitu Medium International Streptomyces Project (ISP) (Horan 1999). Fungi dapat dihilangkan dengan menambahkan antifungi seperti nistatin atau sikloheksimid ke dalam medium, dan bakteri dapat dieliminasi dengan menambahkan beberapa antibiotik ke dalam medium. Selain itu parameter kondisi lingkungan juga harus diperhatikan seperti pH, suhu dan sebagainya. Sebagian besar bakteri lebih peka terhadap pH asam, sedangkan fungi lebih tahan terhadap rentang pH yang lebih lebar. Suhu inkubasi dapat meningkatkan isolasi mikroba yang dikehendaki, misalnya isolasi Thermoactinomyces dapat ditingkatkan dengan inkubasi 50-55 °C, Nocardia pada 25 °C, Streptosporangium pada 40 °C dan sebagainya. Isolasi anggota aktinomisetes pada umumnya menggunakan suhu inkubasi 28 – 30 °C.
Aktinomisetes merupakan mikroba yang paling efektif dalam menggunakan substrat. Sebagai organisme heterotrop, aktinomisetes memerlukan bahan organik sebagai sumber karbon bagi kelangsungan hidupnya dan beberapa jenis diantaranya mampu mendegradasi inulin dan chitin. Bahkan Nocardia sp mampu memecah molekul organik yang tak lazim di alam seperti parafin, fenol, steroid dan pirimidin. Micromonospora mampu mendekomposisi pati, chitin, selulosa, glukosida, pentosan dan mungkin lignin. Atas dasar kemampuannya yang jarang dijumpai pada mikroba lain, maka para ahli telah mengembangkan medium isolasi yang hanya menguntungkan pertumbuhan aktinomisetes daripada mikroba yang lain. Medium tersebut seperti Arginine-Glycerol salt, Benedict, Collodial Chitin, Starch-Casein dan sebagainya (Cross 1982). Menurut Pisano et al. (1989) medium campuran pati dengan kasein sangat cocok digunakan untuk isolasi aktinomisetes. Aktinomisetes mudah tumbuh dalam medium campuran pati dan kasein, namun demikian mikroba lain tumbuh lebih lama dibandingkan dengan aktinomisetes.
teknik rehidrasi diterapkan pada sampel pada habitat air tawar yang akan menghasilkan banyak actinoplanete dan genus baru Cupolomyces. Spora aktinomisetes biasanya tahan terhadap proses pengeringan baik proses pengeringan kering atau basah. Pemanasan sampel pada suhu hangat mampu menekan pertumbuhan bakteri gram negatif yang sering mengganggu proses isolasi aktinomisetes (Pisano 1986). Cara lain untuk menekan perumbuhan bakteri gram negatif adalah dengan mengurangi water activity pada medium isolasi. Kelembaban pada permukaan agar dapat mendorong tumbuh dan menyebarnya bakteri Gram-negatif yang secara signifikan dapat menekan proses germinasi dan pertumbuhan aktinomisetes. Oleh karena itu cawan isolasi dan permukaan agar harus dalam kondisi kering pada saat menyebarkan sampel isolasi (Seong 2001). Beberapa spesies aktinomisetes lebih menyukai permukaan medium kering untuk proses germinasi dan pertumbuhan. Proses pemanasan dan pengeringan dengan kombinasi medium selektif akan mampu menghasilkan koloni aktinomisetes yang relatif banyak. Sentrifugasi diferensial juga dapat digunakan dalam proses pra-perlakuan sampel (Araujo 2008).
Spora aktinomisetes juga tahan terhadap pemanasan kering sampai suhu 120 °C, sifat ini dimanfaatkan untuk perlakuan pendahuluan yang dapat menghilangkan sejumlah bakteri kontaminan (Takashi 2003). Spora aktinomisetes lebih sentisitif terhadap pemanasan basah, yaitu sampel tersuspensi dalam pelarut yang dipanaskan. Pemanasan sampel pada suhu 45-50 °C dapat digunakan untuk isolasi Streptomyces, pada suhu pemanasan 55 °C dapat digunakan untuk mengisolasi Rhodococcus, dan spesies yang lebih tahan pada pemanasan yang lebih tinggi lagi adalah Micromonospora yang dapat bertahan pada pemanasan 60-70 °C selama 30 menit. Perlakuan pendahuluan sampel secara kimia juga banyak dilakukan untuk mengisolasi aktinomisetes, misalnya penggunaan fenol, klor atau amonium kuartener. Metode pra-perlakuan ini biasanya juga mengurangi sejumlah aktinomisetes yang akan diisolasi (Goodfellow et al. 1988).
suhu 100 °C), pemanasan basah (70 °C) selama 15 menit, dan udara kering selama 24 jam. Dari penelitian ini menunjukkan bahwa hasil isolasi aktinomisetes dengan beberapa metode pra-perlakuan sampel tersebut menunjukkan hasil yang sangat bervariatif.
Penggunaan senyawa antibakteri dan antifungi juga menentukan hasil isolasi aktinomisetes. Penggunakan senyawa antibakteri dapat memberikan efek mengurangi jumlah aktinomisetes yang akan diisolasi. Namun demikian cara ini dipandang sangat membantu menekan sejumlah bakteri dan kapang kontaminan, sehingga mempermudah proses isolasi dan pemurnian aktinomisetes. Kombinasi benzyl penicillin (5-10 μg mL-1) dengan asam nalidiksat (15 μg mL-1
) dapat digunakan untuk mendapatkan Saccharothrix, novobiocin (25 μg mL-1
) dan streptomycin (15 μg mL-1
) dapat digunakan untuk mendapatkan isolat dari genus Glycomyces, dan dengan menambahkan vancomycin dapat digunakan untuk mendapatkan Amylocolatopsis. Hanka (1985) dapat menaikkan perolehan koloni Streptoverticillium dengan menggunakan medium agar yang mengandung oxytetracycline dengan metode filter membran yang dapat menghilangkan koloni bakteri nonmiselia.
Salah satu faktor yang penting dalam proses isolasi dan fermentasi aktinomisetes adalah suhu inkubasi. Secara umum aktinomisetes tumbuh baik pada suhu 25 sampai dengan 30 °C. Namun demikian ada beberapa aktinomisetes yang tumbuh baik pada suhu 45 °C (Goodfellow et al. 1988). Isolasi aktinomisetes termofilik akan lebih mudah diisolasi dan dimurnikan dari bakteri kontaminan dibandingkan jenis mesofilik. Namun pada proses produksinya aktinomisetes termofilik akan membutuhkan biaya yang cukup tinggi untuk tetap menjaga panas yang lebih tinggi.
II.3. Antibiotik
Sejarah perkembangan penemuan antibiotik berawal dari penemuan oleh Fleming yang terus berkembang sampai sekarang. Sekarang ini telah ditemukan lebih dari 10.000 senyawa bahan alam yang dihasilkan dari mikroba. Tahun 1940 sampai dengan awal tahun 1950 merupakan tahun keemasan yaitu banyak ditemukan senyawa alam antibiotik yang berasal dari mikroba. Hampir semua antibakteri penting seperti tetrasiklin, sefalosporin, amiloglikosid, dan makrolida telah ditemukan pada tahun-tahun tersebut. Menurut Berdy (2005) pada tahun 1940 sekitar 10-20 antibiotik telah ditemukan, pada tahun 1950-an telah ditemukan 300-400 antibiotik, sekitar tahun 1960 ditemukan 800-1000 antibiotik, tahun 1970 telah ditemukan 2500, tahun 1980 telah ditemukan 5000, tahun 1990 telah ditemukan sekitar 10.000, dan tahun 2000 telah ditemukan sekitar 20.000 antibiotik.
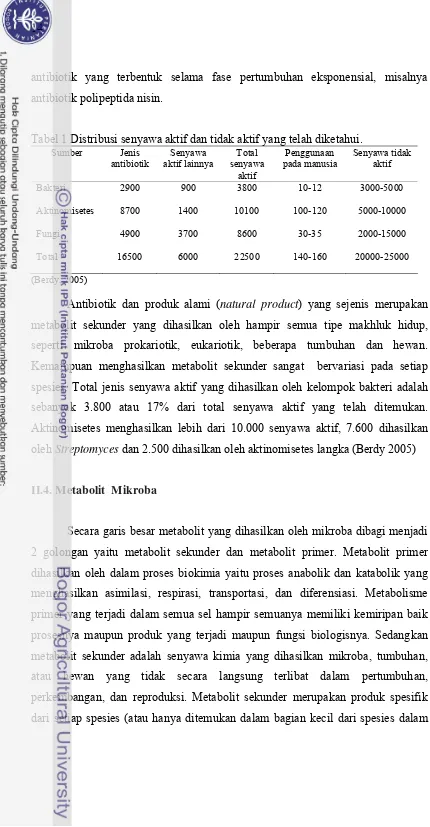
Antibiotik merupakan substansi yang dihasilkan oleh mikroba, dalam konsentrasi rendah mampu menghambat pertumbuhan atau membunuh mikroba lain (Cross 1982). Setiap antibiotik mempunyai aktivitas penghambatan pertumbuhan hanya terhadap mikroba patogen spesifik, yang disebut spektrum penghambat. Mikroba penghasil antibiotik meliputi golongan bakteri, aktinomisetes, fungi, dan beberapa mikroba lainnya. Kurang lebih 70% antibiotik dihasilkan oleh aktinomisetes, 20% dihasilkan oleh fungi dan 10% dihasilkan oleh bakteri. Streptomyces merupakan penghasil antibiotik yang paling besar jenisnya (Berdy 2005). Distribusi senyawa aktif yang telah diketemukan sampai saat ini disajikan pada Tabel 1.
antibiotik yang terbentuk selama fase pertumbuhan eksponensial, misalnya antibiotik polipeptida nisin.
Tabel 1 Distribusi senyawa aktif dan tidak aktif yang telah diketahui.
Sumber Jenis
Aktinomisetes 8700 1400 10100 100-120 5000-10000
Fungi 4900 3700 8600 30-35 2000-15000
Total 16500 6000 22500 140-160 20000-25000
(Berdy, 2005)
Antibiotik dan produk alami (natural product) yang sejenis merupakan metabolit sekunder yang dihasilkan oleh hampir semua tipe makhluk hidup, seperti mikroba prokariotik, eukariotik, beberapa tumbuhan dan hewan. Kemampuan menghasilkan metabolit sekunder sangat bervariasi pada setiap spesies. Total jenis senyawa aktif yang dihasilkan oleh kelompok bakteri adalah sebanyak 3.800 atau 17% dari total senyawa aktif yang telah ditemukan. Aktinomisetes menghasilkan lebih dari 10.000 senyawa aktif, 7.600 dihasilkan oleh Streptomyces dan 2.500 dihasilkan oleh aktinomisetes langka (Berdy 2005)
II.4. Metabolit Mikroba
grup filogenik). Tanpa senyawa ini maka organisme akan berakibat menderita karena kurang dapat mempertahankan diri namun demikian tidak menyebabkan kematian secara langsung, contohnya antifungi, antibakteri, antikolesterol, enziminhibitor, dan lain-lain. Fungsi utama dari metabolit sekunder dalam organisme adalah sebagai fungsi ekologi yaitu sebagai alat pertahanan melawan predator, parasit, dan kompetisi antar spesies (Prescot et al. 2002; Bennett et al.1989; Luckner 1990). Konsep metabolisme sekunder pertama kali dikenal oleh Kossel 1891 (Haslam 1986; Seigler 1998). Metabolit sekunder pada mulanya diasumsikan sebagai hasil samping atau limbah organisme sebagai akibat
produksi metabolit primer yang berlebih. Namun seiring dengan perkembangan
ilmu pengetahuan, terbukti bahwa metabolit sekunder diproduksi oleh organisme
sebagai respon terhadap lingkungan yang tidak sesuai (Dewick 1997). Metabolit sekunder dihasilkan melalui jalur biosintesis metabolit primer. Jalur biosintesis metabolit sekunder lebih spesifik untuk setiap famili atau genus mikroba dan berhubungan terhadap mekanisme evolusi suatu spesies (Torssell 1997).
Berbeda dengan metabolit sekunder, metabolit primer merupakan metabolit yang digunakan untuk pertumbuhan dan kelangsungan hidup,
diantaranya adalah lemak, DNA, protein dan karbohidrat. Metabolisme primer telah ditunjukkan pada proses sintesis asam karboksilat melalui siklus Krebs, asam amino, karbohidrat, lemak, protein dan asam nukleat, yang semuanya merupakan kebutuhan dasar untuk tetap dapat hidup dan terjadi pada semua mikroorganime (Luckner (1990). Semua mikroba yang memiliki sistem jalur metabolisme yang sama akan menghasilkan senyawa metabolit primer yang sama pula. Berbeda halnya dengan metabolit sekunder, metabolit ini bukan merupakan metabolit dasar yang dibutuhkan untuk kelangsungan hidupnya tetapi mendukung kelangsungan hidup suatu spesies untuk tetap hidup (Torsell 1997).
Ada beberapa metabolit sekunder khususnya antibiotik yang dihasilkan dari jalur biosintesis ini seperti antibiotik β-laktam (misalnya penisilin dan
sefalosporin), antibiotik aminoglikosid (streptomisin), steroid (gibberelin), makrolida (tetrasiklin), aktinomisin, dan anthramisin.
II.5. Pertumbuhan Mikrobial
Kurva pertumbuhan mikroba secara curah yang ditumbuhkan dalam medium kimiawi dapat dibuat dengan pengaluran data jumlah sel atau biomassa terhadap waktu pertumbuhannya. Kurva pertumbuhan dibagi menjadi 3 fase yaitu fase lag, fase eksponensial atau fase log, dan fase stasioner. Fase lag atau sering disebut juga fase adaptif, berlangsung segera setelah inokulasi pada medium nutrien dan merupakan periode adaptasi. Pada fase ini mikroba mengalami penyesuaian diri dengan kondisi lingkungan dan substrat yang tersedia. Jumlah sel pada fase ini bisa tetap namun demikian massa sel bisa bertambah. Dapat pula terjadi fase lag yang panjang bila inokulumnya kecil, mempunyai daya tumbuh rendah, atau bila komposisi media propagasi sangat berbeda dengan media fermentasi. Panjang pendeknya fase lag sangat tergantung dari kemampuan adaptasi mikroba tersebut terhadap kondisi yang baru dan medium yang ada (Judoamidjojo et al.1992). Pada periode ini tidak terjadi peningkatan jumlah sel, sehingga dengan persamaan matematis dapat dituliskan sebagai berikut;
X = Xo = tetap dan rx = dx/dt = 0
Demikian pula laju pertumbuhan spesifik, μ adalah nol dx/dt. 1/x = μ = 0
Keterangan :
X = konsentrasi selular (g L-1) Xo = konsentrasi selular pada t = 0 rx = laju pertumbuhan
μ = laju pertumbuhan spesifik (Jam-1 )
antara ln X versus waktu. Ini adalah periode pertumbuhan seimbang atau kondisi mantap dengan laju pertumbuhan spesifik konstan. Sel mikroba membelah dengan cepat dan konstan sehingga jumlah pertumbuhan selnya mengikuti kurva logaritmik. Pada saat laju pertumbuhan atau reproduksi selular mencapai titik maksimum, maka terjadi pertumbuhan secara logaritmik atau eksponensial. Pada fasa ini keadaan pertumbuhan adalah mantap. Dengan laju pertumbuhan spesifik, μ tetap, komposisi selular tetap, sedangkan komposisi kimiawi medium biakan
berubah akibat terjadinya sintesis produk dan penggunaan substrat.
Pada fase eksponensial, laju pertumbuhan, dx/dt meningkat berbanding lurus dengan X. Laju pertumbuhan spesifik tetap dan mencapai nilai maksimal. Laju pertumbuhan dapat digambarkan dengan persamaan sebagai berikut (Stanbury dan Whitaker, 1984);
dX/dt = μm X...(1)
Dari persamaan (1) apabila dilakukan integrasi akan diperoleh persamaan sebagai berikut;
ln X1 = lnXo + μ t ...(2)
dari persamaan (2) maka laju pertumbuhan spesifik (μ) merupakan kemiringan
kurva hasil pengaluran (plotting) ln X1 (konsentrasi biomassa) terhadap waktu (t). Pertumbuhan berbanding lurus dengan kerapatan selular mikroba,
rx = dx/dt = μm X ………..…..(3) pada fasa ini : logX2 – log X1 = μm (t2-t1) ….……...…(4)
maka X2 = X1 eμm (t2-t1) ………..(5) apabila pada saat Tg adalah X2 = 2X1 maka
Tg =ln2/μm = 0,69/μm ………..(6)
Tg = waktu penggandaan (waktu yang diperlukan untuk mendapatkan konsentrasi biomassa (X) menjadi dua kali konsentrasi awal (Xo) pada fasa eksponensial).
Fase stasioner akan terjadi setelah semua sel berhenti membelah diri atau bila sel hidup dan sel mati mencapai keseimbangan, yaitu dengan laju kematian. Namun meskipun pertumbuhan telah berhenti, mungkin saja masih dapat berlangsung proses metabolisme dan akumulasi produk dalam sel atau dalam kaldu fermentasi. Pada awal fase stasioner, konsentrasi konsentrasi biomassa mengalami maksimal. Fasa penurunan ditandai dengan berkurangnya jumlah sel hidup dalam medium akibat kematian yang diikuti autolisis sel oleh enzim selular. Beberapa kemungkinan yang terjadi apabila inkubasi tetap dilakukan, pertama massa sel total mungkin konstan, kedua masa sel hidup cenderung menurun, ketiga terjadi lisis sel dan masa sel menurun drastis atau sel hidup meningkat kembali oleh pertumuhan kriptik. Pola pertumbuhan sel selama fase lag, fase log, dan fase stasioner disajikan dalam Gambar 2.
Fase
a.massa sel tanpa terjadi lisis
b.massa sel terjadi lisis, diikuti pertumbuhan kriptik c.jumlah sel hidup dengan terjadi lisis
Gambar 2 Pola pertumbuhan sel selama fase lag, fase log, dan fase stasioner (Wang 1979)
Berdasarkan kajian pertumbuhan mikroba, dapat ditentukan parameter pertumbuhan seperti koefisien konversi atau rendemen produktivitas.
Yx/s = Xf - Xo ………..(7) So - S
Keterangan:
So : konsentrasi awal substrat
Nilai Yx/s dinyatakan dalam bobot sel kering per bobot atau mol substrat yang dikonsumsi (rendemen molekuler). Produktivitas (bobot biomassa yang dihasilkan per volume medium per jam) merupakan kriteria untuk mengevaluasi proses fermentasi. Produktivitas maksimal dicapai pada waktu tm dan konsentrasi Xm, sehingga;
Pm = Xm / tm ………..…….……(8) Bila produktivitas total dinyatakan sebagai berikut;
Pt = Xt / tt ………(9)
Hubungan laju pertumbuhan mikroba (μ) dengan konsentrasi substrat (S) telah
digambarkan oleh Monod berdasarkan analogi model kinetik enzimatik Michaelis Menten. Persamaan matematik hubungan laju pertumbuhan dengan konsentrasi substrat adalah sebagai berikut;
………...………(10) μ = μm S Ks + S
Ks merupakan konstanta penggunaan substrat yang menunjukkan afinitas mikroba terhadap substrat. Ks merupakan konsentrasi substrat pada saat μ = μm/2.
Pengaruh konsentrasi substrat terhadap laju pertumbuhan spesifik digambarkan pada Gambar 3. Berdasarkan model Monod, laju pertumbuhan (rx) dapat dinyatakan sebagai berikut;
………….(11) rx = μ X = μm S X Ks + S
a b c
Substrat (g L-1)
μ
(jam
-1 )
Keterangan :
a. Pembatasan oleh substrat b.Tidak ada pengaruh oleh substrat c. Penghambatan oleh substrat berlebih
Pada kinetika pertumbuhan mikroba dalam kondisi keseimbangan kimiawi, pertumbuhan sel, pembentukan produk berkaitan erat dengan penggunaan hara atau substrat. Pada fermentasi curah, laju penggunaan substrat persatuan volume, secara sederhana berbanding lurus dengan laju pertumbuhan. rs = 1/Yx/s (rx) karena rx = μX maka rs = μX / Yx/s
µ = dx/dt. 1/x
Yx/s adalah rendemen biomassa yang terbentuk persatuan substrat yang dikonsumsi. Bila pertumbuhan mikroba mengikuti model Monod, maka laju penggunaan substrat (rs) dapat dinyatakan sebagai berikut;
…..………(12) rs = 1/Yx/s μm S X Ks + S
Hubungan kinetik pertumbuhan dan pembentukan produk tergantung pada peranan produk di dalam metabolisme sel. Ada tiga pola kinetika yang umum dalam hubungannya pada kinetika pertumbuhan dengan pembentukan produk, yaitu: pola pembentukan produk berasosiasi dengan pertumbuhan, pola pembentukan produk tidak berasosiasi dengan pertumbuhan, dan pola campuran antara pembentukan produk berasosiasi dan tak berasosiasi dengan pertumbuhan.
Produk yang terbentuk dengan pola pertumbuhan yang berasosiasi dengan pembentukan produk merupakan hasil langsung suatu lintasan katabolik atau disebut metabolit primer. Pada pola ini laju pembentukan produk berbanding secara proporsional dengan laju pertumbuhan;
dp/dt = α dx/dt atau rp = Yp/x rx dan rp = dp/dt
dengan Yp/x adalah rendemen produk yang dihasilkan per biomassa yang dihasilkan (g/g).
Pada pola campuran antara pembentukan produk dan pertumbuhan, laju pembentukan produk berbanding terbalik dengan konsentrasi sel maupun laju pertumbuhan yang dinyatakan sebagai berikut;
dp/dt = α dx/dt + β x atau
1/x dp/dt = α 1/x dx/dt + β atau rp/x = αμ + β …….(13) p = Konsentrasi produk
x = Konsentrasi biomassa t = Waktu
µ = Laju pertumbuhan spesifik
α = Tetapan yang menunjukkan bagian produk yang diproduksi pada fase
logaritmik.
β = Tetapan yang menunjukkan bagian produk yang diproduksi pada fase
logaritmik.
Model ini disebut model kinetika Leudeking dan Piret (Mangunwidjaja dan Suryani 1994).
II.6. Identifikasi Mikroba Menggunakan 16S rRNA
Identifikasi mikroba menggunakan metode molekuler dengan mendeteksi elemen genom (DNA dan RNA) merupakan salah satu teknik identifikasi yang akurat. Identifikasi secara molekuler banyak digunakan untuk mempertegas hasil identifikasi secara fenotip seperti identifikasi morfologi, maupun identifikasi secara biokimia. Identifikasi molekuler memiliki keunggulan lebih akurat, pengerjaannya lebih cepat, dan dapat digunakan untuk identifikasi mikroba yang tidak dapat dikulturkan (unculture).
tiap mikroba prokariot. Sehingga daerah 16S rRNA digunakan untuk mengklarifikasi makhluk hidup ke dalam kelompok yaitu archaea, bakteri, dan prokarya. Ribosomal RNA (rRNA) merupakan salah satu jenis molekul RNA yang unik disamping duta RNA (mRNA) dan transfer RNA (tRNA). RNA berperan dalam pembentukan kerangka ribosom yang merupakan organel penting dalam proses translasi RNA menjadi asam amino (Gick dan Pasternack 2003). Saat ini RNA telah banyak dijadikan sebagai sumber analisis filogenik dan pengklasifikasian makluk hidup. Hal ini disebabkan molekul rRNA bersifat homologi baik secara fungsional maupun evolusinya pada organisme yang berbeda (Broun-Howland et al. 1992).
Tahapan dasar untuk identifikasi molekuler dengan menggunakan analisis sekuen adalah sebagai berikut;
1. Isolasi DNA atau RNA.
Deoxyribonucleic acid atau disingkat DNA merupakan bahan penyusun gen, yaitu penurun sifat yang meneruskan informasi dari induknya (Campbell et al. 2002). DNA terdapat di dalam inti sel terutama pada kromosom. Molekul DNA juga ditemukan pada organel-organel sel seperti sel pada mitokondria dan kloroplas. Ada beberapa tahapan dalam melakukan isolasi DNA, pertama isolasi jaringan, pelisisan dinding sel ekstraksi DNA, dan presipitasi. Presipitasi dilakukan untuk mengendapkan protein sehingga terpisah dari ikatan DNA.
2. PCR (Polymerase Chain Reaction).
3. Elektroforesis Gel.
Elektroforeses gel merupakan suatu teknik untuk memisahan makromolekul (DNA atau protein) berdasarkan ukuran dan muatan listrik(Cambell et al. 2002). Setiap bakteri memiliki 16S rRNA yang merupakan suatu sub unit dari RNA ribosom. Gen 16S rRNA memiliki nukleotida yang relatif pendek yaitu sekitar 1500 bp. Munculnya pita (band) tunggal pada daerah 1500 bp, maka dapat diketahui bahwa gen 16 S rRNA telah diamplifikasi.
4. Sekuensing.
Metode sekuensing merupakan metode pengurutan basa nukleotida pada DNA dan mendapatkan data berupa ukuran nukleotida dari fragmen DNA. Sekuensing DNA akan menghasilkan sekuen yang digambarkan sebagai untaian abjad lambang nukleotida-nukleotida penyusun DNA, yaitu ”A” (nukleotida berbasa adenin), ”T”(nukleotida berbasa timin, ”G”(nukleotida berbasa guanin, dan ”C”(nukleotida berbasa sitosin. (Campbell et al. 2002).
5. BLAST (Basis Local Aligment and Search Tool).
Basis data merupakan kumpulan informasi yang disimpan di dalam komputer secara sistematik sehingga dapat diperiksa menggunakan program komputer untuk memperoleh informasi basis data tersebut. Salah satu basis data untuk BLAST adalah NCBI yang merupakan Gen Bank. Data ini dapat dibuka melalui website http://www.ncbi.nih.nlm.gov yang dapat digunakan untuk membandingkan hasil gen yang telah disekuen.
II.7. Response Surface Methodology
menyelesaikan persamaan multivariabel secara simultan. Persamaan persamaan ini dapat ditampilkan secara grafis sebagai respon permukaan yang dapat digunakan dalam tiga cara, yaitu 1) untuk menggambarkan bagaimana faktor dapat mempengaruhi respon; 2) untuk menentukan hubungan inter-relasi antar faktor; dan 3) untuk menggambarkan efek gabungan dari respon seluruh faktor. Box et al. (1978) menyatakan bahwa RSM memiliki beberapa sifat menarik, diantaranya: (a) RSM merupakan suatu pendekatan sequensial. Hasil dari setiap tahapan akan memandu percobaan yang perlu dilakukan pada tahap berikutnya. Setiap tahapan pengulangan (iterasi) hanya memerlukan sejumlah kecil percobaan, sehingga menjamin peneliti terhindar dari percobaan yang tidak produktif; (b) RSM mengantarkan fokus penelitian dalam bentuk geometri yang dapat segara dipahami dengan mudah. Hasil RSM berupa ringkasan grafik dan plot-plot kontur merupakan suatu bentuk penyajian yang paling efektif dan mudah dicerna dibandingkan dengan persamaan-persamaan matematis; (c) RSM dapat diaplikasikan pada berbagai peubah. Box dan Draper (1987) menambahkan bahwa RSM telah terbukti sangat berguna dalam penyelesaian sejumlah besar problem dan dapat diaplikasikan dalam : (a) pemetaan permukaan dalam wilayah yang terbatas; (b) pemilihan kondisi operasi untuk mendapatkan spesifikasi yang diinginkan; dan (c) pencarian kondisi-kondisi yang optimal.
Suatu model permukaan respon menggambarkan bentuk funsional suatu permukaan respon. Model-model permukaan respon dapat didasarkan pada pertimbangan teoritis atau empiris. Jika suatu model teoritis tidak dapat dinyatakan secara spesifik dalam suatu percobaan, maka model-model polinomial sering digunakan untuk memperkirakan permukaan respon tersebut. Polinomial kuadratik dapat memberikan perkiraan yang berguna untuk berbagai aplikasi.
Model-model permukaan respon dan model-model regresi pada umumnya dapat disesuaikan dengan dua tipe data yakni data pengamatan dan data yang diperoleh dari percobaan yang terancang baik. Penyesuaian data pengamatan dengan model permukaan respon memiliki beberapa kelemahan potensial, antara lain : (a) umumnya terdapat problem yang berkaitan dengan kolinearitas antar peubah uji, (b) pengaruh peubah uji yang penting mungkin tidak dijumpai karena bervariasi dalam kisaran yang sangat sempit, (c) meskipun pengaruh yang signifikan teridentifikasi, namun penyebabnya tidak dapat dikonfirmasi karena peubah uji yang nyata dapat menjadi pengganti bagi peubah-peubah yang tidak diamati atau dikendalikan, (d) perlu upaya yang berlebihan berkaitan dengan galat data kasar, nilai-nilai yang hilang, dan periode pengumpulan data yang tidak konsisten.
Sebagian problem yang berkaitan dengan data pengamatan diuraikan di atas untuk menekankan pentingnya rancangan secara statistik untuk memenuhi kriteria tujuan, pengaruh faktor, ketepatan, efisiensi, dan keteracakan. Sementara itu data yang diperoleh dari percobaan yang dirancang menggunakan rancangan komposit pusat dapat digunakan secara efisien dan memenuhi model permukaan kuadratik penuh.
1. Dapat menentukan kombinasi optimum dari faktor (peubah bebas) yang akan menghasilkan respon (peubah tidak bebas) yang diinginkan dan dapat menggambarkan bahwa respon mendekati optimum.
2. Dapat menentukan bagaimana suatu pengukuran respon tertentu dipengaruhi oleh perubahan fakto-faktor pada level tertentu.
3. Dapat menentukan level faktor yang akan menghasilkan sekumpulan spesifikasi yang diinginkan secara simultan.
Response surface methodology (RSM) adalah kumpulan teknik matematik dan statistik yang digunakan untuk membentuk model dan menganalisis masalah dalam suatu respon yang dipengaruhi oleh beberapa peubah dan bertujuan untuk mengoptimalisasi respon ini (Box et al. 1978). Dalam banyak masalah RSM, bentuk hubungan antara respon dan peubah bebas tidak diketahui. Jadi langkah pertama adalah mendapatkan suatu pendugaan yang cocok untuk fungsi yang sebenarnya antara y dan himpunan bebasnya. Untuk pendugaan ini biasanya digunakan suatu polinomial orde rendah. Jika respon telah dimodelkan dengan baik oleh fungsi linier dari peubah bebasnya, maka fungsi yang diduga adalah model ordo pertama.
Y = β0 + βiXi + β2X2 + …….+ βkXk + ε ………..………(14)
Jika ada lengkungan dalam sistem, maka polinomial dengan orde yang lebih tinggi harus digunakan, seperti pada model orde kedua.
Y = β0 + ∑βiXi + ∑β2X2 + …….+ ∑βkXk + ε ………(15) i= 1 i= 1 i< 1
III.1. Kerangka Pemikiran
Aktinomisetes merupakan mikroba penghasil senyawa aktif terbanyak
dibandingkan dengan bakteri ataupun kapang, baik itu senyawa aktif sebagai
antimikroba, antikanker, antivirus, maupun antikolesterol. Eksplorasi senyawa
aktif dari yang berasal dari mikroba, selama ini diambil dari sampel tanah
(teristorial) atau dari tumbuhan. Namun demikian eksplorasi senyawa aktif dari
biota laut seperti hewan, tumbuhan, dan mikroba laut belum banyak dilakukan.
Aktinomisetes tersebar di lingkungan yang berbeda-beda. Pada daerah
kondisi panas, misalnya di daerah yang bersuhu lebih dari 60 °C maka
kemungkinan ditemukannya aktinomisetes thermofil menjadi lebih besar. Di
daerah yang berkadar garam tinggi, akan banyak diperoleh jenis aktinomisetes
yang tahan terhadap kadar garam tinggi. Menurut Lam (2006) peluang untuk
mendapatkan senyawa aktif baru aktinomisetes laut masih sangat besar. Seperti
halnya pada populasi aktinomisetes tanah, kondisi ekosistem laut juga
berpengaruh terhadap jenis populasi aktinomisetes laut. Biodiversitas ekosistem laut sangat besar, seperti diketahui tingkat kedalaman laut, kadar garam, dan
pertemuan arus laut berpengaruh terhadap populasi biota laut.
Iklim suatu wilayah juga berpengaruh terhadap populasi mikroba. Sebagai
contoh aktinomisetes yang hidup di daerah subtropik menunjukkan jumlah
populasi aktinomisetes yang berbeda dengan daerah tropis. Populasi mikroba pada
daerah tropis biasanya lebih tinggi dibandingkan dengan daerah subtropis.
Diversitas aktinomisetes berkaitan erat dengan jenis metabolit sekunder
yang dihasilkan, demikian juga habitat mikroba berpengaruh terhadap jenis
metabolit sekunder yang dihasilkan. Dalam spesies yang sama, metabolit sekunder
yang dihasilkan bisa saja berbeda-beda. Ekskresi metabolit sekunder oleh mikroba
merupakan fungsi dari lingkungan mikroba itu berada, dan bukan merupakan
fungsi dari biomassa sel mikroba. Semakin besar keragaman ekologi dalam