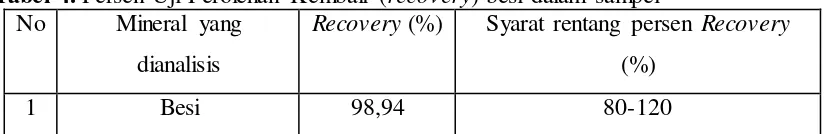STUDI PERBANDINGAN KANDUNGAN BESI PADA
BEBERAPA SPESIES BAYAM SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
OLEH: WINDA YANI NIM 111524049
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
STUDI PERBANDINGAN KANDUNGAN BESI PADA
BEBERAPA SPESIES BAYAM SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
Diajukan untuk melengkapi salah satu syarat memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: WINDA YANI NIM 111524049
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
STUDI PERBANDINGAN KANDUNGAN BESI PADA
BEBERAPA SPESIES BAYAM SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
OLEH: WINDA YANI NIM 111524049
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 27 Juli 2013
Pembimbing I, Panitia Penguji,
Dra. Tuty R. Pardede, M.Si., Apt. Drs. Chairul A. Dalimunthe, M.Sc., Apt. NIP 195401101980032001 NIP 194907061980021001
Pembimbing II, Dra. Tuty R. Pardede, M.Si., Apt. NIP 195401101980032001
Dr. Muchlisyam, M.Si., Apt. Drs. Maralaut Batubara, M.Phill., Apt. NIP 195006221980021001 NIP 195191311976031003
Dra. Sudarmi, M.Si., Apt. NIP 195409101983032001
Medan, September 2013 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas segala
limpahan berkat, rahmat dan karuniaNya, sehingga penulis dapat menyelesaikan
penelitian dan penyusunan skripsi ini.
Skripsi ini di susun untuk melengkapi salah satu syarat mencapai gelar
Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara, dengan
judul Studi Perbandingan Kandungan Besi Pada Beberapa Spesies Bayam
Secara Spektrofotometri Serapan atom.
Pada kesempatan ini dengan segala kerendahan hati penulis
mengucapkan terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr.
Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi Universitas
Sumatera Utara Medan, yang telah memberikan fasilitas sehingga penulis dapat
menyelesaikan pendidikan. Ibu Dra. Tuti Roida Pardede, M.Si., Apt., dan Bapak
Dr. Muchlisyam M.Si., Apt., yang telah membimbing dan memberikan petunjuk
serta saran-saran selama penelitian hingga selesainya skripsi ini. Bapak Drs.
Chairul Azhar Dalimunthe, M.Sc., Apt., dan Ibu Dra. Sudarmi, M.Si., Apt., serta
Bapak Drs. Maralaut Batubara, M.Phill., Apt., selaku dosen penguji yang telah
memberikan kritik, saran dan arahan kepada penulis dalam menyelesaikan
skripsi ini. Bapak dan Ibu staff pengajar Fakultas Farmasi USU Medan yang
telah mendidik selama perkuliahan dan Ibu Dra. Fat Aminah M.Si., Apt., selaku
perkuliahan. Ibu Dra. Masfria, M.Si., Apt., selaku kepala Laboratorium Kimia
Farmasi Kualitatif USU dan Bapak Prof. Dr. rer. nat. Effendy De Lux Putra,
S.U., Apt., selaku kepala Laboratorium penelitian USU yang telah memberikan
izin dan fasilitas untuk penulis sehingga dapat mengerjakan dan menyelesaikan
penelitian.
Penulis juga mengucapkan terima kasih dan penghargaan yang tiada
terhingga kepada Ayahanda Pairin dan Ibunda Rusmawati yang telah
memberikan cinta kasih yang tidak ternilai dengan apapun, doa yang tulus serta
pengorbanan baik materi maupun non materi. Adik, Kakak dan Abang yang
selalu memberikan dorongan dan semangat. Sahabat-sahabat ekstensi 2011,
terima kasih untuk dorongan, semangat dan kebersamaan nya selama ini, serta
seluruh pihak yang telah ikut mebantu penulis yang tidak dapat di sebutkan satu
persatu.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini
masih jauh dari kesempurnaan, oleh karena itu penulis menerima kritik dan saran
demi kesempurnaan skripsi ini. Akhirnya penulis berharap semoga skripsi ini
dapat memberi manfaat bagi kita semua.
Medan, 27 Juni 2013 Penulis,
STUDI PERBANDINGAN KANDUNGAN BESI PADA BEBERAPA SPESIES BAYAM SECARA SPEKTROFOTOMETRI SERAPAN
ATOM
ABSTRAK
Bayam merupakan sayuran yang telah lama dikenal dan dibudidayakan secara luas oleh petani di seluruh wilayah Indonesia. Salah satu bagian dari tanaman bayam yang bermanfaat adalah daun. Pada daun bayam terdapat cukup banyak kandungan protein, kalsium, zat besi dan vitamin yang dibutuhkan oleh manusia. Zat besi yang terkandung pada daun bayam berbeda antara spesies satu dengan yang lainnya. Tujuan penelitian ini adalah untuk mengetahui perbedaan kandungan besi pada berbagai spesies bayam.
Metode penelitian yang dilakukan yaitu analisis kualitatif besi dengan menggunakan pereaksi kalium heksasianoferat (II) dan amonium tiosianat dan analisis kuantitatif dengan menggunakan spektrofotometer serapan atom pada panjang gelombang 248,3 nm dengan menggunakan nyala udara – asetilen.
Hasil penelitian menunjukkan kandungan besi dalam bayam adalah (13,3854 ± 0,4126) mg/100g, bayam merah adalah (11,1592 ± 0,7117) mg/100g dan bayam duri adalah (25,0405 ± 0,8555) mg/100g. Secara statistik, uji beda rata-rata kandungan besi antara bayam, bayam merah dan bayam duri dengan menggunakan distribusi t, menyimpulkan bahwa kandungan besi pada bayam duri dan bayam lebih tinggi secara signifikan dari bayam merah.
THE COMPARATIVE STUDY ON SOME SPECIES OF IRON CONTENT IN SPINACH BY ATOMIC ABSORPTION
SPECTROPHOTOMETR Y
ABSTRACT
Spinach is a vegetable that has long been known and is widely cultivated by farmers in all parts of Indonesia. One piece of useful plant spinach leaves. In the spinach leaves are pretty much protein, calcium, iron and vitamins needed by humans. Iron contained in spinach leaves differ from one species to another. The purpose of this study was to determine differences in the iron content of spinach in a variety of species.
Research methodology is a qualitative analysis of iron using potassium heksasianoferat reagent (II) and ammonium thiocyanate and quantitative analysis using atomic absorption spectrophotometer at a wavelength of 248.3 nm using a flame air - acetylene.
The results showed iron content in spinach is (13.3854 ± 0.4126) mg/100g, red amaranth was (11.1592 ± 0.7117) mg/100g and spinach thorns is (25.0405 ± 0.8555) mg/100g. Statistically, the average difference test between the iron content of spinach, red spinach and spinach spines using the t distribution, concluded that the iron content in spinach and spinach thorns is significantly higher than the red spinach.
DAFTAR ISI
JUDUL Halaman
HALAMAN PEN GESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAK A ... 5
2.1 Bayam ... 5
2.1.1 Mengenal Tanaman Bayam ... 5
2.1.2 Taksonomi Tanaman Bayam ... 6
2.1.3 Jenis-jenis Bayam ... 6
2.1.4 kandungan Gizi bayam ... 9
2.1.5 Manfaat Tanaman Bayam ... 10
2.2 Mineral ... 10
2.4 Keberadaan Besi di dalam Tanaman Bayam ... 12
2.5 Analisis K ualitatif Besi ... 12
2.5.1 Kompleksometri ... 12
2.5.2 Gravimetri ... 13
2.5.3 Spektofotometri Sinar Tampak ... 13
2.5.3.1 Metode tiosianat ... 13
2.5.3.2 Metode 1,10- fenantrolina ... 13
2.5.3.3 Metode asam tioglikolat ... 14
2.5.4 Spektrofotometri Serapan Atom ... 14
2.5.4.1 Instrumentasi SSA ... 15
2.5.4.2 Gangguan-gangguan pada SSA ... 19
2.6 Validasi metode Analisis ... 20
BAB III METODE PEN ELITIAN ... 23
3.1 Tempat dan Waktu Penelitian ... 23
3.2 Bahan-bahan ... 23
3.2.1 Sampel ... 23
3.2.2 Pereaksi ... 23
3.3 Alat-alat ... 23
3.4 Identifikasi sampel ... 24
3.5 Pembuatan Pereaksi ... 24
3.5.1 Larutan HNO3 (1:1) v/v ... 24
3.5.2 Larutan HNO3 1 N v/v ... 24
3.5.3 Larutan Kalium Heksasianoferat (II) 10% b/v ... 24
3.5.4 Larutan Amonium Tiosianat 8% b/v ... 24
3.6 Prosedur Penelitian ... 25
3.6.1 Pengambilan Sampel ... 25
3.6.3 Proses Destruksi ... 25
3.6.4 Pembuatan Larutan Sampel ... 26
3.6.5 Analisis K ualitatif ... 26
3.6.5.1 Reaksi warna dengan Kalium heksasianoferat(II) ... 26
3.6.5.2 Reaksi warna dengan Amonium tiosianat ... 26
3.6.6 Analisis K uantitatif ... 27
3.6.6.1 Pembuatan K urva Kalibrasi Besi ... 27
3.6.6.2 Penetapan Kadar Besi dalam Sampel ... 27
3.6.6.2.1 Penetapan Kadar Besi dalam Bayam (Amaranthus hybridus L.) ... 27
3.6.6.2.2 Penetapan Kadar Besi dalam Bayam merah (Amaranthus tricolor L.) ... 28
3.6.6.2.3 Penetapan Kadar Besi dalam Bayam duri (Amaranthus spinosus L.) ... 28
3.6.7 Penentuan Batas Deteksi dan batas kuantitasi ... 29
3.6.8 Uji Perolehan Kembali (Recovery) ... 29
3.6.9 Simpangan Baku Relatif ... 30
3.6.10 Analisis data Secara Statistik ... 31
3.6.11 Pengujian Beda N ilai Rata-rata ... 32
BAB IV HASIL DAN PEMBAHASAN ... 35
4.1 Analisis K ualitatif ... 35
4.2 Analisis K uantitatif ... 36
4.2.1 Kurva Kalibrasi Besi ... 36
4.2.3 Pengujian Beda Nilai Rata-rata Kadar Besi pada
Bayam, Bayam merah, Bayam duri ... 38
4.2.4 Batas Deteksi dan Batas K uantitasi ... 40
4.2.5 Uji Perolehan kembali (Recovery) ... 40
4.2.6 Simpangan Baku Relatif ... 41
BAB V K ESIMPULAN DAN SARAN ... 42
5.1 Kesimpulan ... 42
5.2 Saran ... 42
DAFTAR PUSTAKA ... 43
DAFTAR TABEL
Halaman
Tabel 3.1. N ilai Qkritis pada Taraf Kepercayaan 95% ... 32
Tabel 1. Hasil Analisis Kualitatif dalam Sampel ... 35
Tabel 2. Hasil Analisis Kuantitatif Kadar Besi dalam Sampel Bayam .. 37
Tabel 3. Hasil Uji Beda N ilai Rata-rata Besi dalam Sampel ... 39
DAFTAR GAMBAR
Halaman
Gambar 1. Kurva Kalibrasi Besi ... 36
Gambar 2. Sampel Bayam (Amaranthus hybridus L.) ... 48
Gambar 3. Sampel Bayam merah (Amaranthus tricolor L.) ... 48
Gambar 4. Sampel Bayam duri (Amaranthus spinosus L.) ... 49
Gambar 5. Spektrofotometer Serapan Atom hitachi Z-2000 ... 50
Gambar 6. Neraca Analitik ... 50
Gambar 7. Tanur Stuart ... 51
Gambar 8. Hasil analisis kualitatif dengan Larutan pereaksi Kalium heksasianoferat (II) 8% ... 54
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Identifikasi Sampel ... 45
Lampiran 2. Gambar Sampel yang Digunakan ... 48
Lampiran 3. Alat-alat yang Di gunakan ... 50
Lampiran 4. Bagan Alir Proses Dekstruksi Kering ... 52
Lampiran 5. Bagan Alir Proses Pembutan Larutan Sampel ... 53
Lampiran 6. Hasil Analisis K ualitatif Besi ... 54
Lampiran 7. Data Hasil Pengukuran Absorbansi Larutan Standar Besi ... 55
Lampiran 8. Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 56
Lampiran 9. Hasil Analisis Kadar Besi dalam Sampel ... 58
Lampiran 10. Contoh Perhitungan Kadar Besi dalam Sampel ... 59
Lampiran 11. Perhitungan Statistik Kadar Besi ... 61
Lampiran 12. Perhitungan Batas Deteksi dan K uantitasi ... 64
Lampiran 13. Hasil Uji Perolehan Kembali Besi Setelah Penambahan Larutan Baku ... 66
Lampiran 14. Perhitungan Uji Perolehan Kembali Besi dalam Sampel ... 67
Lampiran 15. Perhitungan Simpangan Baku Relatif ... 68
Lampiran 16. Pengujian Beda Nilai Rata-rata Kadar Besi antara Bayam dan Bayam merah ... 69
Lampiran 17. Pengujian Beda Nilai Rata-rata Kadar Besi antara Bayam dan Bayam duri ... 71
Lampiran 18. Pengujian Beda Nilai Rata-rata Kadar Besi antara Bayam merah dan Bayam duri ... 73
Lampiran 19. Tabel Distribusi t ... 75
STUDI PERBANDINGAN KANDUNGAN BESI PADA BEBERAPA SPESIES BAYAM SECARA SPEKTROFOTOMETRI SERAPAN
ATOM
ABSTRAK
Bayam merupakan sayuran yang telah lama dikenal dan dibudidayakan secara luas oleh petani di seluruh wilayah Indonesia. Salah satu bagian dari tanaman bayam yang bermanfaat adalah daun. Pada daun bayam terdapat cukup banyak kandungan protein, kalsium, zat besi dan vitamin yang dibutuhkan oleh manusia. Zat besi yang terkandung pada daun bayam berbeda antara spesies satu dengan yang lainnya. Tujuan penelitian ini adalah untuk mengetahui perbedaan kandungan besi pada berbagai spesies bayam.
Metode penelitian yang dilakukan yaitu analisis kualitatif besi dengan menggunakan pereaksi kalium heksasianoferat (II) dan amonium tiosianat dan analisis kuantitatif dengan menggunakan spektrofotometer serapan atom pada panjang gelombang 248,3 nm dengan menggunakan nyala udara – asetilen.
Hasil penelitian menunjukkan kandungan besi dalam bayam adalah (13,3854 ± 0,4126) mg/100g, bayam merah adalah (11,1592 ± 0,7117) mg/100g dan bayam duri adalah (25,0405 ± 0,8555) mg/100g. Secara statistik, uji beda rata-rata kandungan besi antara bayam, bayam merah dan bayam duri dengan menggunakan distribusi t, menyimpulkan bahwa kandungan besi pada bayam duri dan bayam lebih tinggi secara signifikan dari bayam merah.
THE COMPARATIVE STUDY ON SOME SPECIES OF IRON CONTENT IN SPINACH BY ATOMIC ABSORPTION
SPECTROPHOTOMETR Y
ABSTRACT
Spinach is a vegetable that has long been known and is widely cultivated by farmers in all parts of Indonesia. One piece of useful plant spinach leaves. In the spinach leaves are pretty much protein, calcium, iron and vitamins needed by humans. Iron contained in spinach leaves differ from one species to another. The purpose of this study was to determine differences in the iron content of spinach in a variety of species.
Research methodology is a qualitative analysis of iron using potassium heksasianoferat reagent (II) and ammonium thiocyanate and quantitative analysis using atomic absorption spectrophotometer at a wavelength of 248.3 nm using a flame air - acetylene.
The results showed iron content in spinach is (13.3854 ± 0.4126) mg/100g, red amaranth was (11.1592 ± 0.7117) mg/100g and spinach thorns is (25.0405 ± 0.8555) mg/100g. Statistically, the average difference test between the iron content of spinach, red spinach and spinach spines using the t distribution, concluded that the iron content in spinach and spinach thorns is significantly higher than the red spinach.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Bayam (Amaranthus L.) merupakan genus dari berbagai spesies bayam
diantaranya bayam (Amaranthus hybridus L.), bayam merah (Amaranthus
tricolor L.) dan bayam duri (Amaranthus spinosus L.) (Sunarjono, 2009).
Tanaman ini merupakan sayuran yang telah lama dikenal dan dibudidayakan
secara luas oleh petani di seluruh wilayah Indonesia, bahkan di negara lain.
Tanaman ini terdiri dari beberapa spesies dan varietas, baik yang telah
dibudidayakan maupun masih merupakan tanaman liar. Di Indonesia hanya
dikenal dua spesies bayam budi daya yaitu Amaranthus tricolor L. dan
Amaranthus hybridus L. Di luar spesies bayam tersebut merupakan bayam liar
(Bandini dan Nurudin, 2001).
Bagian bayam yang bermanfaat adalah daun. Pada daun bayam terdapat
cukup banyak kandungan protein, kalsium, zat besi dan vitamin yang dibutuhkan
oleh manusia, terutama bagi anak-anak dan ibu yang sedang hamil. Zat besi yang
terdapat di daun bayam dapat mencegah penyakit anemia atau kurang darah dan
memperkuat tulang dan gigi (Bandini dan Nurudin, 2001).
Tubuh tidak mampu mensintesa mineral sehingga unsur-unsur mineral
ini harus disediakan lewat makanan (Budianto, 2009). Mineral mikro terdapat
dalam jumlah yang sangat kecil di dalam tubuh, namun mempunyai fungsi
mikro yang paling banyak terdapat dalam tubuh manusia, yaitu sebanyak 3-5
gram di dalam tubuh manusia dewasa. Mineral besi yang terikat dengan
hemoglobin mempunyai beberapa fungsi essensial di dalam tubuh : sebagai alat
angkut oksigen dari paru-paru ke jaringan tubuh, alat angkut elektron di dalam
sel dan sebagai unsur Fe merupakan bagian terpenting dari reaksi enzim di dalam
jaringan tubuh (Almatsier, 2004).
Berdasarkan informasi yang diperoleh dari masyarakat, kandungan besi
yang terdapat dalam bayam merah lebih banyak dari bayam karena bayam
tersebut berwarna merah, sehingga mereka menganggap bahwa bayam merah
dapat menambah darah karena warna merah tersebut yang seperti darah. Tetapi
menurut literatur yang mengandung besi lebih banyak adalah bayam
dibandingkan bayam merah, sedangkan pada bayam duri belum diketahui.
Perbedaan kandungan besi pada bayam disebabkan oleh kandungan klorofil
yang terdapat dalam daun bayam tersebut (Rosmarkam dan Yuwono, 2002).
Besi berfungsi sebagai kofaktor dalam pembentukan klorofil, protein dan
berperan dalam perkembangan kloroplas dengan cara mengaktifkan enzim
sitokrom, katalase, peroksidase sehingga ada kolerasi antara ketersediaan besi
dengan kadar klorofil dalam tanaman. Kekurangan besi menyebabkan
terhambatnya pembentukan klorofil, sehingga produksi klorofil berkurang
(Rosmarkam dan Yuwono, 2002).
Analisis kuantitatif besi dapat dilakukan secara Spektrofotometri sinar
tampak, Gravimetri, Kompleksometri dan Spektrofotometri serapan atom.
didasarkan pada ketelitian alat, kecepatan analisis, tidak memerlukan pemisahan
pendahuluan, dan dapat menetukan kadar suatu unsur dengan konsentrasi yang
rendah (Khopkar, 2008). Berdasarkan hal tersebut, peneliti melakukan penelitian
terhadap perbedaan kandungan besi pada tiga spesies bayam yang terdapat di
Indonesia.
1.1 Perumusan Masalah
1. Berapakah kadar besi yang terkandung di dalam Bayam, Bayam merah
dan Bayam duri.
2. Apakah ada perbedaan kadar besi yang terkandung di dalam Bayam,
Bayam merah dan Bayam duri.
1.2 Hipotesis
1. Besi yang terkandung di dalam Bayam, Bayam merah dan Bayam duri
dalam jumlah tertentu.
2. Terdapat perbedaan kadar besi yang terkandung di dalam Bayam, Bayam
merah dan Bayam duri.
1.3Tujuan Penelitian
1. Untuk mengetahui kadar besi pada Bayam, Bayam merah dan Bayam
duri.
2. Untuk membandingkan kadar besi yang terdapat dalam Bayam, Bayam
1.4Manfaat Penelitian
Untuk memberikan informasi kepada masyarakat tentang kandungan
BAB II
TINJAUAN PUSTAKA
2.1 Bayam
2.1.1 Mengenal Tanaman Bayam
Bayam merupakan salah satu jenis sayuran komersial yang mudah di
peroleh disetiap pasar, baik pasar tradisional maupun pasar swalayan. Harganya
pun dapat terjangkau oleh semua lapisan masyarakat. Tanaman ini awalnya
berasal dari negara Amerika beriklim tropis, namun sekarang tersebar keseluruh
dunia. Hampir semua orang mengenal dan menyukai kelezatan nya, karena
lunak, dapat memberikan rasa dingin dalam perut dan memperlancar
pencernaan. Umumnya yang dikonsumsi adalah bagian daun dan batangnya
(Bandini dan Nurudin, 2001).
Tanaman bayam sangat mudah dikenali, yaitu berupa perdu yang tumbuh
tegak, batangnya tebal berserat dan ada beberapa jenis yang mempunyai duri.
Daunnya bisa tebal atau tipis, besar atau kecil, berwarna hijau atau ungu kemerahan
(pada jenis bayam merah). Bunganya berbentuk pecut, muncul di pucuk tanaman
atau pada ketiak daunnya. Bijinya berukuran sangat kecil berwarna hitam atau
coklat dan mengkilap. Tanaman bayam sangat toleran terhadap perubahan keadaan
iklim. Bayam banyak ditanam di dataran rendah hingga menengah, terutama pada
ketinggian antara 5-2000 meter dari atas permukaan laut. Kebutuhan sinar matahari
untuk tanaman bayam adalah tinggi, dimana pertumbuhan optimum dengan suhu
rata-rata 20-300C, curah hujan antara 1000-2000 mm, dan kelembaban di atas 60 %.
Oleh karena itu, bayam tumbuh baik bila ditanam di lahan terbuka dengan sinar
2.1.2 Taksonomi Tanaman Bayam
Menurut Bandini dan Nurudin (2001), dalam taksonomi tanaman,
bayam diklasifikasikan sebagai berikut:
Kerajaan : Plantae
Divisi : Spermatophyta
Class : Dycotyledoneae
Ordo : Chenopodiales
Family : Amaranthaceae
Genus : Amaranthus L
Tanaman bayam digolongkan dalam keluarga Amaranthaceae. Sebagai
keluarga Amaranthaceae, bayam termasuk tanaman gulma yang tumbuh liar.
Namun karena perkembangannya, manusia memanfaatkan bayam sebagai tanaman
budidaya yang mengandung gizi tinggi.
2.1.3 Jenis-jenis Bayam
Menurut Bandini dan Nurudin (2001), secara ringkas bayam dapat di
kelompokkan menjadi dua jenis, yaitu:
1. Bayam Liar
Bayam ini tumbuh secara liar, dapat dijumpai di lahan-lahan kosong
tak terurus, sebagai gulma di lahan pertanian atau di tempat-tempat
yang lembap, seperti di tepi selokan. Tanaman ini tumbuh cepat dan
semakin subur jika musim hujan tiba.
Menurut Bandini dan Nurudin (2001), jenis bayam liar yang ada yaitu
a. Bayam tanah (Amaranthus blitum L.), mempunyai ciri utamanya
terletak pada batang yang berwarna merah. Daun nya berbentuk
lancip dan kecil. Rasanya agak keras dan kasar.
b. Bayam berduri (Amaranthus spinosus L.), mempunyai ciri-ciri
yang sama dengan bayam tanah, yaitu daun kecil tetapi batangnya
berwarna hijau. Namun pada batang nya terdapat duri yang keluar
dari buku-bukunya. Bayam ini dapat di konsumsi, tetapi lebih
banyak di gunakan obat atau bahan untuk kecantikan.
2. Bayam budi daya
Menurut Bandini dan Nurudin (2001), jenis bayam budi daya
memang sengaja dibudidayakan untuk dikonsumsi karena rasa
daunnya empuk dan mempunyai kandungan gizi yang tinggi. Jenis
bayam yang banyak di budidayakan adalah sebagai berikut:
a. Bayam cabut (Amaranthus tricolor L.)
Bayam cabut disebut juga bayam sekul atau bayam putih.
Cirinya, daun agak bulat dengan daging yang tebal dan lemas.
Bunga keluar dari ketiak cabang. Batang berwarna hijau
keputih-putihan sampai merah. Adapun varietas dari bayam cabut adalah
sebagai berikut:
1. Giti hijau
Tanaman ini merupakan introduksi dari Thailand, umur 28
mencapai 20-25 cm. Bercabang sedikit, bentuk batang bulat
langsing, halus dan berwarna keputih-putihan. Daun
berwarna hijau keputih-putihan, berbentuk mirip delta,
berukuran kecil, dan berurat halus (Bandini dan Nurudin,
2001).
2. Giti merah
Bayam ini juga merupakan tanaman introduksi dari Thailand.
Ciri-ciri tanaman ini antara lain bercabang sedikit, tinggi
tanaman pada waktu cabut yaitu 20-25 cm. Batang berwarna
merah tua, bentuk bulat, langsing dan halus. Tanaman ini
dipanen pada umur 30 hari (Bandini dan Nurudin, 2001)
b. Bayam Petik/bayam tahunan (Amaranthus Hybridus L.)
Menurut Bandini dan Nurudin (2001), tanaman ini berdaun lebar,
berbatang tegap. Daun diambil secara dipetik. Pemetikan ini dapat
berlangsung hingga tahunan sehingga di sebut bayam tahunan. Tetapi
sekarang bayam ini dipanen dengan cara dicabut saat masih muda
karena kebutuhan pasar yang mendesak. Adapun varietas dari bayam
petik ini adalah sebagai berikut:
a. Amaranthus hybridus varietas caudatus
Daun agak panjang dengan ujung runcing dan berwarna
hijau. Bayam ini juga di sebut bayam ekor kucing.
Daun agak besar dan berwarna hijau. Perbanyakannya
banyak di negara Asia Tenggara (Bandini dan Nurudin,
2001).
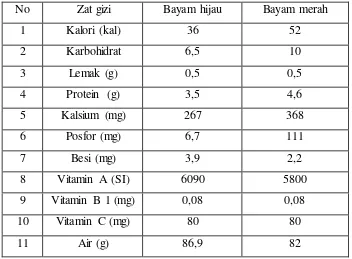
2.1.4 Kandungan Gizi bayam
Di dalam daun tanaman bayam terdapat cukup banyak kandungan protein,
mineral, kalsium, zat besi dan vitamin yang dibutuhkan oleh tubuh manusia. Pada
tabel di bawah ini diuraikan mengenai komposisi gizi yang terkandung tiap 100g
pada daun tanaman bayam, yaitu:
No Zat gizi Bayam hijau Bayam merah
1 Kalori (kal) 36 52
2 Karbohidrat 6,5 10
3 Lemak (g) 0,5 0,5
4 Protein (g) 3,5 4,6
5 Kalsium (mg) 267 368
6 Posfor (mg) 6,7 111
7 Besi (mg) 3,9 2,2
8 Vitamin A (SI) 6090 5800
9 Vitamin B 1 (mg) 0,08 0,08
10 Vitamin C (mg) 80 80
11 Air (g) 86,9 82
(Bandini dan Nurudin, 2001)
2.1.5 Manfaat Tanaman Bayam
Mengkonsumsi bayam dalam jumlah yang cukup memberikan manfaat yang
besar. Ditinjau dari kandungan gizinya, bayam merupakan jenis sayuran hijau yang
anak-anak dan para ibu yang sedang hamil. Di dalam daun bayam terdapat cukup banyak
kandungan protein, mineral, kalsium, zat besi dan vitamin yang dibutuhkan oleh
tubuh manusia. Kandungan vitamin A dalam daun bayam berguna untuk
memberikan ketahanan tubuh dalam menanggulangi penyakit mata, sakit
pernafasan, kesehatan kulit dan selaput lendir. Kandungan vitamin B dapat
mencegah penyakit beri-beri, memperkuat syaraf dan melenturkan otot rahim,
sehingga dianjurkan bagi ibu yang sedang hamil untuk memudahkan persalinan nya.
Vitamin C sangat membantu menyembuhkan sariawan atau gusi berdarah. Zat besi
dapat mencegah penyakit anemia dan sakit kuning serta memperkuat tulang dan
gigi. Manfaat lain dari bayam yaitu akarnya dapat menjadi obat untuk
menghilangkan panas (antipiretik), meluruhkan kencing (diuretik), menghilangkan
racun (antitoksik), menyembuhkan bengkak, obat diare dan membersihkan darah
(Bandini dan Nurudin, 2001).
2.2 Mineral
Mineral merupakan bagian dari tubuh dan memegang peranan penting
dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ maupun
fungsi tubuh secara keseluruhan. Mineral digolongkan ke dalam mineral makro
dan mineral mikro. Mineral makro adalah mineral yang dibutuhkan tubuh dalam
jumlah lebih dari 100 mg sehari, sedangkan mineral mikro dibutuhkan kurang
dari 100 mg sehari (Almatsier, 2004).
Mineral merupakan unsur essensial bagi fungsi normal sebagian enzim.
Mineral merupakan konstituen tulang dan gigi, yang memberikan kekuatan
sehingga unsur-unsur ini harus disediakan lewat makanan
(Budianto, 2009).
2.3 Besi
Besi yang murni adalah logam berwarna putih perak, melebur pada
1535oC (Svehla, 1979). Sumber zat besi diantaranya adalah telur, daging, ikan,
tepung, gandum, roti, sayuran hijau, hati, bayam, kacang-kacangan, kentang dan
jagung. Fungsi besi diantaranya adalah:
- untuk pembentukan hemoglobin baru
- untuk mengimbangi sejumlah kecil zat besi yang secara konstan di
keluarkan tubuh terutama lewat urine ,feses dan keringat
Kebutuhan akan zat besi untuk berbagai jenis kelamin dan golongan usia adalah
sebagai berikut:
- untuk laki-laki dewasa 10 mg/hari
- wanita yang mengalami haid 12 mg/hari
- anak-anak 8-15 mg/hari
zat besi yang tidak mencukupi bagi pembentukan sel darah, akan mengakibatkan
anemia, menurunkan kekebalan tubuh, sehingga sangat peka terhadap serangan
penyakit (Budianto, 2009).
2.4 Keberadaan Besi di dalam tanaman bayam
Besi (Fe) merupakan unsur mikro yang di serap dari dalam tanah. Besi
dalam perkembangan kloroplas dengan cara mengaktifkan enzim sitokrom,
katalase, peroksidase sehingga ada kolerasi antara ketersediaan besi dengan
kadar klorofil dalam tanaman. Kekurangan besi menyebabkan terhambatnya
pembentukan klorofil, sehingga produksi klorofil berkurang (Rosmarkam dan
Yuwono, 2002). Defisiensi besi pada tanaman akan terlihat pada daun berwarna
hijau pucat (klorosis) (Winarso, 2005).
2.5 Analisis Kuantitatif Besi
Analisis kuantitatif besi dapat dilakukan secara Kompleksometri,
Gravimetri, Spektofotometri Sinar Tampak dan Spektrofotometri Serapan Atom
(Basset, et al, 1991).
2.5.1 Kompleksometri
Penetapan besi secara kompleksometri dilakukan dengan cara masukkan
larutan besi ke dalam labu erlenmeyer, kemudian sesuaikan pH menjadi 2-3,
kemudian tambahkan 5 tetes indikator biru variamina, panaskan labu sampai
suhu 40oC dan titrasi dengan larutan EDTA (0,05 M) standar sampai warna awal
larutan yang biru berubah menjadi abu-abu tepat sebelum titik akhir, dan dengan
tetes reagensia yang terakhir, berubah menjadi kuning (Basset, et al, 1991).
2.5.2 Gravimetri
Penetapan besi secara gravimetri dapat dilakukan dengan cara
menambahkan amonia sedikit berlebih ke dalam larutan besi untuk
mengendapkan oksida – terhidrasi Fe2O3.xH2O. kemudian endapan disaring
klorida, kemudian endapan hasil saringan dipijar pada suhu 1000oC sehingga
menghasilkan besi oksida atau panaskan pada tanur pada suhu 500-550oC dan
timbang hasil pemijaran. Ulangi hasil pemijaran (10-15 menit) hingga diperoleh
berat konstan (dengan batas selisih 0,0002 g) (Basset, et al, 1991).
2.5.3 Spektrofotometri Sinar Tampak
Penetapan besi dengan spektrofotometri sinar tampak dapat dilakukan
dengan 3 metode, yaitu metode tiosianat, metode 1,10-fenantrolina dan metode
asam tioglikolat (Basset, et al, 1991).
2.5.3.1 Metode tiosianat
Besi(III) bereaksi dengan tiosianat menghasilkan senyawa kompleks
yang berwarna merah tua [Fe(SCN)6]3- yang dapat diukur absorbansi nya dengan
spektrofotometer sinar tampak pada panjang gelombang 480 nm (Basset, et al,
1991).
2.5.3.2 Metode 1,10-fenantrolina
Besi(II) bereaksi dengan 1,10-fenantrolina membentuk kompleks jingga
merah [C12H8N2)3Fe]2+ yang dapat diukur dengan spektrofotometer sinar tampak
pada panjang gelombang 515 nm. Besi(III) dapat direduksi dengan
hidroksilamonium klorida atau dengan hidrokuinon menjadi besi(II), apabila
ingin direaksikan dengan 1,10- phenantrolina (Basset, et al, 1991).
Besi(III) bereaksi dengan asam tioglikolat memberikan warna ungu
merah yang dapat diukur dengan spektrofotometer sinar tampak pada panjang
gelombang 535 nm (Basset, et al, 1991).
2.5.4 Spektrofotometri Serapan Atom
Spektrofotometri serapan atom digunakan untuk analisis kuantitatif
unsur-unsur logam dalam jumlah sekelumit (trace) dan sangat kelumit
(ultratrace). Cara analisis ini memberikan kadar total unsur logam dalam suatu
sampel dan tidak tergantung pada bentuk molekul dari logam dalam sampel
tersebut. Cara ini cocok untuk analisis kelumit logam karena mempunyai
kepekaan yang tinggi ( batas deteksi kurang dari 1 ppm ), pelaksanaannya relatif
sederhana, dan interferensinya sedikit. Spektrofotometri serapan atom
didasarkan pada penyerapan energi sinar oleh atom-atom netral dan sinar yang
diserap biasanya sinar tampak atau ultraviolet. Dalam garis besarnya prinsip
spektrofotometri serapan atom sama saja dengan spektrofotometri sinar tampak
dan ultraviolet. Perbedaan nya terletak pada bentuk spektrum, cara pengerjaaan
sampel dan peralatannya. Metode Spektrofotometri Serapan Atom (SSA)
mendasarkan pada prinsip absorbsi cahaya oleh atom. Atom-atom akan
menyerap cahaya pada panjang gelombang tertentu, tergantung pada sifat
unsurnya (Gandjar dan Rohman, 2007).
Jika suatu larutan yang mengandung suatu garam logam (atau suatu
senyawa logam) dihembuskan kedalam suatu nyala (misalnya asetilena yang
terbakar di udara) dapatlah terbentuk uap yang mengandung atom-atom logam
atau dengan perkataan lain, dalam keadaan dasar. Jadi jika cahaya dengan
panjang gelombang yang khas dengan logam tersebut dilewatkan nyala yang
mengandung atom-atom yang bersangkutan, maka sebagian cahaya tersebut
akan diserap dan jauhnya penyerapan akan berbanding lurus dengan banyaknya
atom keadaan dasar yang berada dalam nyala. Inilah asas yang mendasari
spektrofotometri serapan atom (SSA) (Basset, et al, 1991).
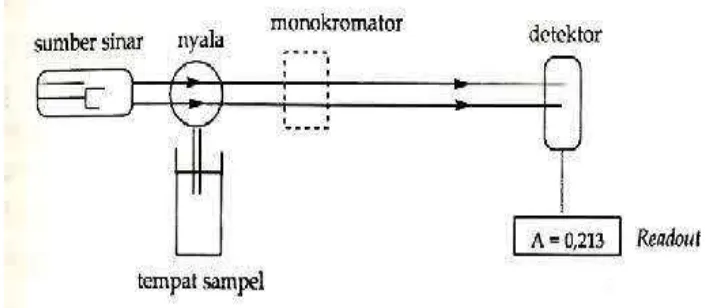
2.5.4.1 Instrumentasi SSA
Sistem peralatan spektrofotometer serapan atom dapat dilihat pada
gambar di bawah ini:
Gambar Instrumentasi Spektrofotometer Serapan Atom (Gandjar dan Rohman, 2007)
1. Sumber sinar
Sumber sinar yang lazim dipakai adalah lampu katoda berongga (hollow
catodhe lamp). Lampu ini terdiri atas tabung kaca tertutup yang mengandung
suatu katoda dan anoda. Katoda sendiri berbentuk silinder berongga yang terbuat
dari logam atau dilapisi dengan logam tertentu. Tabung logam ini diisi dengan
gas mulia (neon atau argon) dengan tekanan rendah (10-15 torr). Neon biasanya
[image:31.596.124.477.343.497.2]Bila anoda dan katoda diberi suatu selisih tegangan yang tinggi (600 volt), maka
katoda akan memancarkan berkas-berkas elektron yang bergerak menuju anoda
yang mana kecepatan dan energinya sangat tinggi dalam perjalanannya menuju
anoda akan bertabrakan dengan gas-gas mulia yang bertabrakan tadi. Akibat dari
tabrakan-tabrakan ini membuat unsur-unsur gas mulia akan kehilangan elektron
dan menjadi ion bermuatan positif. Ion-ion gas mulia yang bermuatan positif ini
selanjutnya akan bergerak ke katoda dengan kecepatan dan energi yang tinggi
pula. Sebagaimana disebutkan diatas, pada katoda terdapat unsur-unsur yang
sesuai dengan unsur yang akan dianalisis. Unsur-unsur ini akan ditabrak oleh
ion-ion positif gas mulia. Akibat tabrakan ini, unsur-unsur akan terlempar ke luar
dari permukaan katoda. Atom-atom unsur dari katoda ini kemudian akan
mengalami eksitasi ke tingkat energi-energi elektron yang lebih tinggi dan akan
memancarkan spektrum pancaran dari unsur yang sama dengan unsur yang akan
dianalisis (Gandjar dan Rohman, 2007).
2. Tempat sampel
Dalam analisis dengan spektrofotometri serapan atom, sampel yang akan
dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan
asas. Ada berbagai macam alat yang dapat digunakan untuk mengubah suatu
sampel menjadi uap atom-atom yaitu: dengan nyala (flame) dan tanpa nyala
(flameless) (Gandjar dan Rohman, 2007).
Nyala digunakan untuk mengubah sampel yang berupa padatan atau
cairan menjadi bentuk uap atomnya, dan juga berfungsi untuk atomisasi. Suhu
yang dapat dicapai oleh nyala tergantung pada gas-gas yang digunakan, misalkan
untuk gas batubara-udara, suhunya kira-kira sebesar 1800oC; gas alam-udara:
1700oC; asetilen-udara: 2200oC; dan gas asetilen-dinitrogen oksida (N 2O) sebesar 3000oC (Gandjar dan Rohman, 2007).
Pemilihan bahan bakar dan bahan pengoksida serta komposisi
perbandingannya sangat mempengaruhi suhu nyala. Sumber nyala yang paling
banyak di gunakan adalah campuran asetilen sebagai bahan bakar dan udara
sebagai pengoksida (Gandjar dan Rohman, 2007).
b. Tanpa nyala (flameless)
Teknik atomisasi dengan nyala dinilai kurang peka karena: atom gagal
mencapai nyala, tetesan sampel yang masuk ke dalam nyala terlalu besar, dan
proses atomisasi kurang sempurna. Oleh karena itu muncullah suatu teknik
atomisasi yang baru yakni atomisasi tanpa nyala. Pengatoman dapat dilakukan
dalam tungku dari grafit seperti tungku yang dikembangkan oleh Masmann
(Gandjar dan Rohman, 2007).
Sejumlah sampel diambil sedikit (untuk sampel cair diambil hanya
beberapa µL, sementara sampel padat diambil beberapa mg), lalu di letakkan
dalam tabung grafit, kemudian tabung tersebut dipanaskan dengan sistem
elektris dengan cara melewatkan arus listrik pada grafit. Akibat pemanasan ini,
maka zat yang akan dianalisis berubah menjadi atom-atom netral dan pada fraksi
sehingga terjadilah proses penyerapan energi sinar yang memenuhi kaidah
analisis kuantitatif. Sistem pemanasan dengan tanpa nyala ini dapat melalui 3
tahap yaitu: pengeringan (drying) yang membutuhkan suhu yang relatif rendah,
pengabuan (ashing) yang membutuhkan suhu yang lebih tinggi dan pengatoman
(atomising) (Gandjar dan Rohman, 2007).
3. Monokromator
Pada spektrofotometri serapan atom, monokromator dimaksudkan untuk
memisahkan dan memilih panjang gelombang yang digunakan untuk analisis
(Gandjar dan Rohman, 2007).
4. Detektor
Detektor digunakan untuk mengukur intensitas cahaya yang melalui
tempat pengatoman. Biasanya digunakan tabung penggandaan foton
(photomultiplier tube). Ada 2 cara yang dapat digunakan dalam sistem deteksi
yaitu: (a) yang memberikan respon terhadap radiasi resonansi dan radiasi
kontinyu; dan (b) yang hanya memberikan respon terhadap radiasi resonansi
(Gandjar dan Rohman, 2007).
5. Readout
Readout merupakan suatu sistem pencatatan hasil yang berupa hasil
pembacaan. Pencatatan hasil dilakukan dengan suatu alat yang telah terkalibrasi
untuk pembacaan transmisi atau absorbsi. Hasil pembacaan dapat berupa angka
atau kurva (Gandjar dan Rohman, 2007).
Menurut (Gandjar dan Rohman, 2007), yang dimaksud dengan
gangguan-gangguan pada SSA adalah peristiwa-peristiwa yang menyebabkan
pembacaan absorbansi unsur yang dianalisis menjadi lebih kecil atau lebih besar
dari nilai yang sesuai dengan konsentrasinya dalam sampel.
Gangguan-gangguan yang dapat terjadi dalam SSA adalah sebagai berikut:
1. Gangguan yang berasal dari matriks sampel yang mana dapat
mempengaruhi banyaknya sampel yang mencapai nyala
Sifat – sifat tertentu matriks sampel dapat mengganggu analisis yakni
matriks tersebut dapat berpengaruh terhadap laju aliran bahan bakar gas
pengoksidasi. Sifat-sifat tersebut adalah viskositas, tegangan permukaan, berat
jenis dan tekanan uap. Gangguan matriks yang lain adalah pengendapan unsur
yang dianalisis sehingga jumlah atom yang mencapai nyala menjadi lebih sedikit
dari konsentrasi yang seharusnya yang terdapat dalam sampel (Gandjar dan
Rohman, 2007).
2. Gangguan kimia yang dapat mempengaruhi jumlah/banyak nya atom
yang terjadi di dalam nyala
Terbentuknya atom-atom netral yang masih dalam keadaan azas di dalam
nyala sering terganggu oleh dua peristiwa kimia yaitu: disosiasi
senyawa-senyawa yang tidak sempurna dan ionisasi atom-atom di dalam nyala. Terjadi
disosiasi yang tidak sempurna disebabkam oleh terbentuknya senyawa-senyawa
yang bersifat refraktorik (sukar diuraiakan di dalam nyala api). Contoh senyawa
Dengan terbentuknya senyawa ini, maka akan mengurangi jumlah atom netral
yang ada di dalam nyala. Ionisasi atom-atom di dalam nyala dapat terjadi jika
suhu yang digunakan untuk atomisasi terlalu tinggi. Prinsip analisis dengan SSA
adalah mengukur absorbansi atom-atom netral yang berada dalam keadaan azas.
Jika terbentuk ion maka akan mengganggu pengukuan absorbansi atom netral
karena atom-atom yang mengalami ionisasi tidak sama spektrum atom dalam
keadaan netral (Gandjar dan Rohman, 2007).
3. Gangguan oleh penyerapan non-atomik (non atomic absorption)
Gangguan jenis ini berarti terjadinya penyerapan cahaya dari sumber
sinar yang bukan berasal dari atom-atom yang akan dianalisis. Penyerapan non
atomik dapat disebabkan oleh adanya penyerapan cahaya oleh partikel-partikel
padat yang berada di dalam nyala (Gandjar dan Rohman, 2007).
2.6 Validasi Metode Analisis
Validasi metoda analisis adalah suatu tindakan penilaian terhadap
parameter tertentu, berdasarkan percobaan laboratorium, untuk membuktikan
bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004).
Menurut Harmita (2004), beberapa parameter analisis yang harus dipertimbangkan dalam validasi metode analisis adalah sebagai berikut:
1. Kecermatan (accuracy)
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil
analis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai
persen perolehan kembali (recovery) analit yang ditambahkan. Kecermatan hasil
analis sangat tergantung kepada sebaran galat sistematik di dalam keseluruhan
dapat dilakukan dengan cara mengurangi galat sistematik tersebut seperti
menggunakan peralatan yang telah dikalibrasi, menggunakan pereaksi dan
pelarut yang baik, pengontrolan suhu, dan pelaksanaannya yang cermat, taat asas sesuai prosedur. Kecermatan ditentukan dengan dua cara yaitu:
Metode simulasi (spiked-placebo recovery)
Dalam metode simulasi, sejumlah analit bahan murni ditambahkan ke
dalam campuran bahan pembawa sediaan farmasi (plasebo) lalu campuran
tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar yang sebenarnya) (Harmita, 2004).
Metode penambahan baku (standard additionmethod)
Dalam metode penambahan baku, sampel dianalisis lalu sejumlah
tertentu analit yang diperiksa ditambahkan ke dalam sampel dicampur dan
dianalisis lagi. Selisih kedua hasil dibandingkan dengan kadar yang sebenarnya
(hasil yang diharapkan) (Harmita, 2004).
Dalam kedua metode tersebut, persen peroleh kembali dinyatakan
sebagai rasio antara hasil yang diperoleh dengan hasil yang sebenarnya. % Perolehan kembali dapat ditentukan dengan cara membuat sampel plasebo
(eksepien obat, cairan biologis) kemudian ditambah analit dengan konsentrasi
tertentu (biasanya 80% sampai 120% dari kadar analit yang diperkirakan),
kemudian dianalisis dengan metode yang akan divalidasi. Tetapi bila tidak
memungkinkan membuat sampel plasebo karena matriksnya tidak diketahui seperti obat-obatan paten, atau karena analitnya berupa suatu senyawa endogen
misalnya metabolit sekunder pada kultur kalus, maka dapat dipakai metode adisi. Metode adisi dapat dilakukan dengan menambahkan sejumlah analit dengan
konsentrasi tertentu pada sampel yang diperiksa, lalu dianalisis dengan metode
tersebut. Persen perolehan kembali ditentukan dengan menentukan berapa
persen analit yang ditambahkan tadi dapat ditemukan (Harmita, 2004).
2. Keseksamaan (precision)
Keseksamaan adalah ukuran yang menunjukkan derajat kesesuaian
rata-rata jika prosedur diterapkan secara berulang pada sampel-sampel yang diambil
dari campuran yang homogen (Harmita, 2004).
3. Selektivitas (Spesifisitas)
Selektivitas atau spesifisitas suatu metode adalah kemampuannya yang
hanya mengukur zat tertentu saja secara cermat dan seksama dengan adanya komponen lain yang mungkin ada dalam matriks sampel (Harmita, 2004).
4. Linearitas dan Rentang
Linearitas adalah kemampuan metode analisis yang memberikan respon
yang secara langsung atau dengan bantuan transformasi matematik yang baik,
proporsional terhadap konsentrasi analit dalam sampel. Rentang metode adalah
pernyataan batas terendah dan tertinggi analit yang sudah ditunjukkan dapat
ditetapkan dengan kecermatan, keseksamaan, dan linearitas yang dapat diterima
(Harmita, 2004).
5. Batas Deteksi dan Batas Kuantitasi
Batas deteksi adalah jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan
blangko. Batas kuantitasi merupakan parameter pada analisis renik dan diartikan sebagai kuantitas terkecil analit dalam sampel yang masih dapat memenuhi
BAB III
METODOLOGI PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Farmasi Kualitatif dan
di Laboratorium Penelitian Farmasi Fakultas Farmasi Universitas Sumatera
Utara pada bulan Februari 2013 - April 2013.
3.2 Bahan-bahan
3.2.1 Sampel
Sampel yang digunakan adalah sampel segar yaitu Bayam (Amaranthus
hybridus L.), Bayam merah (Amaranthus tricolor L.) yang diambil secara
purposif di Pasar Sore Jalan Jamin Ginting, Padang Bulan, Medan dan Bayam
duri (Amaranthus spinosus L.) yang diambil dari kompleks USU Medan
(Gambar dapat dilihat pada Lampiran 2, halaman 48 dan 49).
3.2.2 Pereaksi
Semua pereaksi yang digunakan adalah pro analis keluaran E. Merck
yaitu HNO3 65% b/v, Larutan baku besi 1000 µg/ml, Kalium heksasianoferat
(II), Amonium tiosianat, kecuali Aquabides (PT. Ikapharmindo Putramas).
3.3 Alat-alat
Alat – alat yang digunakan dalam penelitian ini adalah Spektrofotometer
Whatman no.42, Neraca analitik (Shimadzu), Botol gelap, Kurs porselen, Cawan
penguap, Hot plate (Shott), Alat-alat gelas (Pyrex dan Oberoi).
3.4 Identifikasi Sampel
Identifikasi tanaman bayam dilakukan oleh Laboratorium Taksonomi
Tumbuhan Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan
Alam Universitas Sumatera Utara.
3.5 Pembuatan Pereaksi
3.5.1 Larutan HNO3 (1:1) v/v
Larutan HNO3 (1: 1) dibuat dengan cara mengencerkan 500 ml HNO3
65% b/v dengan air suling 500 ml (Ditjen POM,1979).
3.5.2 Larutan HNO3 1 N v/v
Larutan HNO3 1 N dibuat dengan cara mengencerkan 69 ml HNO3 65%
b/v dengan air suling 1000 ml(Ditjen POM,1979).
3.5.3 Larutan Kalium Heksasianoferat (II) 10% b/v
Larutan Kalium heksasianoferat (II) 10% b/v dibuat dengan cara
melarutkan sebanyak 10 g kalium heksasianoferat (II) dengan 100 ml air suling
(Ditjen POM, 1995).
Larutan Amonium tiosianat 8% b/v dibuat dengan cara melarutkan
sebanyak 8 g Amonium tiosianat dengan 100 ml air suling (Ditjen POM, 1995).
3.6 Prosedur Penelitian
3.6.1 Pengambilan Sampel
Metode pengambilan sampel dilakukan dengan cara sampling purposif
yang dikenal juga sebagai sampling pertimbangan dimana sampel ditentukan
atas pertimbangan bahwa populasi sampel adalah homogen dan sampel yang
tidak diambil mempunyai karakteristik yang sama dengan sampel yang sedang
diteliti (Sudjana, 2005).
3.6.2 Penyiapan Bahan
Sampel yang digunakan adalah Bayam, Bayam merah dan Bayam duri.
Masing-masing bayam yang masih segar diambil daunnya tetapi tidak ikut pucuk
daunnya, kemudian dicuci dengan aquades dan dikeringkan dengan dianginkan,
dirajang dan ditimbang masing-masing daun bayam sebanyak ± 100 g.
Kemudian dikeringkan selama 2 hari di udara terbuka.
3.6.3 Proses Dekstruksi
Bayam yang segar masing-masing ditimbang sebanyak ± 100 gram
dikeringkan selama 2 hari di udara terbuka, kemudian dimasukkan ke dalam
cawan porselen, ditambah 10 ml HNO3 p lalu diarangkan menggunakan hot plate
dengan suhu 100oC, lalu diabukan di tanur mula-mula pada temperature 100oC
dan secara perlahan-lahan dinaikkan interval 25oC setiap 5 menit sampai
dibiarkan dingin di dalam desikator. Kemudian abu dilarutkan dalam 10 ml
HNO3 (1:1) dan dipanaskan di atas hot plate dengan suhu 100oC sampai kering,
kemudian ditanur pada suhu 500oC selama 1 jam (Helrich, 1990 dengan
modifikasi). Bagan alir proses dekstruksi kering dapat dilihat pada Lampiran 4,
halaman 52.
3.6.4 Pembuatan larutan Sampel
Hasil dekstruksi dilarutkan dengan 10 ml HNO3 (1:1) hingga larut
sempurna, kemudian dimasukkan ke dalam labu tentukur 100 ml dan kurs
porselen dibilas dengan aquabides sebanyak 3 kali. Hasil pembilasan
dimasukkan ke dalam labu tentukur. Setelah itu dicukupkan volumenya dengan
aquabides hingga garis tanda. Kemudian disaring dengan kertas saring Whatman
no. 42 dengan membuang 5 ml larutan pertama hasil penyaringan untuk
menjenuhkan kertas saring (Helrich, 1990 dengan modifikasi). Larutan ini
digunakan untuk analisis kualitatif dan analisis kuantitatif. Analisis yang sama
dilakukan sebanyak 6 kali untuk masing-masing sampel. Bagan alir proses
pembuatan larutan sampel dapat dilihat pada Lampiran 5, halaman 53.
3.6.5 Analisis kualitatif
3.6.5.1 Reaksi warna dengan Kalium heksasianoferat (II) 10 % b/v
Kedalam tabung reaksi dimasukkan 1 ml sampel kemudian ditambahkan
1 tetes kalium heksasianoferat (II) 10 % b/v. Jika terdapat besi maka akan terjadi
endapan biru tua (Svehla, 1979).
Kedalam tabung reaksi dimasukkan 1 ml sampel kemudian ditambahkan
1 tetes ammonium tiosianat 8 % b/v. Jika terdapat besi maka akan terbentuk
warna merah tua (Svehla, 1979).
3.6.6 Analisis kuantitatif
3.6.6.1 Pembuatan Kurva Kalibrasi Besi
Larutan baku besi (1000 µg/ml) dipipet sebanyak 10 ml dimasukkan ke
dalam labu tentukur 100 ml, kemudian ditambahkan 10 ml HNO3 1 N,
dicukupkan dengan aquabides sampai garis tanda (konsentrasi 100 µg/ml).
Larutan untuk kurva kalibrasi besi dibuat dengan memipet (2; 4; 6; 8 dan
10) ml larutan baku 100 µg/ml, masing-masing dimasukkan ke dalam labu
tentukur 100 ml, ditambahkan 10 ml HNO3 1 N kemudian dicukupkan dengan
aquabides sampai garis tanda (larutan ini mengandung 2 µg/ml, 4 µg/ml, 6
µg/ml, 8 µg/ml dan 10 µg/ml) dan diukur pada panjang gelombang 248,3 nm
dengan nyala udara-asetilen.
3.6.6.2 Penetapan Kadar Besi dalam Sampel
3.6.6.2.1 Penetapan Kadar Besi dalam Bayam (Amaranthus hybridus L.)
Larutan sampel bayam sebanyak 0,5 ml dimasukkan ke dalam labu
tentukur 25 ml dan ditambahkan 2,5 ml larutan HNO3 1 N dan diencerkan
dengan aquabides hingga garis tanda (Faktor pengenceran = 25/0,5 = 50 kali).
Diukur absorbansinya dengan Spektrofotometri Serapan Atom pada panjang
gelombang 248,3 nm. Nilai absorbansi yang diperoleh berada di dalam rentang
nilai kurva kalibrasi larutan baku besi. Konsentrasi besi dalam sampel ditentukan
3.6.6.2.2 Penetapan Kadar Besi dalam Bayam merah (Amaranthus tricolor
L.)
Larutan sampel bayam merah sebanyak 1,0 ml dimasukkan ke dalam
labu tentukur 25 ml dan ditambahkan 2,5 ml larutan HNO3 1 N dan diencerkan
dengan aquabides hingga garis tanda (Faktor pengenceran = 25/1,0 = 25 kali).
Diukur absorbansinya dengan Spektrofotometri Serapan Atom pada panjang
gelombang 248,3 nm. Nilai absorbansi yang diperoleh berada di dalam rentang
nilai kurva kalibrasi larutan baku besi. Konsentrasi besi dalam sampel ditentukan
berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.6.6.2.3 Penetapan Kadar Besi dalam Bayam duri (Amaranthus spinosus
L.)
Larutan sampel bayam sebanyak 0,25 ml dimasukkan ke dalam labu
tentukur 25 ml dan ditambahkan 2,5 ml larutan HNO3 1 N dan diencerkan
dengan aquabides hingga garis tanda (Faktor pengenceran = 25/0,25 = 100 kali).
Diukur absorbansinya dengan Spektrofotometri Serapan Atom pada panjang
gelombang 248,3 nm. Nilai absorbansi yang diperoleh berada di dalam rentang
nilai kurva kalibrasi larutan baku besi. Konsentrasi besi dalam sampel ditentukan
berdasarkan persamaan garis regresi dari kurva kalibrasi.
Kadar besi dalam sampel dapat dihitung dengan cara sebagai berikut:
Keterangan : C = konsentrasi logam dalam larutan sampel (µg/ml) V = volume larutan sampel (ml)
Fp = Faktor pengenceran W = berat sampel (g)
3.6.7 Penentuan Batas Deteksi dan batas kuantitasi
Menurut Harmita (2004), batas deteksi merupakan jumlah terkecil analit
dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan.
Sebaliknya batas kuantitasi merupakan kuantitas terkecil analit dalam sampel
yang masih dapat memenuhi kriteria cermat dan seksama.
Batas deteksi dan batas kuantitasi ini dapat dihitung dengan rumus
sebagai berikut:
Simpangan baku =
√
− �−
Batas Deteksi (LOD) =
�
Batas Kuantitasi (LOQ) = �
3.6.8 Uji Perolehan Kembali (Recovery)
Uji perolehan kembali atau recovery dilakukan dengan metode
penambahan larutan standar (standard addition method). Dalam metode ini,
kadar logam dalam sampel ditentukan terlebih dahulu, selanjutnya dilakukan
penentuan kadar logam dalam sampel yang sudah ditambahkan larutan standar
dengan konsentrasi tertentu, kemudian dihitung berapa jumlah analit yang
Sampel yang telah ditimbang ± 100 g dan telah dikeringkan, lalu
ditambahkan 10 ml larutan baku besi (konsentrasi 1000 µg/ml), kemudian
dilanjutkan dengan prosedur dekstruksi kering seperti yang telah dilakukan
sebelumnya. Prosedur pengukuran uji perolehan kembali dilakukan sama
dengan prosedur penetapan kadar sampel.
Menurut Harmita (2004), persen perolehan kembali dapat dihitung
dengan rumus di bawah ini:
Persen Perolehan Kembali = �− �
�∗
�
%
Keterangan : CA = Kadar logam dalam sampel sebelum penambahan baku (mg/100g)
CF = Kadar logam dalam sampel setelah penambahan baku (mg/100g)
C*
A = Kadar larutan baku yang ditambahkan (mg/100g)
3.6.9 Simpangan Baku Relatif
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau
koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang
menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode
dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku
relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode
yang dilakukan (Harmita, 2004).
Menurut Harmita (2004), rumus untuk menghitung simpangan baku
relatif adalah sebagai berikut:
RSD = 100%
X SD
SD = Standar Deviasi
RSD = Relative Standard Deviation
3.6.10 Analisis data Secara Statistik
Menurut Gandjar dan Rohman (2007), kadar besi yang diperoleh dari
hasil pengukuran masing-masing larutan sampel dianalisis secara statistik
dengan metode standar deviasi dengan menggunakan rumus sebagai berikut:
SD =
1 -n X -Xi 2
Keterangan : Xi = Kadar sampel
X = Kadar rata-rata sampel n = jumlah pengulangan
Kadar besi yang diperoleh dari hasil pengukuran masing-masing ke enam
larutan sampel, diuji secara statistik dengan uji Q.
Untuk mengetahui data ditolak atau diterima dilakukan dengan uji Q
yang dapat dihitung dengan rumus:
Qhitung =
terendah Nilai tertinggi Nilai terdekat yang Nilai dicurigai yang Nilai
Hasil pengujian atau nilai Q yang diperoleh ditinjau terhadap daftar harga Q
pada Tabel 3.1, apabila Qhitung > Qkritis maka data tersebut ditolak.
Tabel 3.1 Nilai Qkritis pada Taraf Kepercayaan 95%
Banyak Data Nilai Qkritis
Menurut Sudjana
(2005), untuk menentukan kadar besi di dalam sampel dengan interval
kepercayaan 95, = 0,05, dk = n-1, dapat digunakan rumus:
µ = X ± t
(½,dk)x (SD/
n)
Keterangan : µ = interval kepercayaan X = kadar rata-rata sampel
t = harga t tabel sesuai dengan dk = n-1 = tingkat kepercayaan
SD = standar deviasi n = jumlah perlakuan
3.6.11 Pengujian Beda Nilai Rata-rata
Menurut Sudjana (2005), sampel yang dibandingkan adalah independen
dan jumlah pengamatan masing-masing lebih kecil dari 30 dan varians () tidak
diketahui sehingga dilakukan uji F untuk mengetahui apakah varians kedua
populasi sama (1 = 2) atau berbeda (1 2) dengan rumus:
F0 =
�
�
Keterangan : F0 = Beda nilai yang dihitung
S1 = Standar Deviasi sampel 1
S2 = Standar Deviasi sampel 2
5 0,717
6 0,621
7 0,570
Apabila dari hasilnya diperoleh Fo tidak melewati nilai kritis F maka dilanjutkan uji
dengan distribusi t dengan rumus:
to = −
� √ / + /
Sp
=
√
− � +
− �
+ −
Keterangan : X1 = kadar rata-rata sampel 1
X2 = kadar rata-rata sampel 2
Sp = simpangan baku
n1 = jumlah perlakuan sampel 1
n2 = jumlah perlakuan sampel 2
S1 = Standar Deviasi sampel 1
S2 = Standar Deviasi sampel 2
Dan jika Fo melewati nilai kritis F maka dilanjutkan uji dengan distribusi t dengan
rumus:
to = −
� √� / + � /
Keterangan : X1 = kadar rata-rata sampel 1
X2 = kadar rata-rata sampel 2
Sp = simpangan baku
n1 = jumlah perlakuan sampel 1
n2 = jumlah perlakuan sampel 2
S1 = Standar Deviasi sampel 1
S2 = Standar Deviasi sampel 2
Kedua sampel dinyatakan berbeda apabila to yang diperoleh melewati nilai kritis t, dan
BAB IV
HASIL DAN PEMBAHASAN 4.1 Analisis kualitatif
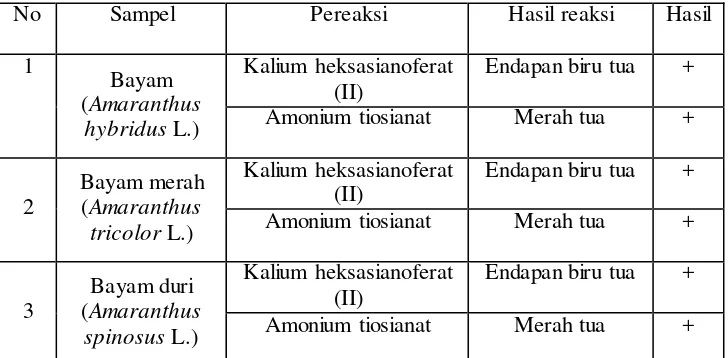
Analisis kualitatif dilakukan sebagai analisis pendahuluan untuk
mengetahui ada atau tidaknya besi dalam sampel. Data dan Gambar dapat dilihat
[image:51.596.112.476.285.464.2]pada Tabel 1 dan Lampiran 6, halaman 54.
Tabel 1. Hasil Analisis Kualitatif
No Sampel Pereaksi Hasil reaksi Hasil
1
Bayam
(Amaranthus
hybridus L.)
Kalium heksasianoferat (II)
Endapan biru tua +
Amonium tiosianat Merah tua +
2
Bayam merah
(Amaranthus
tricolor L.)
Kalium heksasianoferat (II)
Endapan biru tua +
Amonium tiosianat Merah tua +
3
Bayam duri
(Amaranthus
spinosus L.)
Kalium heksasianoferat (II)
Endapan biru tua +
Amonium tiosianat Merah tua +
Keterangan : + = Mengandung besi
Tabel di atas menunjukkan bahwa Bayam (Amaranthus hybridus L.),
Bayam merah (Amaranthus tricolor L.) dan Bayam duri (Amaranthus spinosus
L.) mengandung besi. Sampel di katakan positif mengandung besi jika
menghasilkan endapan biru tua dengan penambahan Kalium heksasianoferat II
4.2 Analisis kuantitatif
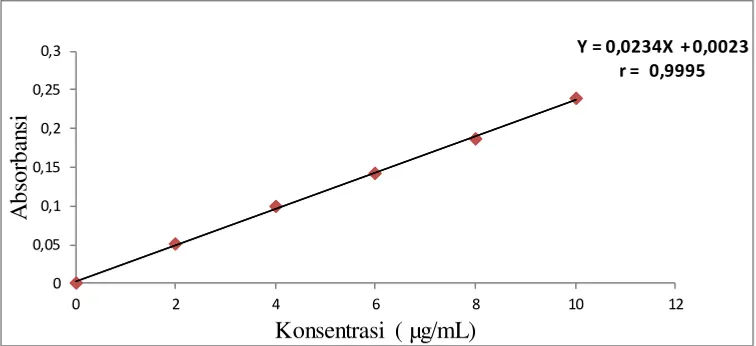
4.2.1 Kurva kalibrasi Besi
Kurva kalibrasi besi diperoleh dengan cara mengukur absorbansi dari
larutan standar besi pada panjang gelombang 248,3 nm. Dari pengukuran kurva
kalibrasi besi diperoleh persamaan garis regresi yaitu Y= 0,0234X + 0,0023
Gambar 1. Kurva kalibrasi Larutan Standar Besi
Berdasarkan kurva diatas diperoleh hubungan yang linear antara
konsentrasi dengan absorbansi, dengan koefisien korelasi (r) untuk besi sebesar
0,9995. Nilai r ≥ 0,97 menunjukkan adanya korelasi yang linear yang
menyatakan adanya hubungan antara X (konsentrasi) dan Y (absorbansi) (Ermer
dan Miller, 2005). Data hasil pengukuran absorbansi larutan standar besi dan
perhitungan persamaan garis regresi dapat di lihat pada Lampiran 7 dan 8,
halaman 55 dan 56.
4.2.2 Analisis Kadar Besi dalam Bayam
0 0,05 0,1 0,15 0,2 0,25 0,3
0 2 4 6 8 10 12
A
bs
or
ba
ns
i
Konsentrasi ( µg/mL)
[image:52.596.115.493.263.436.2]Pada pengukuran sampel yang dilakukan secara spektrofotometri serapan
atom, terlebih dahulu dikondisikan alat dan diatur modenya. Setelah itu
dilakukan pengenceran terhadap sampel. Pengenceran yang dilakukan yaitu
sebesar 25 kali untuk sampel Bayam merah, 50 kali untuk sampel Bayam dan
100 kali untuk Bayam duri. Untuk pengukuran kadar besi dalam sampel Bayam
duri, karena konsentrasi besi yang terdapat dalam Bayam duri besar, perlu
pengenceran 100 kali, agar berada dalam rentang kurva kalibrasi besi. Dan pada
sampel Bayam merah di perlukan pengenceran 25 kali, karena konsentrasi besi
yang terdapat dalam Bayam merah tidak sebesar konsentrasi besi yang terdapat
pada Bayam dan Bayam duri, maka hanya dengan pengenceran 25 kali
konsentrasi besi berada pada rentang kurva kalibrasi besi. Data dan contoh
perhitungan dapat dilihat pada Lampiran 9 dan 10halaman 58 dan 59.
Analisis dilanjutkan dengan perhitungan statistik (perhitungan dapat
dilihat pada Lampiran 11, halaman 61. Hasil analisis kuantitatif besi pada sampel
[image:53.596.114.486.572.680.2]dapat dilihat pada Tabel 2.
Tabel 2. Kadar besi dalam sampel Bayam (Amaranthus hybridus L.), Bayam merah (Amaranthus tricolor L.) dan Bayam duri (Amaranthus
spinosus L.)
No Sampel Kadar Besi (mg/100g)
1 Bayam (Amaranthus hybridus L.) 13,3854 ± 0,4126
2 Bayam merah (Amaranthus tricolor L.) 11,1592 ± 0,7117
Setelah dilakukan uji statistik terhadap kadar sampel maka dapat dilihat
bahwa kadar besi yang terdapat dalam Bayam (Amaranthus hybridus L.), Bayam
merah (Amaranthus tricolor L.) dan Bayam duri (Amaranthus spinosus L.)
mempunyai perbedaan yang signifikan. Hal ini dipengaruhi oleh faktor
perbedaan spesies tanaman dan lingkungannya (Ruskin, 1984).
Dari hasil analisis kuantitatif, sesuai yang tercantum pada tabel, Bayam
duri dengan daun berwarna hijau yang lebih tua dari Bayam dan Bayam merah,
mempunyai kadar yang lebih tinggi dari Bayam dan Bayam merah, sedangkan
Bayam merah memiliki kadar besi yang paling kecil dibandingkan Bayam dan
Bayam duri.
Hal ini bertolak belakang dengan pendapat umum masyarakat bahwa
bayam merah mengandung besi yang lebih tinggi, tetapi kenyataannya tidak.
Besi berfungsi sebagai kofaktor dalam pembentukan klorofil, protein dan
berperan dalam perkembangan kloroplas dengan cara mengaktifkan enzim
sitokrom, katalase, peroksidase sehingga ada kolerasi antara ketersediaan besi
dengan kadar klorofil dalam tanaman. Kekurangan besi menyebabkan
terhambatnya pembentukan klorofil, sehingga produksi klorofil berkurang
(Rosmarkam dan Yuwono, 2002). Defisiensi besi pada tanaman akan terlihat
pada daun berwarna hijau pucat (klorosis) (Winarso, 2005).
4.2.3 Pengujian Beda Nilai Rata-rata Kadar Besi pada Bayam, Bayam Merah dan Bayam Duri
Pengujian nilai beda rata-rata kadar besi pada sampel bertujuan untuk
ke tiga sampel bayam. Uji statistik yang digunakan yaitu uji beda nilai rata-rata
kadar besi antara ketiga sampel dengan menggunakan distribusi t pada taraf
kepercayaan 95% , jika diperoleh to atau thitung lebih tinggi atau lebih rendah dari
range t tabel maka menunjukkan perbedaan kadar yang signifikan antara ketiga
sampel tersebut.
Tabel 3. Hasil Uji Beda Nilai Rata-rata Kadar Besi antara tiga Sampel dari Spesies yang berbeda
Mineral No Sampel t hitung t tabel Kesimpulan
Besi
1 S1 terhadap S2 6,9563
± 2,2281
Ditolak
2 S1 terhadap S3 -54,4852 Ditolak 3 S2 terhadap S3 -34,0651 Ditolak
Keterangan : S1 = Sampel Bayam (Amaranthus hybridus L.) S2 = Sampel Bayam merah (Amaranthus tricolor L.) S3 = Sampel Bayam duri (Amaranthus spinosus L.)
Daerah kritis penolakan dengan menggunakan distribusi t dengan taraf
kepercayaan 95% adalah thitung < -2.2281 dan thitung > 2,2281. Dari tabel di atas
menunjukkan bahwa hipotesa ditolak. Hasil ini menunjukkan bahwa terdapat
perbedaan kandungan besi yang signifikan antara sampel Bayam (Amaranthus
hybridus L.), sampel Bayam merah (Amaranthus tricolor L.) dan sampel Bayam
duri (Amaranthus spinosus L.). Perhitungan dapat dilihat pada Lampiran 16, 17
dan 18, halaman 69, 71 dan