i
IDENTIFIKASI KERAGAMAN GEN HORMON PERTUMBUHAN
(EXON 2) PADA KAMBING PERANAKAN ETAWAH (PE),
SAANEN DAN PERSILANGANNYA (PESA) DENGAN
METODE PCR-SSCP
SKRIPSI IRINE
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
ii
RINGKASAN
IRINE. D14070168. 2011. Identifikasi Keragaman Gen Hormon Pertumbuhan (EXON 2) pada Kambing Peranakan Etawah (PE), Saanen dan Persilangannya (PESA) dengan Metode PCR-SSCP. Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Prof. Dr. Ir. Muladno, MSA Pembimbing Anggota : Dr. Jakaria, S.Pt, M.Si
Kambing merupakan salah satu ternak ruminansia kecil yang telah dikenal oleh masyarakat Indonesia. Upaya yang dapat dilakukan untuk meningkatkan mutu genetik ternak kambing adalah dengan melakukan eksplorasi terhadap gen-gen potensial yang diduga kuat berpengaruh terhadap pertumbuhan. Salah satu gen mayor yang diduga kuat terkait dengan pertumbuhan adalah gen Growth Hormone
(GH) yang menghasilkan hormon pertumbuhan yang dibutuhkan untuk pertumbuhan jaringan dan metabolisme lemak. Gen GH terbagi dalam sekuens nukleotida terdiri dari 5 exon dan 4 intron. Keragaman genetik pada tingkat DNA khususnya di gen GH pada kambing masih sangat terbatas. Penelitian ini bertujuan untuk mengidentifikasi keragaman gen GH exon 2 pada kambing Peranakan Etawah (PE), Saanen, dan persilangannya (PESA) dengan metode PCR-SSCP. Penelitian ini dilaksanakan di Laboratorium Genetika Molekuler Ternak, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Sampel darah kambing yang berhasil diidentifikasi berjumlah 180 sampel yang terdiri dari kambing PE yang berasal dari Ciapus (4), Cariu (10), Sukajaya (46); kambing Saanen berasal dari Cijeruk (18), Cariu (29), Sukabumi (40); serta kambing PESA yang berasal dari Cariu (17) dan Balitnak (16). Amplifikasi gen GH dilakukan dengan menggunakan teknik PCR, sedangkan untuk identifikasi keragaman dilakukan menggunakan metode PCR-SSCP. Analisis data dilakukan dengan menghitung frekuensi alel dan genotipe serta derajat heterozigositas.
Gen GH kambing exon 2 yang berhasil diamplifikasi berukuran 198 pb. Pendeteksian keragaman gen GH exon 2 menghasilkan dua tipe alel, yaitu alel A dan alel B. Frekuensi alel A pada masing-masing bangsa, yaitu PE (76%), Saanen (63%), dan PESA (71%). Alel B memiliki frekuensi lebih kecil dibandingkan alel A pada semua bangsa, yaitu PE (24%), Saanen (37%), dan PESA (29%). Genotipe yang diperoleh adalah AB dan AA. Frekuensi genotipe AB pada masing-masing bangsa, yaitu PE (48%), Saanen (74%), dan PESA (58%), sementara genotipe AA pada masing-masing bangsa, yaitu PE (52%), Saanen (26%), dan PESA (42%). Nilai heterozigositas pengamatan pada masing-masing bangsa dari yang tertinggi sampai terendah, yaitu Saanen (74%), PESA (58%), dan PE (48%). Nilai heterozigositas harapan pada masing-masing bangsa, yaitu Saanen (47%), PESA (41%), dan PE (37%).
Kata-kata kunci: kambing Peranakan Etawah (PE), kambing Saanen, kambing
persilangan Saanen + Etawah (PESA), gen Hormon Pertumbuhan,
iii
ABSTRACT
Growth Hormone Gene Polymorphisms (Exon 2) Identification on Peranakan Etawah (PE), Saanen and Crossbreeding (PESA) Goat Using
PCR-SSCP Method
Irine, Muladno, and Jakaria
The objective of this research was to identify exon 2 Growth Hormone (GH) gene polymorphism on Peranakan Etawah (PE), Saanen, and crossbreeding (PESA) goat using PCR-SSCP method. Identification analysis was carried out at Animal Molecular Genetic Laboratory, Department of Animal Production and Science Technology, Faculty of Animal Science, Bogor Agricultural University during Desember 2010 until March 2011. Total samples which identified are 180 samples of goat DNA which were consisting of the breed of PE which come from Ciapus (4), Cariu (10), Sukajaya (46); Saanen which come from Cijeruk (18), Cariu (29), Sukabumi (40); and PESA which come from Cariu (17) and Balitnak (16). The result shows that highest genotype was found at Saanen (AB) and PE (AA). The highest allele was found at PE (allele A) and Saanen (allele B). Ho values for PE, Saanen, and PESA are 48%, 74%, and 58%, respectively; furthermore He values in order are 37%, 47%, and 41%, respectively. It is concluded that all DNA samples used in analysis contains all genotype (AB, AA) and allele (A,B).
iv
IDENTIFIKASI KERAGAMAN GEN HORMON PERTUMBUHAN
(EXON 2) PADA KAMBING PERANAKAN ETAWAH (PE),
SAANEN DAN PERSILANGANNYA (PESA)
DENGAN METODE PCR-SSCP
IRINE D14070168
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
v
Judul : Identifikasi Keragaman Gen Hormon Pertumbuhan (EXON 2) pada Kambing Peranakan Etawah (PE), Saanen dan Persilangannya (PESA) dengan Metode PCR-SSCP
Nama : Irine NIM : D14070168
Menyetujui,
Mengetahui, Ketua Departemen
Ilmu Produksi dan Teknologi Peternakan
(Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc) NIP: 19591212 198603 1 004
Tanggal Ujian: 09 Mei 2011 Tanggal Lulus: Pembimbing Utama,
(Prof. Dr. Ir. Muladno, MSA) NIP: 19610824 198703 1 001
Pembimbing Anggota,
vi
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 08 Maret 1989 di Baturaja, Sumatera Selatan.
Penulis adalah anak keempat dari empat bersaudara dari pasangan Bapak Rusdi dan
Ibu Lenawati.
Penulis mengawali pendidikan dasar pada tahun 1995 di Sekolah Dasar
Xaverius 1 Baturaja dan diselesaikan pada tahun 2001. Pendidikan lanjutan tingkat
pertama dimulai pada tahun 2001 dan diselesaikan pada tahun 2004 di Sekolah
Lanjutan Tingkat Pertama Xaverius 1 Baturaja. Penulis melanjutkan pendidikan di
Sekolah Menengah Atas Xaverius 1 Baturaja pada tahun 2004 dan diselesaikan pada
tahun 2007.
Penulis diterima di Institut pertanian Bogor pada tahun 2007 melalui jalur
Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Ilmu Produksi
dan Teknologi Peternakan pada tahun 2007. Penulis aktif dalam organisasi
Himpunan Mahasiswa Ilmu Produksi dan Teknologi Peternakan (HIMAPROTER)
periode 2008-2009 sebagai staf Klub Unggas dan Keluarga Mahasiswa Buddhis
Institut Pertanian Bogor (KMB-IPB) sebagai anggota, periode 2007-2011. Penulis
pernah mengikuti kegiatan Pelatihan Penerapan Hazard Analysis and Critical Control Points (HACCP) pada Agroindustri Peternakan di Bogor dan Banten pada tahun 2010. Penulis berkesempatan menjadi penerima beasiswa PERTAMINA pada
tahun 2008/2009. Skripsi dengan judul Identifikasi Keragaman Gen Hormon Pertumbuhan (Exon 2) pada Kambing Peranakan Etawah (PE), Saanen dan Persilangannya (PESA) dengan Metode PCR-SSCP diselesaikan penulis sebagai syarat untuk memperoleh gelar sarjana di Fakultas Peternakan Institut Pertanian
vii
KATA PENGANTAR
Puji dan syukur senantiasa dipanjatkan kepada Tuhan Yang Maha Esa, karena
atas segala rahmat dan karunia-Nya, penulis dapat menyelesaikan studi, penelitian,
dan penulisan skripsi dengan judul Identifikasi Keragaman Gen Hormon Pertumbuhan (Exon 2) pada Kambing Peranakan Etawah (PE), Saanen dan Persilangannya (PESA) dengan Metode PCR-SSCP.
Beberapa hal yang mendasari dilakukannya penelitian ini diantaranya adalah
1) potensi kambing perah yang cukup tinggi, yaitu sebagai penghasil daging juga
sebagai penghasil susu; 2) terbatasnya informasi keragaman genetik pada tingkat
DNA khususnya di gen GH pada kambing.
Penelitian ini bertujuan untuk mengidentifikasi keragaman gen hormon
pertumbuhan exon 2 pada kambing PE, Saanen, dan persilangannya (PESA) dengan metode PCR-SSCP. Hasil yang diperoleh dari penelitian ini ditujukan sebagai
informasi awal mengenai keragaman gen GH exon 2 kambing PE, Saanen, dan persilangannya (PESA) untuk penelitian selanjutnya, guna mendapatkan ternak
kambing dengan kuantitas dan kualitas produksi yang lebih baik. Semoga penulisan
skripsi ini dapat bermanfaat dan memberikan sumbangan yang berarti bagi kemajuan
peternakan Indonesia. Amin.
Bogor, Mei 2011
ix
Prosedur ... 18
Ekstraksi DNA ... 18
Amplifikasi Gen GH ... 18
Pendeteksian Keragaman Gen GH dengan Metode PCR- SSCP ... 19
Pewarnaan Perak ... 19
Penentuan Genotipe Gen GH ... 19
Analisis Data ... 20
Frekuensi Alel dan Genotipe ... 20
Derajat Heterozigositas ... 21
HASIL DAN PEMBAHASAN ... 22
Amplifikasi Gen GH Exon 2 ... 22
Keragaman Gen GH Exon 2 ... 23
Frekuensi Genotipe dan Alel ... 26
Nilai Heterozigositas ... 29
KESIMPULAN DAN SARAN ... 32
Kesimpulan ... 32
Saran ... 32
UCAPAN TERIMA KASIH ... 33
DAFTAR PUSTAKA ... 34
x
DAFTAR TABEL
Nomor Halaman
1. Sampel Darah Kambing ... 16
xi
DAFTAR GAMBAR
Nomor Halaman
1. Kambing Kacang ... 5
2. Kambing Kosta ... 6
3. Kambing Gembrong ... 8
4. Kambing Etawah ... 8
5. Kambing Saanen ... 9
6. Kambing PE ... 9
7. Kambing PESA ... 10
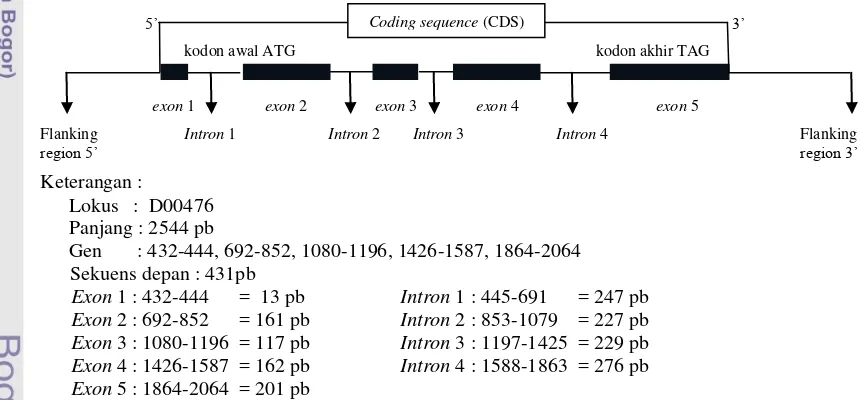
8. Rekonstruksi Struktur Gen GH Berdasarkan Sekuens Gen GH yang Diakses di GenBank No. D00476 ... 11
9. Sekuens Gen GH pada Ternak Kambing yang Diakses di GenBank No. D00476 ... 12
10. Runutan Nukleotida Gen GH Exon 2 Berdasarkan GenBank No. D00476 ... 17
11. Hasil Visualisasi Pita Gen GH Exon 2 pada Kambing Algarvia dengan Metode PCR-SSCP ... 20
12. Hasil Amplifikasi Gen GH Exon 2 dengan PCR dalam Gel 1,5% Agarose ... 22
13. Hasil Pendeteksian Keragaman Gen GH Exon 2 ... 24
14. Rekonstruksi Genotipe Gen GH Exon 2 ... 24
15. Frekuensi Genotipe Gen GH Exon 2 ... 27
16. Frekuensi Alel Gen GH Exon 2 ... 29
1 Kambing merupakan salah satu ternak ruminansia kecil yang telah dikenal oleh masyarakat Indonesia. Populasi ternak kambing terus meningkat dari tahun ke
tahun. Hal ini terlihat dari populasi kambing pada tahun 2005 sebesar 13.409.277
ekor menjadi 15.655.740 ekor pada tahun 2009 (Direktorat Jenderal Peternakan,
2010). Meskipun demikian, perkembangan ternak kambing masih termasuk rendah
yang disebabkan oleh tingkat produktivitas masih rendah. Produktivitas ternak
kambing yang rendah disebabkan oleh bibit ternak yang ada di masyarakat
berkualitas rendah, baik ternak betina produktif maupun pejantan. Penyebab lain
adalah masih tingginya perkawinan antara individu yang masih berkerabat dekat
serta semakin menurunnya ternak yang bermutu baik karena banyak yang dijual
(Subandriyo et al., 1995).
Kambing mempunyai daya adaptasi yang tinggi terhadap iklim tropik yang
ekstrim, fertilitas tinggi, interval generasi yang pendek, serta kemampuan
memanfaatkan berbagai macam hijauan dengan efisiensi biologis yang lebih tinggi
dibandingkan sapi (Heriyadi, 2004). Potensi kambing perah yang cukup tinggi, yaitu
sebagai penghasil susu juga sebagai penghasil daging, maka peningkatan mutu ternak
kambing harus dilakukan sehingga kuantitas dan kualitas produksi dapat
ditingkatkan. Upaya yang dapat dilakukan untuk meningkatkan mutu genetik ternak
kambing adalah dengan melakukan eksplorasi terhadap gen-gen potensial yang
diduga kuat berpengaruh terhadap pertumbuhan.
Salah satu gen mayor yang diduga kuat terkait dengan pertumbuhan adalah
gen Growth Hormone (GH). Gen-gen lain yang juga berpengaruh terhadap pertumbuhan diantaranya yaitu gen Growth Hormone Releasing Hormone (GHRH),
Somatotropin Releasing-Inhibitor Factor (SRIF) (Anderson et al., 2004), Pituitary
-Specific Positive Transcription Factor 1 (PIT-1) (Brunsch et al., 2002), dan Insulin-like growth factor-1 (IGF-1) (Hartman, 2000).
Hormon pertumbuhan disandikan oleh gen GH. Gen GH terdiri atas 5 exon
dan 4 intron (Barta et al., 2001). Gen GH exon 2 memiliki dua macam alel dan dua
2 polymorphism) merupakan metode yang sederhana, mudah, efisien, dan sangat
sensitif dalam mendeteksi adanya keragaman pada tingkat DNA. Keterbatasan
informasi mengenai keragaman gen GH pada kambing perah yang ada di Indonesia,
khususnya kambing PE, Saanen dan PESA, menjadi dasar penelitian ini dilakukan.
Tujuan
Penelitian ini bertujuan untuk mengidentifikasi keragaman genotipe, jumlah
3
TINJAUAN PUSTAKA Sejarah Perkembangan Kambing
Kambing merupakan hewan piaraan tertua yang didomestikasi setelah anjing
dan domba. Domestikasi kambing pertama kali diperkirakan terjadi pada abad 7
sebelum Masehi, atau dua abad setelah domestikasi domba. Domestikasi kambing
pertama kali terjadi oleh masyarakat yang hidup di Lembah Zawi Chemi Shanidar
dan Gua Shanidar di daerah Pegunungan Zagros Asia Barat yang sekarang
merupakan daerah di wilayah Irak Utara, kurang lebih sekitar 120 km dari Sungai
Tigris (Gall, 1981; Devendra dan Burns, 1994; Moelijanto dan Wiryanta, 2002).
Kambing yang berkembang sekarang berasal dari nenek moyang bangsa kambing
yang hidup di daerah-daerah marginal dan berbatu (Capra hircus aegagrus)
(Heriyadi, 2004).
Sampai saat ini diperkirakan terdapat lebih dari 300 bangsa kambing di
seluruh dunia. Berdasarkan jumlah tersebut, baru sekitar 81 bangsa kambing yang
telah diidentifikasi dan dideskripsikan dengan baik, minimum dapat dibedakan dari
sisi performa fisik yang menyangkut sifat-sifat kualitatif dan sifat-sifat kuantitatif,
serta hanya beberapa bangsa yang dapat dibedakan dari segi komposisi darah dan
gen (Heriyadi, 2001). Bangsa kambing dapat dikelompokkan berdasarkan
kegunaannya, yaitu kambing penghasil daging, susu, dan bulu (mohair). Ada pula
beberapa bangsa kambing yang tergolong tipe dwiguna (dual purpose), seperti
bangsa kambing PE yang tergolong tipe daging dan susu (Heriyadi, 2004).
Kambing termasuk ternak yang memiliki daya adaptasi tinggi, khususnya dari
sisi toleransinya terhadap berbagai jenis hijauan, mulai dari jenis rumput-rumputan,
leguminosa, rambanan, daun-daunan, sampai dengan semak belukar yang biasanya
tidak disukaioleh jenis ruminansia lain, seperti sapi perah, sapi potong, kerbau, dan
domba (Heriyadi, 2004).
Bangsa-bangsa Kambing di Indonesia
Bangsa kambing yang ada di Indonesia antara lain kambing Kacang
(menyebar hampir di seluruh wilayah), kambing PE (banyak terdapat di pulau Jawa),
kambing Etawah, kambing Kosta (banyak terdapat di provinsi Banten), dan kambing
4 2001). Bangsa kambing di Indonesia dapat dikelompokkan berdasarkan
kegunaannya, yaitu penghasil daging (kambing Kacang dan kambing Kosta), mohair
(kambing Gembrong), susu (kambing PESA), serta tipe dwiguna (kambing PE,
kambing Etawah dan kambing Saanen).
Kambing Kacang
Kambing Kacang merupakan kambing asli Indonesia yang juga terdapat di
Malaysia dan Philipina. Kambing Kacang sangat cepat berkembang biak, pada umur
15-18 bulan sudah dapat menghasilkan keturunan. Kambing ini cocok sebagai
penghasil daging dan kulit, bersifat prolifik, tahan terhadap berbagai kondisi, dan
mampu beradaptasi dengan baik di berbagai lingkungan yang berbeda termasuk
dalam kondisi pemeliharaan yang sangat sederhana (Pamungkas et al., 2009). Ciri-ciri kambing Kacang adalah antara lain bulu pendek dan berwarna
tunggal (putih, hitam, dan cokelat). Warna bulunya dapat berasal dari campuran
ketiga warna tersebut. Kambing jantan maupun betina memiliki tanduk yang
berbentuk pedang, dan melengkung ke atas sampai ke belakang dengan telinga
pendek dan menggantung. Janggut selalu terdapat pada jantan, sementara pada betina
jarang ditemukan. Leher berukuran pendek dan punggung berbentuk melengkung.
Kambing jantan berbulu surai panjang dan kasar sepanjang garis leher, pundak, dan
punggung sampai ekor (Pamungkas et al., 2009) (Gambar 1).
Tingkat kesuburan kambing Kacang tinggi dengan kemampuan hidup dari
lahir sampai sapih 79,4%, sifat prolifik anak kembar dua 52,2%, kembar tiga 2,6%
dan anak tunggal 44,9%. Umur rata-rata dewasa kelamin adalah 307,72 hari dengan
persentase karkas 44-51%. Rata-rata bobot anak lahir 3,28 kg dan bobot sapih (umur
5 Gambar 1. Kambing Kacang (Pamungkas et al., 2009)
Kambing Kosta
Lokasi penyebaran kambing Kosta dilaporkan Setiadi et al. (2002) ada di sekitar Jakarta dan Propinsi Banten. Kambing ini dilaporkan mempunyai bentuk
tubuh sedang, hidung rata dan kadang-kadang ada yang melengkung, tanduk pendek,
dan berbulu pendek (Gambar 2). Kambing ini diduga terbentuk dari persilangan
kambing Kacang dengan salah satu rumpun kambing impor
(Khasmir/Angora/Etawah) (Pamungkas et al., 2009).
Berdasarkan pengamatan yang telah dilakukan, sebaran warna dari kambing
Kosta ini adalah cokelat tua sampai hitam. Persentase terbanyak adalah warna hitam
(61%), cokelat tua (20%), cokelat muda (10,2%), cokelat merah (5,8%), dan abu-abu
(3,4%). Pola warna tubuh umumnya terdiri dari 2 warna, dan bagian yang belang
didominasi oleh warna putih. Persentase sebaran warna, yaitu satu warna (38%), dua
warna (56%), dan tiga warna (6%). Hasil pengamatan Setiadi et al. (2002) menunjukkan bahwa rataan lama bunting kambing Kosta adalah 146,33 hari dengan
kisaran 142-148 hari. Rataan jumlah anak sekelahiran sebesar 1,71 ekor. Hal ini
menunjukkan bahwa kambing Kosta cukup prolifik dengan rataan bobot lahir untuk
kelahiran tunggal adalah 1,9 kg dan kelahiran kembar 1,49 kg. Permasalahan
pengembangan kambing Kosta adalah masih tingginya laju mortalitas anak periode
pra-sapih yaitu pada minggu pertama setelah kelahiran yakni sebesar 42,16 %
6 Gambar 2. Kambing Kosta (Pamungkas etal., 2009)
Kambing Gembrong
Kambing Gembrong berasal dari daerah kawasan Timur Pulau Bali terutama
di Kabupaten Karangasem. Ciri khas kambing ini adalah berbulu panjang (15-25
cm), bahkan rambut pada bagian kepala menutupi muka dan telinga. Rambut panjang
terdapat pada kambing jantan, sedangkan kambing Gembrong betina berbulu pendek
berkisar 2-3 cm (Pamungkas et al., 2009) (Gambar 3).
Berdasarkan pengukuran dari berbagai aspek seperti panjang tubuh, tinggi
pundak, lingkar dada, dan tinggi pinggul, kambing Gembrong lebih kecil
dibandingkan kambing PE namun lebih besar dari kambing Kacang. Semakin besar
ukuran permukaan tubuh, semakin berat bobot badannya. Pengamatan menunjukkan
bahwa berat badan betina dewasa adalah 27,6 kg. Bobot badan kambing Gembrong
betina lebih rendah dari kambing PE betina dewasa (40,2 kg) dan kambing Jawa
randu betina dewasa (28,7 kg), namun sedikit lebih tinggi dari kambing Kacang (23,8
kg) (Setiadi et al., 2002).
Warna tubuh dominan kambing Gembrong adalah putih (61,5%), sebagian
berwarna cokelat muda (23,08%) dan cokelat (15,38%). Pola warna tubuh umumnya
adalah satu warna (69,23%) dan sisanya terdiri dari dua warna (15,38%) dan tiga
warna (15,38%). Rataan litter size kambing Gembrong adalah 1,25. Rataan bobot lahir tunggal 2 kg dan kembar dua 1,5 kg. Tingkat kematian pra-sapih sebesar 20%
7
Kambing Etawah (Jamnapari)
Kambing Etawah asli atau dikenal dengan kambing Jamnapari berasal dari
daerah Jamnapari India dengan ciri-ciri hidung melengkung, telinga panjang (30 cm)
terkulai, kaki panjang dan berbulu panjang pada garis belakang kaki, warna bulu
belang hitam putih atau merah, atau cokelat putih. Kambing Jamnapari sangat baik
sebagai hewan perah, dan juga sering dipelihara sebagai penghasil daging. Kambing
ini mempunyai banyak warna, termasuk warna putih, merah cokelat, dan hitam.
(Devendra dan Burns, 1994). Kambing Jamnapari memiliki tinggi tubuh pada jantan
dewasa 90-127 cm dan betina dewasa 76-92 cm (Sudono dan Abdulgani, 2002)
(Gambar 4).
Bobot badan jantan dewasa sekitar 68-91 kg dan betina dewasa 36-63 kg.
Rataan produksi susu sekitar 3 liter /ekor/hari dengan ambing relatif besar dan
panjang seperti botol (Balai Besar Pengkajian dan Pengembangan, 2008). Kambing
Etawah digunakan secara luas untuk meningkatkan mutu kambing asli yang lebih
kecil diberbagai negara seperti Malaysia dan Indonesia karena kemampuannya untuk
menghasilkan susu dan potensi pertumbuhannya. Produksi susu sekitar 235 kg
selama masa laktasi 261 hari (Devendra dan Burns, 1994). Persilangan dari kambing
Etawah diantaranya adalah kambing PE dan Jawarandu sebagai penghasil susu.
Kambing Saanen
Kambing Saanen berasal dari Swiss barat dan mempunyai ciri-ciri berwarna
putih, krem pucat, atau cokelat muda dengan bercak hitam pada hidung, telinga, dan
ambing. Kambing Saanen baik jantan maupun betina berbulu pendek, telinga tegak
dan mengarah ke depan (Gambar 5). Kambing Saanen umumnya dipelihara sebagai
ternak penghasil daging dan susu (Devendra dan Burns, 1994).
Kambing Saanen sudah tersebar luas di seluruh dunia serta dapat
menghasilkan susu 800 kg per ekor per masa laktasi yang berlangsung selama 250
hari. Bobot saat dewasa kelamin sekitar 65 kg. Kambing ini mempunyai rata-rata
produksi susu tertinggi dibandingkan bangsa kambing manapun, dan karena alasan
ini bangsa kambing ini telah diintroduksi ke banyak negara, termasuk Australia,
Puerto Riko, Hindia Barat, India, Fiji, Ghana, Kenya, Korea, Israel, Malaysia, dan
Filipina. Kambing ini sulit berkembang di daerah tropis karena kepekaannya
8
Gambar 3. Kambing Gembrong Gambar 4. Kambing Etawah (Pamungkas et al., 2009) (Rout et al., 1998)
Kambing Peranakan Etawah (PE)
Kambing PE adalah hasil persilangan kambing Kacang betina dengan
kambing Etawah jantan. Kambing PE termasuk bangsa kambing dwiguna (dual
purpose). Sebagai penghasil daging, bangsa kambing ini memiliki nilai lebih
dibandingkan kambing lokal, yaitu ukuran tubuh yang lebih besar dan pada umur
yang sama memiliki bobot potong lebih berat (Heriyadi, 2004). Selain sebagai
penghasil daging, kambing PE betina memiliki kemampuan menghasilkan susu yang
cukup baik. Kambing PE betina rata-rata dapat menghasilkan susu 1,2 liter/ekor/hari
selama fase 70 hari pertama laktasi (Balai Penelitian Ternak, 2001).
Kambing PE memiliki karakteristik tubuh yang besar dengan bobot badan
jantan dapat mencapai 90 kg dan betina 60 kg. Ciri-ciri spesifik kambing PE antara
lain memiliki bentuk hidung benguk (chubby), kuping, kaki, dan bulu yang panjang,
serta ambing besar dan produksi susu tinggi. Kambing PE telah beradaptasi dengan
baik di Indonesia, dan banyak ditemukan di berbagai daerah di Pulau Jawa dan
Madura, Pulau Sumbawa, dan Pulau Sumatra khususnya di Padang Mangatas
(Direktorat Jenderal Peternakan, 2003).
Kambing PE mempunyai ciri-ciri antara kambing Kacang dengan kambing
Etawah, yaitu bagian (1) telinganya panjang dan terkulai sampai dengan 18-30 cm;
(2) warna bulu bervariasi dari cokelat muda sampai hitam; (3) bobot hidup kambing
PE jantan dewasa sekitar 40 kg dan PE betina sekitar 35 kg dengan tinggi pundak
76-100 cm (Departemen Pertanian, Badan Penelitian dan Pengembangan Pertanian,
9 Gambaran umum kambing PE adalah mempunyai pangkal telinga terkulai,
menggantung, dan melipat mengarah ke depan, tanduk pipih mengarah ke belakang,
serta bulu kaki bagian belakang lebat dan panjang (Dinas Kehewanan dan Kelautan
Purworejo, 2002) (Gambar 6). Kambing PE mampu beranak tiga kali dalam dua
tahun dengan rataan jumlah anak sekelahiran 1-3 ekor (Balai Penelitian Ternak,
2001). Warna bulu ada yang tunggal; putih, hitam dan cokelat, tetapi jarang
ditemukan. Kebanyakan terdiri dari dua atau tiga pola warna, yaitu belang hitam,
belang cokelat, dan putih bertotol hitam (Pamungkas et al., 2009). Rataan bobot lahir kambing PE kelahiran tunggal adalah 3,2 kg untuk betina dan 3,7 kg untuk jantan,
bobot badan kambing PE dewasa jantan berkisar antara 45-80 kg dan betina berkisar
antara 30-50 kg (Setiadi dan Sutama, 1997).
Gambar 5. Kambing Saanen Gambar 6. Kambing PE
(Oklahoma State University, 1995) (Badan Standarisasi Nasional, 2008)
Kambing Peranakan Etawah dan Saanen (PESA)
Kambing PESA merupakan kambing hasil persilangan antara kambing PE
betina dengan kambing Saanen jantan. Kambing PESA mempunyai produksi susu
harian lebih baik daripada kambing PE, tetapi produksinya lebih rendah dari
kambing Saanen impor dan kambing Saanen keturunan (F1) (Ruhimat, 2003).
Produksi susu harian kambing Saanen, PE dan PESA di PT Fajar Taurus Dairy Farm
masing-masing sebesar 2 liter, 1,6 liter, dan 1,8 liter (Noorcandratini, 2004).
Kambing PESA mempunyai produksi susu yang lebih rendah dari Saanen karena
mempunyai masa laktasi yang lebih pendek, dan merupakan persilangan dengan PE
10 kambing Saanen impor, kambing PESA, dan kambing PE berturut-turut adalah
321,82±113,44 hari, 310,60±60,00 hari, 178±65,05 hari (Ruhimat, 2003) dan 170,07
hari (Atabany, 2001).
Gambar 7. Kambing PESA (Rachman, 2010)
Gen Hormon Pertumbuhan
Hormon pertumbuhan disekresikan oleh kelenjar pituitary yang berperan penting dalam laktasi (Baldi, 1999). Hormon pertumbuhan atau growth hormone
(GH) dibutuhkan untuk pertumbuhan jaringan dan metabolisme lemak yang berperan
penting untuk reproduksi, laktasi, dan pertumbuhan tubuh normal (Burton et al., 1994). GH pada hewan yang sedang tumbuh berguna untuk meningkatkan efisiensi
produksi, pengurangan deposisi lemak, merangsang pertumbuhan otot, meningkatkan
efisiensi penggunaan pakan, meningkatkan pertumbuhan organ, dan meningkatkan
pertumbuhan tulang (Etherton dan Bauman, 1998). GH berperan dalam pengaturan
perkembangan kelenjar mamae pada ternak ruminansia (Akers, 2006). Hubungan
tersebut menjadikan hormon pertumbuhan sebagai salah satu kandidat gen yang
dapat digunakan sebagai penanda genetik dalam program seleksi ternak. Hormon
pertumbuhan disandikan oleh gen GH.
Gen GH juga merupakan kandidat gen dalam pengaturan produksi susu,
11 transkripsi bagian intron hilang (splicing), sehingga proses translasi berjalan dengan baik (Jakaria, 2008). Sekuens gen GH ditunjukkan pada Gambar 9 (Kioka et al., 1989). Gen GH memiliki keanekaragaman pola genotipe yang sangat tinggi pada
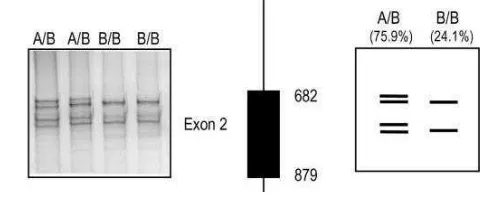
exon 3, 4 dan 5 sementara pada exon 1 dan 2 pola genotipe gen GH lebih terpelihara (seragam) (Marques et al., 2003). Pola genotipe gen GH pada exon 2 yaitu AB (75,9%) dan BB (24,1%) (Malveiro et al., 2001).
Beberapa parameter sekresi GH dan puncak laktasi berhubungan dengan
hewan perah yang mempunyai nilai genetik yang tinggi (Reinecke et al., 1993) yang ditunjukkan oleh hewan yang memiliki produksi susu tinggi (mempunyai rata-rata
level GH yang tinggi) (Vasilatos dan Wangsness, 1981). Keragaman gen GH pada
kambing Algarvia (Portugis) yang diidentifikasi dengan metode single strand conformation polymorphism (SSCP) berhubungan dengan produksi, lemak, dan protein susu (Boutinaud et al., 2003). Keragaman haploid gen GH│HaeIII pada kambing Boer berpengaruh terhadap bobot lahir, bobot sapih, pertambahan bobot
badan perhari sebelum sapih, dan bobot pada umur 11 bulan (Hua, 2009).
5’ 3’
Gambar 8. Rekonstruksi Struktur Gen GH Berdasarkan Sekuens Gen GH yang Diakses di GenBank No. D00476 (Kioka et al., 1989)
12 Gambar 8. Sekuens Gen GH pada Ternak Kambing yang
diakses di GenBank No. D00476 ( Kioka et al., 1989)
1 gggattttct gacccaggga ttaaacctga gtctcctgca tttgcagctc gattctttat
61 ggctgagcca cctgggaagc ccattcgttt ctgctacctc ccccttaaaa agaaaaccta
121 tggggtgggc tctcaagctg agaccctgtg tgtacagccc tcaggctggt ggcagtggag
181 aggggatgat gatgagcctg ggggacatga ccccagagaa ggaacgggaa caggatgagt
241 gagaggaggt tctaaattat ccattagcac aggctgccag tggtccttgc ataaatgtat
301 agagcacaca ggtgggggga aagggagaga gaagaagcca gggtataaaa agggcccagc
361 agagaccaat tccaggatcc caggacccag ttcaccagac gactcagggt cctgctgaca
421 gctcaccaac tatgatggct gcaggtaagc tcacaaaaat cccctccatt agcgtgtcct
481 aagggggtga tgcgggagaa ctgccgatgg atgtgtccac agctttgggt tttagggctt
541 ctgaatgcga acataggtat ctgcacccag acatttggcc aagtttgaaa tgttctcagt
601 ccctggaggg aagggcaggc gggggctggc aggagatcag gcatccagct ctctgggccc
661 ctccgtcgcg gccctcctgg tctctcccta gggccccgga cgtccctgct cctggctttc
721 accctgctct gcctgccctg gactcaggtg gtgggcgcct tcccagccat gtccttgtcc
781 ggcctgtttg ccaacgctgt gctccgggct cagcacctgc atcaactggc tgctgacacc
841 ttcaaagagt ttgtaagctc cccagagatg tgtcctagag gtggggaggc aggaaggggt
901 gaatccgcac cccctccaca caatgggagg gaactgagga cctcagtggt attttatcca
961 agtaaggatg tggtcagggg agtagaaatg ggggtgtgtg gggtggggag ggttccgaat
1021 aaggcagtga ggggaaccac acaccagctt agacccgggt gggtgtgttc tccccccagg
1081 agcgcaccta catcccggag ggacagagat actccatcca gaacacccag gttgccttct
1141 gcttctccga aaccatcccg gcccccacgg gcaagaatga ggcccagcag aaatcagtga
1201 gtggccacct aggaccgagg agcaggggac ctccttcatc ttaagtaggc tgccccagct
1261 ctctgcaccg ggcctggggt ggcgttctcc ctgaggtggc agagggtgtt ggatggcagt
1321 ggaggatgat ggttggtggt ggtggcagga ggtcctcggg cagaggccga ccttgcaggg
1381 ctgccccgag cccggggcac ccaccaacca cccatctgcc agcaggactt ggagctgctt
1441 cgcatctcac tgctccttat ccagtcgtgg cttgggcccc tgcagttcct cagcagagtc
1501 ttcaccaaca gcctggtgtt tggcacctcg gaccgtgtct atgagaagct gaaggacctg
1561 gaggaaggca tcctggcgct gatgcgggtg aggatggcgt tgttgggtcc cttccatgct
1621 gggggccatg cccaccctct cctggcttag ccaggagaac acacgtgggc tgggggagag
1681 agatccctgc tctctctctc tctttctagc agcccagtct tgacccagga gaaacctctt
1741 cccgttttga aacctccttc ctcgcccttc tccaagccta taggggaggg tggaaaatgg
1801 agcgggcagg agggagccgc tcctgagggc cttcggcctc tctgtctctc cctcccttgg
1861 caggagctgg aagatgttac cccccgggct gggcagatcc tcaagcagac ctatgacaaa
1921 tttgacacaa acatgcggag tgacgacgcg ctgctgaaga actacggtct gctctcctgc
1981 ttccggaagg acctgcacaa gacggagacg tacctgaggg tcatgaagtg tcgccgcttc
2041 ggggaggcga gctgcgcgtt ctagttgcca gccatctgtt gttacccctc cccgtgcctt
2101 cctagaccct ggaaggtgcc actccagtgc ccactgtcct ttcctaataa agcgaggaaa
2161 ttgcatcaca ttgtctgagt aggtgtcatt ctattctagg gggtggggtc aggcaggata
2221 gcgagaggga ggattgggaa gacaatagca gggatgctgt gggctctatg ggtacccagg
2281 tgctgaataa ttgacccggt tcttcctggg ccagaaggaa gcaggcacat ccccttctct
2341 gtgacacacc cggtcctcgc ccctggtcct tagttccagc cccactcata ggacactcat
2401 agctcaggag ggctctgcct tcagtcccac ccgctaaagt gcttggagcg gtttctcctt
2461 ccctcatcag cccaccaaac caaacctagc ctccaagagt gggaagaaat taaagcaaga
2521 caggctatga agtacagagg gaga
Gambar 9. Sekuens Gen GH pada Ternak Kambing yang Diakses di
13
Analisis Keragaman DNA
DNA digunakan sebagai bahan genetik karena dapat mewariskan sifat-sifat
organisme induk. Genom adalah segmen DNA yang mengandung informasi genetika
yang bisa diturunkan meliputi gen dan non gen. Molekul DNA adalah polimer dari
Deoxyribonucleotida (basa, zat gula, dan satu atau lebih gugus fosfat). Polymerase chain reaction (PCR) adalah suatu reaksi in vitro untuk menggandakan molekul DNA pada target tertentu dengan cara mensintesis molekul DNA baru yang
berkomplemen dengan molekul DNA tersebut dengan enzim polymerase dan oligonukleotida pendek sebagai primer dalam mesin termocycler. Primer merupakan oligonukleotida spesifik yang menempel pada bagian sampel DNA yang akan
diperbanyak. Enzim polymerase merupakan enzim yang dapat mencetak urutan DNA baru (Williams, 2005). Proses yang terjadi dalam mesin PCR meliputi tiga tahap
utama, yaitu tahap pradenaturasi, tahap kedua yang terdiri dari 35 siklus yang
masing-masing siklus terdiri dari denaturasi (pemisahan untai ganda DNA),
penempelan (annealing), ekstensi awal molekul DNA, dan tahap terakhir adalah
ekstensi akhir. Produk PCR dapat langsung divisualisasikan melalui proses
elektroforesis dan dapat digunakan untuk analisis lebih lanjut (Muladno, 2002).
Penanda Molekuler
Penanda molekuler merupakan pemanfaatan dari keragaman pada tingkat
deoxyribonucleic acid (DNA). Penanda molekuler memiliki peranan penting dalam
genetika ternak, yang merupakan salah satu faktor utama yang mendasari terjadinya
proses seleksi (Vignal etal., 2002).
Penanda molekuler yang utama digunakan pada hewan adalah Restriction Fragment Length Polymorphisms (RFLP), Microsatellites (MS), pemetaan genome, metode untuk mendeteksi marker-hubungan QTL dan penggunaan Marker Assisted Selection (MAS) (Montaldo dan Herrera, 1998), Single-Strand Conformation Polymorphisms (SSCP) (Livingstone et al., 1999). Penanda molekuler yang utama yang digunakan untuk pembiakan tanaman tetapi dengan penggunaan yang potensial
dapat digunakan untuk hewan adalah Randomly Amplified Polymorphic DNA
14 Prinsip dasar penerapan MAS (Marker Assisted Selection) adalah adanya
hubungan yang kuat secara statistik antara tipe gen (alel) tertentu dengan sifat
ekonomis unggul. Kebanyakan sifat-sifat ekonomis penting merupakan sifat
kuantitatif yang dikontrol oleh banyak gen dan masing-masing gen memberikan
sedikit kontribusi pada sifat tersebut (Noor, 2004). Namun demikian, diprediksi
terdapat beberapa gen utama yang memberikan kontribusi lebih pada variasi suatu
sifat. Gen semacam ini disebut dengan gen mayor (major gene) yang terletak pada
lokus sifat kuantitatif atau quantitative traits loci (QTL). Gen mayor yang dapat digunakan sebagai kandidat dalam program MAS adalah apabila gen tersebut
mempunyai fungsi dan pengaruh biologis yang nyata terhadap sifat kuantitatif
(Diyono, 2009).
Sistem mikrosatelit tersusun dari pengulangan DNA yang biasanya
merupakan dinukleotida sederhana (seperti TG) yang setiap dinukleotida diulang
sekitar sepuluh kali pada setiap lokus. Derajat polimorfisme yang tinggi dalam setiap
ulangan memungkinkan penggunaannya sebagai penanda lokasi dalam penandaan
genom. Penggunaan teknik RFLP, menjadi semakin intensif setelah
dikembangkannya teknik amplifikasi fragmen DNA yaitu polymerase chain reaction
(PCR). Kombinasi teknik PCR dan RFLP merupakan teknik pertama yang
dikembangkan untuk memvisualisasikan perbedaan level DNA yang didasarkan pada
penggunaan enzim pemotong (restriction enzyme) yang dapat memotong pada
sekuens nukleotida spesifik (Montaldo dan Herrera, 1998).
Metode PCR-SSCP (Polymerase Chain Reaction-Single Strand Conformation Polymorphism)
PCR-SSCP merupakan salah satu metode analisis lebih lanjut yang
memanfaatkan produk PCR. Metode PCR-SSCP merupakan metode yang handal
dalam mendeteksi adanya mutasi secara cepat (Hayashi, 1991). Metode ini
didasarkan pada asumsi bahwa perubahan asam nukleotida akan menyebabkan
perubahan pola migrasi pada gel poliakrilamida nondenaturasi(Barroso et al., 1999). Mutasi dideteksi dari adanya perbedaan pola migrasi dari bentuk ikatan utas tunggal
DNA pada gel poliakrilamida (Hayashi, 1991) yang disebut sebagai perubahan
15 perbedaan migrasinya dalam gel poliakrilamid pada saat elektroforesis (Montaldo
dan Herrera, 1998).
Beberapa faktor yang dapat mempengaruhi sensitivitas dari metode
PCR-SSCP yaitu: (1) komposisi gel, (2) ukuran fragmen DNA, (3) komposisi buffer,
termasuk kekuatan ion dan derajat keasaman, (4) ada tidaknya buffer aditif seperti
gliserol, (5) suhu pada saat elektroforesis, (6) kosentrasi DNA, (7) kandungan basa G
dan C dalam fragmen DNA (Nataraj et al., 1999). Barroso et al. (1999) menambahkan bahwa lokasi mutasi pada fragmen DNA juga dapat mempengaruhi
sensitivitas dari metode PCR-SSCP.
Metode analisis SSCP meliputi beberapa tahapan seperti yang dijelaskan oleh
Nataraj et al. (1999), yaitu tahap amplifikasi DNA target dengan cara PCR, tahap denaturasi DNA produk PCR pada suhu 94 0C, penambahan formamide dye, dan tahap elektroforesis dalam gel poliakrilamida nondenaturasi. Beberapa kelebihan
SSCP dibanding metode lain, yaitu: (1) sederhana dan tidak memerlukan peralatan
yang rumit dan khusus (Bastos et al., 2001; Nataraj et al., 1999), (2) dapat mendeteksi adanya mutasi pada fragmen DNA (Barroso et al., 1999) sehingga dapat
dibedakan dengan yang normal (Nataraj et al., 1999), (3) visualisasi tidak perlu menggunakan bahan radioaktif (Nataraj et al., 1999), (4) dapat dikerjakan di laboratorium biasa dan tidak terlalu mahal (Bastos et al., 2001). Kekurangan
PCR-SSCP, yaitu: (1) terbatas ukuran fragmen DNA yang dapat dianalisis, (2) butuh
kondisi yang beragam untuk mendeteksi semua kemungkinan mutasi, (3)
kadang-kadang sulit untuk mengintepretasikan pita-pita yang dihasilkan, (4) tidak efisien
untuk fragmen DNA yang tidak diketahui urutan nukleotidanya. Prizenberg et al. (2005) menambahkan bahwa analisis SSCP juga terbatas dalam menentukan jumlah
alel.
Keragaman gen GH pada kambing Algarvia (Portugis) yang diidentifikasi
16
METODE Lokasi dan Waktu
Penelitian ini dilakukan pada pertengahan bulan Desember 2010 sampai akhir
bulan Februari 2011 di Laboratorium Genetika Molekuler Ternak, Fakultas
Peternakan, Institut Pertanian Bogor.
Materi Sampel Darah
Sampel darah kambing yang digunakan dalam penelitian ini adalah sampel
darah dalam alkohol 96% (1:2) yang berjumlah 233 sampel dari koleksi sampel
Laboratorium Genetika Molekuler Ternak pada tahun 2009 dan 2010 yang disajikan
pada Tabel 1.
Tabel 1. Sampel Darah Kambing
Bangsa Lokasi Jumlah (ekor)
PE
Ciapus 20
Cariu 28
Sukajaya 50
Saanen
Cijeruk 20
Cariu 31
Sukabumi 40
PESA Cariu 25
Balitnak 19
Total 233
Primer GH
Primer adalah molekul oligonukleotida yang berukuran pendek (sekitar 18-24
pasang basa) yang akan menempel pada DNA cetakan di tempat spesifik. Pasangan
primer yang digunakan untuk mengamplifikasi gen GH adalah primer forward: 5’ -TCT AGG ACA CAT CTC TGG GG-3’ dan primer reverse: 5’-CTC TCC CTA GGG CCC CGG AC-3’. DNA target yang akan di amplifikasi berada di daerah exon
17 (Malveiro et al., 2001). Sekuens gen GH exon 2 yang diapit oleh pasangan primer (Forward dan Reverse) ditunjukkan oleh Gambar 10.
Keterangan : cetak tebal bergaris bawah (posisi primer)
Gambar 10. Runutan Nukleotida Gen GH Exon 2 Berdasarkan GenBank No. D00476 (Kioka et al., 1989)
Formamida Dye
Komponen formamida dye terdiri dari 80% formamida solution,10 mM EDTA, 1 mg/ml bromthymol blue, dan 1 mg/ml xylene cyanol.
Gel Agarose 1,5%
Bahan-bahan yang digunakan untuk membuat 1 lembar gel agarose 1,5%
adalah larutan 0,5 x TBE (Tris-Borat EDTA) 30 ml, serbuk agarose 0,45 gram, dan
2,5 μl EtBr.
Gel Poliakrilamida 12%
Bahan-bahan yang digunakan untuk membuat 1 lembar gel poliakrilamid
12% adalah air destilata steril 12,3 ml, larutan 30% akrilamida (akrilamida : bis = 29:
1) 10 ml, 2,5 ml larutan 5 x TBE, TEMED 15 μl, dan 10% APS 150μl.
Pewarnaan Perak (Silver Staining)
Bahan-bahan yang digunakan dalam pewarnaan perak adalah larutan A, air
destilata (200 ml), larutan B, dan larutan C. Larutan A terdiri dari 200 ml air
destilata, 0,2 gram AgNO3, 80 μl NaOH, dan 800 μl ammonia. Larutan B terdiri dari
200 ml air
destilata, 6 gram NaOH dan 200 μl formaldehid, sementara larutan C terdiri dari 100 ml air destilata dan 100 μl asam asetat.
Ekstraksi DNA
Bahan-bahan yang digunakan dalam ekstraksi DNA adalah TE (Tris EDTA),
STE (Sodium Tris-EDTA), NaCl, SDS, CIAA (chloroform iso amil alkohol), dan
etanol.
661 ctccgtcgcg gccctcctgg tCTCTCCCTA GGGCCCCGGA Cgtccctgct cctggctttc
18
Prosedur Ekstraksi DNA
Ekstraksi DNA dilakukan secara konvensional mengikuti metode Sambrook
et al. (1989). Sampel darah dalam EtOH diambil sebanyak 200 μl dan dipindahkan
kedalam tabung 1,5 ml, ditambahkan 1000 ml air destilata kemudian di homogenkan
dan diamkan selama ± 5 menit. Campuran tersebut kemudian disentrifugasi dengan
kecepatan 8000 rpm selama 5 menit dan bagian supernatannya dibuang. Endapan
sel-sel darah yang diperoleh dicuci dengan air destilata sebanyak dua kali. Tahap selanjutnya adalah penambahan 40 μl SDS 10%, 10 μl Prot K 5 mg/ml dan 1 x STE sampai volumenya 400 μl, dikocok pelan dalam inkubator pada suhu 550
C selama 2
jam. Molekul DNA dimurnikan dengan cara penambahkan larutan fenol sebanyak 400 μl, 400 μl CIAA, dan 40 μl 5M NaCl yang dikocok pelan pada suhu ruang selama 1 jam. Molekul DNA yang larut dalam fase air dipisahkan dari fase fenol
dengan alat sentrifugasi pada kecepatan 12000 rpm selama 5 menit. Bagian DNA
(bening) dipindahkan dengan menggunakan pipet ke tabung 1,5 ml baru dan ditambahkan 800 μl EtOH absolut serta 40 μl 5M NaCl, kemudian dibekukanselama satu malam. Molekul DNA kemudian dipisahkan dari EtOH absolut dengan cara
sentrifugasi pada kecepatan 12000 rpm selama 5 menit, kemudian supernatan yang
terbentuk dibuang. Endapan yang dihasilkan dicuci dengan menambahkan EtOH 70% sebanyak 800 μl. Molekul DNA dipisahkan dari EtOH 70% dengan sentrifugasi pada kecepatan 12000 rpm selama 5 menit. Supernatan yang diperoleh
kemudian dibuang sehingga diperoleh endapan molekul DNA. Endapan tersebut
didiamkan dalam keadaan terbuka sampai alkohol hilang dan disuspensikan dalam 100 μl TE 80% buffer TE (tris-EDTA) dan disimpan dalam freezer sampai akan digunakan.
Amplifikasi Gen GH
Amplifikasi gen GH secara in vitro menggunakan teknik PCR dengan mesin
thermocycler. Pereaksi PCR terdiri dari sampel DNA 1 μl, air destilata 8,9 μl, primer 0,2 μl, 10 x buffer 1,2 μl, dNTP 0,1 μl, MgCl2 0,5 μl, dan enzim Taq fermentas 0,1 μl dengan volume akhir 12 μl . Campuran tersebut kemudian diinkubasikan dalam
19 95 oC selama 5 menit, tahap kedua yang terdiri dari 35 siklus yang masing-masing
siklus terdiri dari denaturasi pada suhu 95 oC selama 30 detik, penempelan
(annealing) 63 oC selama 45 detik, ekstensi awal molekul DNA 72 oC selama 1
menit, dan tahap terakhir adalah ekstensi akhir 72 oC selama 5 menit.
Pendektesiaan Keragaman Gen GH dengan Metode PCR-SSCP
Elektroforesis dilakukan pada produk PCR yang telah dihasilkan dengan
menggunakan gel agarose 1,5% dengan tegangan 150 volt. Produk PCR sebanyak 5 μl dicampur dengan loading dye (bromthymol blue 0,01%, xylene cyanol 0,01% dan gliserol 50%) 0,5 μl dimasukkan pada masing-masing sisir yang terdapat pada gel
agarose 1,5%, kemudian ditambahkan dengan marker 100 pb. Setelah elektroforesis,
(± 35 menit) gel agarose diambil untuk melihat panjang pita DNA dengan
menggunakan UV-Transilluminator. Produk PCR yang tersisa (7 μl) kemudian ditambahkan formamide dye sebanyak 7 μl. Campuran tersebut diinkubasi dalam
water bath pada suhu 94 oC selama 5 menit dengan tujuan membuat fragmen DNA untai ganda menjadi untai tunggal. Setelah itu, tabung yang berisi campuran tersebut
segera didinginkan pada suhu 0 oC selama 5 menit. Larutan formamida dye berfungsi
untuk mencegah penempelan kembali antara DNA untai tunggal. Sampel sebanyak
10 μl didistribusikan dalam gel 12% poliakrilamida nondenaturasi untuk mendeteksi
keragaman bentuk DNA untai tunggal. Alat elektroforesis dijalankan pada tegangan
370 V selama 18 jam di dalam refrigerator. Setelah itu, gel 12% poliakrilamida dikeluarkan dari cetakan dan dilakukan pewarnaan perak.
Pewarnaan Perak
Gel dikeluarkan dari cetakannya setelah elektroforesis selesai dan direndam
dalam larutan A selama 8 menit. Setelah itu, larutan A dibuang dan gel dibilas
dengan air destilata. Perendaman selanjutnya adalah menggunakan larutan B sambil
digoyang sampai muncul pita. Larutan B dibuang setelah muncul pita, kemudian gel
direndam dalam larutan asam asetat (larutan C) untuk menghentikan reduksi perak.
Penentuan Genotipe Gen GH
Keragaman gen GH dapat dideteksi dengan membandingkan banyaknya pita
yang muncul dalam gel 12% poliakrilamida nondenaturasi. Penentuan tipe gen GH
20 disebabkan karena perbedaan konformasi fragmen DNA untai tunggal. Konformasi
yang berbeda akan mempengaruhi laju migrasi gel 12% poliakrilamida nondenaturasi
sehingga dapat diidentifikasikan keragamannya. Penentuan genotipe sampel
mengacu pada Malveiro et al. (2001) (Gambar 11) namun berbeda dalam cara penamaannya, dalam penelitian ini didasarkan pada migrasi dari anoda (-) ke katoda
(+), sehingga pita DNA yang lebih dahulu bermigrasi dinamakan A.
Gambar 11. Hasil Visualisasi Pita Gen GH Exon 2 pada Kambing Algarvia dengan Metode PCR-SSCP (Malviero etal., 2001)
Analisis Data Frekuensi Alel dan Genotipe
Keragaman genotipe tiap-tiap individu dapat ditentukan dari migrasi pita-pita
DNA. Masing-masing sampel dibandingkan berdasarkan ukuran yang sama dan
dihitung frekuensi alelnya (Nei dan Kumar, 2000) :
Keterangan :
Xi = frekuensi alel ke-i Xii = frekuensi genotipe ke-i
nii = jumlah individu bergenotipe ii
nij = jumlah individu bergenotipe ij
N = jumlah total sampel
Frekuensi genotipe dihitung dengan persamaan sebagai berikut (Walpole,
21
Derajat Heterozigositas
Keragaman genetik (genetic variability) dilakukan melalui perhitungan nilai
heterozigositas pengamatan (Ho), heterozigositas harapan (He) (Weir, 1996) :
Keterangan :
Ho = frekuensi heterozigositas pengamatan
N1ij = jumlah individu heterozigositas pada lokus ke-1
N = jumlah individu yang dianalisis
Keterangan :
He = frekuensi heterozigositas harapan
P1i = frekuensi alel ke-1 pada lokus 1
22
HASIL DAN PEMBAHASAN Amplifikasi Gen GH Exon 2
Gen GH exon 2 pada ternak kambing PE, Saanen, dan persilangannya (PESA) berhasil diamplifikasi menggunakan teknik PCR (Polymerase Chain
Reaction). Pasangan primer yang digunakan berdasarkan Malveiro et al. (2001), yang digunakan pada ternak kambing Algarvia. Hasil amplifikasi gen GH pada gel
agarose 1,5% disajikan pada Gambar 12.
Keterangan: M : Marker 100 bp
1-12 : sampel kambing PE dari Sukajaya
Gambar 12. Hasil Amplifikasi Gen GH exon 2 dengan PCR dalam Gel 1,5% Agarose
Menurut Malveiro et al. (2001), panjang gen GH exon 2 hasil amplifikasi dengan pasangan primer (Gambar 10) adalah 198 pb. Panjang fragmen gen GH exon
2 pada penelitian ini juga memiliki panjang 198 pb. Namun, terdapat perbedaan
dengan panjang fragmen gen GH exon 2 yang diteliti oleh Kioka et al. (1989) yaitu 161 pb. Hal ini mungkin disebabkan oleh perbedaan bangsa kambing yang
digunakan serta desain primer yang dirancang. Panjang fragmen hasil amplifikasi
dapat diketahui dengan cara mencocokkan situs penempelan pasangan primer pada
sekuens gen GH exon 2 (GenBank nomor akses D00476) (Lampiran 1).
Beberapa hal yang umum dilakukan untuk optimasi PCR diantaranya adalah
suhu annealing (penempelan primer), konsentrasi Mg2+, konsentrasi primer, dan konsentrasi DNA target (Viljoen et al., 2005). Suhu annealing adalah suhu yang
memungkinkan terjadinya penempelan primer pada DNA cetakan selama proses
23 digunakan pada penelitian ini 63 oC selama 45 detik, berbeda dengan Malveiro et al. (2001) yaitu 65 oC . Meskipun terdapat perbedaan suhu annealing yang digunakan untuk mengamplifikasi gen GH exon 2, hal ini tidak menjadi masalah karena gen GH
exon 2 yang menjadi target tetap berhasil diamplifikasi.
Keberhasilan dalam mengamplifiksai DNA tergantung pada interaksi
komponen PCR dalam konsentrasi yang tepat (Palumbi, 1996). Persentase
keberhasilan amplifikasi gen GH exon 2 sekitar 77% atau sebanyak 180 sampel yang berhasil diamplifikasi dari total 233 sampel. Amplifikasi DNA yang kurang berhasil
ini dapat disebabkan oleh adanya mutasi pada sekuens target yang mengakibatkan
penempelan primer kurang tepat (mismatches) serta kualitas DNA yang rendah
(konsentarsi atau kemurnian DNA). Selain itu, juga dipengaruhi oleh adanya
inhibitor dalam sampel DNA, yaitu haemoglobin, yang dapat menghambat kerja
enzim taqpolymerase (Al Soud dan Radstrom, 2001).
Keragaman Gen GH Exon 2
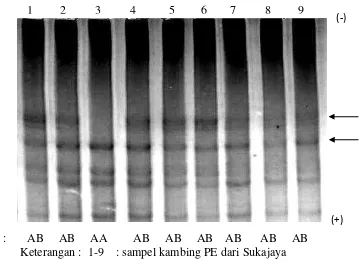
Pendeteksian keragaman gen GH exon 2 dengan metode PCR-SSCP dibedakan berdasarkan banyaknya pita yang muncul dan laju migrasi fragmen DNA.
Genotipe gen GH exon 2 yang ditemukan dalam penelitian ini memiliki jumlah pita di bawah empat. Hasil ini sesuai dengan penelitian Bastos et al., (2001) yang menyatakan bahwa pita maksimum suatu sampel DNA dengan metode PCR-SSCP
adalah empat pita.
Gen GH exon 2 pada penelitian ini yang ditemukan pada kambing perah PE, Saanen, dan PESA bersifat polimorfik (beragam), karena ditemukan dua genotipe
pada exon 2 yaitu AB dan AA. Kondisi tersebut sesuai dengan hasil penelitian yang dilakukan oleh Malveiro et al. (2001) yang menemukan dua genotipe yang mempresentasikan dua alel yaitu genotipe AB dan BB serta alel A dan B.
Masing-masing genotipe dibedakan berdasarkan jumlah pita yang muncul dalam gel
poliakrilamida 12% nondenaturasi. Genotipe AB ditandai dengan adanya 2 pita dan
genotipe AA ditandai dengan adanya 1 pita. Hasil pendeteksian keragaman gen GH
24
A
Genotipe : AAB AB AA AB AB AB AB AB AB B
Keterangan : 1-9 : sampel kambing PE dari Sukajaya
Gambar 13. Hasil Pendeteksian Keragaman Gen GH Exon 2
Gambar 14. Rekonstruksi Genotipe Gen GH Exon 2
Pendeteksian keragaman gen GH exon 2 dilakukan dengan metode
polymerase chain reaction-single strand conformation polymorphism (PCR-SSCP).
Metode PCR-SSCP merupakan metode yang handal dalam mendeteksi keragaman
DNA yang disebabkan adanya perubahan fragmen DNA dan mendeteksi level mutasi
yang rendah (Yahyaoui, 2003). PCR-SSCP memiliki asumsi bahwa perubahan yang
terjadi pada nukleotida akan mempengaruhi bentuk (konformasi) dari fragmen DNA
untai tunggal (Bastos et al., 2001) dan laju migrasi pada saat elektroforesis. AA
AB
(-)
(+)
25 Persentase keberhasilan pendeteksian keragaman dengan PCR-SSCP adalah 100%
dari 180 sampel DNA.
Tahapan dari metode PCR-SSCP terdiri dari amplifikasi DNA target dengan
menggunakan mesin thermocycler, penambahan larutan formamide dye, denaturasi DNA produk PCR pada suhu 94 oC, dan tahap elektroforesis dalam gel
poliakrilamida 12% nondenaturasi pada kondisi suhu yang konstan. Penambahan
larutan formamide dye berfungsi untuk mencegah terjadinya penempelan kembali (redenaturasi) fragmen DNA untai tunggal dengan komplemennya setelah proses
denaturasi, sehingga pada saat sampel dicelupkan dalam air es, suhu turun secara
cepat, fragmen DNA untai tunggal akan melipat dan membentuk suatu konformasi
yang kompleks. Tahap denaturasi yang sempurna akan sangat berpengaruh terhadap
hasil elektroforesis. Denaturasi sampel yang tidak sempurna akan menyebabkan
kesulitan dan kesalahan dalam melakukan identifikasi tipe maupun penentuan
genotipe dari suatu sampel.
Faktor-faktor yang dapat mempengaruhi keberhasilan dengan metode
PCR-SSCP adalah:
1. Panjang Fragmen DNA
Gen GH exon 2 mempunyai panjang fragmen 198 pb. Sensitivitas dari metode PCR-SSCP dipengaruhi oleh panjang fragmen DNA gen hasil amplifikasi.
Menurut Hayashi (1991) sensitivitas dari metode PCR-SSCP adalah 99% untuk
fragmen DNA yang memiliki panjang 100-300 pb dan 89% untuk fragmen yang
memiliki panjang 300-450 pb.
2. Suhu
Elektoforesis pada penelitian ini dilakukan dalam refrigerator dengan
menggunakan kisaran suhu 4 oC. Suhu yang konstan sangat berpengaruh terhadap
ketegasan dan ketajaman pita yang dihasilkan (Bastos et al., 2001) serta untuk menghindari pengaruh dari peningkatan suhu yang ditimbulkan oleh tegangan listrik.
Elektroforesis dapat juga dilakukan pada suhu ruang, namun perlu ditambahkan
buffer aditif seperti gliserol ke dalam gel. Elektroforesis dalam penelitian ini dilakukan dalam refrigerator dengan suhu yang relatif konstan (4 oC), sehingga tidak
26
3. Konsentrasi Akrilamida
Konsentrasi akrilamida gel berpengaruh terhadap pendeteksian keragaman
dalam SSCP. Konsentrasi akrilamida yang semakin rendah menghasilkan gel yang
lebih lembut dan lebih sensitif dalam mendeteksi keragaman (Hayashi, 1991).
Konsentrasi akrilamida yang digunakan dalam penelitian ini adalah 12% (29:1). Hal
ini sesuai dengan Muladno (2002) yang menyatakan efektivitas pemisahan DNA di
dalam gel poliakrilamida bergantung dari konsentrasi akrilamida yaitu 12% untuk
kisaran ukuran DNA 40-200 pb. Panjang target fragmen DNA yang digunakan
adalah 198 pb.
4. Perbandingan Akrilamida dan Bis Akrilamida
Perbandingan akrilamida dan bis akrilamida yang digunakan akan
berpengaruh terhadap lebar matriks yang akan dilewati oleh utas tunggal DNA.
Barroso et al. (1999) menggunakan perbandingan 100:1 untuk menghasilkan kondisi gel terbaik. Ceriotti et al. (2004) menggunakan perbandingan 29:1, sedangkan Agung (2007) menggunakan perbandingan 59:1. Perbandingan akrilamida dan bis
akrilamida yang digunakan dalam penelitian ini adalah 29:1 karena lebih efisien dari
segi biaya. Perbedaan perbandingan tersebut tidak berpengaruh terhadap
pendeteksian selama bentuk ikatan utas tunggal DNA masih dapat bermigrasi dalam
matriks gel tersebut.
Frekuensi Genotipe dan Alel
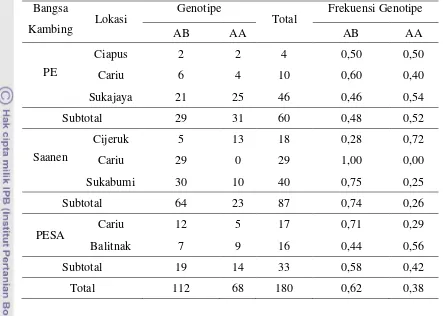
Hasil analisis frekuensi genotipe pada fragmen gen GH pada kambing PE,
Saanen, dan PESA disajikan pada Tabel 2 dan Gambar 15. Frekuensi genotipe dan
alel gen GH exon 2 berdasarkan kriteria bangsa ternak, yaitu kambing PE, Saanen, dan PESA. Keragaman genetik terjadi apabila terdapat dua alel atau lebih dalam
27 Tabel 2. Frekuensi Genotipe Gen GH Exon 2
Bangsa
Kambing Lokasi
Genotipe
Total Frekuensi Genotipe
AB AA AB AA
PE
Ciapus 2 2 4 0,50 0,50
Cariu 6 4 10 0,60 0,40
Sukajaya 21 25 46 0,46 0,54
Subtotal 29 31 60 0,48 0,52
Saanen
Cijeruk 5 13 18 0,28 0,72
Cariu 29 0 29 1,00 0,00
Sukabumi 30 10 40 0,75 0,25
Subtotal 64 23 87 0,74 0,26
PESA Cariu 12 5 17 0,71 0,29
Balitnak 7 9 16 0,44 0,56
Subtotal 19 14 33 0,58 0,42
Total 112 68 180 0,62 0,38
28 Frekuensi genotipe fragmen gen GH exon 2 pada kambing PE memiliki genotipe AA lebih tinggi dibanding dengan genotipe AB. Hal ini berbeda dengan
bangsa kambing Saanen dan silangannya (PESA) yang memiliki frekuensi genotipe
AB yang lebih tinggi. Kondisi seperti ini juga didapatkan oleh Malveiro et al. (2001) yang menghasilkan frekuensi genotipe AB yang lebih tinggi dari frekuensi genotipe
BB yaitu 0,759 dan 0,241, serta Marques et al. (2003) yang menghasilkan genotipe AB dan BB secara berturut-turut untuk tipe Ribatejano yaitu 0,902 dan 0,98 serta
0,935 dan 0,065 untuk tipe Jarmelista. Perbedaan frekuensi genotipe fragmen gen
GH exon 2 antara kambing PE, Saanen, dan PESA disebabkan oleh perbedaan bangsa ternak.
Frekuensi alel adalah frekuensi relatif dari suatu alel dalam populasi atau
jumlah suatu alel terhadap total alel yang terdapat dalam suatu populasi (Nei dan
Kumar, 2000). Frekuensi alel disajikan pada Tabel 3 dan Gambar 16.
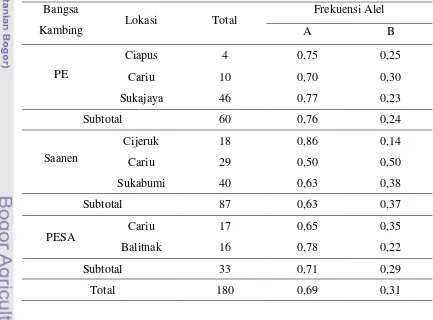
Tabel 3. Frekuensi Alel Gen GH Exon 2
Bangsa
Kambing Lokasi Total
Frekuensi Alel
A B
PE
Ciapus 4 0,75 0,25
Cariu 10 0,70 0,30
Sukajaya 46 0,77 0,23
Subtotal 60 0,76 0,24
Saanen
Cijeruk 18 0,86 0,14
Cariu 29 0,50 0,50
Sukabumi 40 0,63 0,38
Subtotal 87 0,63 0,37
PESA Cariu 17 0,65 0,35
Balitnak 16 0,78 0,22
Subtotal 33 0,71 0,29
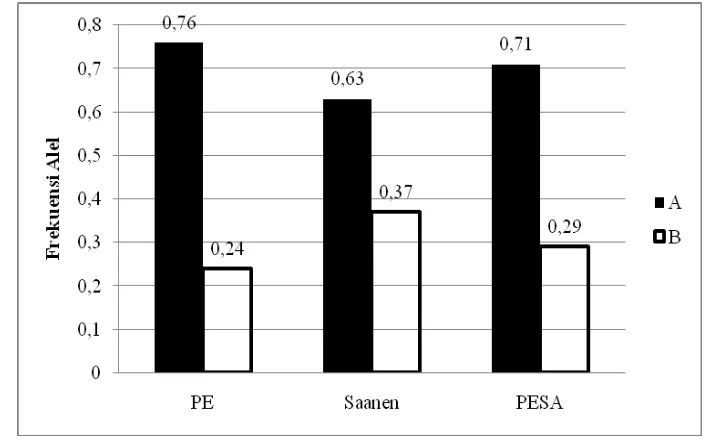
29 Gambar 16. Frekuensi Alel Gen GH Exon 2
Tabel 3 menunjukkan bahwa frekuensi alel A dan B pada gen GH exon 2 bersifat polimorfik sesuai dengan Nei (1987) yang mengatakan bahwa suatu alel
dikatakan polimorfik jika memiliki frekuensi alel sama dengan atau kurang dari 0,99.
Hasil analisis data tersebut memperlihatkan bahwa dari populasi kambing perah
bangsa PE, Saanen, dan PESA, ketiganya mempunyai frekuensi alel A yang lebih
tinggi dibandingkan dengan alel B. Hal tersebut disebabkan tidak ditemukannya
bangsa kambing yang bergenotipe BB. Kemungkinan tidak ditemukannya genotipe
BB di dalam populasi kambing ini karena terdapat keterbatasan pejantan yang
digunakan atau disebabkan oleh banyaknya pejantan bergenotipe BB yang dipotong
sehingga pejantan yang tersisa hanya bergenotipe AA.
Nilai Heterozigositas
Nilai heterozigositas merupakan cara yang paling tepat untuk mengukur
keragaman genetik suatu populasi (Nei, 1987). Hasil analisis nilai heterozigositas
30 Tabel 4. Nilai Heterozigositas Pengamatan dan Heterozigositas Harapan
Bangsa
Kambing Lokasi Total
Heterozigositas Heterozigositas
Pengamatan Harapan
PE
Ciapus 4 0,50 0,38
Cariu 10 0,60 0,42
Sukajaya 46 0,46 0,35
Subtotal 60 0,48 0,37
Saanen
Cijeruk 18 0,28 0,24
Cariu 29 1,00 0,50
Sukabumi 40 0,75 0,47
Subtotal 87 0,74 0,47
PESA Cariu 17 0,71 0,46
Balitnak 16 0,44 0,34
Subtotal 33 0,58 0,41
Total 180 0,62 0,43
Gambar 17. Nilai Heterozigositas Gen GH Exon 2 pada Kambing PE, Saanen, dan PESA
Hasil analisis nilai heterozigositas pengamatan (Ho) dan nilai heterozigositas
31 bangsa kambing yang diamati, khususnya pada bangsa kambing Saanen. Nilai
heterozigositas pengamatan (Ho) yang relatif lebih tinggi terdapat pada bangsa
kambing Saanen (0,74) dan yang terendah pada bangsa kambing PE(0,48). Menurut
Tambasco et al. (2003), perbedaan yang besar antara nilai heterozigositas pengamatan (Ho) dan nilai heterozigositas harapan (He) dapat dijadikan indikator
adanya ketidakseimbangan genotipe pada populasi yang diamati. Ketidakseimbangan
itu mengindikasikan bahwa belum ada kegiatan seleksi yang dilakukan secara
32
KESIMPULAN DAN SARAN Kesimpulan
Gen GH exon 2 pada populasi kambing PE, Saanen, dan persilangannya (PESA) bersifat polimorfik (beragam). Identifikasi keragaman gen GH exon 2 memperoleh dua macam genotipe, yaitu AB dan AA serta dua alel yaitu alel A dan
B. Nilai heterozigositas yang diperoleh menunjukkan bahwa heterozigositas
pengamatan berada pada kategori tinggi. Hal ini mencerminkan keragaman gen GH
kambing exon 2 tinggi.
Saran
Perlu dilakukan penelitian lanjutan untuk menentukan situs mutasi pada
setiap genotipe yang diperoleh serta untuk mengetahui keterkaitan antara genotipe
dengan sifat-sifat produksi susu.
33
UCAPAN TERIMA KASIH
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa yang telah
melimpahkan nikmat yang tak terhingga sehingga penulisan skripsi ini dapat
terselesaikan dengan baik. Penulis mengucapkan banyak terima kasih kepada:
1. Pembimbing skripsi Prof. Dr. Ir. Muladno MSA dan Dr. Jakaria S.Pt, M.Si yang
telah mengarahkan, membimbing dan membantu pelaksanaan penelitian hingga
tersusunnya skripsi ini.
2. Penguji seminar Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc atas segala masukan
yang diberikan dan segala saran serta dukungan selama penulis berada di
Laboratorium Pemuliaan dan Genetika Ternak, Fakultas Peternakan, Institut
Pertanian Bogor.
3. Penguji sidang Dr. Ir. Heri Ahmad Sukria, M.Sc dan Ir. Sri Darwati, M.Si yang
telah memberi banyak masukan untuk perbaikan skripsi.
4. Pembimbing akademik Ir. Salundik, M.Si atas segala arahan, bimbingan dan
motivasi yang diberikan.
5. Papa dan mama saya yang telah mencurahkan cinta dan kasih sayang, serta
senantiasa memberi motivasi, dukungan, dan doa yang tiada henti. Adik-adik
tersayang Imelda dan Ingrit yang selalu memberi warna dalam kehidupan
penulis.
6. Kak Eryk Andreas, kak Restu Misrianti, Kak Surya Nur, Pak Muhammad Ihsan
Andi Dagong, dan Pak Andi Baso Lompengeng Ishak atas segala bantuan dan
bimbingannya selama penulis melakukan penelitian di Laboratorium Pemuliaan
dan Genetika Ternak.
7. Paulina, Ferdy, Lenny, Priskila, Revy, Ica, Diny, Wike, Gabby, Tiffany, Gina,
Desy, Rahmah, Erwin yang bersama-sama penulis selama penelitian di
Laboratorium Pemuliaan dan Genetika Ternak.
8. Roceyana dan teman-teman IPTP 44 yang telah bersama saya selama 3 tahun,
terima kasih atas persahabatan yang diberikan selama kuliah.
9. Leo Mualim dan Rahman Adi Nugroho yang telah membantu dan memberikan
semangat kepada penulis sehingga skripsi ini berhasil diselesaikan.
10. Yunny K., Arianti T., Meditiari dan KMB IPB terima kasih atas dukungan dan
34
DAFTAR PUSTAKA
Agung, P. P. 2007. Identifikasi keragaman gen κ-kasein dan β-laktoglobulin pada domba lokal Indonesia. Skripsi. Fakultas Peternakan, Institut Pertanian Bogor, Bogor.
Akers, R. M. 2006. Major advances associated with hormone and growth factor regulation of mammary growth and lavtation in dairy cows. J. Dairy Sci. 89: 1222-1234.
Al-Soud, W. A. & P. Radstrom. 2001. Purification and characterization of PCR-inhibitory component in bloods cells. J. Clinical Microbiology. 39: 485-493.
Anderson, L. L. S. Jeftinija & C. G. Scanes. 2004. Growth Hormone secretion: molecular and cellular mechanisms and in vitro approaches. Exp. Biol. Med. 229: 291-302.
Atabany, A. 2001. Studi kasus produktivitas kambing Peranakan Etawah dan kambing Saanen pada peternakan kambing perah Barokah dan PT Taurus Dairy Farm. Tesis. Sekolah Pascasarjana, Institut Pertanian Bogor, Bogor.
Badan Standarisasi Nasional. 2008. SNI 7325: Bibit kambing peranakan ettawa (PE). http://www.agribisnis.deptan.go.id/../mutu..standarisasi/sni_7325
2008_bibit_kambing_pe.pdf [11 April 2011].
Balai Besar Pengkajian dan Pengembangan. 2008. Ternak Kambing. http://lampung.litbang.deptan.go.id/ind/images/stories/publikasi/kambing.pdf [2 Agustus 2010].
Balai Penelitian Ternak. 2001. Kambing PE penghasil daging sekaligus susu. Warta Penelitian dan Pengembangan Pertanian Vol. 23 No. 4. Ciawi, Bogor.
Baldi, A. 1999. Manipulation of milk production and quality by use of somatotropin in dairy ruminants other than cow. Domest. Anim. Endocrinol. 17: 131-137.
Barroso, A., S. Dunner & J. Canon. 1999. Technical note: use of PCR-single strand conformation polymorphism analysis for detection of bovine β-casein variants A1, A2, A3, and B. J. Anim. Sci. 77: 2629-2632.
Barta, C., Z. Ronai, M. Szekely- Sasvari & A. Guttman. 2001. Rapid single nucleotide polymorphism analysis by primer extension and capillary electrophoresis using polyvinyl pyrrolidone matrix. Electrophoresis 22: 779– 782.
Bastos, E., A. Cravador, J. Azevedo & H. G. Pinto. 2001. Single strand conformation polymorphism (SCCP) detection in six genes in Portuguese indigenous sheep breed “Churra da Terra Quente”. Biotechnol. Agron. Soc. Environ. 5 (1): 7 -15.