Lampiran 1.
Data pengamatan dan tabel analisis ragam total padatan terlarut (oBrix)
Perlakuan Ulangan Total Rataan
Lampiran 2.
Data pengamatan dan tabel analisis ragam kadar asam asetat (%)
Perlakuan Ulangan Total Rataan
Lampiran 3.
Data pengamatan dan tabel analisis ragam nilai pH
Perlakuan Ulangan Total Rataan
Lampiran 4.
Data pengamatan dan tabel analisis ragam total gula (%)
Perlakuan Ulangan Total Rataan
Lampiran 5.
Data pengamatan dan tabel analisis ragam uji organoleptik nilai skor warna
Perlakuan Ulangan Total Rataan
Lampiran 6.
Data pengamatan dan tabel analisis ragam uji organoleptik nilai hedonik warna
Perlakuan Ulangan Total Rataan
Lampiran 7.
Data pengamatan dan tabel analisis ragam uji organoleptik nilai hedonik aroma
Perlakuan Ulangan Total Rataan
Lampiran 8.
Data analisis bahan baku
Parameter Kulit Buah Kopi
Total padatan terlarut (°Brix) 4,000
Nilai pH 4,861
Total Gula (%) 4,447
Kurva standard uji total gula
y = 0,006x + 0,038 r = 0,993
0.00 0.05 0.10 0.15 0.20 0.25 0.30 0.35 0.40 0.45
0 10 20 30 40 50 60 70
N
il
ai
A
bsor
bans
i
Gambar Produk
Keterangan:
K1 = Konsentrasi gula 0%
L1 = Lama fermentasi 5 hari L3 = Lama fermentasi 15 hari L2 = Lama fermentasi 10 hari L2 = Lama fermentasi 10 hari
K1L3
K1L4
Keterangan:
K2 = Konsentrasi gula 5%
L1 = Lama fermentasi 5 hari L3 = Lama fermentasi 15 hari L2 = Lama fermentasi 10 hari L2 = Lama fermentasi 10 hari
K2L1
K2L2
K2L2
Keterangan:
K3 = Konsentrasi gula 10%
L1 = Lama fermentasi 5 hari L3 = Lama fermentasi 15 hari L2 = Lama fermentasi 10 hari L2 = Lama fermentasi 10 hari
K3L1
K3L2
Keterangan:
K4 = Konsentrasi gula 15%
L1 = Lama fermentasi 5 hari L3 = Lama fermentasi 15 hari L2 = Lama fermentasi 10 hari L2 = Lama fermentasi 10 hari
K
4L
1K
4L
2DAFTAR PUSTAKA
Aditiwati, P. dan Kusnadi. 2003. Kultur campuran dan faktor lingkungan mikroorganisme yang berperan dalam fermentasi “Tea-Cider”. PROC. ITB Sains & Tek. 35A (2) : 147-162.
Amerine, M. A. dan C. S. Ough. 1980. Method for Analysis of Must and Wines. John Willey & Sons Publishing, New York.
Apriyantono, A., Fardiaz D., Puspitasari N. L., Sedharnawati, dan Budiyanto S. 1989. Petunjuk Laboratorium Analisa Pangan. IPB-Press, Bogor.
Baharuddin, Syahidah, dan N. Yatni. 2008. Penentuan mutu cuka nira aren (Arenga pinnata) berdasarkan SNI 01-4371-1996. Jurnal Perennial. 5(1) : 31 -35.
Bangun, M. K. 1991. Rancangan Percobaan Bagian Biometri. Universitas Sumatera Utara, Medan.
BPSa. 2014. Luas tanaman perkebunan besar menurut jenis tanaman indonesia (000 Ha) 1995 - 2013*. http://www.bps.go.id. (28 Oktober 2014).
BPSb. 2014. Potensi kopi di Sumatera Utara.
http://regionalinvestment.bkpm.go.id. (28 Oktober 2014).
BPSc. 2014. Produksi Bulanan Perkebunan Besar Indonesia (000 Ton) 2013*.
http://bps.go.id. (28 Oktober 2014).
BPSd. 2015. Buletin Statistik Perdagangan Luar Negeri (Ekspor). BPS, Jakarta. BPSe. 2015. Buletin Statistik Perdagangan Luar Negeri (Impor). BPS, Jakarta. Brainly. 2014. Apa arti dari sortasi, penyiangan, efesiensi, pengepakan dan
feeding?.http://brainly.co.id.(10 Desember 2014).
Bressani, R., Elias L. G., dan Brenes G. R. A. 1972. Improvement of protein quality by amino acid . Journal Nutrition 97:1732-180.
Buckle, K. A., R. A. Edwards, G. H. Fleet dan M. Wotton. 2009. Ilmu Pangan. Terjemahan H. Purnomo dan Adiano.UI-Press, Jakarta.
Codex. 1987. Codex Standard For Vinegar. Regional European Standard CODEX STAN 162-1987.
Daulay, D. dan A. Rahman.1992. Teknologi Fermentasi Sayur-Sayuran dan Buah-Buahan. IPB-Press. Bogor.
Desrosier, N. W. 1970. The Technology of Food Preservation. The Avi Publishing
Ebookpangan. 2007. Pengemasan bahan pangan. http://tekpan.unimus.ac.id.(28 Oktober 2014).
Egan, Harold, Ronald S., Kirk dan Sawyer R. 1981. Pearsons Chemical Analysis of Food, Churchill.
Fardiaz, S. 1992. Mikrobiologi Pangan 1. Gedia Pustaka Utama, Jakarta. Fellow, P.J. 1992.Food Processing Technology.CRC Press. New York .
Frazier, W. C. 1967. Food Microbiology. Mc. Braw Hill Book Company, Inc, New York.
Gaur, K. 2006. Process Optimization for The Production of Ethanol via Fermentation. Dissertation (Master of Science). Department of Biotechnology and Env. Science. Thapar Institute of Engg and Technology. Patiala.
GTZ-PPP. 2002. Post harvest processing: Limit environmental damage by basic
knowledge of coffee wastewater. http://www.venden.de. (25 Oktober 2014).
Mutiarawati, T. 2009. Penanganan pasca panen hasil pertanian.
http://pustaka.unpad.ac.id. (25 November 2014).
Munthe, S. A. 2004. Pengaruh jumlah starter dan lama fermentasi terhadap mutu vinegar dari kulit pisang raja (Musa paradisiaca L).
Pandey, A., P. Nigam, C. R. Soccol, V. T. Soccol, D. Singh, dan R. Mohan. 2000. Advances in microbial amylases. Journal Biotechnol. Appl. Biochem. (2000) 31:135-152.
Pertiwi, M. F. D. dan W. H. Susanto. 2014. Pengaruh proporsi (buah:sukrosa) dan lama osmosis terhadap kualitas sari buah stroberi (Fragaria vesca L). Jurnal Pangan dan Agoindustri 2(2) : 82-90.
Rahman, A. 1988. Teknologi Fermentasi. Penerbit Arcan, Jakarta. Rahman, A. 1992. Produksi Metabolit Prime. Penerbit Arcan, Jakarta.
Raudah dan Ernawati. 2012. Pemanfaatan kulit kopi arabika dari proses pulping untuk pembuatan bioetanol. Journal of Science and Technology. 10(21) : 12-21.
Reed, G.dan T. W. Nagodawithana. 1991. Yeast Technology. Van Nostrand Reinhold Publisher, New York.
Salle, A. J. 1974. Fundamental principles of bacteriology. Tata Mc Gaw Hill, New Delhi.
Sardjono, E. A. Basrah, dan O. Sukardi. 1985. Penelitian dan Pengembangan Diversifikasi Produk dan Pengepakan Gula Merah Cetak. Bogor.
Simanjuntak, R. 2009. Studi Pembuatan Etanol dari Limbah Gula (Mollases). Journal of Science and Technology.
Siswati, N. D., M. Yatim dan R. Hidayanto. 2012. Bioetanol dari limbah kulit kopi dengan proses fermentasi. Skripsi. Jurusan Teknik Kimia, Fakultas Teknologi Industri, Universitas Pembangunan Nasional “Veteran”, Jawa Timur.
Soeharto, I. 1986. Kinetika Perpindahan Oksigen pada Fermentasi Asam Asetat dari Etanol.
Soekarto, S. T. 1985. Penilaian Organoleptik untuk Industri Pangan dan Hasil Pertanian. IPB-Press, Bogor.
Waluyo, S. 1984. Beberapa Aspek Tentang Pengolahan Vinegar. Dewa Ruci Press, Jakarta.
Widyotomo, S. 2013. Potensi dan teknologi diversivikasi limbah kopi menjadi produk bermutu dan bernilai tambah. Review Penelitian Kopi dan Kakao. 1(1) : 63-80.
Wignyanto, Suharjono, dan Novita. 2001. Pengaruh konsentrasi gula reduksi sari hati nanas dan inokulum Saccharomyces cerevisiae pada fermentasi etanol. Jurnal Teknologi Pertanian. 2(1) : 68-77.
Winarno. 1984. Biofermentasi dan Biosintesa Protein. Angkasa, Bandung. Wikipediaa. 2015. Asam asetat. http://id.wikipedia.org. (15 September 2015). Wikipediab. 2015. Asam klorogenat. http://id.wikipedia.org. (15 September 2015). Wikipediac. 2014. Sukrosa. http://id.wikipedia.org. (10 Desember 2014).
Wikipediad. 2014. Blender. http://id.wikipedia.org. (10 Desember 2014). Wikipediae. 2014. Pasteurisasi. http://id.wikipedia.org. (20 Oktober 2014).
BAHAN DAN METODA
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Maret sampai bulan April 2015 di Laboratorium Teknologi Pangan Progam Studi Ilmu dan Teknologi Pangan Fakultas Pertanian Universitas Sumatera Utara, Medan.
Bahan Penelitian
Bahan penelitian yang digunakan adalah kulit buah kopi Arabika (Coffea
arabica) yang sudah matang dengan warna merah dan masih dalam keadaan segar, ragi instan (Saccharomyces cereviceae), gula pasir, dan starter (biang cuka)
Acetobacter acetii yang diperoleh dari Yogyakarta. Kulit kopi Arabika (Coffea arabica) diperoleh dari petani kopi di daerah Tanjung Barus, Berastagi.
Reagensia
Bahan kimia yang digunakan dalam penelitian ini adalah NaOH 0,1 N, indikator phenolphtalein 1%, glukosa standar, fenol 5%, H2SO4, dan larutan buffer pH 4.
Alat Penelitian
Alat yang digunakan dalam penelitian ini adalah timbangan analitik,
handrefractometer, spektrofotometer, pH meter, blender, erlenmeyer, kain saring, botol kaca, gelas ukur, beaker glass, labu tera, vorteks, alat destilasi, piknometer, pipet tetes, pipet volume, oven, termometer, dan hot plate.
Metode Penelitian (Bangun, 1991)
Penelitian ini dilakukan dengan menggunakan rancangan acak lengkap (RAL), yang terdiri dari dua faktor, yaitu:
Faktor I : Konsentrasi Gula (K) K1 = 0%
K2 = 5% K3 = 10% K4 = 15% Faktor II : Lama Fermentasi (L)
L1 = 5 hari L2 = 10 hari L3 = 15 hari L4= 20 hari
Banyaknya kombinasi perlakuan atau Treatment Combination (Tc) adalah 4 x 4 = 16, maka jumlah ulangan (n) minimum adalah sebagai berikut:
Tc (n –1) ≥ 15 16 (n –1) ≥ 15 16 n – 16 ≥ 15 16 n ≥ 15 + 16 16 n ≥ 31
n ≥ 1,9375……… dibulatkan menjadi 2
Model Rancangan
Penelitian ini dilakukan dengan Rancangan Acak Lengkap (RAL) faktorial dengan model :
Ŷijk = µ + αi+ βj + (αβ)ij + εijk
Ŷijk : Hasil pengamatan dari faktor K pada taraf ke-i dan faktor L pada taraf ke-j dengan ulangan ke-k
µ : Efek nilai tengah
αi : Efek dari faktor K pada taraf ke-i
βj : Efek dari faktor L pada taraf ke-j
(αβ)ij : Efek interaksi faktor K pada taraf ke-i dan faktor L pada taraf ke-j
εijk : Efek galat dari faktor K pada taraf ke-i dan faktor L pada taraf ke-j dalam ulangan ke-k
Apabila diperoleh hasil yang berbeda nyata atau sangat nyata maka dilanjutkan dengan uji LSR (Least Significant Range).
Pelaksanaan Penelitian
Persiapan alat dan bahan
- Botol vinegar dan peralatan kaca lainnya
Botol tempat menyimpan vinegar dan peralatan kaca lainnya dicuci bersih kemudian dikeringkan dalam oven. Sebelum digunakan peralatan tersebut dibilas terlebih dahulu dengan larutan aquades yang telah didihkan.
- Kain saring
- Kulit kopi
Kulit kopi dibersihkan, kemudian diblender dengan perbandingan kulit kopi dan air 2:3 hingga halus. Bubur kulit kopi yang telah halus disaring menggunakan kain saring untuk mendapatkan sari kulit kopi. Sari kulit kopi yang diperoleh kemudian diendapkan selama 24 jam untuk memisahkan sari kulit kopi dengan endapannya. Pengendapan dilakukan dalam wadah yang tertutup untuk menghindari terjadinya kontaminasi. Sari kulit kopi yang telah dipisahkan dari endapannya kemudian dipasteurisasi pada suhu 70 oC selama 30 menit.
Pembuatan vinegar
Sari kulit kopi yang telah dipasteurisasi ditambahkan gula sesuai dengan perlakuan, yaitu: K1 = 0%, K2 = 5%, K3 = 10%, dan K4 = 15%. Selanjutnya diisi sebanyak 300 g ke dalam botol (wadah fermentasi) dan ditambahkan ragi instan
Saccharomyces cereviceae sebanyak 2%, lalu diaduk sampai homogen dan difermentasi secara anaerob selama 5 hari pada suhu kamar. Setelah 5 hari, ditambahkan starter (biang cuka) Acetobacter acetii sebanyak 5%, kemudian difermentasi secara aerob sesuai dengan perlakuan yaitu: L1 = 5 hari, L2 = 10 hari, L3 = 15 hari, dan L4 = 20 hari.
Pengamatan dan Pengukuran Data
Total padatan terlarut
Total padatan terlarut ditentukan dengan metode Muchtadi dan Sugiono (1989). Hand refractometer terlebih dahulu distandarisasi dengan menggunakan akuades. Sampel kemudian diteteskan pada prisma hand refractometer. Kadar total padatan terlarut merupakan nilai yang diperoleh pada hand refractometer dan dinyatakan dalam oBrix.
Kadar asam asetat
Kadar asam asetat dianalisis menggunakan metode Amerine (1980). Penetapan kadar asam asetat dimulai dengan mendestilasi sampel sebanyak 150 ml menggunakan uap panas. Sebanyak 50 ml destilat ditampung dan dititrasi dengan NaOH 0,1 N dengan menggunakan indikator phenolpthtalein. Kadar asam asetat dihitung dengan persamaan berikut:
Volume NaOH (ml) x N NaOH x BM Asam asetat
Asam asetat (%) = x 100% Volume bahan (ml)
Nilai pH
Penentuan nilai pH sampel dilakukan dengan metode Apriyantono, dkk
Total gula
Penentuan total gula dilakukan dengan metode Apriyantono, dkk (1989). - Pembuatan kurva standar
Diambil 10 mg glukosa standar, dimasukkan ke dalam labu tera 100 ml, dibuat larutan. Larutan glukosa standar dengan konsentrasi 0,01, 0,02, 0,03, 0,04, 0,05, dan 0,06. Dengan mekanisme:
0,01 = 1 ml larutan glukosa standar + 9 ml aquades 0,02 = 2 ml larutan glukosa standar + 8 ml aquades 0,03 = 3 ml larutan glukosa standar + 7 ml aquades 0,04 = 4 ml larutan glukosa standar + 6 ml aquades 0,05 = 5 ml larutan glukosa standar + 5 ml aquades 0,06 = 6 ml larutan glukosa standar + 4 ml aquades
Diambil masing-masing 1 ml untuk ditambahkan 0,5 ml fenol 5% lalu divorteks kemudian ditambahkan H2SO4 2,5 ml dan divorteks. Ditunggu 10 menit sebelum diuji di spektrofotometer dengan panjang gelombang 490 nm. Setelah didapat keenam nilai adsorbansinya dibuat kurva standar seperti pada lampiran 8.
- Pengujian sampel
divorteks. Didiamkan 10 menit. Diukur absorbansinya di spektofotometer pada panjang gelombang 490 nm. Kadar gula total dihitung dengan rumus:
Konsentrasi gula x Faktor pengencer x 0,01 Total gula (%) =
Berat bahan (mg)
Organoleptik warna
Uji organoleptik warna ditentukan dengan metode Soekarto (1985). Organoleptik terhadap warna ditentukan dengan uji skor warna dan hedonik warna. Caranya contoh yang telah diberi kode diuji secara acak oleh 15 panelis. Pengujian dilakukan secara inderawi (organoleptik) yang ditentukan berdasarkan skala numerik. Untuk skala skor warna adalah seperti Tabel 3 dan nilai hedonik warna seperti pada Tabel 4.
Tabel 3. Skala skor warna (numerik)
Skala skorwarna Skala numerik
Tabel 4. Skala hedonik warna (numerik)
Skala hedonik Skala numerik
Pengujian dilakukan secara inderawi (organoleptik) yang ditentukan berdasarkan skala numerik. Untuk skala hedonik seperti pada Tabel 5.
Tabel 5. Skala hedonik aroma
Skala hedonik Skala numerik
Sangat suka Suka Agak suka Tidak suka Sangat tidak suka
Gambar 2. Skema pembuatan vinegar kulit kopi
Kulit Kopi
Dicuci bersih dari kotoran
Disaring
Difermentasi secara anaerob selama 5 hari pada suhu ruang
Difermentasi secara aerob
Dipasteurisasi dengan suhu 70 oC selama 30 menit
Dikemas dalam wadah kaca Diblender sampai halus dengan perbandingan kulit kopi dan air 2:3
Diendapkan selama 24 jam
HASIL DAN PEMBAHASAN
Analisis Bahan Baku
Analisis bahan baku dilakukan untuk dapat mengetahui perubahan yang terjadi pada bahan baku selama proses pembuatan produk. Hasil analisis bahan baku terhadap sari kulit buah kopi adalah total padatan terlarut sebesar 4,000 o
Brix, nilai pH sebesar 4,861, dan total gula sari kulit kopi sebesar 4,447%, seperti pada Tabel 6.
Tabel 6. Data analisis bahan baku
Parameter Kulit Buah Kopi
Total padatan terlarut (°Brix) 4,000
Nilai pH 4,861
Total Gula (%) 4,447
Pengaruh Konsentrasi Gula terhadap Parameter yang Diamati
Hasil penelitian memperlihatkan bahwa konsentrasi gula memberikan pengaruh terhadap total padatan terlarut (oBrix), kadar asam asetat (%), nilai pH, total gula (%), nilai skor warna dan nilai hedonik warna vinegar kulit buah kopi seperti pada Tabel 7.
Tabel 7. Pengaruh konsentrasi gula terhadap mutu vinegar
Parameter Konsentrasi Gula Nilai hedonik warna (numerik) 4,267 4,142 2,592 1,667 Nilai hedonik aroma (numerik) 3,267 3,183 3,058 3,125
Tabel 7 memperlihatkan total padatan terlarut tertinggi pada perlakuan K4 sebesar 5,200 ˚Brix dan terendah pada perlakuan K1 sebesar 2,425 ˚Brix. Kadar asam asetat tertinggi diperoleh pada perlakuan K2 sebesar 19,300% dan terendah diperoleh pada perlakuan K4 sebesar 1,300%. Nilai pH tertinggi diperoleh pada perlakuan K4 sebesar 4,346 dan terendah diperoleh pada perlakuan K2 sebesar 3,810. Total gula tertinggi diperoleh pada perlakuan K4 sebesar 8,092% dan terendah diperoleh pada perlakuan K1 sebesar 4,137%.
Uji skor warna tertinggi diperoleh pada perlakuan K1 sebesar 3,767 dan terendah diperoleh pada perlakuan K4 sebesar 2,042. Uji hedonik warna tertinggi diperoleh pada perlakuan K1 sebesar 4,267 dan terendah diperoleh pada perlakuan K4 sebesar 1,667. Uji hedonik aroma tertinggi diperoleh pada perlakuan K1 sebesar 3,267 dan terendah diperoleh pada perlakuan K3 sebesar 3,058.
Pengaruh Lama Fermentasi terhadap Parameter yang Diamati
Hasil penelitian memperlihatkan bahwa lama fermentasi memberikan pengaruh terhadap total padatan terlarut (oBrix), kadar asam asetat (%), nilai pH, total gula (%), nilai skor warna, nilai hedonik warna dan aroma vinegar kulit buah kopi seperti pada Tabel 8.
Tabel 8. Pengaruh lama fermentasi terhadap mutu vinegar
Parameter Lama fermentasi (L)
L1 L2 L3 L4
Total padatan terlarut (oBrix) 4,375 4,163 3,900 3,725 Kadar asam asetat (%) 7,450 12,800 13,600 11,700
Nilai pH 4,141 4,014 4,013 4,056
Total gula (%) 8,061 6,872 6,120 4,517
Tabel 8 memperlihatkan bahwa total padatan terlarut tertinggi pada perlakuan L1 sebesar 4,375 ˚Brix dan terendah pada perlakuan L4 sebesar 3,725 ˚Brix. Kadar asam asetat tertinggi diperoleh pada perlakuan L3 sebesar 13,600% dan terendah diperoleh pada perlakuan L1 sebesar 7,450%. Nilai pH tertinggi diperoleh pada perlakuan L1 sebesar 4,141 dan terendah diperoleh pada perlakuan L3 sebesar 4,013. Total gula tertinggi diperoleh pada perlakuan L1 sebesar 8,061% dan terendah diperoleh pada perlakuan L4 sebesar 4,517%.
Uji skor warna tertinggi diperoleh pada perlakuan L4 sebesar 3,792 dan terendah diperoleh pada perlakuan L1 sebesar 2,242. Uji hedonik warna tertinggi diperoleh pada perlakuan L4 sebesar 3,517 dan terendah diperoleh pada perlakuan L1 sebesar 2,725. Uji hedonik aroma tertinggi diperoleh pada perlakuan L1 sebesar 3,542 dan terendah diperoleh pada perlakuan L4 sebesar 2,642.
Total Padatan Terlarut
Pengaruh konsentrasi gula terhadap total padatan terlarut vinegar
Daftar sidik ragam (Lampiran 1) memperlihatkan bahwa konsentrasi gula memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap total padatan terlarut vinegar yang dihasilkan. Hasil uji LSR pengaruh konsentrasi gula terhadap total padatan terlarut vinegar dapat dilihat pada Tabel 9.
Tabel 9. Uji LSR efek utama pengaruh konsentrasi gula terhadap total padatan terlarut vinegar
Jarak LSR Konsentrasi Rataan Notasi
0,05 0,01 Gula 0,05 0,01
- - - K1= 0% 2,425 c C
2 0,287 0,396 K2= 5% 3,600 b B
3 0,302 0,416 K3= 10% 4,938 a A
4 0,309 0,426 K4= 15% 5,200 a A
Total padatan terlarut vinegar tertinggi diperoleh pada perlakuan K4 (15%) yaitu sebesar 5,200 oBrix dan terendah pada perlakuan K1 (0%) yaitu sebesar 2,425 oBrix. Hubungan konsentrasi gula dengan total padatan terlarut vinegar
dapat dilihat pada Gambar 3.
Gambar 3. Hubungan konsentrasi gula dengan total padatan terlarut vinegar
Tabel 9 dan Gambar 3 memperlihatkan bahwa semakin tinggi konsentrasi gula yang ditambahkan maka semakin tinggi total padatan terlarut vinegar yang dihasilkan. Total padatan terlarut yang meningkat dipengaruhi oleh banyaknya gula yang terdapat dalam bahan, gula yang terlarut memiliki nilai padatan terlarut yang tinggi sehingga semakin tinggi konsentrasi gula yang ditambahkan maka nilai total padatan terlarut vinegar yang dihasilkan akan semakin tinggi (Pertiwi dan Susanto, 2014).
Selain padatan terlarut vinegar dari kulit kopi yang dihasilkan juga menghasilkan padatan tidak larut (endapan) yang cukup banyak pada produk akhir
vinegar. Endapan yang terdapat dalam vinegar tersebut disebabkan oleh kandungan protein yang cukup tinggi pada kulit kopi. Hal ini sesuai dengan pernyataan Sudarmadji (1989) yang menyatakan bahwa protein merupakan
molekul yang sangat besar sehingga mudah mengalami perubahan bentuk secara fisik maupun secara biologis. Perubahan sifat alamiah protein dapat disebabkan oleh beberapa faktor seperti panas, asam, basa, pelarut organik, pH, garam, logam berat, maupun sinar radiasi radioaktif. Perubahan sifat fisik yang mudah diamati adalah terjadinya penjendalan (menjadi tidak larut) atau pemadatan.
Pengaruh lama fermentasi terhadap total padatan terlarut vinegar
Daftar sidik ragam (Lampiran 1) memperlihatkan bahwa lama fermentasi memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap total padatan terlarut vinegar yang dihasilkan. Hasil uji LSR pengaruh lama fermentasi terhadap total padatan terlarut vinegar dapat dilihat pada Tabel 10.
Tabel 10. Uji LSR efek utama pengaruh lama fermentasi terhadap total padatan terlarut vinegar
Jarak LSR Lama Rataan Notasi
0,05 0,01 Fermentasi 0,05 0,01
- - - L1= 5 hari 4,375 a A
2 0,287 0,396 L2= 10 hari 4,163 b B
3 0,302 0,416 L3= 15 hari 3,900 b B
4 0,309 0,426 L4= 20 hari 3,725 c C
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar) menurut uji LSR
Gambar 4. Hubungan lama fermentasi dengan total padatan terlarut vinegar
Tabel 10 dan Gambar 4 memperlihatkan bahwa semakin lama waktu fermentasi maka total padatan terlarut vinegar akan semakin menurun. Hal ini sesuai dengan pernyataan Reed dan Nagodawithana (1991) yang menyatakan bahwa terjadi penurunan total padatan terlarut selama berlangsungnya proses fermentasi khamir dan bakteri. Penurunan total padatan terlarut tersebut disebabkan oleh gula yang merupakan komponen padatan terlarut dominan dirombak oleh mikroba menjadi senyawa-senyawa organik seperti alkohol dan asam asetat (Zubaidah, 2010).
Pengaruh interaksi antara konsentrasi gula dengan lama fermentasi terhadap total padatan terlarut vinegar
Kadar Asam Asetat
Pengaruh konsentrasi gula terhadap kadar asam asetat vinegar
Daftar sidik ragam (Lampiran 2) memperlihatkan bahwa konsentrasi gula memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap kadar asam asetat
vinegar yang dihasilkan. Hasil uji LSR pengaruh konsentrasi gula terhadap kadar asam asetat vinegar dapat dilihat pada Tabel 11.
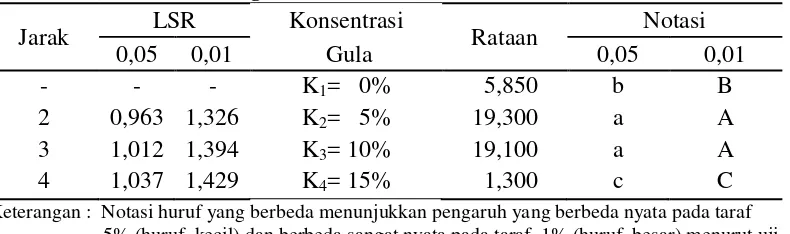
Tabel 11. Uji LSR efek utama pengaruh konsentrasi gula terhadap kadar asam asetat vinegar
Jarak LSR Konsentrasi Rataan Notasi
0,05 0,01 Gula 0,05 0,01
- - - K1= 0% 5,850 b B
2 0,963 1,326 K2= 5% 19,300 a A
3 1,012 1,394 K3= 10% 19,100 a A
4 1,037 1,429 K4= 15% 1,300 c C
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar) menurut uji LSR
Gambar 5. Hubungan konsentrasi gula dengan kadar asam asetat vinegar
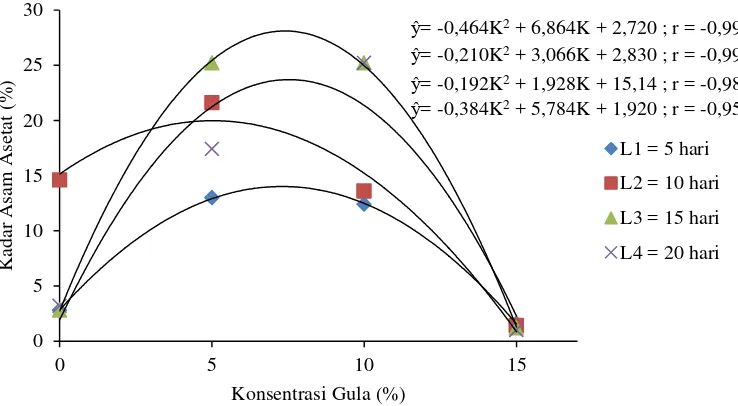
Tabel 11 dan Gambar 5 memperlihatkan bahwa kadar asam asetat semakin meningkat pada konsentrasi gula 0% (K1) sampai konsentrasi gula 5% (K2), kadar asam asetat sedikit menurun pada konsentrasi gula 10% (K3), dan kadar asam asetat menurun drastis pada konsentrasi gula 15% (K4). Pembentukan asam asetat sangat dipengaruhi oleh konsentrasi gula awal. Penambahan gula 5% menghasilkan kadar asam asetat yang sedikit lebih tinggi dibandingkan dengan penambahan gula 10% dan jauh lebih tinggi dibandingkan dengan tanpa penambahan gula dan penambahan gula sebesar 15%. Hal ini disebabkan karena mikroorganisme menghasilkan enzim yang sebanding dengan jumlah substrat (gula), sehingga semakin tinggi jumlah gula yang ditambahkan maka akan semakin tinggi asam asetat yang terbentuk (Aditiwati dan Kusnadi, 2003), tetapi penambahan gula 15% menyebabkan konsentrasi substrat yang berlebih sehingga menyebabkan terhambatnya proses pembentukan asam asetat. Hal ini sesuai dengan pernyataan Gaur (2006) yaitu semakin tinggi konsentrasi substrat maka
akan meningkatkan tekanan osmotik yang dapat mengganggu metabolisme sel mikroba dan efisiensi proses fermentasi.
Pengaruh lama fermentasi terhadap kadar asam asetat vinegar
Daftar sidik ragam (Lampiran 2) memperlihatkan bahwa lama fermentasi memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap kadar asam asetat
vinegar yang dihasilkan. Hasil uji LSR pengaruh lama fermentasi terhadap kadar asam asetat vinegar dapat dilihat pada Tabel 12.
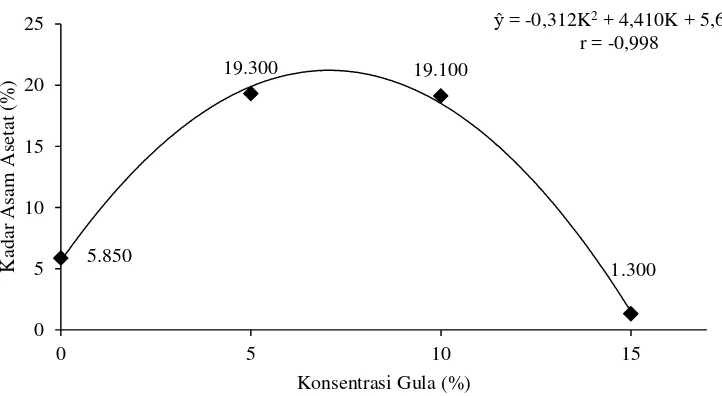
Tabel 12. Uji LSR efek utama pengaruh lama fermentasi terhadap kadar asam asetat vinegar
Jarak LSR Lama Rataan Notasi
0,05 0,01 Fermentasi 0,05 0,01
- - - L1= 5 hari 7,450 c C
2 0,963 1,326 L2= 10 hari 12,800 a A
3 1,012 1,394 L3= 15 hari 13,600 a A
4 1,037 1,429 L4= 20 hari 11,700 b B
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar) menurut uji LSR
Gambar 6. Hubungan lama fermentasi dengan kadar asam asetat vinegar
Tabel 12 dan Gambar 6 memperlihatkan bahwa produksi kadar asam asetat semakin meningkat dari fermentasi hari ke 5 (L1) sampai fermentasi hari ke 15 (L3) dan produksi asam asetat menurun pada fermentasi hari ke 20 (L4). Soeharto (1986) menyatakan bahwa lama fermentasi mempengaruhi kadar asam asetat yang dihasilkan. Waktu fermentasi yang terlalu singkat akan menghasilkan produk yang jumlahnya sedikit karena substrat tidak seluruhnya terdegadasi sedangkan waktu fermentasi yang terlalu lama akan menyebabkan asam asetat teroksidasi menjadi karbondioksida dan air.
Pengaruh interaksi antara konsentrasi gula dengan lama fermentasi terhadap kadar asam asetat vinegar
Daftar sidik ragam (Lampiran 2) memperlihatkan bahwa interaksi antara konsentrasi gula dan lama fermentasi memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap kadar asam asetat vinegar yang dihasilkan. Hasil uji LSR pengaruh interaksi antara konsentrasi gula dan lama fermentasi terhadap kadar asam asetat vinegar dapat dilihat pada Tabel 13.
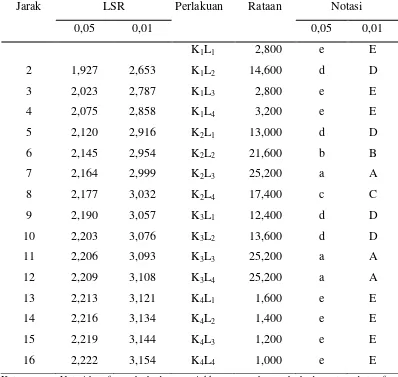
Tabel 13. Uji LSR efek utama pengaruh interaksi antara konsentrasi gula dengan lama fermentasi terhadap kadar asam asetat vinegar
Jarak LSR Perlakuan Rataan Notasi
Gambar 7. Hubungan interaksi antara konsentrasi gula dan lama fermentasi dengan kadar asam asetat vinegar
Nilai pH
Pengaruh konsentrasi gula terhadap nilai pH vinegar
Daftar sidik ragam (Lampiran 3) memperlihatkan bahwa konsentrasi gula memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap nilai pH vinegar
yang dihasilkan. Hasil uji LSR pengaruh konsentrasi gula terhadap nilai pH
vinegar dapat dilihat pada Tabel 14.
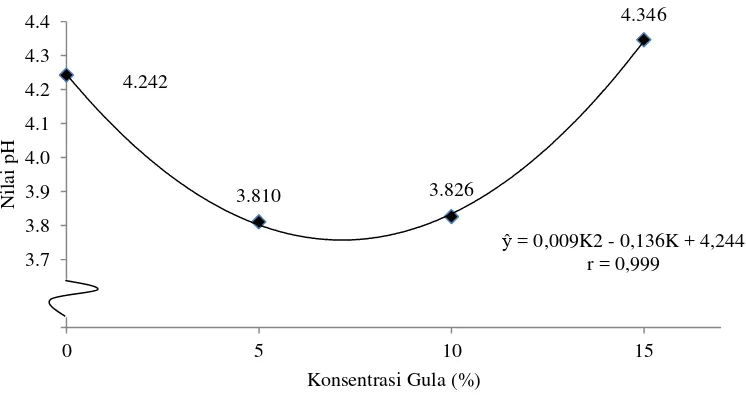
Tabel 14. Uji LSR efek utama pengaruh konsentrasi gula terhadap nilai pH
vinegar
Jarak LSR Konsentrasi Rataan Notasi
0,05 0,01 Gula 0,05 0,01
- - - K1= 0% 4,242 a A
2 0,260 0,358 K2= 5% 3,810 b B
3 0,273 0,376 K3= 10% 3,826 b B
4 0,280 0,386 K4= 15% 4,346 a A
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar) menurut uji LSR
cenderung menunjukkan nilai pH yang tinggi, sedangkan total asam tinggi cenderung menunjukkan nilai pH yang rendah. Hubungan konsentrasi gula dengan nilai pH vinegar dapat dilihat pada Gambar 8.
Gambar 8. Hubungan konsentrasi gula dengan nilai pH vinegar
Pengaruh lama fermentasi terhadap nilai pH vinegar
Daftar sidik ragam (Lampiran 3) memperlihatkan bahwa lama fermentasi memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap nilai pH vinegar
yang dihasilkan, sehingga uji LSR tidak dilanjutkan.
Pengaruh interaksi antara konsentrasi gula dengan lama fermentasi terhadap nilai pH vinegar
Total gula
Pengaruh konsentrasi gula terhadap total gula vinegar
Daftar sidik ragam (Lampiran 4) memperlihatkan bahwa konsentrasi gula memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap total gula vinegar
yang dihasilkan. Hasil uji LSR pengaruh konsentrasi gula terhadap total gula
vinegar dapat dilihat pada Tabel 15.
Tabel 15. Uji LSR efek utama pengaruh konsentrasi gula terhadap total gula
vinegar
Jarak LSR Konsentrasi Rataan Notasi
0,05 0,01 gula (%) 0,05 0,01
- - - K1= 0% 4,137 c C
2 0,544 0,749 K2= 5% 5,737 b B
3 0,571 0,787 K3= 10% 7,604 a A
4 0,586 0,807 K4= 15% 8,092 a A
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar) menurut uji LSR
Gambar 9. Hubungan konsentrasi gula dengan total gula vinegar
Tabel 15 dan Gambar 9 memperlihatkan bahwa semakin tinggi konsentrasi gula maka nilai total gula produk juga semakin tinggi. Hal ini disebabkan karena proses fermentasi tidak merombak seluruh gula yang terdapat dalam produk sehingga produk masih mengandung gula yang tidak dirombak selama proses fermentasi atau disebut dengan istilah residu gula. Semakin tinggi konsentrasi gula awal yang ditambahkan maka residu gula yang diperoleh pada akhir proses fermentasi juga semakin tinggi. Hal ini sesuai dengan pernyataan Wignyanto, dkk (2001) yang menyatakan bahwa banyaknya residu gula yang dihasilkan pada akhir proses fermentasi tergantung pada konsentrasi gula awal yang ditambahkan.
Pengaruh lama fermentasi terhadap total gula vinegar
Daftar sidik ragam (Lampiran 4) memperlihatkan bahwa lama fermentasi memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap total gula vinegar
yang dihasilkan. Hasil uji LSR pengaruh lama fermentasi terhadap total gula
vinegar dapat dilihat pada Tabel 16.
Tabel 16. Uji LSR efek utama pengaruh lama fermentasi terhadap total gula
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar) menurut uji LSR
Total gula vinegar tertinggi diperoleh pada perlakuan L1 yaitu sebesar 8,061% dan terendah pada perlakuan L4 yaitu sebesar 4,517%. Hubungan lama fermentasi dengan total gula vinegar dapat dilihat pada Gambar 10.
Gambar 10. Hubungan lama fermentasi dengan total gula vinegar
Pengaruh interaksi antara konsentrasi gula dengan lama fermentasi terhadap total gula vinegar
Daftar sidik ragam (Lampiran 4) memperlihatkan bahwa interaksi antara konsentrasi gula dan lama fermentasi memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap total gula vinegar yang dihasilkan. Hasil uji LSR pengaruh interaksi antara konsentrasi gula dan lama fermentasi terhadap total gula vinegar
dapat dilihat pada Tabel 17.
Tabel 17. Uji LSR efek utama pengaruh interaksi antara konsentrasi gula dengan lama fermentasi terhadap total gula vinegar
Jarak LSR Perlakuan Rataan Notasi
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar)
K1 = 0%; K2 = 5%; K3 = 10%; K4 = 15%
Total gula vinegar tertinggi merupakan perlakuan K4L1 yaitu sebesar 10,635% dan terendah merupakan perlakuan K1L2 sebesar 3,647%. Hubungan interaksi antara konsentrasi gula dan lama fermentasi dengan total gula vinegar
dapat dilihat pada Gambar 11.
Gambar 11. Hubungan interaksi antara konsentrasi gula dan lama fermentasi dengan total gula vinegar
Tabel 17 dan Gambar 11 memperlihatkan bahwa semakin tinggi konsentrasi gula yang ditambahkan maka semakin tinggi nilai total gula vinegar
(Wignyanto, dkk, 2001). Semakin tinggi konsentrasi gula awal yang ditambahkan dalam pembuatan vinegar maka residu gula yang diperoleh pada akhir proses fermentasi juga semakin tinggi.
Nilai Skor Warna
Pengaruh konsentrasi gula terhadap nilai skor warna vinegar
Daftar sidik ragam (Lampiran 5) memperlihatkan bahwa konsentrasi gula memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap nilai skor warna
vinegar yang dihasilkan. Hasil uji LSR pengaruh konsentrasi gula terhadap nilai skor warna vinegar dapat dilihat pada Tabel 18.
Tabel 18. Uji LSR efek utama pengaruh konsentrasi gula terhadap nilai skor warna vinegar
Jarak LSR Konsentrasi Rataan Notasi
0,05 0,01 gula 0,05 0,01
- - - K1= 0% 3,767 a A
2 0,230 0,317 K2= 5% 3,658 b B
3 0,242 0,333 K3= 10% 2,950 c C
4 0,248 0,341 K4= 15% 2,042 d D
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar) menurut uji LSR
Gambar 12. Hubungan konsentrasi gula dengan nilai skor warna vinegar
Kulit kopi yang digunakan mengalami pencoklatan selama proses pembuatan sari kulit kopi. Pencoklatan tersebut disebabkan oleh terjadinya reaksi pencoklatan enzimatis akibat adanya aktivitas enzim polifenol oksidase. Kopi mengandung asam klorogenat yang tinggi dan oksidasi asam klorogenat yang diikuti oleh polimerisasi (gabungan dari monomer-monomer) menyebabkan pembentukan quinon yang menyebabkan warna coklat. Reaksi tersebut tergantung pada enzim polifenol oksidase dengan kofaktor tembaga dan O2 sebagai donor electron (Wikipediab, 2015).
Tabel 18 dan Gambar 12 memperlihatkan bahwa semakin tinggi konsentrasi gula yang ditambahkan maka akan semakin rendah nilai skor warna
vinegar yang dihasilkan. Hal ini menunjukkan bahwa konsentrasi gula mempengaruhi warna dari produk yang dihasilkan. Semakin banyak gula yang ditambahkan pada produk maka warna coklat pada produk yang dihasilkan akan semakin gelap. Hal ini sesuai dengan pernyataan Sardjono, dkk (1985) yang menyatakan bahwa kadar gula pereduksi mempengaruhi warna produk yang
dihasilkan, semakin rendah kadar gula pereduksi pada bahan akan menyebabkan warna produk menjadi lebih terang dan semakin tinggi kadar gula pereduksi yang terdapat dalam bahan akan menyebabkan warna produk yang dihasilkan menjadi semakin gelap.
Pengaruh lama fermentasi terhadap nilai skor warna vinegar
Daftar sidik ragam (Lampiran 5) memperlihatkan bahwa lama fermentasi memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap nilai skor warna
vinegar yang dihasilkan. Hasil uji LSR pengaruh lama fermentasi terhadap nilai skor warna vinegar dapat dilihat pada Tabel 19.
Tabel 19. Uji LSR efek utama pengaruh lama fermentasi terhadap nilai skor warna vinegar
Jarak LSR Lama Fermentasi Rataan Notasi
0,05 0,01 0,05 0,01
- - - L1= 5 hari 2,242 d D
2 0,230 0,317 L2= 10 hari 2,867 c C
3 0,242 0,333 L3= 15 hari 3,517 b B
4 0,248 0,341 L4= 20 hari 3,792 a A
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar) menurut uji LSR
Nilai skor warna vinegar tertinggi diperoleh pada perlakuan L4 yaitu sebesar 3,792 dan terendah pada perlakuan L1 yaitu sebesar 2,242. Hubungan lama fermentasi dengan nilai skor warna vinegar dapat
Gambar 12. Hubungan lama fermentasi dengan nilai skor warna vinegar
Tabel 19 dan Gambar 12 memperlihatkan bahwa semakin lama waktu fermentasi maka semakin tinggi nilai skor warna vinegar yang dihasilkan. Semakin lama waktu fermentasi warna coklat gelap dari vinegar yang dihasilkan semakin berkurang. Hal ini disebabkan oleh gula, yang merupakan komponen yang berperan dalam memberikan warna coklat pada produk selain bahan baku, dirombak menjadi senyawa-senyawa organik selama proses fermentasi berlangsung. Semakin lama proses fermentasi berlangsung maka jumlah gula yang dirombak akan semakin banyak (Hidayat, dkk, 2006), sehingga warna coklat gelap yang dihasilkan pada produk akan semakin berkurang.
Pengaruh interaksi antara konsentrasi gula dengan lama fermentasi terhadap nilai skor warna vinegar
Daftar sidik ragam (Lampiran 5) memperlihatkan bahwa interaksi antara konsentrasi gula dan lama fermentasi memberikan pengaruh berbeda nyata (P<0,05) terhadap nilai skor warna vinegar yang dihasilkan. Hasil uji LSR pengaruh interaksi antara konsentrasi gula dan lama fermentasi terhadap nilai skor warna vinegar dapat dilihat pada Tabel 20.
Tabel 20. Uji LSR efek utama pengaruh interaksi antara konsentrasi gula dengan lama fermentasi terhadap nilai skor warna vinegar
Jarak
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar)
K1 = 0%; K2 = 5%; K3 = 10%; K4 = 15%
L1 = 5 hari; L2 = 10 hari; L3 = 15 hari; L4 = 20 hari
Nilai skor warna vinegar tertinggi merupakan perlakuan K1L4 yaitu sebesar 4,500 dan terendah merupakan perlakuan K4L1 sebesar 1,233. Hubungan interaksi antara konsentrasi gula dan lama fermentasi dengan nilai skor warna
Gambar 13. Hubungan interaksi antara konsentrasi gula dan lama fermentasi dengan nilai skor warna vinegar
Nilai Hedonik Warna
Pengaruh konsentrasi gula terhadap nilai hedonik warna vinegar
Daftar sidik ragam (Lampiran 6) memperlihatkan bahwa konsentrasi gula memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap nilai hedonik warna vinegar yang dihasilkan. Hasil uji LSR pengaruh konsentrasi gula terhadap nilai hedonik warna vinegar dapat dilihat pada Tabel 21.
Tabel 21. Uji LSR efek utama pengaruh konsentrasi gula terhadap nilai hedonik warna vinegar
Jarak LSR Konsentrasi Gula Rataan Notasi
0,05 0,01 0,05 0,01
- - - K1= 0% 4,267 a A
2 0,268 0,369 K2= 5% 4,142 b B
3 0,281 0,387 K3= 10% 2,592 c C
4 0,288 0,397 K4= 15% 1,667 d D
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar) menurut uji LSR
Nilai hedonik warna vinegar tertinggi diperoleh pada perlakuan K1 (0%) yaitu sebesar 4,267 dan nilai hedonik warna terendah pada perlakuan K4 (15%) yaitu sebesar 1,667. Hubungan konsentrasi gula dengan nilai hedonik warna
Gambar 14. Hubungan konsentrasi gula dengan nilai hedonik warna vinegar
Tabel 21 dan Gambar 14 memperlihatkan bahwa semakin tinggi konsentrasi gula yang ditambahkan maka semakin rendah nilai hedonik warna
vinegar yang dihasilkan. Sardjono, dkk (1985) menyatakan bahwa kadar gula pereduksi mempengaruhi warna produk yang dihasilkan, semakin tinggi kadar gula pereduksi yang terdapat dalam bahan akan menyebabkan warna produk yang dihasilkan menjadi semakin gelap dan menyebabkan warna produk menjadi kurang disukai.
Pengaruh lama fermentasi terhadap nilai hedonik warna vinegar
Daftar sidik ragam (Lampiran 6) memperlihatkan bahwa lama fermentasi memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap nilai hedonik warna vinegar yang dihasilkan. Hasil uji LSR pengaruh lama fermentasi terhadap nilai hedonik warna vinegar dapat dilihat pada Tabel 22.
Tabel 22. Uji LSR efek utama pengaruh lama fermentasi terhadap nilai hedonik warna vinegar
Jarak LSR Lama Fermentasi Rataan Notasi
0,05 0,01 0,05 0,01
- - - L1= 5 hari 2,725 c C
2 0,268 0,369 L2= 10 hari 3,083 b B
3 0,281 0,387 L3= 15 hari 3,342 a A
4 0,288 0,397 L4= 20 hari 3,517 a A
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar) menurut uji LSR
Nilai hedonik warna vinegar tertinggi diperoleh pada perlakuan L4 yaitu sebesar 3,517 dan nilai hedonik warna terendah adalah pada perlakuan L1 yaitu sebesar 2,725. Hubungan lama fermentasi dengan nilai hedonik warna vinegar
dapat dilihat pada Gambar 15.
Gambar 15. Hubungan lama fermentasi dengan nilai hedonik warna vinegar
Tabel 22 dan Gambar 15 memperlihatkan bahwa semakin lama waktu fermentasi maka semakin tinggi nilai hedonik warna vinegar yang dihasilkan. Nilai hedonik warna yang semakin tinggi menunjukkan bahwa semakin lama proses fermentasi berlangsung maka warna vinegar yang dihasilkan akan semakin
disukai. Hal ini disebabkan karena proses fermentasi menggunakan gula sebagai substrat yang akan diubah menjadi senyawa-senyawa organik sehingga konsentrasi gula akan berkurang selama proses fermentasi berlangsung, semakin lama proses fermentasi berlangsung maka jumlah gula yang dirombak akan semakin banyak (Hidayat, dkk, 2006)
.
Berkurangnya konsentrasi gula pada produk menyebabkan warna gelap pada produk juga semakin berkurang dan warna produk yang dihasilkan akan semakin disukai.Pengaruh interaksi antara konsentrasi gula dengan lama fermentasi terhadap nilai hedonik warna vinegar
Daftar sidik ragam (Lampiran 6) memperlihatkan bahwa interaksi antara konsentrasi gula dan lama fermentasi memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap nilai hedonik warna vinegar yang dihasilkan, sehingga uji LSR tidak dilanjutkan.
Nilai Hedonik Aroma
Pengaruh konsentrasi gula terhadap nilai hedonik aroma vinegar
Daftar sidik ragam (Lampiran 7) memperlihatkan bahwa konsentrasi gula memberikan pengaruh tidak nyata (P>0,05) terhadap nilai hedonik aroma vinegar
yang dihasilkan, sehingga uji LSR tidak dilanjutkan.
Pengaruh lama fermentasi terhadap nilai hedonik aroma vinegar
Tabel 23. Uji LSR efek utama pengaruh lama fermentasi terhadap nilai hedonik aroma vinegar
Jarak LSR Lama Fermentasi Rataan Notasi 0,05 0,01 0,05 0,01 - - - L1= 5 hari 3,542 a A 2 0,238 0,328 L2= 10 hari 3,400 b B 3 0,250 0,345 L3= 15 hari 3,050 c C 4 0,256 0,353 L4= 20 hari 2,642 d D
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar) menurut uji LSR
Nilai hedonik aroma vinegar tertinggi diperoleh pada perlakuan L1 yaitu sebesar 3,542 dan terendah pada perlakuan L4 yaitu sebesar 2,642. Hubungan lama fermentasi dengan nilai hedonik aroma dapat dilihat pada Gambar 16.
Gambar 16. Hubungan lama fermentasi dengan nilai hedonik aroma vinegar
Tabel 23 dan Gambar 16 memperlihatkan bahwa semakin lama waktu fermentasi maka nilai hedonik aroma semakin rendah yang menunjukkan bahwa
vinegar yang dihasilkan semakin kurang disukai. Fermentasi merupakan proses perombakan gula menjadi senyawa-senyawa organik seperti alkohol dan asam-asam organik, semakin lama waktu fermentasi maka semakin banyak asam-asam yang
terbentuk sehingga aroma asam akan semakin kuat dan kurang disukai oleh panelis. Hal ini sesuai dengan pernyataan Aditiwati dan Kusnadi, (2003) yang menyatakan bahwa pembentukan asam yang semakin lama semakin tinggi akan menyebabkan pH produk semakin rendah dan kurang disukai oleh para panelis.
Pengaruh interaksi antara konsentrasi gula dengan lama fermentasi terhadap nilai hedonik aroma vinegar
KESIMPULAN DAN SARAN
Kesimpulan
Dari hasil penelitian pengaruh konsentrasi gula dan lama fermentasi terhadap parameter yang diamati dapat diambil kesimpulan sebagai berikut :
1. Konsentrasi gula memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap total padatan terlarut, kadar asam asetat, nilai pH, total gula, nilai skor warna, dan nilai hedonik warna. Semakin tinggi konsentrasi gula yang ditambahkan menyebabkan total padatan terlarut dan total gula semakin meningkat, nilai skor warna dan nilai hedonik warna semakin menurun, kadar asam asetat semakin meningkat pada konsentrasi gula 0% sampai konsentrasi gula 10% dan menurun pada konsentrasi gula 15%, sedangkan nilai pH semakin menurun pada konsentrasi gula 0% sampai konsentrasi gula 10% dan meningkat pada konsentrasi gula 15%
2. Lama fermentasi memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap total padatan terlarut, kadar asam asetat, total gula, nilai skor warna, nilai hedonik warna, dan nilai hedonik aroma. Semakin lama waktu fermentasi menyebabkan total padatan terlarut, total gula dan nilai hedonik aroma semakin menurun, nilai skor warna dan nilai hedonik warna semakin meningkat, dan kadar asam asetat semakin meningkat pada lama fermentasi 5 hari sampai 15 hari dan menurun pada lama fermentasi 20 hari.
3. Interaksi antara konsentrasi gula dengan lama fermentasi memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap kadar asam asetat dan total gula, memberikan pengaruh berbeda nyata (P<0,05) terhadap nilai skor warna
serta memberikan pengaruh tidak nyata (P>0,05) terhadap total padatan terlarut, nilai pH, nilai hedonik warna, dan nilai hedonik aroma.
4. Vinegar kulit buah kopi yang terbaik dihasilkan pada formulasi konsentrasi gula 5% (K2) dengan lama fermentasi 15 hari (L3).
Saran
1. Sebaiknya dilakukan proses blansing terhadap bahan baku kulit kopi sebelum dilakukan proses pengolahan untuk menghindari terjadinya pencoklatan enzimatis yang dapat menyebabkan warna produk menjadi gelap dan kurang disukai.
2. Proses pengendapan yang dilakukan sebelum proses fermentasi tidak cukup untuk menghilangkan semua endapan dari sari kulit kopi dan menyebabkan produk akhir vinegar masih menghasilkan endapan setelah proses fermentasi selesai, untuk itu sebaiknya perlu dilakukan proses pengendapan kembali saat proses fermentasi selesai dilakukan agar dapat menghasilkan vinegar yang jernih (tidak keruh).
TINJAUAN PUSTAKA
Vinegar
Vinegar berasal dari bahasa Perancis, yaitu vinaige, yang artinya adalah anggur yang telah asam. Vinegar merupakan produk hasil fermentasi dari bahan yang mengandung gula dan pati. Vinegar dihasilkan dari fermentasi gula menjadi alkohol yang dilanjutkan dengan fermentasi alkohol menjadi asam asetat. Produk akhir vinegar mengandung asam asetat minimal 4 gam/100 ml (Waluyo, 1984).
Menurut Adam (1985) dalam Munthe (2004), vinegar merupakan larutan asam asetat yang diproduksi melalui dua tahapan fermentasi. Pada tahap pertama terjadi perubahan gula menjadi alkohol oleh khamir, biasanya dari Saccharomyces cereviceae, dan pada tahap kedua terjadi perubahan alkohol menjadi asam asetat oleh bakteri dari genus Acetobacter.
Frazier (1967) mendefinisikan vinegar sebagai bahan penyedap masakan yang dibuat dari bahan-bahan yang mengandung gula atau pati dengan melalui proses fermentasi alkohol yang dilanjutkan dengan fermentasi asam asetat. Mutu
vinegar sangat tergantung pada mutu dari bahan baku yang digunakan. Buah-buahan yang digunakan dalam pembuatan vinegar harus sehat, bersih dan mempunyai derajat kematangan yang optimal (Waluyo, 1984).
Vinegar biasanya digunakan sebagai bahan penyedap untuk memperbaiki flavor pada berbagai jenis masakan. Vinegar juga dikonsumsi sebagai minuman setelah dilakukan proses aging/penuaan terhadap vinegar tersebut. Minuman
vinegar memiliki keistimewaan tersendiri karena memiliki flavor (perpaduan antara rasa dan bau) yang baik (Kwartiningsih dan Mulyati, 2005).
Asam asetat merupakan komponen utama pada vinegar. Asam asetat adalah cairan yang tidak berwarna dan memiliki bau yang tajam dan rasa yang jelas. Berat jenis asam asetat adalah 1,049 dengan titik didih sebesar 118,1 oC pada tekanan 1 atmosfer (Egan, dkk, 1981). Menurut Ebner (1982), vinegar merupakan larutan jernih tidak berwarna atau berwarna, tergantung dari bahan yang digunakan, dan pada umumnya tingkat keasaman vinegar berkisar antara 3 – 3,5. Tabel 1. Syarat mutu vinegar fermentasi berdasarkan Codex Standard For Vinegar
No. Kriteria uji Satuan Persyaratan
1 Kadar asam asetat g/l Min 50
Berbagai produk hasil pertanian yang memiliki kadar gula tinggi dapat digunakan sebagai bahan baku dalam pembuatan asam asetat. Beberapa negara di benua Amerika dan Eropa menggunakan sari buah dari berbagai jenis buah-buahan sebagai bahan baku pembuatan asam asetat (Rahman, 1988).
dihasilkan melalui proses fermentasi mempunyai keunggulan dibandingkan dengan produk asam cuka yang beredar di pasaran, yang pada umumnya diperoleh dari reaksi kimia, hal ini disebabkan karena asam cuka (vinegar) yang diperoleh dari hasil fermentasi memiliki flavor yang lebih baik (Waluyo, 1984).
Kopi
Kopi merupakan salah satu komoditas hasil tanaman perkebunan utama di Indonesia dan merupakan salah satu penghasil sumber devisa Negara dan berperan penting dalam pengembangan industri perkebunan. Pengolahan kopi akan menghasilkan limbah padat maupun cair yang sangat besar. Penanganan limbah dari hasil pengolahan kopi ini merupakan salah satu permasalahan utama dalam proses pengolahan kopi. Kulit kopi merupakan salah satu jenis limbah yang dihasilkan dari proses pengolahan kopi. Kulit kopi memiliki kandungan nutrisi dan senyawa potensial yang dapat diubah menjadi produk samping yang lebih bermanfaat dan bernilai ekonomis tinggi yang dapat meningkatkan pendapatan dan peluang usaha di sektor perkebunan kopi rakyat (Widyotomo, 2013).
Anatomi buah kopi (Widyotomo, 2013) dapat dilihat pada Gambar 1.
Gambar 1. Anatomi buah kopi
Kopi diperoleh dari serangkaian proses pengolahan. Salah satu proses pengolahan yang dilakukan dalam pembuatan kopi adalah proses pemisahan kulit kopi dengan biji kopi (proses pulping). Limbah yang dihasilkan dari proses pemisahan kulit kopi dengan biji kopi (proses pulping) dalam bentuk biomassa sangat melimpah jumlahnya, dan hanya beberapa persen dari limbah tersebut yang dimanfaatkan sebagai makanan ternak dan kompos (Raudah dan Ernawati, 2012).
Kulit Kopi
Kulit kopi merupakan salah satu limbah yang diperoleh dari proses pengolahan kopi. Salah satu komponen penting dalam limbah kulit kopi yang menjadikan limbah kulit kopi masih dapat dimanfaatkan adalah sukrosa. Kadar gula dalam buah kopi akan meningkat dengan cepat selama proses pematangan buah kopi yang dapat diidentifikasikan dengan meningkatnya rasa manis pada
Kulit luar
Kulit buah
Biji Biji
Kulit ari Tangkai
buah (Widyotomo, 2013). Siswati, dkk(2012) menyatakan bahwa bioetanol dapat dihasilkan dari proses fermentasi limbah kulit kopi. Kandungan selulosa yang terdapat di dalam limbah kulit kopi sebesar 65,2%. Selulosa memiliki potensi sebagai bahan baku alternatif pembuatan etanol.
Limbah padat dan cair pengolahan kopi mengandung materi organik yang cukup tinggi dan sangat potensial sebagai media tumbuh mikroorganisme untuk dapat diubah menjadi produk bernilai tambah (Pandey, dkk, 2000).
Proses fermentasi dilakukan untuk mengubah limbah kulit kopi menjadi produk bioetanol. Proses fermentasi tersebut dilakukan dengan bantuan mikroba yang akan mengubah gula yang terkandung dalam limbah kulit kopi menjadi salah satu sumber energi terbaru yaitu bioetanol. Salah satu jenis mikroba yang mampu mengubah gula menjadi bioetanol ialah jenis ragi Saccharomyces cerevisiae
(Raudah dan Ernawati, 2012).
Kandungan atau komposisi gizi yang terdapat dalam kulit buah kopi dapat dilihat dalam Tabel 2.
Tabel 2. Kandungan nutrisi kulit kopi
Nutrisi Kandungan bahan (%)
Ekstrak eter 0,48
Serat kasar 21,40
Protein kasar 10,10
Abu 1,50
Ekstrak nitrogen bebas (NFE) 31,30
Bahan Tambahan Pada Pembuatan Vinegar
Gula
Gula dapur atau yang dalam istilah kimianya lebih dikenal dengan sukrosa merupakan suatu disakarida yang dibentuk dari monomer-monomer berupa glukosa dan fruktosa, dengan rumus molekul C12H22O11. Gula dapur diperoleh dari gula tebu atau gula bit. Produksi gula setiap tahunnya mencapai sekitar 150 juta ton. Penambahan gula dalam media berfungsi sebagai sumber karbon. Proses fermentasi gula melibatkan mikroorganisme yang menggunakan substrat gula sebagai sumber untuk menghasilkan energi dengan melepaskan karbondioksida dan produk samping berupa alkohol (Wikipediac, 2014).
Asam asetat dapat diproduksi dari berbagai produk hasil pertanian yang mengandung kadar gula tinggi. Beberapa negara di benua Amerika dan Eropa menggunakan sari buah dari berbagai jenis buah-buahan sebagai bahan baku pembuatan asam asetat (vinegar). Beberapa negara lain seperti Jepang memproduksi asam asetat menggunakan bahan baku beras yang telah mengalami proses sakarifikasi (Rahman, 1988).
Proses awal pembuatan vinegar adalah perombakan gula menjadi etanol oleh Saccharomyces cereviceae. Etanol yang dihasilkan kemudian dirombak menjadi asam asetat oleh Acetobacter aceti. Dengan demikian, jumlah gula pada bahan akan mempengaruhi jumlah etanol yang dihasilkan dan juga mempengaruhi jumlah asam asetat yang dihasilkan (Rahman, 1992).
Saccharomyces cereviceae adalah gula. Oleh karena itu, dalam proses fermentasi gula menjadi alkohol, konsentrasi gula sangat mempengaruhi kuantitas alkohol yang dihasilkan (Waluyo, 1984).
Ragi (Saccharomyces cereviceae)
Khamir sejak dulu berperan dalam proses fermentasi yang bersifat alkohol dengan produk utama dari hasil proses metabolismenya adalah etanol.
Saccharomyces cereviceae merupakan jenis khamir utama yang berperan dalam proses pengolahan minuman beralkohol seperti bir dan anggur dan juga digunakan dalam proses fermentasi adonan dalam pengolahan roti (Rahman, 1992).
Pemilihan mikroorganisme didasarkan pada jenis karbohidrat yang digunakan sebagai medium pertumbuhan dari mikroorganisme tersebut. Untuk memproduksi alkohol dari pati dan gula digunakan khamir Saccharomyces cereviseae. Pemilihan tersebut dilakukan karena Saccharomyces cereviseae
mampu tumbuh dengan cepat dan mempunyai toleransi terhadap konsentrasi gula yang tinggi, mampu menghasilkan alkohol dalam jumlah yang banyak dan tahan terhadap alkohol tersebut (Simanjuntak, 2009).
Media pertumbuhan Saccharomyces cereviceae harus memiliki kadar gula optimum 10-15% untuk dapat menghasilkan etanol sebesar 8-10%. Semakin besar etanol yang dihasilkan dalam proses fermentasi maka semakin besar asam asetat yang terbentuk, selama kondisi lingkungan tetap mendukung pertumbuhannya (Rahman, 1988).
Acetobacter aceti
Berbagai jenis bakteri fermentatif mampu menghasilkan asam asetat, namun hanya spesies-spesies tertentu dari golongan bakteri asam asetat tersebut yang dapat digunakan untuk memproduksi asam asetat secara komersil. Bakteri asam asetat yang umum digunakan tersebut adalah Gluconobacter dan
Acetobacter (Rahman, 1992).
Kebanyakan spesies bakteri pembentuk asam asetat termasuk dalam jenis
Acetobacter dan Gluconobacter. Kedua jenis bakteri tersebut dapat mengoksidasi alkohol menjadi asam asetat. Spesies bakteri yang lebih sering dan umum digunakan dalam industri pembuatan asam asetat yaitu Acetobacter acetii dan
Gluconobacter suboxydans (Fardiaz, 1992).
Bakteri pembentuk asam asetat termasuk dalam golongan bakteri gam negatif yang berbentuk batang dan termasuk dalam genus Acetobacter. Proses metabolisme bakteri ini lebih bersifat aerobik. Peranan utama Acetobacter dalam proses fermentasi bahan pangan adalah kemampuannya untuk mengoksidasi alkohol menjadi asam asetat (Muchtadi, 1989 dalam Munthe, 2004).
Sifat-sifat dari Acetobacter antara lain adalah memiliki kepekaan terhadap kekurangan oksigen, memiliki kepekaan terhadap kekurangan etanol, dan memiliki kepekaan terhadap perubahan suhu (Prescot dan Dunn, 1982).
Proses Pengolahan Vinegar
Sortasi dan Pencucian
Sortasi merupakan suatu proses dalam penanganan pasca panen yang bertujuan untuk memisahkan bahan utama (produk utama) dengan bahan pengotor (losses) atau bahan yang tidak diinginkan/dibutuhkan. Proses sortasi ini sering disebut juga dengan pemisahan (Brainly, 2014).
Pencucian (washing) dilakukan pada produk hasil pertanian yang tumbuh dekat tanah untuk membersihkan kotoran yang menempel. Selain itu dengan dilakukannya proses pencucian dapat mengurangi residu pestisida dan hama penyakit yang terdapat pada bahan pangan. Pencucian disarankan menggunakan air yang bersih, penggunaan desinfektan pada air pencuci juga dianjurkan (Mutiarawati, 2009).
Penyaringan
Filtrasi atau penyaringan merupakan pembersihan partikel padat dari suatu fluida dengan cara melewatkannya pada medium penyaringan atau septum, yang di atasnya padatan akan terendapkan atau terpisah dari fluida. Tingkat penyaringan pada industri dimulai dari penyaringan sederhana hingga pemisahan yang kompleks. Fluida yang disaring dapat berupa cairan atau gas. Aliran yang lolos dari saringan mungkin saja cairan, padatan, atau keduanya tergantung pada tujuan penyaringannya (Wikipediad, 2014).
Fermentasi Alkohol
Fermentasi merupakan suatu reaksi oksidasi atau reaksi dalam sistem biologi yang menghasilkan energi di mana donor dan aseptor merupakan senyawa organik. Senyawa organik yang biasa digunakan dalam proses fermentasi adalah gula. Senyawa organik tersebut akan diubah oleh reaksi reduksi dengan katalis enzim menjadi senyawa lain (Fardiaz, Winarno, 1984 dalam Kwartiningsih dan Mulyati, 2005).
Metode yang digunakan untuk mengubah kulit kopi menjadi bioetanol adalah metode fermentasi. Bantuan mikroba sangat berperan penting dalam mengubah gula yang terkandung dalam kulit kopi menjadi bioetanol. Mikroba yang mampu untuk mengubah gula menjadi bioetanol salah satunya ialah jenis ragi Saccharomycescerevisiae (Raudah dan Ernawati, 2012).
fermentasi tersebut maksimal sekitar 15% (Salle, 1974 dalam Kwartiningsih dan Mulyati, 2005).
Dalam pembuatan vinegar terdapat dua kali proses fermentasi. Fermentasi yang pertama adalah fermentasi pembentukan alkohol dengan yeast
Saccharomyces cereviceae. Pada proses fermentasi ini terjadi perombakan glukosa menjadi alkohol dan gas CO2 dengan reaksi sebagai berikut :
C6H12O6 2 CH3CH2OH + 2 CO2 (Glukosa) (Etanol)
Fermentasi Asetat
Fermentasi alkohol menjadi asam asetat dilakukan dengan bantuan bakteri asam asetat. Fermentasi ini berlangsung dalam kondisi aerobik menggunakan bakteri dari genus Acetobacter (Frazier, 1967). Menurut Ebner (1982), rendemen etanol yang dikonversikan menjadi asam asetat berkisar 95% - 98%, minimal 4g/100 ml asam asetat.
Proses produksi asam asetat dapat dilakukan secara kimiawi dan biologis. Proses kimiawi produksi asam asetat yang banyak dilakukan adalah oksidasi butana. Untuk kebutuhan pangan, produksi asam asetat harus dilakukan melalui proses biologis, salah satunya adalah fermentasi dari bahan baku alkohol. Fermentasi dilakukan dengan menggunakan bakteri dari genus Acetobacter dalam kondisi aerobik (Hardoyo, dkk, 2007).
Fermentasi perubahan alkohol menjadi asam asetat dan air dilakukan dengan bantuan bakteri Acetobacter aceti. Reaksi fermentasi pembentukan asam asetat dituliskan sebagai berikut:
Fermentasi perubahan alkohol menjadi asam asetat dilakukan dalam kondisi aerob. Pada fermentasi pembentukan asam asetat tersebut terjadi perubahan etanol menjadi asetaldehid dan asetaldehid diubah menjadi asam asetat dengan reaksi sebagai berikut :
CH3CH2OH + ½ O2 CH3CHO + H2O Etanol Asetaldehid CH3CHO + ½ O2 CH3COOH Asetaldehid Asam asetat (Salle, 1974 dalam Kwartiningsih dan Mulyati, 2005).
Tempat penyimpanan asam asetat yang telah difermentasi harus ditutup dengan baik dan harus dapat menghindari masuknya oksigen, karena enzim-enzim bakteri asam asetat akan merombak asam asetat dan menghasilkan gas karbondioksida dan air jika asam asetat terkontaminasi dengan udara (Waluyo, 1984). Menurut Daulay dan Rahman (1992), kriteria mutu vinegar yang utama adalah kadar asam asetat, cuka memiliki daya simpan yang lama disebabkan kandungan asetat didalamnya. Sebanyak 0,1% asam asetat dapat menghambat pertumbuhan bakteri pembentuk spora penyebab keracunan makanan dan 0,3% asam asetat dapat mencegah kapang penghasil metoksin.
Pasteurisasi
Berbeda dengan sterilisasi, pasteurisasi tidak dimaksudkan untuk membunuh seluruh mikroorganisme yang ada dalam bahan pangan. Pasteurisasi bertujuan untuk mengurangi jumlah mikroorganisme sehingga tidak lagi bisa menyebabkan penyakit terhadap orang yang mengkonsumsinya (dengan syarat produk yang telah dipasteurisasi didinginkan dan digunakan sebelum tanggal kadaluarsa) (Wikipediad, 2014).
Pengemasan
Kemasan adalah suatu benda yang digunakan sebagai wadah atau tempat yang dapat digunakan sebagai perlindungan sesuai dengan tujuan yang diinginkan. Kemasan dapat membantu mencegah ataupun mengurangi terjadinya kerusakan dan melindungi bahan dari pencemaran serta gangguan fisik lainnya seperti gesekan, benturan dan getaran (Syarief, 1989).
Botol kaca merupakan salah satu jenis kemasan. Botol yang digunakan adalah botol yang bersih dan steril serta tertutup yang berfungsi untuk mencegah masuknya udara dari luar. Pasteurisasi yang dilakukan pada vinegar dilakukan dengan suhu 60 oC sampai 66 oC selama 30 menit (Desrosier, 1970).
PENDAHULUAN
Latar Belakang
Kopi merupakan salah satu dari tanaman perkebunan yang memiliki nilai ekonomis tinggi selain tanaman cokelat dan teh. Produksi buah kopi di Indonesia cukup tinggi dan berdasarkan data yang disampaikan dalam Kompasiana (2014) pada tahun 2013, Indonesia menjadi negara penghasil kopi terbesar ketiga di dunia setelah Brazil dan Vietnam. Produksi kopi di Indonesia pada tahun 2013 berdasarkan data BPSa (2014) mencapai 298.000 ton dengan luas lahan perkebunan 478.000 Ha.
Salah satu wilayah penghasil kopi di Indonesia adalah Sumatera Utara. Sumatera Utara memiliki 33 kabupaten/kota, namun tidak semua daerah yang berpotensi dalam pengembangan komoditi kopi. Beberapa daerah yang berpotensi yaitu Tapanuli Utara, Tapanuli Tengah, Tapanuli Selatan, Toba Samosir, Samosir, Humbang Hasundutan, Simalungun, Dairi, Deli Serdang, Karo, Labuhan Batu Selatan, Langkat, Nias, Nias Barat, Nias Utara, Padang Lawas, Padang Lawas Utara, Pakpak Barat, Mandailing dan Gunung Sitoli. Jenis kopi yang ditanam di wilayah Sumatera Utara adalah kopi Arabika dan kopi Robusta, tetapi jenis yang lebih banyak ditanam adalah jenis kopi Arabika. Produksi kopi Arabika di Sumatera Utara pada tahun 2013 mencapai 47.230,23 ton dan kopi Robusta 8.082,99 ton (BPSb, 2014).
Buah kopi terdiri dari kulit daging buah, kulit tanduk, kulit ari dan biji. Bagian dari buah kopi yang pada umumnya dimanfaatkan menjadi minuman penyegar adalah bagian biji sedangkan bagian buah lain yang tidak digunakan