ANALISIS KANDUNGAN PROTEIN PADA
KACANG-KACANGAN YANG DIKALENGKAN
SECARA SPEKTROFOTOMETRI SINAR TAMPAK
SKRIPSI
OLEH:
MARIA INTAN
NIM 091501042
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS KANDUNGAN PROTEIN PADA
KACANG-KACANGAN YANG DIKALENGKAN
SECARA SPEKTROFOTOMETRI SINAR TAMPAK
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh
Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
MARIA INTAN
NIM 091501042
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
ANALISIS KANDUNGAN PROTEIN PADA
KACANG-KACANGAN YANG DIKALENGKAN
SECARA SPEKTROFOTOMETRI SINAR TAMPAK
OLEH: MARIA INTAN NIM 091501042
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara Pada Tanggal: 03 Agustus 2013
Pembimbing I, Panitia Penguji,
Prof. Dr. Siti Morin Sinaga, M.Sc., Apt.
NIP 195008281976032002 NIP 195306191983031001
Pembimbing II, Prof. Dr. Siti Morin Sinaga, M.Sc., Apt. NIP 195008281976032002
Prof. Dr. Jansen Silalahi, M.App.Sc., Apt. Dr. Ginda Haro, M.Sc., Apt. NIP 195006071979031001 NIP 195108161980031002
Drs. Immanuel S. Meiliala, M.Si., Apt. NIP 195001261983031002
Medan, Oktober 2013 Fakultas Farmasi Universitas Sumatera Utara
Dekan,
Prof. Dr. Sumadio Hadisahputra, Apt. NIP 195311281983031002
KATA PENGANTAR
Puji syukur kepada Tuhan Yang Maha Kuasa yang hanya oleh karena
berkat dan kasihNya yang berlimpah sehingga penulis dapat menjalani masa
perkuliahan dan penelitian hingga akhirnya menyelesaikan penyusunan skripsi
dengan judul “Analisis Kandungan Protein pada Kacang-kacangan yang
Dikalengkan secara Spektrofotometri Sinar Tampak”. Skripsi ini diajukan sebagai
salah satu syarat guna memperoleh gelar Sarjana Farmasi dari Fakultas Farmasi
Universitas Sumatera Utara.
Pada kesempatan ini penulis ingin menyampaikan rasa hormat dan terima
kasih yang setulus-tulusnya kepada Ibu Prof. Dr. Siti Morin Sinaga, M.Sc., Apt.,
dan Bapak Prof. Dr. Jansen Silalahi, M.App.Sc., Apt., selaku dosen pembimbing
yang telah banyak memberikan bimbingan dan motivasi dengan penuh kesabaran
dan keikhlasan selama penelitian dan penulisan skripsi ini berlangsung. Ucapan
terima kasih juga penulis sampaikan kepada Bapak Prof. Dr. Sumadio
Hadisaputra, Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera Utara
yang telah memberikan fasilitas selama masa pendidikan dan penelitian, juga
kepada Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, S.U., Apt., Bapak Dr.
Ginda Haro, M.Sc., Apt., dan Bapak Drs. Immanuel Meiliala, M.S., Apt., selaku
penguji yang telah memberikan kritik dan saran demi kesempurnaan skripsi ini.
Penulis menyampaikan rasa terima kasih yang tulus kepada Ayahanda
Irwan Sunaryo dan Ibunda Yuliana Sim serta adik-adik tersayang Sultan, Imam
dan Diana yang telah sabar dan setia memberikan dukungan, doa, semangat, dan
Pada kesempatan ini juga penulis ingin menyampaikan rasa terima kasih
kepada teman-teman Elsa, Debo, Ella, Vivian, Merlyn, Noven, Mimi, Andrew,
Aryanto, Edric, Agus, Fennie, Tio, asisten serta teman-teman di Laboratorium
Teknologi Pangan Fakultas Pertanian dan teman-teman seangkatan lainnya yang
tidak dapat disebutkan satu per satu yang telah banyak memberikan saran,
dukungan, dan doa selama penelitian dan penyusunan skripsi ini berlangsung.
Penulis menyadari bahwa skripsi ini masih memiliki banyak kekurangan,
oleh sebab itu dengan segala kerendahan hati penulis bersedia menerima kritik
dan saran yang membangun untuk kesempurnaan skripsi ini. Semoga skripsi ini
dapat menjadi sumbangan yang bermanfaat bagi ilmu pengetahuan.
Medan, 10 Juli 2013 Penulis,
ANALISIS KANDUNGAN PROTEIN PADA KACANG-KACANGAN YANG DIKALENGKAN SECARA SPEKTROFOTOMETRI
SINAR TAMPAK ABSTRAK
Penetapan kadar protein yang paling sering dilakukan adalah penetapan protein kasar yang bertujuan untuk menentukan jumlah protein total di dalam bahan pangan. Metode penetapan kadar protein yang paling lazim digunakan adalah metode Kjeldahl. Namun, seiring semakin berkembangnya ilmu pengetahuan, penetapan kadar protein dapat dilakukan dengan metode spektrofotometri. Salah satunya adalah spektrofotometri sinar tampak dengan pereaksi Biuret. Metode spektrofotometri ini banyak digunakan karena operasionalnya yang sederhana dan memberikan hasil yang cepat.
Tujuan penelitian ini adalah untuk mengetahui kadar protein dalam kacang-kacangan yang dikalengkan secara spektrofotometri sinar tampak dan apakah ada perbedaan dengan kadar protein yang diperoleh dengan metode Kjeldahl.
Pada penelitian ini sampel yang digunakan adalah kacang-kacangan yang dikalengkan, antara lain: kacang polong Hosen, kacang tanah Ayam Brand, kacang buncis Daucy, kacang gingko Mili dan kacang merah SW. Analisis dilakukan secara spektrofotometri sinar tampak menggunakan pereaksi Biuret pada panjang gelombang maksimum 553,36 nm.
Hasil penelitian menunjukkan kadar protein kelima sampel yang ditentukan secara spektrofotometri sinar tampak adalah: untuk kacang polong 1,37 ± 0,0308 g/100 g, kacang tanah 1,36 ± 0,0247 g/100 g, kacang buncis 2,77 ± 0,0263 g/100 g, kacang gingko 1,44 ± 0,0728 g/100 g, dan kacang merah 2,26 ± 0,0126 g/100 g, sementara pengukuran kadar protein dengan metode Kjeldahl hanya dilakukan pada satu sampel yaitu kacang polong dengan hasil 5,98 ± 0,4691 g/100 g. Hasil uji verifikasi metode spektrofotometri diperoleh persen perolehan kembali adalah 99,13% dengan koefisien variasi (KV) 0,55% yang menunjukkan bahwa metode ini memiliki kecermatan dan keseksamaan yang baik. Batas deteksi dan batas kuantitasi untuk metode ini masing-masing adalah 129,6313 mcg/ml dan 432,1043 mcg/ml.
PROTEIN ANALYSIS IN CANNED LEGUMES USING VISIBLE SPECTROPHOTOMETRY
ABSTRACT
Protein is usually measured as crude protein which is called as the total protein in food and is determined using Kjeldahl method. But, along with knowledge advances, protein can be measured using spectrophotometry method. One of the method is visible spectrophotometry method using Biuret reagent. Spectrophotometry method is commonly used because it is easy to operate and quick in result.
The purpose of this study is to determine the protein concentration of canned legumes using visible spectrophotometry and to recognize the difference between Kjeldahl method and spectrophotometry method.
In this study, five canned samples that is Hosen green peas, Ayam Brand peanuts, Daucy flageolet beans, Mili gingko nuts and SW kidney beans were used. The analysis was conducted by using visible spectrophotometry method using Biuret as the reagent at maximum wavelength 553.36 nm.
The result of the study shows that the protein concentration of five samples that have been determined by visible spectrophotometry are 1.37 ±
0.0308 g/100 g for green peas; 1.36 ± 0.0247 g/100 g for peanuts; 2.77 ± 0.0263 g/100 g for flageolet beans; 1.44 ± 0.0728 g/100 g for gingko
beans; and 2.26 ± 0.0126 g/100 g for kidney beans, while protein determination using Kjeldahl method is only applied for one sample, which is green peas, with result 5.98 ±0.4691 g/100 g. Method verification results show that the recovery percentage is 99.13% with 0.55% of coefficient variation, which shows that this method has a good accuracy and precision. The limit of detection (LOD) and limit
of quantitation (LOQ) for this method are 129,6313 mcg/ml and 432,1043 mcg/ml.
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ……… iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB 1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 5
1.5 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Protein ... 6
2.1.1 Struktur protein ... 7
2.1.2 Klasifikasi protein ... 10
2.1.3 Sumber protein ... 11
2.2 Pencernaan dan Metabolisme Protein ... 14
2.3 Penyakit yang Berhubungan dengan Protein ... 15
2.4 Pengaruh Pengolahan Terhadap Protein ... 17
2.5 Analisis Protein ... 18
2.5.1 Metode Kjeldahl ... 18
2.5.2 Metode Spektrofotometri ... 21
2.5.3 Metode Titrasi Formol ... 26
2.5.4 Metode Dumas ... 27
2.6 Pengalengan ... 27
BAB III METODE PENELITIAN ... 31
3.1 Alat–alat ... 31
3.2 Bahan-bahan ... 31
3.3 Pengambilan Sampel ... 31
3.4 Prosedur Penelitian ... 32
3.4.1 Pembuatan pereaksi ... 32
3.4.2 Pembuatan larutan induk baku ... 32
3.4.3 Pembuatan kurva serapan Bovine Serum Albumin ... 33
3.4.4 Penentuan waktu optimum... 33
3.4.5 Pembuatan kurva kalibrasi Bovine Serum Albumin ... 33
3.4.6 Preparasi sampel ... 34
3.4.7 Penetapan kadar protein ... 34
3.4.8 Analisis statistik data penetapan kadar protein ... 35
3.5 Verifikasi Metode ... 36
3.5.2 Keseksamaan/Presisi ... 36
3.5.3 Batas deteksi dan batas kuantitasi ... 37
3.6 Penetapan kadar protein dengan metode Kjeldahl ... 37
BAB IV HASIL DAN PEMBAHASAN ... 39
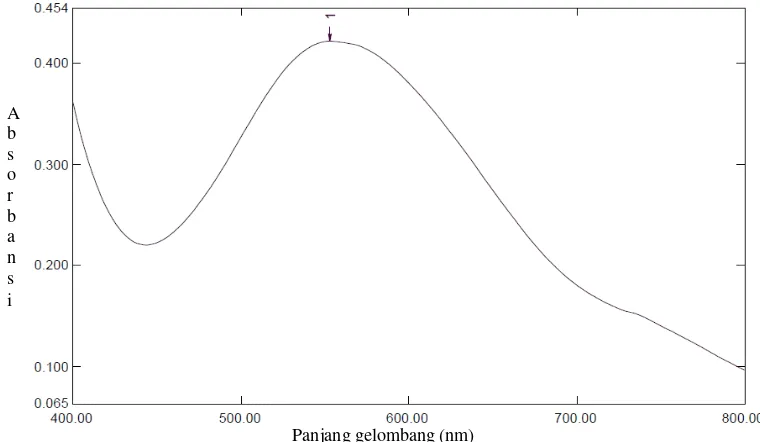
4.1 Kurva Serapan Bovine Serum Albumin ... 39
4.2 Waktu Optimum ... 40
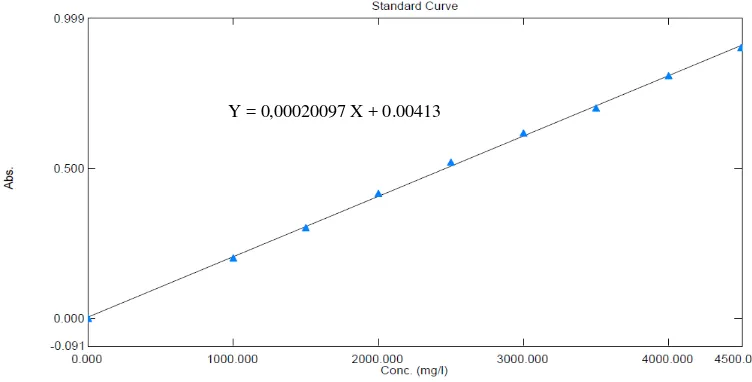
4.3 Kurva Kalibrasi Bovine Serum Albumin ... 40
4.4 Kadar Protein ... 41
4.5 Uji Verifikasi Metode ... 43
4.5.1 Uji kecermatan ... 44
4.5.2 Uji keseksamaan ... 44
4.5.3 Batas deteksi dan batas kuantitasi ... 44
BAB V KESIMPULAN DAN SARAN... 46
5.1 Kesimpulan ... 46
5.2 Saran ... 46
DAFTAR PUSTAKA ... 47
DAFTAR TABEL
Tabel Halaman
1. Kandungan Protein dari Beberapa Jenis Kacang-kacangan ... 12
2. Faktor Konversi untuk Berbagai Bahan ... 21
3. Data Kadar Protein secara Spektrofotometri Sinar Tampak, Kjeldahl
dan yang tercantum dalam kemasan ………... 41
DAFTAR GAMBAR
Gambar Halaman
1. Struktur Dasar Asam Amino ... 7
2. Struktur Primer Protein……… ...………...………. 8
3. Struktur Sekunder Protein... 8
4. Struktur Tersier Protein ... 9
5. Struktur Kuartener Protein ... 9
6. Reaksi Protein dengan Pereaksi Biuret... 23
7. Reaksi Protein dengan Pereaksi Lowry ... 25
8. Reaksi Protein dengan Pereaksi Bradford ... 26
9. Kurva Absorpsi Bovine Serum Albumin... 39
10.Kurva Kalibrasi Bovine Serum Albumin ... 40
11.Spektrofotometer Shimadzu ... 88
DAFTAR LAMPIRAN
Lampiran Halaman
1. Daftar Spesifikasi Sampel... 51
2. Skema Prosedur Preparasi dan Analisis Protein secara Spektrofoto- metri Sinar Tampak ... 54
3. Skema Prosedur Preparasi dan Analisis Protein secara Kjeladahl ... 55
4. Kurva Absorpsi dan Panjang Gelombang Maksimum Bovine Serum Albumin ... 56
5. Data Pengukuran Waktu Optimum ... 57
6. Kurva Kalibrasi Bovine Serum Albumin pada Panjang Gelombang 553,36 nm ... 59
7. Data Perhitungan Persamaan Regresi ... 60
8. Perhitungan Koefisien Korelasi ... 62
9. Data Penimbangan dan Absorbansi Sampel ... 63
10.Contoh Perhitungan Kadar Protein secara Spektrofotometri Sinar Tampak pada Sampel Kacang Polong ... 64
11.Contoh Perhitungan Analisis Statistik uji t untuk Mencari Kadar Sebenarnya secara Spektrofotometri Sinar Tampak pada Sampel Kacang Polong ... 65
12. Data Penimbangan dan Titrasi Sampel Kacang Polong ... 67
13.Contoh Perhitungan Kadar Protein secara Kjeldahl pada Sampel Kacang Polong ... 68
15. Data Hasil Perhitungan Kadar Protein secara Spektrofotometri Sinar
Tampak dan Kjeldahl ... 71
16. Data Hasil Perhitungan Analisis Statistik Uji t untuk mencari Kadar
Sebenarnya secara Spektrofotometri Sinar Tampak dan Kjeldahl ... 72
17. Data Penimbangan dan Absorbansi Perolehan Kembali Sampel
Kacang Polong ... 73
18. Contoh Perhitungan Persen Perolehan Kembali dengan Metode
Penambahan Baku (Standard Addition Method) dari Sampel Kacang
Polong ... 74
19.Contoh Data Perhitungan Koefisien Korelasi (KV) ... 75
20.Data Perhitungan Batas Deteksi dan Batas Kuantitasi Larutan Bovine
Serum Albumin ... 76
21.Tabel Distribusi t ... 77
22.Tabel Distribusi F ... 79
23.Data Uji Statistik One Way Anova Kadar Protein antara Sampel
Kacang-kacangan yang Dikalengkan ... 80
24.Data Uji Statistik Idenpendent T Test Kadar Protein Kacang Polong
secara Spektrofotometri Sinar Tampak dan Kjeldahl ... 82
25.Data Uji Statistik One Sample T Test Kadar Protein Kacang Polong
secara Spektrofotometri Sinar Tampak dengan yang Tercantum pada
Label Kemasan ... 83
26.Data Uji Statistik One Sample T Test Kadar Protein Kacang Tanah
secara Spektrofotometri Sinar Tampak dengan yang Tercantum pada
27.Data Uji Statistik One Sample T Test Kadar Protein Kacang Buncis
secara Spektrofotometri Sinar Tampak dengan yang Tercantum pada
Label Kemasan ... 85
28.Data Uji Statistik One Sample T Test Kadar Protein Kacang Gingko
secara Spektrofotometri Sinar Tampak dengan yang Tercantum pada
Label Kemasan ... 86
29.Data Uji Statistik One Sample T Test Kadar Protein Kacang Merah
secara Spektrofotometri Sinar Tampak dengan yang Tercantum pada
Label Kemasan ... 87
30.Gambar Instrumen Spektrofotometer ... 88
ANALISIS KANDUNGAN PROTEIN PADA KACANG-KACANGAN YANG DIKALENGKAN SECARA SPEKTROFOTOMETRI
SINAR TAMPAK ABSTRAK
Penetapan kadar protein yang paling sering dilakukan adalah penetapan protein kasar yang bertujuan untuk menentukan jumlah protein total di dalam bahan pangan. Metode penetapan kadar protein yang paling lazim digunakan adalah metode Kjeldahl. Namun, seiring semakin berkembangnya ilmu pengetahuan, penetapan kadar protein dapat dilakukan dengan metode spektrofotometri. Salah satunya adalah spektrofotometri sinar tampak dengan pereaksi Biuret. Metode spektrofotometri ini banyak digunakan karena operasionalnya yang sederhana dan memberikan hasil yang cepat.
Tujuan penelitian ini adalah untuk mengetahui kadar protein dalam kacang-kacangan yang dikalengkan secara spektrofotometri sinar tampak dan apakah ada perbedaan dengan kadar protein yang diperoleh dengan metode Kjeldahl.
Pada penelitian ini sampel yang digunakan adalah kacang-kacangan yang dikalengkan, antara lain: kacang polong Hosen, kacang tanah Ayam Brand, kacang buncis Daucy, kacang gingko Mili dan kacang merah SW. Analisis dilakukan secara spektrofotometri sinar tampak menggunakan pereaksi Biuret pada panjang gelombang maksimum 553,36 nm.
Hasil penelitian menunjukkan kadar protein kelima sampel yang ditentukan secara spektrofotometri sinar tampak adalah: untuk kacang polong 1,37 ± 0,0308 g/100 g, kacang tanah 1,36 ± 0,0247 g/100 g, kacang buncis 2,77 ± 0,0263 g/100 g, kacang gingko 1,44 ± 0,0728 g/100 g, dan kacang merah 2,26 ± 0,0126 g/100 g, sementara pengukuran kadar protein dengan metode Kjeldahl hanya dilakukan pada satu sampel yaitu kacang polong dengan hasil 5,98 ± 0,4691 g/100 g. Hasil uji verifikasi metode spektrofotometri diperoleh persen perolehan kembali adalah 99,13% dengan koefisien variasi (KV) 0,55% yang menunjukkan bahwa metode ini memiliki kecermatan dan keseksamaan yang baik. Batas deteksi dan batas kuantitasi untuk metode ini masing-masing adalah 129,6313 mcg/ml dan 432,1043 mcg/ml.
PROTEIN ANALYSIS IN CANNED LEGUMES USING VISIBLE SPECTROPHOTOMETRY
ABSTRACT
Protein is usually measured as crude protein which is called as the total protein in food and is determined using Kjeldahl method. But, along with knowledge advances, protein can be measured using spectrophotometry method. One of the method is visible spectrophotometry method using Biuret reagent. Spectrophotometry method is commonly used because it is easy to operate and quick in result.
The purpose of this study is to determine the protein concentration of canned legumes using visible spectrophotometry and to recognize the difference between Kjeldahl method and spectrophotometry method.
In this study, five canned samples that is Hosen green peas, Ayam Brand peanuts, Daucy flageolet beans, Mili gingko nuts and SW kidney beans were used. The analysis was conducted by using visible spectrophotometry method using Biuret as the reagent at maximum wavelength 553.36 nm.
The result of the study shows that the protein concentration of five samples that have been determined by visible spectrophotometry are 1.37 ±
0.0308 g/100 g for green peas; 1.36 ± 0.0247 g/100 g for peanuts; 2.77 ± 0.0263 g/100 g for flageolet beans; 1.44 ± 0.0728 g/100 g for gingko
beans; and 2.26 ± 0.0126 g/100 g for kidney beans, while protein determination using Kjeldahl method is only applied for one sample, which is green peas, with result 5.98 ±0.4691 g/100 g. Method verification results show that the recovery percentage is 99.13% with 0.55% of coefficient variation, which shows that this method has a good accuracy and precision. The limit of detection (LOD) and limit
of quantitation (LOQ) for this method are 129,6313 mcg/ml and 432,1043 mcg/ml.
BAB 1 PENDAHULUAN
1.1Latar Belakang
Protein adalah zat makanan yang sangat penting bagi tubuh manusia. Di
dalam tubuh protein menempati 1/6 dari berat tubuh manusia. Zat ini memegang
peranan penting sebagai zat pembangun untuk membentuk jaringan-jaringan
dalam tubuh manusia, perkembangan dan regenerasi sel, menjaga kekebalan tubuh
(Anonim, 2012).
Protein merupakan makromolekul penting yang tersusun oleh asam-asam
amino yang mengandung unsur-unsur utama C, H, O dan N. Molekul protein juga
mengandung unsur belerang, fosfor, besi dan tembaga, asam-asam amino tersebut
dihubungkan oleh ikatan peptida (Legowo, dkk., 2005; Stayanarayana dan
Chakrapati, 2007).
Protein berdasarkan sumbernya dibagi menjadi protein nabati dan protein
hewani. Protein dari sumber nabati lebih baik bagi tubuh dibanding protein
hewani (Susianto, dkk., 2008). Sumber makanan berprotein tinggi yang baik dan
mudah dicerna dapat diperoleh antara lain dari ikan, daging, kacang-kacangan,
susu, yoghurt, telur, dan produk olahannya. Kacang-kacangan telah lama dikenal
sebagai sumber protein, selain mudah diperoleh dan harganya terjangkau,
kacang-kacangan juga banyak mengandung asam amino yang dapat saling melengkapi
Semakin berkembangnya zaman, kebutuhan yang besar akan bahan
pangan berkualitas semakin tinggi, akan tetapi bahan pangan mudah mengalami
kerusakan sehingga dikembangkan berbagai metode pengawetan pangan dan
pengalengan merupakan salah satu proses pengawetan makanan yang digemari
saat ini, selain bahan makanan dapat bertahan lebih lama, kemasannya juga lebih
praktis (Desrosier, 2008). Selain itu, pengawetan dengan pengalengan dapat
melindungi bahan dari kerusakan oksidasi, menjaga tekstur bahan sehingga tidak
jauh berbeda dari bahan segar, menjaga agar kadar air tidak berubah secara
drastis, menjaga tekanan udara bahan baik di dalam maupun dari luar kaleng dan
melindungi bahan pangan terhadap pencemaran partikel asing dan kerusakan
mekanik (Winarno, 1995).
Kandungan protein dalam makanan umumnya ditetapkan berdasarkan total
nitrogen yang terkandung di dalamnya yang disebut sebagai protein kasar.
Penetapan protein kasar bertujuan untuk menentukan jumlah protein total di
dalam bahan pangan. Metode penetapan kadar protein yang paling lazim
digunakan adalah metode Kjeldahl (Legowo, dkk., 2005).
Ada dua kelemahan utama dalam metode Kjeldahl, yaitu waktu yang
diperlukan untuk analisis sangat lama dan perlu untuk melakukan dua analisis
untuk menetapkan perbedaan Non-Protein Nitrogen (NPN) dan Total Protein
Nitrogen (TPN). Meskipun demikian, metode Kjeldahl ini masih secara luas
digunakan dalam ilmu dan teknologi pangan dan telah diaplikasikan secara
mendunia untuk menentukan kadar nitrogen dalam berbagai jenis makanan dan
merupakan metode standard yang lazim dilakukan untuk penetapan kadar protein
Ilmu pengetahuan dalam bidang analisis telah banyak berkembang. Para
ilmuwan terus mengembangkan berbagai instrumen analisis untuk mempermudah
analisis dalam bidang kimia maupun biokimia. Salah satunya adalah
spektrofotometer yang secara luas telah digunakan karena pengoperasian alatnya
yang cukup sederhana dan memberikan hasil yang cepat (Christian, 2004).
Beberapa metode spektrofotometri untuk analisis protein yaitu metode
spektrofotometri sinar tampak dengan menggunakan pereaksi Biuret, Lowry,
Bradford, dan metode pengikatan warna (Legowo, dkk., 2005). Selain itu dapat
pula dilakukan dengan metode spektrofotometri ultraviolet pada panjang
gelombang 280 nm dan 205 nm, serta metode emisi fluoresensi (Sumonian,
2005). Penetapan kadar protein dengan menggunakan metode spektrofotometri
merupakan metode yang umum digunakan dalam beberapa area seperti analisis
biokimia, fisiologi, penelitian di bidang kesehatan dan berbagai area lainnya
(Isaac, 1990).
Semua protein tersusun dari asam-asam amino yang dihubungkan oleh
ikatan peptida. Ikatan peptida ini terbentuk dari reaksi kondensasi antara gugus
amin dan gugus karboksilat dari asam-asam amino. Peptida-peptida yang
mengandung lebih dari tiga asam-asam amino akan membentuk kompleks kelat
yang berwarna dengan ion tembaga pada suasana alkali yang dikenal dengan
reaksi Biuet. Berdasarkan intensitas warna yang terbentuk konsentrasi total
protein dapat diukur dengan spektrofotometer pada panjang gelombang sinar
tampak (Krohn, 2005).
Ketika suatu metode baru, metode yang belum dikenal luas, atau metode
dilakukan untuk memastikan bahwa metode tersebut sesuai untuk digunakan
(Wood, dkk., 1998) antara lain: uji akurasi, presisi, sensitifitas dengan parameter
batas deteksi dan batas kuantitasi, rentang linear, ketangguhan dan kekuatan
metode. Sementara verifikasi merupakan pengujian spesifikasi validasi yang
dilakukan oleh produsen ataupun peneliti lain untuk mengkonfirmasi
keterterimaan dan keterulangan suatu metode. Dalam verifikasi uji yang paling
ditonjolkan adalah uji akurasi dan uji presisi, namun tidak jarang juga dilakukan
uji sensitifitas (McClure, 2012).
Berdasarkan hal tersebut di atas, peneliti tertarik untuk mengetahui kadar
protein yang terkandung dalam kacang-kacangan yang dikalengkan secara
spektrofotometri sinar tampak dengan pereaksi Biuret.
1.2 Perumusan Masalah
Berdasarkan uraian pada latar belakang, maka permasalahan dalam
penelitian ini adalah berapakah kadar protein yang terkandung dalam
kacang-kacangan yang dikalengkan yang ditetapkan secara spektrofotometri sinar
tampak dengan pereaksi Biuret dan apakah ada perbedaannya dengan yang
ditetapkan secara Kjeldahl?
1.3 Hipotesis
Berdasarkan perumusan masalah diatas maka hipotesis penelitian ini
adalah ada perbedaan antara kadar protein yang ditetapkan secara
spektrofotometri sinar tampak dengan pereaksi Biuret dan Kjeldahl, dimana kadar
protein secara spektrofotometri sinar tampak adalah lebih rendah dibandingkan
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui kadar protein dalam
kacang-kacangan yang dikalengkan secara spektrofotometri sinar tampak dengan
pereaksi Biuret dan untuk mengetahui perbedaannya dengan yang ditetapkan
secara Kjeldahl.
1.5 Manfaat Penelitian
Melalui penelitian ini diharapkan dapat memberi informasi tentang kadar
protein dalam kacang-kacangan yang dikalengkan secara spektrofotometri sinar
BAB II
TINJAUAN PUSTAKA
2.1 Protein
Manusia membutuhkan energi dan nutrisi untuk pertumbuhan,
pemeliharaan fungsi biokimia tubuh, dan perkembangannya. Nutrisi dikategorikan
menjadi dua yaitu makronutrisi yang terdiri dari karbohidrat, lemak dan protein,
dan mikronutrisi berupa vitamin dan mineral (Tull, 1996). Makronutrisi terutama
protein berperan penting karena kaitannya yang erat dengan proses-proses
kehidupan. Semua hayat hidup sel berhubungan dengan zat gizi protein. Nama
protein berasal dari kata Yunani ‘protebos’ yang artinya “yang pertama” atau
“yang terpenting” (Sediaoetama, 2008).
Protein adalah makromolekul penting yang mana tersusun dari asam-asam
amino yang terhubung oleh ikatan peptida membentuk struktur kompleks tiga
dimensi (Stayanarayana dan Chakrapati, 2007). Molekul protein mengandung
unsur-unsur C, H, O, dan N. Selain itu, protein juga dapat mengandung unsur
belerang, fosfor, serta logam seperti seng dan besi (Tull, 1996). Telah banyak
studi tentang berapa banyak jumlah protein yang diperlukan oleh tubuh per
harinya untuk dapat memenuhi kebutuhan tubuh akan asam amino selama
beberapa tahun. Studi-studi tersebut menunjukkan bahwa kebutuhan protein untuk
orang dewasa normal adalah 0,8 g/kg berat badan. Kebutuhan ini sama untuk
wanita maupun pria (Forsythe, 1995).
Unsur khusus yang terdapat dalam protein dan tidak terdapat di dalam
analisis bahan makanan untuk menentukan kadar protein dengan menganggap
bahwa jumlah N yang terkandung sebanding dengan kadar protein di dalam
makanan (Sediaoetama, 2008).
2.1.1 Struktur protein
Protein tersusun atas unit-unit individual asam-asam amino. Setiap asam
amino memiliki gugus amin (NH2) pada salah satu dari atom karbon pusat dan
sisi lainnya merupakan gugus asam (COOH). Di dalam makanan ada 20 jenis
asam amino yang berbeda, masing-masing memiliki struktur dasar yang sama,
yang membedakan hanyalah gugus R pada salah satu sisinya. Gugus R yang
berbeda dapat bervariasi dari atom tunggal hidrogen hingga molekul kompleks
yang membuat setiap asam amino unik (Forsythe, 1995). Struktur dasar asam
amino dapat dilihat pada Gambar 1.
H
NH2 -C- COOH
R
Gambar 1. Struktur dasar asam amino (Forysthe, 1995)
Dalam molekul protein, asam-asam amino saling dirangkaikan melalui
reaksi antara gugus karboksil asam amino yang satu dengan gugus amin dari asam
amino yang lain, sehingga terbentuk ikatan yang disebut ikatan peptida. Ikatan
peptida ini merupakan ikatan tingkat primer. Dua molekul asam amino yang
saling diikatkan dengan cara demikian disebut ikatan dipeptida, bila tiga molekul
asam amino disebut ikatan tripeptida dan bila banyak disebut ikatan polipeptida.
Polipeptida yang hanya terdiri dari beberapa molekul asam amino disebut
dipertautkan dengan ikatan peptida tersebut merupakan struktur primer protein
(Sediaoetama, 2008). Struktur primer protein dapat dilihat pada Gambar 2.
Gambar 2. Struktur Primer Protein (Usmeningsih, 2008)
Rantai polipeptida berinteraksi lokal melalui ikatan hidrogen atau ikatan
sulfhidril membentuk suatu konformasi yang berbentuk seperti spiral yang disebut
α-helix ataupun seperti lembaran yang disebut β-sheet. Ada 13 atom yang terikat
dalam ikatan hidrogen pada α-helix dimana ikatan hidrogen ini berorientasi sejajar
dengan sumbu heliks. β-sheet terhubung secara lateral oleh lima atau lebih ikatan
hidrogen membentuk lembaran yang mana gugus asam dan basanya berorientasi
tegak lurus terhadap arah rantai. Konformasi ini dikenal sebagai struktur sekunder
protein(Brown dan Rogers, 1981). Gambar struktur sekunder protein dapat dilihat
pada Gambar 3.
Gambar 3. Struktur Sekunder Protein (Usmeningsih, 2008) Asam Amino
Struktur Primer Protein
adalah susunan rantai asam-asam amino.
Lembaran yang berlipat
Alfa heliks
Struktur Sekunder Protein
Struktur tersier protein mengarah pada interaksi rantai polipeptida dan
struktur sekunder. Struktur ini terbentuk oleh karena gaya-gaya pada gugusan
reaktif yang lebih lemah pada protein yaitu gugusan yang mengandung muatan
listrik dan gaya tarik Van der Waals membentuk konformasi tiga dimensi
(Sediaoetama, 2008). Struktur tersier protein dapat dilihat pada Gambar 4.
Gambar 4. Struktur Tersier Protein (Usmeningsih, 2008)
Struktur kuartener protein terbentuk bila protein mengandung dua atau
lebih rantai polipeptida yang mempunyai konfigurasi tiga dimensi. Dimana
rantai-rantai polipeptida ini saling berinteraksi membentuk struktur yang lebih
kompleks (Brown dan Rogers, 1981). Struktur kuartener protein dapat dilihat pada
Gambar 5.
Gambar 5. Struktur Kuartener Protein (Usmeningsih, 2008) Alfa heliks
Lembaran yang berlipat
Struktur Kuartener Protein
adalah protein yang mengandung lebih dari satu rantai polipeptida
Struktur Tersier Protein
Kombinasi dari struktur-struktur inilah yang memberikan struktur alamiah
yang khas pada molekul protein. Struktur alamiah kompleks ini diperlukan oleh
protein untuk dapat menjalankan fungsinya. Bila struktur stereometri alamiah ini
berubah atau rusak, maka protein tersebut akan kehilangan kesanggupannya untuk
memenuhi fungsi fisiologisnya (Sediaoetama, 2008).
2.1.2 Klasifikasi Protein
Klasifikasi protein dapat dibagi dua yaitu berdasarkan komponen
penyusun dan fungsi fisiologisnya. Protein berdasarkan komponen penyusunnya
terbagi tiga yaitu protein sederhana (simple protein) yang bila dihidrolisis
menghasilkan asam amino (albumin), protein kompleks (Complex/Conjugation
Protein) yang bila dihidrolisis menghasilkan berbagai jenis asam amino dan juga
komponen lain yang bukan protein seperti unsur logam, gugus fosfat, lipid,
karbohidrat dan asam nukleat (kromoprotein, lipoproterin, glikoprotein,
fosfoprotein, dan nukleoprotein) dan protein derivat yang merupakan produk
antara sebagai hasil hidrolisis parsial protein (albumosa, pepton dan peptida)
(Sediaoetama, 2008).
Berdasarkan fungsi fisiologisnya atau daya dukungnya bagi pertumbuhan
dan pemeliharaan jaringan, protein dibagi menjadi protein sempurna, protein
setengah sempurna dan protein tidak sempurna. Protein sempurna adalah protein
yang mengandung asam amino essensial lengkap baik macam maupun jumlahnya
sehingga mampu menyokong pertumbuhan dan pemeliharaan jaringan, contohnya
kasein dan albumin. Protein setengah sempurna adalah protein yang mengandung
asam amino essensial lengkap tetapi jumlahnya terbatas, protein ini tidak dapat
contohnya: legumin dan gliadin. Protein tidak sempurna adalah protein yang
mengandung asam amino essensial tidak lengkap, protein ini tidak dapat
menyokong pertumbuhan maupun untuk pemeliharaan jaringan, contohnya zein
(Suhardjo dan Kusharto, 2010).
2.1.3 Sumber Protein
Sumber protein dapat berasal dari hewani dan nabati. Sumber protein
hewani berupa daging ataupun organ-organ dalam seperti hati, pankreas, jantung,
paru-paru, jerohan (babat/gaster dan usus halus dan usus besar/iso), telur, susu,
ikan, kerang, jenis udang dan produk olahannya (Sediaoetama, 2008).
Sumber protein nabati berasal dari sumber padi-padian, biji-bijian,
kacang-kacangan, gandum dan produk olahannya. Contoh protein nabati yang bersumber
dari padi-padian: nasi, pasta, dan roti; untuk golongan kacang-kacangan: kacang
polong, kacang tanah, kacang kedelai, kacang merah, kacang almond, kacang
mente, dan sebagainya; dari biji-bijian: biji wijen, biji bunga matahari, dan biji
labu (Marshall, 2002).
Kacang-kacangan atau leguminosa merupakan sumber makanan penting
yang menyumbang zat nutrisi dalam makanan sehari-hari. Kacang-kacangan
menempati posisi kedua sebagai sumber nutrisi setelah kelompok padi-padian.
Kacang-kacangan telah lama dikenal sebagai sumber protein. Kandungan protein
pada kacang-kacangan dua kali lebih tinggi daripada padi-padian (Sathe dan
Deshpande, 2003), selain mudah diperoleh dan harganya terjangkau,
kacang-kacangan juga banyak mengandung asam amino yang dapat saling melengkapi
Kandungan kolesterol dan lemak jahatnya rendah serta kaya akan lesitin
yang mampu mengurangi kadar kolesterol darah, disamping itu juga mengandung
baik serat yang larut maupun tidak larut. Kandungan seratnya yang tinggi dapat
mempercepat pengeluaran ammonia dari tubuh (Almatsier, 2006).
Kacang-kacangan dibagi dalam beberapa suku yaitu Vicieae contohnya
kacang golongan peas dan lentils, suku Hedysareae contohnya golongan nuts dan
suku Phaseolaeae contohnya golongan beans dan peanuts (Sathe dan Deshpande,
2003). Kandungan protein dari beberapa jenis kacang-kacangan dapat dilihat pada
Tabel 1.
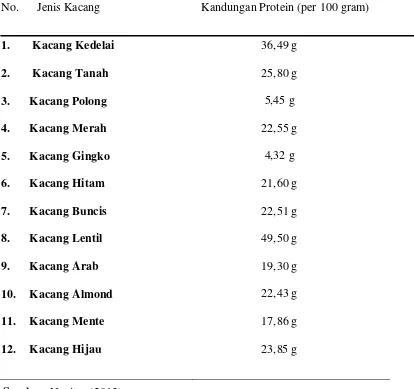
Tabel 1. Kandungan protein dari beberapa jenis kacang-kacangan
No. Jenis Kacang Kandungan Protein (per 100 gram)
1. Kacang Kedelai 2. Kacang Tanah 3. Kacang Polong 4. Kacang Merah 5. Kacang Gingko 6. Kacang Hitam 7. Kacang Buncis 8. Kacang Lentil 9. Kacang Arab 10. Kacang Almond 11. Kacang Mente 12. Kacang Hijau
36,49 g 25,80 g 5,45 g 22,55 g 4,32 g 21,60 g 22,51 g 49,50 g 19,30 g 22,43 g 17,86 g 23,85 g
Kacang-kacangan golongan peas, beans dan kacang tanah memiliki
cadangan protein yang tinggi dalam bijinya karena adanya bantuan dari bakteri
yang hidup pada akar tumbuhan tersebut, dimana bakteri-bakteri ini mengkonversi
unsur nitrogen dari udara untuk digunakan tumbuhan tersebut. Sementara
kacang-kacangan golongan nuts menyediakan protein berkualitas tinggi, akan
tetapi, kacang golongan ini juga tinggi kandungan lemak dan kalorinya sehingga
jarang dijadikan sumber nutrisi dalam makanan tetapi lebih sering dijadikan
selingan makanan (Eschleman, 1984).
2.1.4 Fungsi Protein
Protein dalam makanan berperan dalam pertumbuhan, pemeliharaan dan
perbaikan jaringan, sintesis enzim, sintesis hormon, sistem imun tubuh atau
mekanisme pertahanan tubuh dan juga sebagai cadangan energi (Tull, 1996).
Fungsi protein yang paling ditekankan adalah sebagai zat pembangun atau
pembentuk yang berperan dalam pertumbuhan dan pemeliharaan jaringan,
menggantikan sel-sel yang mati dan rusak terpakai. Sebagai zat pengatur, protein
mengatur proses-proses metabolisme dalam bentuk enzim dan hormon. Boleh
dikatakan bahwa semua proses metabolik (reaksi biokimia) di dalam tubuh diatur
dan dilangsungkan atas pengaturan enzim (Sediaoetama, 2008).
Protein yang berperan sebagai pembangun dan pembentuk adalah kolagen
yang menghubungkan tulang rawan, urat, otot dan pembuluh darah; elastin
sebagai penyambung jaringan ikat sendi; keratin sebagai protein pembentuk
rambut dan kuku. Peran protein dalam metabolisme ditunjukkan oleh kerja enzim
misalnya enzim hidrolase untuk proses hirolisis; lipase untuk pemecahan lemak.
harmonis antara proses metabolisme yang satu dengan yang lain. Contohnya
hormon pertumbuhan (GH) dan somatotropin (STH) yang berfungsi untuk
pertumbuhan dan perkembangan jaringan dapat dirusak oleh enzim tripsin dan
pepsin (Sumardjo, 2006).
Protein yang berperan dalam sistem imun tubuh adalah immunoglobulin
yang secara otomatis dibentuk oleh tubuh bila ada antigen yang masuk ke tubuh.
Sebagai zat pengangkut protein membawa ion dan molekul tertentu dari suatu
organ ke organ lainnya melalui aliran darah. Contohnya hemoglobin untuk
mengangkut oksigen dari paru-paru ke jaringan (Sumardjo, 2006).
Mengingat fungsi protein yang sangat penting, sudah selayaknya bila
protein ini diberikan perhatian dan tempat penting dalam penyediaan pangan, baik
bagi anak-anak maupun orang tua (Sediaoetama, 2008).
2.2 Pencernaan dan Metabolisme Protein
Pencernaan protein dalam tubuh terjadi ketika setiap asam amino terputus
dari rantai protein. Pencernaan protein secara enzimatik dalam saluran cerna
dimulai dari lambung. Protein oleh asam lambung didenaturasi kemudian pepsin
pada lambung akan menghidrolisis protein menjadi proteosa, pepton dan
polipeptida dengan bobot molekul rendah. Hasil hidrolisis ini kemudian masuk ke
usus halus. Pankreas akan melepas enzim-enzim karboksipeptidase, tripsin,
kimotripsin, aminopeptidase dan dipeptidase ke usus halus. Karboksipeptidase
akan memutus ikatan karbosil bebas pada ujung rantai polipeptida sedangkan
aminopeptidase akan memutus ikatan amin bebas pada ujung rantai lainnya.
polipeptida membentuk dipeptida yang kemudian oleh dipeptidase diubah menjadi
asam amino (Sumardjo, 2006).
Selanjutnya asam amino diabsorpsi, asam amino akan terdeposito di dalam
hati atau otot di dalam kantong asam amino untuk dapat digunakan pada sintesis
protein dalam tubuh. Setelah selesai makan, tubuh dalam kondisi anabolik. Ini
berarti bahwa tubuh telah siap untuk sintesis protein. Materi genetik dalam tubuh
yaitu Deoxyribo Nucleic Acid (DNA) menyediakan “blueprint” untuk sintesis
protein. DNA menyediakan informasi asam amino mana yang diperlukan dan
urutan protein apa yang harus disintesis. Selama seluruh asam amino tersedia di
dalam kantungnya, sintesis protein akan terus berlangsung. Sangatlah penting
bahwa semua asam amino tersedia dalam jumlah yang cukup ketika protein
disintesis. Struktur dan fungsi dari setiap rantai protein tergantung pada urutan
daripada asam-asam aminonya (Forsythe, 1995).
2.3 Penyakit yang berhubungan dengan Protein
Penyakit yang berkaitan dengan protein yaitu: 1) berdasarkan defisiensi
protein (penyakit utama) dan 2) penyakit penyerta.
1. Berdasarkan defisiensi protein
Defisiensi protein hampir selalu berkaitan dengan defisiens kalori.
Penyebab defisiensi protein dikenal ada dua, yaitu: 1) defisiensi kalori secara
ekstrim mengakibatkan terjadinya defisiensi protein disebut marasmus, 2) jumlah
kalori relatif mencukupi tetapi terjadi defisiensi protein yang ekstrim disebut
Manifestasi dari marasmus adalah pertumbuhan yang terhambat. Berat
badan penderita dibawah 60% berat badan standar sehingga penderita terlihat
sangat kurus seperti hanya terbungkus oleh kulit, di jaringan subkutan tidak
ditemukan adanya jaringan otot dan lemak. Keadaan ini disebut paniculus
adiposus. Karena tidak adanya jaringan otot dan lemak di subkutan, kulit
penderita menjadi kusut dan berlipat kurus (oldman face/monkey face). Pada
penderita kwashiorkor tubuhnya kurus tetapi berat badan penderita diatas 60%
berat badan standar. Penderita tampak apatis, kadar albumin dalam darah juga
turun drastis, terjadi udema akibat akumulasi cairan pada jaringan limfa dan
abdomen. Warna rambut penderita belang (flag sign phenomena), kulitnya juga
kasar, kering dan tampak garis-garis permukaan yang nyata (mosaic skin)
(Crowley, 2011).
2. Penyakit penyerta
Menurut Sediaoetama (2008), penderita defisiensi protein biasanya akan
mengalami infeksi yang merupakan penyakit penyerta. Hal ini terjadi karena
menurunnya daya imun tubuh secara umum sehingga lebih rentan terhadap
serangan berbagai penyakit infeksi. Karena infeksi penderita akan mengalami
demam, diare, dehidrasi, dan kadang kejang. Penyakit infeksi yang sering
dijumpai adalah:
a. Infeksi saluran nafas, terutama saluran nafas bagian atas.
b. Infeksi saluran cerna yang ditandai dengan gejala mencret-mencret.
Terapi untuk penderita defisiensi protein yang pertama harus ditanggulangi
adalah gejala infeksi akut seperti kejang, diare, dan dehidrasi. Kemudian
menangani infeksi spesifik sambil menangani kondisi kekurangan kalori protein
(KKP). Penanganan penyakit dilakukan dengan memberi makanan cair terlebih
dahulu dengan kalori dan zat gizi yang cukup. Konsentrasi zat diberi secara
parsial dan bertingkat. Bila penderita telah dapat bertahan dengan makanan cair
konsentrasi tinggi maka dilanjutkan dengan pemberian makanan semi padat
kemudian makanan padat (Sediaoetama, 2008).
2.4Pengaruh Pengolahan Terhadap Protein
Pada prinsipnya pengolahan pangan bertujuan untuk: (1) pengawetan,
pengemasan dan penyimpanan produk pangan; (2) mengubah bahan pangan
menjadi produk yang diinginkan; (3) mempersiapkan bahan pangan agar siap
dihidangkan. Salah satu cara pengolahan yang sering digunakan adalah
pemanasan seperti sterilisasi, pengeringan, penggorengan, perebusan, pengukusan,
pemanggangan, pengalengan, dan pasteurisasi. Hal-hal yang terjadi pada proses
pengolahan terhadap protein adalah a) reaksi Maillard yaitu reaksi antara asam
amino dengan gula pereduksi yang terutama terjadi pada penggorengan yang
menyebabkan timbul warna kecoklatan, b) pembentukan lisinolalanin karena
pengolahan protein dengan bahan yang bersifat alkali sehingga memutus ikatan
silang protein, toksisitas bila termakan, dan kerusakan ginjal, (c) rasemisasi asam
amino yaitu perubahan bentuk L asam amino menjadi bentuk D yang terjadi bila
protein diproses dengan penambahan basa, asam dan pada proses pemanggangan,
(e) interaksi protein dengan lemak teroksidasi menyebabkan protein bermodifikasi
amino yang mengandung sulfur akibat teroksidasi radikal bebas (Palupi, dkk.,
2007).
Penelitian oleh Sumiati (2008) pada ikan mujair (Tilapia moasambica)
membuktikan bahwa proses pengolahan yang berbeda akan mempengaruhi nilai
gizi terutama kandungan proteinnya. Kandungan protein ikan mujair menurun dari
62,97 g/100 g menjadi 59,84 g/100 g pada perebusan, 59,05 g/100 g pada
pengukusan, 57,78 g/100 g pada pemanggangan dan penurunan paling drastis
terjadi pada penggorengan yaitu menjadi 33,32 g/100 g.
2.5 Analisis Protein
Analisis protein dapat dilakukan dengan dua cara yaitu 1) secara langsung
menggunakan zat kimia yang spesifik terhadap protein, contohnya seperti dengan
pereaksi Biuret, Lowry, Bradford atau dengan metode pengikatan warna dimana
konsentrasi ditentukan berdasarkan kompleks warna yang terbentuk; 2) secara
tidak langsung dengan menghitung jumlah nitrogen yang terkandung di dalam
bahan, contohnya metode Kjeldahl dan metode Dumas dimana kadar protein
sebanding dengan total N yang terkandung di dalamnya (Rhee, 2005).
2.5.1 Metode Kjeldahl
Sejak abad ke-19, metode Kjeldahl telah dikenal dan diterima secara
universal sebagai metode untuk analisis protein dalam berbagai variasi produk
makanan dan produk jadi (Rhee, 2005). Penetapan kadar protein dengan metode
Kjeldahl merupakan metode empiris (tidak langsung) yaitu melalui penetapan
kadar N dalam bahan yang disebut protein kasar (Estiasih, dkk., 2012).
Prinsip metode Kjeldahl ini adalah senyawa-senyawa yang mengandung
bereaksi dengan asam pekat membentuk garam amonium. Kemudian ditambahkan
basa untuk menetralisasi suasana reaksi dan kemudian didestilasi dengan asam
dan dititrasi untuk mengatahui jumlah N yang dikonversi (Estiasih, dkk., 2012).
Tahapan kerja pada metode Kjeldahl dibagi tiga yaitu:
a. Tahap Dekstruksi
Pada tahap ini, sampel dipanaskan dengan asam sulfat pekat sehingga
terjadi destruksi menjadi unsur karbon (C), hidrogen (H), oksigen (O) dan
nitrogen (N) kemudian teroksidasi menjadi karbon monoksida (CO), karbon
dioksida (CO2) dan air. Unsur N akan bereaksi dengan asam sulfat membentuk
garam amonium sulfat. Untuk mempercepat proses destruksi maka ditambahkan
katalisator berupa campuran Na2SO4 dan HgO atau K2SO4 dan CuSO4. Gunning
menyarankan penggunaan katalisator K2SO4 dan CuSO4 karena sifat kalium sulfat
yang dapat menaikkan titik didih sehingga destruksi berlangsung lebih cepat dan
sempurna. Terkadang dapat pula ditambahkan selenium untuk mempercepat
proses oksidasi akan tetapi, selenium sifatnya lebih reaktif sehingga oksidasi
berlangsung sangat cepat yang memungkinkan hilangnya unsur nitrogen (Rohman
dan Sumantri, 2007). Menurut Chang (1998), reaksi pada tahap destruksi adalah:
H H H
-OOC-C- NH-C- COO- NH- C- COO- (NH4)2SO4
R R R
b. Tahap Destilasi
Garam amonium sulfat yang terbentuk dipecah menjadi ammonia (NH3)
dengan penambahan basa NaOH dan dipanaskan. Ammonia yang dilepas
ditampung dalam larutan asam. Agar kontak antara asam dan ammonia H2SO4
berlangsung sempurna maka ujung tabung destilasi harus tercelup sedalam
mungkin dalam larutan asam. Pada tahap destilasi dapat juga ditambahkan logam
Zn agar tidak terjadi superheating (percikan cairan atau timbulnya gelembung gas
yang besar) (Rohman dan Sumantri, 2007). Menurut Chang (1998), reaksi pada
tahap destilasi adalah:
(NH4)2SO4 + H2O + 2 NaOH 2 NH4OH + Na2SO4
NH4OH+ H2SO4 NH4HSO4 + H2O
c. Tahap Titrasi
Bila larutan asam yang digunakan untuk penampung destilat adalah asam
klorida dan asam sulfat maka sisa asam yang tidak bereaksi dengan amonia akan
bereaksi dengan larutan pentiter yaitu NaOH. Tetapi bila digunakan larutan
penampung destilat berupa asam borat maka banyaknya asam borat yang bereaksi
dengan ammonia dapat diketahui dengan mentritrasi ion amonium dengan
menggunakan pentiter HCl (Rohman dan Sumantri, 2007). Menurut Chang
(1998), reaksi pada tahap titrasi adalah sebagai berikut:
H2SO4 + 2NaOH Na2 SO4 + 2 H2O
Menurut Rohman dan Sumantri (2007), kadar protein dalam sampel dapat
dihitung dengan rumus:
Kadar = (� ������ −� ������) ��������,�14 ���
�� � 100%
dimana :
Faktor konversi untuk berbagai macam bahan dapat dilihat pada Tabel 2.
Tabel 2. Faktor konversi untuk berbagai macam bahan
N o
Bahan Faktor Konversi (FK)
1 Bir, sirup, biji-bijian, ragi, makanan
ternak, buah-buahan, teh, anggur
6,25
2 Beras 5,95
3 Roti, gandum, makaroni, bakmi 5,70
4 Kacang tanah 5,46
5 Kedelai 5,75
6 Kenari 5,18
7 Susu 6,38
Sumber: Rohman dan Sumantri (2007)
Keuntungan menggunakan metode Kjeldahl ini adalah dapat diaplikasikan
untuk semua jenis bahan pangan, tidak memerlukan biaya yang mahal untuk
pengerjaannya, dapat dimodifikasi sesuai kuantitas protein yang dianalisis.
Adapun kerugiannya adalah yang ditentukan adalah jumlah total nitrogen yang
terdapat didalamnya bukan hanya nitrogen dari protein, waktu yang diperlukan
relatif lebih lama (minimal 4 jam untuk menyelesaikannya), presisi yang lemah,
pereaksi yang digunakan ada yang bersifat beracun, korosif dan berbahaya bagi
kesehatan, dan adanya variasi faktor konversi untuk masing-masing sampel
(Chang, 1998).
2.5.2 Metode Spektrofotometri
Penentuan kadar protein dengan menggunakan instrumen dibagi menjadi
dua yaitu: 1) metode pengukuran langsung pada panjang gelombang 205 nm dan
280 nm dan 2) metode pembentukan warna dengan pereaksi tertentu (Simonian,
1. Metode pengukuran langsung pada panjang gelombang 205 nm dan 280 nm
Absorbansi pada panjang gelombang 205 nm dan 280 nm digunakan untuk
menghitung konsentrasi protein dengan terlebih dahulu distandarisasi dengan
protein standar. Metode ini dapat dengan mudah diaplikasikan dan sederhana,
cocok untuk larutan protein yang telah dimurnikan atau dimurnikan parsial.
Penetapannya berdasarkan absorbansi sinar ultraviolet oleh asam amino triptopan,
tirosin dan ikatan disulfida sistein yang menyerap kuat pada panjang gelombang
tersebut, terutama panjang gelombang 280 nm (Simonian, 2005).
Keuntungan metode ini adalah waktu yang diperlukan untuk analisis cepat,
memiliki sensitifitas yang baik, tidak ada gangguan dari ion ammonium dan
garam-garam buffer, larutan sampel masih dapat digunakan untuk analisis lain
selain analisis protein. Kerugian metode ini adalah asam nukleat juga memiliki
absorbansi yang kuat pada panjang gelombang 280 nm, susunan asam amino
aromatis dapat bervariasi untuk setiap sampel protein, larutan protein harus
benar-benar jernih dan tidak berwarna ataupun keruh (Chang, 1998).
2. Metode pembentukan warna dengan pereaksi tertentu
a. Pereaksi Biuret
Semua protein terususun dari asam-asam amino yang terhubung oleh
ikatan-ikatan peptida. Ion Cu2+ dari CuSO4 dalam suasana basa NaOH akan
membentuk kompleks dengan ikatan peptida protein (-CO-NH-), kompleks ini
memberikan akan warna sehingga konsentrasi protein dapat ditentukan dengan
spektrofotometer sinar tampak (Estiasih, dkk., 2012).
Pemilihan protein standar dapat menyebabkan kesalahan fatal dalam
Untuk analisis protein secara umum, standar Bovine Serum Albumin (BSA)
merupakan pilihan yang baik untuk analisis protein karena memiliki kemurnian
yang tinggi, dan harganya tidak terlalu mahal. Selain itu, Bovine Gamma Globulin
(BGG) juga merupakan pilihan yang baik bila akan digunakan untuk analisis
kadar protein immunoglobulin dalam tubuh, karena BGG memberikan warna dan
kurva yang sangat mirip dengan Immunoglobulin G (Ig G). Asam amino tunggal
dan dipeptida tidak akan memberikan reaksi dengan Biuret, akan tetapi tripeptida
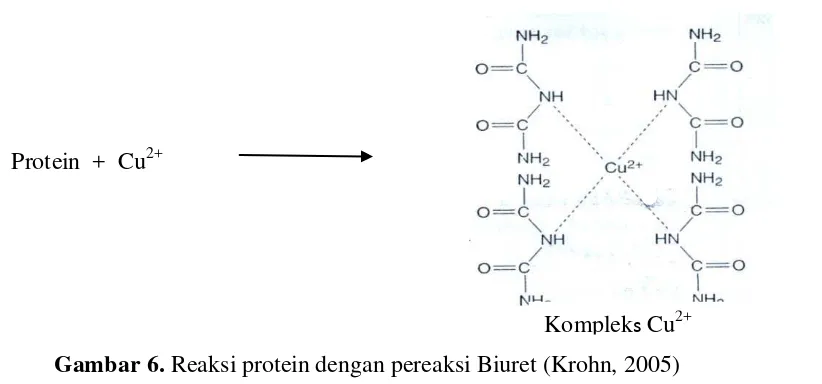
dan polipeptida akan membentuk kompleks chelat. Satu ion Cu2+ akanbereaksi
dengan empat sampai enam ikatan peptida. (Krohn, 2005). Reaksi protein dengan
pereaksi Biuret dapat dilihat pada Gambar 6.
Reaksi Biuret ini menunjukkan hasil yang positif melalui pembentukan
warna ungu, merah violet, atau biru violet. Intensitas warna yang terbentuk
sebanding dengan banyaknya ikatan peptida yang bereaksi. Pereaksi Biuret
merupakan dasar dari metode pembentukan warna yang paling sederhana untuk
penetapan konsentrasi total protein secara kuantitatif (Sumardjo, 2006; Krohn,
2005).
[image:40.595.120.531.382.574.2]Protein + Cu2+
Keuntungan dari metode ini adalah prosedur yang sederhana, tidak
memerlukan biaya yang mahal, waktu yang digunakan relatif singkat, deviasai
warna sangat sedikit bila dibandingkan dengan Lowry, Bradford dan metode
turbidimetri sehingga absorpsi warnanya relatif stabil, sangat sedikit senyawa
yang berinteraksi dengan pereaksi Biuret, dan tidak mendeteksi nitrogen dari
sumber non-protein. Kerugiannya adalah kurang sensitif dibandingkan dengan
Lowry dan Bradford, absorbansinya dapat dipengaruhi oleh asam empedu,
konsentrasi garam ammonium yang sangat tinggi, adanya variasi warna untuk
beberapa protein tertentu, bila bahan mengandung lemak dan karbohidrat yang
sangat tinggi dapat menyebabkan larutan menjadi buram sehingga tidak dapat
ditembus cahaya UV, dan karena metode ini bukan merupakan metode absolut
sehingga absorpsi warnanya perlu terlebih dahulu distandarisasi terhadap protein
murni seperti Bovine Serum Albumin (BSA) (Chang, 1998).
b. Pereaksi Lowry
Pada tahun 1951, Oliver H. Lowry memperkenalkan penggunaan pereaksi
ini yang merupakan perkembangan lebih lanjut dari Biuret. Metode ini diakui
cukup sensitif untuk menentukan konsentrasi total protein (Krohn, 2005).
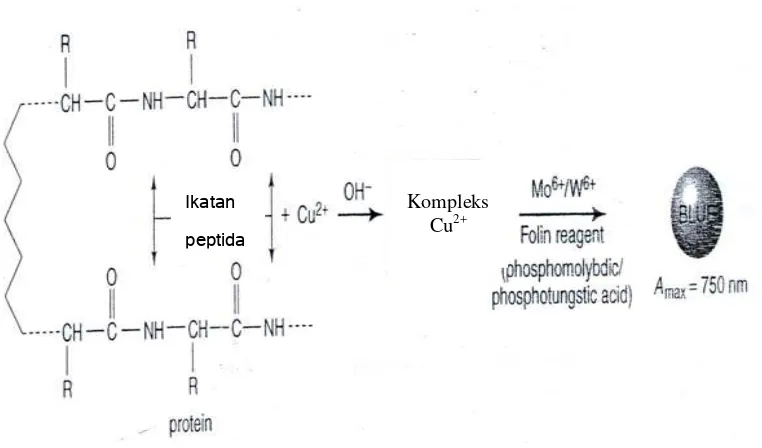
Prinsipnya tidak jauh berbeda dengan Biuret, dimana ion tembaga akan
membentuk kompleks dengan ikatan peptida kemudian dengan adanya pereaksi
fosfotungstik-fosfomolibdat akan mengoksidasi rantai samping asam amino
sehingga menghasilkan warna dan konsentrasi protein dapat diukur dengan
spektrofotometer (Chang, 1998). Reaksi protein dengan pereaksi Lowry dapat
Gambar 7. Reaksi protein dengan pereaksi Lowry (Krohn, 2005) Keuntungan analisis dengan pereaksi ini adalah memiliki sensitifitas yang
lebih baik dibanding Biuret, lebih spesifik dibanding metode lain, dan waktu
untuk analisis lebih singkat bila dibandingkan dengan metode Kjeldahl (sekitar
1-1,5 jam). Kerugian analisis dengan pereaksi Lowry adalah variasi warnanya
yang lebih banyak dibanding dengan pereaksi Biuret, warna yang terbentuk tidak
secara tepat menggambarkan konsentrasi protein, reaksinya sangat dipengaruhi
oleh senyawa-senyawa pengganggu seperti glukosa, lemak, garam buffer fosfat,
senyawa-senyawa yang mengandung amin, gula pereduksi, garam ammonium
dalam konsentrasi tinggi dan senyawa sulfhidril (Chang, 1998).
c. Pereaksi Bradford
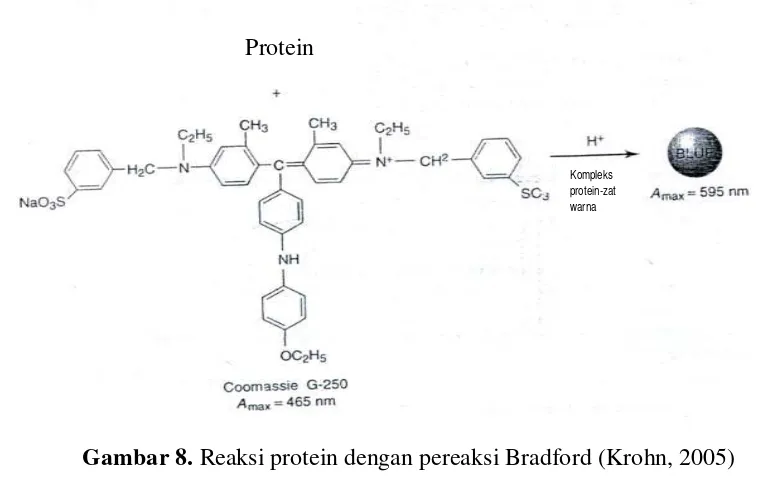
Pada tahun 1976, Marion Bradford memperkenalkan penggunaan pereaksi
Coomassive Blue untuk penetapan secara kuantitatif konsentrasi total protein.
Coomasive Blue ini akan berinteraksi dengan gugus samping asam amino yang
memiliki ikatan rangkap sehinngga terjadi perubahan warna pereaksi dari merah Ikatan
peptida
menjadi biru (Chang, 1998). Reaksi protein dengan pereaksi Bradford dapat
dilihat pada Gambar 8 dibawah ini.
Keuntungan analisis dengan pereaksi Bradford adalah tidak menggunakan
pereaksi yang berbahaya, hanya protein yang akan diukur, memiliki presisi yang
lebih tinggi dibanding metode Kjeldahl, waktu analisis yang diperlukan singkat,
biaya yang diperlukan tidak terlalu mahal, dan cukup akurat untuk digunakan
dalam analisis kandungan total protein dalam makanan. Adapun kerugiannya
adalah kandungan asam amino yang berbeda akan mempengaruhi kapasitas
pembentukan warna, senyawa gula, kalsium dan fosfat dapat mengganggu ikatan
warna sehingga akan mengganggu hasil analisis, dan adanya variasi absorbansi
yang signifikan tegantung jenis protein (Chang, 1998).
2.5.3 Metode Titrasi Formol
Prinsip metode ini adalah dengan adanya air dan penambahan Kalium
oksalat, protein akan dihidrolisis menjadi asam-asam amino. Selanjutnya dengan
[image:43.595.112.499.140.385.2]penambahan formaldehid akan memblokade gugus basa asam amino membentuk
Gambar 8. Reaksi protein dengan pereaksi Bradford (Krohn, 2005) Protein
gugus dimethilol sehingga tidak mengganggu reaksi antara NaOH dengan gugus
asam dari asam amino dan konsentrasi protein dapat ditentukan. Titrasi formol ini
kurang tepat untuk menentukan kadar protein dam lebih tepat digunakan untuk
menunjukkan proses hidrolisis protein (Estiasih, dkk., 2012).
2.5.4 Metode Dumas
Pada metode ini sampel dioksidasi pada suhu sangat tinggi (700-900°C).
Hasil oksidasi menghasilkan gas O2, N2 dan CO2. Gas nitrogen yang dilepaskan
dikuantitasi menggunakan kromatografi gas dengan detektor konduktivitas termal
(Thermal Detector Conductivity/TDC) kemudian jumlah nitrogen yang diperoleh
dikonversi. Jumlah nitrogen dalam sampel sebanding dengan kadar proteinnya
(Pomeranz dan Meloan, 1987).
Keuntungan metode ini adalah merupakan metode alternatif dari metode
Kjeldahl tetapi waktu analisis yang diperlukan lebih singkat dari metode Kjeldahl,
tidak menggunakan senyawa yang berbahaya, banyak sampel dapat diukur
sekaligus karena perkembangan alatnya yang sudah menggunakan sistem
otomatis. Adapun kekurangan metode ini adalah membutuhkan instrumen analisis
yang mahal, tidak mengukur kadar protein yang sesungguhnya karena yang diukur
adalah total nitrogen sehingga nitrogen non-protein juga terukur sebagai protein,
memiliki variasi faktor konversi, membutuhkan sampel dalam jumlah besar untuk
analisis (Chang, 1998).
2.6 Pengalengan
Sistem pengawetan pangan secara umum adalah menghambat pertumbuhan
mikroba. Pada akhir tahun 1795, Nicolas Appert, seorang pembuat kembang gula
dalam suatu kemasan tertutup tetap awet bila kemasan tersebut tidak dibuka lagi
atau tutupnya tidak bocor. Setelah beliau menghabiskan sepuluh tahun untuk
membuktikannya, proses tersebut disebutnya dengan “seni Appertisasi”.
Berdasarkan penemuan oleh Appert inilah pengawetan dengan pengalengan mulai
dikembangkan. Pada tahun 1810, Peter Durant membuat hak paten untuk kemasan
gelas dan logam untuk mengemas bahan pangan. Kemasan logam ini terbuat dari
timah yang tebal, kasar dan sulit ditutup yang disebut canisters. Istilah can atau
kaleng diduga berasal dari kata canisters tersebut (Desrosier, 2008).
Appert mensyaratkan bahwa kemasan bahan pangan harus ditutup dan
dipanaskan dengan hati-hati dan kebersihan adalah hal yang penting dalam
keseluruhan proses karena mikrobalah yang merupakan agensia pembusuk. Proses
Appertisasi selalu menggunakan istilah kedap (hermetic) yang berarti penutupan
rapat sehingga dapat mencegah terjadinya pembusukan dan fermentasi.
Organisme tertentu masih resisten terhadap panas dan mampu membusukkan
makanan kaleng walupun sudah dipanaskan pada tingkat tertentu. Oleh karena itu,
selain proses pemanasan, proses pendinginan juga merupakan hal yang penting,
kaleng harus segera didinginkan agar organisme termofil yang masih hidup
selama proses pemanasan dapat dimatikan (Desrosier, 2008).
Pengalengan hingga kini masih dianggap sebagai salah satu metode
pengawetan pangan yang cukup efektif untuk mempertahankan daya simpan
bahan. Proses pengalengan secara umum meliputi proses preparasi bahan dimana
bahan dicuci kemudian disortasi, dikuliti dan direndam dalam air bersuhu
85-95°C yang disebut blanching. Blanching merupakan salah satu proses penting
mengurangi jumlah mikroba dan mengurangi gas sehingga membantu proses
pengvakuman. Setelah preparasi selesai, bahan diisikan ke dalam kaleng beserta
bahan-bahan tambahan lain yang diperlukan. Proses pengisian harus
memperhatikan berat bahan dan volume ruang pengisian. Selanjutnya, kaleng
dijenuhkan dengan metode pengaliran uap panas dan segera disegel agar tutup
kaleng dapat menutup dengan rapat dan baik. Yang terakhir adalah proses
sterilisasi. Proses ini dilakukan dengan cara sterilisasi panas pada suhu diatas
130°C (Ramaswamy dan Chen, 2004).
Keunggulan dari metode pengawetan dengan pengalengan adalah hampir
semua bahan pangan dapat diawetkan dengan metode ini, mutunya stabil baik
dalam skala besar maupun kecil, dapat digunakan segera bila diperlukan, daya
simpannya lebih lama dibandingkan bahan segarnya, teksturnya mendekati tekstur
bahan segar, kemasan kaleng melindingi bahan dari partikel-partikel asing dari
luar, gas-gas, tekanan udara baik dari dalam maupun dari luar kaleng maupun
benturan yang dapat merusak mutu bahan (Winarno, 1995).
Akan tetapi, pengalengan ini juga memiliki beberapa kelemahan,
diantaranya adalah penambahan garam dengan konsentrasi tinggi dan bahan
pengasam dimana garam dan asam dapat mengakibatkan terjadinya kerusakan
protein, di samping itu juga harus melalui beberapa tahap pemanasan dalam
prosesnya. Sebelum dikalengkan, bahan harus direndam terlebih dahulu dalam air
panas bersuhu 85-95°C untuk menghentikan aktivitas enzimnya, kemudian kaleng
dibuat vakum dengan metode penjenuhan uap panas. Sterilisasi untuk
pengalengan juga dilakukan dengan pemanasan pada suhu diatas 130°C.
menyebabkan penurunan kandungan nutrisi bahan makanan terutama zat yang
tidak tahan panas seperti vitamin dan protein (Ramaswamy dan Chen, 2004).
Selain suhu pemanasan dan lama pemanasan, kecepatan penetrasi panas
dalam makanan kaleng juga turut serta memberikan peranan terhadap nilai gizi
makanan kaleng. Ada beberapa faktor yang mempengaruhi kecepatan penetrasi
panas dalam makanan kaleng yaitu: luas permukaan kaleng, volume kaleng, sifat
dan komposisi dari wadah kaleng yang digunakan, konsistensi produk, suhu
pemanasan, kecepatan rotasi atau agitasi kaleng, isi dan ruang di atas kaleng (head
space) dan metode pengemasan makanan ke dalam kemasan kaleng (Buckle, dkk.,
1985).
Menurut penelitian yang dilakukan oleh Aberoumand (2011) pada ikan tuna
Orcynopsis unicolor dan Euthynus affinis menunjukkan kadar protein yang
ditetapkan dengan metode Kjeldahl pada kedua spesies ikan tuna tersebut
menurun setelah dikalengkan. Namun, setelah penyimpanan selama enam bulan
dengan rentang pengukuran dua bulan menunjukkan adanya peningkatan kadar
protein sekitar 2-3%. Hal yang sama juga ditunjukkan oleh penelitian Maheswa,
dkk (2011) pada ikan tuna Euthynus affinis dalam medium kari dengan variasi
kaleng yang mengandung timah dan kaleng bebas timah dimana kadar protein
juga menurun dari sebelum dikalengkan dengan setelah dikalengkan dan kadar
BAB III
METODE PENELITIAN
Metode yang digunakan dalam penelitian ini adalah metode deskriptif,
yaitu penetapan kadar protein dalam sampel. Penelitian dilakukan di
Laboratorium Penelitian Fakultas Farmasi dan Laboratorium Teknologi Pangan
Fakultas Pertanian Universitas Sumatera Utara pada bulan Januari hingga April
2013.
3.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah seperangkat
instrumen Spektrofotometer (Shimadzu model UV-1800), neraca analitik (Mattler
Toledo), centrifuge (Hitachi), lumpang, stamfer, gelas ukur (Orberol), labu ukur
(Orberol), maat pipet (Pyrex), gelas beker (Pyrex), erlenmeyer (Pyrex), tabung
Kjeldahl, hot plate, magnetic stirrer, selang air, pendingin liebig, buret, statis,
klem, batang pengaduk, bola pengisap, pipet tetes, blender, kertas saring, spatula
dan corong.
3.2 Bahan-bahan
Bahan – bahan yang digunakan dalam penelitian ini bila tidak dinyatakan
lain adalah berkualitas pro analisis (E. Merck) antara lain Bovine Serum Albumin
(BSA) (BDH Chemicals), aquadestilata, K Na Tartrat, KI, CuSO4, K2SO4, H2SO4
98% v/v, NaOH, metilen biru, metilen merah, dan alkohol 96%.
3.3 Pengambilan Sampel
Pengambilan sampel dilakukan secara purposif, artinya sampel dipilih
dikehendaki telah ada dalam anggota sampel yang diambil (Nasution, 2003).
Sampel yang digunakan adalah kacang polong (Hosen), kacang tanah (Ayam
Brand), kacang buncis (Daucy), kacang gingko (Mili) dan kacang merah (SW)
yang seluruhnya merupakan kacang yang dikalengkan, masing-masing diambil
satu kaleng dan diperoleh dari Brastagi Supermarket, Medan. Spesifikasi daftar
sampel dapat dilihat pada Lampiran 1 halaman 51-53.
3.4 Prosedur Penelitian 3.4.1 Pembuatan pereaksi
Pereaksi Biuret dibuat dengan mencampurkan 3 g CuSO4.5H2O dan 9 g
Na K Tartrat ke dalam 500 ml NaOH 0,2 N kemudian ditambahkan 5 g KI dan
diencerkan dengan NaOH 0,2 N hingga 1000 ml (Estiasih, dkk., 2012). H2SO4
0,02 N dibuat dengan mencampurkan 0,55 ml H2SO4 pekat 98% dan aquadestilata
ke dalam labu hingga 1000 ml. NaOH 0,02623 N dibuat dengan mencampurkan
0,8 g NaOH dan aquadestilata dalam labu hingga 1000 ml (Vogel, 1985).
Indikator Mengsel dibuat dengan mencampurkan 100 mg metilen merah dan
30 mg metilen biru dalam 60 ml alkohol 96% kemudian diencerkan dengan
aquadestilata yang telah didihkan hingga 100 ml (Sudarmadji, dkk., 1989).
3.4.2 Pembuatan larutan induk baku
Untuk larutan induk baku 1 (LIB 1), ditimbang 250 mg baku Bovine
Serum Albumin, dimasukkan ke dalam labu ukur 50 ml dan dicukupkan hingga
garis batas dengan aquadestilata (C= 5000 mcg/ml). Untuk larutan induk baku 2
(LIB 2) ditimbang 1000 mg baku albumin, dimasukkan ke dalam labu ukur 50 ml
3.4.3 Pembuatan kurva serapan Bovine Serum Albumin
Untuk pembuatan kurva serapan Bovine Serum Albumin, dipipet 3 ml dari
LIB 1 kemudian dimasukkan ke dalam labu ukur 10 ml, ditambahkan 6 ml
pereaksi Biuret, dicukupkan hingga garis batas dengan aquadestilata dan
dihomogenkan. Didiamkan selama kurang lebih 30 menit dan diukur dengan
spektrofotometer pada rentang panjang gelombang 400-800 nm.
3.4.4 Penentuan waktu optimum
Untuk penentuan waktu optimum (operating time), dipipet 3 ml dari LIB 1
dan dimasukkan ke dalam labu ukur 10 ml. Kemudian ditambahkan 6 ml pereaksi
Biuret, jalankan pengukur waktu dan dicukupkan hingga garis batas dengan
aquadestilata dan dihomogenkan. Kemudian diukur dengan spektrofotometer pada
panjang gelombang maksimum 553.36 nm setelah satu menit. Penentuan waktu
optimum dilakukan selama 60 menit.
3.4.5 Pembuatan kurva kalibrasi Bovine Serum Albumin
Untuk pembuatan kurva kalibrasi Bovine Serum Albumin, dipipet dari
LIB 2 0,5 ml (C= 1000 mcg/ml), 0,75 ml (C= 1500 mcg/ml), 1 ml (C=
2000 mcg/ml), 1,25 ml (C= 2500 mcg/ml), 1,5 ml (C= 3000 mcg/ml), 1,75 ml
(C= 3500 mcg/ml), 2 ml (C= 4000 mcg/ml) dan 2,25 ml (C= 4500 mcg/ml) ke
dalam labu ukur 10 ml. Kemudian ditambahkan 6 ml pereaksi Biuret dan
dicukupkan hingga garis tanda dengan aquadestilata dan dihomogenkan.
Didiamkan selama kurang lebih 17-22 menit dan diukur absorbansinya pada
3.4.6 Preparasi sampel
Preparasi sampel dilakukan dengan cara sampel kurang lebih 30 g dibilas
terlebih dahulu dengan aquadestilata dan ditiriskan pada suhu kamar. Kemudian
ditimbang seksama kurang lebih 25 g, dihaluskan dengan menggunakan waring
blender dan dicukupkan volumenya hingga 50 ml dalam labu ukur. Selanjutnya,
larutan yang diperoleh disaring dengan kertas saring kemudian disentrifugasi pada
kecepatan 11000 rpm selama 10 menit. Supernatan hasil sentrifugasi didekantasi
untuk dipergunakan selanjutnya (protein yang terdapat dalam supernatan adalah
protein terlarut) (Estiasih, dkk., 2012).
3.4.7 Penetapan kadar protein
Larutan protein dipipet 3 ml lalu dimasukkan ke dalam labu ukur 10 ml.
Kemudian ditambahkan 6 ml pereaksi Biuret, dicukupkan hingga garis tanda
dengan aquadestilata dan dihomogenkan. Didiamkan selama kurang lebih
17-22 menit dan diukur absorbansinya pada panjang gelombang maksimum
553.36 nm (Estiasih, dkk., 2012). Skema prosedur preparasi dan analisis protein
secara spektrofotometri sinar tampak dapat dilihat pada Lampiran 2 halaman 54.
Menurut Gandjar dan Rohman (2008), konsentrasi dapat dihitung dengan
mensubstitusikan absorbansi sampel pada Y dari persamaan regresi: Y = ax + b,
dimana:
Y = absorbansi sampel X = konsentrasi sampel a = slope
b = intersep
Kadar protein dalam sampel dapat dihitung dengan cara:
dimana K = kadar total analit dalam sampel (mg/g) X = konsentrasi setelah pengenceran (mcg/ml) V = volume sampel (ml)
Fp = faktor pengenceran BS = berat sampel (g)
3.4.8 Analisis statistik data penetapan kadar protein
Data penetapan kadar protein dianalisis secara statistik menggunakan uji t.
Menurut Gandjar dan Rohman (2008), untuk menghitung Standar Deviasi (SD)
digunakan rumus:
SD =
�
∑(�−��)2
�−1
Dasar penolakan data adalah apabila thitung ≥ ttabel pada taraf kepercayaan
99% dengan nilai α = 0,01, dimana thitung dihitung dengan rumus:
t
hitung=
�
�−�� ��√�
�
dimana:
SD = Standar Deviasi X = Kadar protein
�� = Kadar rata-rata protein n = Jumlah perlakuan
Menurut Harvey (2000), kadar sebenarnya dapat dihitung dengan rumus:
μ =
��
± t
tabelx
�� √�dimana:
μ
=
kadar sebenarnya3.5 Verifikasi Metode
Verifikasi metode bertujuan untuk mengevaluasi bahwa kinerja sistem
memenuhi standar yang dipersyaratkan oleh metode tersebut (Watson, 2010). Uji
verifikasi yang dilakukan meliputi uji kecermatan/akurasi, keseksamaan/presisi,
batas deteksi dan batas kuantitasi.
3.5.1 Kecermatan/Akurasi
Dalam penelitian ini, uji kecermatan dilakukan dengan metode
penambahan baku (Standard Addition). Sampel diperlakukan sama seperti pada
saat preparasi. Sebelum dicukupkan volumenya pada labu ukur, ditambahkan
baku Bovine Serum Albumin yang telah ditimbang seksama setara kurang lebih
15 mg/g berat sampel. Selanjutnya, prosedur dilakukan sama seperti perlakuan
pada penetapan kadar protein sampel. Hasil uji kecermatan dinyatakan sebagai
persen perolehan kembali.
Menurut