ISOLASI SENYAWA FLAVONOIDA DARI KULIT BUAH
RAMBUTAN (
Nephellium lappaceum
L.)
SKRIPSI
DEWI F SIRINGORINGO
100802030
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ISOLASI SENYAWA FLAVONOIDA DARI KULIT BUAH
RAMBUTAN (
Nephellium lappaceum
L.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar sarjana sains
DEWI F SIRINGORINGO
100802030
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ISOLASI SENYAWA FLAVONOIDA DARI KULIT
BUAH RAMBUTAN (Nephellium lappaceum L.)
Kategori : SKRIPSI
Nama Mahasiswa : DEWI F SIRINGORINGO
Nomor Induk Mahasiswa : 100802030
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Agustus 2014
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Sovia Lenni, M.Si Lamek Marpaung, M.Phil, Ph.D
NIP. 1975 1018 2000 032001 NIP. 1952 0828 1982 031001
Diketahui/ Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI KULIT BUAH RAMBUTAN
(Nephellium lappaceum L.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Agusutus 2014
PENGHARGAAN
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Pengasih dan Maha Penyayang atas segala penyertaan-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan tugas akhir ini.
Ucapan terima kasih saya sampaikan kepada Bapak Lamek Marpaung, M.Phil, Ph.D dan Ibu Dr. Sovia Lenni, M.Si selaku dosen pembimbing yang telah banyak memberikan arahan, bimbingan, ilmu dan waktu selama penulis melakukan penelitian dan penulisan tugas akhir ini hingga selesai. Ucapan terima kasih yang sebesar-besarnya penulis sampaikan kepada kedua orang tua tercinta, Ayah tercinta J. Siringoringo dan Ibu tercinta M. Tambunan juga kakak dan adik-adik tercinta (Tutur, Jamot, Okto,dan Putri) juga Tante Nelli, Zetro, dan Eska yang selalu memberikan kasih sayang dan dukungan dalam hal moral dan materi, serta telah berjuang tak kenal lelah dalam memberikan yang terbaik dalam kehidupan penulis, serta seluruh keluarga besar yang selalu memberikan motivasi dan semangat kepada penulis. Ucapan terima kasih juga penulis ucapkan kepada Ketua dan Sekretaris Departemen Kimia FMIPA USU, Ibu Dr. Rumondang Bulan Nst, MS dan Bapak Drs. Albert Pasaribu, M.Sc serta Bapak Dr. Mimpin Ginting, Msi yang telah bayak memberikan nasihat dan masukan selama penulis menjalani masa kuliah. Bapak dan Ibu dosen bidang Kimia Bahan Alam Hayati serta seluruh dosen Departemen Kimia FMIPA USU. Terima kasih juga penulis sampaikan kepada rekan-rekan asisten Kimia Bahan Alam Hayati FMIPA USU (Agnes, Berkat, Doni, Siska, dan Anita), teman-teman seperjuangan dalam penelitian dan teman-teman stambuk 2010 dan untuk sahabat-sahabat tercinta (Laura, Lina, Mei, Lia, Della, Melda, dan Gusti) yang telah memberikan motivasi dan bantuan kepada penulis. Dan penulis juga mengucapkan terimakasih kepada seluruh teman, saudara, dan kerabat yang telah banyak membantu dalam penyelesaian tugas akhir ini, tetapi tidak bisa saya tuliskan satu per satu.
Tuhan Yesus Memberkati.
ISOLASI SENYAWA FLAVONOIDA DARI KULIT BUAH RAMBUTAN
(Nephellium lappaceum L.)
ABSTRAK
Isolasi senyawa flavonoida yang terkandung di dalam kulit buah rambutan
(Nephellium lappaceum L.) dilakukan dengan maserasi dengan pelarut metanol. Ekstrak pekat metanol dilarutkan dengan etil asetat secara berulang-ulang sampai larutan tersebut negatif flavonoida. Ekstrak pekat etil asetat dilarutkan dengan metanol dan dipartisi dengan n-heksan. Ekstrak metanol pekat Kemudian dihidrolisa dengan HCl 2 N dan sambil dipanaskan. Filtratnya kemudian dipartisi dengan kloroform hingga bening. Ekstrak kloroform di kolom kromatografi dengan eluen N-heksan : Etil Asetat (70:30)v/v dan dimurnikan dengan preparatif dan direkristalisasi menghasilkan kristal merah kecoklatan sebanyak 12 mg. dengan harga Rf=0,43. Selanjutnya dianalisis dengan spektrofotometer UV-Visible, Spektrofotometer Inframerah (FT-IR), dan spektrometer Resonansi Magnetik Inti Proton (1H-NMR). Dari data analisis dan interpretasi spektroskopi, mengindikasikan bahwa senyawa hasil isolasi yang diperoleh adalah senyawa flavonoida golongan isoflavon.
ISOLATION OF FLAVONOID FROM THE RINDS OF RAMBUTAN
(Nephellium lappaceum L.)
ABSTRACT
Isolation of flavonoid compounds from the rinds of rambutan (Nephellium lappaceum
L.) has been done with maceration by methanol solvent. The concentrated extract then dissolved with aethyl acetate until the solution negative flavonoid. The concentrated extract of aethyl acetate then dissolved with methanol and partition extracted with N-hexane. The concentrated extract of methanol then acided by HCl 2 N while heated. The filtrate continue partition extracted with chloroform to get the flavonoid compound. The concentrated chloroform extract, which is total flavonoid was analysed with thin layer chromatography, then separated with column chromatography with eluent N-hexane: aethyl acetate (70:30)v/v. The compounds was purified with TLC preparative yielding brownish-red crystall with weight 12 mg with Rf= 0,43. The compound further identified analysis by using spectroscopy ultraviolet Visible (UV-Vis), Fourier Transform Infra Red Spectroscopy (FT-IR), and Proton
Nuclear Magnetic Resonancy Spectroscopy (1H-NMR) was yielded flavonoid is
isoflavone.
DAFTAR ISI
Daftar Tabel viii
Daftar Gambar ix
Daftar Lampiran x
Bab 1 Pendahuluan 1
2.2. Senyawa Organik Bahan Alam 6
2.3. Senyawa Flavonoida 9
Bab 3 Metodologi Penelitian 28
3.1 Alat-alat 28
3.2 Bahan-bahan 29
3.3.1 Penyediaan Sampel 29
DAFTAR TABEL
Halaman
Tabel 2.1 Golongan – Golongan Flavonoida Menurut Harbone 18
Tabel 2.2 Rentang Serapan Spektrum UV-Tampak Flavonoida 25
Tabel 4.1 Serapan Pada Analisis Spektrofotometer FT-IR 39
DAFTAR GAMBAR
Halaman
Gambar 2.1 Kerangka Dasar Senyawa Flavonoida 10
Gambar 4.1 Spektrum UV-Visible Senyawa Hasil Isolasi 37
Gambar 4.2 Spektrum FT-IR Senyawa Hasil Isolasi 38
Gambar 4.3 Spektrum 1H-NMR Senyawa Hasil Isolasi 40
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Gambar Buah Rambutan 48
Lampiran 2. Kromatogram Lapis Tipis Ekstrak Pekat Kloroform Kulit Buah Rambutan Sebelum Kromatografi Kolom
49
Lampiran 3. Kromatogram Lapis Tipis Ekstrak Pekat Lapisan Kloroform Kulit Buah Rambutan Tipis Penggabungan Fraksi
50
Lampiran 4. Kromatogram Lapis Tipis Senyawa Hasil Isolasi 51
Lampiran 5. Spektrum Ultraviolet-Visible Beberapa Senyawa Flavonoida 52
Lampiran 6. Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi pada δ= 3,7- n 7, 5 ppm
53
ISOLASI SENYAWA FLAVONOIDA DARI KULIT BUAH RAMBUTAN
(Nephellium lappaceum L.)
ABSTRAK
Isolasi senyawa flavonoida yang terkandung di dalam kulit buah rambutan
(Nephellium lappaceum L.) dilakukan dengan maserasi dengan pelarut metanol. Ekstrak pekat metanol dilarutkan dengan etil asetat secara berulang-ulang sampai larutan tersebut negatif flavonoida. Ekstrak pekat etil asetat dilarutkan dengan metanol dan dipartisi dengan n-heksan. Ekstrak metanol pekat Kemudian dihidrolisa dengan HCl 2 N dan sambil dipanaskan. Filtratnya kemudian dipartisi dengan kloroform hingga bening. Ekstrak kloroform di kolom kromatografi dengan eluen N-heksan : Etil Asetat (70:30)v/v dan dimurnikan dengan preparatif dan direkristalisasi menghasilkan kristal merah kecoklatan sebanyak 12 mg. dengan harga Rf=0,43. Selanjutnya dianalisis dengan spektrofotometer UV-Visible, Spektrofotometer Inframerah (FT-IR), dan spektrometer Resonansi Magnetik Inti Proton (1H-NMR). Dari data analisis dan interpretasi spektroskopi, mengindikasikan bahwa senyawa hasil isolasi yang diperoleh adalah senyawa flavonoida golongan isoflavon.
ISOLATION OF FLAVONOID FROM THE RINDS OF RAMBUTAN
(Nephellium lappaceum L.)
ABSTRACT
Isolation of flavonoid compounds from the rinds of rambutan (Nephellium lappaceum
L.) has been done with maceration by methanol solvent. The concentrated extract then dissolved with aethyl acetate until the solution negative flavonoid. The concentrated extract of aethyl acetate then dissolved with methanol and partition extracted with N-hexane. The concentrated extract of methanol then acided by HCl 2 N while heated. The filtrate continue partition extracted with chloroform to get the flavonoid compound. The concentrated chloroform extract, which is total flavonoid was analysed with thin layer chromatography, then separated with column chromatography with eluent N-hexane: aethyl acetate (70:30)v/v. The compounds was purified with TLC preparative yielding brownish-red crystall with weight 12 mg with Rf= 0,43. The compound further identified analysis by using spectroscopy ultraviolet Visible (UV-Vis), Fourier Transform Infra Red Spectroscopy (FT-IR), and Proton
Nuclear Magnetic Resonancy Spectroscopy (1H-NMR) was yielded flavonoid is
isoflavone.
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Flavonoida merupakan kandungan khas tumbuhan hijau dengan mengecualikan alga. Flavonoida sebenarnya terdapat pada semua bagian tumbuhan termasuk akar, kayu, kulit, tepung sari, nektar, bunga, buah, dan biji. Hanya sedikit saja catatan yang melaporkan adanya flavonoida pada hewan (Markham,1988).
Flavonoida yang terdapat di dalam tumbuhan dapat digunakan sebagai pelindung tubuh manusia dari radikal bebas dan dapat mengurangi resiko terjadinya penyakit kanker dan peradangan (Nesa, 2003).
Flavonoida adalah senyawa yang mengandung C15 terdiri atas dua inti fenolat
yang dihubungkan dengan tiga satuan karbon (Sastrohamidjojo, 1996).
Indonesia juga diketahui memiliki kekayaan keanekaragaman hayati terbesar di dunia dengan kurang lebih 30.000 jenis tumbuh-tumbuhan berikut biota laut. Dari sekian besar jumlah tersebut baru sekitar 940 spesies yaang diketahui berkhasiat melalui penelitian kimia dan hanya sekitar 180 spesies diantaranya yang dimanfaatkan dalam temuan obat tradisional oleh industri obat tradisional Indonesia (Arif, 2004).
Penelitian terdahulu terhadap tumbuhan rambutan sebagai berikut:
1. Oentarini Tjandra dkk telah melakukan penelitian mengenai Uji Aktivitas Antioksidan dan Profil Fitokimia Kulit Rambutan (Nephellium lappaceum L.).
2. Pada tahun 2006, Melisa Asrianti dkk melakukan penelitian mengenai Telaah
3. Frendsiane R. P. dkk telah melakukan penelitian mengenai Uji Aktivitas Anti
Jamur Ekstrak Etanol Kulit Batang Rambutan (Nephellium lappaceum L.)
Terhadap Jamur Candida albicans Secara In Vitro.
Dari uraian diatas dan berdasarkan literatur mengenai kandungan kimia yag terdapat pada tubuhan rambutan maka peneliti tertarik untuk mengisolasi senyawa flavonoida yag terdapat di dalam kulit buah rambutan (Nephellium lappaceum L.).
1.2 Permasalahan
Permasalahan dalam penelitian ini adalah golongan flavonoida apa dan bagaimana cara mengisolasi senyawa flavonoida yang terdapat pada kulit buah rambutan (Nephellium lappaceum L.).
1.3 Tujuan Penelitian
Tujuan dari penelitian adalah untuk mengisolasi senyawa flavonoida dari kulit buah rambutan (Nephellium lappaceum L.).
1.4 Manfaat Penelitian
1.5 Lokasi Penelitian
1. Lokasi pengambilan sampel
Sampel yang digunakan diperoleh dari salah satu pohon buah rambutan milik warga di daerah Tanjung Anom, Medan.
2. Lokasi melakukan penelitian
Penelitian dilakukan di laboraorium kimia bahan alam hayati FMIPA, Universitas Sumatera Utara.
3. Lokasi Identifikasi Kristal Hasil Isolasi
Analisa spektrofotometri UV-Visible dilakukan di Laboratorium Penelitian Farmasi Universitas Sumatera Utara. Analisa spektrofotometri Infamerah (FT-IR) dan spektrometri Resonansi Magnetik Inti Proton (1H-NMR) dilakukan di pusat penelitian kimia – LIPI kawasan PUSPITEK Serpong, Tangerang.
1.6 Metodologi Penelitian
Dalam penelitian ini, isolasi senyawa flavonoida dilakukan terhadap kulit buah rambutan berupa serbuk harus yang kering sebanyak 950 gram.
Tahap awal dilakukan uji skrining fitokimia untuk senyawa flavonoida dari ekstrak etil asetat kulit buah rambutan, yaitu dengan penambahan:
- NaOH 10% menghasilkan larutan biru violet.
- FeCl3 5 % menghasilkan hitam.
- Shinoda test yaitu dengan menambahkan serbuk magnesium pada ekstrak sampel
- H2SO4(p), flavon dan flavonon akan memberikan perubahan larutan kuning-pekat. Khalkon dan auron menghasilkan larutan berwarna merah atau merah kebiru-biruan. Flavanon memberikan warna orange sampai merah (Cannell, 1998).
Tahapan isolasi yang dilakukan :
- Ekstraksi maserasi
- Ekstraksi partisi
- Analisa kromatografi lapis tipis
- Analisa kromatografi kolom
- Analisa kristal hasil isolasi
Tahapan analisa hasil isolasi yang dilakukan adalah :
- Analisa kromatografi lapis tipis
- Pengukuran titik lebur
- Identifikasi dengan menggunakan Spektrofotometer UV-Visible,
BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Rambutan
2.1.1 Morfologi Tumbuhan Rambutan
Rambutan (Nephelium lappaceum) termasuk keluarga Sapindaceae dengan ordo
Sapindales. Tanaman ini merupakan tanaman buah-buahan tropis asli Indonesia, dan saat ini telah menyebar luas di daerah beriklim tropis seperti Filipina dan negara-negara Amerika Latin. Penyebaran tanaman rambutan yang pada awalnya sangat terbatas hanya di daerah tropis saja, saat ini sudah bisa ditemui di daratan yang beriklim subtropis. Hal ini disebabkan oleh karena perkembangan di bidang ilmu pengetahuan dan teknologi dengan berhasil diciptakannya ‘rumah kaca’ (Mahisworo,1998).
Kayu pohon tumbuhan rambutan cukup keras dan kering, tetapi mudah pecah sehingga kurang baik untuk bahan bangunan. Walaupun demikian kayu rambutan bagus sekali untuk kayu bakar. Akar tanaman ini untuk obat demam, kulit kayu untuk obat radang mulut, dan daunnya untuk obat sakit kepala sebagai tapal (Sunarjono, 2000).
2.1.2 Sistematika Tumbuhan Rambutan
sama sekali. Ranting atau cabang ujung mempunyai warna coklat kusam dengan permukaan kulit berkerut-kerut (Mahisworo,1990).
Sistematika tumbuhan rambutan adalah sebagai berikut :
Kingdom : Plantae
Divisio : Magnoliophyta
Kelas : Magnoliopsida
Ordo : Sapindales
Familia : Sapindaceae
Genus : Nephellium
Spesies : Nepphellium lappaceum L.
2.2 Senyawa Organik Bahan Alam
Kimia organik mengalami kemajuan yang sejajar dengan kemajuan cara pemisahan dan penelitian bahan alam. Karena sangat beranekaragam, molekul yang berasal dari mahluk hidup mempunyai arti yang sangat penting bagi para ahli kimia organik, yaitu untuk memperluas dan memperdalam pengetahuan tentang reaksi – reaksi organik, terutama dapat untuk menguji hipotesis – hipotesis tertentu, misalnya hipotesis tentang mekanisme reaksi. Pada mulanya, biogenesis dari produk alami berkaitan dengan kimia organik dan biokimia tetapi mempunyai tujuan yang berlainan (Manitto, 1992).
Senyawa organik bahan alam dapat diklasifikasikan berdasarkan sifat – sifat kimia yang dimilikinya. Ada empat cara klasifikasi yang diusulkan, yaitu:
1. Klasifikasi Berdasarkan Struktur Kimiawi
Klasifikasi ini berdasarkan pada kerangka molekuler dari senyawa yang bersangkutan. Menurut sistem ini ada 4 kelas yaitu:
a. Senyawa alifatik rantai terbuka atau lemak dan minyak.
Contoh: asam – asam lemak, gula, dan asam – asam amino pada umumnya. b. Senyawa alisiklik atau sikloalifatik
Contoh: terpenoid, steroida, dan beberapa alkaloida.
Contoh: golongan fenolat dan golongan kuinon. d. Senyawa heterosiklik
Contoh: alkaloida, flavonoida, dan golongan basa asam inti.
Karena klasifikasi ini hanyalah superfisial, maka tidak megherankan jika suatu senyawa organik bahan alam tertentu dapat dimasukkan kedua kelas berlainan. Contohnya: geraniol, farsenol, dan skualen termasuk kelas senyawa alifatik rantai terbuka, timol termasuk senyawa aromatik. Namun, keempat senyawa tersebut merupakan anggota dari kelas terpenoida dan steroida.
2. Klasifikasi Berdasarkan Sifat Fisiologik
Setelah penelitian yang lebih mendalam dilakukan tehaadap morfin (1860), penisilin (1939), dan prostaaglandin (1963), maka perhatian para ahli sering ditujukan kepada isolasi dan penentuan fungsi fisiologis dari senyawa organik bahan alam tertentu. Hampir separuh dari obat – obatan yang digunakan sehari – hari merupakan bahan alam, misalnya alkaloida dan antibiotik atau golonga – golongan sintetik. Oleh karena itu, senyawa organik bahan alam dapat juga diklasifiksikan dari segi aktivitas fisiologik dari bahan yang bersangkutan. Misalnya kelas hormon, vitamin, antibiotik, dan mikotoksin.
farnesol
3. Klasifikasi Berdasarkan Taksonomi
Pengklasifikasian ini berdasarkan pada penyelidikan morfologi komparatif dari tumbuh – tumbuhan yaitu taksonomi tumbuhan. Pada hewan dan sebagian mikroorganisme metabolit terakhir biasanya dibuang ke luar tubuh, sedangkan pada tumbuh – tumbuhan metabolit tersimpan dalam tumbuhan itu sendiri. Pada mulanya, beberapa metabolit dinggap hanya berasal dari tumbuh – tumbuhan tertentu. Kemudian diketahui bahwa beberapa metabolit tersebar pada berbagai tumbuhan dan teryata bahwa banyak konstituen tumbuhan (seperti alkaloida dan terpenoida) yang dapat diisolasi dari spesies, genera, suku, atau family tumbuhan tertentu. Dalam satu spesies tunggal dapat ditemukan sejumlah konstituen yang stukturnya berhubungan erat satu sama lainnya. Misalnya “opium” dari Papaver somniferum mengandung dua puluhan alkaloida termasuk morfin, tebain, kodein, dan narkotin yang kesemuanya dibiosintesis dari precusor 1- benzilisokuinolin melalui penggadengan (coupling) secara oksidasi. Oleh karena itu, alkaloida – alkaloida tersebut yan stukturnya mirip satu sama lain dan berasal dari genus tumbuhan tertentu disebut alkaloida opium.
4. Klasifikasi Berdasarkan Biogenesis
Semua konstituen tumbuhan dan hewan dibiosintesis dalam organisme melalui reaksi – reaksi yang dibantu oleh enzim tertentu. Istilah “biosintesis” dan “biogenesis” mempunyai arti yang sama yakni pembentukan bahan alam oleh organisme hidup. “Biosintesis” mengacu kepada perolehan data eksperimental dalam membuktikan jalur sintesis yang berlangsung sedangkan “biogenesis” masih bersifat hipotetik dan lebih menekan aspek spekulatif dari fakta.
Setelah pengetahuan tentang kimia organik bahan alam semakin berkembang sejak tahun 1930-an, beberapa ahli mulai menyusun teori langkah – langkah biogenetik dari senyawa organik bahan alam yang berlangsung dalam organisme hidup. “Aturan isoprene” yang diusulkan oleh Ruzicka menyatakan bahwa semua senyawa terpenoida terbentuk dari “unit isopren” C5.
Teori lain dengan nama “jalur asam sikimat” diusulkan oleh Davis yang menyatakan bahwa biosintesis dari asam – asam amino aromatik dan senyawa aromatik yang bertalian. Robinson juga menemukan hubungan diantara alkaloida dengan asam amino prekusornya.
Dari semua teori biogenesis itu dapat disimpulkan adanya 4 kelas senyawa organik bahan alam, yakni:
a. Poliketida (asetogenin) b. Fenolat (fenilpropanoida) c. Isoprenoida
d. Alkaloida (Tobing, 1989).
2.3 Senyawa Flavonoida
Senyawa – senyawa flavonoida adalah senyawa – senyawa polifenol yang mempunyai 15 atom karbon, terdiri dari dua cincin benzena yang dihubungkan menjadi satu oleh rantai linear yang terdiri dari tiga aton karbon. Senyawa – senyawa flavonoida adalah senyawa 1,3 diaril propana, senyawa isoflavonoida adalah senyawa 1,2 diaril propana, sedangkan senyawa – senyawa neoflavonoida adalah 1,1 diaril propana.
Dalam tubuh manusia senyawa flavonoida berfungsi sebagai antioksidan sehingga sangat baik untuk pencegahan kanker. Manfaat lain flavonoida adalah melindungi struktur sel, meningkatkan efektifitas vitamin C, anti inflamasi, mencegah keropos tulang,, dan sebagai antibiotik (Muhammad, 2011).
Sekitar 2% dari seluruh karbon yang difotosintesis oleh tumbuhan atau kira –
kira 1x109 ton/tahun diubah menjadi flavonoida atau senyawa yang berkaitan
dengannya. Sebagian besar taninpun berasal dari flavonoida. Jadi flavonoida merupakan salah satu golongan fenol alam yang terbesar.
Senyawa flavonoida sebenarnya terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit, tepung sari, bunga, buah, dan biji. Kebanyakan flavonoida ini berada di dalam tumbuh – tumbuhan kecuali alga. Namun ada juga flaavonoida yang terdapat pada hewan, misalnya dalam kelenjar bau berang – berang dan sekresi lebah. Dalam sayap kupu – kupu dengan anggapan bahwa flavonoida berasal dari tumbuh – tumbuhan yang menjadi makanan hewan tersebut dan tidak dibiosintesis di dalam tubuh mereka. Penyebaran jenis flavonoida pada golongan
tumbuhan yang tersebar yaitu angiospermae, klorofita, fungi, dan briofita
(Markham, 1988).
2.3.1 Struktur Dasar Senyawa Flavonoida
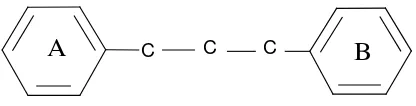
Golongan flavonoida dapat digambarkan sebagai deretan C6-C3-C6. Artinya kerangka karbonnya terdiri atas dua gugus C6 ( cincin benzena tersubsitusi) disambungkan oleh rantai alifatik tiga-karbon ( Robinson, 1995).
C C C
A B
2.3.2 Klasifikasi Senyawa Flavonoida
Flavonoida mengandung sistem aromatik yang terkonjugasi sehingga menunjukkan pita serapan kuat pada daerah spektrum sinar ultraviolet dan spektrum sinar tampak umumnya dalam tumbuhan terikat gula yang disebut dengan glikosida (Harbone, 1996).
Dalam tumbuhan, flavonoida terdapat dalam berbagi stuktur. Keragaman ini disebabkan oleh perbedaan tahap modifikasi lanjutan dari struktur dasar flavonoida tersebut, antara lain:
1. Flavonoida O-glikosida, satu gugus hidroksil (atau lebih) terikat pada satu gula (atau lebih) dengan ikatan hemiasetal yan tahan asam. Pengaruh glikosilasi menyebabkan flavonoida menjadi kurang reaktif dan lebih mudah larut dalam air. Glukosa merupakan gula yang paling umum terlibat dan gula lain yang sering juga terdapat adalah galaktosa, ramnosa, xilosa, dan arabinosa. Gula lain yang kadang – kadang ditemukan adalah, manosa, fruktosa, apiosa, dan asam glukoronat serta galakturonat.
2. Flavonoida C-glikosida, gula terikat pada atom karbon flavonoida dan dalam hal ini gula tersebut terikat langsung pada inti benzena dengan suatu ikatan karbon – karbon yang tahan asam. Glikosida yang demikian disebut C-glikosida. Jenis gula yang terlibat ternyata jauh lebih sedikit ketimbang jenis gula pada O-glikosida biasanya dari jenis glukosa yang paling umum juga galaktosa, ramnosa, xilosa, dan arabinosa.
3. Flavonoida sulfat, senyawa ini mengandung satu ion sulfat atau lebih yang
terikat pada hidroksil fenol atau gula. Senyawa ini sebenarnya bisulfat karena terdapat sebagai garam, yaitu flavon-O-SO3K. Banyak yanng berupa glikosida
4. Biflavonoida, yaitu flavonoida dimer. Flavonoida yang biasanya terlibat adalah flavon dan flavanon yang secara biosintesis mempunyai pola oksigenasi yang sederhana 5,7,4’ dan ikatan antar flavonoida berupa ikatan – ikatan karbon atau kadang – kadang eter. Monomer flavonoida yang digabungkan menjadi biflavonoida dapat berjenis sama atau berbeda, dan letak ikatannya berbeda – beda. Biflavonoida jarang ditemukan sebagai glikosida dan penyebarannya terbatas, terdapat terutama pada gimnospermae.
5. Aglikon favonoida yang aktif – optic yaitu sejumlah aglikon flaavonoida mempunyai atom karbonasimetrik dan dengan demikian menunjukkan kereaktifan optik yaitu memutar cahaya terpolarisasi – datar, yang termasuk dalam golongan flavonoida ini adalah flavanon, dihidroflavanon, katekin, rotenoid, dan lain – lain (Markham, 1988).
Menurut Robinson (1995), flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3 yaitu :
1. Flavonol
2. Flavon
Flavon berbeda dengan flavonol dimana pada flavon tidak terdapat gugusan 3-hidroksi. Hal ini mempunyai serapan UV-nya, gerakan kromatografi, serta reaksi warnanya. Flavon yang paling umum dijumpai adalah apigenin dan luteolin. Jenis yang paling umum adalah 7-glukosida dan terdapat juga flavon yang terikat pada gula melalui ikatan karbon. Flavon dianggap sebagai induk dalam nomenklatur kelompok senyawa flavonoida.
Merupakan isomer flavon. Jumlahnya sangat sedikit dan sebagai fitoaleksin (senyawa pelindung) dalam tumbuhan untuk pertahanan terhadap penyakit. Beberapa isoflavon (misalnya daidzein) memberikan warna biru muda cemerlang dengan sinar UV bila diuapi amonia tetapi kebanyakan tampak sebagai bercak lembayung yang pudar dengan amonia berubah menjadi coklat.
4. Flavanon
Flavanon terdistribusi luas di alam. Flavanon terdapat di dalam kayu, daun, dan bunga. Flavanon glikosida merupakan konstituen utama dari tanaman genus prenus dan buah jeruk. Dua glikosida yang paling lazim adalah neringenin dan hesperitin, terdapat dalam buah anggur dan jeruk.
O
O
A
B
C
Flavanon
5. Flavanonol
Senyawa ini berkhasiat sebagai antioksidan dan hanya terdapat sedikit sekali jika dibandingkan dengan flavonoida lain. Sebagian besar senyawa ini diabaikan karena konsentrasinya rendah dan tidak berwarna.
O
O
A
B
C
OH
6. Katekin
Katekin terdapat pada seluruh dunia tumbuhan terutama pada tumbuhan berkayu. Senyawa ini mudah diperoleh dalam jumlah besar dari ekstrak kental Uncaria gambir
dan daun teh kering yang mengandung kira-kira 30% senyawa ini. Katekin berkhasiat sebagai antioksidan.
O
OH
C
A
B
Katekin
7. Leukoantosianidin
Leukoantosianidin merupakan senyawa tan warna terutama terdapat pada tumbuhan berkayu. Senyawa ini jarang terdapat sebagai glikosida, contohnya melaksidin dan apiferol.
O
A
B
C
OH OH HO
8. Antosianin
Antosianin merupakan pewarna yang paling penting dan paling tersebar luas dalam tumbuhan. Pigmen yng berwarna kuat dan larut dalam air ini adalah penyebab hampir semua warna merah jambu, merah marak, ungu, dan biru dalam daun, bunga, dan buah pada tumbuhan tinggi. Secara kimia semua antosianin merupakan turunan suatu struktur aromatik tunggal yaitu sianidin dan semuanya terbentuk dari pigmen sianidin ini dengan penambahan atau pengurangan gugus hidroksil atau dengan metilasi atau glikosilasi.
O
A
B
C
OH
Antosianin
9. Khalkon
Khalkon adalah pigmen fenol kuning yang berwarna coklat kuat dengan sinar UV bila dikromatografi kertas. Aglikon khalkon dapat dibedakan dari glikosidanya karena hanya pigmen dalam bentuk glikosida yang dapat bergerak pada kromatografi kertas dalam pengembang air.
A
B
O
10. Auron
Auron berupa pigmen kuning emas yang terdapat dalam bunga tertentu dan briofita. Dalam larutan basa senyawa ini berwarna merah rose dan tampak pada kromatografi kertas berupa bercak kuning, dengan sinar ultraviolet warna kuning kuat berubah menjadi merah jingga bila diberi uap ammonia (Robinson, 1995).
A
B
O
O
CH
Tabel 2.1. Golongan – golongan flavonoida menurut Harborne Golongan
flavonoida
Penyebaran Ciri khas
Antosianin Pigmen bunga merah dan
biru dalam daun dan jaringan lain.
Larut dalam air, λ maks 515 – 545nm, bergerak dengan BAA pada kertas.
Proantosianidin Dalam daun tumbuhan
berkayu.
Menghasilkan antosianidin bila jaringan dipanaskan di dalam HCl 2 M selama setengah jam.
Flavonol Terutama ko-pigmen zat
warna dalam bunga sianik dan asianik tersebar luas dalam daun.
Setelah hidrolisis berupa bercak kuning mirip pada kromatogram forestal bila disinari UV, λ maks
330 – 350 nm.
Flavon Seperti flavonol Setelah hidrolisis bercak coklat
redup pada kromatogram forestall, λmaks 330 – 350 nm.
Glikoflavon Seperti flavonol Mengandung gula yang terikat
melalui ikatan C-C, bergerak dengan pengembang air, tidak seperti flavon biasa.
Biflavonil Hampir seluruhnya terbatas
pada gymnospermae
Pada kromatogram BAA berupa bercak redup denga Rf tinggi
Khalkon dan auron Pigmen bunga kuning,
kadang – kadang terdapat juga dalam jaringan lain.
Dengan amonia berwaran merah (perubahan warna dapat in situ),
λmaks 370-410 nm.
Flavanon Tanwarna dalam daun dan
buah (terutama dalam Citrus)
Berwarna kuat dengan MgHCl
Isoflavon Tanwarna sering kali
dalam akar; hanya terdapat dalam satu suku, Leguminosae
2.3.3 Sifat Kelarutan Flavonoida
Aglikon flavonoida adalah polifenol dan karena itu mempunyai sifat kimia senyawa fenol, yaitu berfsifat agak asam sehingga dapat larut dalam basa. Tetapi harus diingat, bila dibiarkan dalam larutan basa dan disamping itu terdapat banyak oksigen banyak yang akan terurai. Karena mempunyai sejumlah gugus hidroksi atau suatu gula. Flavonoida merupakan senyawa polar seperti etanol (EtOH), metanol (MeOH), butanol (BuOH), aseton, dimetilsulfoksida (DMSO), dimetilformamida (DMF), air, dan lain – lain. Adanya gula yang terikat pada flavonoida (bentuk yang umum diketahui) cenderung menyebabkan flavonoida lebih mudah larut dalam air dan dengan demikian campuran pelarut yang disebut diatas dengan air merupakan pelarut yang lebih baik, untuk glikosida. Sebaliknya, aglikon yang kurang polar cenderung lebih mudah larut dalam pelarut seperti eter dan kloroform (Markham, 1988).
2.4 Teknik Pemisahan
Teknik pemisahan memiliki tujuan untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni tidak tercampur dengan komponen-komponen lainnya.
Ada dua jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya
perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada
2.4.1 Ekstraksi
Ekstraksi adalah suatu proses pemisahan substansi atau zat dari campurannya dengan menggunakan pelarut yang sesuai, dimana zat terlarut yang terdistribusi diantara dua pelarut dinyatakan pertama kali oleh Walter Nernst sebagai hukum distribusi atau partisi yakni, “ Jika solut dilarutkan sekaligus ke dalam dua pelarut yang tidak saling bercampur, maka solut akan terdistribusi diantara kedua pelarut. Pada keadaan setimbang perbandingan konsentrasi solut berharga tetap pada suhu tetap.”
Pada metode ekstraksi cair-cair, ekstraksi dapat dilakukan dengan cara bertahap atau dengan cara kontinu. Cara paling sederhana dan banyak digunakan adalah ekstraksi bertahap, yakni dengan cara menambahkan pelarut pengekstrak yang tidak bercampur dengan larutan sampel melalui corong pisah kemudian dilakukan pengocokan sampai terjadi kesetimbangan konsentrasi solut pada kedua pelarut. Setelah didiamkan beberapa saat akan terbentuk dua lapisan dan yang berada dibawah dengan kerapatan lebih besar dapat dipisahkan untuk analisa selanjutnya (Yazid, 2005).
Ekstraksi dapat dilakukan dengan metode maserasi, sokletasi, dan perkolasi. Sebelum ekstraksi dilakukan biasanya serbuk tumbuhan dikeringkan lalu dihaluskan dengan derajat kehalusan tertentu kemudian diekstraksi dengan salah satu cara di atas. Ekstraksi dengan metode sokletasi dapat dilakukan secara bertingkat dengan berbagai pelarut berdasarkan kepolarannya misalnya n-heksana, etil asetat, methanol, dan air.
Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan ekstrak yang pekat, biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator (Harborne, 1996).
2.4.2 Kromatografi
Cara-cara kromatografi dapat digolongkan sesuai dengan sifat-sifat dari fasa diam yang dapat berupa zat padat atau zat cair. Jika fasa diam berupa zat padat disebut kromatografi serapan, jika berupa zat cair disebut kromatografi partisi. Karena fase gerak dapat berupa zat cair atau gas maka ada empat macam sistem kromatografi, yaitu:
1. Fasa gerak cair-fasa diam padat (kromatografi serapan), yakni: a. Kromatografi lapis tipis
b. Kromatografi penukar ion
2. Fasa gerak gas-fasa diam padat, yakni kromatografi gas padat
3. Fasa gerak cair-fasa diam cair (kromatografi partisi), yakni kromatografi kertas 4. Fasa gerak gas-fasa diam zat cair, yakni:
a. Kromatografi gas-cair b. Kromatografi kolom kapiler
Semua pemisahan dengan kromatografi tergantung pada kenyataan bahwa senyawa-senyawa yang dipisahkan terdistribusi diantara fasa gerak dan fasa diam dalam perbandingan yang sangat berbeda-beda dari satu senyawa terhadap senyawa yang lain (Sastrohamidjojo, 1991).
2.4.2.1 Kromatografi Lapis Tipis
Menurut Markham KLT terutama berguna untuk tujuan berikut: a. Mencari pelarut untuk kromatografi kolom
b. Analisis fraksi yang diperoleh dari kromatografi kolom
c. Untuk mengetahui perkembangan reaksi seperti hidrolisis atau metilasi d. Identifikasi flavonoida secara ko-kromatografi
e. Isolasi flavonoida murni skala kecil (Markham, 1988).
Untukmengidentifikasi suatu senyawa, maka harga Rf senyawa tersebut dapat dibandingkan dengan harga Rf senyawa pembanding.
Jarak perambatan bercak dari titik penotolan
Rf =
Jarak perambatan pelarut dari titik penotolan
Faktor-faktor yang mempengaruhi gerakan noda dalam KLT yang juga mempengaruhi harga Rf ( Sastrohamidjojo, 1985).
1. Struktur kimia dari senyawa yang dipisahkan 2. Sifat dari penyerap dan derajat aktivasi 3. Tebal kerataan dan lapisan penyerap 4. Pelarut dan derajat kemurnian fase gerak 5. Derajat kejenuhan dari uap
6. Jumlah cuplikan yang digunakan
7. Suhu
8. Kesetimbangan
.
2.4.2.2 Kromatografi Lapis Tipis Preparatif
Metode kromatografi dapat dilakukan dengan metode kromatografi lapis tipis preparatif, yaitu pemisahan yang terdiri atas sejumlah senyawa serupa. KLT preparatif adalah cara ideal untuk memisahkan cuplikan kecil (50 mg sampai 1 g). Penyerap yang dipakai adalah silika gel dan dipakai untuk pemisahan campuran senyawa lipofil maupun campuran senyawa hidrofil. Ketebalan adsorben yang paling sering dipakai 0,5-2 mm. Ukuran plat kromatografi biasanya 20 x 20 cm atau 20 x 40 cm.
tersebut diharapkan mengandung komponen murni, kemudian dikerok dari plat kaca dengan spatula dan ditampung dengan logam tipis atau kertas lilin. Penyerap diletakkan dalam corong kaca memakai kertas saring lalu dielusi beberapa kali dengan pelarut yang cocok (Underwood,1981).
2.4.2.3 Kromatografi Kolom
Kromatografi cair yang dilakukan dalam kolom besar merupakan metode kromatografi terbaik untuk pemisahan dalam jumlah besar (lebih dari 1 g). Pada kromatografi kolom campuran yang akan dipisahkan diletakkan berupa pita pada bagian atas kolom penyerap yang berada dalam tabung kaca, tabung logam, dan tabung plastik. Pelarut atau fasa gerak dibiarkan mengalir melalui kolom karena aliran yang disebabkan oleh gaya berat atau didorong dengan tekanan. Pita senyawa linarut bergerak melalui kolom dengan laju yang berbeda, memisah, dan dikumpulkan berupa fraksi ketika keluar dari atas kolom (Gritter, 1991).
Dengan menggunakan cara ini, skala isolasi flavonoida dapat ditingkatkan hampir ke skala industri. Pada dasarnya, cara ini meliputi penempatan campuran flavonoida (berupa larutan) diatas kolom yang berisi serbuk peyerap (seperti selulosa, silika atau poliamida) dilanjutkan dengan elusi beruntun setiap komponen memakai pelarut yang cocok. Kolom hanya berupa tabung kaca yang dilengkapi dengan keran pada salah satu ujung (Markham, 1988).
2.4.2.4 Kromatografi Cair Kinerja Tinggi (KCKT)
Berdasarkan pada mekanisme sorpsi solut maka jenis KCKT dapat dibagi secara lebih spesifik, yakni kromatografi adsorbsi, partisi, penukar ion, dan eksklusi ukuran. Pada pemisahan kromatografi adsorbsi penggunaannya sesuai untuk pemisahan- pemisahan campuran isomer struktur dan untuk pemisahan solut dengan gugus fungsional yang berbeda (Sudjadi, 2007).
Pada sebagian besar analisis flavonoida yang cocok ialah KCKT kolom fase balik (hidrokarbon terikat pada kemasan silika). Pengembang seperti air/metanol, air/ metanol/asam asetat, dan air/asetonitril dalam berbagai perbandingan telah digunakan dengan berhasil pada senyawa flavon, flavonol, katekin, dihidroflavonoida, antosianin, dan flavonoida glikosida (Markham, 1988).
2.5 Teknik Spektroskopi
Teknik spektroskopi adalah salah satu analisis kimia fisika yang mengamati tentang interaksi atom dan molekul dengan radiasi elektromagnetik. Ada dua macam instrumen pada teknik spektroskopi yaitu spektrometer dan spektrofotometer. Instrumen yang memakai monokromator celah tetap pada bidang fokus disebut sebagai spektometer. Apabila spektrometer tersebut dilengkapi dengan detektor yang bersifat fotoelektrik maka disebut spektrofotometer (Muldja, 1995).
2.5.1 Spektrofotometri Ultra-Violet (UV-Visible)
Spektrum ultraviolet terentang dari 100-400 nm. Absorpsi cahaya ultraviolet atau visible mengakibatkan transisi elektronik, yaitu promosi elektron-elektron dari orbital keadaan dasar yang berenergi rendah ke orbital keadaan tereksitasi berenergi lebih tinggi. Absorpsi oleh suatu sampel kemudian diukur pada perbagai panjang gelombang dan dialirkan oleh suatu perekam untuk menghasilkan spektrum (Fessenden,1994).
Tabel 2.2 Rentang serapan spektrum UV-Tampak flavonoida
Pita II (nm) Pita I (nm) Jenis flavonoid
250-280 310-350 Flavon
250-280 330-360 Flavonol (3-OH tersubstitusi)
250-280 350-385 Flavonol (3-OH bebas)
245-275 310-330 bahu
Kira-kira 320 puncak
Isoflavon
Isoflavon (5-deoksi-6,7-dioksigenasi)
275-295 300-330 bahu Flavanon dan dihidroflavonol
230-270
270-280 465-560 Antosianidin dan antosianin
(Markham,
1988).
2.5.2 Spektrofotometri Infra-Merah (FT-IR)
grafik yang akan menunjukkan persentasi transmitan yag beravariasi pada setiap frekuensi radiasi inframerah. Satuan frekuensi yang digunakan dinyatakan dalam bilangan gelombang (Dachriyanus, 2004).
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi getaran yang berlainan. Pancaran inframerah yang kerapatannya kurang dari 100 cm-1 panjang gelombang lebih dari pada 100 um diserap oleh sebuah molekul organik dan diubah menjadi putaran energi molekul. Penyerapan ini tercantum, namun spektrum getaran terlihat bukan sebagai garis – garis melainkan berupa pita – pita. Hal ini disebabkan perubahan energi tunggal selalu disertai sejumlah perubahan energi putaran (Silverstein, 1986).
Dalam molekul sederhana beratom dua atau berarom tiga tidak sukar untuk menentukan jumlah dan jenis vibrasinya dan menghubungkan vibrasi – vibrasi tersebut dengan energi serapan. Tetapi untuk molekul – molekul beratom banyak, analisis jumlah dan jenis vibrasi itu menjadi sukar sekali atau tidak mungkin sama sekali karena bukan saja disebabkan besarnya jumlah pusat – pusat vibrasi melainkan karena juga harus diperhitungkan terjadinya saling mempengaruhi (inter–aksi) beberapa pusat vibrasi.
Vibrasi molekul dapat dibagi dalam dua golongan, yaitu vibrasi regang dan vibrasi lenur.
1. Vibrasi regang
Disini terjadi terus – menerus perubahan jarak antara dua atom di dalam suatu molekul. Vibrassi regang ada dua macam yaitu vibrasi regang simetris dan tak simetris.
2. Vibrasi lentur
2.5.3 Spektrometri Resonansi Magnetik Inti Proton (1H-NMR)
Prinsip dasar Spektrometri Resonansi Magnetik inti proton adalah penyerapan gelombang radio oleh inti-inti tertentu dalam molekul organik. Asal usul gejala NMR disebabkan oleh adanya energi dan gelombang radio (senyawa yang mempunyai spin adalah 11H dan 136C ). Inti-inti akan beresonansi dalam medan magnet bila suatu
proton berpindah dari keadaan paralel ke keadaan anti paralel.
Medan magnet yang diderita oleh sebuah proton dalam sebuah molekul tertentu adalah gabungan dua medan:
1. Medan magnet luar (H0 ) yang dipasang.
2. Medan magnet molekul imbasan (Induced).
Proton yang lebih mudah terbalik akan menyerap energi pada H0 lebih rendah.
Proton ini akan menimbulkan peak bawah medan (tak terperisai=deshielded= downfield, lebih kekiri pada spektrumnya). Sedangkan proton yang sukar terbalik akan menyerap energi pada H0 tinggi dan menimbulkan peak atas medan ( terperisai=
shielded= upfield, lebih kekanan pada spektrumnya). Kuat medan imbasan bergantung pada rapatan elektron didekat atom hidrogen didalam ikatan sigma. Semakin besar rapatan elektron ini, maka akan semakin besar medan imbasan dan semakin jauh ke atas medan absorpsi yang teramati (Fessenden, 1994).
Senyawa yang paling lazim dan paling berguna dipakai sebagai acuan adalah tetrametilsilina (TMS). Beberapa keuntungan dari pemakaian standar internal TMS yaitu:
1. TMS mempunyai 12 proton yang setara sehingga akan memberikan spektrm
puncak tunggal yang kuat.
2. TMS merupakan cairan yang mudah menguap, dapat ditambahkan ke dalam
larutan sampel dalam pelarut CDCl3 atau CCl4 (Silverstein, 1986).
BAB 3
METODE PENELITIAN
3.1 Alat-alat
1. Kolom Kromatografi
2. Neraca Analitis Mettler PM 480
3. Rotari evaporator Buchi B-480
4. Labu alas 500 ml Pyrex
12.Tabung Reaksi Pyrex
13.Corong kaca 14.Spatula 15.Botol Vial
16.Bejana KLT Preparatif
17.Lampu UV 254 nm,356 nm UVGL 58
18.Penangas air
19.Spektrofotometer UV-Visible
20.Spektrofotometer IR Shimadzu
3.2 Bahan-bahan
1. Kulit buah rambutan
2. Metanol Teknis
3. N-heksana Teknis
4. Etil asetat Teknis
12.Kloroform Teknis
13.Kapas
14.Plat KLT silika gel 60 F254 E.Merck.Art 554
15.Plat KLT Preparatif 60 F254
16.Benzena p.a. E. Merck
17.Eter p.a. E. Merck
18.Pereaksi Benedict
3.3 Prosedur Penelitian
3.3.1 Penyediaan Sampel
3.3.2 Uji Pendahuluan Terhadap Ekstrak Kulit Buah Rambutan
Serbuk kulit buah rambutan diidentifikasi dengan mengunakan cara: 1. Skrining Fitokimia
2. Analisis kromatografi lapis tipis
3.3.2.1 Skrining Fitokimia
Untuk mengetahui adanya senyawa flavonoida pada kulit buah rambutan, maka dilakukan uji pendahuluan secara kualitatif sebagai berikut :
- Dimasukkan ± 10 gram serbuk kulit buah rambutan ( Nephellium lappaeum L.) yang telah dikeringkan dan dipotong-potong kecil dimasukkan ke dalam Erlenmeyer.
- Ditambahkan metanol ± 100 ml
- Didiamkan
- Disaring
- Dibagi ekstrak metanol kedalam 4 tabung reaksi
- Ditambahkan masing-masing pereaksi
a. Tabung I : dengan FeCl3 5% menghasilkan larutan berwarna hitam.
b. Tabung II : dengan H2SO4(p) menghasilkan larutan orange kekuningan.
c. Tabung III : dengan Mg-HCl menghasilkan larutan merah muda.
d. Tabung IV : dengan NaOH 10% menghasilkan larutan biru violet.
3.3.2.2 Analisis Kromatografi Lapis Tipis (KLT)
Analisa kromatografi lapis tipis dilakukan terhadap ekstrak kloroform dengan
menggunakan fasa diam silika gel 60F254 Merck. Analisis ini dimaksudkan untuk
mencari pelarut yang sesuai untuk komatografi kolom. Fasa gerak yang digunakanadalah campuran n-neksana : etil asetat dengan perbandingan (90:10, 80:20, 70:30, 60:40) v/v.
Dimasukkan 10 ml larutan fasa gerak n- heksana : eti asetat (90:10)v/v ke dalam bejana kromatografi kemudian dijenuhkan. Ditotolkan ekstrak pekat kloroform pada plat KLT yang telah diaktifkan. Kemudian dimasukkan plat ke dalam bejana yang telah berisi pelarut setelah dijenuhkan lalu ditutup dan dielusi. Plat yang telah dielusi dikeluarkan dari bejana lalu dikeringkan dan difiksasi dengan pereaksi FeCl3 5
%. Diamati warna bercak yang ditimbul kemudian dihitung harga Rf yang diperoleh. Perlakuan yang sama dilakukan untuk perbandingan pelarut n-heksana : etil asetat dengan perbandingan (80:20, 70:30, 60:40) v/v.
Dari hasil analisis KLT menunjukkan bahwa di dalam kulit buah rambutan terkandung senyawa flavonoida. Hasil pemisahannya diberikan pada fasa gerak n-heksana : etil asetat (70:30) v/v (Lampiran 3).
3.3.3 Ekstraksi Kulit Buah Rambutan
3.3.4 Isolasi Senyawa Flavonoida dengan Kromatografi Kolom
Isolasi senyawa flavonoida secara kolom dilakukan terhadap ekstrak pekat kloroform yang telah diperoleh. Fasa diam yang digunakan adalah silika gel 40 (70-230 mesh) ASTM dan fasa gerak yaitu n-heksana 100% dan campuran pelarut n-heksana : etil asetat dengan perbandingan (90:10, 80:20, 70:30, 60:40) v/v.
Dirangkai alat kolom kromatografi. Terlebih dahulu dibuburkan silika gel 40 (70-230 mesh) ASTM dengan menggunakan n-heksana, diaduk-aduk hingga homogen lalu dimasukkan ke dalam kolom kromatografi. Kemudian dielusi dengan menggunakan n-heksana 100% hingga silika gel padat dan homogen. Dimasukkan 0,5390 g ekstrak pekat kloroform ke dalam kolom kromatografi yang telah berisi bubur silika gel lalu ditambahkan fasa gerak n-heksana : etil asetat (90:10) v/v secara perlahan – lahan diatur sehingga aliran fasa yang keluar dari kolom sama banyaknya dengan penambahan fasa gerak dari atas. Ditingkatkan kepolaran dengan menambahkan fasa gerak n-heksana : etil asetat dengan perbandingan (80:20, 70:30, 60:40) v/v. Hasil yang diperoleh ditampung dalam botol vial setiap ±10 ml lalu di
KLT dan digabung fraksi dengan harga Rf yang sama lalu diuji dengan FeCl3 5%.
Kemudian diuapkan sampai terbentuk kristal.
3.3.5 Pemurnian
Kristal yang diperoleh dilarutkan kembali dengan Me-OH lalu dianalisis KLT untuk mencari fasa gerak yang sesuai untuk preparatif KLT. Kristal yang telah dilarutkan ditotolkan secara perlahan-lahan dan sama rata disepanjang tepi bawah plat kaca. Plat
kemudian dimasukkan kedalam bejana yang telah berisi pelarut CHCl3 : Me-OH
dengan perbandingan (90:10) v/v. Kemudin ditutup. Setelah dielusi, plat dikeluarkan dari bejana dikeringkan dan hasilnya diperiksa dibawah sinar UV. Setiap zona diberi tanda kemudian dikeruk lalu dielusi dengan metanol 100% dan disaring. Hasil elusi diuapkan dan diperoleh kristal.
3.3.6 Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis (KLT)
Uji kemurnian kristal dilakukan dengan kromatografi lapis tipis dengan menggunakan fasa diam silika gel 60 F254 dengan fasa gerak n-heksan : etil asetat (70:30) v/v.
Dimasukkan 10 ml larutan fasa gerak ke dalam bejana kromatografi, lalu dijenuhkan. Ditotolkan kristal yang sebelumnya dilarutkan dengan etil asetat pada plat KLT. Dimasukkan plat KLT tersebut ke dalam bejana kromatografi. Setelah pelarut merembes, plat KLT dikeluarkan dari bejana, dikeringkan kemudian difiksasi dengan
menggunakan pereaksi FeCl3 5% hasil menunjukkan adanya bercak hitam yang
menandakan adanya flavonoida.
3.3.7 Identifikasi Senyawa Hasil Isolasi
3.3.7.1 Identifikasi dengan Spektrofotometer UV-Visible
Analisis dengan alat spketrofotometer UV-Visible diperoleh dari Laboratorium Penelitian Farmasi, Universitas Sumatera Utara, Medan. Menggunakan metanol sebagai pelarut.
3.3.7.2 Identifikasi dengan Spektrofotometer Inframerah ( FT-IR )
Analisis dengan alat Spektrofotometer FT-IR diperoleh dari Laboratorium Pusat Penelitian Kimia - LIPI, Kawasan PUSPIPTEK Serpong, Tangerang.
3.3.7.3 Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton (1H- NMR)
Analisis dengan alat Spektrometer 1H-NMR diperoleh dari Laboratorium Pusat
3.4 Bagan Skrining Fitokimia
Serbuk kulit buah rambutan (Nephellim lappacem L.)
Dimaserasi dengan metanol Disaring
Dipekatkan
Dibagi kedalam 4 tabung reaksi
3.5 Bagan penelitian
Serbuk kulit buah rambutan (Nephellim lappacem L.)
Diskrining fitokimia
Dimaserasi dengan metanol sebanyak 4 L Didiamkan selama ± 24 jam
Dilakukan sebanyak 3 kali
Ekstrak metanol Residu
Diskrining fitokima
Dipekatkan dengan rotarievaporator Diuapkan hingga semua metanol menguap Diuapkan hingga semua etil asetat menguap Dilarutkan dengan metanol
Diekstraksi partisi dengan n-heksan sampai bening
Residu
Dilakukan uji kandungan gula dengan peraksi benedict (+) Dihidrolisis dengan HCl 2 N sambil dipanaskan selama 60 menit Didinginkan
Disaring
Lapisan n-heksan
Ekstrak metanol asam Residu
(tidak dilanjutkan Diekstraksi partisi dengan kloroform sebanyak 4 kali
Lanjutan
Lapisan kloroform
Dipekatkan dengan rotarievaporator
Fraksi 1-43 (90:10)
Diskrining fitokmia
Diuji KLT dengan eluen n-heksan:etil asetat (90:10; 80:20; 70:30; 60;40) v/v
Dikolom kromatografi dengan fasa diam silika gel dan fasa gerak (eluen) n-heksan : etil asetat (90:10, 80:20, 70:30, 60;40) v/v
Ditampung tiap fraksi sebanyak ±10 mL dalam botol vial Diuji KLT untuk mengetahui harga Rf
Digabung fraksi dengan harga Rf yang sama Ekstrak pekat kloroform
Fraksi 44-64 (80: 20) Fraksi 65-165 (70:30) Fraksi 165-182 (60:40)
Diuji FeCl3 5%
Dipreparatif dengan eluen kloroform: metanol (90:10) v/v Dikeringkan
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
Dari hasil skrining pendahuluan terhadap ekstrak dari kulit buah rambutan (Nephellium lappaceum L.). Dengan adanya penambahan pereaksi-pereaksi warna untuk menentukan golongan senyawa kimia yang dikandung dengan menggunakan pereaksi flavonoida ternyata sampel positif mengandung flavonoida.
Hasil analisis spektrofotometer UV- Visibel pada kristal hasil isolasi dengan pelarut metanol yang memberikan panjang gelombang maksimum yang dapat dilihat pada gambar 4.1.
Dari hasil analisis spektrofotometer Ultraviolet Visible (UV-Visible) dengan pelarut metanol ( gambar 4.1) memberikan panjang gelombang maksimum (λ maks) 261,00 nm dan 296,00 nm.
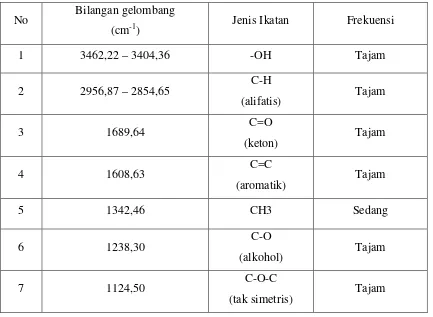
Hasil analisis spektrofotometer FT-IR dari kristal hasil isolasi menghasilkan pita-pita serapan pada daerah bilangan gelombang yang dapat dilihat pada gambar 4.2 dengan penjelasan sebagai berikut:
Hasil analisis Spektrofotometer FT-IR pada kristal hasil isolasi menghasilkan pita–pita serapan pada daerah bilangan gelombang yang ditunjukkan pada Tabel 4.1
berikut: (Pavia, 1979)
Tabel 4.1 Serapan pada analisis Spektrofotometer FT-IR
No Bilangan gelombang
(cm-1) Jenis Ikatan Frekuensi
1 3462,22 – 3404,36 -OH Tajam
2 2956,87 – 2854,65 C-H
(alifatis) Tajam
3 1689,64 C=O
(keton) Tajam
4 1608,63 C=C
(aromatik) Tajam
5 1342,46 CH3 Sedang
6 1238,30 C-O
(alkohol) Tajam
7 1124,50 C-O-C
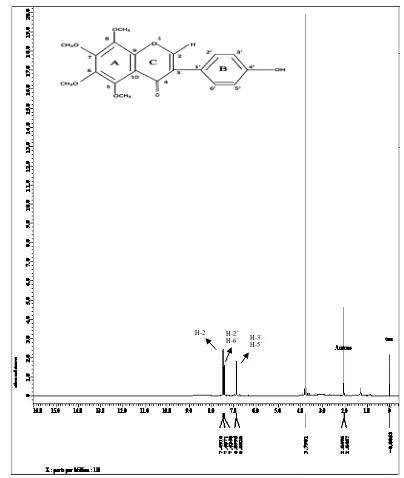
Hasil analisis spektrometer Resonansi Magnetik Inti Proton (H-NMR) senyawa hasil isolasi dengan menggunakan pelarut asetondan TMS sebagai standar yang memberikan signal-signal pergeseran kimia pada daerah yang dapat dilihat pada gambar 4.3.
Gambar 4.3. Spektrum 1H-NMR Senyawa Hasil Isolasi
H-3’ H-5’ H-2 H-2’
Hasil analisis Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR)
senyawa hasil isolasi dengan menggunakan pelarut aseton dan TMSsebagai standar
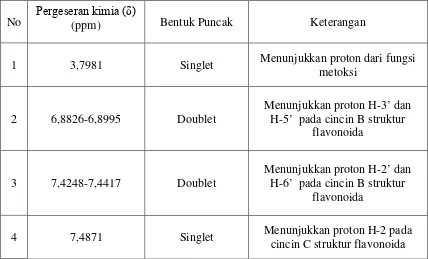
memberikan pergeseran kimia (ppm) yang ditunjukkan pada Tabel 4.2 berikut:
Tabel 4.2 Pergeseran kimia pada analisa spektometer 1H-NMR
No Pergeseran kimia (δ)(ppm) Bentuk Puncak Keterangan
1 3,7981 Singlet Menunjukkan proton dari fungsi
metoksi
2 6,8826-6,8995 Doublet
Menunjukkan proton H-3’ dan H-5’ pada cincin B struktur
flavonoida
3 7,4248-7,4417 Doublet
Menunjukkan proton H-2’ dan H-6’ pada cincin B struktur
flavonoida
4 7,4871 Singlet Menunjukkan proton H-2 pada
4.2 Pembahasan
Untuk menentukan struktur dari kristal yang diperoleh digunakan metode spektroskopi UV untuk menentukan golongan flavonoida sedangkan spektroskopi IR untuk menentukan gugus fungsi kabonil, aromatik (ikatan rangkap), OH, CH
streching, dan C-O. Untuk menetukan proton digunakan spektroskopi 1H-NMR.
Dengan menggabungkan ketiga metode ini maka dapat diramalkan struktur dari kristal.
Hasil interpretasi spektrum infra merah (FT-IR) dan spektrum resonansi magnetik inti proton (1H-NMR) senyawa hasil isolasi dengan menggunakan pelarut aseton dalam standar TMS diperoleh:
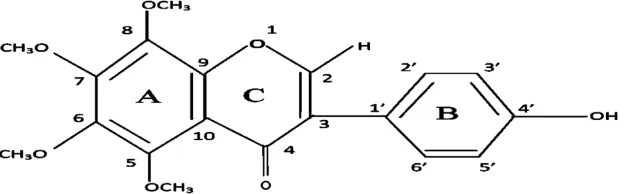
1. Pergeseran kimia pada daerah δ=3,7981 ppm terdapat puncak singlet menunjukkan proton dari gugus metoksi –OCH3 pada cincin C5’, C6’, C7’, dan C8’. Hal ini
didukung oleh spektrum inframerah pada bilangan gelombang 1342,46 cm-1 puncak
sedang menunjukkan adanya vibrasi tekuk -CH3 dan pada bilangan gelombang
1124,50 cm-1 puncak sedang menunjukkan adanya vibrasi ulur C-O-C tak simetrik.
2. Pergeseran kimia pada daerah δ= 6,8826-6,8995 ppm terdapat puncak doublet menunjukkan adanya proton pada posisi C3’ dan C5’ . Hal ini didukung oleh
spektrum inframerah pada bilangan gelombang 2956,87-2854,65 cm-1 dengan
puncak tajam menunjukkan adanya vibrasi ulur C-H dan pada cincin aromatik dan pada bilangan gelombang 1608,63 cm-1 dengan puncak tajam menunjukkan adanya vibrasi ulur C=C dari sistem aromatik.
3. Pergeseran kimia pada daerah δ= 7,4248-7,4417 ppm terdapat puncak doublet menunjukkan adanya proton pada posisi C6’ dan C2’ . Hal ini didukung oleh
spektrum inframerah pada bilangan gelombang 2956,87-2854,65 cm-1 dengan
4. Pergeseran kimia pada daerah δ= 7,4871 ppm terdapat puncak singlet menunjukkan adanya proton pada posisi C2 . Hal ini didukung oleh spektrum inframerah pada
bilangan gelombang 2956,87-2854,65 cm-1 dengan puncak tajam menunjukkan
adanya vibrasi ulur C-H dan pada cincin aromatik dan pada bilangan gelombang 1608,63 cm-1 dengan puncak tajam menunjukkan adanya vibrasi ulur C=C dari sistem aromatik.
Dari hasil pembahasan diatas, data spektrum UV-Vis, data inframerah dan
1
H-NMR dapat, dan berdasarkan skrining fitokimia dapat diduga bahwa senyawa yang diisolasi dari kulit buah rambutan (Nephellium lappacceum, L) merupakan senyawa flavonoida golongan isoflavon dengan kerangka sebagai berikut :
Gambar 4.4 Struktur Isoflavon
Sesuai spektrum 1H-NMR bahwa semua atom karbon pada cincin A harus
penuh tersubsitusi. Tetapi struktur isoflavon (Gambar 4.4) posisi OCH3 tidak dapat
ditentukan dengan pasti apakah salah satu gugus OCH3 pada cincin A bertukar posisi
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Dari hasil uji skrining fitokimia dengan pereaksi flavonoida menunjukkan
bahwa (Nephellium lappaceum L.) mengandung senyawa flavonoida
berupa kristal merah kecoklatan, dengan massa sebanyak 12 mg, dan Rf= 0,433 dengan eluen n- heksana : etil asetat (70:30) v/v.
2. Hasil analisis spektrum Inframerah dan spektrum Magnetik Inti Proton
(1H-NMR) menunjukkan bahwa senyawa hasil isolasi dari kulit buah
rambutan adalah senyawa golongan isoflavon.
5.2 Saran
DAFTAR PUSTAKA
Arif, H. H. 2004. Tumbuhan Obat dan khasiatnya (Seri Agri Sehat). Seri Pertama. Penerbit Penebar Swadaya. Jakarta.
Asrianti, M., Ruslan, Komar., Nawawi, A., 2006. Telaah Fitokimia Biji Rambutan. Bernasconi, G. 1995. Teknologi Kimia. Jilid 2. Edisi Pertama. Jakarta: PT. Pradaya
Pramita.
Bresnick, S. 2003. Intisari Kimia Organik. Jakarta: Erlangga.
Cannell,R. 1998. Natural Products Isolation. Humana Press Inc. Totowa, New Jersey.
Cresswell, C.J., dkk. 1982. Analisis Spektrum Senyawa Organik. Edisi kedua.
Penerbit ITB. Bandung.
Dachriyanus. 2004. Analisis Struktur Senyawa Organik secara Spektroskopi. Padang: Andalas University Press.
Fessenden, R. J & Fessenden, J.S. 1982. Kimia Organik. Jilid 1. Edisi Kedua. Terjemahan Aloysius Pudjaatmaka. Jakarta: Erlangga.
Gritter, R. J. 1991. Pengantar Kromatografi. Terbitan kedua. Terjemahan Kosasih Padmawinata. Bandung: Penerbit ITB.
Harborne, J. B. 1996. Metode Fitokimia, Penuntun Cara Modern Menganalisa
Tumbuhan. Terbitan ke-2. Terjemahan Kosasih Padmawinata dan Iwang Soediro. ITB. Bandung.
Mahisworo, S. K. 1990. Bertananam Rambutan. Penebar Swadaya. Jakarta.
Manitto, P. 1992. Biosintesis Produk Alami. Cetakan Pertama. Terjemahan
Koensomardiyah. Semarang : Penerbit IKIP press.
Markham, K.R. 1988. Cara Mengidentifikasi Flavonoida. Terjemahan Kosasi
Muhammad, A. 2011. Sarang Semut dan Buah Merah Pembasmi Ragam Penyakit Ganas. Cetakan Pertama. Yogyakarta: Laksana.
Muldja, M.H.1995. Analisa Instrumental. Cetakan Pertama. Surabaya: Universitas
Airlangga Press.
Nessa, F. dkk. 2003. Free Radical-Scavenging Activity of Organik Extract and Pure Flavonoids of Blumea Balsamifera DC Leaves. Food Chemistry.88: hal. 243-252.
Noerdin, D. 1985. Elusidasi Struktur Senyawa Organik dengan Cara Spektroskopi
Ultra. Bandung: Penerbit Angkasa.
Oentarini, T., Rusliati, T., Zulhipri. 2013. Uji Aktivitas Antioksidan dan Profil Fitokimia Kulit Buah Rambutaan (Nephellium lappaceuj L.).
Pangalinan, F., Kojong, N., Yamlean, P., 2012. Uji Aktivitas AntiJamur Ekstrak
Etanol Kulit Batang Rambutan (Nephellium lappaceum L.) Terhadap Jamur Candida Albicans Secara In Vitro.
Pavia, D.L. 1979 Lampman, G.M., Kriz, G.S. 1979. Introduction to Spectroscopy: A Guide for Students of Organic Chemistry. Philadelphia: Saunders College.
Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. Edisi ke-4. Terjemahan
Kosasih Padmawinata. ITB Press. Bandung.
Satrohamidjojo, H. 1996. Kromatografi. Edisi Pertama. Cetakan Pertama. Yogyakarta: Penerbit Liberty.
Silverstein, R. M. 1986. Penyidikan Spektrometrik Senyawa Organik. Terjemahan A. J. Hatomo dan Anny Viktor Purba. Edisi Keempat. Jakarta: Penerbit Erlangga.
Sudjadi. 1985. Metode Pemisahan. Yogyakarta: Penerbit Kanisius.
Tobing, R. L. 1989. Kimia bahan Alam. Departemen Pendidikan dan Kebudayaan. Direktorat Jendral Pendidikan Tingi. Jakarta. Proyek Pembanguna Lembaga Pendidikan Tenaga Kependidikan.
Lampiran 1. Gambar Tumbuhan Rambutan (Nephellium lappaceum L.)
Lampiran 2. Kromatogram Lapis Tipis Ekstrak Pekat Lapisan Kloroform Kulit Buah Rambutan (Nephellium lappaceum L.) Sebelum Kromatografi Kolom.
Keterangan :
Fasa diam : Kieselgel 60 F254
E : Ekstrak Pekat Lapisan Kloroform Kulit Buah Rambutan
Lampiran 3. Kromatogram Lapis Tipis Ekstrak Pekat Lapisan Kloroform Kulit Buah Rambutan (Nephellium lappaceum L.) Penggabungan Fraksi.
Lampiran 4. Kromatogram Lapis Tipis Senyawa Hasil Isolasi
Keterangan :
Fasa diam : Kieselgel 60 F254
E : Ekstrak Pekat Etil Asetat Kulit Buah Rambutan.
I : Fasa gerak n-heksana : etil asetat (70:30) v/v
II : Fasa gerak kloroform : metanol (90:10) v/v
No Fasa Gerak Jumlah
Noda Rf
I n-heksan : etil asetat
(70 : 30) v/v 1 0,433
II kloroform : methanol
(90 : 10) v/v 1 0,867
I II
Lampiran 6. Ekspansi Spektrum 1-H-NMR Senyawa Hasil Isolasi pada δ= 3,7-7,5 ppm
H-3’ H-5’ H-2’