EFEK EKSTRAK ETANOL DAUN KEJI BELING
(
Strobilanthus crispus
(L.) Blume) TERHADAP KONTRAKSI
OTOT POLOS ILEUM MARMUT JANTAN (
Cavia porcellus
)
TERISOLASI SECARA KUALITATIF
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas SumateraUtara
OLEH: AINI SAVITRI NIM 121524051
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
EFEK EKSTRAK ETANOL DAUN KEJI BELING
(
Strobilanthes crispus
(L.) Blume) TERHADAP KONTRAKSI
OTOT POLOS ILEUM MARMUT JANTAN (
Cavia porcellus
)
TERISOLASI SECARA KUALITATIF
SKRIPSI
OLEH:
AINI SAVITRI
NIM 121524058
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
EFEK EKSTRAK ETANOL DAUN KEJI BELING
(
Strobilanthus crispus
(L.) Blume) TERHADAP KONTRAKSI
OTOT POLOS ILEUM MARMUT JANTAN (
Cavia porcellus
)
TERISOLASI SECARA KUALITATIF
OLEH:
AINI SAVITRI
NIM 121524058
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 1 Juni 2015 Disetujui Oleh:
Pembimbing I,
Hari Ronaldo Tanjung, S.Si., M.Sc., Apt. NIP197803142005011002
Pembimbing II,
Marianne, S.Si., M.Si., Apt. NIP 198005202005012006
Panitia Penguji,
Prof. Urip Harahap, Apt. NIP 195301011983031004
iv
KATA PENGANTAR
Puji syukur kehadirat Allah SWT. atas segala limpahan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Efek Ekstrak Etanol Daun Keji Beling (Strobilanthus crispus (L.) Blume) Terhadap Kontraksi Otot Polos Ileum Marmut Jantan (Cavia porcellus) Terisolasi Secara Kualitatif”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Penulis menyampaikan terima kasih yang sebesar-besarnya kepada Bapak Dekan Fakultas Farmasi Prof. Dr. Sumadio Hadisahputra, Apt., yang telah memberikan fasilitas kepada penulis sehingga dapat menyelesaikan pendidikan. Kepada Bapak Hari Ronaldo Tanjung, S.Si., M.Si., Apt. dan Ibu Marianne, S.Si., M.Si., Apt., yang telah membimbing penulis dengan sabar sehingga penulisan skripsi ini dapat diselesaikan. Kepada Bapak Prof. Urip Harahap, Apt., Ibu Khairunnisa., M.Pharm, Ph.D., Apt., Bapak Drs. Saiful Bahri, M.S., Apt. selaku dosen penguji yang telah memberikan saran, arahan, kritik dan masukan kepada penulis dalam penyelesaian skripsi ini. Kepada Bapak Drs. Maralaut Batubara, M.Phil. selaku penasehat akademik yang telah memberikan nasehat dan motivasi kepada penulis selama masa perkuliahan dan Bapak/Ibu Pembantu Dekan, Bapak dan Ibu staf pengajar Fakultas Farmasi USU atas ilmu yang telah diberikan.
v
serta kedua adik tersayang Shofia Irdha Imani dan Dian Fairuza, sahabat seperjuangan asal Palembang, dan teman-teman Farmasi Ekstensi stambuk 2012 atas motivasi dan segala bantuan dalam penyelesaian skripsi ini.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari kesempurnaan. Untuk itu penulis mengharapkan kritik dan saran yang membangun dari semua pihak demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan khususnya di bidang Farmasi.
Medan, Juni 2015 Penulis,
vi
EFEK EKSTRAK ETANOL DAUN KEJI BELING
(Strobilanthus crispus (L.) Blume) TERHADAP KONTRAKSI OTOT POLOS ILEUM MARMUT JANTAN (Cavia porcellus) TERISOLASI
SECARA KUALITATIF
ABSTRAK
Tumbuhan obat banyak dipilih masyarakat dalam mengatasi beberapa penyakit. Salah satu tumbuhan tersebut adalah keji beling. Keji beling sering digunakan masyarakat untuk obat diabetes, batu ginjal, batu empedu, ambeien, tumor, kolesterol, dan sembelit. Penelitian ini bertujuan untuk mengetahui efek kontraksi dari ekstrak etanol daun keji beling pada otot polos ileum marmut terisolasi.
Tahapan penelitian ini meliputi karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak etanol daun keji beling dan uji efek kontraksi menggunakan otot polos ileum marmut. Penelitian ini dilakukan secara in vitro dengan menggunakan alat organ bath. Parameter yang diukur dalam penelitian ini adalah kontraksi otot polos ileum marmut terisolasi. Sebelum dilakukan pengujian, ileum marmut terisolasi diekuilibrasi selama 45 menit sampai diperoleh kondisi yang stabil didalam larutan tyrode dengan suhu 37oC yang diaerasi gas karbogen. Pengujian efek kontraksi dilakukan pada ileum marmut yang diberikan konsentrasi kumulatif ekstrak etanol daun keji beling dan asetilkolin. Pengujian mekanisme efek kontraksi ekstrak etanol daun keji beling dilakukan dengan menginkubasi ileum dengan atropin 2 x 10-3 selama 10 menit kemudian diberikan konsentrasi kumulatif ekstrak etanol daun keji beling.
Hasil pengujian menunjukkan bahwa ekstrak etanol daun keji beling memiliki efek kontraksi dan adanya korelasi positif antara peningkatan
konsentrasi ekstrak etanol daun keji beling dengan efek kontraksi ileum (r = 0,965; p < 0,05). Mekanisme kerja efek kontraksi ekstrak etanol daun keji
beling diduga tidak melalui reseptor muskarinik.
vii
THE EFFECT OF KEJI BELING (Strobilanthus crispus (L.) Blume) LEAVES ETHANOL EXTRACT ON ILEAL SMOOTH MUSCLE
CONTRACTION OF ISOLATED GUINEA PIG (Cavia porcellus) QUALITATIVELY
ABSTRACT
Medicinal plants were chosen by people in addressing some of the disease. One such plant is keji beling. Keji beling frequently used by people for diabetes medications, kidney stones, gall stones, hemorrhoids, tumors, cholesterol, and constipation. This research aims to observe the contraction effect of keji beling leaves ethanol extract on isolated guinea pig’s ileal.
Stages of the study included the characterization of crude drugs, phytochemical screening, the preparation of keji beling leaves ethanol extract and contraction effect test of isolated guinea pig’s ileal. This research was conducted using in vitro in organ bath The parameter measured in this research is the contraction of isolated guinea pig’s ileal smooth muscle. Before the test, isolated guinea pig ileum were equilibrated for 45 minutes to obtain a stable condition in Tyrode solution at 37°C aerated carbogen gas. The contraction effect test was done on guinea pig’s ileal by given the keji beling leaves ethanol extract cumulative concentrate and acethylcholin. The mechanism of action of the keji beling leaves ethanol extract contraction effect was done by incubated the ileal with atropin sulfate 2 x 10-3 for 10 minutes then subsequently given the keji beling leaves ethanol extract cumulative concentration.
The result showed that keji beling leaves ethanol extract has contraction effect. There is a positive correlation between increased concentrations keji beling leaves ethanol extract with ileal contraction effect (r = 0.965; p < 0.05) The mechanism of action of the keji beling leaves ethanol extract doesn’t go through muscarinic receptor.
viii DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan ... 6
2.1.1 Sistematika tumbuhan ... 6
2.1.2 Nama daerah ... 6
ix
2.1.4 Morfologi tumbuhan ... 7
2.1.5 Manfaat tumbuhan ... 7
2.2 Ekstraksi ... 8
2.3 Persyarafan Sistem Pencernaan ... 10
2.3.1 Sistem syaraf intrinsik-sistem syaraf enterik ... 10
2.3.2 Sistem syaraf ekstrinsik-sistem syaraf otonom ... 11
2.4 Usus Halus ... 11
2.4.1 Histologi usus halus ... 12
2.4.2 Pergerakan usus halus ... 13
2.4.3 Ileum ... 15
2.4.4 Usus marmut ... 15
2.5 Otot Polos ... 15
2.5.1 Mekanisme Kontraksi Otot ... 16
2.6 Mediator Kontraksi Otot Polos ... 16
2.6.1 Reseptor muskarinik ... 17
2.6.2 Reseptor histaminergik ... 17
2.6.3 Prostaglandin E2 (PGE2) ... 18
2.6.4 Nitrioksida (NO) ... 18
2.7 Antagonis Muskarinik ... 19
2.8 Organ Terisolasi ... 20
2.9 Konstipasi ... 21
BAB III METODE PENELITIAN... 23
3.1 Alat dan Bahan ... 23
x
3.1.2 Bahan-bahan ... 23
3.2 Hewan Percobaan ... 24
3.3 Pengumpulan dan Pengolahan Bahan Tumbuhan ... 24
3.3.1 Pengumpulan bahan tumbuhan ... 24
3.3.2 Identifikasi tanaman ... 24
3.3.3 Pengolahan bahan tumbuhan ... 25
3.4 Pembuatan Larutan Pereaksi ... 25
3.4.1 Pereaksi Mayer ... 25
3.4.2 Pereaksi Dragendorf ... 25
3.4.3 Pereaksi Bourchardat ... 26
3.4.4 Pereaksi Molish ... 26
3.4.5 Pereaksi asam klorida 2 N ... 26
3.4.6 Pereaksi asam sulfat 2 N ... 26
3.4.7 Pereaksi natrium hidroksida 2 N ... 26
3.4.8 Pereaksi timbal (II) asetat 0,4 M ... 26
3.4.9 Pereaksi besi (III) klorida 1% ... 26
3.4.10 Pereaksi Liebermann-Burchard ... 27
3.5 Karakterisasi Simplisia ... 27
3.5.1 Pemeriksaan makroskopik ... 27
3.5.2 Pemeriksaan mikroskopik ... 27
3.5.3 Pemeriksaan kadar air ... 27
3.5.4 Penetapan kadar abu total ... 28
3.5.5 Penetapan kadar abu tidak larut asam ... 28
xi
3.5.7 Penetapan kadar sari larut dalam etanol ... 29
3.6 Skrining Fitokimia ... 29
3.6.1 Pemeriksaan alkaloida ... 29
3.6.2 Pemeriksaan glikosida ... 30
3.6.3 Pemeriksaan flavonoid ... 31
3.6.4 Pemeriksaan tanin ... 31
3.6.5 Pemeriksaan saponin ... 31
3.6.6 Pemeriksaan steroida/triterpenoid ... 31
3.7 Tahapan Persiapan Percobaan ... 32
3.7.1 Pembuatan larutan ekstrak etanol daun keji beling ... 32
3.7.2 Pembuatan larutan tirode ... 33
3.7.3 Penyiapan larutan asetilkolin ... 33
3.7.4 Penyiapan larutan atropin sulfat ... 35
3.8 Tahap Pengujian ... 36
3.8.1 Preparasi organ ... 36
3.8.2 Pengujian kontraksi seri konsentrasi asetilkolin terhadap otot polos ileum ... 36
3.8.3 Pengujian efek kontraksi ekstrak etanol keji beling beling pada kontraksi otot polos ileum ... 37
3.8.4 Pengujian mekanisme aksi terhadap efek kontraksi ekstrak etanol daun keji beling pada otot polos ileum ... 38
3.9 Data dan Analisis Data ... 38
3.9.1 Data ... 38
3.9.2 Analisis data ... 39
BAB IV HASIL DAN PEMBAHASAN ... 40
xii
4.1.1 Hasil identifikasi tumbuhan ... 40
4.1.2 Hasil karakterisasi simplisia ... 40
4.2 Skrining Fitokimia ... 42
4.3 Ekstraksi Serbuk Simplisia Daun Keji Beling ... 42
4.4 Hasil Pengujian Kontraksi Seri Konsentrasi Asetilkolin terhadap Otot Polos Ileum ... 43
4.5 Hasil Pengujian Kontraksi Ekstrak Etanol Daun Keji Beling (EEDKB) Pada Otot Polos Ileum ... 44
4.6 Hasil Pengujian Mekanisme Aksi Terhadap Efek kontraksi Ekstrak Etanol Daun Keji Beling (EEDKB) Pada Otot Polos Ileum dalam nkubasi Atropin Sulfat ... 46
BAB V KESIMPULAN DAN SARAN ... 50
5.1 Kesimpulan ... 50
5.2 Saran ... 50
DAFTAR PUSTAKA ... 51
xiii
DAFTAR TABEL
Halaman Tabel 2.1 Obat-obat yang merangsang dan menghambat reseptor
kolinergik dengan masing-masing reseptornya... 19
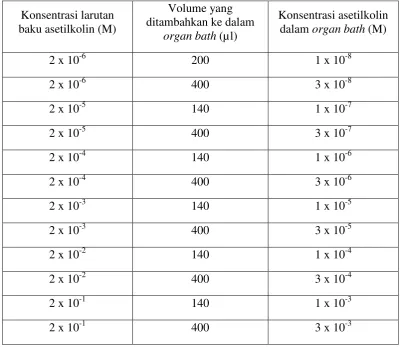
Tabel 3.1 Pemberian asetilkolin secara kumulatif pada organ bath
xiv
DAFTAR GAMBAR
Halaman Gambar 1.1 Kerangka pikir penelitian ... 5 Gambar 4.1 Grafik % kontraksi otot polos organ ileum terisolasi yang
dikontraksi dengan pemberian seri konsentrasi asetilkolin (10-8 – 3 x 10-3 M) ... 43 Gambar 4.2 Grafik % kontraksi setelah pemberian seri konsentrasi
ekstrak etanol daun keji beling (EEDKB) pada otot polos ileum terisolasi ... 45 Gambar 4.3 Grafik % kontraksi setelah pemberian seri konsentrasi asetilkolin dan ekstrak etanol daun keji beling (EEDKB) pada otot polos ileum terisolasi ... 46 Gambar 4.4 Grafik % kontraksi setelah pemberian seri konsentrasi
xv Lampiran 5. Hasil pemeriksaan mikrokopik serbuk simplisia daun keji beling ... 59 Lampiran 6. Bagan pembuatan, skrining fitokimia dan karakteristik serbuk simplisia ... 60 Lampiran 7. Bagan pembuatan, skrining fitokimia dan karakterisasi ekstrak ... 61 Lampiran 8. Bagan kerja pengukuran kontraksi ileum marmut terisolasi 62 Lampiran 9. Perhitungan kadar air simplisia daun keji beling ... 63 Lampiran 10. Perhitungan kadar abu total simplisia daun keji beling ... 64 Lampiran 11. Perhitungan kadar abu tidak larut asam simplisia daun keji beling ... 65 Lampiran 12. Perhitungan kadar sari larut air simplisia daun keji beling 66 Lampiran 13. Perhitungan kadar sari larut etanol simplisia daun keji beling ... 67 Lampiran 14. Data pengujian kontraksi seri konsentrasi asetilkolin terhadap otot polos ileum ... 68 Lampiran 15. Data pengujian efek kontraksi ekstrak etanol daun keji
beling pada kontraksi ileum ... 73 Lampiran 16. Data efek kontraksi ekstrak etanol daun keji beling
terhadap kontraksi otot polos ileum dengan inkubasi atropin sulfat selama 10 menit ... 74 Lampiran 17. Data AUC efek kontraksi ekstrak etanol daun keji beling
xvi
Lampiran 18. Data AUC efek kontraksi ekstrak etanol daun keji beling terhadap kontraksi otot polos ileum menggunakan atropin
atropin sulfat selama 10 menit ... 76
Lampiran 19. Hasil uji korelasi efek kontraksi ekstrak etanol daun keji beling pada kontraksi ileum ... 77
Lampiran 20. Hasil uji-t independen nilai % kontraksi ekstrak etanol daun keji beling 6 mg/ml dengan nilai % kontraksi asetilkolin 1 x 10-4 M ... 78
Lampiran 21. Hasil uji-t independen nilai %kontraksi ekstrak etanol daun keji beling terhadap kontraksi otot polos ileum dengan dan tanpa inkubasi larutan atropin sulfat ... 80
Lampiran 22. Hasil uji-t independen nilai AUC dari %kontraksi ekstrak etanol daun keji beling dengan dan tanpa inkubasi atropin sulfat ... 88
Lampiran 23. Gambar preparasi organ ileum marmut ... 90
Lampiran 24. Gambar alat organ bath ... 93
vi
EFEK EKSTRAK ETANOL DAUN KEJI BELING
(Strobilanthus crispus (L.) Blume) TERHADAP KONTRAKSI OTOT POLOS ILEUM MARMUT JANTAN (Cavia porcellus) TERISOLASI
SECARA KUALITATIF
ABSTRAK
Tumbuhan obat banyak dipilih masyarakat dalam mengatasi beberapa penyakit. Salah satu tumbuhan tersebut adalah keji beling. Keji beling sering digunakan masyarakat untuk obat diabetes, batu ginjal, batu empedu, ambeien, tumor, kolesterol, dan sembelit. Penelitian ini bertujuan untuk mengetahui efek kontraksi dari ekstrak etanol daun keji beling pada otot polos ileum marmut terisolasi.
Tahapan penelitian ini meliputi karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak etanol daun keji beling dan uji efek kontraksi menggunakan otot polos ileum marmut. Penelitian ini dilakukan secara in vitro dengan menggunakan alat organ bath. Parameter yang diukur dalam penelitian ini adalah kontraksi otot polos ileum marmut terisolasi. Sebelum dilakukan pengujian, ileum marmut terisolasi diekuilibrasi selama 45 menit sampai diperoleh kondisi yang stabil didalam larutan tyrode dengan suhu 37oC yang diaerasi gas karbogen. Pengujian efek kontraksi dilakukan pada ileum marmut yang diberikan konsentrasi kumulatif ekstrak etanol daun keji beling dan asetilkolin. Pengujian mekanisme efek kontraksi ekstrak etanol daun keji beling dilakukan dengan menginkubasi ileum dengan atropin 2 x 10-3 selama 10 menit kemudian diberikan konsentrasi kumulatif ekstrak etanol daun keji beling.
Hasil pengujian menunjukkan bahwa ekstrak etanol daun keji beling memiliki efek kontraksi dan adanya korelasi positif antara peningkatan
konsentrasi ekstrak etanol daun keji beling dengan efek kontraksi ileum (r = 0,965; p < 0,05). Mekanisme kerja efek kontraksi ekstrak etanol daun keji
beling diduga tidak melalui reseptor muskarinik.
vii
THE EFFECT OF KEJI BELING (Strobilanthus crispus (L.) Blume) LEAVES ETHANOL EXTRACT ON ILEAL SMOOTH MUSCLE
CONTRACTION OF ISOLATED GUINEA PIG (Cavia porcellus) QUALITATIVELY
ABSTRACT
Medicinal plants were chosen by people in addressing some of the disease. One such plant is keji beling. Keji beling frequently used by people for diabetes medications, kidney stones, gall stones, hemorrhoids, tumors, cholesterol, and constipation. This research aims to observe the contraction effect of keji beling leaves ethanol extract on isolated guinea pig’s ileal.
Stages of the study included the characterization of crude drugs, phytochemical screening, the preparation of keji beling leaves ethanol extract and contraction effect test of isolated guinea pig’s ileal. This research was conducted using in vitro in organ bath The parameter measured in this research is the contraction of isolated guinea pig’s ileal smooth muscle. Before the test, isolated guinea pig ileum were equilibrated for 45 minutes to obtain a stable condition in Tyrode solution at 37°C aerated carbogen gas. The contraction effect test was done on guinea pig’s ileal by given the keji beling leaves ethanol extract cumulative concentrate and acethylcholin. The mechanism of action of the keji beling leaves ethanol extract contraction effect was done by incubated the ileal with atropin sulfate 2 x 10-3 for 10 minutes then subsequently given the keji beling leaves ethanol extract cumulative concentration.
The result showed that keji beling leaves ethanol extract has contraction effect. There is a positive correlation between increased concentrations keji beling leaves ethanol extract with ileal contraction effect (r = 0.965; p < 0.05) The mechanism of action of the keji beling leaves ethanol extract doesn’t go through muscarinic receptor.
1 BAB I
PENDAHULUAN
1.1 Latar Belakang
Saat ini masyarakat Indonesia terutama yang di perkotaan mengalami pergeseran pola konsumsi pangan. Seiring dengan kemajuan zaman dan perbaikan sosial ekonomi masyarakat, maka terjadi pula perubahan kebiasaan makan yang cenderung kebarat-baratan (western style diet). Makanan jadi dan makanan siap saji telah menjadi kegemaran di masyarakat. Masyarakat umumnya belum tahu atau kurang menyadari bahwa makanan jadi telah kehilangan banyak komponen-komponen essensial makanan, khususnya serat. Asupan serat yang terlampau rendah dalam kurun waktu lama akan mempengaruhi kesehatan seperti konstipasi, kegemukan, dan serangan penyakit degeneratif (Soelistijani, 2002).
Konstipasi merupakan suatu gejala proses defekasi yang bermasalah dapat berupa defekasi tidak lancar dan tidak teratur, mengedan serta defekasi keras dan tidak tuntas (Tjay dan Rahardja, 2007). Semakin lama tinja tertahan dalam usus, konsistensinya semakin keras sehingga susah dikeluarkan. Hal tersebut berpangkal pada kelemahan tonus otot dinding usus akibat penuaan yaitu kegiatan fisik yang mulai berkurang, serta kurangnya asupan serat dan cairan (Arisman, 2007).
2
berusia diatas usia 60 tahun merupakan konsumen yang teratur menggunakan obat pencahar. Sekitar 20% populasi yang berusia di atas 65 tahun di Australia, mengeluh menderita konstipasi (Siswono, 2003).
Penelitian kepada 60 penderita konstipasi yang berobat ke RSUPH Adam Malik Medan menunjukan bahwa gejala konstipasi yang timbul pada pasien dengan konsumsi tinggi serat sebanyak 7 orang atau 11,7%, konsumsi yang baik serat dengan 33 orang atau 55%, dan konsumsi yang kurang serat dengan 20 orang atau 33,3%. Hal ini menunjukkan semakin tinggi konsumsi serat maka prevalensi kejadian konstipasi semakin rendah (Wanda, 2012).
Saat ini, masyarakat semakin luas menggunakan tumbuhan obat dalam mengatasi masalah kesehatannya daripada menggunakan obat-obatan modern. Masyarakat telah mengenal dan menggunakan obat-obatan alamiah yang berasal dari tumbuh-tumbuhan, hewan, dan mineral. Mereka meramu dan meraciknya sendiri atas dasar pengalaman yang diwariskan secara turun-temurun oleh generasi sebelumnya (Dalimartha, 2007).
Keji beling telah lama diketahui sebagai tanaman tradisional. Keji beling banyak digunakan untuk pengobatan beberapa jenis penyakit antara lain batu ginjal, batu empedu, diabetes, ambeien, kolesterol, sembelit, dll. Unsur-unsur yang terkandung dalam tanaman keji beling yang bersifat diuretik dapat menghancurkan gumpalan kolesterol dan memperlancar sekresi gula dalam darah, serta membantu memperlancar proses pembuangan tinja yang keras sehingga bisa berfungsi sebagai pencahar (Chusnia, 2010).
3
terhadap kontraksi otot polos ileum tikus terisolasi serta mekanisme kerjanya yang dilakukan secara kualitatif pada marmut jantan.
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas maka dapat diambil perumusan masalah sebagai berikut:
a. apakah ekstrak etanol daun keji beling dapat meningkatkan kontraksi otot polos ileum marmut jantan terisolasi secara kualitatif?
b. apakah mekanisme kerja ekstrak etanol daun keji beling mempunyai pola yang sama dengan asetilkolin sebagai kolinergik melalui reseptor muskarinik?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas maka dibuat hipotesis analisis sebagai berikut:
a. ekstrak etanol daun keji beling meningkatkan kontraksi otot polos ileum marmut terisolasi.
4 1.4 Tujuan Penelitian
Berdasarkan rumusan masalah dan hipotesis di atas maka tujuan penelitian ini antara lain:
a. untuk mengetahui efek kontraksi ekstrak etanol daun keji beling dengan meningkatkan kontraksi usus ileum marmut terisolasi secara kualitatif.
b. untuk mengetahui mekanisme efek kontraksi ekstrak etanol daun keji beling pada otot polos marmut terisolasi.
1.5 Manfaat Penelitian
Adapun manfaat penelitian ini adalah untuk memperoleh bukti ilmiah tentang efek kontraksi ekstrak etanol daun keji beling terhadap otot polos ileum marmut terisolasi dan mekanisme kerjanya.
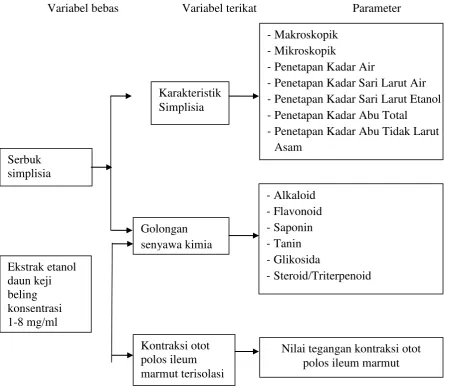
1.4 Kerangka Pikir Penelitian
5
Variabel bebas Variabel terikat Parameter
Gambar 1.1 Kerangka Pikir Penelitian Serbuk
-Penetapan Kadar Air
-Penetapan Kadar Sari Larut Air
-Penetapan Kadar Sari Larut Etanol
-Penetapan Kadar Abu Total
-Penetapan Kadar Abu Tidak Larut Asam
6 BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi sistematika tumbuhan, nama daerah, nama asing, morfologi tumbuhan dan manfaat tumbuhan.
2.1.1 Sistematika tumbuhan
Sistematika tumbuhan keji beling adalah sebagai berikut (Jayusman dan Sulaksana, 2005):
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledonae Ordo : Solanales Famili : Acanthaceae Genus : Strobilanthes
Spesies : Strobilanthes crispus Bl 2.1.2 Nama daerah
Nama daerah dari tumbuhan ini adalah ngokilo, enyoh kilo, keci beling (Jawa) dan picah beling (Jakarta) (Jayusman dan Sulaksana, 2005).
2.1.3 Kandungan kimia tumbuhan
7 2.1.4 Morfologi tumbuhan
Tanaman keji beling dibagi menjadi bagian akar, batang, daun dan bunga. Karekteristik bentuk bagian tanaman keji beling tersebut sebagai berikut: akarnya berbentuk tunggang (tap root) yaitu akar utama. Umumnya, akar tunggang merupakan pengembangan radikula lembaga yang tumbuh tegak kebawah dan bercabang. Akar berwarna putih kekuningan, fungsi akar untuk memperkuat berdirinya tanaman serta menyerap air dan unsur hara dari media tanam atau tanah. Keji beling merupakan jenis tanaman berbatang basah dan sepintas menyerupai rumput berbatang tegak. Batang berbentuk bulat, beruas dan berdiameter antara 0,2-0,7 cm. Kulit batang berwarna ungu dengan bintik-bintik hijau pada waktu muda dan berubah menjadi coklat setelah tua. Batang bercabang dan berbulu halus. Daun berbentuk bulat telur. Pada bagian tepi daun bergerigi dengan jarak sekitar 1 cm dan berbulu halus sampai-sampai hampir tidak terlihat oleh mata telanjang. Panjang helaian daun (tanpa tangkai) berkisar 5-8 cm dan lebar 2-5 cm. Daun berwarna hijau dengan bunga dalam bulir pendek berbentuk kepala, berbulu seperti bulu domba dengan 2 daun pelindung (Jayusman dan Sulaksana, 2005).
2.1.5 Manfaat tumbuhan
8 2.2 Ekstraksi
Ekstraksi adalah suatu cara untuk menarik satu atau lebih zat dari bahan asal dengan menggunakan pelarut. Umumnya zat berkhasiat tersebut dapat ditarik, namun khasiatnya tidak berubah. Tujuan utama ekstraksi adalah mendapatkan atau memisahkan sebanyak mungkin zat-zat yang memiliki khasiat pengobatan dari zat-zat yang tidk dibutuhkan, agar lebih mudah digunakan (kemudahan diabsorpsi, rasa dan pemakaian) dan disimpan dibandingkan simplisia asal dan tujuan pengobatannya terjamin. Hasil ekstraksi disebut dengan eksrak yaitu sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan (Ditjen POM, 1995).
Ekstraksi dengan menggunakan pelarut dapat dilakukan dengan beberapa cara yaitu:
a. Cara dingin i. Maserasi
9 ii. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar (Ditjen POM, 2000)
b. Cara panas i. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik (Ditjen POM, 2000).
ii. Sokletasi
Sokletasi adalah ekstraksi kontinu menggunakan alat soklet, dimana pelarut akan terdestilasi dari labu menuju pendingin, kemudian jatuh membasahi dan merendam sampel dalam tabung soklet, kemudian setelah pelarut mencapai tinggi tertentu maka akan turun ke labu destilasi setelah melewati pipa sifon, demikian berulang-ulang (Ditjen POM, 2000).
Keuntungan dari metode ini adalah ekstraksi simplisia dapat dilakukan dengan sempurna dan pelarut yang digunakan lebih sedikit dibandingkan metode lainnya (Voight, 1995).
iii.Digesti
10 iv.Infus
Infus adalah sediaan cair yang dibuat dengan menyari simplisa nabati dengan air pada suhu 90oC selama 15 menit (Ditjen POM, 1979). v. Dekok
Dekok adalah sediaan cair yang dibuat dengan menyari simplisia nabati dengan air pada waktu yang lebih lama ±30 menit dengan temperatur sampai titik didih air (Ditjen POM, 2000).
2.3 Persyarafan Sistem Pencernaan
Ada dua sistem syaraf yang memegang peranan penting dalam fungsi saluran pencernaan , yaitu sistem syaraf intrinsik yang terdiri atas sistem syaraf enterik, dan sistem syaraf ekstrinsik yang terdiri atas sistem syaraf otonom parasimpatis dan simpatis.
2.3.1 Sistem syaraf intrinsik - Sistem syaraf enterik
Sistem syaraf ini terbentang didalam dinding saluran pencernaan mulai dari esofagus sampai ke anus. Sistem syaraf enterik terdiri atas dua pleksus, yaitu:
a. Pleksus mienterikus (pleksus Auerbach)
Pleksus ini terbentang di antara lapisan otot longitudinal dari lapisan otot sirkuler. Fungsinya mengontrol fungsi motorik saluran pencernaan.
b. Pleksus submukosa atau pleksus Meissner
11
pada mukosa saluran pencernaan serta meningkatkan absorpsi dan aliran darah di sekitarnya (Herman, 2004).
2.3.2 Sistem syaraf ekstrinsik – sistem syaraf otonom
Sistem syaraf ekstrinsik terbagi menjadi dua, yaitu: a. Sistem syaraf parasimpatis
Neuron pascaganglion (postganglionnic neuron) sistem parasimpatis terletak di dalam kedua pleksus sistem syaraf enterik, yaitu pleksus mienterikus dan pleksus submukosa. Ujung serat syaraf parasimpatis menyekresikan asetilkolin sebagai neurotransmitternya. Stimulasi parasimpatis pada umumnya menyebabkan peningkatan aktivitas sistem syaraf enterik yang selanjutnya meningkatkan aktivitas saluran pencernaan.
b. Sistem syaraf simpatis
Ujung serat syaraf simpatis menyekresikan neurotransmitter norepinefrin. Sistem syaraf ini merangsang sistem pencernaan melalui dua cara, yaitu: (1) secara langsung pada otot polos saluran pencernaan dan (2) secara tidak langsung, yaitu melalui neuron sistem syaraf enterik.
2.4 Usus Halus
12
besar. Usus halus dibagi menjadi tiga segmen, yaitu duodenum 20 cm (8 inci), jejunum 2,5 m (8 kaki) dan ileum 3,6 m (12 kaki) (Sherwood, 2001).
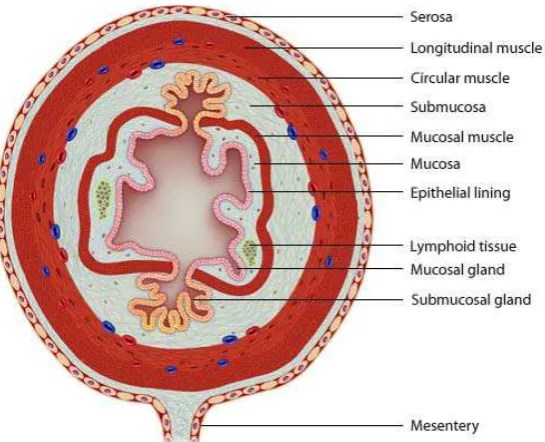
2.4.1 Histologi usus halus
Menurut Herman (2004), pada umumnya dinding usus halus terdiri atas empat lapisan (Gambar 2.1), yaitu:
a. Lapisan mukosa
Lapisan mukos merupakan lapisan terdalam dari dinding saluran pencernaan. Lapisan ini berbentuk membran (selaput) mukosa dan dibentuk oleh tiga komponen, yaitu lapisan epitel, lamina propria dan lapisan muskularis mukosa.
b. Lapisan submukosa
Lapisan submukosa terdiri atas jaringan penyambung areolar yang mengikatkan lapisan mukosa ke lapisan muskularis. Lapisan ini sangat kaya dengan pembuluh darah dan mengandung jaringan syaraf yang disebut pleksus submukosa atau disebut juga pleksus Meissner.
c. Lapisan muskularis
13
Gambar 2.1 Lapisan usus halus (Virtual Medical Centre, 2006) d. Lapisan serosa
Lapisan serosa adalah lapisan terluar dari dinding saluran pencernaan. Lapisan ini berupa suatu mebran yang terdiri atas jaringan penyambung dan sel-sel epitel. Pada lapisan ini terdapat pembuluh darah dan syaraf yang berukuran lebih besar yang berjalan di antara jaringan penyambung dan jaringan lemak (adipose tissue) yang terdapat didaerah ini. Lapisan serosa yang terletak di bawah diafragma (sekat rongga badan) ikut membentuk dan merupakan bagian dari peritonium secara keseluruhan dan disebut peritoneum viseral.
2.4.2 Pergerakan usus halus
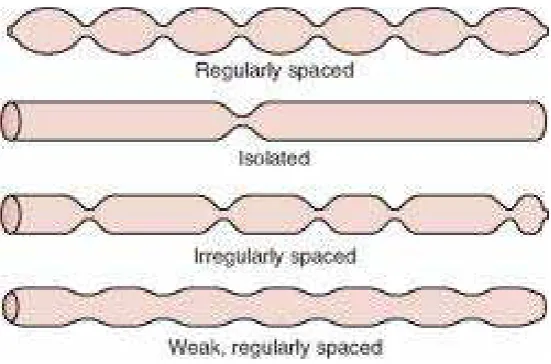
14 a. Gerakan pencampur (segmentasi)
Gerakan segmentasi berbeda-beda sifat dan bentuk gerakannya di setiap bagian saluran pencernaan, walaupun perbedaannya hanya sedikit. Secara garis besar dapat dikatakan bahwa gerakan segmentasi pada umumnya berupa kontraksi lokal yang muncul selama beberapa detik di setiap beberapa sentimeter dinding usus. Begitu suatu seri kontriksi lokal ini hilang, maka muncul lagi seri seri kontriksi yang baru dilokasi yang berbeda. Dengan demikian, isi usus seperti dipotong-potong oleh gerakan
kontriksi ini. Pergerakan segmentasi usus halus ditunjukkan pada Gambar 2.2.
Gambar 2.2 Pergerakan segmentasi usus halus (Guyton, 1987) b. Gerakan pendorong
15
memungkinkan terjadinya proses digesti (pencernaan) makanan dan proses absorpsi hasil digesti.
2.4.3 Ileum
Ileum merupakan 3/5 bagian usus halus. Disinilah proses absorpsi yang besar terjadi, pada bagian ini sari-sari makanan hasil proses pencernaan diserap. Asam amino dan glukosa, vitamin, garam mineral akan diangkut oleh kapiler darah, sedangkan asam lemak dan gliserol akan diangkut oleh pembuluh getah bening usus menuju ke pembuluh balik besar bawah selangka (Irianto, 2004) 2.4.4 Usus marmut
Bagian pertama adalah duodenum dengan bentuknya seperti lengkungan S dan mempunyai pankreas pada lengkungan kedua. Bagian ini mempunyai panjang sekitar 1 sampai 3 inci. Selanjutnya pada jejunum panjangnya sekitar 8 inci. Dilanjutkan dengan ileum dengan panjang sekitar 3-5 inci. Setelah ileum berakhir pada caecum dimana merupakan pintu masuk dari colon. Caecum merupakan organ seperti kantong besar yang mempunyai panjang sekitar 1 sampai 6 inci (Potter, et al., 1956)
2.5 Otot Polos
16
Sel otot polos dilapisi oleh selaput yang disebut sarkolema dan protoplasmanya disebut sarkoplasma. Otot polos memiliki inti, letaknya ditengah dengan miofibril yang homogen, panjangnya 15-500 mikron dengan diameter 20 mikron. Otot polos merupakan otot tak sadar, karena bekerja diluar kesadaran kita dan dipengaruhi oleh susunan saraf otonom (Irianto, 2004).
2.5.1 Mekanisme Kontraksi Otot
17 2.6 Mediator Kontraksi Otot Polos
Kontraksi otot polos dapat di mediasi oleh beberapa jalur, seperti reseptor muskarinik, reseptor histaminergik, nitrioksida (NO), prostaglandin E2 (PGE2), cGMP.
2.6.1 Reseptor muskarinik
Reseptor muskarinik terdistribusi luas diseluruh tubuh dan mendukung berbagai fungsi vital, di otak, sistem saraf otonom terutama saraf parasimpatis. Reseptor muskarinik merupakan reseptor yang terhubung dengan protein G, terdiri dari 5 subtipe yaitu: M1, M2, M3, M4 dan M5. Resptor M1, M3 dan M5 terhubung dengan protein Gq. Sedangkan reseptor M2 dan M4 terhubung dengan protein Gi dan dengan suatu kanal ion. Respons yang timbul dari aktivasi reeptor muskarinik oleh ACh dapat berbeda, tergantung pada subtipe reseptor dan lokasinya (Rahardjo, 2009).
18 2.6.2 Reseptor histaminergik
Histamin adalah pembawa pesan (messenger) bahan kimia yang memperantarai beragam respon seluler, termasuk alergik dan reaksi inflamasi, sekresi asam lambung dan neurotransmisi pada bagian otak. Histamin pada dasarnya muncul dalam semua jaringan, tetapi tidak didistribusikan secara rata, dengan jumlah yang tinggi ditemukan dalam paru, kulit, dan saluran cerna. Histamin yang dilepaskan sebagai respons terhadap berbagai rangsangan mengeluarkan efeknya dengan cara berikatan kepada satu atau lebih dari empat tipe reseptor—reseptor H1, H2, H3 dan H4. Beberapa efek farmakologik histamin diperantarai oleh kedua reseptor H1 dan H2, sedangkan lainnya diperantarai hanya oleh satu kelas. Sebagai contoh, reseptor H1 penting dalam kontraksi otot polos dan peningkatan permeabilitas kapiler. Reseptor H2 memperantarai sekresi asam lambung (Mycek et al., 2001).
2.6.3 Prostaglandin E2 (PGE2)
Prostaglandin adalah turunan asam lemak komposisi 20 karbon yang dapat ditemukan di semua jaringan dan organ.prostaglandin disintesis dalam sel dari prekusor asam lemak esensial, termasuk salah satunya adalah asam arakhidonat dengan melibatkan enzim siklooksigenase (COX) (Calder, 2009).
Prostaglandin E2 (PGE2) adalah salah satu prostanoid terpenting yang ditemukan di saluran pencernaan. Karena pada kenyataannya PDE2 mengatur banyak fungsi fisiologis saluran pencernaan seperti proteksi mukosa, menghambat sekresi lambung dan motilitas. Pada saluran pencernaan, PGE2 dan PGF2α
19 2.6.4 Nitrit oksida (NO)
Nitrit Oksida berasal dari sintesis konversi enzim dari L-Arginine menjadi L-Citrulline oleh nitrit oxide synthase (NOS). Elektron yang tidak berikatan menyebabkan NO merupakan radikal bebas yang sangat reaktif dan dapat menyebabkan kerusakan protein, karbohidrat, nukleotida dan lipid bersama-sama dengan mediator inflamasi yang lain yang menyebabkan kerusakan sel. NO berpotensi merelaksasi arteri dan vena otot polos dan secara kuat menghambat agregasi dan adhesi. Asupan NO berperan sebagai agen vasodilator dan mungkin berguna untuk terapi. NO juga berperan pada regulasi jaringan pada proses fisiologi namun jika berlebihan dapat menyebabkan toksisitas. NO mengaktifkan guanilil siklase yang membentuk guanosin monofosfat siklik (cyclic guanosine monophosphate/cGMP) dari guanosine trifosfat. cGMP menghasilkan relaksasi otot polos melalui reduksi konsentrasi Ca2+ intraseluler (Mycek et al., 2001).
2.7 Antagonis Muskarinik
20
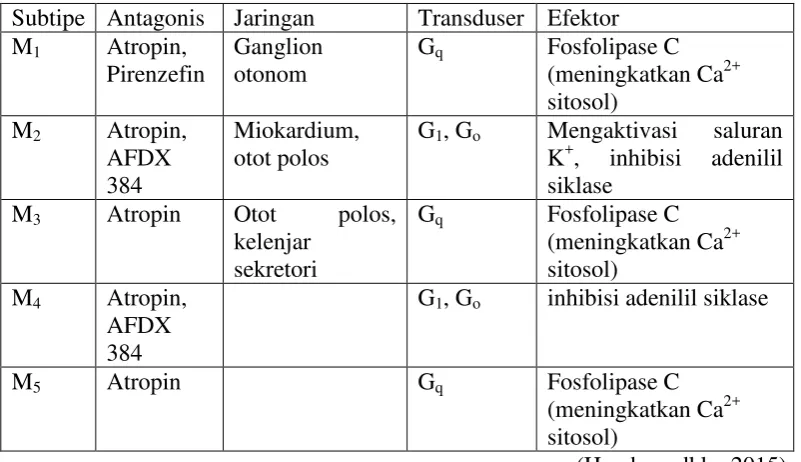
Pada reseptor muskarinik terdapat lima subtipe reseptor (M1, M2, M3, M4, M5) dengan respon yang berbeda pada tiap jaringan tubuh manusia. Semua subtipe reseptor muskarinik dapat diblok oleh atropin (Tabel 2.1).
Tabel 2.1 Subtipe reseptor muskarinik dengan antagonisnya Subtipe Antagonis Jaringan Transduser Efektor M1 Atropin,
G1, Go Mengaktivasi saluran K+, inhibisi adenilil
G1, Go inhibisi adenilil siklase
M5 Atropin Gq Fosfolipase C
(meningkatkan Ca2+ sitosol)
(Harahap, dkk., 2015) 2.8 Organ Terisolasi
Organ terisolasi adalah suatu metode percobaan in vitro. Pada prinsipnya penelitian ini menggunakan organ yang direndam dalam larutan fisiologis yang sesuai, temperatur diatur atau dikondisikan pada kondisi yang sama dari mana organ tersebut berasal serta pengaturan aliran oksigen. Percobaan organ terisolasi ini menggunakan alat organ bath (Perry, 1970).
21
respon kontraktilitas terhadap rangsangan yang diberikan. Respon kontraktilitas dapat direkam dan dapat diukur untuk selanjutnya dapat dibuat kurva dosis respon. Untuk mendapatkan hasil percobaan yang akurat, maka diperlukan persiapan yang baik dan seluruh percobaan harus betul-betul terkontrol. Hewan percobaan yang digunakan dibunuh tanpa anastesi sehingga tidak mempengaruhi kontraktilitasnya. Organ yang diambil segera dimasukkan ke dalam cairan fisiologis dan dikontrol oksigenasinya dan dihubungkan ke transducer dan diteruskan ke alat pencatat misalnya, kymograph atau maclab computer (Syamsudin dan Darmono, 2011).
2.9 Konstipasi
Konstipasi atau sembelit merupakan suatu keadaan yang dapat dialami oleh siapa saja tanpa mengenal usia. Seseorang dapat dikatakan mengalami konstipasi jika terjadi penurunan frekuensi buang air besar yang biasanya ditandai dengan buang air besar yang susah dan feses yang keras. Konstipasi terjadi akibat perlambatan gerakan feses melalui usus sehingga feses terakumulasi pada usus bagian bawah. Tingkat keparahan konstipasi berbeda-beda pada setiap orang. Pada umumnya penderita hanya mengalami konstipasi dalam jangka waktu yang singkat, sementara pada penderita lainnya dapat menjadi kronis (jangka lama) yang kemudian menimbulkan rasa sakit dan tidak nyaman sehingga mempengaruhi kualitas hidup penderita (BPOM, 2013).
22
23 BAB III
METODE PENELITIAN
Metode yang digunakan pada penelitian ini adalah metode eksperimental. Prosedur yang dilakukan meliputi pembuatan simplisia, skrining fitokimia simplisia, karakterisasi simplisia, tahapan persiapan bahan pengujian dan tahapan pengujian kontraksi ileum menggunakan alat organ bath.
3.1 Alat dan Bahan
3.1.1 Alat-alat
Alat- alat yang digunakan pada penelitian ini adalah mortir dan stamfer, blender, alat-alat gelas laboratorium, tanur, mikroskop, micropipet (Socorex,
Swiss), amplifier (ADinstrumental), transducer (ADinstrumental), recorder
(ADinstrumental), lemari pengering, oven listrik, rotary evaporator (Heidolph WB 2000), neraca analitik (vibra), vortex (Boeco Germany), timbangan hewan, jarum suntik, alat-alat bedah, organ bath volume 40 ml (Panlab).
3.1.2 Bahan-Bahan
24
Glukosa, CaCl2. Bahan pembanding yang digunakan adalah asetilkolin klorida (Sigma Aldrich, USA).
3.2 Hewan Percobaan
Hewan yang digunakan pada penelitian ini adalah marmut (Cavia porcellus) jantan, berat badan 300-500 g dengan usia 2-4 bulan dan kondisi sehat. Hewan diaklimatisasi selama 1 (satu) minggu dengan tujuan untuk menyeragamkan makanan dan hidupnya dengan kondisi yang serba sama sehingga dianggap memenuhi syarat untuk penelitian. Sebelum digunakan pada tahap penelitian, hewan percobaan dipuasakan selama 24 jam agar usus yang digunakan dalam keadaan kosong.
3.3 Pengumpulan dan Pengolahan Bahan Tumbuhan
3.3.1 Pengumpulan bahan tumbuhan
Pengambilan bahan tumbuhan dilakukan secara purposive yaitu tanpa membandingkan dengan daerah lain. Sampel yang digunakan pada penelitian ini adalah daun keji beling (Strobilanthus crispus (L.) Blume). Diperoleh dari jalan Harmonika No 102, Kecamatan Medan baru, Kota Medan, Provinsi Sumatera Utara. Daun yang diambil sebagai sampel adalah keseluruhan dari daun tumbuhan yang masih dalam keadaan baik.
3.3.2 Identifikasi tanaman
25 3.3.3 Pengolahan bahan tumbuhan
Tumbuhan yang digunakan pada penelitian ini adalah daun keji beling yang masih segar. Daun dibersihkan dari pengotoran dengan air bersih, kemudian ditiriskan untuk menghilangkan airnya. Selanjutnya ditimbang berat basah dengan berat 5 kg, lalu dikeringkan dengan cara dimasukkan ke dalam lemari pengering dengan suhu ±40oC selama 3-4 hari. Sampel dianggap kering bila sudah rapuh (dapat dipatahkan), kemudian disortasi kering dan berat kering simplisia ditimbang, lalu simplisia diblender sampai menjadi serbuk, ditimbang beratnya. Selanjutnya serbuk simplisia disimpan dalam kantung plastik dengan silika gel dan dimasukkan dalam lemari pengering untuk mencegah pengaruh lembab dan pengotoran lain. Diperoleh berat kering 855 gram.
3.4 Pembuatan Larutan Pereaksi
3.4.1 Pereaksi Mayer
Sebanyak 1,4 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml, pada wadah lain ditimbang sebanyak 5 g kalium iodida lalu dilarutkan dalam 10 ml air suling, kedua larutan dicampurkan dan ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.2 Pereaksi Dragendorf
26 3.4.3 Pereaksi Bourchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling secukupnya, lalu ditambahkan 2 g iodium kemudian ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.4 Pereaksi Molish
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N hingga
diperoleh larutan 100 ml (Ditjen POM, 1995). 3.4.5 Pereaksi asam klorida 2 N
Sebanyak 17 ml larutan asam klorida pekat ditambahkan air suling hingga diperoleh larutan 100 ml (Ditjen POM, 1995).
3.4.6 Pereaksi asam sulfat 2 N
Sebanyak 5,4 ml larutan asam sulfat pekat ditambahkan air suling sampai 100 ml (Ditjen POM, 1995).
3.4.7 Pereaksi natrium hidroksida 2 N
Sebanyak 8 g kristal natrium hidroksida dilarutkan dengan air suling sebanyak 100 ml (Ditjen POM, 1995).
3.4.8 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air suling bebas karbon dioksida sebanyak 100 ml (Ditjen POM, 1995).
3.4.9 Pereaksi besi (III) klorida 1%
27 3.4.10 Pereaksi Liebermann-Burchard
Sebanyak 5 bagian volume asam sulfat pekat dicampurkan dengan 50 bagian volume etanol 90%. Kemudian ditambahkan dengan hati-hati 5 bagian volume asam asetat anhidrida ke dalam campuran tersebut dan dinginkan (Ditjen POM, 1995).
3.5 Karakterisasi Simplisia
Karakteristik simplisia meliputi pemeriksaan makroskopik dan mikroskopik, penetapan kadar air, penetapan kadar abu total, penetapan kadar abu tidak larut asam, penetapan kadar sari larut air dan penetapan kadar sari larut etanol.
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan cara mengamati warna, bentuk, ukuran dan tekstur dari simplisia.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik terhadap simplisia dilakukan dengan cara menaburkan serbuk simplisia diatas kaca objek yang telah diteteskan dengan larutan kloralhidrat dan ditutup dengan kaca penutup kemudian diamati di bawah mikroskop.
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode azeotropi (destilasi toluena). Alat meliputi labu alas 500 ml, alat penampung, tabung penerima 5 ml berskala 0,05 ml, pendingin, tabung penyambung, pemanas.
28
suling, kemudian didestilasai selama 2 jam, toluen didinginkan selama 30 menit dan volume air pada tabung penerima dibaca. Selanjutnya ke dalam labu dimasukkan 5 g serbuk simplisia yang telah ditimbang seksama, lalu dipanaskan hati-hati selama 15 menit. Setelah toluena mendidih kecepatan tetesan diatur 2 tetes tiap detik hingga sebagian air tersuling, kemudian kecepatan penyulingan dinaikkan hingga 4 tetes tiap detik. Setelah semua air tersuling, bagian dalam pendingin dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin sampai suhu kamar. Setelah air dan toluena memisah sempurna, dibaca volume air dengan 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1992).
3.5.4 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama, dimasukkan ke dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus porselen dipijarkan perlahan-lahan pada suhu 600oC sampai arang habis, kemudian dinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan diudara (WHO, 1992). 3.5.5 Penetapan kadar abu tidak larut asam
29 3.5.6 Pemeriksaan kadar sari larut dalam air
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air sampai 1 liter) dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam dan disaring. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara dan sisa dipanaskan dalam oven pada suhu 105oC sampai diperoleh bobot tetap. Kadar sari larut dalam air dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1995). 3.5.7 Pemeriksaan kadar sari larut dalam etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara dan dipanaskan pada suhu 105oC sampai bobot tetap. Kadar sari yang larut dalam etanol dihitung terhadap bahan yang telah dikeringkan di udara (Ditjen POM, 1995).
3.6 Skrining Fitokimia
3.6.1 Pemeriksaan alkaloida
30
a. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Mayer akan terbentuk endapan berwarna putih atau kuning.
b. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Bouchardat, akan terbentuk endapan berwarna coklat sampai kehitaman.
c. Filtrat sebanyak 3 tetes ditambah dengan 2 tetes larutan pereaksi Dragendorff, akan terbentuk endapan merah atau jingga.
Alkaloida positif jika terjadi endapan atau kekeruhan paling sedikit dua dari tiga percobaan diatas (Ditjen POM, 1995).
3.6.2 Pemeriksaan glikosida
31 3.6.3 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambahkan 100 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas, kedalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol (Farnsworth, 1966). 3.6.4 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan diambil 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%. Jika terjadi warna biru, atau kehitaman menunjukkan adanya tanin (Ditjen POM, 1995).
3.6.5 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan dalam tabung reaksi, ditambahkan 10 ml air panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik, jika terbentuk buih yang mantap setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya saponin (Ditjen POM, 1995).
3.6.6 Pemeriksaan steroida/triterpenoida
32 3.7 Tahapan Persiapan Percobaan
3.7.1 Pembuatan larutan ekstrak etanol daun keji beling
Sejumlah 1600 mg ekstrak etanol daun keji beling (EEDKB) dilarutkan dengan 1 ml DMSO (Dimethil sulfoxida), kemudian dicukupkan dengan larutan tirode hingga 5 ml. Diperoleh konsentrasi ekstrak 320 mg/ml (larutan stock). DMSO merupakan pelarut yang inert, non toksis dan dapat melarutkan hampir seluruh senyawa dan merupakan pelarut yang semipolar, namun masih dapat bercampur dengan media tirode (Velasco, et al., 2003; Bertoluzza, et al., 1979; Brown, et al., 1963). Batas penggunaan jumlah pelarut DMSO yang ditambahkan kedalam organ bath (40 ml) adalah sebesar 400 µL atau 1% v/v (Husori, 2011). Dari larutan stock dipipet berturut-turut ekstrak etanol daun keji beling:
a. Dipipet 125 µL ekstrak daun keji beling kedalam organ bath sehingga konsentrasi ekstrak dalam organ bath didapat 1 mg/ml.
b. Dipipet 125 µL ekstrak daun keji beling kedalam organ bath sehingga konsentrasi ekstrak dalam organ bath didapat 2 mg/ml.
c. Dipipet 125 µL ekstrak daun keji beling ke dalam organ bath sehingga konsentrasi ekstrak dalam organ bath didapat 3 mg.ml.
d. Dipipet 125 µL ekstrak daun keji beling ke dalam organ bath sehingga konsentrasi ekstrak dalam organ bath didapat 4 mg/ml.
e. Dipipet 125 µL ekstrak daun keji beling ke dalam organ bath sehingga konsentrasi ekstrak dalam organ bath didapat 5 mg/ml.
33
g. Dipipet 125 µL ekstrak daun keji beling ke dalam organ bath sehingga konsentrasi ekstrak dalam organ bath didapat 7 mg/ml.
h. Dipipet 125 µL ekstrak daun keji beling ke dalam organ bath sehingga konsentrasi ekstrak dalam organ bath didapat 8 mg/ml.
3.7.2 Pembuatan larutan tirode
Larutan buffer fisiologis yang digunakan adalah larutan tirode. Untuk membuat 1 liter larutan tirode ditimbang:
NaCl : 8,00 gram
KCl : 0,20 gram
MgCl2 : 0,10 gram
NaH2PO4 : 0,05 gram NaHCO3 : 1,00 gram D-Glukosa : 1,00 gram CaCl2 : 0,20 gram
Bahan (NaCl, KCl, MgCl2, NaH2PO3, CaCl2) dilarutkan terpisah dengan akuades sampai larut. NaHCO3 dan D-Glukosa ditambahkan terakhir setelah semua bahan tercampur.
Setelah semua bahan tercampur, larutan di aerasi dengan karbogen (O2 95%, CO2 5%) agar tidak terjadi pengendapan garam kalsium yang ditandai dengan kekeruhan. Selanjutnya larutan diatur pada pH 7,4. Larutan tirode dapat bertahan selama 24 jam (Tyrode, 1910).
3.7.3 Penyiapan larutan asetilkolin
34
Dibuat larutan induk dengan cara melarutkan asetilkolin ke dalam aqua destilata sehingga didapat konsentrasi 2 x 10-1 M. Kemudian dibuat larutan yang lebih encer sampai kadar 2 x 10-6 M dengan faktor pengenceran 5 kali.
a. Pembuatan larutan baku asetilkolin klorida
Timbang seksama asetilkolin klorida (BM 181,60 g/mol) seberat 181,60 mg kemudian dilarutkan dalam 5,0 ml aquadest. Diperoleh larutan asetilkolin klorida 2 x 10-1 M.
b. Pembuatan seri konsentrasi asetilkolin klorida i. Asetilkolin klorida 2 x 10-2 M
Dipipet 500 µL larutan baku asetilkolin 2 x 10-1 M. masukkan kedalam tabung reaksi, tambahkan 4500 µL aquadest. Vortex selama 3 menit. ii. Asetilkolin klorida 2 x 10-3 M
Dipipet 500 µL larutan baku asetilkolin 2 x 10-2 M. masukkan kedalam tabung reaksi, tambahkan 4500 µL aquadest. Vortex selama 3 menit.
iii. Asetilkolin klorida 2 x 10-4 M
Dipipet 500 µL larutan baku asetilkolin 2 x 10-3 M. masukkan kedalam tabung reaksi, tambahkan 4500 µL aquadest. Vortex selama 3 menit.
iv. Asetilkolin klorida 2 x 10-5
Dipipet 500 µL larutan baku asetilkolin 2 x 10-4 M. masukkan kedalam tabung reaksi, tambahkan 4500 µL aquadest. Vortex selama 3 menit.
v. Asetilkolin klorida 2 x 10-6
35 3.7.4 Penyiapan larutan atropin sulfat
Dalam penelitian ini atropin sulfat digunakan sebagai antagonis kolinergik. Senyawa ini dapat menghambat kontraksi otot polos pada usus halus. Dibuat larutan induk dengan cara melarutkan atropin sulfat ke dalam aqua destilata sehingga didapat konsentrasi 2 x 10-1 M. Kemudian dibuat larutan yang lebih encer sampai kadar 2 x 10-6 M dengan faktor pengenceran 5 kali.
a. Pembuatan larutan baku atropin sulfat
Timbang seksama atropin sulfat (BM 694,84 g/mol) seberat 694,84 mg kemudian dilarutkan dalam 5,0 ml aquadest. Diperoleh larutan asetilkolin klorida 2 x 10-1 M.
b. Pembuatan seri konsentrasi atropin sulfat i. Atropin sulfat 2 x 10-2 M
Dipipet 500 µL larutan baku Atropin sulfat 2 x 10-1 M. masukkan kedalam tabung reaksi, tambahkan 4500 µL aquadest. Vortex selama 3 menit. ii. Atropin sulfat 2 x 10-3 M
Dipipet 500 µL larutan baku Atropin sulfat 2 x 10-2 M. masukkan kedalam tabung reaksi, tambahkan 4500 µL aquadest. Vortex selama 3 menit. iii. Atropin sulfat 2 x 10-4 M
Dipipet 500 µL larutan baku Atropin sulfat 2 x 10-3 M. masukkan kedalam tabung reaksi, tambahkan 4500 µL aquadest. Vortex selama 3 menit. iv. Atropin sulfat 2 x 10-5 M
36 v. Atropin sulfat 2 x 10-6 M
Dipipet 500 µL larutan baku Atropin sulfat 2 x 10-5M. masukkan kedalam tabung reaksi, tambahkan 4500 µL aquadest. Vortex selama 3 menit.
3.8 Tahapan Pengujian
3.8.1 Preparasi organ
Pada penelitian ini digunakan usus halus terpisah marmut yang sebelumnya telah di puasakan selama 24 jam. Marmut dikorbankan dengan cara dislokasi tulang belakang kepala (cervix), untuk menghindari pengaruh dari obat-obatan bila digunakan anastesi umum. Dilakukan pembedahan pada bagian abdomen, kulit bagian abdomen dipotong dengan menggunakan gunting. Usus dibersihkan dari lapisan mesenteric yang melindunginya. Saat jaringan sudah rileks, dipotong segmen usus bagian bawah yang mendekati caecum sepanjang 2-3 cm. Dengan menggunakan jarum kedua ujung potongan usus diikat dengan benang pada arah yang berlawanan. Benang bagian bawah usus diikatkan pada batang penahan jaringan dan benang bagian atas usus dihubungkan ke transduser daya. Jaringan usus halus dimasukkan kedalam organ bath yang berisi larutan tirode, dengan suhu larutan dipertahankan 37oC sambil di aerasi dengan karbogen secara terus menerus. Jaringan yang telah terisolasi diinkubasi selama 30 menit dengan pergantian larutan tirode setiap 10 menit. Dibiarkan beberapa saat sampai kondisi ritmik yang optimal (Vogel, et al., 2002).
3.8.2 Pengujian kontraksi seri konsentrasi asetilkolin terhadap otot polos ileum
37
bertingkat dengan pemberian kumulatif asetilkolin sehingga diperoleh konsentrasi di dalam organ bath 10-8 sampai 3 x 10-3 M (Tabel 3.1). Ileum marmut yang telah diekuilibrasi selama 45 menit (dengan pergantian larutan tirode tiap 15 menit) diberikan larutan asetilkolin klorida dengan konsentrasi didalam organ bath 10-8 sampai 10-3 M (otot polos ileum tikus menunjukkan respon kontraksi maksimum). Tabel 3.1 Pemberian asetilkolin secara kumulatif pada organ bath volume 40ml
Konsentrasi larutan
3.8.3 Pengujian efek kontraksi ekstrak etanol keji beling pada kontraksi otot polos ileum
38
daun keji beling ke dalam organ bath (Tabel 3.2). Ileum marmut yang telah diekulibrasi selama 45 menit (dengan pergantian larutan tirode tiap 15 menit) diberikan ekstrak etanol daun keji beling didalam organ bath.
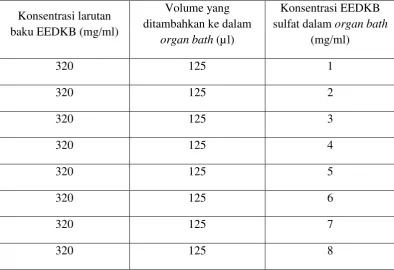
Tabel 3.2 Pemberian konsentrasi ekstrak etanol daun keji beling secara kumulatif pada organ bath volume 40 ml. sulfat dalam organ bath
(mg/ml)
3.8.4 Pengujian mekanisme aksi terhadap efek kontraksi ekstrak etanol daun keji beling pada otot polos ileum
39 3.9 Data dan Analisis Data
3.9.1 Data
Data yang diperoleh dalam penelitian ini adalah data kontraksi otot polos ileum pada komputer (program komputer : LabChart® 7.02). Data yang diperoleh dalam persentase (%) respons terhadap respons maksimum yang dicapai. Selanjutnya, dibuat grafik hubungan antara konsentrasi terhadap % respon.
3.9.2 Analisis data
Nilai EC80 (konsentrasi agonis yang dapat menghasilkan respon sebesar 80% dari respons maksimum) agonis reseptor, dihitung berdasarkan grafik hubungan konsentrasi terhadap %respon. EC80 dihitung berdasarkan persamaan dibawah ini:
Keterangan:
�����80 =� 80−�1
�2−�1 × (�2− �1)�+�1
X1 : Log. konsentrasi dengan respons tepat di bawah 80% X2 : Log. konsentrasi dengan respons tepat di atas 80% Y1 : %respons tepat di bawah 80%
Y2 : %respons tepat di atas 80%
40 BAB IV
HASIL DAN PEMBAHASAN
4.1 Pemeriksaan Bahan Tumbuhan
4.1.1 Hasil identifikasi tanaman
Hasil identifikasi yang dilakukan di Herbarium Bogoriense. Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor terhadap sampel tanaman yang digunakan pada penelitian ini adalah keji beling (Strobilanthus crispus (L.) Blume) suku Acanthaceae.Hasil identifikasi dapat dilihat pada lampiran 1 halaman 55.
4.1.2 Hasil karakterisasi simplisia
Standarisasi suatu simplisia dilakukan sebagai pemenuhan terhadap persyaratan sebagai bahan obat dan menjadi penetapan nilai untuk berbagai parameter produk (Ditjen POM, 2000).
Hasil pemeriksaan karakteristik simplisia daun keji beling secara makroskopik adalah daun berwarna hijau tua, helai daun berbentuk lanset melonjong atau hampir jorong, pinggir daun bergerigi, panjang helai daun 9 cm sampai 18 cm, lebar helai daun 3 cm sampai 8 cm. Kedua permukaannya kasar. Hasil pemeriksaan makroskopik simplisia daun keji beling dapat dilihat pada Lampiran 4 halaman 58.
Hasil pemeriksaan mikroskopik simplisia daun kejii beling terlihat adanya fragmen pengenal berupa sel-sel litosis dan sistolit. Fragmen permukaan bawah daun dengan stomata tipe bidiastik, rambut penutup dan rambut kelenjar. Hasil pemeriksaan mikroskopik simplisia daun keji beling dapat dilihat pada Lampiran 5 halaman 59.
41
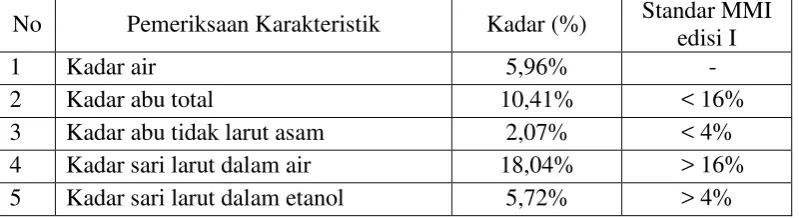
Tabel 4.1 Hasil karakteristik simplisia daun keji beling.
No Pemeriksaan Karakteristik Kadar (%) Standar MMI edisi I
1 Kadar air 5,96% -
2 Kadar abu total 10,41% < 16%
3 Kadar abu tidak larut asam 2,07% < 4%
4 Kadar sari larut dalam air 18,04% > 16% 5 Kadar sari larut dalam etanol 5,72% > 4%
Monografi dari simplisia daun keji beling tertera di buku Materia Medika Indonesia (MMI) Edisi I kecuali untuk parameter kadar air. Hasil penetapan kadar air simplisia daun keji beling adalah 5,96%telah memenuhi standarisasi kadar air simplisia secara umum yaitu tidak lebih dari 10% (Ditjen POM, 1995). Kelebihan air dalam simplisia menyebabkan pertumbuhan mikroba, jamur atau serangga, serta mendorong kerusakan bahan aktif yang terkandung didalamnya karena dapat terurai (hidrolisis) (WHO, 1998).
Berdasarkan hasil dari penetapan kadar simplisia daun keji beling pada Tabel 4.1 dapat dilihat bahwa kadar abu total, kadar abu tidak larut asam, kadar sari larut dalam air, kadar sari larut dalam etanol dari simplisia daun keji beling telah memenuhi persyaratan menurut Materia Medika Indonesia Edisi I. Perhitungan hasil karakterisasi simplisia daun keji beling dapat dilihat pada Lampiran 9 halaman 63-67.
4.2 Skrining Fitokimia
42
steroid/triterpenoid. Hasil skrining fitokimia simplisia dan ekstrak dari daun keji beling dapat dilihat pada Tabel 4.2.
Tabel 4.2 Hasil skrining fitokimia simplisia dan ekstrak etanol daun keji beling
No Pemeriksaan Kandungan Hasil
Simplisia Ekstrak
Berdasarkan hasil skrining diketahui bahwa simplisia dan ekstrak etanol daun keji beling mengandung alkaloid, flavonoid, tanin, glikosida, saponin dan steroid/triterpenoid.
4.3 Ekstraksi Serbuk Simplisia Daun Keji Beling
Pembuatan ekstrak dilakukan dengan metode perkolasi menggunakan pelarut etanol 96%. Serbuk kering simplisia daun keji beling yang diperoleh sebanyak 855 gram setelah perkolasi dan dipekatkan dengan menggunakan rotary evaporator diperoleh ekstrak kental sebanyak 156,8 gram.
4.4. Hasil Pengujian Kontraksi Seri konsentrasi Asetilkolin Terhadap Otot Polos Ileum
43
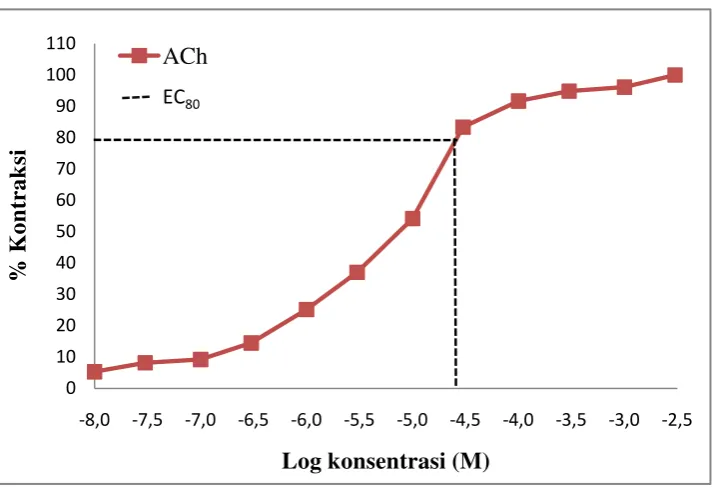
otot polos ileum terisolasi terhadap peningkatan konsentrasi asetilkolin (10-8 M sampai 3 x 10-3 M) (Gambar 4.1).
Gambar 4.1 Grafik %kontraksi otot polos organ ileum terisolasi yang dikontraksi dengan pemberian seri konsentrasi asetilkolin (10-8 – 3 x 10-3 M). Data yang disajikan adalah nilai rata-rata ± SEM, n = 3.
Penambahan seri konsentrasi asetilkolin menyebabkan terjadinya kontraksi pada otot polos ileum terisolasi. Kontraksi otot polos ileum meningkat dengan meningkatnya konsentrasi asetilkolin. Respon kontraksi maksimal otot polos ileum diperoleh pada konsentrasi asetilkolin 2 x 10-2 M, karena peningkatan konsentrasi asetilkolin yang lebih tinggi tidak lagi menunjukkan peningkatan kontraksi. Jumlah reseptor membatasi efek yang ditimbulkan, sehingga walaupun konsentrasi ditingkatkan, respon tidak bertambah. Respon terhadap dosis obat yang rendah biasanya meningkat sebanding langsung dengan dosis. Namun, dengan meningkatnya dosis peningkatan respon menurun. Pada akhirnya tercapailah dosis yang tidak dapat meningkatkan respon lagi (Bourne dan Zastrow, 2001). Hasil pengujian kontraksi otot polos ileum marmut dengan
44
penambahan seri konsentrasi asetilkolin dapat dilihat pada Lampiran 14 halaman 63.
Asetilkolin bekerja pada reseptor ACh (reseptor asetilkolin – muskarinik = kolinoseptor) pada sel-sel pascasinaptik di sel-sel efektor (otot polos, otot jantung dan kelenjar). Asetilkolin menstimulasi sekresi kelenjar dan menyebabkan kontraksi otot polos melalui aktivasi reseptor M3. Pemberian obat agonis muskarinik akan merangsang sekresi kelenjar terutama kelenjar ludah dan lambung, serta meningkatkan aktifitas motorik saluran cerna dan merelaksasi sfinkter. Keadaan ini disebabkan oleh depolarisasi dan Ca++ pada otot polos saluran cerna (Munaf, 1994).
4.5 Hasil Pengujian Kontraksi Ekstrak Daun Etanol Keji Beling (EEDKB) Pada Otot Polos Ileum
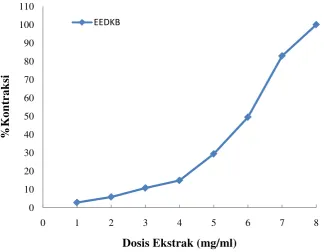
Pengujian efek kontraksi EEDKB terhadap otot polos ileum terisolasi dengan cara mengkontraksi otot polos ileum melalui pengamatan terhadap %respon kontraksi otot polos ileum terhadap penambahan seri konsentrasi ekstrak 1-8 mg/mL pada organ ileum. Pemberian seri konsentrasi EEDKB menghasilkan efek kontraksi (Gambar 4.2).
Berdasarkan uji korelasi diperoleh hubungan antara konsentrasi EEDKB
dengan besarnya efek kontraksi otot polos ileum terisolasi yang bermakna (r = 0,965; p < 0,05). Hal ini menunjukkan bahwa sebanyak 96,5% peningkatan
45
Gambar 4.2 Grafik %kontraksi setelah pemberian seri konsentrasi ekstrak etanol daun keji beling (EEDKB) pada otot polos ileum terisolasi. Data yang di sajikan adalah nilai rata-rata ±SEM, n = 8.
Berdasarkan afinitasnya pada Gambar 4.3 menunjukkan bahwa ikatan yang terjadi antara asetilkolin dengan reseptor jauh lebih kuat dibandingkan dengan ikatan yang terjadi pada EEDKB. Hal ini dikarenakan EEDKB belum menjadi senyawa murni yang masih banyak mengandung komponen-komponen kimia campuran sedangkan asetilkolin merupakan senyawa murni dimana kerjanya mirip dengan ACh endogen.
46
Gambar 4.3 Grafik kekuatan kontraksi setelah pemberian seri konsentrasi (A) asetilkolin (1=10-8; 2=3x10-8; 3=10-7; 4=3x10-7; 5=10-6; 6=3x10-6; 7=10-5; 8=3x10-5 M) dan (B) ekstrak etanol daun keji beling (EEKB) (1=1; 2=2; 3=3; 4=4; 5=5; 6=6; 7=7; 8=8 mg/ml) pada otot polos ileum terisolasi. Data yang di sajikan adalah nilai rata-rata ± SEM, n = 8.
Berdasarkan hasil analisis kekuatan kontraksi menunjukkan tidak terdapat perbedaan persentase efek kontraksi yang signifikan antara asetilkolin dan ekstrak (p > 0,05; uji t-independent).
4.6 Hasil Pengujian Mekanisme Aksi Terhadap Efek Kontraksi Ekstrak Etanol Daun Keji Beling (EEDKB) Pada Otot Polos Ileum dalam inkubasi Atropin Sulfat
Pengujian mekanisme efek kontraksi pada otot polos ileum terisolasi diamati dengan pengujian yang diawali dengan inkubasi ileum dengan antagonis muskarinik yaitu atropin sulfat 2 x 10-3 selama 10 menit. Efek kontraksi yang dihasilkan kemudian dibandingkan dengan efek kontraksi EEDKB yang dilakukan tanpa inkubasi dengan atropin.
47
Pengujian mekanisme efek kontraksi EEDKB dengan inkubasi atropin dan tanpa inkubasi terdapat perbedaan persentase efek kontraksi. Pada konsentrasi 1 – 2 mg/mL menunjukkan bahwa persentase efek kontraksi yang signifikan (p < 0,05) antara perlakuan dengan inkubasi awal dengan larutan atropin dan tanpa inkubasi awal pada organ ileum. Sedangkan pada konsentrasi 3-8 mg/mL, perlakuan dengan inkubasi awal dan tanpa inkubasi tidak terdapat perbedaan efek kontraksi yang signifikan (p > 0,05; uji t-independen)(Gambar 4.4).
Gambar 4.4 Grafik %kontraksi setelah pemberian seri konsentrasi ekstrak etanol daun keji beling (EEDKB) yang diinkubasi dengan atropin selama 10 menit dan tanpa inkubasi. Data dianalisis menggunakan uji-t independen. Data yang disajikan adalah nilai rata-rata ±SEM, n= 6.
48
Tabel 4.3 Persentase kontraksi setelah pemberian seri konsentrasi EEDKB yang diinkubasi dengan atropin 2 x 10-3 selama 10 menit dan tanpa inkubasi
Perlakuan AUC
Ekstrak 131,773583 ± 6,878%
Atropin+Ekstrak 126,167200 ± 3,15489
49
50 BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian efek kontraksi ekstrak etanol daun keji beling (Strobilanthus crispus (L.) Blume) terhadap otot polos ileum marmut (Cavia porcellus) terisolasi secara in vitro, maka dapat disimpulkan:
a. ekstrak etanol daun keji beling (Strobilanthus crispus (L.) Blume) memiliki efek kontraksi terhadap otot polos ileum marmut terisolasi. Terdapat pengaruh antara peningkatan konsentrasi ekstrak etanol daun keji beling dengan efek kontraksi otot polos ileum marmut terisolasi (r = 0,965; p < 0,05).
b. mekanisme efek kontraksi EEDKB pada otot polos ileum terisolasi diduga tidak melalui jalur reseptor muskarinik.
5.2 Saran
Dari penelitian yang telah dilakukan maka disarankan untuk melakukan: a. pengujian efek kontraksi dari berbagai fraksi.