(Cr
3+) UNTUK MENINGKATKAN KETAHANAN
TUBUH IKAN MAS TERHADAP VIRUS
HERPES
PADA SUHU
RENTAN KHV
AYI SANTIKA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN
MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Efektivitas
Suplementasi Kromium-Ragi (Cr3+) untuk Meningkatkan Ketahanan Tubuh Ikan
Mas terhadap Virus Herpes pada Suhu Rentan KHV, adalah karya saya sendiri
dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun.
Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun
tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan
dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2007
Ayi Santika
Meningkatkan Ketahanan Tubuh Ikan Mas terhadap Virus Herpes pada Suhu Rentan KHV. Dibimbing oleh DARNAS DANA, MARTHEN B.M. MALOLE
Penelitian ini dilakukan untuk mengkaji efektivitas suplementasi
kromium-ragi (Cr3+) untuk meningkatkan ketahanan tubuh ikan mas terhadap koi
herpes virus (KHV), pada berbagai suhu media pemeliharaan. Penelitian
dilakukan dalam dua tahap. Penelitian tahap pertama untuk mengkaji pengaruh
suhu terhadap status kesehatan ikan yang dianalisis berdasarkan gambaran darah,
dan keterkaitannya dengan kejadian infeksi KHV. Penelitian tahap dua dilakukan
untuk menguji efektifitas suplementasi kromium-ragi (Cr3+) sebagai bahan
immunostimulan untuk meningkatkan respon imunitas selular non spesifik ikan
mas dalam menghadapi serangan KHV.
Penelitian tahap satu dan dua menggunakan model eksperimental
laboratorium. Penelitian tahap satu dalam aplikasinya berupa penginfeksian KHV
secara intramuscular (Dosis FID50-120 jam), pada ikan mas yang dipelihara dalam
suhu media yang berbeda. Rancangan yang digunakan pada penelitian tahap ini
adalah Rancangan Acak Lengkap (RAL), terdiri dari 3 perlakuan, yaitu
penginfeksian virus pada level suhu media : 20±2 oC (Ti), 25±2 oC (Tii) dan
30±2oC (Tiii). Adapun untuk penelitian tahap dua menggunakan Rancangan Acak
Lengkap Faktorial (Faktorial RAL), terdiri atas faktor suhu dan dosis
kromium-ragi (Cr 3+). Faktor suhu mengaplikasikan 2 level suhu media yaitu Ti (suhu 20±2
0
C) dan Tii (suhu 25±2 0C), dimana kedua suhu tersebut bersifat rentan terhadap
infeksi KHV (hasil penelitian tahap satu), sedangkan dosis kromium-ragi terdiri
dari 3 level yaitu, penambahan kromium ragi dalam pakan sebanyak 1.5 ppm
(K1); 2.0 ppm (K2); 2.5 ppm (K3) dan kontrol yaitu kromium 0 ppm (K0).
Hasil penelitian tahap satu menunjukkan bahwa ikan mas yang dipelihara
pada suhu 20±2 oC (Ti), 25±2 oC (Tii) bersifat rentan terhadap infeksi KHV.
Hasil penelitian tahap dua memperlihatkan bahwa konsentrasi optimal
meningkatkan respon imunitas non spesifik ikan mas secara maksimal sehingga
MENINGKATKAN KETAHANAN TUBUH IKAN MAS TERHADAP VIRUS HERPES PADA SUHU RENTAN KHV
(Effectiveness of Dietary Organic Chromium Supplementation to Improve Immune Response of Common Carp (Cyprinus carpio) Against Herpes Virus Infection)
A research to study the effectiveness of dietary organic chromium supplementation to improve immune responses of common carp against herpes virus (KHV) in different temperature was done. Research was conducted with “Two Factors Experiments in Completely Randomized Design”. The first factor was concentration of chromium supplementation on diet which have four levels of chromium, namely diet K0 (0 ppm Cr3+), diet K1 (1.5 ppm Cr3+), diet K2 (2 ppm Cr3+) and diet K3 (2.5 ppm Cr3+). The second factor was two levels of water temperature, namely Ti (temperature 20 oC), and Tii (temperature 25 oC). Supplementation of organic chromium was applied on commercial diet (protein concentration ± 26 %). Juvenile Common Carp (15-20 g average weight) which have been conditioned in two levels temperature (Ti and Tii), were fed four different diets (K0, K1, K2, and K3) for 8 weeks. After 4 weeks fish were injected intramuscularly with 0.1 ml filtrates homogenates containing one FID50 of herpes virus. Observation on clinical sign, and histological evaluation were done to confirm the KHV infection. Haematological evaluation was done every week by measuring haematological parameters such as haematocrit value, leucocyte count, leucocyte differential count and Phagoytic activity. The result showed the gill necrosis as the main clinical sign. Diseased fish showed consistent histopatological findings including intranuclear amphophilic inclusion bodies with peripheral chromatin margination. Diet containing chromium 1.5 ppm on temperature 25 oC (K1.Tii) and diet containing chromium 2 ppm on temperature 20 oC (K2.Ti) have capability to increase haematocrit value, leucocyte count, leucocyte differential count and phagolytic activity.
EFEKTIVITAS SUPLEMENTASI KROMIUM-RAGI (Cr
3+)
UNTUK MENINGKATKAN KETAHANAN TUBUH IKAN MAS
TERHADAP VIRUS
HERPES
PADA SUHU
RENTAN KHV
AYI SANTIKA
Tesis
Diajukan sebagai salah satu syarat untuk
memperoleh gelar Magister Sains pada Program Studi Ilmu Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis
:
Efektivitas Suplementasi Kromium-Ragi (Cr3+) untuk Meningkatkan Ketahanan Tubuh Ikan Mas terhadap Virus Herpes, pada Suhu Rentan KHVNama Mahasiswa
: Ayi Santika
Nomor Pokok
: C151030081
Program Studi
: Ilmu Perairan
Disetujui,
Komisi Pembimbing
Prof. Dr. Ir. Darnas Dana, M.Sc (Alm.) Dr. drh. Marthen B.M. Malole, M.Sc
Ketua Anggota
Diketahui,
Ketua Program Studi Ilmu Perairan, Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Enang Harris, MS Prof. Dr. Ir. Khairil A. Notodiputro, MS
Puji dan syukur kepada Allah SWT, atas berkat dan perlindunganNya,
sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam
penelitian yang dilaksanakan sejak Bulan Mei-November 2006 ini adalah Upaya
Peningkatan Ketahanan Tubuh Ikan Mas terhadap Virus Herpes Melalui
Suplementasi Kromium-Ragi (Cr3+).
Pada kesempatan ini, penulis menyampaikan terima kasih kepada:
1. Komisi Pembimbing, Bapak Prof. Dr. Darnas Dana, M.Sc selaku ketua, dan
Bapak Dr. Drh. Marthen B.M. Malole, M.Sc sebagai anggota atas segala
fasilitas dan bimbingannya selama penelitian dan penulisan tesis.
2. Pembimbing Luar Komisi, Ibu Dr. Ir. Etty Riany MS yang telah menguji dan
memberi banyak saran dalam perbaikan penulisan tesis.
3. Kepala Balai Besar Pengembangan Budidaya Air Tawar Sukabumi, Bapak
Ir.Maskur atas kesempatan dan dukungan yang diberikan kepada penulis
untuk menyelesaikan tugas belajar di Sekolah Pascasarjana IPB, melalui Dana
APBN. TA. 2003-2004 dan 2004-2005.
4. Ibu Ir. Endang Mudjiutami & Ibu Ir. Murtiati dan rekan di Lababoratorium
Kesehatan Ikan dan Lingkungan yang telah banyak memberi dorongan
semangat dan fasilitas selama penelitian dan Bapak Ir. Ceno H. Adi, M.Si
serta Ir Ahmad Jauhary, M.Si dan rekan yang telah memberi kesempatan
pemakaian fasilitas di Indoor Hatchery. Tidak lupa rekan Adi Sucipto, Ade
Sunarma yang telah banyak membantu dan memberikan dorongan semangat.
5. Ucapan terimasih yang mendalam disampaikan kepada yang tercinta ayah, ibu
beserta Azizah, Nadiya, Fiqri, Takiyudin dan keluarga atas segala doa dan
kasih sayang.
Bogor, Agustus 2007
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 13 Maret 1969 dari Ayah Drs
H.E.A Suryadi dan Ibu Hj. Saleha. Penulis merupakan anak ketiga dari sembilan
bersaudara.
Tahun 1987 penulis lulus dari SMAN Balaendah, Bandung dan pada tahun
yang sama diterima di Institut Pertanian Bogor, melalui jalur PMDK. Gelar
Sarjana (S-1) diperoleh dari Program Studi Budidaya Perairan, Fakultas Perikanan
dan Ilmu Kelautan, Institut Pertanian Bogor pada tahun 1993. Pada tahun
1993-1994 penulis bekerja pada PT. Hemakaruna Citra di Denpasar, Bali, dan pada
tahun 1994-1997 berwirausaha pembenihan ikan bandeng dan kerapu di
Singaraja, Bali. Pada tahun 1997 hingga saat ini penulis bekerja sebagai
perekayasa di Balai Besar Pengembangan Budidaya Air Tawar di Sukabumi.
Pada tahun 2003 penulis masuk Sekolah Pasca Sarjana pada Program Studi Ilmu
Perairan.
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... x
I. PENDAHULUAN 1.1. Latar Belakang ... 1
1.2. Tujuan dan Manfaat ... 3
1.3. Perumusan Hipotesis... 3
II. TINJAUAN PUSTAKA... 4
2.1. Koi Herpes Virus (KHV) ... 4
2.1.1. Karakteristik KHV... .. ... 4
2.1.2. Patogenitas dan Gejala Klinis ... 5
2.1.3. Diagnosa Virologis KHV ... 8
2.2. Hematologi ... 8
2.3. Sistem Pertahanan Ikan... 11
2.4. Virulensi KHV, Respon Imunitas Ikan dan Suhu Lingkungan . 17 2.5. Kromium-ragi (Cr 3+) sebagai Immunostimulan... 19
III. METODOLOGI... 23
3.1. Waktu dan Tempat ... 23
3.2. Rancangan Penelitian... 23
3.3. Prosedur Penelitian ... 24
3.3.1. Penelitian Tahap Satu: Penentuan Pengaruh Suhu terha- dap Infeksi KHV ... 24
3.3.2. Penelitian Tahap Dua: Penentuan Efektifitas Suplemen- tasi kromium-ragi sebagai Immunostimulan pada Suhu Rentan KHV ... 26
3.4. Analisis Data ... 29
IV. HASIL DAN PEMBAHASAN... 30
4.1. Hasil Penelitian Tahap Satu ... 30
4.1.1. Penentuan Pengaruh Suhu terhadap Infeksi KHV ... 30
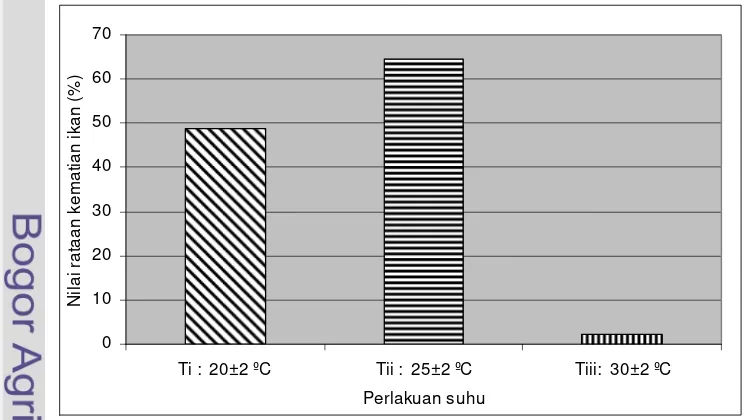
4.1.1.1. Prosentase Kematian Ikan... 30
4.1.1.2. Gejala Klinis dan Pola Kematian Ikan... 31
4.1.1.3. Pengamatan pada Preparat Histologi ... 35
4.1.2. Status Kesehatan Ikan pada Berbagai Perlakuan Suhu.... 39
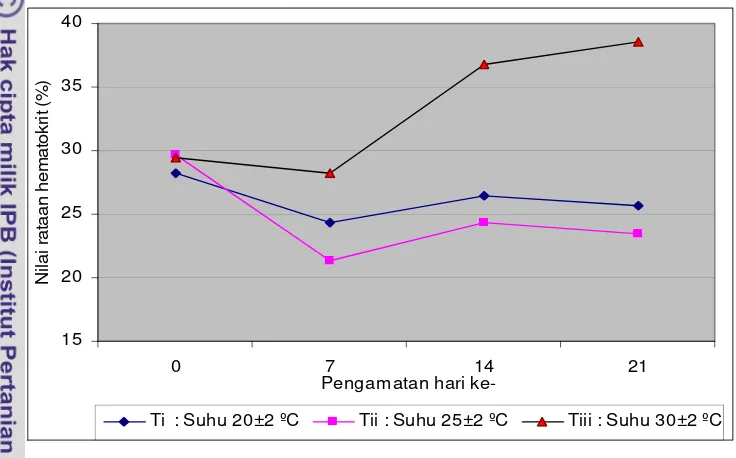
4.1.2.1. Hematokrit ... 39
4.1.2.2. Total Leukosit ... 40
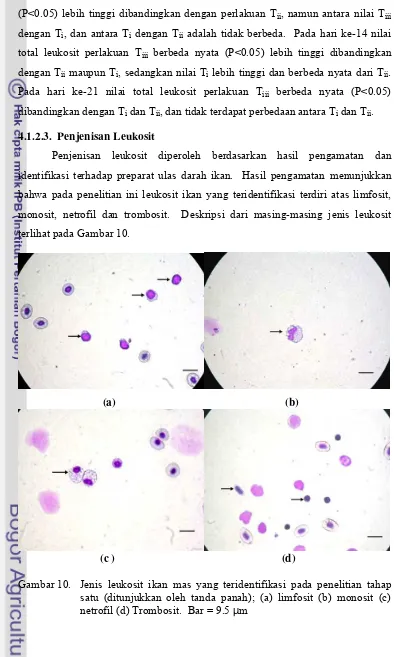
4.1.2.3. Penjenisan Leukosit ... 42
4.1.2.4. Indeks Fagositosis ... 48
4.2. Hasil Penelitian Tahap Dua ... 50
4.2.1. Status Kesehatan Ikan pada Berbagai Perlakuan Konsen- trasi Kromium dan Suhu, serta Responnya terhadap In- feksi KHV ... 50
4.2.1.1. Hematokrit ... 50
4.2.1.2. Total Leukosit ... 54
4.2.1.3. Penjenisan Leukosit ... 58
4.2.1.4. Indeks Fagositosis ... 76
4.2.2. Respon Ikan yang Diberi Pakan Berkromium terhadap Infeksi KHV... 81
4.2.2.1. Prosentase Kematian Ikan ... 81
4.2.2.2. Gejala Klinis dan Pola Kematian Ikan... 82
4.2.3. Kualitas Air pada Penelitian Tahap Dua... 84
4.3. Pembahasan Penelitian Tahap Satu ... 85
4.3.1. Pengaruh Suhu terhadap Infeksi KHV... 85
4.3.1.1. Prosentase Kematian Ikan ... 85
4.3.1.2. Gejala Klinis dan Pola Kematian Ikan ... 87
4.3.1.3. Pengamatan Histopatologi untuk Validasi Infeksi KHV ... 90
4.3.2. Status Kesehatan Ikan pada Berbagai Perlakuan Suhu.... 91
4.3.2.1. Hematokrit ... 91
4.3.2.2. Total Leukosit ... 92
4.3.2.3. Penjenisan Leukosit ... 95
4.3.2.4. Indeks Fagositosis ... 100
4.3.3. Kualitas Air pada Penelitian Tahap Satu ... 101
4.4. Pembahasan Penelitian Tahap Dua ... 102
4.4.1. Status Kesehatan Ikan pada Berbagai Perlakuan Konsen- trasi Kromium dan Suhu, serta Responnya terhadap In-
DAFTAR TABEL
Halaman
1. Kombinasi perlakuan konsentrasi kromium-ragi (Cr3+) dan suhu
media pemeliharaan pada penelitian tahap dua... 24
2. Uraian tahapan kegiatan pada penelitian tahap dua ... 28
3. Nilai rataan prosentase kematian ikan pada masing-masing perla-
kuan dan hasil uji Duncan pada penelitian tahap satu ... 31
4. Nilai rataan prosentase hematokrit dan hasil uji Duncan pada
masing-masing perlakuan suhu pada penelitian tahap satu ... 40
5. Nilai rataan total leukosit dan hasil uji Duncan pada penelitian
tahap satu ... 41
6. Nilai rataan limfosit dan hasil uji Duncan pada penelitian tahap
satu ... 43
7. Nilai rataan monosit dan hasil uji Duncan pada penelitian tahap
satu ... 45
8. Nilai rataan netrofil dan hasil uji Duncan pada penelitian tahap
satu ... 46
9. Nilai rataan trombosit dan hasil uji Duncan pada penelitian tahap
satu ... 47
10. Nilai rataan indeks fagositosis dan hasil uji Duncan pada peneli-
tian tahap satu ... 49
11. Kisaran parameter kualitas air pada penelitian tahap satu ... 49
12.1.Nilai rataan hematokrit dan hasil uji Duncan dari masing-masing
perlakuan pada penelitian tahap dua (periode sebelum infeksi) ... 51
12.2.Nilai rataan hematokrit dan hasil uji Duncan dari masing-masing
perlakuan pada penelitian tahap dua (periode setelah infeksi) ... 53
13.1.Nilai rataan total leukosit dan hasil uji Duncan dari masing-masing perlakuan pada penelitian tahap dua (periode sebelum infeksi) ... 56
14.1.Nilai rataan limfosit dan hasil uji Duncan dari masing-masing
perlakuan pada penelitian tahap dua (periode sebelum infeksi) ... 60
14.2.Nilai rataan limfosit dan hasil uji Duncan dari masing-masing
perlakuan pada penelitian tahap dua (periode setelah infeksi) ... 62
15.1.Nilai rataan monosit dan hasil uji Duncan dari masing-masing
perlakuan pada penelitian tahap dua (periode sebelum infeksi) ... 65
15.2.Nilai rataan monosit dan hasil uji Duncan dari masing-masing
perlakuan pada penelitian tahap dua (periode setelah infeksi) ... 66
16.1.Nilai rataan netrofil dan hasil uji Duncan dari masing-masing
perlakuan pada penelitian tahap dua (periode sebelum infeksi) .... 69
16.2.Nilai rataan netrofil dan hasil uji Duncan dari masing-masing
perlakuan pada penelitian tahap dua (periode setelah infeksi) ... 71
17.1.Nilai rataan trombosit dan hasil uji Duncan dari masing-masing
perlakuan pada penelitian tahap dua (periode sebelum infeksi) ... 73
17.2.Nilai rataan trombosit dan hasil uji Duncan dari masing-masing
perlakuan pada penelitian tahap dua (periode setelah infeksi) ... 75
18.1.Nilai rataan indeks fagositosis dan hasil uji Duncan dari masing-
masing perlakuan pada penelitian tahap dua (sebelum infeksi) .... 78
18.2 Nilai rataan indeks fagositosis dan hasil uji Duncan dari masing-
masing perlakuan pada penelitian tahap dua (setelah infeksi) ... 79
19. Nilai rataan prosentase kematian ikan pada masing-masing perla- .
kuan dan hasil uji Duncan, pada penelitian tahap dua ... 82
DAFTAR GAMBAR
Halaman
1. Nilai rataan prosentase kematian ikan pada penelitian tahap satu .... 30
2. Gambaran gejala klinis KHV pada suhu 20 dan 25±2 oC... 32
3. Gambaran gejala klinis KHV pada suhu 30±2 oC... 33
4. Pola kematian ikan pada berbagai perlakuan suhu, setelah penginfeksian virus pada penelitian tahap satu ... 34
5. Gambaran histopatologi insang dari ikan yang terinfeksi virus pada perlakuan suhu 20±2 oC ... 36
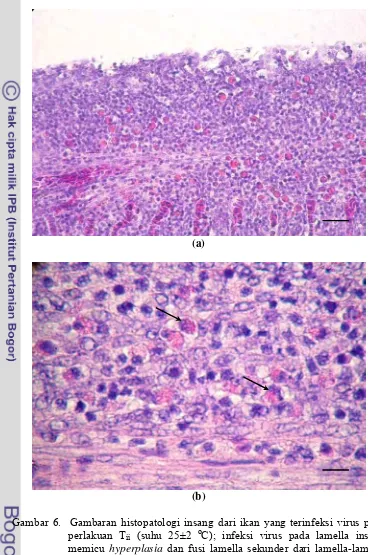
6. Gambaran histopatologi insang dari ikan yang terinfeksi virus pada perlakuan suhu 25±2 oC ... 37
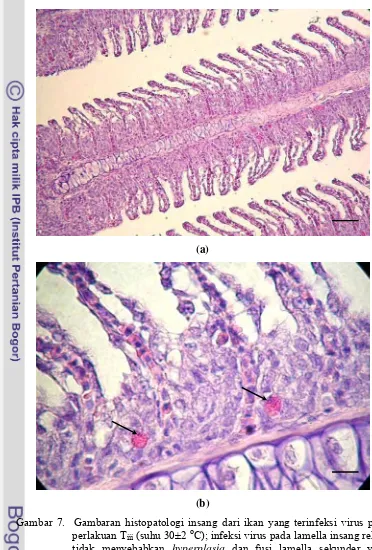
7. Gambaran histopatologi insang dari ikan yang terinfeksi virus pada perlakuan suhu 30±2 oC ... 38
8. Pola perubahan nilai rataan hematokrit pada penelitian tahap satu .. 40
9. Pola perubahan nilai rataan total leukosit pada penelitian tahap satu 41 10.Jenis leukosit ikan mas yang teridentifikasi pada penelitian tahap satu ... 42
11.Pola perubahan nilai rataan limfosit pada penelitian tahap satu ... 43
12.Pola perubahan nilai rataan monosit pada penelitian tahap satu... 44
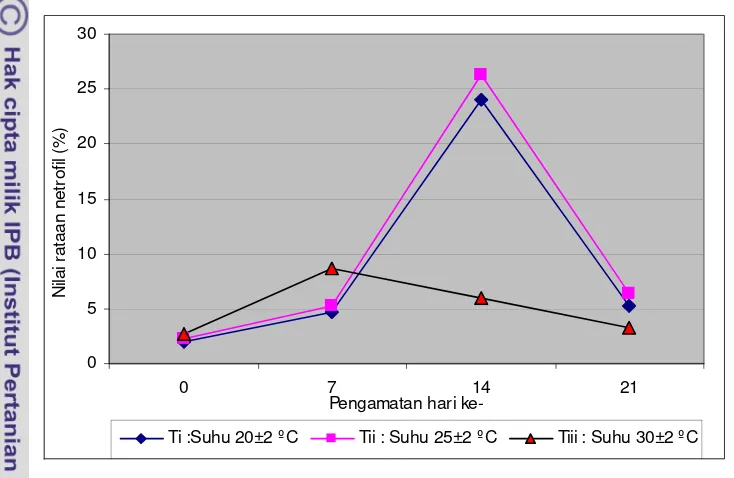
13.Pola perubahan nilai rataan netrofil pada penelitian tahap satu... 46
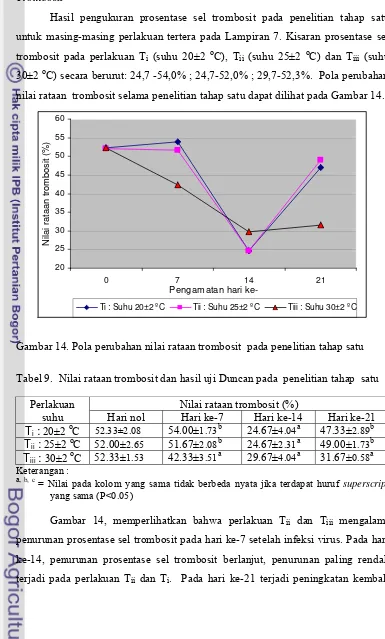
14.Pola perubahan nilai rataan trombosit pada penelitian tahap satu .... 47
15.Pola perubahan nilai rataan indeks fagositosis pada penelitian tahap satu ... 48
16.Pola perubahan nilai rataan hematokrit pada penelitian tahap dua... 50
17.Pola perubahan nilai rataan total leukosit pada penelitian tahap dua 55 18.Pola perubahan nilai rataan limfosit pada penelitian tahap dua... 59
20.Pola perubahan nilai rataan netrofil pada penelitian tahap dua ... 68
21.Pola perubahan nilai rataan trombosit pada penelitian tahap dua... 72
22.Pola perubahan nilai rataan indeks fagositosis pada penelitian tahap dua... 77
23.Nilai rataan prosentase kematian ikan pada berbagai perlakuan, pada penelitian tahap dua ... 81
24.Pola kematian ikan pada berbagai perlakuan, setelah penginfeksian
DAFTAR LAMPIRAN
Halaman
1. Data kematian harian dan nilai kumulatif prosentase kematian pada penelitian tahap satu
128
2. Hasil analisis varian prosentase ikan yang mati dan atau terinfeksi parah (moribund) pada penelitian tahap satu
128
3. Data hasil pengukuran hematokrit pada penelitian tahap satu 129
4. Hasil analisis varians prosentase hematokrit pada penelitian tahap satu
129
5. Data rataan total leukosit pada penelitian tahap satu 130
6. Hasil analisis varians rataan total leukosit pada penelitian tahap satu
130
7. Data penjenisan leukosit pada penelitian tahap satu 131
8. Hasil analisis varians rataan prosentase limfosit, monosit, netrofil dan trombosit pada penelitian tahap satu
132
9. Data indek fagositosis pada penelitian tahap satu 134
10. Hasil analisis varians rataan prosentase indeks fagositosis pada penelitian tahap satu
134
11. Data hasil pengukuran hematokrit pada penelitian tahap dua 135
12. Hasil analisis varians prosentase hematokrit pada penelitian tahap dua
136
13. Data rataan total leukosit pada penelitian tahap dua 139
14. Hasil analisis varians total leukosit pada berbagai perlakuan pada penelitian tahap dua
140
15. Data penjenisan leukosit, pada penelitian tahap dua 143
16. Hasil analisis varians prosentase limfosit pada penelitian tahap dua.
145
17. Hasil analisis varians prosentase monosit pada penelitian tahap dua
148
18. Hasil analisis varians prosentase netrofil pada penelitian tahap dua
151
19. Hasil analisis varians prosentase trombosit pada penelitian tahap dua
20. Data indek fagositosis pada penelitian tahap dua 157
21. Hasil analisis varians prosentase indeks fagositosis pada penelitian tahap dua
158
22. Data kematian ikan pada penelitian tahap dua 161
23. Hasil analisis varians prosentase kematian ikan dan atau ikan yang terinfeksi parah (moribund) pada penelitian tahap dua
162
24. Uji pendahuluan (FID50-120 jam) 163
25. Metode analisis parameter darah yang digunakan pada penelitian 164
1.1. Latar Belakang
Serangan koi herpes virus (KHV) pada ikan mas dan koi telah tersebar ke
berbagai belahan dunia sejak tahun 1998, meliputi beberapa negara seperti
Amerika Serikat, Jerman, Italia, Belanda, Israel (Gilad et al. 2003); Korea (Cho et
al. 2005); Jepang (Ikuta et al. 2005); dan sejak tahun 2002 tercatat menyerang
berbagai kawasan di Indonesia (Sunarto et al. 2005). KHV bersifat sangat
menular namun terbatas menyerang ikan mas dan koi (Cyprinus carpio),
mengakibatkan mortalitas tinggi (80-100% populasi) (Ilouze et al. 2006), dengan
masa inkubasi 14 hari (Taukhid et al. 2004). Kasus ini telah mengakibatkan
kerugian besar bagi petani, hobbyist serta pengusaha ikan mas dan koi. Kerugian
yang tercatat di Indonesia, berdasarkan informasi yang dikumpulkan hingga awal
tahun 2004, secara kumulatif untuk wilayah pulau Jawa, Bali, Sumbawa dan
Sumatra diperkirakan mencapai lebih dari 100 milyar rupiah (Taukhid et al.
2004).
Kasus kematian ikan karena KHV, umumnya sangat terkait dengan
kondisi lingkungan perairan, terutama suhu air. Berdasarkan data yang dihimpun
OATA (2001), kisaran suhu air, saat terjadinya serangan koi herpes virus berkisar
18-27 °C. Dijelaskan pula oleh OATA (2001) serta Taukhid et al. (2004) bahwa
infeksi virus tersebut, bersifat lebih mematikan pada kisaran suhu air 23-27 °C;
dan kematian ikan akan menurun bila suhu air berkisar pada 30 °C dan diatasnya.
Ikan merupakan hewan poikilothermik, karena itu berbagai proses
fisiologisnya sangat dipengaruhi oleh suhu lingkungan. Demikian pula halnya
dengan respon imunitas, sebagai suatu proses fisiologi sangat dipengaruhi oleh
suhu (Ellis 2001). Pada suhu rendah produk respon imunitas humoral dan seluler
berkurang; batas bawah dan atas respon ini berkaitan dengan kisaran toleransi
suhu bagi kehidupan ikan yang bersangkutan. Pada suhu rendah, penolakan
antigen berlangsung lambat dan produksi antibodi berkurang.
Berdasarkan informasi tersebut, kisaran suhu media yang relatif tinggi
sangat diperlukan untuk meningkatkan respon imunitas ikan. Pada suhu media
2
KHV lebih baik, sehingga ikan mampu bertahan hidup. Namun dalam suatu
sistem budidaya, kisaran suhu yang relatif tinggi tersebut tidak selalu tersedia.
Dengan demikian upaya peningkatan respon imunitas ikan sulit dilakukan hanya
dengan mempertimbangkan faktor suhu.
Salah satu upaya yang dapat diterapkan untuk meningkatkan respon
imunitas ikan adalah penggunaan immunostimulan (disamping teknik vaksinasi).
Immunostimulan merupakan suatu senyawa biologi dan sintetis (kimia) atau
bahan lainnya yang dapat meningkatkan sistem kekebalan tubuh non spesifik (Raa
et al. 1992). Berdasarkan sumber bahannya Sakai (1999) serta Dalmo dan
Bricknell (2005) membagi immunostimulan dalam beberapa kelompok yaitu:
bahan asal bakteri, bahan asal alga, bahan asal hewan, hormon/sitokin dan faktor
nutrisi. Sejumlah bahan nutrisi mikro berupa vitamin meliputi vitamin C, E,
retinol dan pyridoxine, mampu berperan sebagai immunostimulan (Blazer 1992;
Pulsford et al. 1995 dalam Gatta et al. 2001). Baru-baru ini kromium diketahui
sebagai micro nutrient yang penting baik bagi kebutuhan nutrisi manusia maupun
hewan.
Hasil penelitian pada ternak tercatat kromium mempengaruhi beberapa
aspek metabolisme dan berperan positif pada pertumbuhan, efisiensi reproduksi,
komposisi karkas dan terbukti mampu meningkatkan respon imunitas (Burton et
al. 1996; Chang et al. 1995; Kegley et al. 1996; Mallard & Borgs 1997 dalam
Gatta et al. 2001). Namun demikian aplikasi kromium pada ikan chanel catfish
(Ichtalurus punctatus) oleh (Ng & Wilson 1997) dan gilthead sea bream (Sparus
aurata) oleh (Fernandes et al. 1999) menunjukkan respon negatif. Perlu
diperhatikan pula bahwa kromium dalam bentuk heksavalensi (Cr6+), bersifat
toksik (Srivastava et al. 2002); karsinogenik dan menekan respon imunitas pada
ikan mas (Steinhagen et al. 2004).
Peran kromium sebagai immunostimulan pada mamalia telah mendorong
pula kajian yang sama pada ikan. Hasil pengujian Gatta et al. (2001) pada ikan
rainbow trout (Onchorinchus mykiss), menunjukkan bahwa kromium-ragi (Cr3+)
mampu berperan dalam peningkatkan respon imunitas berupa peningkatan
aktivitas sel-sel fagosit, respiratory burst dan serum lysozyme. Aplikasi
respon imunitas pada ikan gurame, ditandai dengan kenaikan total sel leukosit dan
total immunoglobulin (Hastuti 2004).
Upaya peningkatan respon imunitas ikan mas melalui suplementasi
kromium-ragi (Cr3+) pada pakan diharapkan dapat membantu upaya pengendalian
keganasan infeksi KHV. Namun efektivitas penggunaannya pada berbagai suhu
yang bersifat rentan KHV, masih perlu diuji, demikian pula terkait ketepatan
dosis, waktu dan lama pemberiannya. Oleh karena itu pada penelitian ini, diteliti
efektivitas penggunaan kromium-ragi (Cr3+) untuk meningkatkan ketahanan tubuh
ikan mas terhadap virus herpes, pada berbagai suhu media yang bersifat rentan
KHV.
1.2 Tujuan dan Manfaat
Penelitian ini bertujuan untuk menguji efektivitas penggunaan
kromium-ragi (Cr3+) untuk meningkatkan ketahanan tubuh ikan mas terhadap virus herpes,
pada berbagai suhu media pemeliharaan. Hasil penelitian ini diharapkan dapat
menjadi informasi dasar bagi kemungkinan penggunaan kromium ragi (Cr3+)
dalam pakan untuk meningkatkan sistem pertahanan tubuh ikan mas dalam upaya
pencegahan/pengendalian serangan KHV.
1.3 Perumusan Hipotesis
Hipotesis yang diuji pada penelitian ini adalah jika pemberian
kromium-ragi (Cr3+) dalam pakan, pada suhu tertentu efektif meningkatkan respon selular
non spesifik berupa total leukosit, jenis leukosit dan aktivitas sel fagositik, maka
daya tahan tubuh ikan mas akan meningkat sehingga mampu menahan serangan
II. TINJAUAN PUSTAKA
2.1. Koi Herpes Virus
2.1.1. Karakteristik Koi Herves Virus (KHV)
Virus merupakan kompleks nucleoprotein, dan bersifat parasitik. Pada
keadaan yang paling sederhana, virus terdiri atas satu molekul asam nukleat (RNA
atau DNA, tidak pernah keduanya) dan suatu selubung protein. Virus memiliki
ukuran yang sangat kecil sehingga tidak bisa dilihat dengan mikroskop cahaya,
kebanyakan berukuran 30-100 nm, namun ada pula lebih besar seperti poxvirus
(200-400 nm) dan fitovirus (lebih dan 1000 nm) (Voyle 2002). Dalam
kehidupannya virus bersifat parasit intraseluler, tidak mempunyai metabolisme
sendiri dan hanya dapat bereplikasi dengan bantuan sel-sel lain (inangnya), karena
itu virus tidak dianggap sebagal organisme yang berdiri sendiri. Virus bersifat
patogen karena dalam perkembangannya ia dapat mengganggu/merusak sel-sel
inang sehingga menyebabkan terjadinya penyakit (Voyle 2002).
Virus herpes merupakan salah satu jenis virus yang berbiak dalam inti sel
inang dan membentuk badan inklusi yang disebut cowdry type A. Dalam
penyebarannya virus herpes bergerak dari satu sel ke sel lainnya melalui jembatan
antar sel karena bersatunya sel-sel (cell fusion), dengan demikian tidak ada kontak
antara virus dengan lingkungan di luar sel (Malole 1988). Berdasarkan
strukturnya morfologinya kelompok virus Herpesviridae terdiri atas genom DNA
linier utas ganda yang dikemas dalam suatu kapsid ikosahedral, bagian kapsid ini
dikelilingi oleh permukaan tegument proteinaceous dan pada bagian terluar
terdapat selubung (amplop) (Waltzek et al. 2005).
Dari sejumlah banyak virus DNA yang menyerang ikan, Herpesvirus
merupakan jenis virus yang paling banyak ditemui, namun masih sedikit yang
dapat diisolasi (Hedrick et al. 2000). Salah satu virus dari kelompok
Herpesviridae yang menyerang kelompok ikan Cyprinidae yang telah berhasil
diisolasi yaitu Cyprinid herpesvirus (CHV). Cyprinid herpesvirus (CHV) telah
diisolasi dan kemudian didemonstrasikan oleh Sano (Hedrick et al. 2000)
keberadaan tumor pada sisik/mukus ikan mas (Cyprinus carpio). Sejak tahun
tahun 1998, agen virus dari kelompok Herpesviridae yang lain telah menimbulkan
wabah kematian yang hebat pada ikan mas dan koi (Cyprinus carpio), dengan
kematian di kolam berkisar 80-100% (Pirelberg et al. 2003), dan sebaran
wilayahnya menyeluruh meliputi, Amerika Serikat, Jerman, Inggris, Italia,
Belanda, Israel, Indonesia, Jepang dan Korea (Hedrick et al. 2000; Gilad et al.
2003; Ronen et al. 2003; Ilouze et al. 2006).
Hedrick et al. (2000) berhasil melakukan isolasi terhadap agen virus
tersebut pada kultur sel (Koi Fin cells-1), dan observasi yang lebih detail dengan
menggunakan mikroskop elektron menunjukkan bahwa morfologi dan ukuran dari
virus adalah konsisten ke dalam famili Herpesviridae (Hedrick et al. 2005).
Virion virus tersebut tersusun atas suatu inner capsid dengan simetri ikosahedral
dengan kisaran diameter 100-110 nm. Dijelaskan pula bahwa virion virus
mempunyai tegument yang terletak diantara amplop dan nukleokapsid, sehingga
diameter virion matang berkisar 170-230 nm. Berdasarkan morfologi dan
ukurannya serta tahapan perkembangannya dalam inang, maka virus ini dinamai
KHV (koi herpes virus).
2.1.2. Patogenitas dan Gejala Klinis
Menurut Malole (1988), patogenitas merupakan studi tentang proses atau
mekanisme terjadinya infeksi virus sampai menimbulkan penyakit, yang meliputi
interaksi antara virus, inang dan lingkungan. Untuk menginfeksi suatu sel,
pertama-tama virus harus kontak dengan permukaan sel, lalu masuk ke dalam
dinding sel. Dijelaskan pula oleh Fenner et al. (1993) bahwa kulit merupakan
permukaan tubuh terbesar, virus dari famili Herpesviridae dapat masuk melalui
luka/lecet kecil pada permukaan kulit. Di dalam dinding sel virus membuka
selubungnya untuk memungkinkan keluar dan bereplikasi.
Virus herpes merupakan salah satu jenis virus yang berbiak dalam inti sel
inang dan membentuk badan inklusi yang disebut cowdry type A. Memperoleh
amplopnya sewaktu budding melalui membran inti sel. Penyebaran virus dari sel
ke sel melalui jembatan antar sel karena bersatunya sel-sel (cell fusion). Dengan
6
virus herpes telah menginfeksi inang, maka sejumtah virus ini akan tetap tinggal
dalam bentuk laten seumur hidup inangnya (Malole 1988).
Menurut Taukhid et al. (2004), mekanisme penularan KHV dalam
kegiatan akuakultur umumnya terjadi melalui kontak antar ikan, cairan dari ikan
yang terinfeksi, lewat air/lumpur yang terkontaminasi, peralatan perikanan serta
media transportasi. Hal ini didukung pula oleh pendapat (Perelberg et al. 2003)
bahwa partikel virus tersebut masih dapat bertahan di luar inang (dalam air) dan
masih infektif sekurangnya selama 4 jam.
Walaupun KHV dalam penyebarannya tergolong penyakit yang sangat
menular, namun ternyata bahwa inang dari virus ini sangat terbatas kisarannya.
Spesies ikan yang dapat terinfeksi KHV hanya dua jenis, yaitu ikan mas
(Cyprinus carpio) dan koi (Cyprinus carpio koi), kedua jenis ikan tersebut sebagai
inang utama dan tidak terdapat inang antara. Hasil pengujian Perelberg et al.
(2003) menunjukkan bahwa KHV tidak menginfeksi ikan tilapia (Oreochromis
niloticus), silver perch (Bidyanus bidyanus), silver carp (Hypopthalmus molitrix),
goldfish (Carasius auratus) dan grass carp (Ctenopharyngodon idella). Hasil
pengujian Taukhid et al. (2004) mengungkapkan pula bahwa infeksi buatan
dengan menggunakan homogenate organ insang asal ikan positif KHV, terhadap
beberapa jenis ikan budidaya seperti ikan nila, gurame, komet dan lele;
menunjukan bahwa ikan-ikan tersebut bukan inang yang cocok.
Pada sisi lain mekanisme infeksi KHV sangat dipengaruhi pula oleh faktor
suhu lingkungan. Dalam sistem budidaya virus ini dapat menginfeksi ikan pada
suhu lingkungan yang sangat spesifik, yaitu pada suhu air 18-27 oC (OATA,
2001), 18-28 oC (Gilad et al. 2003; Pirelberg et al. 2003; Perelberg et al. 2005;
Ilouze et al. 2006). Kematian ikan akan menurun bahkan berhenti bila suhu
berada diatas atau dibawah kisaran toleransi suhu tersebut (Gilad et al. 2003).
Kisaran toleransi suhu bagi kehidupan KHV teramati pula pada penelitian secara
in vitro, dimana virulensi dan replikasi virus tersebut pada kisaran toleransi suhu
15-25 °C, dan tidak ada atau minim replikasinya pada suhu 4, 10, 30, 37 °C (Gilad
et al. 2003).
Penyakit KHV menyebabkan kematian yang besar dan bersifat sporadis
kematian yang tinggi, 80-100% dari populasi dalam 6-22 hari setelah infeksi pada
suhu 18-28 °C (Pirelberg et al. 2003). Menurut OATA (2001), pada suhu 23-28
°C kekuatan sistem pertahanan ikan lebih rendah dibanding virulensi KHV,
sehingga ikan tidak mampu menghadapi serangan KHV, dan pada suhu di atas 30
o
C sistem pertahanan ikan lebih kuat dibanding virulensi KHV, sehingga tidak ada
lagi kematian ikan oleh virus.
Gejala klinis ikan mas yang terinfeksi KHV menunjukkan kondisi ikan
yang lemah, kehilangan keseimbangan dan sulit bernafas. Penampakan luar dari
penyakit meliputi luka pada epithelium dengan hilangnya mukus dan kasar,
pendarahan pada operkulum, sirip dan insang (Sunarto et al. 2005). Menurut
OATA (2001), serangan penyakit ini menunjukkan kematian yang sangat cepat,
ikan akan terlihat sakit dan akhirnya mati dalam waktu 24-48 jam. Gejala klinis
ikan yang terserang virus herpes adalah pendarahan pada insang, bercak pucat
pada insang, mata cekung dan ikan gelisah (kadang tidak aktif berubah menjadi
sangat aktif atau sebaliknya).
Dijelaskan pula oleh Taukhid et al. (2004) bahwa serangan koi herpes
virus menunjukkan gejala-gejala berupa: 1) produksi lendir (mukus) berlebih
sebagai respon fisiologis terhadap kehadiran patogen, selanjutnya produksi lendir
menurun drastis sehingga tubuh. ikan terasa kasat, 2) insang berwarna pucat dan
terdapat bercak putih atau coklat (sebenarnya adalah kematian sel-sel insang atau
nekrosa insang), selanjutnya menjadi rusak, geripis pada ujung tapis insang dan
akhirnya membusuk. Secara makroskopis menunjukkan adanya kerusakan
jaringan yang serius serta kematian sel yang berat, 3) pendarahan (haemorage) di
sekitar pangkal dan ujung sirip serta permukaan tubuh lainnya, 4) Adanya kulit
melepuh, 5) hati berwarna pucat selanjutnya menjadi rusak, 6) ginjal (anterior dan
posterior) berwarna pucat.
Hasil pengamatan (Hedrick et al. 2000) melalui mikroskop cahaya
menunjukkan bahwa ikan yang terinfeksi mengalami kelainan pada insang dan
organ internal seperti ginjal, limpa, jantung dan saluran pencernaan. Pada insang
terjadi hipertropi, hiperplasia dan fusi pada lamella sekunder insang. Sunarto et
al. (2000), melakukan pengamatan histopatologi pada jaringan insang dan ginjal
8
tubuh/organ yang terinfeksi menunjukan perubahan jaringan berupa pembentukan
badan inklusi yang bersifat eosinofilik dengan inti hipertropi dan kromatin yang
sedikit bersifat basofilik. Hipertropi pada inti disebabkan karena penumpukan
virion-virion dalam nukleus.
2.1.3. Diagnosa Virologis KHV
Menurut Taukhid et al. (2004) upaya untuk mendiagnosa KHV dapat
dilakukan melalui 2 pendekatan yaitu secara langsung dan tidak langsung.
Pendekatan langsung adalah dengan melihat keberadaan virus atau partikel virus
secara langsung, melalui kegiatan isolasi dan identifikasi virus secara in vitro pada
kultur jaringan dengan pengamatan cytophatic effects (CPE); penggunaan
mikroskop elektron untuk pengamatan partikel virus dan teknik polymerase chain
reaction (PCR) untuk mendeteksi DNA virus. Sedangkan secara tidak langsung
dilakukan dengan mendeteksi respon dari inang akibat infeksi virus (misalnya
antibodi). Diagnosa tidak langsung dilakukan dengan pengamatan enzim linked
immunosorbent assay test (uji ELISA) dan flouresecent antibody tecnique (FAT)
Metoda diagnosa KHV pada ikan mas dan koi telah distandarkan pula oleh
FAO/NACA/OIE (Sunarto et al. 2005), yang dilakukan melalui 3 level diagnosa.
yakni : pengamatan lapangan dan gejala klinis (level 1), perubahan histopatologi
(level 2) dan biologi molekuler (level 3). Karakter kematian ikan mas dan koi
yang tinggi dalam 7 hari dengan menunjukkan kerusakan insang dengan atau
tanpa gejala klinis (level 1), secara histopatologi pada ikan sakit, konsisten
ditemukan adanya amphophilik intranuklear badan inklusi dengan marginasi
kromatin periperal pada sel epitel insang dan sel epitel pada tubular ginjal
(diagnostik level 2), deteksi PCR menggunakan primer spesifik (diagnostik level
3). Karakter gejala klinis (level 1) yang telah umum dikenal yaitu munculnya
warna pucat pada insang dan terdapat bercak putih (Hedrick et al. 2000; Taukhid
et al. 2004; Hedrick et al. 2005).
2.2. Hematologi
Darah ikan tersusun dari sel-sel darah yang tersuspensi dalam plasma dan
diedarkan ke seluruh jaringan tubuh melalui sistem sirkulasi tertutup. Menurut
dan elemen-elemen seluler (sel-sel darah). Plasma darah terdiri dari air, protein
(yakni albumin, globulin, dan faktor-faktor koagulasi), lipid dan ion. Adapun sel
darah terdiri dari sel darah merah (eritrosit) dan sel darah putih (leukosit).
Sel darah merah (eritrosit) ikan mempunyai inti, umumnya berbentuk bulat
dan oval tergantung pada jenis ikannya. Inti sel eritrosit terletak sentral dengan
sitoplasma terlihat jernih kebiruan dengan pewarnaan giemsa (Chinabut et al.,
1991).
Sel darah putih (leukosit) ikan merupakan bagian dari sistim pertahanan
tubuh yang bersifat non spesifik. Leukosit ikan terdiri dan granulosit dan
agranulosit. Lagler et al. (1977) mengungkapkan, bahwa granulosit terdiri dari
limfosit, monosit dan trombosit, sedangkan agranulosit terdiri dari basofil, netrofil
dan eosinofil.
Secara morfologinya, limfosit adalah berupa sel darah kecil dengan
nukleus yang besar (menempati bagian terbesar dari sel) tidak bergranula dan
dikelilingi sejumlah kecil sitoplasma (Chinabut et al. 1991; Takashima & Hibiya
1995). Limfosit biasanya merupakan proporsi sel darah putih terbanyak
(Takashima dan Hibiya 1995). Menurut Blaxhall (1972) kisaran limfosit adalah
71.12-82.88 % dari total leukosit. Namun kisaran jumlah limfosit pada ikan
sangat bervariasi, tergantung tempat, musim , umur, spesies dan dipengaruhi pula
oleh sex dan tingkat kematangan (Svobodova et al. 2001; Tierney et al. 2004).
Limfosit merupakan sel-sel respon pertahanan tubuh terpenting, dan
diklasifikasikan kedalam 2 sub-klas: sel B dan sel T. Sel B mempunyai
kemampuan untuk bertranformasi menjadi sel plasma, yaitu sel yang
memproduksi antibodi. Sedangkan sel T sangat berperan dalam mengontrol
respon imun (Kresno 2001; Almendras & Catap 2002).
Monosit ikan berbentuk bulat-oval, intinya terletak ditengah sel dengan
sitoplasmanya tidak bergranula (Takashima dan Hibiya 1995). Monosit
berkemampuan masuk ke jaringan dan berdiferensiasi menjadi sel makrofag.
Peran monosit sangat penting, sebagai sel fagosit utama untuk menghancurkan
berbagai patogen penyerang dan berperan pulan sebagai antigen presenting cells
(APC) yang fungsinya untuk menyajikan antigen kepada sel limfosit (Kresno
10
Trombosit merupakan sel darah yang tidak berinti dan paling kecil
ukurannya. Ciri khusus trombosit adalah lingkaran sitoplasmanya tipis di
sekeliling inti, yang berwarna cerah dengan pewarnaan giemsa (Chinabut et al.
1991). Trombosit ini berperan penting dalam kejadian imflamasi dan dan
pendarahan (membantu proses pembekuan darah) (Kresno 2001).
Chinabut et al. (1991) menyebutkan, bahwa netrofil berbentuk bulat
dengan inti dapat memenuhi sebagian ruang sitoplasma dan terdapat granula
dalam sitoplasmanya. Seperti halnya monosit/makrofag, sel netrofil berperan pula
dalam respon nonspesifik dengan melakukan fagositosis untuk menyingkirkan
mikroorganisme penyerang (Kresno 2001; Kollner et al. 2002). Selain netrofil,
terkadang dapat pula ditemukan adanya granulosit lainnya yakni basofil dan
eosinofil Ferguson (1989). Sitoplasma basofil terlihat kebiruan, bergranula besar,
intinya berlobus dua; sedangkan sitoplasma eosinofil berwarna merah, dengan
granula besar dan intinya terletak ditepi sel.
Sel dan cairan darah (plasma darah) mempunyai peran fisiologi yang
sangat penting. Berbagai perubahan fisiologis pada ikan terjadi karena sangat
dipengaruhi oleh lingkungan maupun agen infeksius, dan perubahannya dapat
dinilai berdasarkan perubahan dalam komponen-komponen darah (Kollner et al.
2002; Swain et al. 2007). Dijelaskan pula oleh Ellsaesser et al. (1985) bahwa
pemeriksaan darah penting artinya untuk memantapkan diagnostik suatu penyakit.
Sehingga perubahan gambaran darah banyak digunakan untuk menilai status
kesehatan ikan (Amrullah 2004; Hastuti 2004)
Dalam penelitian hematologik ikan, parameter darah yang diukur meliputi
jumlah eritrosit, kadar hemoglobin, hematokrit, lekosit total dan hitung jenis
lekosit (Wedemeyer dan Yasutake 1977). Parameter lainnya yang juga sering
diukur antara lain protein plasma total, titer antibodi, aktivitas fagositik dan kadar
kortisol plasma (Anderson dan Siwicki 1993).
Blaxhall (1972) mengatakan, bahwa kadar Hb merupakan indikator
anemia. Menurunnya kadar hematokrit dapat dijadikan petunjuk mengenai
rendahnya kandungan protein pakan, defisiensi vitamin atau ikan mendapat
infeksi, sedangkan meningkatnya kadar hematokrit, menunjukkan ikan ada dalam
Rendahnya jumlah eritrosit menunjukkan ikan menderita anemia,
kerusakan ginjal; sedangkan tingginya jumlah eritrosit menandakan ikan dalam
keadaan stres (Wedemeyer dan Yasutake 1977). Perubahan nilai leukosit total dan
hitungan jenis leukosit dapat dijadikan indikator adanya penyakit infeksi tertentu
yang terjadi pada ikan (Blaxhall 1972).
Anderson dan Siwicki (1993) mengulas tentang aktivitas fagositik yang
rendah berkaitan dengan infeksi kronis dan meningkat dalam keadaan permulaan
infeksi. Berkaitan dengan kondisi stres, Anderson (1990) mengemukakan, bahwa
secara umum ikan dalam keadaan stres kadar kortisol dan kadar glukosa dalam
plasma darah tinggi.
2.3. Sistim Pertahanan Ikan
Ikan mengalami kontak yang sangat intim dengan lingkungannya, yang
mengandung berbagai mikroba patogen, misalnya bakteri, virus, fungus, protozoa
dan parasit yang dapat menyebabkan infeksi (Ellis 2001). Untuk
mempertahankan diri terhadap serangan berbagai patogen tersebut ikan memiliki
berbagai respon pertahanan tubuh yang tersusun dalam suatu sistem pertahanan
yang komplek dan disebut sebagai sistem imun (Almendras & Catap 2002).
Berbagai komponen pendukung sistem imun dibentuk oleh jaringan
limfoid. Pada ikan, jaringan ini menyatu dengan jaringan mieloid, sehingga
dikenal sebagai jaringan limfomieloid. Organ limfomieloid pada ikan teleostei
adalah ginjal depan, timus dan limpa (Fange 1982), produknya berupa sel-sel
darah dan respon pertahanan selular dan humoral. Menurut (Rombout et al.
2005), pada ikan teleostei ginjal merupakan organ myelopoeitic, berperan dalam
pembentukan berbagai kelompok sel darah putih seperti monosit/makrofag dan
granulosit (netrofil, basofil, eosinofil), selain itu ginjal depan berperan pula
sebagai organ utama dalam pembentukan sel limfosit B. Organ timus dalam
perkembangannya berperan sebagai organ limfoid yaitu membentuk limfosit T.
Adapun organ limpa lebih banyak berperan dalam pembentukan sel trombosit dan
sel darah merah (eritrosit). Dijelaskan pula oleh Takashima dan Hibiya (1995),
peran lain limpa dalam sistem pertahanan adalah pengaturan volume darah yang
12
Berdasarkan sifat responnya dalam menghadapi agen patogen penyerang,
sistem imun terbagi atas sistem pertahanan alamiah (innate immunity) yang
bersifat non spesifik dan pertahanan adaptif (adaptive immunity) yang bersifat
spesifik (Almendras & Catap 2002). Menurut Ellis (2001) pertahanan non
spesifik merupakan pertahanan tubuh terdepan, bereaksi cepat/langsung dalam
menghadapi serangan berbagai mikroorganisme patogen (antigen). Disebut
pertahanan non spesifik karena tidak ditujukan terhadap mikroorganisme tertentu
dan telah ada sejak lahir (alamiah). Sedangkan sistem pertahanan spesifik
membutuhkan waktu untuk mengenal antigen terlebih dahulu sebelum dapat
memberikan responnya. Jadi pertahanan spesifik merupakan lapis pertahanan
kedua, namun sangat spesifik terhadap antigen tertentu yang menginduksinya dan
mampu membentuk memori spesifik antigen (Shoemaker et al. 2001). Namun
dalam implementasinya, mekanisme pertahanan terhadap antigen merupakan
interaksi antara peran sitem non spesifik maupun spesifik dan respon keduanya
bersifat saling menguatkan.
Sistem Imun Non Spesifik
Sistem pertahanan nonspesifik pada ikan, meliputi barrier mekanik dan
kimiawi (mukus, kulit, sisik dan insang) serta respon imun selular yang
melibatkan sel-sel yang mampu memfagosit (monosit/makrofag, dan kelompok
granulosit) (Almendras & Catap 2002). Mukus ikan, menyelimuti permukaan
tubuh, insang dan terdapat juga dalam lapisan mukosa usus berperan untuk
memperangkap patogen secara mekanik dan mengeliminasinya secara kimiawi
dengan lisosim dan enzim proteolitik lainnya. Selain itu mukus mengandung
imunoglobulin, aglutinin alamiah dan lisin yang berkemampuan untuk
mengeliminir patogen (Balfry & Higgs 2001).
Menurut Almendras dan Catap (2002), sistem imun non spesifik ikan
didukung dua komponen utama yaitu respon selular dan respon humoral.
Dijelaskan pula bahwa respon selular dalam implementasinya terdapat dalam
beberapa tipe mekanisme meliputi: imflamasi, fagositosis (fagositosis killing
mechanism), fagositosis sebagai penyajian antigen (antigen presenting cells), dan
Imflamasi merupakan upaya proteksi dan pengisolasian suatu situs infeksi,
hal ini terjadi segera setelah masuknya antigen (bakteri, virus, fungus, parasit).
Masuknya antigen ke dalam jaringan akan merangsang terjadinya pemusatan
sel-sel sistem imun dan produk yang dihasilkannya di area infeksi (Secombes 1996;
Balfry & Higgs 2001). Dijelaskan pula oleh Tizard (1988) bahwa inflammatory
respons merupakan upaya proteksi reaksi restoratif dari tubuh sejak ikan berusaha
menjaga kondisi homeostasis/kestabilan sistem dari pengaruh lingkungan yang
kurang baik.
Aktivitas fagositik merupakan pertahanan pertama dari respon selular
(Woo, 1995) dan dilakukan oleh monosit/makrofag dan granulosit (Kollner et al.
2002). Proses fagositosis meliputi pengenalan material yang akan dieliminir,
tahap kemotaksis, tahap perlekatan, tahap penguraian sel dan melakukan digesti
internal dengan beberapa mekanisme antimikrobial. Menurut Kollner et al. (2002)
sirkulasi sel darah putih (monosit/makrofag, dan granulosit) membentuk suatu
kesatuan jaringan pertahanan yang mampu mengeliminasi berbagai patogen
penyerang dan sekresinya (faktor terlarut) melalui fagositosis tanpa suatu aktivasi
awal.
Proses fagositosis oleh sel-sel fagosit berkontribusi pula dalam mekanisme
penyajian antigen (antigen presenting cells) untuk menstimulasi respon sel
limfosit. Partikel yang difagosit diproses dan dipresentasikan sebagai peptide
antigen yang berasosiasi dengan molekul MHC kelas II pada permukaan sel
fagosit. Presentasi antigen kepada sel limfosit (T-helper) menyebabkan terjadinya
seksresi berbagai mediator terlarut yang terlibat dalam aktivasi sel limfosit seperti
interleukuin 1 (IL-1) (Murphy et al. 1999; Almendras & Catap 2002).
Mekanisme lain dari pertahan seluler adalah non specific cytotoxic cells
(NCCs), pada mamalia dikenal sebagai sel natural killer. Sel natural killer
merupakan subpopulasi sel limfosit yang dapat membunuh sel sasaran secara
spontan tanpa pengaktifan terlebih dahulu dan tanpa bergantung pada
produk-produk MHC. Pada ikan, respon sel sitotoksik ini bersifat spontan dan
mempunyai toksisitas non spesifik yang dapat menghancurkan berbagai sel-sel
asing yang menyerang (Murphy et al. 1999; Almendras & Catap 2002).
14
pula sekuen putative dari natural killer enhancing factor (NKEF) pada ikan
rainbow trout dan mas (Fischer et al. 2006).
Sistem imun non spesifik didukung pula oleh berbagai faktor humoral
yang dapat berperan pula dalam perlawanan terhadap invasi patogen. Subtansi ini
bereaksi melakukan lisis berbagai mikroba patogen, melapisi (opsonisasi) atau
menghambat pertumbuhannya. Berbagai subtansi tersebut meliputi: acute phase
protein, komplemen, interferon, lytic enzyme dan enzim inhibitor. Diantara
berbagai subtansi tersebut, komplemen dan interferon sangat berperan dalam
respon pertahan terhadap infeksi virus (Murphy et al. 1999; Almendras & Catap
2002).
Menurut Almendras dan Catap (2002) sistem komplemen terdiri dari
sekitar 30 protein serum yang dapat diaktifkan menjadi komplemen bagi respon
imun. Terdapat dua jalur pengaktifan komplemen yaitu: (1) jalur klasik yang
tergantung pada keberadaaan kompleks antigen-antibodi dan (2) jalur alternatif,
jalur pengaktifannya tidak tergantung antibodi. Beberapa faktor eksternal seperti:
LPS, dinding sel fungi (B-1,3-glucan) dapat mengaktifkan jalur alternatif
(Almendras & Catap 2002; Magnadottir et al. 2005). Pada infeksi virus aktivasi
jalur alternatif tersebut terjadi terutama setelah infeksi oleh amplop virus yang
matang oleh budding melalui membran plasma sel inang (Murphy et al. 1999),
karena aktivasinya tidak memerlukan antibodi sehingga respon dapat segera
terjadi setelah adanya invasi virus.
Interferon adalah sekresi protein (sitokin) yang menginduksi status anti
viral pada sel inang, dan memainkan peran dalam pertahanan terhadap infeksi
virus pada vertebrata. Interferon disekresikan oleh sel inang yang terifeksi dan
ditransfer ke dalam darah untuk memberi isyarat bahaya pada sel-sel lain dalam
tubuh. Pada ikan, aktifitas seperti interferon (IFN-like activity) teridentifikasi
sejak tahun 1965, terdeteksi pada sel dari sejumlah spesies ikan, setelah infeksi
oleh virus. Baru-baru ini IFNs ikan dengan struktur dan fungsi yang sama dengan
IFNs tipe I telah diklon dari Atlantic salmon, chanel catfish, pufferfish dan
zebrafish (Robertsen 2006). Dijelaskan pula oleh Robertsen (2006) bahwa dua
famili dari IFNs (tipe I dan II) dan dapat dibedakan berdasarkan pada sekuensi
IFN-α/ßs, yang diinduksi umumnya oleh virus di dalam sel, sedangkan IFN tipe
II adalah identik dengan IFN-γ dan ia diproduksi melalui sel natural killer (sel
NK) dan limfosit T sebagai respon terhadap interleukin-12 (IL-12), interleukin-18
(IL-18), mitogen atau antigen (Robertsen 2006).
Sistem Imun Spesifik
Sel limfosit merupakan inti dalam respon imun spesifik karena sel-sel ini
merupakan merupakan sel yang mengenal berbagai antigen, baik antigen yang
terdapat intraselular maupun ekstraselular misalnya dalam cairan tubuh atau
dalam darah (Kresno 2001). Menurut Almendras dan Catap (2002), antigen
adalah substansi spesifik yang dapat merangsang suatu respon imun antigen dapat
berupa molekul yang berada pada permukaan patogen atau juga dapat berupa
toksin yang diproduksi oleh patogen. Umumnya substansi antigen tersebut berupa
molekul besar seperti protein, polisakarida dan asam nukleat.
Sistem imun ikan mengenal dan merespon hanya pada bagian kecil dari
molekul besar antigen, yang dikenal dengan istilah antigenic determinant atau
hapten. Sel limfosit mempunyai reseptor membran bagi antigen spesifik.
Reseptor tersebut berupa protein yang secara spesifik mengenal dan berikatan
dengan antigen (Almendras dan Catap 2002).
Sistem imun spesifik (adaptive immunity) pada dasarnya merupakan
mekanisme interaksi antara sel limfosit dan fagosit. Respon spesifik ini diawali
dengan kerja sel-sel fagosit/makrofag atau antigen presenting cell (APC) yang
memproses dan mempresentasikannya pada sel-sel imun spesifik (Kresno 2001;
Kollner et al. 2002). Pengolahan antigen merupakan proses yang penting untuk
stimulasi limfosit selanjutnya, karena reseptor pada sel limfosit akan mengenali
antigen berdasarkan susunan asam amino dalam rantai peptida (bukan bentuk
proteinnya). Peptida antigen (hasil pengolahan) akan dipresentasikan
bersama-sama molekul protein MHC (major histocompatibility complex) haplotype tertentu
membentuk struktur yang unik pada permukaan sel makrofag/APC, dan dapat
dikenali oleh reseptor sel T (TcR) (Kresno 2001). Pengenalan struktur unik
MHC-peptida antigen oleh limfosit T, mengakibatkan sel-sel imun berproliferasi
dan berdiferensiasi, menjadi sel yang memiliki kopetensi imunologik dan mampu
16
spesifik pada dasarnya terbagi dua yaitu: respon imun selular yang merupakan
fungsi dari sel limfosit T, dan respon humoral yang merupakan fungsi dari sel
limfosit B (Almendras & Catap 2002).
Respon imun selular sangat diperlukan untuk melawan organisme
intraselluler. Sub populasi sel T yang disebut sel T penolong (T-helper) akan
mengenali mikroorganisme atau antigen bersangkutan melalui MHC (major
histocompatibility complex) kelas II yang terdapat pada permukaan sel makrofag.
Sinyal ini menginduksi limfosit untuk memproduksi berbagai jenis limfokin,
termasuk diantaranya interferon yang dapat membantu makrofag menghancurkan
mikroorganisme tersebut. Sub populasi limfosit T yang lain disebut T-sitotoksik,
berfungsi untuk menghancurkan mikroorganisme intrasel yang yang disajikan
melaiui MHC kelas I secara Iangsung (cell to cell). Selain itu, juga menghasilkan
gamma interferon yang mencegah penyebaran mikroorganisme ke dalam sel lain
(Kresno 2001; Almendras & Catap 2002). Menurut Fischer (2006), mekanisme
ini dikenal sebagai spesifik cell-mediated cytotoxicity (spesifik CMC).
Respon humoral pada sistem imun spesifik dilakukan melalui sekresi
protein-protein terlarut yaitu antibodi atau immunoglobulin (Ig), yang mengalir
dalam darah dan limpa, mereka bergabung dengan antigen dan menetralkannya.
Struktur dasar molekul immunoglobulin (Ig) terdiri dari dua rantai polipeptida
berat (rantai H) dan polipeptida rantai ringan (rantai L) (Shoemaker et al. 2001).
Kedua rantai tersebut ditautkan oleh ikatan disulfida dan memiliki situs
pengikatan antigen. Ikan hanya memiliki 1 kelas Ig yaitu Ig M-like (Rosenhein et
al. 1986) dengan berat molekul 700kDa (Lobb 1986).
Respon humoral yang diperantarai antibodi awalnya merupakan fungsi
dari sel limfosit B. Sel B dapat mengenal antigen dan berinteraksi dengan afinitas
yang tinggi karena adanya immunoglobulin spesifik (sIg) yang berfungsi sebagai
reseptor antigen. Sel B sebagai APC akan menangkap antigen melalui proses
endositosis, masuk ke dalam sitoplasma, diproses menjadi fragmen-fragmen.
Fragmen antigen tersebut bersama-sama dengan MHC kelas II selanjutnya
dipresentasikan pada limfosit Th (penolong), proses pengenalan komplek protein
MHC kelas II-fragmen antigen (hapten) akan mengaktivasi sel B untuk
menghasilkan antibodi (Fenner et al. 1993; Kresno 2001; Almendras & Catap
2002).
Mekanisme pengaktifan sel-sel limfosit oleh suatu antigen, selain
menyebabkan proliferasi dan diferensiasi klon limfosit yang diperlukan untuk
menghadapi antigen, juga menyisakan klon limfosit memori (Almendras & Catap
2002). Klon limfosit memori ini dapat mengenali antigen bersangkutan, dan
mampu menghasilkan respon imun yang lebih cepat dan kuat pada kejadian
infeksi di masa depan.
2.4. Virulensi KHV, Respon Imunitas Ikan dan Suhu Lingkungan
Ikan merupakan hewan poikilothermik, ia tidak mampu untuk mengatur
suhu internal tubuhnya (Bowden et al. 2006). Karena suhu badan ikan sangat
dipengaruhi oleh suhu air sebagai lingkungannya, maka proses-proses fisiologis
yang terjadi di dalamnya sangat dipengaruhi oleh suhu air. Demikian pula halnya
dengan respon imun sebagai suatu proses fisiologi dipengaruhi oleh suhu
(Manning dan Nakanishi 1996). Beberapa faktor lainnya yang juga mempengaruhi
pembentukkan respon imun adalah hormon kortisol, umur ikan dan densitas ikan
(Ellis 1988).
Suhu merupakan faktor lingkungan utama yang menstimulasi perubahan
respon imun pada beberapa spesies ikan, baik innate maupun acquired/adaftive
immune respon (Bowden et al. 2006). Sebagian peneliti berpendapat bawa respon
imun non spesifik (innate immunity) tidak dipengaruhi oleh suhu, dan sebaliknya
acquired immunity dipengaruhi oleh suhu (Elllis 2001). Namun terbukti pada
ikan chanel catfish dan tench bahwa innate imunity juga dapat dipengaruhi suhu
(Bowden et al. 2006).
Suhu yang lebih tinggi (pada kisaran fisiologi normal) dapat meningkatkan
respon imun (Bowden et al. 2006), sedangkan suhu yang lebih rendah akan
menekan fungsi imunitas (non permissive temperature ), dan terdapat pula kisaran
suhu optimal untuk aktivitas respon imun terbaik (immunologycally permissive)
(Manning dan Nakanishi 1996). Pada dasarnya di dalam suatu mekanisme respon
imun terdapat berbagai kejadian kompleks, dimana beberapa fase/kejadian
18
Pengaruh suhu terhadap respon imun spesifik terutama respon humoral
telah diuji oleh (Morvan et al 1998). Respon ikan mas yang diimunisasi terhadap
bovine serum albumin, terbukti bahwa repon primer antibodi mengalami
hambatan pada suhu rendah. Sedangkan hasil penelitian lainnya, menunjukkan
bahwa pada suhu yang lebih rendah respon primer antibodi bersifat terunda
namun nilai besarannya tetap (Rijkers et al. 1980), atau terkurangi (Einarsdottir et
al. 2000). Gangguan dalam pembentukan antibodi mencerminkan fungsi
pembangkitan sel limfosit T-helper yang peka terhadap suhu rendah (Morvan et
al. 1998). Menurut Manning dan Nakanishi (1996), proliferasi dari sel limfosit T
terhadap mitogen ConA berkurang pada suhu rendah. Dijelaskan pula oleh
Morvan et al. (1998) bahwa pembangkitan T-helper mengalami hambatan pada
suhu rendah, sedang sel T memori dan sel B tidak terganggu. Pengujian lain
mencatat pula bahwa suhu rendah menekan pula terhadap fungsi spesifik limfosit
sitotoksik pada ginjal ikan mas (Morvan et al. 1998). Jadi pada sistem imun
spesifik, suhu rendah dapat berpengaruh negatif terhadap respon humoral maupun
seluler.
Seperti telah dijelaskan sebelumnya bahwa pengaruh suhu rendah dapat
bersifat menekan pula pada sistem imun non spesifik. Respon imun non spesifik
yang mendapat perhatian adalah fagositosis dan NCCs (Nonspecific cytotoxic
Cells). Berdasarkan evaluasi terhadap aktivitas fagositosis pada ikan chanel
catfish (Ichtalurus punctatus), menunjukkan bahwa sel-sel fagosit bersifat resisten
terhadap suhu rendah, bahkan mekanisme adaptasi dari sel fagosit mampu
mendorong peningkatan aktivitas ledakan respirasi (respiratory burst) (Morvan et
al. 1998). Sedangkan NCCs bersifat lebih sensitif pada suhu rendah (Morvan et
al. 1998). Tercatat bawa aktivitas aktivitas lytic yang diperantarai oleh NCCs
terhadap sel-sel murine mastocytoma meningkat pada suhu rendah. Respon
peningkatan NCCs dapat terjadi segera (24 jam) setelah ia diekpos pada suhu
rendah, dan efek maksimum terjadi pada minggu ke-4 dan menghilang pada
minggu ke-8. Sebagai tambahan adalah aktivitas komplemen lewat jalur alternatif
berperan dominan selama periode suhu rendah, sedangkan jalur klasik tertekan
(Morvan et al. 1998). Kesimpulannya, pada suhu rendah sistem pertahanan non
spesifik yang tertekan, sebelum pada akhirnya akan terjadi pula mekanisme
adaptasi dari respon spesifik.
Kasus KHV umumnya sangat terkait dengan kondisi lingkungan perairan,
terutama suhu air. Bahkan Gilad et al. (2003) menyimpulkan bahwa faktor yang
paling nyata mempengaruhi virulensi KHV adalah suhu air. Berdasarkan
penelitian pada kondisi laboratorium, kisaran toleransi untuk virulensi dan
replikasi virus tersebut secara invitro adalah pada kisaran 15-25 °C, dan tidak ada
atau minim replikasinya pada suhu 4, 10, 30 dan 37°C. Sedangkan berdasarkan
data lapang yang dihimpun OATA (2001), bahwa serangan virus herpes yang
menyebabkan kematian adalah pada suhu 18-27°C. Pada kejadian wabah di
Indonesia tercatat serangan KHV yang mematikan adalah pada suhu 23-27°C, dan
kematian ikan akan menurun bila suhu berada diatas atau tidak terdapat kejadian
infeksi pada suhu 30°C dan diatasnya (Taukhid et al. 2004).
Virulensi KHV pada kasus infeksi ikan mas sangat dipengaruhi suhu,
dimana suhu akan berpangaruh langsung terhadap replikasi virus, dan di lain
pihak replikasi virus dipengaruhi secara tidak langsung oleh perubahan
(berkurang atau bertambahnya) keampuhan respon imun ikan (Alcorn et al. 2002).
Karena respon imun ikan sebagai vertebrata ectothermic, sangat dipengaruhi suhu
(Ahne et al. 2002).
Masuknya patogen ke tubuh ikan dicapai melalui beberapa mekanisme
yang tergantung pada fisiologis ikan (status kesehatan organisme), virulensi dan
jumlah dari agen patogen dan kondisi lingkungan. Jika kesehatan organisme
menurun, atau kondisi Iingkungan kurang mendukung, maka organisme akan
mengalami stres. Hal ini akan menyebabkan kemampuan organisme
mempertahankan diri dari serangan penyakit menurun, sehingga patogen dapat
menginfeksi ikan (Elliss 1981).
2.5. Kromium-ragi (Cr3+) sebagai Immunostimulan
Immunostimulan merupakan suatu senyawa biologi dan sintetis atau bahan
lainnya yang dapat meningkatkan sistem kekebalan tubuh. Apabila masuk ke
dalam tubuh ikan, akan merangsang makrofag untuk memproduksi interleukin
yang akan menggiatkan sel limfosit yang kemudian membelah menjadi limfosit-T
20
makrofag sehingga dapat memfagositosis bakteri, virus dan partikel asing lainnya
yang masuk ke dalam tubuh ikan. Masuknya immunostimulan juga akan
merangsang makrofag untuk memproduksi lebih banyak lisozim dan komplemen.
Interleukin juga menggiatkan limfosit-B untuk memproduksi antibodi (Raa et al.
1992).
Berdasarkan sumber bahannya (Sakai 1999; Dalmo dan Bricknell 2005)
membagi immunostimulan dalam beberapa kelompok yaitu: bahan asal bakteri,
bahan asal alga, bahan asal hewan, faktor nutrisi dan hormon/sitokin. Beberapa
bahan dari faktor nutrisi berpengaruh dalam mendukung kesehatan dan
mengurangi kerentanan terhadap penyakit (Gatta et al. 2001), sehingga bahan
tersebut tergolong sebagai bahan immunostimulan. Sejumlah bahan nutrisi mikro
berupa vitamin meliputi vitamin (ascorbic acid) C, (tocopherol) E, retinol dan
pyridoxine, mampu berperan sebagai immunostimulan (Blazer, 1992 ; Pulsford et
al. 1995 dalam Gatta et al. 2001). Bahan mikro nutrisi kromium akhir-akhir ini
mendapat perhatian pula sebagai bahan immunostimulan bagi ikan (Gatta et al.
2001; Hastuti 2004).
Kromium (Cr3+) merupakan trace element essential untuk hewan dan
manusia (Lall 2002) dan merupakan komponen penting pada GTF (glucose
toleranice faktor). GTF (glucose tolerance faktor) adalah suatu komponen hati
yang larut dalam air, plasma darah, ragi brewer (brewer’s yeast) dan beberapa
ekstrak biologis serta sel (Linder 1992). GTF yang mengandung Cr (kompleks
organik) berpotensi meningkatkan bioaktivitas insulin sampai 2 kali lipat dalam
rnentransfer glukosa ke sel, glikogenesis, lipogenesis, dan transport serta
pengambilan asam amino.
Beberapa kriteria fisiologis tubuh, termasuk fungsi imunitas, dapat
ditingkatkan oleh kromium trivalensi, dan efeknya terlihat lebih jelas selama stres.
Sistim imunitas dipengaruhi secara negatif selama stres. Hubungan antara
kromium dan fungsi imunitas telah diteliti pada sapi dan angsa. Konsentrasi total
imunoglobulin dan IgM ditemukan mengalami peningkatan setelah stres
transportasi pada sapi yang diberi suplemen ragi yang mengandung kromium
meningkatkan produksi antibodi dalam merespon ovalbumin pada sapi setelah
melahirkan (Van de Ligt et al. 2002).
Hasil penelitian yang konsisten adalah bahwa kromium mereduksi tingkat
kortisol serum (Berger 1996). Hal ini menunjukkan bahwa pemberian kromium
sangat bermanfaat selama periode stres, karena dalam periode tersebut, hewan
akan meningkatkan mobilisasi kromium dan simpanan dalam tubuh (Berger
1996). Dalam periode stres, sapi mudah mengalami defisiensi Cr, dan setelah
diberi suplemen kromium organik menghasilkan produksi, status kekebalan dan
kesehatan yang nyata meningkat, namun konsentrasi kortisol dalam darah
menurun selama kondisi sangat stres (Burton 1995). Respon penurunan kortisol
(kortikosteron) juga ditemukan pada burung quail yang diberi pakan dengan
suplemen kromium-pikolinat dan dipelihara dalam kondisi stres suhu (Sahin et al.
2002).
Studi peran kromium pada ikan umumnya terkait dengan metabolisme,
pertumbuhan dan toksisitas. Sejumlah penelitian mengenai peran kromium
dalam metabolisme menunjukkan bahwa kromium berpengaruh positif dalam
peningkatan pertumbuhan ikan mas (Jain et al. 1994 dalam Gatta et al. 2001), dan
meningkatkan pemanfaatan karbohidrat pada ikan mas dan nila (Hertz et al. 1989;
Shiau & Chen 1993; Shiau & Shy 1998 dalam Gatta et al. 2001). Namun aplikasi
kromium pada ikan chanel catfish (Ichtalurus punctatus) oleh (Ng & Wilson
1997) dan gilthead sea bream (Sparus aurata) oleh (Fernandes et al. 1999)
menunjukkan respon negatif.
Peran kromium sebagai immunostimulan pada mamalia telah mendorong
pula kajian yang sama pada ikan. Hasil pengujian Gatta et al. (2001) pada ikan
rainbow trout (Onchorinchus mykiss), menunjukkan bahwa kromium ragi (Cr3+)
mampu berperan meningkatkan respon imunitas berupa peningkatan aktivitas
sel-sel fagosit, respiratory burst dan serum lysozyme. Aplikasi kromium-ragi (Cr3+)
dalam pakan baru-baru ini efektif juga diterapkan sebagai immunostimulan pada
ikan gurame (Hastuti 2004). Hasil yang diperoleh menunjukkan bahwa
penambahan kromium-ragi (Cr3+) dalam pakan sebesar 1.5 hingga 3.2 ppm
mampu meningkatkan respon imunitas ikan gurame yang dinfeksi oleh bakteri,
22
Kebutuhan kromium dipengaruhi oleh kondisi fisiologis ikan. Stres
meningkatkan mobilisasi kromium dari jaringan dan selanjutnya meningkatkan
ekskresinya. Sehingga stres akan mempengaruhi defisiensi kromium marginal dan
meningkatkan kebutuhannya (Sahin et al. 2002). Kromium dibutuhkan dalam
konsentrasi yang kecil dan belum diketahui dengan pasti. Sumber kromium yang
ekonomis dalam diet kemungkinan adalah kromium klorida, ragi yang kaya
Waktu dan Tempat
Penelitian ini dilaksanakan bulan Mei hingga November 2006 di
Laboratorium Kesehatan Ikan Balai Besar Pengembangan Budidaya Air Tawar
(BBPBAT) Sukabumi dan Laboratorium Kesehatan Ikan, Jurusan Budidaya
Perairan, Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor.
Rancangan Penelitian
Penelitian dilakukan dalam dua tahap. Penelitian tahap satu untuk
mengkaji pengaruh suhu terhadap gambaran darah ikan dan keterkaitannya
dengan kejadian infeksi KHV. Penelitian tahap dua dilakukan untuk menguji
efektifitas suplementasi kromium-ragi (Cr3+) sebagai bahan immunostimulan
untuk meningkatkan respon imunitas selular non spesifik ikan mas dalam
menghadapi serangan KHV.
Penelitian tahap satu dan dua menggunakan model eksperimental
laboratorium. Penelitian tahap satu dalam aplikasinya berupa penginfeksian KHV
secara intramuscular (Dosis FID50-120 jam), pada ikan mas yang dipelihara
dalam suhu media yang berbeda. Rancangan yang digunakan pada penelitian
tahap ini adalah Rancangan Acak Lengkap (RAL), terdiri dari 3 perlakuan, yaitu
penginfeksian virus pada level suhu media : 20±2 oC (Ti), 25±2 oC (Tii) dan
30±2oC (Tiii). Masing-masing perlakuan suhu media, diaplikasikan dengan 3
ulangan.
Adapun untuk penelitian tahap dua menggunakan Rancangan Acak
Lengkap Faktorial (Faktorial RAL), terdiri atas faktor suhu dan dosis
kromium-ragi (Cr 3+). Faktor suhu menggunakan 2 level suhu media yaitu Ti (suhu 20±2
o
C) dan Tii (suhu 25±2 0C), sedangkan dosis kromium-ragi terdiri dari 3 level
yaitu, suplementasi kromium ragi dalam pakan sebanyak 1.5 ppm (K1); 2.0 ppm
(K2); 2.5 ppm (K3) dan kontrol yaitu kromium 0 ppm (K0). Kombinasi
perlakuan suhu media pemeliharan dan konsentrasi kromium ragi yang