PERAN MIKORIZA DALAM REGENERASI
POHON MERBAU [Intsia bijuga (Colebr.) O. Kuntze]
ASAL PAPUA
JULIUS DWI NUGROHO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi ”Peran Mikoriza Dalam Regenerasi Pohon Merbau [Intsia bijuga (Colebr.) O. Kuntze] Asal Papua” adalah karya saya sendiri dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi.
Bogor, Juni 2010
Julius Dwi Nugroho
ABSTRACT
JULIUS DWI NUGROHO. The Significance of Mycorrhiza in Regeneration of Merbau [Intsia bijuga (Colebr.) O. Kuntze] originating from Papua. Supervised by IRDIKA MANSUR, AGUS PURWITO and ENDANG SUHENDANG.
Merbau [Intsia bijuga (Colebr.) Kuntze] is considered as one of valuable timber tree in South-East Asia which has long been exploited but its silviculture for supporting plantation development is neglected. How to produce good quality of merbau seedlings by using generative and vegetative regeneration methods collaborated with the application of ectomycorrhizal association on merbau for improving the performance of the seedlings is an important issue to be answer. The research was carried out in a series of laboratory experiments and field work (exploration). Exploration was done in merbau natural stands, plantation and nurseries for collecting merbau seeds, wildlings, soils suspiciously containing ectomycorrhizal propagules, sporocarps and ectomycorrhizal root tips of merbau. While experiments to find out the efficient method of merbau regeneration through vegetative and generative propagation were conducted in the laboratory. Merbau was easily regenerated through seeds and shoot cuttings. Merbau seeds revealed variation in morphology and seed weight. Seed nicking followed with seed soaking in low concentration of sodium hypochlorite (0.525 %) for 15 minutes and then in hot water for 24 hours gave the highest percentage of seed germination of merbau (78.67%). Seed weight of > 2.25 g gave better in mean germination time and height performance of the seedlings. The application of auxin IBA/NAA (1000 ppm/500 ppm) gave highest percentage of rooted cuttings (77.1%) and of rooted and sprouted cuttings (50.0%). Merbau regeneration by micro cuttings in vitro was successful to produce explants although the regeneration was in low frequency. The constraints are mainly related to early defoliation of leaves and shoots, and the cessation of the growth after 2 months in the culture medium. Maintaining relatively high concentration of nitrogen and phosphate content close to those of MS medium likely gave beneficial effects for shoot initiation of micro-cuttings of merbau in vitro. Only one species of ectomycorrhizal fungus was found associated with merbau [Intsia bijuga (Colebr.) Kuntze]. The fungus formed mycorrhizae with monopodial pinnate branching type. The fungus was identified belonging to the genus of Scleroderma. The fungus could be cultured in both agar and semi-solid media of MMN. Other ectomycorrhizal fungi i.e. Scleroderma sinnamariense, Scleroderma columnare, Scleroderma. dictyosporum and Pisolithus sp were not able to form ectomycorrhizae with merbau seedlings. Inoculation using both suspension of spore masses and mycelia aggregates of Scleroderma sp did not gave any influences to the cuttings success. On the other hand the inoculation effectively improved the seedling and the transplanted-rooted cutting performance.
JULIUS DWI NUGROHO. Peran Mikoriza dalam Regenerasi Pohon Merbau [Intsia bijuga (Colebr.) O. Kuntze] Asal Papua. Di bawah bimbingan IRDIKA MANSUR, AGUS PURWITO dan ENDANG SUHENDANG.
Merbau [Intsia bijuga (Colebr.) O. Kuntze] merupakan salah satu jenis pohon penghasil kayu berharga di Asia Tenggara. Jenis ini menjadi salah satu target utama untuk produksi kayu, namun pengembangan pengetahuan silvikulturnya untuk dapat mendukung regenerasi dan pembubidayaan hingga saat ini terabaikan. Pengembangan pengetahuan teknik regenerasi merbau secara generatif maupun vegetatif yang efisien digabungkan dengan pemanfaatan peran fungi ektomikoriza untuk meningkatkan mutu bibit tanaman merbau digunakan untuk memperoleh teknologi produksi bibit merbau yang efisien dan mampu menghasilkan bibit bermutu baik.
Penelitian ini merupakan suatu seri penelitian, terdiri atas sub-penelitian berjudul (1) Biologi dan perkecambahan biji merbau [Intsia bijuga (Colebr.) O. Kuntze]; (2) Inisiasi stek mikro pucuk merbau [Intsia bijuga (Colebr.) O. Kuntze] secara in vitro pada berbagai komposisi media kultur; (3) Karakterisasi morfologi ektomikoriza pada merbau [Intsia bijuga (Colebr.) O. Kuntze]; (4) Pembiakan fungi ektomikoriza Scleroderma sp. secara in vitro; (5) Spesifisitas merbau [Intsia bijuga (Colebr.) O. Kuntze] sebagai inang fungi ektomikoriza; (6) Keberhasilan stek merbau [Intsia bijuga (Colebr.) O. Kuntze] menggunakan auksin (IBA/NAA) dan inokulum fungi ektomikoriza; (7) Pengaruh inokulasi fungi ektomikoriza Scleroderma sp. terhadap keberhasilan penyapihan stek merbau [Intsia bijuga (Colebr.) O. Kuntze].
dalam petridish memperlihatkan biji merbau dengan perlakuan pelukaan berkecambah dalam 8 hari setelah penyemaian. Daun pertama kecambah merbau muncul dari dalam kotiledon terjadi pada hari ke 16.
Perbanyakan merbau melalui stek mikro pucuk merbau secara in vitro dilakukan dengan mengeksplorasi media MS yang dimodifikasi susunan garam anorganiknya dan media WPM yang dimodifikasi komposisi vitaminnya mengikuti komposisi pada media MS. Eksplorasi juga mengikutsertakan penggunaan sitokinin BAP, auksin NAA dan IBA, adenin sulfat, casein hidrolisat, vitamin C dan arang aktif. Dalam penelitian ini berhasil diperoleh inisiasi tunas dari stek mikro merbau hingga 42,9%. Kendala dalam inisiasi dan pertumbuhan tunas merbau berhubungan dengan defoliasi dini pucuk dan daun, berhentinya pertumbuhan tunas dan rendahnya frekuensi regenerasi tunas.
Ektomikoriza pada merbau dipelajari melalui eksplorasi lapangan, dan melalui penanaman cabutan alam dari lapangan dengan menggunakan media tanah yang diambil dari bawah tegakan merbau dengan tujuan untuk mendapatkan akar bermikoriza dan sporokarp (baiting method). Badan buah maupun ektomikoriza yang diperoleh dari kedua metode tersebut didiskripsi karakter morfologi maupun morfotipenya, sedangkan karakter mikroskopis ditelaah secara histologi. Dari kegiatan ini ditemukan satu jenis fungi ektomikoriza yaitu Scleroderma sp. yang bersimbiosis dengan anakan merbau,. Fungi ektomikoriza ini dapat diisolasi dan dibiakkan dalam media kultur Modified Melin-Norkrans (MMN) agar padat dan semi cair. Dengan pertumbuhan 2,52 ± 1,10 cm /2 bulan pada media MMN padat dan 0,41 ± 0,14 cm/2 bulan pada media MMN semi cair.
Merbau sebagai inang fungi ektomikoriza diuji spesifisitasnya dengan menginokulasikan fungi ektomikoriza asal anakan merbau yaitu Scleroderma sp., dan asal tegakan lainyaitu Scleroderma sinnamariense, Scleroderma columnare, Scleroderma dictyosporum dan Pisolithus sp. Inokulum diberikan dalam dua macam bentuk yaitu bentuk agregat miselium dan suspensi spora. Dari pengujian ini diperoleh hasil bahwa seluruh tanaman yang terinfeksi memiliki ciri morfotipe ektomikoriza sama dengan ciri yang ditampakkan oleh asosiasi Scleroderma sp. dengan merbau, sebaliknya empat fungi ektomikoriza asal tegakan lain tidak dapat membentuk ektomikoriza dengan merbau.
Fungi ektomikoriza Scleroderma sp. berperan penting dalam meningkatkan keragaan tanaman sapih asal biji. Total berat biomassa kering tanaman bermikorisa menunjukkan 78% lebih tinggi daripada tanaman tidak bermikoriza. Anakan merbau lebih efektif diinokulasi dengan inokulum spora, dengan perbedaan persen akar terinfeksi mencapai 67% dibandingkan dengan inokulum agregat miselia.
Penggunakan auksin IBA/NAA maupun pemberian inokulum fungi ektomikoriza Scleroderma sp.dalam bentuk agregat miselia maupun suspensi spora ditujukan untuk meningkatkan keberhasilan stek. Perlakuan IBA/NAA 2000 ppm/1000 ppm memberikan hasil terbaik dengan persen stek berakar (76,4%) dan persen stek berakar dan bertunas (43,1%). Peran mikoriza untuk meningkatkan pengakaran stek belum tampak. Stek berakar yang terkolonisasi Scleroderma sp. berjumlah 0,01-0,02%.
@ Hak Cipta milik IPB, tahun 2010 Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB 2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh
MERBAU [Intsia bijuga (Colebr.) O. Kuntze]
ASAL PAPUA
JULIUS DWI NUGROHO
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Pengetahuan Kehutanan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
1. Ujian Tertutup Tanggal 03 Mei 2010 Penguji Luar Komisi Pembimbing: a. Prof. Dr. Ir. Cecep Kusmana, M.S.
Guru Besar pada Departemen Managemen Hutan, Fakultas Kehutanan, Institut Pertanian Bogor
b. Dr. Ir. Sri Wilarso Budi R, M.S.
Staf Pengajar pada Departemen Silvikultur Tropika, Fakultas Kehutanan, Institut Pertanian Bogor
2. Ujian Terbuka Tanggal 08 Juni 2010 Penguji Luar Komisi Pembimbing: a. Dr. Ir. Hadi Daryanto, DEA
Direktur Jenderal Bina Produksi Kehutanan, Kementerian Kehutanan Republik Indonesia.
b. Dr. Ir. Arum Sekar Wulandar, M.S.
Judul Disertasi : Peran Mikoriza pada Regenerasi Pohon Merbau [Intsia bijuga (Colebr.) O. Kuntze] Asal Papua Nama : Julius Dwi Nugroho
NIM : E061040051
Disetujui
Komisi Pembimbing
Dr. Ir. Irdika Mansur, M.For.Sc. Ketua
Dr. Ir. Agus Purwito, M.Sc. Prof. Dr. Ir. Endang Suhendang, M.S. Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pasca Sarjana Ilmu Pengetahuan Kehutanan
Prof. Dr. Ir. Imam Wahyudi, M.S. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Pengasih atas terselesaikannya disertasi ini. Penulisan disertasi merupakan salah satu syarat untuk memperoleh gelar Doktor pada Program Sekolah Pascasarjana Institut Pertanian Bogor, Program Studi Ilmu Pengetahuan Kehutanan.
Disertasi berjudul ”Peran Mikoriza dalam Regenerasi Pohon Merbau [Intsia bijuga (Colebr.) O. Kuntze] Asal Papua” merupakan suatu seri penelitian yang terdiri atas survei lapangan maupun percobaan di rumah kaca dan laboratorium. Keseluruhan seri penelitian ini bertujuan untuk mengungkapkan cara regenerasi merbau dengan menyertakan pemanfaatan mikoriza untuk memperoleh bibit merbau yang bermutu baik. Bab 5 dan 6 dari disertasi ini telah dipublikasikan dalam Hayati Journal of Biosciences Vol. 17, No.2, June 2010, dengan judul “Morphological Characteristics of Ectomycorrhizas on Merbau [Intsia bijuga (Colebr.) Kuntze]”
Penyelesaian disertasi ini tidak terlepas dari bantuan segala pihak. Pada kesempatan ini penulis menyampaikan penghargaan dan mengucapkan terimakasih kepada: Dr. Ir. Irdika Mansur, M.For.Sc., Prof. Dr. Endang Suhendang, M.S. dan Dr. Ir. Agus Purwito, M.Sc., selaku komisi pembimbing, yang telah mencurahkan waktu dan perhatian dalam proses penelitian hingga penyelesaian disertasi penulis. Demikian pula kepada Dr. Ir. Sri Wilarso Budi R, M.S., Prof. Dr. Cecep Kusmana, M.S., Dr. Ir. Hadi Daryanto, DEA. dan Dr. Arum Sekar Wulandari, M.S., selaku penguji dalam ujian prelim, penguji luar komisi dalam ujian tertutup dan ujian terbuka, penulis sampaikan terima kasih atas kesediaan dan saran-saran penyempurnaan isi desertasi.
Pendidikan Nasional RI melalui Dirjen Pendidikan Tinggi melalui bantuan Beasiswa Pendidikan Pasca Sarjana (BPPS), DP3M Dikti atas Beasiswa Unggulan (P3SWOT) 2007 dan Hibah Doktor 2009. Untuk itu, penulis menyampaikan terimakasih.
Kepada Rektor Institut Pertanian Bogor, Pimpinan Program Pascasarjana IPB, Rektor Universitas Negeri Papua dan Dekan Fakultas Kehutanan Universitas Negeri Papua, penulis ucapkan terimakasih atas kesempatan yang diberikan untuk mengikuti program pendidikan S3 di Program Pascasarjana IPB. Ucapan terimakasih penulis sampaikan pula kepada Kepala Bagian Laboratorium Silvikultur Fakultas Kehutanan IPB, Laboratorium Silvikultur SEAMEO-BIOTROP, dan Laboratorium Budidaya Hutan Fakultas Kehutanan Universitas Negeri Papua atas ijin dan bantuannya dalam penggunaan fasilitas laboratorium selama penulis melakukan penelitian.
Demikian pula penulis sampaikan terimakasih kepada Bu Melya dan keluarga, Pak Abi, Pak Iskandar, Ibu Widi, Teh Nur, Mbak Faiq, Bu Diana, Bi Itah, Pak Atang, Pak Santa, rekan-rekan SPs IPB. dan seluruh rekan mahasiswa asal Papua atas bantuan, dorongan semangat dan kebersamaan selama ini.
Secara khusus, penulis sampaikan terima kasih kepada orang tua, mertua dan keluarga besar penulis atas dukungan dan doanya. Demikian pula kepada istri, Elda Irma Jeanne Joice Kawulur, dan ananda, Ignacio Simeon Nugroho tercinta atas segala pengorbanan, kasih sayang dan doa yang tak henti.
Akhirnya, semoga hasil penelitian ini dapat bermanfaat bagi pengembangan silvikultur merbau di tanah air dan khususnya bagi pembangunan kehutanan di Papua.
Bogor, Juni 2010
RIWAYAT HIDUP
Penulis dilahirkan di Purworejo tanggal 8 Juli 1960 sebagai anak kedua dari tujuh bersaudara, dari ayah Simeon Soepratiknjo (Alm) dan ibu Erlina Soelihingsih. Penulis menikah dengan Elda Irma Jeanne Joice Kawulur dan dianugerahi seorang anak, Ignacio Simeon Nugroho.
Pendidikan Sekolah Dasar, Sekolah Menengah Pertama dan Sekolah Menengah Atas diselesaikan di Jayapura. Pada tahun 1979 penulis melanjutkan pendidikan di Universitas Cenderawasih Fakultas Pertanian Peternakan dan Kehutanan di Manokwari. Penulis memperoleh gelar sarjana kehutanan pada tahun 1986. Pada tahun yang sama penulis diterima sebagai pengajar di Fakultas Pertanian Peternakan dan Kehutanan, Universitas Cenderawasih di Manokwari, yang kemudian berubah nama menjadi Universitas Negeri Papua pada tahun 2000. Sejak tahun tersebut hingga sekarang penulis aktif sebagai pengajar di Fakultas Kehutanan Universitas Negeri Papua.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xxiii
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xxxi
PENDAHULUAN ... 1
Latar Belakang ... 1
Rumusan Masalah ... 3
Tujuan Penelitian ... 6
TINJAUAN PUSTAKA ... 9
Merbau [Intsia bijuga (Colebr.) O. Kun ……… 9
Nama Botanis dan Vernakular ... 9
Penyebaran Geografi dan Ekologi... 9
Ciri Botanis ... 10
Penggunaan ... 11
Status Konservasi ... 11
Ektomikoriza ... 12
Ciri Umum Ektomikor... ... 13
Fungi Ektomikoriza... 14
Manfaat Mikoriza ... 15
Karakterisasi dan Identifikasi Fungi Ektomikoriza ... 16
Isolasi Fungi Ektomikoriza ………... .. 18
Asosiasi dan Spesifisitas Ektomikoriza ... . 20
Regenerasi Tanaman Berkayu ………... 21
Perbanyakan Tanaman Melalui Biji ... 21
Perbanyakan Tanaman Melalui Stek (Cuttings) ... 25
Perbanyakan Tanaman Secara In Vitro ... 26
Pemanfaatan Ektomikoriza Dalam Perbanyakan Tanaman... ... 33
Perkembangan Penelitian Jenis Merbau ... 37
Kerangka Pemecahan Masalah ... 40
Hipotesis ... 43
Daftar Pustaka ……… 44
BIOLOGI DAN PERKECAMBAHAN BIJI MERBAU [Intsia bijuga (Colebr.) O. Kuntze] ………... ….. 51
Abstrak ……….. 51
Abstract ……….……… 51
Pendahuluan ……….. 52
Latar Belakang ……… 52
xx
Bahan dan Metode ………. 53
Bahan Percobaan ………... 53
Biologi Benih dan Perkecambahan ………... 54
Pengaruh ukuran biji dan Perlakuan awal terhadap ... 54
Analisis Data ……… 56
Hasil dan Pembahasan ……….. 57
Hasil Penelitian ……… 57
Pembahasan ………. 63
Simpulan ……… 67
Daftar Pustaka ……… 69
INISIASI STEK MIKRO PUCUK MERBAU [Intsia bijuga (Colebr.) O.Kuntze] SECARA IN VITRO PADA BERBAGAI KOMPOSISI MEDIA KULTUR ………...… 71
Abstrak ……….. 71
Abstract ……….………. 71
Pendahuluan ……….. 72
Latar Belakang .……… .. 72
Tujuan Penelitian ………. 73
Bahan dan Metode ………….……….. 73
Bahan Penelitian ……….. 73
Rancangan Penelitian ……….. 73
Prosedur Penelitian ……….. 74
Pengamatan dan Analisis Data ……… 74
Hasil dan Pembahasan……… 74
Hasil Penelitian ……… 74
Pembahasan …..……… 77
Simpulan ……… 81
Daftar Pustaka ……… 82
KARAKTERISASI MORFOLOGI EKTOMIKORIZA PADA MERBAU [Intsia bijuga (Colebr.) O. Kuntze] …………...……… 85
Abstrak ……….. 85
Abstract ………. 85
Pendahuluan ……….. 86
Latar Belakang ……… ... 86
Tujuan Penelitian ………. 86
Bahan dan Metode ... 87
Lokasi Penelitian ………. 87
Survei Lapangan dan Baiting Method ……….. 87
Karakterisasi Morfologi dan Anatomi Mikoriza... 88
Hasil dan Pembahasan ... 88
Hasil Penelitian ……… 88
xxi Halaman
Simpulan ………... 93
Daftar Pustaka ………... 93
PEMBIAKAN FUNGI EKTOMIKORIZA Scleroderma sp. SECARA IN VITRO ... 95
Abstrak ……….. 95
Abstract ………. 95
Pendahuluan ……….. 95
Latar Belakang ……… …… 95
Tujuan Penelitian ……….……… 96
Bahan dan Metode ...… 96
Hasil dan Pembahasan ... 98
Hasil Penelitian ……… 98
Pembahasan ……… 100
Simpulan ……… 101
Daftar Pustaka ……… 102
SPESIFISITAS MERBAU [Intsia bijuga (Colebr.) O. Kuntze] SEBAGAI INANG FUNGI EKTOMIKORIZA ……… 105
Abstrak ……….. 105
Abstract ……….……… 105
Pendahuluan ……….. 106
Latar Belakang ……… 106
Tujuan Penelitian ………. 107
Bahan dan Metode ….……….……….………. 107
Rancangan Penelitian……… 107
Prosedur Penelitian………... 108
Pengamatan dan Analisis Data………. 110
Hasil dan Pembahasan………..…. 111
Hasil Penelitian ………. ….. 111
Pembahasan …..………... 115
Simpulan ………..…….. 121
Daftar Pustaka ……… 122
KEBERHASILAN STEK MERBAU [Intsia bijuga (Colebr.) O. Kuntze] MENGGUNAKAN AUKSIN (IBA/NAA) DAN INOKULUM FUNGI EKTOMIKORIZA ……… 125
Abstrak ……….…. 125
Abstract ……….………..….. 125
Pendahuluan ……….. 126
Latar Belakang ……… … 126
Tujuan Penelitian ………. 127
xxii
Rancangan Penelitian ……….. 127
Prosedur Penelitian ……….. 127
Pengamatan dan Analisis Data ……… 129
Hasil dan Pembahasan……… 130
Hasil Penelitian ……….…. …. 130
Pembahasan …..….……….. 134
Simpulan ……..…..………..…………. 136
Daftar Pustaka ……… 137
PENGARUH INOKULASI FUNGI EKTOMIKORIZA Scleroderma sp TERHADAP KEBERHASILAN PENYAPIHAN STEK MERBAU [Intsia bijuga (Colebr.) O. Kuntze] ……… 139
Abstrak ……….…. 139
Abstract ……….………..….. 139
Pendahuluan ……….. 140
Latar Belakang ……… …… 140
Tujuan Penelitian ………. 140
Bahan dan Metode ………….……….. 140
Bahan Penelitian ……….. 140
Rancangan Penelitian ……….. 141
Prosedur Penelitian ……….. 141
Pengamatan dan Analisis Data ……… 142
Hasil dan Pembahasan……… 142
Hasil Penelitian ……… 142
Pembahasan …..….……….. 146
Simpulan ………..…………. 148
Daftar Pustaka ……… 149
PEMBAHASAN UMUM ……… .. 151
SIMPULAN DAN SARAN ………... 157
Simpulan ……….. 157
Saran ………. 157
DAFTAR PUSTAKA ………. 159
Halaman 1 Fungi basidiomycetes pembentuk ektomikoriza dan tipe hormon
tumbuh yang dihasilkan ... 36
2 Rangkuman Hasil-hasil Penelitian Jenis Merbau [Intsia bijuga (Colebr.) O. Kuntze] yang mendukung dalam pengembangan penelitian di bidang silvikultur ...
38
3 Rata-rata benih merbau [Intsia bijuga (Colebr.) O. Kuntze] berimbibisi (%) setelah perlakuan awal pelukaan, perendaman dalam larutan sodium hipoklorit NaOCl 5,25% dan pembakaran
pada benih dengan ukuran benih yang berbeda ……… 61
4 Modifikasi media Woody Plant Media (WPM), Murashige dan Skoog (MS) untuk media inisiasi tunas stek mikro merbau
[Intsia bijuga (Colebr.) O. Kuntze] secara in vitro ………. 75
5 Persentase eksplan bertunas (ET), eksplan berkalus (EK) dan eksplan berakar (EA) stek mikro merbau [Intsia bijuga (Colebr.)
O. Kuntze] pada beberapa media modifikasi WPM dan MS ... 78
6 Deskripsi karakter biakan Scleroderma sp yang ditumbuhkan pada media Modified Melin-Norkrans (MMN) padat dan
semi-cair ... 99
7 Sifat kimia media tanam ... 109
8 Kemampuan fungi ektomikoriza uji dalam menginfeksi dan mengkolonisasi, dan penampilan keragaan anakan merbau [Intsia bijuga (Colebr.) O. Kuntze] akibat keberadaan fungi
ektomikoriza ... 112
9 Korelasi persentase kolonisasi (K) dengan berat kering akar
(BKA), berat kering pucuk (BKP), serapan N dan serapan P ... 115
10 Rata-rata persentase stek hidup (SH), persentase stek bertunas (ST), persentase stek berakar (SA), persentase stek bertunas dan berakar (STA), jumlah rata-rata akar primer (JA), rata-rata panjang akar primer (PA), jumlah daun (JD) dan persentase stek terinfeksi (I) dipengaruhi oleh pemberian auksin dan inokulasi fungi ektomikoriza Scleroderma sp. pada 4 minggu setelah
xxiv
11 Rata-rata penampilan keragaan, persentase tanaman terinfeksi dan persentase kolonisasi pada tanaman sapihan stek merbau [Intsia bijuga (Colebr.) O. Kuntze] umur 4 bulan sebagai akibat
pengaruh inokulasi fungi ektomikoriza Scleroderma sp. ... 143
12 Korelasi antara tingkat kolonisasi fungi EcM dengan berat kering akar (BKA), berat kering pucuk (BKP), serapan N dan
xxv
DAFTAR GAMBAR
Halaman
1 Ciri morfologi merbau [Intsia bijuga (Colebr.) O. Kuntze]. (a) Daun majemuk merbau; (b) bunga biseksual merbau, (c) buah
polong merbau dengan (d) biji yang berkulit keras ... 11
2 Ciri anatomi ektomikoriza. M = mantel (sheath), HN=Hartig net
dan C=sel kortek (Brundrett et al. 1994) ... 13
3 Beberapa jenis fungi ektomikoriza yang mudah dijumpai pada beberapa tanaman di Indonesia. Scleroderma columnare (A), S. sinamariensis (B), Scleroderma dictyosporum (C) dan Pisolithus
sp. (D) ………..…... 15
4 Struktur morfologi fungi Basidiomycetes. 1-3 Epigeous fungi, A= cap (pileus), B=hymenium/gill/lammeliae, C=stipe/ stalk/stem, D=partial veil/annulus/cortina, E=base, F=universal veil remains, G=fleshl. 4. hypogeous fungi, H=peridium, I=gleba (internal fertile tissue), J=locules, K=columella (steril tissue); dan pada semua tipe fungi, L=attached hyphae, M=bruising
exudates (Brundrett et al. 1994) ... 17
5 Perbedaan antara zygotic embryogenesis dan somatic
embriogenesis (Gray 2005) ………...……. 28
6 Sumber sel embriogenik, tipe embriogenesis dan perkembangan
embrio menjadi tanaman (Gray 2005) ………...…… 29
7 Kerangka Pemecahan Masalah Penelitian. Garis terputus adalah kondisi saat ini, garis tak terputus adalah cara pemecahan
masalah dan angka 1-7 adalah topik penelitian. ... 42
8 (a) Bentuk morfologi biji merbau [Intsia bijuga (Colebr.) O. Kuntze] bervariasi. Mulai dari gambar atas kanan ke kiri, biji berbentuk pipih seperti spatula, bulat (globose) hingga oval (eliptikal), mendekati bentuk hati (kordata) hingga mendekati bentuk persegi empat (oblong). (b-c) bentuk dan ukuran biji tergantung letaknya saat terbentuk dalam polong buah
merbau ... 58 9 Variasi bobot biji merbau [Intsia bijuga (Colebr.) O. Kuntze].
A-E = lokasi pengambilan biji, dan F merupakan variasi gabungan bobot biji dari seluruh lokasi pengambilan biji. Bar dengan huruf yang sama menunjukkan tidak berbeda nyata
xxvi
10 Struktur biji dan proses imbibisi pada merbau [Intsia bijuga (Colebr.) O. Kuntze]. (a) penampakan penampang melintang biji merbau. T=testa (seed coat), Pl=plumula, Hyp=hipokotil, R=radikula, C=kotiledon dan Hil=hilum; (b) anatomi testa sebelum terjadinya imbibisi Cut=kutikula, MS=sel makroskleroid, Os=sel osteoskleroid, Pa=sel parenkim; (c) imbibisi telah terjadi dan tampak pelepasan testa; (d) biji yang telah terimbibisi, (e) Kulit terluar telah terlepas menampakkan sebagian testa bagian dalam yang tersisa, demikian pula kotiledon tampak
telanjang………..…………..……… 60
11 Proses perkecambahan biji merbau [Intsia bijuga (Colebr.) O. Kuntze]. (a) penampakan embrio setelah perlakuan awal diberikan; (b) pemanjangan plumula maupun radikle telah tampak pada 5 hari setelah penyemaian; (c) akar telah memanjang keluar pada 8 hari setelah penyemaian; (d) akar cabang mulai terbentuk pada 14 hari setelah penyemaian; (e) pemanjangan plumula terus berlanjut pada 14 hari setelah penyemaian, walau kotiledon masih tertutup; (f) daun pertama muncul dari dalam kotiledon pada 16
hari setelah penyemaian …...……… 60
12 Pengaruh ukuran benih (kecil <2,25 g, besar 2,25-3,25, besar >3,25) terhadap daya berkecambah (G), rata-rata benih berkecambah per hari (MDG), rata-rata waktu untuk berkecambah (MGT) dan tinggi kecambah merbau [Intsia bijuga (Colebr.) O. Kuntze]. Bar dengan huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji jarak berganda Duncan (DMRT,
p<0,05)... 62
13 Perbedaan keragaan yang dihasilkan oleh benih dengan ukuran berbeda. Dari kiri ke kanan anakan merbau [Intsia bijuga (Colebr.) O. Kuntze] umur 30 hari setelah tanam asal benih ber
ukuran besar, sedang dan kecil ... 63
14 Pengaruh perlakuan awal benih (P = NaClO 5.25%+air panas; B=bakar+ NaClO 0.525%+air panas; L=pelukaan+NaClO 0.525%+air panas) terhadap daya berkecambah (G), rata-rata benih berkecambah per hari (MDG), rata-rata waktu untuk berkecambah (MGT) dan tinggi kecambah merbau [Intsia bijuga (Colebr.) O. Kuntze]. Bar dengan huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji jarak berganda Duncan
xxvii Halaman
15 Inisiasi tunas stek mikro merbau [Intsia bijuga (Colebr.) O. Kuntze pada media modifikasi Woody Plant Media (WPM),
Murashige dan Skoog (MS). ...………... 79
16 Scleroderma sp (a) sporokarp berbentuk globose hingga tak beraturan; (b) potongan memanjang dari sporocarp memperlihatkan peridium berwarna putih kekuningan mengandung massa spora berwarna coklat terang kekuningan; (c) sporokarp dewasa; dengan massa spora berwarna coklat (d) basidiospora di lihat dengan mikroskop dan (e) basidiospora menampakkan ornamentasi retikulat di bawah Scanning electron
microscope; (f) sambungan apit ... 90
17 Ektomikoriza pada merbau [Intsia bijuga (Colebr.) O. Kuntze]. (a) sistem akar bermikoriza merbau dengan percabangan monopodial pinnate; (b) ujung akar bermikoriza merbau di bawah Scanning electron microscope (SEM) dengan ayaman miselia yang rapat, (c) potongan melintang dari asosiasi ektomikoriza Scleroderma sp pada merbau, menunjukkan mantel yang tebal; (d) morfotipe dari mantel, menunjukkan tipe jaringan mantel yang pseudoparenchymatous. M=matel, HN=hartig net, E=sel epidermis, C=sel kortek, En=Sel
Endodermis ... 91
18 Kultur in vitro Scleroderma sp. (a) kultur berumur 2 bulan pada media agar Modified Melin-Norkrans (MMN), tampak atas, dan (b) tampak bawah. (c) eksudat kuning kecoklatan sering tampak saat isolasi. (d) kultur berumur 2 bulan dalam media semi-cair (agar 3%) MMN menghasilkan gumpalan-gumpalan agregat
miselium…... 99
19 Kolonisasi fungi Scleroderma sp. pada akar anakan merbau [Intsia bijuga (Colebr.) O. Kuntze] berumur satu tahun. (a) akar tanaman kontrol (K) tidak ada kolonisasi, (b) kolonisasi sempurna pada perlakuan inokulasi dengan Scleroderma sp. dalam bentuk spora (Is), (c) kontaminasi Scleroderma sp. pada perlakuan inokulasi dengan Pisolithus sp. dalam bentuk spora (Ps) (tanda panah warna merah) terjadi dekat pangkal batang, (d) sporocarp Scleroderma sp. (tanda panah warna hitam) terbentuk pada Ps, (e) morfotipe ektomikoriza yang terbentuk pada Is
xxviii
20 Analisis histologi (a) akar non mikoriza dan (b) akar bermikoriza hasil inokulasi fungi Scleroderma sp. M=Mantel, Hn=Hartig net, Ep=Epidermis, C=kortek, Recc = Radially elongated epidermis
cel ... 114
21 Perbandingan keragaan anakan merbau [Intsia bijuga (Colebr.) O. Kuntze] yang diinokulasi dengan fungi ektomikoriza Scleroderma sp. dalam bentuk spora dan miselium 12 bulan
setelah tanam dalam kondisi terkontrol ... 116
22 Perkembangan pembentukan ektomikoriza pada anakan merbau [Intsia bijuga (Colebr.) O. Kuntze] yang diinokulasi dengan suspensi spora dalam kontainer kaca. (a) ujung akar bermikoriza mulai tampak saat anakan berumur 4 bulan setelah tanam, (b) ektomikoriza muncul di permukaan tanah dekat pangkal batang saat 5 bulan setelah tanam, (c) ujung akar bermikoriza saat 5 bulan setelah tanam, (d) ujung akar bermikoriza saat 8 bulan setelah tanam, (e) badan buah Scleroderma sp. (tanda panah) terbentuk saat 8 bulan setelah tanam, dan (f) pembentukan ektomikoriza telah merata pada seluruh perakaran satu tahun
setelah tanam. ... 117
23 Bahan stek untuk percobaan. Bagian apikal (ruas 1-3) dan bagian
basal (ruas 4-6) ... 128 24 Keragaman diameter bahan stek yang digunakan. Bahan stek asal
bagian basal (A dan B) dan bahan stek asal bagian apikal (C dan
D) ……...……….……… 131
25 Perbedaan hasil penyetekan batang merbau [Intsia bijuga (Colebr.) O. Kuntze] pada 4 minggu setelah tanam akibat pengaruh pemberian auksin, (a) Kontrol (Z0), (b) perlakuan 1000 ppm IBA/500 ppm NAA (Z1), (c) perlakuan 2000 ppm IBA/1000 ppm NAA (Z2), (d) perlakuan 3000 ppm IBA/1500 ppm NAA
(Z3) ... 132
26 Karakteristik pembentukan akar dan tunas pada stek merbau [Intsia bijuga (Colebr.) O. Kuntze]. (a) pembentukan akar pada perlakuan auksin selalu didahului dengan terbentuknya kalus (tanda panah), (b) akar adventif tumbuh dari ruas stek (internode), (c) akar stek yang terkolonisasi fungi ektomikoriza Scleroderma sp., (d) buku (node) bagian bawah (tanda panah hitam) dan bagian atas (tanda panah putih). Buku bawah yang
xxix Halaman
27 Keragaan tanaman sapih stek merbau [Intsia bijuga (Colebr.) O. Kuntze]. (a) tanaman kontrol (tanpa inokulasi fungi ektomikoriza Scleroderma sp.), (b) tanaman sapih dengan inokulasi suspensi spora, (c) dengan inokulasi suspensi agregat miselium, (d-e) gugur pucuk dan daun akibat stres. Gejala umum pada tanaman tidak bermikoriza, menyebabkan pertunasan yang menyemak (f) penampilan yang mirip antara tanaman hasil stek (sebelah kanan) dengan hasil perbanyakan dengan biji berumur satu tahun
(sebelah kiri) ... 144
28 Perbandingan antara akar bermikoriza dengan akar non-mikoriza pada tanaman sapih merbau hasil stek. (a-b) kolonisasi fungi ektomikoriza Scleroderma sp. pada akar tanaman merbau [Intsia bijuga (Colebr.) O. Kuntze] hasil stek umur 4 bulan setelah tanam. Tampak sporokarp muda terbentuk dalam polibag, maupun muncul di permukaan tanah (tanda panah merah). (c) kolonisasi fungi ektomikoriza terbentuk sangat baik menutup seluruh perakaran tanaman hasil stek umur 4 bulan setelah tanam
DAFTAR LAMPIRAN
Halaman
1 Analisis sidik ragam (Anova) pengaruh bobot biji dan perlakuan awal benih terhadap persen biji terimbibisi pada merbau [Intsia bijuga (Colebr.) O. Kuntze]. Nilai biji terimbibisi ditransformasi
menggunakan Arcsin√x ………... 171
2 Analisis sidik ragam (Anova) pengaruh bobot biji dan perlakuan awal benih terhadap daya kecambah (G) biji merbau [Intsia bijuga (Colebr.) O. Kuntze]. Nilai daya kecambah ditransformasi
menggunakan Arcsin√x ... 171
3 Analisis sidik ragam (Anova) pengaruh bobot biji dan perlakuan awal benih terhadap rata-rata waktu berkecambah (MGT) biji
merbau [Intsia bijuga (Colebr.) O. Kuntze]... 171
4 Analisis sidik ragam (Anova) pengaruh bobot biji dan perlakuan awal benih terhadap rata-rata benih berkecambah per hari (MDG) pada merbau [Intsia bijuga (Colebr.) O. Kuntze]
... 172
5 Analisis sidik ragam (Anova) pengaruh bobot biji dan perlakuan awal benih terhadap tinggi (T) kecambah merbau [Intsia bijuga
(Colebr.) O. Kuntze]... 172
6 Analisis sidik ragam (Anova) pengaruh inokulasi fungi ektomikoriza terhadap tinggi (T) anakan merbau [Intsia bijuga
(Colebr.) O. Kuntze] ... 172
7 Analisis sidik ragam (Anova) pengaruh inokulasi fungi ektomikoriza terhadap diameter (D) anakan merbau [Intsia
bijuga (Colebr.) O. Kuntze] ... 173
8 Analisis sidik ragam (Anova) pengaruh inokulasi fungi ektomikoriza terhadap berat kering pucuk (BKP) anakan merbau
[Intsia bijuga (Colebr.) O. Kuntze] ... 173
9 Analisis sidik ragam (Anova) pengaruh inokulasi fungi ektomikoriza terhadap persen infeksi (I) anakan merbau [Intsia bijuga (Colebr.) O. Kuntze] .. Data ditransformasi menggunakan
xxxii
10 Analisis sidik ragam (Anova) pengaruh inokulasi fungi ektomikoriza terhadap persen kolonisasi (M) anakan merbau [Intsia bijuga (Colebr.) O. Kuntze] .. Data ditransformasi
menggunakan Arcsin√x ... 174
11 Analisis sidik ragam (Anova) pengaruh pemberian ZPT dan inokulasi fungi EcM Scleroderma sp. terhadap persentase stek
hidup (SH) merbau [Intsia bijuga (Colebr.) O. Kuntze] ... 174
12 Analisis sidik ragam (Anova) pengaruh pemberian ZPT dan inokulasi fungi EcM Scleroderma sp. terhadap persentase stek
bertunas (ST) merbau [Intsia bijuga (Colebr.) O. Kuntze] ... 174
13 Analisis sidik ragam (Anova) pengaruh pemberian ZPT dan inokulasi fungi EcM Scleroderma sp. terhadap persentase stek
berakar (SA) merbau [Intsia bijuga (Colebr.) O. Kuntze] ... 175
14 Analisis sidik ragam (Anova) pengaruh pemberian ZPT dan inokulasi fungi EcM Scleroderma sp. terhadap persentase stek bertunas dan berakar (STA) merbau [Intsia bijuga (Colebr.) O.
Kuntze] ... 175
15 Analisis sidik ragam (Anova) pengaruh pemberian ZPT dan inokulasi fungi EcM Scleroderma sp. terhadap jumlah akar primer (JA) stek merbau [Intsia bijuga (Colebr.) O. Kuntze].
Data ditransformasi menggunakan √x ... 175
16 Analisis sidik ragam (Anova) pengaruh pemberian ZPT dan inokulasi fungi EcM Scleroderma sp. terhadap jumlah daun (JD) stek merbau [Intsia bijuga (Colebr.) O. Kuntze]. Data
ditransformasi menggunakan √x ... 176
17 Analisis sidik ragam (Anova) pengaruh pemberian ZPT dan inokulasi fungi EcM Scleroderma sp. terhadap jumlah tunas (JT)
stek merbau [Intsia bijuga (Colebr.) O. Kuntze] ... 176
18 Analisis sidik ragam (Anova) pengaruh pemberian ZPT dan inokulasi fungi EcM Scleroderma sp. terhadap panjang akar
primer (PA) stek merbau [Intsia bijuga (Colebr.) O. Kuntze] ... 176
19 Analisis sidik ragam (Anova) pengaruh inokulasi fungi EcM Scleroderma sp. terhadap persentase anakan sapih hidup asal
xxxiii
Halaman
20 Analisis sidik ragam (Anova) pengaruh inokulasi fungi EcM Scleroderma sp. terhadap tinggi anakan sapih merbau asal stek
[Intsia bijuga (Colebr.) O. Kuntze] ... 177
21 Analisis sidik ragam (Anova) pengaruh inokulasi fungi EcM Scleroderma sp. terhadap diameter anakan sapih asal stek
.merbau [Intsia bijuga (Colebr.) O. Kuntze] ... 177
22 Analisis sidik ragam (Anova) pengaruh inokulasi fungi EcM Scleroderma sp. terhadap berat kering pucuk anakan sapih asal stek merbau [Intsia bijuga (Colebr.) O. Kuntze]. Data
ditransformasi menggunakan √x ... 178
23 Analisis sidik ragam (Anova) pengaruh inokulasi fungi EcM Scleroderma sp. terhadap berat kering akar anakan sapih asal stek merbau [Intsia bijuga (Colebr.) O. Kuntze]. Data
ditransformasi menggunakan √x ... 178
24 Analisis sidik ragam (Anova) pengaruh inokulasi fungi EcM Scleroderma sp. terhadap jumlah tunas anakan sapih asal stek merbau [Intsia bijuga (Colebr.) O. Kuntze]. Data ditransformasi
menggunakan √x ... 178
25 Analisis sidik ragam (Anova) pengaruh inokulasi fungi EcM Scleroderma sp. terhadap jumlah daun anakan sapih asal stek
merbau [Intsia bijuga (Colebr.) O. Kuntze] ... 179
26 Analisis sidik ragam (Anova) pengaruh inokulasi fungi EcM Scleroderma sp. terhadap jumlah akar primer anakan sapih asal stek merbau [Intsia bijuga (Colebr.) O. Kuntze]. Data
ditransformasi dengan √x ... 179
27 Analisis sidik ragam (Anova) pengaruh inokulasi fungi EcM Scleroderma sp terhadap jumlah akar sekunder anakan sapih asal stek merbau [Intsia bijuga (Colebr.) O. Kuntze]. Data
ditransformasi dengan √x ... 179
28 Analisis sidik ragam (Anova) pengaruh inokulasi fungi EcM Scleroderma sp. terhadap panjang akar primer anakan sapih asal stek merbau [Intsia bijuga (Colebr.) O. Kuntze]. Data
xxxiv
29 Analisis sidik ragam (Anova) pengaruh inokulasi fungi EcM Scleroderma sp. terhadap persentase anakan sapih asal stek merbau [Intsia bijuga (Colebr.) O. Kuntze] yang terinfeksi fungi
EcM. Data ditransformasi dengan Arcsin√x ... ... 180
30 Analisis sidik ragam (Anova) pengaruh inokulasi fungi EcM Scleroderma sp. terhadap persentase kolonisasi fungi EcM pada akar anakan sapih asal stek merbau [Intsia bijuga (Colebr.) O.
PENDAHULUAN
Latar Belakang
Hutan alam Papua, dengan potensi merbaunya yang tinggi, merupakan satu-satunya hutan alam di Indonesia yang dianggap masih relatif utuh setelah hutan alam Kalimantan dieksploitasi besar-besaran pada beberapa dekade terakhir ini. Keadaan demikian menyebabkan banyak pihak beralih perhatiannya untuk mengeksploitasi hutan alam Papua. Sampai tahun 2008, sebanyak 45 ijin usaha pemanfaatan hasil hutan kayu telah diterbitkan untuk hutan alam Papua (Kementerian Kehutanan Republik Indonesia 2010). Produksi kayu merbau dari hutan alam Papua tercatat sebesar 58.546,53 m3 pada 2002, 122.411,01 m3 pada tahun 2003 dan 50.960,21 m3 pada tahun 2005. Produksi kayu ini belum termasuk laporan produksi kayu merbau ilegal yang disampaikan beberapa pihak (Tokede et al. 2006). Melihat kondisi seperti demikian, peningkatan eksploitasi hutan alam Papua dapat dipastikan akan terjadi di tahun-tahun mendatang. Sayangnya hal demikian tidak diikuti dengan perkembangan pengetahuan tentang jenis-jenis pohon lokal, termasuk merbau, yang terkandung dalam hutan alam Papua. Sampai saat ini pengetahuan tentang biologi dan silvikultur jenis-jenis lokal hutan alam Papua masih sangat terbatas
Di alam, pohon merbau terindikasi sebagai jenis yang sulit dalam permudaan alam. Benih merbau, yang ditabur di atas permukaan tanah tanpa perlakuan awal dan tanpa tindakan pembersihan tapak, meniru kondisi areal bekas tebangan yang terbuka, memperlihatkan keberhasilan berkecambah dan hidup sangat rendah, yaitu 4,75% setalah 3 bulan ditabur (Nurhasybi & Sudrajat 2009). Nilai ini belum memperhitungkan faktor kegagalan akibat hama dan patogen. Fakta ini memperlihatkan bahwa regenerasi buatan dan pengembangan hutan tanaman merbau menjadi sangat penting untuk dilakukan.
Keberhasilan upaya regenerasi pohon merbau ditentukan oleh faktor hereditas tanaman dan faktor lingkungan tempat tumbuh tanaman tersebut. Kedua faktor tersebut akan menentukan arah pertumbuhan tanaman dengan cara mempengaruhi proses fisiologisnya. Perbedaan kapasitas hereditas dapat ditunjukkan oleh tanaman tersebut oleh adanya perbedaan kemampuan dalam mentoleransi ataupun menghindari stres, dalam pola pertumbuhan tanaman dan dalam menghasilkan produk tanaman. Dilain pihak, faktor lingkungan akan menentukan sejauh mana potensi hereditas yang dimiliki tanaman tersebut dapat diekspresikan. Konsep demikian dikenal sebagai konsep Kleb (Kozlowski & Pallardy 1997). Berdasarkan konsep ini, apabila merbau diregenerasikan menggunakan bibit dengan potensi hereditas unggul, ditanam pada lingkungan yang dapat dimanipulasi untuk memperoleh pertumbuhan tanaman optimal melalui perlakuan silvikultur, maka tegakan yang terbentuk akan merupakan tegakan yang menjanjikan. Oleh karena itu, keberhasilan regenerasi dan pembangunan hutan tanaman merbau sangat ditentukan oleh ketersediaan bibit yang unggul secara genetik maupun fenotipik. Bibit yang bermutu baik merupakan jaminan bagi keberhasilan tegakan akhir yang akan dibangun.
pertumbuhan bagi tanaman bergantung pada sifat fisik, kimia dan biologi tanah yang bersangkutan.
Regenerasi dan pengembangan hutan tanaman terutama dilakukan di lahan-lahan marginal, yang pada umumnya mempunyai kondisi fisik, kimia dan biologi tanah yang telah terdegradasi. Dengan keadaan lahan seperti itu, regenerasi dan pembangunan hutan tanaman akan sulit berhasil. Untuk mengatasi kendala ini, pengelolaan biologi tanah sering dilakukan. Keberadaan organisme tanah sangat penting dalam mempengaruhi ketersediaan unsur hara dan perbaikan struktur tanah. Peningkatan aktivitas organisme tanah selalu seiiring dengan meningkatnya kesuburan dan perbaikan struktur tanah. Metode demikian sering dilakukan dengan memanfaatkan peran organisme simbiosis seperti fungi mikoriza.
Rumusan Masalah
Peran mikoriza bagi pertumbuhan tanaman telah diketahui antara lain terkait dengan peningkatan kemampuan tanaman dalam penyerapan unsur hara tanaman melalui perluasan permukaan penyerapan maupun dengan kemampuannya untuk menghasilkan enzim fosfatase sehingga unsur P dalam bentuk tidak tersedia dapat diubah menjadi bentuk tersedia (Molina & Trappe 1984; Pedersen & Sylvia 1996; Smith & Read 2008). Kolonisasi akar tanaman oleh fungi ectomikoriza (EcM) juga berfungsi menyediakan perlindungan bagi tanaman terhadap serangan fungi patogenik (Jalani & Jalal 1991; Brundrett et al. 1996). Demikian pula kemampuan fungi EcM dalam memproduksi zat pengatur tumbuh auksin terutama indole acetic acid (IAA) yang mampu membantu pengakaran stek tanaman (Slankis 1973; Gay 1992; Niemi et al. 2002). Banyaknya manfaat asosiasi tanaman dengan fungi EcM, maka sangat mungkin asosiasi ini dapat dimanfaatkan untuk regenerasi merbau yang telah diketahui memiliki ektomikoriza (Wattling et al. 2002; Smith & Read 2008).
tegakan yang dibangun. Salah satu usaha yang dapat dilakukan untuk memproduksi bibit merbau yang bermutu adalah dengan memanfaatkan peran mikoriza dalam peningkatan mutu bibit. Pemanfaatan mikoriza secara luas telah dilakukan pada banyak tanaman kehutanan. Namun demikian, sampai saat ini belum pernah dieksplorasi pemanfaatannya dalam produksi bibit merbau. Sebagai landasan dalam pemanfaatan asosiasi merbau-fungi EcM diperlukan adanya pengetahuan tentang jenis-jenis fungi yang berasosiasi dengan merbau dan karakterisasi dari EcM yang terbentuk, yang sampai saat ini informasi tersebut belum tersedia dan belum dipahami dengan baik.
Kontinyuitas penyediaan bibit tidak semata hanya bergantung pada penyediaan bibit melalui teknik regenerasi secara generatif dengan menggunakan biji, namun harus pula didukung ketersediaan teknologi regenerasi secara vegetatif seperti melalui teknik stek maupun kultur in vitro. Penyediaan bibit melalui perbanyakan vegetatif dengan teknik stek maupun kultur in vitro akan berguna saat benih tidak tersedia di pasar atau mahal harganya. Perbanyakan melalu stek merupakan metode perbanyakan yang sangat umum dilakukan pada tanaman kehutanan karena mudah dilakukan. Di lain pihak perbanyakan melalui kultur in vitro, walaupun untuk diterapkan pada tanaman berkayu lebih sulit, namun melalui cara ini penyediaan bibit dalam jumlah massal dapat dilakukan. Penguasaan perbanyakan secara vegetatif baik secara in vivo maupun in vitro berarti pula menyediakan fasilitas bagi pengembangan dalam pemuliaan tanaman merbau untuk memperoleh benih dan bibit yang secara genetis unggul.
lapangan tampaknya merbau memiliki keragaman bentuk dan ukuran biji. Telaah lebih lanjut untuk melihat keragaman biji dan hubungannya dengan kemampuan berkecambah biji merbau perlu dilakukan.
Pemecahan dormansi benih merbau selama ini dilakukan dengan memberikan perlakuan awal berupa pengikiran (Tamba 1992; PROSEA 1994) atau perendaman dalam larutan asam pekat (PROSEA 1994; Murdjoko 2003). Cara ini dipandang tidak praktis untuk produksi bibit berskala besar sehingga diperlukan pencarian alternatif lain yang lebih mudah dan aman dilakukan. Larutan sodium hipoklorit (NaOCl) sering digunakan sebagai bahan dasar larutan pemutih pakaian, tetapi dapat juga digunakan untuk pemecahan dormansi benih pada tanaman tertentu seperti padi. Larutan ini sering pula digunakan untuk eradikasi jamur pada benih yang menyebabkan penyakit londoh (Hartman et al. 2002; Schmidt 2000). Penggunaan larutan sodium hipoklorit ini apakah juga akan efektif untuk memecahkan dormansi benih pada tanaman merbau? Apabila cara ini efektif, maka ini akan sangat menguntungkan, karena relatif mudah dan aman dalam pelaksanaannya.
baik (Hartman et al. 2002). Metode aplikasi demikian belum dicoba pada tanaman merbau.
Teknologi metode regenerasi secara generatif maupun vegetatif yang tepat dan efisien, digabungkan dengan pemanfaatan peran mikoriza untuk peningkatan keragaan tanaman sangat diperlukan dalam pengembagan hutan tanaman merbau. Walaupun demikian, untuk mengembangkan teknologi tersebut masih banyak pertanyaan yang sangat relevan untuk dijawab, seperti pertanyaan berikut: Apakah terdapat keragaman biji merbau dan bila ada apakah keragaman tersebut berpengaruh terhadap perkecambahan merbau dan mutu bibit yang dihasilkan? Karakter biji apa yang berhubungan dengan imbibisi dan perkecambahan biji merbau? Adakah metode lain untuk memecahkan dormansi biji merbau yang lebih efisien sebagai alternatif metode konvensional yang selama ini digunakan? Apakah merbau dapat dikembangkan melalui stek dan teknik kultur jaringan? Jenis fungi ektomikoriza apa yang dapat dikembangkan dan digunakan untuk peningkatan mutu bibit merbau? Apakah jenis EcM tersebut dapat dikembangbiakan? Apakah spesifisitas tanaman merbau sebagai inang fungi EcM tinggi? Apakah mikoriza dapat membantu dalam pengakaran stek, sekaligus dapat meningkatkan keragaan anakan hasil stek?
Tujuan Penelitian
Sejalan dengan permasalahan yang dihadapi, maka penelitian ini secara umum bertujuan untuk mengkaji peran mikoriza dalam mendapatkan bibit merbau secara efisien dan berkualitas baik melalui teknik regenerasi generatif maupun vegetatif.
Sedangkan tujuan penelitian secara khusus adalah:
1. Mendapatkan teknik pemecahan dormansi pada benih merbau
3. Mendapatkan jenis fungi ektomikoriza yang berasosiasi dengan tanaman merbau
4. Mengkaji spesifisitas tanaman merbau sebagai inang fungi EcM
5. Mendapatkan teknik perbanyakan vegetatif melalui stek dengan memanfaatkan ZPT dan ektomikoriza
TINJAUAN PUSTAKA
Merbau [Intsia bijuga (Colebr.) O. Kuntze]
Nama Botanis dan Vernakular
Intsia bijuga (Colebr.) O. Kuntze tergolong dalam famili Fabaceae, subfamily Caesalpinioideae (Thaman et al. 2004; UNEP 2005). Di Indonesia dalam perdagangan dikenal sebagai merbau, namun secara lokal di Papua lebih banyak dikenal dengan sebutan kayu besi karena kayunya yang keras. Nama merbau ataupun kayu besi meliputi pula kerabat dekatnya Intsia palembanica Miq. Jenis ini dikenal pula dengan sebutan kwila (PNG dan daerah Pasifik), ipil dan ipil laut (Philipina), ipil, ipil tandok, ipeh, malapari, merbau ayer, merbau changkat dan merbau laut (Malaysia), praduu thale dan lumpho-thale (Thailand) (PROSEA 1994; Dinas Kehutanan Irian Jaya 1976).
Penyebaran Geografi dan Ekologi
Jenis ini memiliki daerah penyebaran secara alami meliputi Pulau Madagaskar, India, Burma, Kamboja, Malaysia, Thailand, Vietnam, Philipina, Indonesia, PNG dan Pulau-pulau Pasifik. Daerah ekologi utama di Indonesia meliputi Sumatera, Kalimantan, Sulawesi, Jawa, Maluku, NTT dan Papua (Departemen Kehutanan 2006). Di Papua, merbau dijumpai di seluruh daerah dataran rendah seperti di Holtekamp, Sekoli, Tanussa Borowai, Bahongko, dan Sentani (Jayapura), Ernia, Asmat (Merauke), Oransbari, Side, Prafi, Namber (Manokwari). Jenis ini merupakan jenis pohon dominan di hutan hujan tropis dataran rendah Papua yang umumnya tumbuh berasosiasi dengan jenis-jenis lain seperti Intsia palembanica, Pometia pinnata, Calophyllum inophyllum, dan Palaquium amboinensis (Untarto 1977).
ketinggian 0-450 m dengan curah hujan tahunan 1500-2300 mm. Pada beberapa tempat dijumpai jenis ini tumbuh hingga ketinggian 600 m dpl bercampur dengan tegakan Intsia palembanica (PROSEA 1994; Thaman et al. 2004; UNEP 2005).
Ciri Botanis
Merbau saat dewasa di daerah Pasifik umumnya memiliki tinggi bebas cabang 7-25 m dengan diameter 0,5 – 1 m (Thaman et al. 2004). Di hutan alam Papua, merbau merupakan pohon dominan, dapat mencapai ukuran raksasa, tinggi bebas cabang mencapai lebih dari 30 m dengan diameter batang dapat berukuran >200 cm (Untarto 1998). Sebaliknya di daerah semenanjung Malaysia tegakan merbau tidak pernah dijumpai dominan demikian pula ukurannya jauh lebih kecil (UNEP 2005). Secara umum merbau memiliki batang tidak tegak, tidak silindris sempurna dan memiliki akar papan dapat mencapai tinggi 2 m (Dinas Kehutanan Irian Jaya 1976)
Batang merbau halus berwarna agak merah jambu hingga coklat kemerahan dan sedikit keabuan. Kulit kayu sering terkelupas berupa sisik dengan ukuran tidak terlalu besar. Bagian kulit batang yang mati tebalnya 0,51 mm, sedangkan bagian kulit batang yang mati ketebalannya dapat mencapai 5-10 mm. Kayu gubal dan kayu teras sangat mudah dibedakan karena sangat kontras. Kayu gubal berwarna putih sedangkan kayu teras berwarna coklat merah dan saat dipotong batang mengeluarkan cairan berwana coklat kehitaman (Dinas Kehutanan Irian Jaya 1976).
ini berbunga sepanjang tahun walaupun memiliki musim berbunga puncak pada bulan tertentu yang berbeda pada setiap daerah. Buah merbau merupakan buah polong yang tebal dan kaku, panjang 10 cm dengan lebar mencapai 30 cm. Setiap polong buah berisi 2-8 biji berwarna coklat gelap, pipih bulat dengan lebar 2-4 cm dan berkulit keras (Thaman et al. 2004).
Gambar 1 Ciri morfologi merbau [Intsia bijuga (Colebr.) O. Kuntze]. (a) daun majemuk merbau; (b) bunga biseksual merbau, (c) buah polong merbau dengan (d) biji yang berkulit keras.
Penggunaan
Merbau banyak digunakan untuk bahan konstruksi umum, papan flooring dan furniture dan secara tradisional merupakan salah satu jenis kayu yang paling sering digunakan untuk bahan ukiran, tombak, anak panah, peralatan rumah tangga dan bahan bangunan rumah tradisional (PROSEA 1994; Tokede et al. 2006).
Status Konservasi
Trade in Endangered Species of Wild Flora and Fauna (CITES) sebagai jenis yang rawan (vulnerable) (CITES Appendix III); dan menurut The World Conservation Monitoring Centre (WCMC) sebagai jenis yang terancam (threatened) (UNEP 2005). Banyak pihak saat ini mengusulkan merbau untuk dimasukkan ke dalam CITES Appendix II dengan status langka (Endagered).
Ektomikoriza
Mikoriza adalah istilah yang diberikan oleh Frank (1885) yang berasal dari kata fungi dan akar untuk mengambarkan adanya hubungan simbiotik antara fungi dan akar tanaman dalam memperoleh makanan. Pada perkembangannya mikoriza selanjutnya didefinisikan sebagai asosiasi antara hifa fungi dengan akar tanaman tingkat tinggi yang berhubungan dengan penyerapan unsur hara dan substansi lainnya dari dalam tanah (Smith & Read 2008).
Terdapat tujuh tipe mikoriza yang sampai saat ini dikenal di alam, namun dari ke tujuh tipe tersebut, dua tipe mikoriza yaitu Asbucular Mycorrhiza (AM) dan ektomikoriza (EcM) yang paling dikenal (Smith & Read 2008). Asosiasi Asbucular Mycorrhiza (AM), sering disebut pula sebagai Vesicular-Asbucular Mycorrhiza (VAM) atau glomeromycotan mycorrhiza, merupakan bentuk asosiasi akar tanaman-fungi yang paling luas dan umum dijumpai (Brundrett 2004). Tipe mikoriza ini mengkolonisasi lebih dari 90% dari semua famili tanaman vaskular yang menyebar pada hampir semua gradien lingkungan (Kimmins 1987). Di lain pihak EcM merupakan bentuk asosiasi akar tanaman-fungi yang berperan penting pada banyak habitat walau bentuk hubungan ini hanya terbatas pada beberapa famili tanaman berkayu. Selanjutnya bentuk keragaman mikoriza oleh Brundrett (2004) lebih diperluas lagi didasarkan atas pemahaman seluruh spektrum variasi asosiasi yang dijumpai yaitu meliputi (1) adanya aktivitas endopitik (endopitisme); (2) Balanced mycorrhiza; (3) Exploitative mycorrhizal association.
Ciri Umum Ektomikoriza
permukaan akar sehingga akar-akar lateral tampak seperti membengkak yang sangat mudah terlihat dengan mata telanjang (Gambar 2). Hifa fungi memasuki jaringan akar hingga pada beberapa jenis dapat mencapai ruang antar sel kortek, yang selanjutnya membentuk semacam struktur jaringan yang disebut sebagai Hartig net. Akar bermikoriza berciri pendek dan dapat berbentuk dichotomous (bercabang dua) atau dalam bentuk percabangan yang lebih komplek (highly branched). Jaringan hifa yang dihasilkan fungi EcM dalam tanah juga dapat membentuk sporokarp (fruit body) untuk reproduksi (Smith & Read 2008).
Gambar 2 Ciri anatomi ektomikoriza. M = mantel (sheath), HN=Hartig net dan C=sel kortek (Brundrett et al. 1994).
tanaman Pinus dalam berasosiasi dengan fungi EcM ada yang menunjukkan asosiasi yang obligat(Smith & Read 2008).
Fungi Ektomikoriza
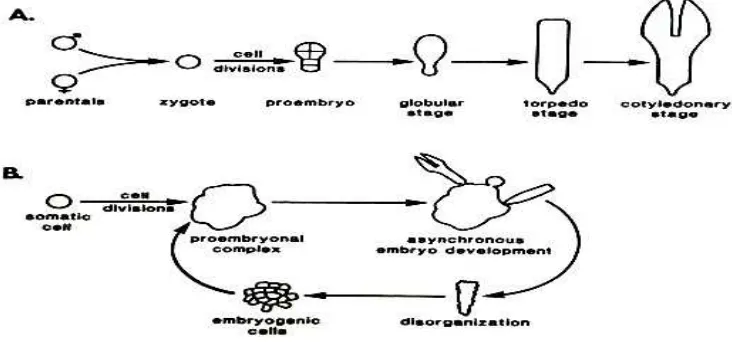
Fungi yang membentuk EcM merupakan fungi tingkat tinggi terutama dari golongan Basidiomycetes, walaupun terdapat pula beberapa dari golongan Ascomycetes. Golongan fungi ini mampu membentuk struktur badan buah (sporokarp) sebagai alat reproduksi. Fungi ektomikoriza untuk kemudahan biasanya dikategorikan menjadi (1) yang membentuk sporokarp atau tumbuh di atas tanah (epigeous) dan (2) yang membentuk sporokarp atau tumbuh di bawah tanah (hypogeous). Sebagian besar fungi ektomikoriza bercirikan epigeous (Brundrett et al. 1994; Giovani 1995). Jenis fungi Basidiomycetes yang membentuk ektomikoriza contohnya, antara lain adalah: jenis-jenis dari Russula, Lactarius, Suillus, Scleroderma, Chroogamphus, Paxillus, Laccaria, Cortinarius, Amanita, Rhizopogon, Pisolithus dan Boletus (Brundrett et al. 1994; Giovani 1995).
Acacia mangium (Mansur 2008, komunikasi pribadi). Lebih lanjut, Pisolithus dan Scleroderma merupakan jenis yang paling umum digunakan untuk menginokulasi tanaman kehutanan (Turjaman et al. 2006; Watling 2006) (Gambar 3)
Gambar 3 Beberapa jenis fungi ektomikoriza yang mudah dijumpai pada beberapa tanaman di Indonesia. Scleroderma columnare (A), Scleroderma sinamariensis (B), Scleroderma dictyosporum (C) dan Pisolithus sp.(D).
Manfaat Mikoriza
enzim fosfatase yang dihasilkan mikoriza menjadi bentuk tersedia dengan mendorong laju pelapukan (Pedersen & Sylvia 1996; Smith & Read 2008); (4) Kolonisasi fungi ektomikoriza memberikan perlindungan bagi tanaman terhadap fungi parasit dan nematoda, kemungkinan melalui perlindungan fisik oleh selubung miselium, maupun secara kimia dengan dihasilkan senyawa antibiotik ataupun inhibitor oleh fungi (Jalani & Jalal 1991; Brundrett et al. 1996). Karena peran mikoriza bagi tanaman inangnya, maka pemanfaatan fungi EcM untuk produksi bibit tanaman baik dari hasil regenerasi secara generatif maupun vegetatif telah umum diaplikasikan pada tanaman kehutanan.
Karakterisasi dan Identifikasi Fungi Ektomikoriza
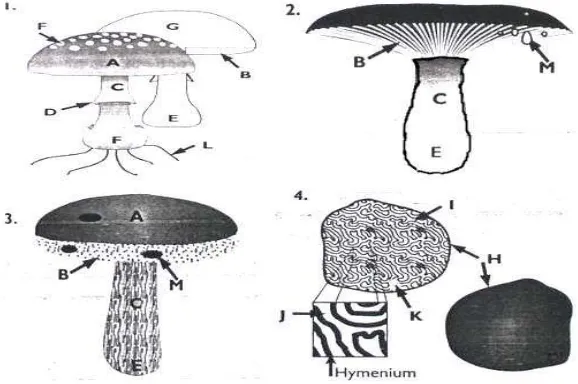
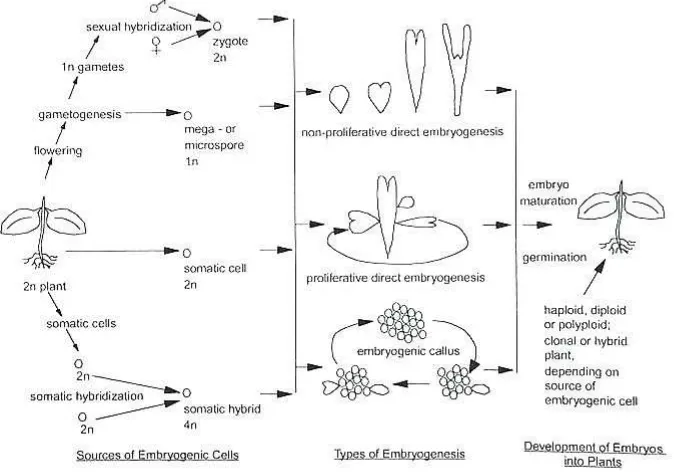
Fungi EcM pada umumnya merupakan fungi Basidiomycetes yang dicirikan dengan adanya struktur badan buah (sporokarp) sebagai alat reproduksi dan dalam pekerjaan determinasi dan identifikasi fungi ektomikoriza yang selama ini digunakan hampir sebagian besar dilakukan berdasarkan sifat morfologi dan anatomi sporokarp (Setiadi et al. 1992; Brundrett et al. 1994). Gambar struktur morfologi Basidiomycetes disajikan pada Gambar 4.
Basidiomycetes adalah fungi yang memproduksi sporanya di luar basidium dan basidia dihasilkan di dalam badan buah (basidiocarp) dengan ukuran dan kekomplekan struktur yang bervariasi. Tiga ciri utama dari basidiomycetes adalah adanya basidium, miselium yang tipikal dikaryotik dan adanya sambungan apit (clamp connection). Sambungan apit adalah struktur khusus pada hifa berukuran kecil berbentuk semi sirkular yang menghubungkan dua sel hyphae yang terbentuk saat pembelahan inti sel. Struktur ini dipercaya berfungsi untuk menjamin agar setiap sel memiliki sepasang inti yang kompatibel (Alexopoulos 1960; Wong 2005).
kehadiran sporocarp di sekitar akar tanaman dapat dijadikan indikasi adanya ektomikoriza, namun dugaan inipun belum terlalu menyakinkan untuk memastikan bahwa fungi tersebut yang mengkolonisasi perakaran tanaman. Oleh karena itu telaah morfologi dan studi histologi ujung akar bermikoriza perlu turut disertakan sebagai alat untuk identifikasi taxa fungi ektomikoriza (Wurzburger et al. 2001).
Karakterisasi morfotipe ujung akar bermikoriza secara detail meliputi parameter karakter berupa warna, bentuk akar bermikoriza, ada tidaknya rizomorp atau strands dan hifa yang berasosisasi, sklerotia (jika ada), pola dinding mantel (bagian dalam dan luar), kehadiran laticiferous hyphae dalam mantel, penampakan permukaan mantel (sistidia, hifa yang ke luar, ketebalan dinding hifa dan lapisan karang, kristal), adanya septa dan sambungan apit (clamp connection) pada hifa, bentuk dan distribusinya, tipe sambungan hifa, konfigurasi, reaksi terhadap pereaksi terseleksi, Hartig net (ketebalan, organisasi dan struktur hifa), dan habitatnya (Setiadi et al. 1992; Brundrett et al. 1996)).
Isolasi Fungi Ektomikoriza
Keberhasilan isolasi dan pembiakan fungi EcM akan menyediakan fasilitas bagi penyediaan inokulum dalam bentuk agregat miselia yang sangat berguna bagi penelitian-penelitian eksperimental untuk pemahaman biologi, fisiologi dan ekologi fungi ektomikoriza (Setiadi et al. 1992). Fungi ektomikoriza yang sebagian besar berupa fungi Basidiomycetes dapat diisolasi dengan menggunakan jaringan basidiocarp (mycelial aggregation), spora tunggal (spore print), hifa (rhizomorph), permukaan EcM (mycorrhizal root) dan sklerotia bagi fungi yang menghasilkan sklerotia seperti Cenococcum geophilum (Setiadi et al. 1992; Ainsworth 1993; Brundrett et al. 1994; Carris 2005). Walaupun keseluruhan bagian dari basidiocarp dapat digunakan karena terdiri dari agregat miselia, namun kultur terbaik dapat diperoleh dengan menggunakan bagian tudung (cap), daerah teratas dari batang (stalk) tempat gill menyambung, karena dari struktur inilah dapat diperoleh jaringan yang bebas kontaminasi (Carris 2005). Secara umum dapat dikatakan bahwa kultur akan lebih mudah dilakukan dengan sporokarp daripada struktur yang lebih kecil seperti stromata ataupun mikoriza (Ainsworth 1993).
disukai menggunakan larutan H2O2 5-10%. Pada saat dijumpai adanya
kontaminasi bakteri, isolasi sering dilakukan dengan menggunakan media mengandung bakterisida seperti novobiocin (Sigma) 0,1 g/l atau benomyl (Benlate, DuPont) 2 mg/l (Ainsworth 1993).
Media isolasi fungi ektomikoriza, seperti pada media kultur untuk mikroorganisme lain setidaknya harus memenuhi persyaratan bagi pertumbuhan optimum fungi ektomikoriza yang bersangkutan. Media kultur setidaknya mendekati kondisi persyaratan hidup alaminya sehingga seluruh kegiatan metabolisme organisme yang bersangkutan dapat berjalan baik. Secara umum Setiadi et al. (1992) memberikan persyaratan bagi media yang baik untuk pertumbuhan mikroorganisme yaitu: (1) mempunyai semua nutrisi yang mudah digunakan oleh mikroorganisme; (2) mempunyai tekanan osmosa, tegangan permukaan dan derajat kemasaman (pH) yang sesuai; (3) tidak mengandung zat-zat yang menghambat pertumbuhan mikroorganisme yang dikehendaki; (4) steril dan terlindung dari kontaminasi.
Terdapat beberapa macam media yang sering digunakan untuk isolasi Basidiomycetes seperti media Malt Extract Agar (2% MEA), Raper & Thom MEA (RTMEA), Fries Agar dan Potato Dextrose Agar (PDA), walaupun untuk fungi ektomikoriza lebih sering menggunakan media Modified Melin-Norkrans Agar (MMN) dengan beberapa variasinya (Setiadi et al. 1992; Ainsworth 1993; Brundrett et al. 1994; Carris 2005).
Cripps (2001) menggunakan media Hagem yang dimodifikasi oleh Van Corner (1987) dalam melakukan isolasi dan kultur fungi ektomikoriza. Komposisi media terdiri atas 4 g malt extract, 1 g yeast extract, 5 g d-glucose, 0,5 g NH4Cl,
0,5 g KH2PO4, 0,5 g MgSO4.7H2O, 0,5 ml FeCl3 (1% aqueous), 100 ml biotin (0,5
Kjøller dan Bruns (2003) menggunakan eksplan berupa ujung akar bermikoriza dalam mengisolasi Rhizopogon sp. Ujung akar bermikoriza yang telah disterilisasi permukaannya dengan 30% hidrogen peroksida selama 30 menit selanjutnya diinkubasi dalam media pra kondisi berupa media MMN yang mengandung 12 mg chloramphenol, streptomisin, ampicillin dan 1 mg benomyl. Disamping itu pada media MMN ini kandungan glukosa, malt extract, nitrogen dan fosfor relatif rendah yaitu dengan komposisi 1 g glukosa, 2,5 g Malt ekstract, 50 mg CaCl22H2O, 25 mg NaCl, 150 mg MgSO4.7H2O, 25 mg (NH4)2HPO4, 50
mg KH2PO4, 12 mg Ferro-citrate, 1 mg thiamin-HCl, dan 20 g agar. Media
prakondisi dimaksudkan untuk mendapatkan kultur yang bersih yang selanjutnya dapat diinkubasikan ke media MMN dengan konsentrasi penuh dengan komposisi 2,5 g glukosa, 10 g Malt ekstract, 50 mg CaCl2.2H2O, 25 mg NaCl, 150 mg
MgSO4.7H2O, 250 mg (NH4)2HPO4, 500 mg KH2PO4, 12 mg Ferro-citrate, 1 mg
thiamin-HCl, dan 20 g agar untuk pembuatan 1 L media.
Niemi et al. (2002) dalam penelitiannya melakukan perbanyakan fungi ektomikoriza Pisolithus tinctorius dan Paxillus involutus dengan menggunakan micelia asal biakan murni hasil koleksi in vitro yang ditumbuhkan pada media Melin-Norkrans (MMN) sesuai petunjuk Marx (1969) yang dimodifikasi oleh Tanskin dan Holopainen (1991) dengan komposisi 3,7 mM KH2PO4, 4,7 mM
NH4Cl, 0,45 mM CaCl2, 0,43 mM NaCl, 0,61 mM MgSO4.7H2O, 0,2 μM
thiamine-HCl, 30,8 μM FeCl3.6H2O dan 55,5 mM glukosa dengan pH 5,8 dan
dipadatkan menggunakan 1,5% agar.
Asosiasi dan Spesifisitas Ektomikoriza
terdapat fungi EcM yang tidak dapat tumbuh di alam tanpa adanya hubungan dengan tanaman inangnya (Bruns et al. 2002), Beberapa fungi EcM memiliki rentang tanaman inang yang sangat terbatas disebut sebagai memiliki spesifisitas tinggi, sedangkan lainnya memiliki rentang tanaman inang yang lebar, disebut sebagai memiliki spesifisitas rendah. Tanaman dengan spesifitas yang tinggi dengan seluruh kebutuhan C diperoleh dari fungi EcM jarang dijumpai. Kejadian seperti ini disebut sebagai epiparasit atau mycorrhizal cheater dan lebih umum dijumpai pada tanaman non-fotosintetik (Bruns et al. 2002; Smith & Read 2008).
Regenerasi Tanaman Berkayu
Regenerasi ataupun perbanyakan tanaman berkayu dapat ditempuh dengan cara (1) seksual dengan menggunakan biji baik dengan metode perbanyakan melalui biji secara konvensional maupun secara kultur in vitro, (2) aseksual dengan menggunakan biji apomistik dan vegetatif (aseksual) diantaranya seperti perbanyakan dengan cara stek (cutting) dan sambung (grafting), maupun perbanyakan secara in vitro seperti stek mikro dan embriogenesis somatik.
Perbanyakan Tanaman Melalui Biji
Perbanyakan melalui biji merupakan cara perbanyakan utama bagi tanaman di alam dalam melakukan reproduksi dan beregenerasi. Cara ini merupakan cara yang paling banyak digunakan dalam perbanyakan tanaman budidaya (Harmant et al. 2002) terutama apabila dalam perbanyakan tersebut diinginkan untuk mendapatkan keturunan yang memiliki keragaman yaitu gabungan sifat dari tetuanya yang muncul akibat adanya persilangan.
Dari sifat kemampuan penyimpanannya benih dapat dikategorikan menjadi (1) benih ortodoks yaitu benih yang toleran terhadap pengeringan (desikasi) hingga kadar air benih 5-7% tanpa kehilangan viabilitasnya. Benih seperti ini dapat disimpan dalam jangka waktu lama. (2) benih rekalsitran yaitu biji yang akan rusak bila dilakukan pengeringan, sehingga tidak penyimpanan benih tidak dapat dilakukan dalam jangka waktu lama (Schmidt 2000; Theilade & Petri 2003). Pada jenis orthodox dormansi sering terjadi sebaliknya pada jenis rekalsitran tidak memiliki masa dormansi atau lemah dan seringkali kemasakan dan perkecambahan terjadi dalam selang waktu yang singkat (Schmidt 2000).
Aktivasi proses metabolisme dari embrio yang menyebabkan munculnya anakan tanaman baru disebut sebagai perkecambahan (germination). Tiga kondisi harus dipenuhi dalam perkecambahan, yakni (1) benih harus viabel yaitu embrio harus dalam kondisi hidup dan mampu berkecambah; (2) benih harus memperoleh kondisi lingkungan yang mendukung untuk terjadinya perkecambahan, seperti ketersediaan air, rejim temperatur yang sesuai, suplai oksigen, dan terkadang cahaya yang sesuai; dan (3) Kondisi dormansi primer benih bila ada harus dapat diatasi (Harmant et al. 2002).
Benih tetap dalam kondisi tidak aktif dengan laju metabolisme dalam benih yang rendah sampai saat benih tersebut menerima kondisi lingkungan yang mendukung untuk memicu terjadinya pertumbuhan embrio. Tanggap benih terhadap kondisi lingkungan berbeda satu sama lainnya. Beberapa jenis tanaman mempunyai benih yang mampu berkecambah hanya beberapa hari setelah terjadinya fertilisasi dan jauh sebelum waktu panen, sedangkan jenis lainnya memerlukan masa perkembangan tambahan sebelum perkecambahan terjadi (Harmant et al. 2002; Copeland & McDonald 1995).
menjadi lebih sederhana dan kemudian ditranslokasikan ke titik tumbuh dari embryo axis; dan (3) Pertumbuhan kecambah. Embrio terdiri atas axis untuk keluarnya satu atau lebih daun benih atau kotiledon, sedangkan titik tumbuh akar disebut sebagai radikel yang berada pada bagian bawah dari embryo axis dan titik tumbuh tunas pucuk disebut sebagai plumula yang berada pada bagian ujung atas dari embrio (Harmant et al. 2002).
Pada tanaman yang memiliki dormansi fisik dicirikan dengan kulit biji yang keras, perkecambahan dapat dipercepat dengan perlakuan awal benih secara skarifikasi. Skarifikasi adalah suatu proses yang ditujukan untuk memecahkan, melukai, merubah sifat mekanis atau melunakkan kulit benih yang keras agar permiabel terhadap air dan gas. Skarifikasi dapat dilakukan dengan beberapa cara, antara lain (1) skarifikasi mekanis seperti melukai kulit biji dengan mengamplas atau mengikir biji, atau memecahkan kulit (2) skarifikasi basah dengan menggunakan air panas atau hangat; (3) skarifikasi menggunakan larutan masam seperti asam sulfat, (4) skarifikasi temperatur tinggi, seperti pada kejadian perkecambahan yang dipacu akibat adanya kebakaran dan skarifikasi dengan bantuan mikroorganisme pelapuk. Sejumlah bahan kimia alternatif seperti alkohol, hidrogen peroksida juga pernah dicobakan untuk mematahkan dormansi fisik (Harmant et al. 2002; Schmidt 2000).
Skarifikasi mekanis dengan cara pengikiran atau pengamplasan benih walau mudah dilakukan namun sangat tidak efisien bila benih yang akan dikecambahkan dalam jumlah banyak disamping benih yang dilukai menjadi peka terhadap patogen selama dalam proses perkecambahan. Skarifikasi dengan asam sulfat walau efisien namun sering merusak benih disamping pula penggunaan asam sulfat sering membahayakan bagi pemakai. Demikian pula penggunaan skarifikasi panas ataupun skarifikasi basah panas sering memberikan akibat terhadap benih yang mirip dengan perlakuan asam sulfat (Harmant et al. 2002; Schmidt 2000; Boscagli & Sette 2001).
kecepatan perkecambahan dan perkembangan semai lebih baik dibandingkan benih dengan ukuran yang lebih kecil. Namun demikian perlu diperhatikan bahwa perbandingan antar provenan tidak selalu dapat dipercaya, karena variasi genetik dapat menyamarkan adanya perbedaan vigor (Schmidt 2000).
Perlakuan sterilisasi permukaan benih juga sering disarankan untuk mengatasi penyakit yang umumnya berasal dari jamur yang menempel pada permukaan benih. Damping-off adalah istilah yang telah lama digunakan untuk menggambarkan penyakit fungi yang mengakibatkan matinya tanaman muda saat diperkecambahan. Fungi penyebab damping-off umumnya adalah Phytium ultimum dan Rhizoctonia solani walaupun terdapat pula fungi lain seperti Botrytis cinerea dan Phytophthora spp. Peroksida (H2O2) 30% selama 20 menit, Sodium
hipoklorit (10% NaClO) dan 75% etanol sering digunakan untuk menghilangkan jamur di permukaan benih yang dapat menyebabkan penyakit londoh ( damping-off), walaupun dijumpai pula sodium hipoklorit mampu menstimulasi perkecambahan benih padi, yang kemungkinan akibat hilangnya
![Gambar 1 Ciri morfologi merbau [Intsia bijuga (Colebr.) O. Kuntze]. (a) daun majemuk merbau; (b) bunga biseksual merbau, (c) buah polong merbau dengan (d) biji yang berkulit keras](https://thumb-ap.123doks.com/thumbv2/123dok/247229.303312/41.612.172.464.197.425/gambar-morfologi-intsia-colebr-kuntze-majemuk-biseksual-berkulit.webp)


![Tabel 2 Rangkuman Hasil-hasil Penelitian Jenis Merbau [Intsia bijuga (Colebr.) O. Kuntze] yang mendukung dalam pengembangan penelitian di bidang silvikultur](https://thumb-ap.123doks.com/thumbv2/123dok/247229.303312/68.612.103.488.158.686/rangkuman-penelitian-colebr-kuntze-mendukung-pengembangan-penelitian-silvikultur.webp)
![Gambar 8 (a) bentuk morfologi biji merbau [Intsia bijuga (Colebr.) O. Kuntze] bervariasi](https://thumb-ap.123doks.com/thumbv2/123dok/247229.303312/88.612.156.433.196.557/gambar-bentuk-morfologi-merbau-intsia-colebr-kuntze-bervariasi.webp)
![Gambar 9 Variasi bobot biji merbau [Intsia bijuga (Colebr.) O. Kuntze]. A-E = lokasi pengambilan biji, dan F merupakan variasi gabungan bobot biji dari seluruh lokasi pengambilan biji](https://thumb-ap.123doks.com/thumbv2/123dok/247229.303312/89.612.137.455.130.376/variasi-kuntze-pengambilan-merupakan-variasi-gabungan-seluruh-pengambilan.webp)