PENGARUH KONSENTRASI GULA DAN LAMA INKUBASI
TERHADAP MUTU MINUMAN PROBIOTIK SARI UBI JALAR UNGU
SKRIPSI
OLEH :
DESI LYAN SARI SIMANJUNTAK 080305005
PROGRAM STUDI ILMU DAN TEKNOLOGI PANGAN
FAKULTAS PERTANIAN
2013
PENGARUH KONSENTRASI GULA DAN LAMA INKUBASI
TERHADAP MUTU MINUMAN PROBIOTIK SARI UBI JALAR UNGU
SKRIPSI
Oleh:
DESI LYAN SARI SIMANJUNTAK 080305005/ILMU DAN TEKNOLOGI PANGAN
Skripsi sebagai salah satu syarat untuk memperoleh gelar sarjana di Fakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI ILMU DAN TEKNOLOGI PANGAN
FAKULTAS PERTANIAN
Judul Skripsi : Pengaruh Konsentrasi Gula dan Lama Inkubasi Terhadap Mutu Minuman Probiotik Sari Ubi Jalar Ungu
Nama : Desi Lyan Sari Simanjuntak
NIM : 080305005
Program Studi : Ilmu dan Teknologi Pangan
Disetujui Oleh, Komisi Pembimbing
Ir. Sentosa Ginting, MP Ir. Terip Karo-Karo, MS Ketua Anggota
Mengetahui:
Dr. Ir. Herla Rusmarilin, MP Ketua Program Studi
ABSTRAK
DESI LYAN SARI SIMANJUNTAK : Pengaruh Konsentrasi Gula dan Lama Inkubasi terhadap Mutu Minuman Probiotik Sari Ubi Jalar Ungu, dibimbing oleh Sentosa Ginting dan Terip Karo-Karo.
Penelitian ini dilakukan untuk mengetahui pengaruh konsentrasi gula manis dan lama inkubasi terhadap mutu minuman probiotik sari ubi jalar ungu. Penelitian ini dilakukan di Laboratorium Teknologi Pangan , USU, Medan, menggunakan rancangan acak lengkap faktorial 2 faktor yaitu konsentrasi gula (G1) : 2%, (G2) : 3%, (G4) : 4%, (G5) : 5% dan lama inkubasi (I1) : 4 jam, (I2) : 8
jam, (I3) : 12 jam, (I1) : 16 jam. Parameter yang dianalisa adalah Total soluble
solid( obrix), pH, Kadar protein (%), Total mikroba (CFU/g), Viskositas (dp.a), Uji organoleptik warna, aroma dan rasa.
Hasil penelitian menunjukkan bahwa konsentrasi gula memberikan pengaruh berbeda sangat nyata terhadap Total soluble solid (oBrix), pH, Kadar protein (%), Total mikroba (CFU/g), Viskositas (dp.a), Uji organoleptik warna, aroma dan rasa dan pengaruh lama inkubasi memberikan pengaruh berbeda sangat nyata terhadap Total soluble solid( obrix), pH, Kadar protein (%), Total mikroba (CFU/g), Viskositas (cp), Uji organoleptik warna, aroma dan rasa. Konsentrasi gula pada uji organoleptik rasa (G1) : 2% dan lama inkubasi pada uji organoleptik
rasa I3 : 12 jam menhasilkan rasa yang terbaik dan lebih diterima.
Kata kunci : Konsentrasi gula , Lama inkubasi , Sari Ubi Jalar Ungu.
ABSTRACT
DESI LYAN SARI SIMANJUNTAK: Effect of Sugar Concentration and Time of Incubation on the Quality of Purple Sweet Juice Probiotic Drink, supervised by Sentosa Ginting and Terip Karo-Karo.
This research was conducted to determine the effect of sweet sugar concentration and time of incubation on the quality of purple sweet potato probiotic juice. The research was perfomed at the Laboratory of Food Technology, University of Sumatera Utara Medan, using completely randomized design with two factors, i.e, the concentration of glucose (G1): 2%, (G2): 3%,
(G4): 4%, (G5): 5% and duration of incubation (I1): 4 hours, (I2): 8 hours, (I3): 12
hours, (I4): 16 hours. Parameters analyzed were total soluble solid( obrix), pH,
protein content (%), total microbial (CFU / g), viscosity (cp), organoleptic values of color, flavor and taste.
The results showed that the concentration of sugar gives had highly significant different effects on total soluble solid(obrix), pH, protein content (%), total microbial (CFU / g), viscosity (dp.a), organoleptic values of color, falvor and taste and the effect of incubation time differed significant on total soluble solid ( oBrix), pH, protein content (%), total microbial (CFU / g), viscosity (dp.a), organoleptic values of color, aroma and taste. The concentration of sugar of (G1): 2% and incubation time of I3: 12 hours resulted in the best taste and more
acceptable.
DAFTAR RIWAYAT HIDUP
DESI LYAN SARI SIMANJUNTAK dilahirkan di Perbaungan pada tanggal 04 Desember 1990 dari Bapak S.M Simanjuntak dan Ibu R. Lubis . Penulis merupakan anak kedua dari empat bersaudara.
Pada Tahun 2008 penulis lulus dari SMA Negeri 1 Perbaungan dan pada tahun yang sama masuk ke Fakultas Pertanian USU melalui jalur PMP (Pemandu Minat dan Prestasi). Penulis memilih Program Studi Ilmu dan Teknologi Pangan.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Tuhan yang Maha Esa atas segala rahmat dan karuniaNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “ Pengaruh konsentrasi gula dan lama inkubasi terhadap mutu minuman probiotik sari ubi jalar ungu”.
Pada kesempatan ini penulis menghaturkan pernyataan terima kasih sebesar-besarnya kepada kedua orang tua penulis S.M Simanjuntak dan R. Lubis yang telah membesarkan, memelihara dan mendidik penulis selama ini dan kakak Julyani Kristina Simanjuntak, adik Astri May Ledi Simanjuntak, Nova Simanjuntak dan Riski Amelia Simanjuntak yang telah memberikan doa dan dukungan kepada penulis selama ini. Penulis menyampaikan ucapan terima kasih
kepada Ir. Sentosa Ginting, MP selaku ketua komisi pembimbing dan Ir. Terip Karo-Karo, MS selaku anggota komisi pembimbing yang telah
membimbing dan memberikan berbagai masukan berharga kepada penulis dari mulai menetapkan judul, melakukan penelitian, sampai pada ujian akhir.
DAFTAR ISI
Komposisi Ubi Jalar Ungu ... 7
Manfaat Ubi Jalar Ungu ... 8
Minuman Probiotik ... 9
Faktor yang Mempengaruhi Mutu Minuman Probiotik ... 11
Bahan Tambahan yang Digunakan ... 12
Susu ... 12
Gula ... 13
Sari ubi jalar ungu... 14
Gelatin ... 14
Pembuatan Starter Yoghurt ... 15
Pembuatan Sari Ubi Jalar Ungu ... 16
Pembuatan Minuman Probiotik Ubi Jalar Ungu ... 17
Pemanasan sari ubi jalar ungu ... 17
Pencampuran susu dan gula ... 18 Waktu dan Tempat Penelitian ... 21
Bahan Penelitian ... 21
Pembuatan Sari Ubi Jalar Ungu ... 24
Pembuatan Minuman Probiotik Sari Ubi Jalar Ungu ... 24
Pengamatan dan pengukuran data ... 25
Penentuan total asam laktat (%) ... 25
Penentuantotal padatan terlarut oBrix ... 26
Penentuan pH ... 26
Penentuan kadar protein (%) ... 26
Penentuan total mikroba medote Total Plate Count (CFU/g) ... 27
Penentuan viskositas ... 28
Uji organoleptik rasa dan aroma ... 28
Uji organoleptik warna ... 29
SKEMA PENELITIAN ... 30
HASIL DAN PEMBAHASAN Pengaruh Konsentrasi Gula terhadap Parameter yang Diamati ... 33
Pengaruh Lama Inkubasi terhadap Parameter yang Diamati ... 34
Total Asam Laktat Pengaruh konsentrasi gula terhadap total asam laktat ... 36
Pengaruh lama inkubasi terhadap total asam laktat ... 37
Pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap total asam laktat ... 38
Total Padatan Terlarut Pengaruh konsentrasi gula terhadap total padatan terlarut ... 40
Pengaruh lama inkubasi terhadap total padatan terlarut ... 41
Pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap total padatan terlarut ... 43
pH
Pengaruh konsentrasi gula terhadap pH ... 45 Pengaruh lama inkubasi terhadap pH ... 46 Pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap pH .... 47 Kadar Protein
Pengaruh konsentrasi gula terhadap kadar protein ... 49 Pengaruh lama inkubasi terhadap kadar protein ... 50 Pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap kadar protein ... 52 Total Mikroba
Pengaruh konsentrasi gula terhadap total mikroba ... 54 Pengaruh lama inkubasi terhadap total mikroba ... 55 Pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap total mikroba ... 56 Viskositas
Pengaruh konsentrasi gula terhadap viskositas ... 58 Pengaruh lama inkubasi terhadap viskositas ... 59 Pengaruh interaksi antara konsentrasi gula dan lamainkubasi terhadap
viskositas ... 61 Uji Organoleptik Warna
Pengaruh konsentrasi gula terhadap organoleptik warna ... 63 Pengaruh lama inkubasi terhadap organoleptik warna ... 64 Pengaruh interaksi antara konsentrasigula dan lama inkubasi terhadap
organoleptik warna ... 65 Uji Organoleptik Aroma
Pengaruh konsentrasi gula terhadap organoleptik aroma ... 67 Pengaruh lama inkubasi terhadap organoleptik aroma ... 69 Pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap
organoleptik aroma ... 70 Uji Organoleptik Rasa
Pengaruh konsentrasi gula terhadap organoleptik rasa ... 72 Pengaruh lama inkubasi terhadap organoleptik rasa ... 73 Pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap
organoleptik rasa ... 75
KESIMPULAN DAN SARAN ... 76
DAFTAR TABEL
No. Hal
1 Komposisi kimia ubi jalar ungu (Per 100g bahan) ... 8
2 Syarat mutu yoghurt ... 11
3 Skala uji hedonik terhadap aroma dan rasa (numerik) ... 29
4 Skala uji hedonik terhadap warna (numerik) ... 29
5 Pengaruh konsentrasi gula terhadap parameter yang diamati ... 33
6 Pengaruh lama inkubasi terhadap parameter yang diamati ... 35
7 Uji LSR efek utama pengaruh konsentrasi gula terhadap total asam laktat (%) ... 36
8 Uji LSR efek utama pengaruh lama inkubasi terhadap total asam laktat (%) .. 38
9 Uji LSR efek utama pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap total asam laktat (%) ... 39
10 Uji LSR efek utama pengaruh konsnetrasi gula terhadaptotal padatan terlarutoBrix ... 41
11 Uji LSR efek utama pengaruh lama inkuabsi terhadaptotal padatan terlarut o Brix ... 42
12 Uji LSR efek utama pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadaptotal padatan terlarutoBrix ... 43
13 Uji LSR efek utama pengaruh konsentrasi gula terhadap pH ... 45
14 Uji LSR efek utama pengaruh lama inkubasi terhadap pH ... 46
15 Uji LSR efek utama pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap pH ... 48
16 Uji LSR efek utama pengaruh konsentrasi gula terhadap kadar protein (%) .... 49
17 Uji LSR efek utama pengaruh lama inkubasi terhadap kadar protein (%) ... 51
18 Uji LSR efek utama pengaruh interaksi antara konsentrasi gula dan lama
inkubasi terhadap kadar protein (%) ... 52 19 Uji LSR efek utama pengaruh konsentrasi gula terhadap total mikroba
(106 CFU/g) ... 54 20 Uji LSR efek utama pengaruh lama inkubasi terhadap total mikroba
(106 CFU/g) ... 55 21 Uji LSR efek utama pengaruh interaksi antara konsentrasi gula dan lama
inkubasi terhadap total mikroba (106CFU/g) ... 57 22 Uji LSR efek utama pengaruh konsentrasi gula terhadap viskositas (cp) ... 59 24 Uji LSR efek utama pengaruh lama inkubasi terhadap viskositas (cp) ... 60 25 Uji LSR efek utama pengaruh interaksi antara konsentrasi gula dan lama
inkubasi terhadap viskositas (cp) ... 61 26 Uji LSR efek utama pengaruh konsentrasi gula terhadap uji organoleptik
warna (numerik) ... 63 27 Uji LSR efek utama pengaruh lama inkubasi terhadap uji organoleptik warna
(numerik) ... 64 28 Uji LSR efek utama pengaruh interaksi antara konsentrasi gula dan lama
inkubasi terhadap uji organoleptik warna (numerik) ... 66 29 Uji LSR efek utama pengaruh konsentrasi gula terhadap uji organoleptik
aroma (numerik) ... 68 30 Uji LSR efek utama pengaruh lama inkubasi terhadap uji organoleptik
aroma (numerik) ... 70 31 Uji LSR efek utama pengaruh interaksi antara konsentrasi gula dan lama
inkubasi terhadap uji organoleptik aroma (numerik) ... 71 32 Uji LSR efek utama pengaruh konsentrasi gula terhadap uji organoleptik
rasa (numerik) ... 72 33 Uji LSR efek utama pengaruh lama inkubasi terhadap uji organoleptik rasa
DAFTAR GAMBAR
1 Skema pembuatan starter yoghurt ... 30
2 Skema pembuatan sari ubi jalar ungu ... 31
3 Skema pembuatan minuman probiotik sari ubi jalar ungu... 32
4 Hubungan konsentrasi gula dengan total asam laktat (%) ... 37
5 Hubungan lama inkubasi dengan total asam laktat (%) ... 38
7 Hubungan interaksi antara konsentrasi gula dan lama inkubasi terhadap total asam laktat ... 40
8 Hubungan konsentrasi gula dengan total padatan terlarut oBrix ... 41
9 Hubungan lama inkubasi dengan total padatan terlaruto Brix ... 42
10 Hubungan interaksi antara konsentrasi gula dan lama inkubasi terhadap total padatan terlarut oBrix ... 44
11 Hubungan konsentrasi gula dengan pH... 45
12 Hubungan lama inkubasi dengan pH ... 47
13 Hubungan interaksi antara konsentrasi gula dan lama inkubasi terhadap pH ... 48
14 Hubungan konsentrasi gula dengan kadar protein (%) ... 50
15 Hubungan lama inkubasi dengan kadar protein (%) ... 51
16 Hubungan interaksi antara konsentrasi gula dan lama inkubasi terhadap kadar protein (%) ... 53
17 Hubungan konsentrasi gula dengan total mikroba (106CFU/g) ... 55
18 Hubungan lama inkubasi dengan total mikroba (106CFU/g) ... 56
19 Hubungan interaksi antara konsentrasi gula dan lama inkubasi terhadap total mikroba (106CFU/g) ... 58
20 Hubungan konsentrasi gula dengan viskositas (cp) ... 59
22 Hubungan interaksi antara konsentrasi gula dan lama inkubasi terhadap
viskositas (cp) ... 62 23 Hubungan konsentrasi gula dengan uji organoleptik warna (numerik) ... 64 24 Hubungan lama inkubasi dengan uji organoleptik warna (numerik) ... 65 25 Hubungan interaksi antara konsentrasi gula dan lama inkubasi terhadap uji
organoleptik warna (numerik) ... 67 26 Hubungan konsentrasi gula dengan uji organoleptik aroma (numerik) ... 68 27 Hubungan lama inkubasi dengan uji organoleptik aroma (numerik) ... 70 28 Hubungan interaksi antara konsentrasi gula dengan lama inkubasi terhadap
uji organoleptik aroma (numerik) ... 71 29 Hubungan konsentrasi gula dengan uji organoleptik rasa (numerik)... 73 30 Hubungan lama inkubasi dengan uji organoleptik rasa (numerik) ... 74
DAFTAR LAMPIRAN
No. Hal
1 Data Pengamatan Total Asam (%) Minuman Probiotik ... 81
2 Daftar Analisis Sidik Ragam Total Asam (%) Minuman Probiotik ... 81
3 Data pengamatan Total Padatan TerlarutoBrix Minuman Probiotik ... 82
4 Daftar analisis sidik ragam Total Padatan TerlarutoBrix Minuman Probiotik .. 82
5 Data Pengamatan pH Minuman Probiotik ... 83
6 Daftar analisis Sidik Ragam pH Minuman Probiotik ... 83
7 Data Pengamatan Kadar Protein (%) Minuman Probiotik ... 84
8 Daftar Analisis Sidik Kadar Protein (%) Minuman Probiotik ... 84
9 Data Pengamatan Total Mikroba (106CFU/g) Minuman Probiotik ... 85
10 Daftar Analisis Sidik Ragam Total Mikroba (106CFU/g) Minuman Probiotik. ... 85
11 Data Pengamatan Viskositas (cp) Minuman Probiotik ... 86
12 Daftar Analisis Sidik Ragam Viskositas (cp) Minuman Probiotik ... 86
13 Data Pengamatan Uji Organoleptik Warna (numerik) ... 87
14 Daftar Analisis Sidik Ragam Uji Organoleptik Warna (numerik) ... 87
15 Data Pengamatan Uji Organoleptik Aroma (numerik) ... 88
16 Daftar Analisis Sidik Ragam Uji Organoleptik Aroma (numerik) ... 88
17 Data Pengamatan Uji Organoleptik Rasa (numerik) ... 89
18 Daftar Analisis Sidik Ragam Organoleptik Rasa (numerik) ... 89
ABSTRAK
DESI LYAN SARI SIMANJUNTAK : Pengaruh Konsentrasi Gula dan Lama Inkubasi terhadap Mutu Minuman Probiotik Sari Ubi Jalar Ungu, dibimbing oleh Sentosa Ginting dan Terip Karo-Karo.
Penelitian ini dilakukan untuk mengetahui pengaruh konsentrasi gula manis dan lama inkubasi terhadap mutu minuman probiotik sari ubi jalar ungu. Penelitian ini dilakukan di Laboratorium Teknologi Pangan , USU, Medan, menggunakan rancangan acak lengkap faktorial 2 faktor yaitu konsentrasi gula (G1) : 2%, (G2) : 3%, (G4) : 4%, (G5) : 5% dan lama inkubasi (I1) : 4 jam, (I2) : 8
jam, (I3) : 12 jam, (I1) : 16 jam. Parameter yang dianalisa adalah Total soluble
solid( obrix), pH, Kadar protein (%), Total mikroba (CFU/g), Viskositas (dp.a), Uji organoleptik warna, aroma dan rasa.
Hasil penelitian menunjukkan bahwa konsentrasi gula memberikan pengaruh berbeda sangat nyata terhadap Total soluble solid (oBrix), pH, Kadar protein (%), Total mikroba (CFU/g), Viskositas (dp.a), Uji organoleptik warna, aroma dan rasa dan pengaruh lama inkubasi memberikan pengaruh berbeda sangat nyata terhadap Total soluble solid( obrix), pH, Kadar protein (%), Total mikroba (CFU/g), Viskositas (cp), Uji organoleptik warna, aroma dan rasa. Konsentrasi gula pada uji organoleptik rasa (G1) : 2% dan lama inkubasi pada uji organoleptik
rasa I3 : 12 jam menhasilkan rasa yang terbaik dan lebih diterima.
Kata kunci : Konsentrasi gula , Lama inkubasi , Sari Ubi Jalar Ungu.
ABSTRACT
DESI LYAN SARI SIMANJUNTAK: Effect of Sugar Concentration and Time of Incubation on the Quality of Purple Sweet Juice Probiotic Drink, supervised by Sentosa Ginting and Terip Karo-Karo.
This research was conducted to determine the effect of sweet sugar concentration and time of incubation on the quality of purple sweet potato probiotic juice. The research was perfomed at the Laboratory of Food Technology, University of Sumatera Utara Medan, using completely randomized design with two factors, i.e, the concentration of glucose (G1): 2%, (G2): 3%,
(G4): 4%, (G5): 5% and duration of incubation (I1): 4 hours, (I2): 8 hours, (I3): 12
hours, (I4): 16 hours. Parameters analyzed were total soluble solid( obrix), pH,
protein content (%), total microbial (CFU / g), viscosity (cp), organoleptic values of color, flavor and taste.
The results showed that the concentration of sugar gives had highly significant different effects on total soluble solid(obrix), pH, protein content (%), total microbial (CFU / g), viscosity (dp.a), organoleptic values of color, falvor and taste and the effect of incubation time differed significant on total soluble solid ( oBrix), pH, protein content (%), total microbial (CFU / g), viscosity (dp.a), organoleptic values of color, aroma and taste. The concentration of sugar of (G1): 2% and incubation time of I3: 12 hours resulted in the best taste and more
acceptable.
PENDAHULUAN
Latar Belakang
Salah satu komoditas pertanian yang potensial dikembangkan di Indonesia adalah ubi jalar. Tanaman ini dapat tumbuh sepanjang musim di berbagai tempat dan kondisi sehingga sangat mudah untuk dibudidayakan. Tanaman ubi jalar dapat ditanam didaerah dengan curah hujan 500-5000 mm/tahun, optimalnya antara 750-1500 mm/tahun. Tanaman ubi jalar dapat beradaptasi luas terhadap
lingkungan tumbuh karena daerah penyebaran terletak pada 300oLU dan 300oLS (Juanda dan Cahyono, 2000).
Ubi jalar merupakan salah satu bahan pangan sumber karbohidrat non biji. Sebenarnya, Indonesia memiliki potensi besar dalam memproduksi ubi jalar, namun belum optimal dalam menyumbang total kebutuhan kalori, yaitu sebesar 6%. Sementara itu, beras selama ini menyumbang 64,2% dari total kebutuhan kalori. Untuk itu, perlu dilakukan serangkaian upaya untuk meningkatkan pangan nasional.
jumlah bakteri ini akan menekan pertumbuhan bakteri pembusuk yang merugikan seperti Escherichiacoli dan Streptococcus faecalis (Silalahi, 2006).
Selain itu untuk ubi jalar ungu memiliki kelebihan yaitu kandungan antosianin yang merupakan salah satu senyawa antioksidan selain betakaroten. Antosianin termasuk dalam kelompok flavonoid yang penyebarannya luas diantara spesies tanaman, merupakan pigmen berwarna yang umumnya terdapat di
bunga berwarna merah, ungu dan biru. Ubi jalar ungu mengandung antosianin berkisar ± 519 mg/100 g berat basah (Juanda dan Cahyono, 2000).
Ubi jalar ungu dapat diolah menjadi berbagai macam produk pangan, seperti keripik, aneka kue seperti donat, brownis, tepung, mie dan es krim. Pengolahan ubi jalar ungu menjadi minuman probiotik merupakan salah satu cara untuk memanfaatkan kandungan oligosakarida sebagai pemberi efek prebiotik dimana kandungan oligosakarida ini tidak dapat dicerna oleh enzim-enzim pada pencernaan manusia tetapi dapat merangsang pertumbuhan bakteri baik dalam usus besar manusia.
Penelitian tentang minuman probiotik sari ubi jalar ungu sudah pernah dilakukan sebelumnya. Dari hasil penelitian Rahmania (2011), pembuatan minuman probiotik ubi jalar ungu dengan penambahan sukrosa dan flavor anggur dengan menggunakan Lactobacillus acidophilus diperoleh hasil terbaik yaitu dari
perlakuan penambahan sukrosa 6% dengan jumlah total bakteri asam laktat 3,0633 x 108 CFU/ml, pH 4,48, total asam 0,8827%, serat kasar 0,2060%, total
gula 4,0267%, dan aktivitas antioksidan 78,9424%.
Penelitian lain, Handayani (2011), pembuatan minuman probiotik ubi jalar ungu dengan perlakuan lama pengukusan ubi jalar dan lama fermentasi media menggunakan Lactobacillus plantarum B2, diperoleh hasil rerata total bakteri asam laktat berkisar antara 2,2 x 108 CFU/ml – 4,3 x 109CFU/ml, rerata total antosianin berkisar antara 1,15 mg/L – 16,49 mg/L. Kadar total antosianin terendah pada media dengan perlakuan ubi jalar tanpa pengukusan dan fermentasi selama 24 dan 48 jam. Kadar total antosianin tertinggi pada perlakuan ubi jalar kukus 20 menit dengan lama fermentasi media selama 48 jam. Rerata total gula berkisar antara 0,03% - 0,23%, rerata total asam tertitrasi berkisar antara 1,76% - 3,30% dengan pH antara 3,0 – 3,2, rerata total padatan terlarut berkisar antara 3,4oBrix – 5,5oBrix dan rerata nilai L berkisar antara 27,5 – 29,9, nilai a* berkisar antara 15,4 – 32,0, nilai b* berkisar antara 4,3 – 12,8.
Untuk menambah nilai guna, penambahan nilai ekonomis serta pengembangan produk ubi jalar ungu, maka dilakukan penelitian “Pengaruh Konsentrasi Gula dan Lama Inkubasi Terhadap Mutu Minuman Probiotik
Sari Ubi jalar Ungu”.
Untuk mengetahui pengaruh konsentrasi gula dan lama inkubasi terhadap mutu minuman probiotik sari ubi jalar ungu.
Kegunaan Penelitian
Sebagai sumber data dalam penyusunan skripsi di Program Studi Ilmu dan Teknologi Pangan, Fakultas Pertanian, Universitas Sumatera Utara, Medan serta sebagai informasi ilmiah bagi masyarakat dalam pembuatan minuman probiotik sari ubi jalar ungu.
Hipotesa Penelitian
TINJAUAN PUSTAKA
Sekilas Tentang Ubi jalar
Tanaman ubi jalar dalam sisitematika (taksonomi) tumbuhan diklasifikasikan sebagai berikut :
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotyledonae Ordo : Convolvulales Famili : Convoloulaceae Genus : Ipomoea
Spesies : Ipomoea batatas L. Sin batatas eduluis choisy
(Juanda dan Cahyono, 2000).
Ubi jalar yang nama latinnya Ipomoea batatas adalah merupakan tanaman yang menjalar. Tanaman ini termasuk keluarga Convoloulaceae dan satu keluarga dengan tanaman kangkung. Ubi jalar merupakan jenis tanaman tropis. Untuk setiap daerah memiliki nama sesuai dengan bahasa daerah setempat. Misalnya telo rambat, telo elung, ubi jendral dan sebagainya (Suparman, 2010).
bertipe tegak antara 1-2 meter sedangkan pada tipe merambat (menjalar) antara 2-3 meter (Rukmana, 1997).
Sifat ubi jalar jika digunakan dalam pembuatan produk lain, hampir sama sifatnya dengan kentang biasa, tetapi kandungan vitamin ubi jalar dan karbohidratnya lebih tinggi dari kentang. Ubi jalar telah dikembangkan dalam bahan baku produk seperti cornflake ubi jalar sama dengan cornflake yang terbuat dari gandum (Lapedes, 1977).
Kelebihan yang dimiliki ubi jalar terutama yang berwarna ungu dibanding jenis umbi-umbian lainnya yaitu kandungan vitamin A yang sangat tinggi. Melihat potensinya semakin besar dalam menyumbang zat gizi, maka produk olahan pangan dari ubi jalar ungu perlu diintensifkan
(Susanto dan Saneto, 1994).
Ubi Jalar Ungu
Ubi jalar adalah sumber vitamin C yang baik dan vitamin B. Ubi berdaging jingga adalah sumber betakaroten yang amat baik, yang kandungannya lebih tinggi dibandingkan dengan yang berdaging kuning. Ubi jalar mentah mengandung penghambat tripsin yang mengurangi ketercernaan protein. Namun karena dimakan setelah dimasak, penghambat tersebut sudah tidak ada
(Rubatzky dan Yamaguchi, 1998).
(Juanda dan Cahyono, 2000).
Komposisi Kimia Ubi Jalar Ungu
Ubi jalar banyak mengandung pro vitamin A, vitamin B dan vitamin C. selain itu juga terdapat banyak kandungan karbohidrat dan lemak serta sedikit protein, yang sangat berguna untuk penghasil energi dan kesehatan tubuh kita. Kelebihan dari ubi jalar yang berwarna yaitu mengandung antioksidan yang kuat untuk menetralisir keganasan radikal bebas penyebab penuaan dini dan pencetus aneka penyakit degeneratif seperti kanker dan jantung. Zat gizi lain yang banyak terdapat dalam ubi jalar adalah energi, vitamin C, vitamin B6 (piridoksin) yang
berperan penting dalam kekebalan tubuh. (Suparman, 2010).
Selain mengandung antioksidan, ubi jalar juga mengandung oligosakarida, yang merupakan komponen non gizi yang tidak tercerna tetapi bermanfaat bagi pertumbuhan bakteri probiotik sehingga ubi jalar dapat berfungsi sebagai
prebiotik. Oleh karena itu penambahan ubi jalar dalam yoghurt juga
mempengaruhi kehidupan mikroba kultur yoghurt yang digunakan dan proses fermentasi yoghurt (Apraidji, 2006).
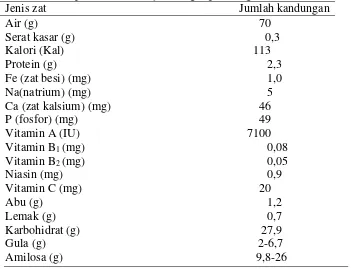
Tabel . 1 Komposisi kimia ubi jalar ungu (per 100g bahan).
Jenis zat Jumlah kandungan
Air (g) Sumber : (Juanda dan Cahyono, 2000).
Ubi jalar ungu biasa disebut Ipomoea batatas blackie karena memiliki kulit dan daging umbi yang berwarna ungu kehitaman (ungu pekat). Ubi jalar ungu mengandung pigmen antosianin yang lebih tinggi dari pada ubi jalar jenis lain. Pigmennya lebih stabil bila dibandingkan antosianin dari sumber lain seperti kubis merah, elderberries, blueberries dan jagung merah. Kandungan nutrisi ubi jalar ungu lebih tinggi bila dibandingkan ubi jalar varietas lain, terutama kandungan lisin, Cu, Mg, K, Zn rata-rata 20% (Yusuwah, 2011).
Manfaat Ubi Jalar Ungu
aktif yaitu selenium dan iodine yang 20 kali lebih tinggi dari jenis ubi lainnya. Ubi jalar ungu memiliki aktivitas antioksidan dan anti bakteri 2,5 dan 3,2 kali lebih tinggi dari pada beberapa varietas blueberry Ubi jalar ungu juga baik untuk mendorong kelancaran peredaran darah (Masudi, 2010).
Kandungan mineralnya dalam ubi jalar seperti fosfor, kalsium, mangan, zat besi dan serat yang larut untuk menyerap kelebihan lemak/kolesterol dalam darah. Selain itu untuk ubi jalar ungu memiliki kelebihan yaitu kandungan antosianin yang merupakan salah satu senyawa antioksidan selain betakaroten (Apriliyanti, 2010).
Minuman Probiotik
Probiotik yang berasal dari kata probios yang berarti kehidupan adalah pangan yang mengandung mikroorganisme hidup yang secara aktif meningkatkan kesehatan dengan cara memperbaiki keseimbangan flora usus jika dikonsumsi dalam keadaan hidup dalam jumlah yang memadai. Probiotik yang efektif sebaiknya memenuhi beberapa kriteria sebagai berikut: tidak patogenik dan tidak toksik, mengandung sejumlah besar sel hidup, mampu bertahan dan melakukan kegiatan metabolisme dalam usus, tetap hidup selama penyimpanan dan waktu digunakan, mempunyai sifat sensori yang tinggi (Dania, dkk., 2006).
yang menguntungkan bagi konsumen ditinjau dari aspek nutrisi dan kesehatan juga menambah jenis yoghurt, terutama dalam hal penggunaan kultur starter (Hidayat, dkk., 2006).
Dalam pembuatan minuman probiotik dengan bahan baku susu, komponen susu yang paling berperan adalah laktosa dan kasein. Laktosa merupakan karbohidrat utama dalam susu yang digunakan oleh kultur starter Lactobacillus bulgaricus dan Strptococcus thermophillus sebagai sumber energi dan karbon selama pertumbuhan biakan. Laktosa dihidrolisis menjadi asam laktat oleh enzim
laktat dehidrogenase yang dihasilkan oleh kedua bakteri tersebut. Asam laktat yang dihasilkan menyebabkan pH susu menurun. Jika pH susu menjadi sekitar 4,6, kasein susu akan terkoagulasi (menggumpal). Selain berperan dalam pembentukan gel, asam laktat juga memberikan ketajaman rasa, rasa asam dan menimbulkan aroma khas pada minuman probiotik seperti yoghurt
(Koswara, 1992).
Fermentasi susu menjadi yoghurt dilakukan dengan bantuan bakteri asam
laktat yaitu Lactobacilus bulgaricus dan Streptococcus thermophilus. L. bulgaricus adalah bakteri gram positif berbentuk batang dan tidak membentuk
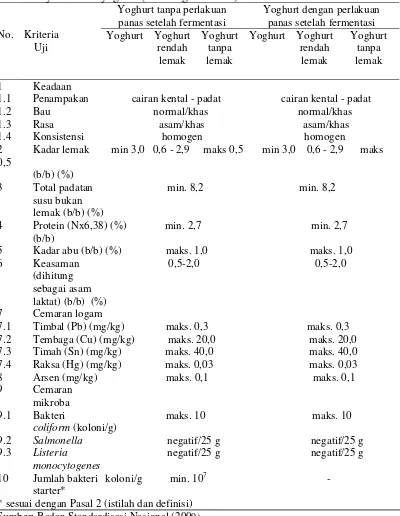
Tabel 2. Syarat mutu yoghurt (SNI Yoghurt 2981)
* sesuai dengan Pasal 2 (istilah dan definisi) Sumber: Badan Standardisasi Nasional (2009)
Faktor yang Mempengaruhi Mutu Minuman Probiotik
selama penyimpanan. Temperatur sebagai suhu inkubasi berpengaruh terhadap warna, tekstur yoghurt sedangkan pada rasa tidak berpengaruh. Bahan dasar yoghurt berpengaruh terhadap warna, tekstur, rasa yoghurt. Ada interaksi yang nyata antara temperatur dan jenis susu yang digunakan dan hasil yang paling baik diperoleh pada temperatur 44°C (Ginting dan Pasaribu, 2005).
Bahan Tambahan yang Digunakan
Susu
Susu adalah suatu sekresi yang komposisinya sangat berbeda dari komposisi darah yang merupakan asal susu. Misalnya lemak susu, kasein, laktosa yang disintesa oleh alveoli dalam ambing, tidak terdapat di tempat lain mana pun dalam tubuh sapi. pH susu segar berada di antara pH 6,6-6,7 dan bila terjadi cukup banyak pengasaman oleh aktivitas bakteri, angka-angka ini akan menurun secara nyata (Buckle, dkk., 1985).
Gula
Gula adalah suatu istilah umum yang sering diartikan bagi setiap karbohidrat yang digunakan sebagai pemanis, tetapi dalam industri pangan biasanya digunakan untuk menyatakan sukrosa, gula yang diperoleh dari bit atau tebu. Penambahan gula pada produk bukan saja untuk menghasilkan rasa manis meskipun sifat ini sangatlah penting. Jadi, gula bersifat untuk menyempurnakan rasa asam, cita rasa, juga memberikan kekentalan. (Buckle, dkk., 1985).
Sukrosa atau sakarosa dinamakan juga gula tebu atau gula bit. Secara komersial gula pasir yang 99 % terdiri atas sukrosa dibuat dari kedua macam bahan makanan tersebut melalui proses penyulingan dan kristalisasi. Bila dicernakan atau dihidrolisis, sukrosa pecah menjadi satu unit glukosa dan satu unit fruktosa (Almatsier, 2004).
Gula disamping sebagai sumber rasa (manis) juga merupakan sebagai sumber energi yang baik untuk mikroorganisme. Semakin besar jumlah gula ditambahkan maka substrat yang tersedia bagi mikroba semakin banyak dan pertumbuhannya semakin banyak dan cepat sehingga aktivitas mendegradasi laktosa dan bahan organik lainnya menjadi asam organik semakin tinggi pula (Scribd, 2011).
Sari ubi jalar ungu
Ubi jalar ungu biasa disebut Ipomoea batatas blackie karena memiliki kulit dan daging, umbi yang berwarna ungu mengandung pigmen antosianin yang lebih tinggi daripada ubi jalar jenis lain. Pigmennya lebih stabil bila dibandingkan antosianin dari sumber lain seperti kubis merah, elderberries, blueberries, dan jagung. Kandungan antosianin yang tinggi pada ubi jalar ungu serta mempunyai stabilitas yang tinggi dibanding antosianin dari sumber lain, membuat tanaman ini sebagai pilihan yang lebih sehat dan sebagai alternatif pewarna alami. Beberapa industri pewarna dan minuman berkarbonat menggunakan ubi ungu sebagai bahan mentah penghasil antosianin. Begitu juga industri ice cream, minuman beralkohol,
pie dan roti. Ubi jalar ungu juga telah dikembangkan dalam bentuk produk es krim, sirup dan anggur asam (Masudi, 2010).
Gelatin
Gelatin dapat diperoleh dari kolagen yang dapat dijumpai pada kulit dan tulang belulang dan kasein tulang. Gelatin umumnya tidak larut dalam air dingin, tetapi kelarutannya naik pada suhu di atas 45oC, kecuali bubuk gelatin yang diperoleh dengan spray drying. Gel gelatin melebur pada suhu 25-28oC tergantung pada kandungan padatan dalam larutan. Gelatin digunakan luas dalam industri pangan untuk pembuatan kristal jeli, pudding yang dibungkus, es krim, sosis dan dalam pengalengan makanan. Gelatin juga dapat digunakan dalam penjernihan minuman hasil fermentasi (Cahyadi, 2009).
umumnya diproduksi dari kulit dan tulang sapi atau babi. Gelatin digunakan pada industri makanan, farmasi, obat-obatan, dan industri lainnya. Penggunaan di bidang pangan diantaranya untuk produk permen, coklat, hasil olah susu, es krim dan produk daging. Gelatin juga digunakan dalam produk kosmetik, tablet, kapsul, perekat (lem), pelapis kertas dan pembuatan film untuk fotografi. Dalam produk-produk pangan gelatin terutama karena kemampuannya sebagai penstabil dan pengemulsi produk-produk pangan. Sebagai pengemulsi artinya gelatin dapat membuat atau mencampur minyak dan air menjadi campuran yang merata. Sebagai penstabil, artinya campuran tersebut stabil atau tidak pecah selama penyimpanan (Ayo Bertani, 2009).
Gelatin disebut miracle food. Hal ini disebabkan karena gelatin memiliki fungsi yang masih sulit digantikan dalam industri pangan maupun obat-obatan. Salah satu keunggulan yang paling terkenal adalah bisa memiliki sifat melting in the mouth. Ini sifat yang paling disukai oleh hampir semua pengusaha industri pangan (Halalguide, 2010).
Pembuatan Starter Yoghurt
Kultur yoghurt mempunyai peranan yang penting dalam proses asidifikasi dan fermentasi susu. Kualitas hasil akhir yoghurt sangat dipengaruhi oleh komposisi dan preparasi kultur starter. Komposisi starter harus terdiri dari bakteri
thermofilik dan mesofilik. Yang umum digunakan adalah Lactobacillus Bulgaricus dengan suhu optimum 42-45oC dan Streptococcus thermophillus
Tahap pemanasan pada pembuatan yoghurt akan membunuh organisme pencemar, menurunkan potensi redoks campuran tersebut dan menghasilkan faktor-faktor dan kondisi yang menguntungkan untuk perkembangan bakteri yang dimasukkan sebagai inokular. Pemanasan juga menyebabkan denaturasi sifat protein whey dan perubahan menjadi kasein yang memberi konsistensi yang lebih baik dan lebih seragam pada produk akhir (Buckle, dkk., 1985).
Untuk pembuatan yoghurt maupun soyghurt maka harus ditambahkan sumber gula terlebih dahulu ke dalam susu sebelum diinokulasi. Sumber-sumber gula yang dapat ditambahkan adalah sukrosa (gula pasir), glukosa, laktosa, fruktosa atau dengan penambahan susu skim sebagai sumber laktosa sebanyak 4% (Koswara, 1992).
Pada persiapan biakan untuk produk susu, terlebih dahulu dipilih dan dipersiapkan starter yang spesifik. Umumnya susu dipasteurusasi kemudian starter ditambahkan dalam susu sesuai dengan waktu inokulasi dan waktu yang dibutuhkan untuk pertumbuhan bakteri dalam susu yang difermentasi. Kemudian susu diaduk dan setelah dingin lalu dibiarkan dalam inokulasi maka bakteri akan tumbuh (Mehas and Rodgers, 1997).
Pembuatan Sari Ubi Jalar Ungu
Adapun proses pembuatan sari ubi jalar ungu yaitu :
terdapat dalam bahan baku dan untuk memberikan lingkungan yang steril dan kondusif untuk pertumbuhan kultur starter (Hidayat, dkk, 2006). Penyaringan dilakukan menggunakan kain saring untuk memisahkan ampas dengan sarinya. Sari yang sudah didapatkan diendapkan menggunakan sentrifugator yang dapat memisahkan pati, supaya tidak merusak kualitas minuman probiotik yang dihasilkan, sehingga didapatkan filtrat/ sari yang jernih (Wordpress, 2009).
Pembuatan Minuman Probiotik Sari Ubi Jalar Ungu
Pemanasan sari ubi jalar ungu
Sari ubi jalar ungu yang dihasilkan melalui proses pengendapan dipanaskan pada suhu sekitar 70oC selama 30 menit. Suhu jangan terlalu tinggi agar antosianin yang ada pada ubi jalar tidak banyak yang rusak akibat adanya pemanasan (Dania, 2006).
Jumlah panas yang diberikan dalam proses pengolahan pangan tidak boleh lebih dari jumlah minimal panas yang dibutuhkan untuk membunuh mikroba yang dimaksud. Dalam proses pemanasan ada hubungan antara panas dan waktu, yaitu jika suhu yang digunakan rendah maka waktu pemanasan harus lebih lama, sedangkan jika suhu tinggi maka waktu pemanasan singkat (Winarno, dkk., 1984).
Penambahan gelatin
yang tinggi dapat memberikan tekstur yang sangat disukai, dan sebagai pelarut yang sangat efektif (Phlips and Williams, 2000).
Pencampuran susu dan gula
Pada proses ini ditambahkan bahan tambahan seperti susu skim ke dalam sari ubi jalar oranye sebagai tambahan nutrisi bagi Bifidobacterium bifidum dan untuk menambah total padatan, membentuk tekstur yang bagus, membentuk aroma dan cita rasa, serta memperbaiki kualitas akhir produk probiotik yang dihasilkan. Pencampuran bertujuan agar bahan-bahan dapat larut dengan baik dan tidak menggumpal sehingga dapat memperbaiki kualitas akhir dan kenampakan produk (Wordpress, 2009).
Homogenisasi campuran bahan-bahan setelah pasteurisasi sangat diperlukan untuk mendapatkan campuran yang betul-betul homogen sehingga tidak dapat terjadi pemisahan cream selama inkubasi dan penyimpanan. Juga untuk memperoleh konsistensi yang stabil. Homogenisasi juga dapat meningkatkan partikel-partikel kasein sehingga dapat memperbaiki konsistensi gel selama proses koagulasi (Hidayat, dkk., 2006).
Pendinginan
Pendinginan dilakukan pada suhu ruang sampai suhu produk mencapai ±40°C agar sesuai untuk pertumbuhan Bifidobacterium bifidum. Pendinginan dapat dilakukan dengan cara meletakkan wadah berisi bahan ke dalam air dingin untuk mempercepat proses pendinginan atau dapat dilakukan dengan memperluas permukaan wadah bahan (Wordpress, 2009).
Pada pembuatan minuman probiotik, tambahkan starter atau bibit
Lactobacillus casei sebanyak 2 % (2 ml bibit per 100 ml prebiotik. Tarik udara yang ada dengan spet atau suntikan untuk membuat suasana anaerob (tanpa udara) agar bakteri probiotik tumbuh dengan baik (Dania, 2006).
Pada proses pembuatan yoghurt, pencampuran starter Lactobacillus bulgaricus dan Streptococcus thermpphillus biasanya ditambahkan dalam susu yang telah dipasteurisasi. Lactobaciluus acidophilus atau yang lain dapat juga ditambahkan sebagai starter (Bennion andScheule, 2004).
Inkubasi
Inkubasi dapat dilakukan pada suhu 37oC selama 3 hari. Jika tidak ada alat untuk suhu tersebut maka dapat dilakukan pada suhu kamar. Jika bibit yang digunakan adalah yoghurt yang dijual di toko maka inkubasi pada suhu 40oC selama 3-5 jam atau selama 1 hari pada suhu kamar (Hidayat, dkk., 2006).
Proses fermentasi merupakan kunci keberhasilan dari produksi yoghurt karena karakteristik produk akhir terbentuk selama proses fermentasi berlangsung. Pada umumnya fermentasi dilakukan pada suhu 40-45oC selama 2,5-3 jam, namun suhu dan waktu fermentasi bisa berubah tergantung pada jenis bakteri pada kultur starter yang digunakan (Dania, 2006).
bakteri-bakteri starter. Senyawa-senyawa tersebut akan memberikan cita rasa spesifik pada yoghurt (Luthana, 2008)
Penelitian Sebelumnya
Menurut penelitian dari Sylvia Wati Theresia Hutabarat (2006), lama penyimpanan memberi pengaruh sangat nyata terhadap kadar vitamin C, total asam, kadar protein, waktu viabilitas dan nilai organoleptik. Semakin lama penyimpanan maka kadar vitamin C, kadar protein dan nilai organoleptik akan semakin menurun, sedangkan total asam dan viabilitas akan semakin meningkat (Hutabarat, 2006).
Hasil penelitian yang telah dilakukan oleh Estu (2005), tentang pembuatan minuman kesehatan ubi jalar ungu dengan starter yoghurt (Lactobacillus Bulgaricus dan Streptococcus Thermophillus) menunjukkan bahwa perlakuan terbaik terdapat pada perlakuan konsentrasi susu skim 12% dan lama fermentasi 12 jam dengan karakteristik total asam 0,6077% pH 4,875, total gula 17,7033%, antosianin 101,863 mg/1000ml, total bakteri asam laktat (BAL) 8,789 log CFU/ml, warna merah 14,133. Sedangkan pada penelitian ini dilakukan pembuatan minuman probiotik sinbiotik ubi jalar ungu menggunakan starter
BAHAN DAN METODA
Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Desember 2012 sampai Januari 2013 di laboratorium Teknologi Pangan Program Studi Ilmu dan Teknologi Pangan Fakultas Pertanian Universitas Sumatera Utara, Medan.
Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah Ubi jalar ungu, Susu
full cream, gelatin, gula pasir, starter biokul plain yoghurt.
Bahan Kimia
Bahan kimia yang digunakan dalam penelitian ini adalah Akuades, NaOH 0,01N, indikator phenolpthalein 1%, PCA (plate count agar), K2SO4 :
CuSO4 (1:1), H2SO4 pekat, H2SO4 0,02 N, NaOH 40%, indikator mengsel.
Alat Penelitian
Metoda Penelitian
Penelitian ini menggunakan metoda Rancang Acak Lengkap (RAL) faktorial yang terdiri dari 2 faktor, yaitu:
Faktor I : Konsentrasi Gula (G) yang terdiri dari 4 taraf, yaitu: G1 = 2%
G2 = 3%
G3 = 4 %
G4 = 5%
Faktor II : Lama Inkubasi (I) yang terdiri dari 4 taraf, yaitu: I1 = 4 jam
I2 = 8 jam
I3 = 12 jam
I4 = 16 jam
Banyaknya kombinasi perlakuan (Tc) adalah 4 x 4 = 16, maka jumlah ulangan (n) adalah sebagai berikut:
Tc (n-1) ≥ 15 16 (n-1) ≥ 15 16n - 16 ≥ 15 16n ≥ 31
Model Rancangan (Bangun, 1991)
Penelitian ini dilakukan dengan Rancangan Acak Lengkap (RAL) faktorial dengan model :
Ŷijk = µ + αi + βj + (αβ)ij + εijk
Ŷijk : Hasil Pengamatan dari faktor G dari taraf ke-i dan Faktor I
pada taraf ke–j dengan ulangan k µ : Efek nilai tengah
αi : Efek dari Faktor G pada taraf ke–i βj : Efek dari Faktor I pada Taraf ke–j
(αβ)ij : Efek interaksi faktor G pada taraf ke–i dan faktor I pada
taraf ke–j
εijk : Efek galat dari faktor G pada taraf ke–i dan faktor I pada
taraf ke–j dalam ulangan ke-k.
Pelaksanaan Penelitian
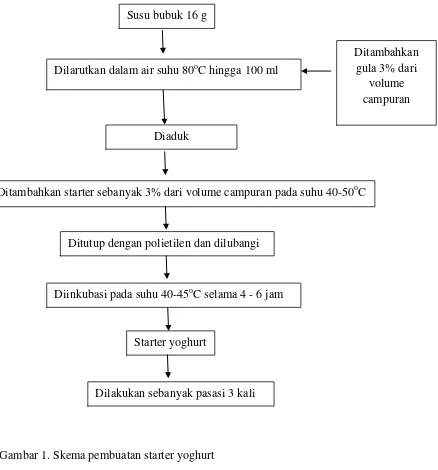
Pembuatan Starter
Ditimbang susu 16 g, ditambahkan air matang hingga 100 ml. Ditambahkan gula pasir sebanyak 3% dari volume campuran. Dipanaskan susu hingga suhu 80oC sambil diaduk. Diangkat dan didinginkan hingga suhu mencapai 40-50oC. Ditambahkan yoghurt plain yoghurt yang mengandung bakteri
45oC selama 4 - 6 jam. Dilakukan sebanyak pasasi 3 kali. Disimpan di dalam lemari pendingin, skema pembuatan starter yoghurt disajikan pada Gambar 1.
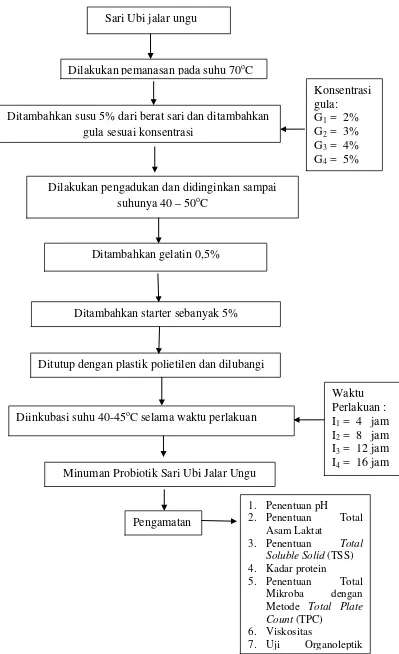
Pembuatan Sari Ubi Jalar Ungu
Dipilih ubi jalar ungu yang sudah tua dan belum bertunas, kemudian dikupas kulitnya dan dicuci bersih. Ubi jalar ungu yang telah bersih dipotong kecil-kecil kemudian dihancurkan dengan menggunakan blender dengan perbandingan ubi jalar ungu dan air matang 1 : 2. Dipanaskan campuran ubi jalar ungu dan air yang telah diblender pada suhu 70oC selama 30 menit dan sambil diaduk. Kemudian didinginkan dan disaring untuk mendapatkan sarinya, lalu diendapkan selama 1 malam untuk memisahkan sari dan pati yang tersisa, skema pembuatan sari ubi jalar ungu disajikan pada Gambar 2.
Pembuatan Minuman Probiotik Sari Ubi Jalar Ungu
Pengamatan dan Pengukuran Data
Pengamatan dan pengukuran data dilakukan dengan cara analisis terhadap parameter sebagai berikut :
1. Penentuan total asam laktat 2. Penentuan total padatan terlarut 3. Penentuan pH
4. Kadar protein
5. Penentuan total mikroba dengan metode total plate count (TPC) 6. Penentuan viskositas
7. Uji Organoleptik Rasa, Aroma dan Aroma
1. Penentuan total asam laktat (%) (Ranganna, 1978)
Ditimbang contoh sebanyak 10 g, dimasukkan ke dalam beaker glass dan ditambahkan akuades sampai volume 100 ml. Diaduk hingga merata dan disaring dengan kertas saring. Diambil filtratnya sebanyak 10 ml dan dimasukkan ke dalam erlenmeyer lalu ditambahkan phenolphtalein 2-3 tetes kemudian dititrasi dengan menggunakan NaOH 0,01 N. Titrasi dihentikan setelah timbul warna merah jambu yang stabil.
Dihitung total asam dengan rumus :
Total Asam Laktat (%) =mlNaOHxNNaOHxBMasamlaktatxFP
BeratContoh (g)x1000x Valensi x 100%
Keterangan :
2. Penentuan total padatan terlarutoBrix (AOAC, 1978)
Diambil bahan 2 g dan ditambahkan akuades sampai volume 6 ml. Hand refractometer terlebih dahulu distandarisasi dengan menggunakan akuades. Diambil sari yang sudah diencerkan dengan pipet tetes dan kemudian diteteskan pada prisma hand refractometer. Diamati pembacaan skala dan dicatat nilainya. Kadar TSS-nya yaitu angka pada skala dikalikan dengan 3.
3. Penentuan pH (Apriyantono et al., 1989)
Penetapan pH menggunakan pH meter yang telah dilakukan kalibrasi dengan larutan buffer pada pH 4 dan 7. Suhu sampel diukur menggunakan pengatur suhu pH meter pada suhu terukur. Kemudian pH meter dinyalakan dan dibiarkan sampai stabil (15 – 30 menit). Elektroda pada pH meter dibilas dengan akuades dan dikeringkan elektroda dengan kertas tissu. Setelah itu elektroda dicelupkan ke dalam larutan sampel dan di-set pengukur pH-nya. Elektroda dibiarkan tercelup di dalam larutan selama beberapa saat sampai diperoleh pembacaan yang stabil. Kemudian pH sampel dicatat.
4. Penentuan kadar protein (%) (Metode Kjeldahl, AOAC, 1978)
Sampel sebanyak 0,2 g yang telah dihaluskan dimasukkan dalam labu kjeldahl, ditambahkan K2SO4 : CuSO4 (1:1) sebanyak 2 g selanjutnya
ditambahkan dengan 3 ml H2SO4 pekat. Sampel didihkan 1-1,5 jam atau sampai
cairan berwarna jernih. Labu beserta isinya didinginkan lalu isinya dipindahkan ke dalam erlenmeyer 500 ml dan ditambahkan 15 ml akuades lalu dipasang pada alat destilasi dan ditambahkan NaOH 40% hingga warna menjadi hitam. Erlenmeyer berisi 25 ml H2SO4 0,02 N diletakkan di bawah kondensor yang sebelumnya
alkohol dengan perbandingan 2:1) kemudian diangkat jika volume mencapai 125 ml. Dititrasi penampung tersebut dengan NaOH 0,02 N sampai terjadi perubahan warna dari biru keunguan menjadi hijau kebiruan. Penetapan blanko dengan cara yang sama. Kemudian dihitung kadar protein dengan rumus :
Kadar protein
=
(b−a)xNNaOHx0,014xFaktorKonversix100%Beratsampel
Keterangan :
a : ml NaOH untuk sampel b : ml NaOH untuk blanko faktor konversi = 6,25
5. Penentuan mikroba metoda total plate count CFU/g (Fardiaz, 1992)
Bahan diambil sebanyak 1 ml dan dimasukkan ke dalam tabung reaksi kemudian ditambahkan akuades 9 ml dan diaduk sampai merata. Hasil pengenceran ini diambil dengan pipet tetes sebanyak 1 ml kemudian ditambahkan akudes 9 ml. Pengenceran ini dilakukan sampai 1000.000 kali (106).
Dari hasil pengenceran pada tabung reaksi yang terakhir diambil sebanyak 1 ml dan diratakan pada medium agar PCA (ditimbang 7 gr PCA,ditambahkan akuades 250 ml dan kemudian disterilisasikan dalam autoclave pada suhu 121oC selama 15 menit). PCA yang telah disiapkan di atas cawan petridish, selanjutnya diinkubasi selama 24 jam pada suhu 32oC dengan posisi terbalik. Jumlah koloni yang ada dihitung dengan colony counter.
Total mikrobia = jumlah koloni hasil perhitungan × 1
FP
6. Penentuan viskositas (Sukardjo, 2002)
Penentuan waktu alir zat pada viskometer Oswald (t2) dilakukan dengan
cara yaitu diambil 10 ml sampel dan dimasukkan ke dalam viskometer Oswald. Sampel diisap dengan bola bulb sampai batas tanda yang terdapat pada alat viskometer. Sampel dibiarkan mengalir ke bawah sampai batas tanda yang terdapat pada alat. Dicatat waktu yang diperlukan dengan menggunakan
stopwatch. Penentuan massa jenis zat (ρ2) dilakukan dengan cara yaitu diambil 10
ml sampel kemudian diukur beratnya. Massa jenis adalah hasil pembagian antara berat zat dengan volume zat. Dilakukan perhitungan viskositas dengan menggunakan rumus sebagai berikut :
ŋ1 /ŋ 2 = ρ1t1 / ρ2t2
Keterangan :
ŋ 1 = Viskositas air ŋ 2 = Viskositas sampel ρ1 = Massa jenis air ρ2 = Massa jenis sampel
t1 = Waktu alir air
t2 = Waktu alir sampel
7 .Uji organoleptik rasa dan aroma (Soekarto, 1985)
ditentukan berdasarkan skala numerik. Untuk skala rasa, warna, dan aroma adalah sebagai berikut :
Tabel 3. Skala uji hedonik terhadap aroma dan rasa (Numerik)
Skala Numerik Keterangan
4 Sangat suka
3 Suka
2 Agak suka
1 Tidak suka
8. Organoleptik warna (Numerik) (Soekarto, 1985)
Penentuan nilai organoleptik terhadap warna dilakukan dengan uji kesukaan secara hedonik. Caranya contoh diuji secara acak dengan pemberian kode pada bahan yang akan diuji kepada 15 panelis yang akan melakukan penilaian. Pengujian dilakukan secara inderawi (organoleptik) yang ditentukan berdasarkan skala numerik. Untuk skala warna adalah sebagai berikut :
Tabel 4. Skala uji hedonik terhadap warna (Numerik) Skala Numerik Keterangan
4 Ungu kehitaman
3 Ungu
2 Ungu muda
Gambar 1. Skema pembuatan starter yoghurt Susu bubuk 16 g
Ditambahkan gula 3% dari
volume campuran
Ditutup dengan polietilen dan dilubangi Diaduk
Diinkubasi pada suhu 40-45oC selama 4 - 6 jam
Starter yoghurt
Ditambahkan starter sebanyak 3% dari volume campuran pada suhu 40-50oC
Gambar 2. Skema pembuatan sari ubi jalar ungu Ubi Jalar Ungu
Dipanaskan pada suhu 70oC selama 30 menit Dikupas Kulitnya dan
dicuci
Didinginkan dan disaring
Dipotong dan di blander ubi jalar ungu dan air matang 1 : 2 Disortasi
Gambar 3. Skema pembuatan minuman probiotik sari ubi jalar ungu.
Minuman Probiotik Sari Ubi Jalar Ungu Sari Ubi jalar ungu
Ditambahkan susu 5% dari berat sari dan ditambahkan gula sesuai konsentrasi
Dilakukan pengadukan dan didinginkan sampai suhunya 40 – 50oC
Dilakukan pemanasan pada suhu 70oC
Ditambahkan starter sebanyak 5%
Ditutup dengan plastik polietilen dan dilubangi
Diinkubasi suhu 40-45oC selama waktu perlakuan
HASIL DAN PEMBAHASAN
Pengaruh Konsentrasi Gula terhadap Parameter yang Diamati
Hasil penelitian menunjukkan bahwa penambahan gula memberikan pengaruh terhadap total asam laktat (%), total padatan terlarut (o Brix), kadar protein (%), pH, total mikroba 106 (CFU/g) , viskositas (cp) dan uji organoleptik warna, aroma dan rasa seperti yang terlihat pada Tabel 5.
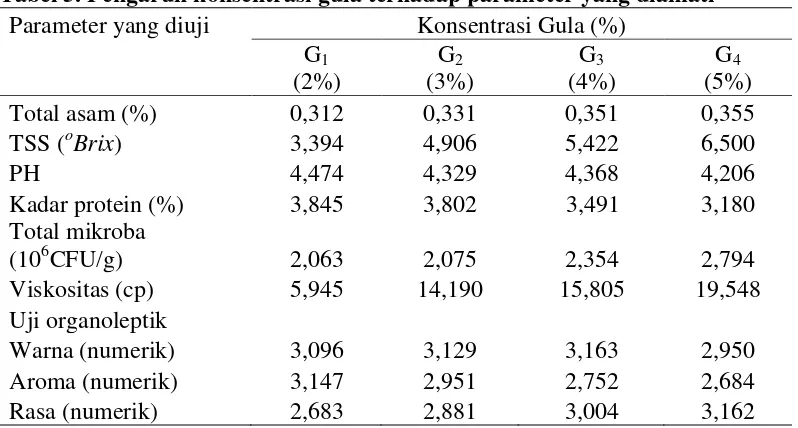
Tabel 5. Pengaruh konsentrasi gula terhadap parameter yang diamati
Parameter yang diuji Konsentrasi Gula (%)
Dari Tabel 5 dapat dilihat bahwa pengaruh lama inkubasi memberikan pengaruh terhadap parameter yang diuji. Dari Tabel 5 dapat dilihat bahwa total asam (%) tertinggi terdapat pada perlakuan G4 (konsentrasi gula 5%) yaitu sebesar 0,355 % dan terendah pada G1 (konsentrasi gula 2%) yaitu sebesar
0,312%. Total padatan terlarut oBrix tertinggi terdapat pada perlakuan G4
(konsentrasi gula 5%) yaitu sebesar 6,500 oBrix dan terendah terdapat pada perlakuan G1 (konsentrasi gula 2%) yaitu sebesar 3,394 oBrix. pH tertinggi
terdapat pada perlakuan G1 (konsentrasi gula 2%) yaitu sebesar 4,474 dan
Kadar protein (%) tertinggi terdapat pada perlakuan G1 (konsentrasi gula 2%)
yaitu sebesar 3,845% dan terendah terdapat pada perlakuan G4 (konsentrasi gula
5%) yaitu sebesar 3,180%. Total mikroba tertinggi terdapat pada perlakuan G4
(konsentrasi gula 5%) yaitu sebesar 2,794x106CFU/g dan terendah terdapat pada perlakuan G1 (konsentrasi gula 2%) yaitu sebesar 2,063x106CFU/g. Viskositas
tertinggi terdapat pada perlakuan G4 (konsentrasi gula 5%) yaitu sebesar 19,55 cp
dan terendah terdapat pada perlakuan G1 (konsentrasi gula 2%) yaitu sebesar 5,95
cp . Nilai uji organoleptik warna tertinggi terdapat pada perlakuan G3 (konsentrasi
gula 4%) yaitu sebesar 3,163 dan terendah terdapat pada perlakuan G4
(konsentrasi gula 5%) yaitu sebesar 2,950. Nilai uji organoleptik aroma tertinggi terdapat pada perlakuan G1 (konsentrasi gula 2%) yaitu sebesar 3,147 dan
terendah terdapat pada perlakuan G4 (konsentrasi gula 5%) yaitu sebesar 2,684.
Nilai uji organoleptik rasa tertinggi terdapat pada perlakuan G4 (konsentrasi gula
5%) yaitu sebesar 3,162 dan terendah terdapat pada perlakuan G1 (konsentrasi
gula 2%) yaitu sebesar 2,683.
Pengaruh Lama Inkubasi terhadap Parameter yang Diamati
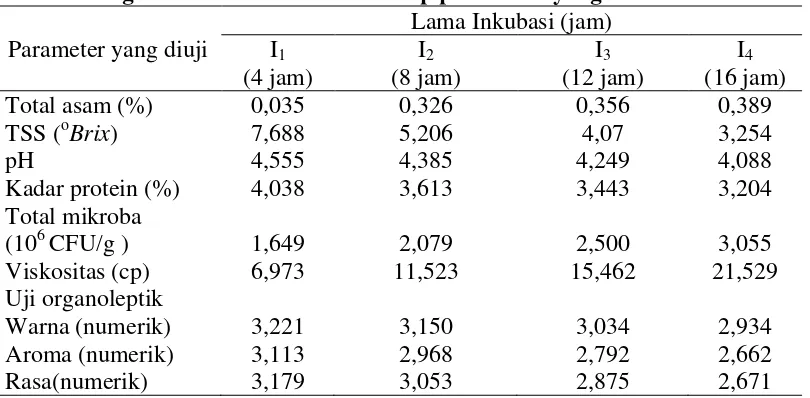
Tabel 6. Pengaruh lama inkubasi terhadap parameter yang diamati
Dari Tabel 6 dapat dilihat bahwa konsentrasi gula memberikan pengaruh terhadap parameter yang diuji. Dari Tabel 6 dapat dilihat bahwa Total asam laktat (%) tertinggi terdapat pada perlakuan I4 (lama inkubasi 16 jam) yaitu sebesar
0,389 % dan terendah pada I1 (lama inkubasi 4 jam) yaitu sebesar 0,035%. Total
padatan terlarut (TSS) tertinggi terdapat pada perlakuan I1 (lama inkubasi 4 jam)
yaitu sebesar 7,688 oBrix dan terendah terdapat pada perlakuan I4 (konsentrasi
gula 5%) yaitu sebesar 3,254 oBrix. pH tertinggi terdapat pada perlakuan I1 (lama
inkubasi 4 jam) yaitu sebesar 4,555 dan terendah terdapat pada perlakuan I4 (lama
inkubasi 16 jam) yaitu sebesar 4,088. Kadar protein tertinggi terdapat pada perlakuan I1 (lama inkubasi 4 jam) yaitu sebesar 4,038% dan terendah terdapat
pada perlakuan I4 (lama inkubasi 16 jam) yaitu sebesar 3,204%. Total mikroba
tertinggi terdapat pada perlakuan I4 (lama inkubasi 16 jam) yaitu sebesar 3,055 x
106 CFU/g dan terendah terdapat pada perlakuan I1 (lama inkubasi 4 jam) yaitu
sebesar 1,649 x 106 CFU/g. Viskositas tertinggi terdapat pada perlakuan I4 (lama
inkubasi 16 jam) yaitu sebesar 21,53 cp dan terendah terdapat pada perlakuan I1
terdapat pada perlakuan I1 (lama inkubasi 4 jam) yaitu sebesar 3,221 dan terendah
terdapat pada perlakuan I4 (lama inkubasi 16 jam) yaitu sebesar 2,934. Nilai uji
organoleptik aroma tertinggi terdapat pada perlakuan I1 (lama inkubasi 4 jam)
yaitu sebesar 3,113 dan nilai uji organoleptik aroma terendah terdapat pada perlakuan I4 (lama inkubasi 16 jam) yaitu sebesar 2,662. Nilai uji organoleptik
rasa tertinggi terdapat pada perlakuan I1 (lama inkubasi 4 jam) yaitu sebesar 3,179
dan terendah terdapat pada perlakuan I4 (lama inkubasai 16 jam) yaitu sebesar
2,671.
Total Asam Laktat
Pengaruh konsentrasi gula terhadap total asam laktat
Dari daftar sidik ragam (Lampiran 1) dapat dilihat bahwa pengaruh konsentrasi gula memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap total asam minuman probiotik yang dihasilkan.
Untuk melihat pengaruh penambahan konsentrasi gula terhadap total asam pada tiap-tiap perlakuan telah dilakukan uji LSR dan dapat dilihat pada Tabel 6. Tabel 7. Uji LSR efek utama pengaruh konsentrasi gula terhadap total asam laktat
(%)
Jarak LSR Konsentrasi gula Rataan Notasi
0,05 0,01 0,05 0,01
- - - G1= 2% 0,312 c C
2 0,0115 0,0159 G2= 3% 0,331 b B
3 0,0121 0,0167 G3= 4% 0,351 a A
4 0,0124 0,0171 G4= 5% 0,355 a A
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar).
Dari Tabel 7 dapat dilihat bahwa perlakuan G1 berbeda sangat nyata
terhadap G2 ,G3 dan G4. Perlakuan G2 berbeda sangat nyata terhadap G3 dan G4.
pada perlakuan G4 (konsentrasi gula 5%) yaitu sebesar 0,355% dan terendah pada G1 (konsentrasi 2%) yaitu sebesar 0,312%. Hubungan konsentrasi gula dengan
total asam dapat dilihat Gambar 4.
Gambar 4. Hubungan konsentrasi gula dengan total asam laktat (%).
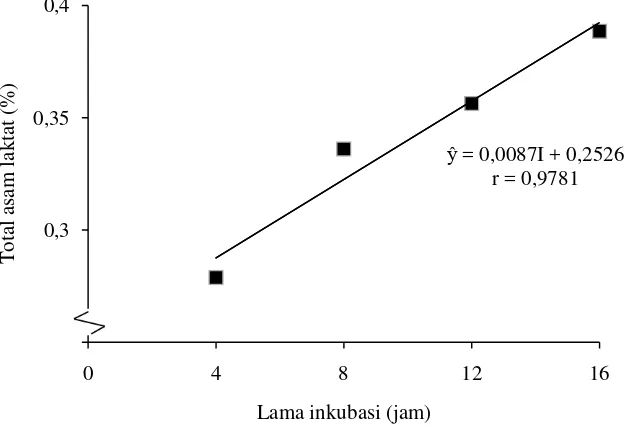
Pengaruh lama inkubasi terhadap total asam laktat
Dari daftar sidik ragam (Lampiran 1) dapat dilihat bahwa pengaruh konsentrasi gula memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap total asam minuman probiotik yang dihasilkan. Untuk melihat pengaruh penambahan konsentrasi gula terhadap total asam pada tiap-tiap perlakuan telah dilakukan uji LSR dan dapat dilihat pada Tabel 8.
Dari Tabel 8 dapat dilihat bahwa perlakuan I1 berbeda sangat nyata dengan
I2, dan berbeda sangat nyata terhadap I3 dan I4. Perlakuan I2 berbeda sangat nyata
dengan I3 dan I4. Perlakuan I3 berbeda sangat nyata dengan I4. Total asam laktat
tertinggi terdapat pada perlakuan I4 (Lama inkubasi 16 jam) yaitu sebesar 0,389 % dan terendah pada I1 (lama inkubasi 4 jam) yaitu sebesar 0,279%. Hubungan lama
inkubasi dengan total asam dapat dilihat Gambar 5.
Tabel 8. Uji LSR efek utama pengaruh lama inkubasi terhadap total asam laktat
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar).
Gambar 5. Hubungan lama inkubasi dengan total asam laktat (%)
Pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap total asam laktat
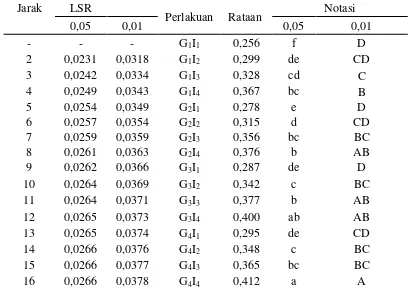
Dari Tabel 9 dapat dilihat bahwa kombinasi perlakuan antara konsentrasi gula dan lama inkubasi memberikan pengaruh yang berbeda nyata terhadap total asam laktat. Total asam laktat tertinggi diperoleh dari kombinasi perlakuan G4I4
yaitu sebesar 0,412% dan terendah diperoleh pada kombinasi perlakuan G1I1 yaitu
sebesar 0,256%.
Tabel 9. Uji LSR efek utama pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap total asam laktat (%)
Jarak LSR
Perlakuan Rataan Notasi
0,05 0,01 0,05 0,01
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar).
akan semakin meningkat. Hal ini karena selama inkubasi terjadi perkembangbiakan bakteri asam laktat sehingga asam-asam organik semakin banyak yang dihasilkan. Menurut Elisabeth (2003), selama penyimpanan yoghurt, jumlah bakteri asam laktat dan viskositas meningkat sampai waktu tertentu kemudian mengalami penurunan. Menurut Tamime dan Robinson (1999) bahwa katabolisme dari kultur starter akan menghasilkan asam laktat, dimana asam laktat dapat menurunkan pH sehingga asam laktat yang terbentuk akan semakin tinggi.
Gambar 6. Hubungan interaksi antara konsentrasi gula dan lama inkubasi terhadap total asam laktat (%).
Total Padatan Terlarut
Pengaruh konsentrasi gula terhadap total padatan terlarut
Dari daftar sidik ragam (Lampiran 2) dapat dilihat bahwa pengaruh konsentrasi gula memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap total padatan terlarut (oBrix) minuman probiotik. Untuk melihat pengaruh penambahan konsentrasi gula terhadap total padatan terlarut (oBrix) pada tiap-tiap perlakuan telah dilakukan uji LSR dan dapat dilihat pada Tabel 10.
Dari Tabel 10 dapat dilihat bahwa perlakuan G1 berbeda sangat nyata
dengan G2, G3 dan G4. Perlakuan G2 berbeda nyata dengan G3 dan G4. Perlakuan
G3 berbeda sangat nyata dengan G4. total padatan terlarut (oBrix) tertinggi terdapat
pada perlakuan G4 (konsentrasi gula 5%) yaitu sebesar 6,500 oBrix dan terendah pada G1 (2%) yaitu sebesar 3,394 oBrix.
Tabel 10. Uji LSR efek utama pengaruh konsentrasi gula terhadap total padatan terlarut (oBrix).
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar).
Hubungan konsentrasi gula dengan total padatan terlarut (oBrix) dapat dilihat Gambar 7.
Gambar 7. Hubungan konsentrasi gula dengan total padatan terlarut (oBrix)
Pengaruh lama inkubasi terhadap total padatan terlarut
Dari daftar sidik ragam (Lampiran 2) dapat dilihat bahwa pengaruh lama inkubasi memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap total asam
minuman probiotik yang dihasilkan. Untuk melihat pengaruh penambahan lama inkubasi terhadap total padatan terlarut (oBrix) pada tiap-tiap perlakuan telah dilakukan uji LSR dan dapat dilihat pada Tabel 11.
Tabel 11. Uji LSR Efek utama pengaruh lama inkubasi terhadap total padatan terlarut (oBrix)
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar).
Dari Tabel 11 dapat dilihat bahwa perlakuan I1 berbeda sangat nyata
dengan I2, I3 dan I4. Perlakuan I2 berbeda sangat nyata dengan I3 dan I4.
Perlakuan I3 berbeda sangat nyata dengan I4. Total padatan terlarut (oBrix)
tertinggi terdapat pada perlakuan I2 (lama inkubasi 4 jam) yaitu sebesar 7,688
o
Brix dan terendah pada I4 (lama inkubasi 16 jam) yaitu sebesar 3,254 oBrix.
Hubungan lama inkubasi dengan total padatan terlarut (oBrix) dapat dilihat Gambar 8.
Pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap total padatan terlarut
Dari daftar analisis sidik ragam (Lampiran 2 ) dapat dilihat bahwa interaksi konsentrasi gula dan lama inkubasi memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap minuman probiotik yang dihasilkan. Hasil pengujian dengan LSR menunjukkan bahwa pengaruh interaksi konsentrasi gula dan lama inkubasi terhadap total padatan terlarut (oBrix) tiap-tiap perlakuan dapat dilihat pada Tabel 12.
Tabel 12 . Uji LSR efek utama pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap total padatan terlarut (oBrix)
Jarak LSR Perlakuan Rataan Notasi
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar).
diperoleh dari kombinasi perlakuan G4I1 yaitu sebesar 8,850% dan terendah
diperoleh pada kombinasi perlakuan G1I4 yaitu sebesar 1,650%.
Gambar 9. Hubungan interaksi antara konsentrasi gula dan lama inkubasi terhadap total padatan terlarut (oBrix).
Dari Gambar 9 dapat dilihat bahwa semakin lama inkubasi maka total padatan terlarut semakin menurun, karena mikroba lebih banyak memanfaatkan substrat untuk proses metabolisme sehingga total padatan menjadi rendah (Sunarlim dan Usmiati, 2008). Semakin tinggi konsentrasi gula maka total padatan terlarut (oBrix) semakin meningkat. Hal ini karena minuman probiotik yang dihasilkan semakin kental akibat penambahan gula sehingga terbentuk padatan terlarut Purwati (2006) menjelaskan, keasaman yang tinggi dapat menyebabkan protein menggumpal, dan menyebabkan kekentalan produk.
pH
Pengaruh konsentrasi gula terhadap pH
Dari daftar sidik ragam (Lampiran 3) dapat dilihat bahwa pengaruh konsentrasi gula memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap pH minuman probiotik yang dihasilkan. Untuk melihat pengaruh penambahan konsentrasi gula terhadap pH pada tiap-tiap perlakuan telah dilakukan uji LSR dan dapat dilihat pada Tabel 13.
Tabel 13 . Uji LSR efek utama pengaruh konsentrasi gula terhadap pH
Jarak LSR Konsentrasi Rataan Notasi
0,05 0,01 Gula 0,05 0,01
- - - G1= 2% 4,474 a A
2 0,0235 0,0323 G2= 3% 4,329 b B
3 0,0247 0,0340 G3= 4% 4,268 c C
4 0,0253 0,0348 G4= 5% 4,206 d D
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar).
Hubungan konsentasi gula dengan pH dapat dilihat Gambar 10.
Gambar 10. Hubungan konsentrasi gula dengan pH.
ŷ = -0,0864G + 4,6214 r = - 0,9729
4,10 4,20 4,30 4,40 4,50
0 1 2 3 4 5
pH
Dari Tabel 13 dapat dilihat bahwa perlakuan G1 berbeda sangat nyata dengan G2,
G3 dan G4. Perlakuan G2 berbeda nyata dengan G3 dan G4. Perlakuan G3 berbeda
sangat nyata dengan G4. pH tertinggi terdapat pada perlakuan G1 (konsentrasi gula
2%) yaitu sebesar 4,474 dan terendah pada G4 (konsentrasi gula 5%) yaitu
sebesar 4,206.
Pengaruh lama inkubasi terhadap pH
Dari daftar sidik ragam (Lampiran 3) dapat dilihat bahwa pengaruh lama inkubasi memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap pH minuman probiotik yang dihasilkan. Untuk melihat pengaruh penambahan lama inkubasi terhadap pH pada tiap-tiap perlakuan telah dilakukan uji LSR dan dapat dilihat pada Tabel 14.
Tabel 14. Uji LSR efek utama pengaruh lama inkubasi terhadap pH
Jarak LSR Lama Rataan Notasi
0,05 0,01 Inkubasi 0,05 0,01
- - - I1= 4 jam 4,555 a A
2 0,0235 0,0323 I2= 8 jam 4,385 b B
3 0,0247 0,0340 I3= 12 jam 4,249 c C
4 0,0253 0,0348 I4= 16 jam 4,088 d D
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar).
Dari Tabel 14 dapat dilihat bahwa perlakuan I1 berbeda sangat nyata
dengan I2, I3 dan I4. Perlakuan I2 berbeda nyata dengan I3 dan I4. Perlakuan I3
berbeda sangat nyata dengan I4. pH tertinggi terdapat pada perlakuan I1 (Lama
inkubasi 4 jam) yaitu sebesar 4,555 dan terendah pada I4 (lama inkubasi 16 jam)
Gambar 11 Hubungan lama inkubasi dengan pH.
Pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap pH Dari daftar analisis sidik ragam (Lampiran 3) dapat dilihat bahwa interaksi konsentrasi gula dan lama inkubasi memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap minuman probiotik yang dihasilkan. Hasil pengujian dengan LSR menunjukkan bahwa pengaruh interaksi konsentrasi gula dan lama inkubasi terhadap pH tiap-tiap perlakuan dapat dilihat pada Tabel 15.
Dari Tabel 15 dapat dilihat bahwa kombinasi perlakuan antara konsentrasi gula dan lama inkubasi memberikan pengaruh yang berbeda sangat nyata terhadap pH. pH tertinggi diperoleh dari kombinasi perlakuan G1I1 yaitu sebesar
4,735 dan pH terendah diperoleh pada kombinasi perlakuan G4I4 yaitu sebesar
3,990.
ŷ= -0,0385I + 4,7038 r = -0,9991
4,00 4,10 4,20 4,30 4,40 4,50 4,60
0 4 8 12 16
pH
Tabel 15 . Uji LSR efek utama pengaruh interaksi antara konsentrasi gula dan lama inkubasi terhadap pH
Jarak LSR
Perlakuan Rataan Notasi
0,05 0,01 0,05 0,01
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar).
Dari Gambar 12 dapat dilihat bahwa semakin tinggi konsentrasi gula maka protein akan semakin menurun. Menurut Setioningsih, dkk (2004) bahwa asam laktat diperoleh dengan jalan perombakan gula yang berupa glukosa, laktosa, sukrosa, raffinosa dan stakiosa media fermentasi melalui proses glikolisis. Adanya asam laktat menyebabkan pH menurun.ksemakin lama inkubasi dan semakin tinggi konsentrasi gula derajat keasaman semakin rendah. Hal ini karena semakin banyak asam organik yang terbentuk selama inkubasi. Selain itu, glukosa mengalami perombakan menjadi asam organik. Menurut Muawanah (2006) menyatakan bahwa semakin lama inkubasi pada pembuatan minuman probiotik, maka total asam akan semakin meningkat dan pH akan semakin rendah.
Kadar Protein
Pengaruh konsentrasi gula terhadap kadar protein
Dari daftar sidik ragam (Lampiran 4) dapat dilihat bahwa pengaruh konsentrasi gula memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap kadar protein minuman probiotik yang dihasilkan.
Untuk melihat pengaruh penambahan konsentrasi gula terhadap kadar protein pada tiap-tiap perlakuan telah dilakukan uji LSR dan dapat dilihat pada Tabel 16.
Tabel 16. Uji LSR efek utama pengaruh konsentrasi gula terhadap kadar protein (%)
Jarak LSR Konsentrasi Gula Rataan Notasi
0,05 0,01 0,05 0,01
- - - G1= 2% 3,845 a A
2 0,066 0,091 G2= 3% 3,802 a A
3 0,070 0,096 G3= 4% 3,491 b B
4 0,071 0,098 G4= 5% 3,180 c C