Kultur Jaringan Tanaman iii
KATA PENGANTAR
Kultur Jaringan Tanaman merupakan teknik perbanyakan vegetatif tanaman modern yang banyak diperbincangkan saat ini. Buku ini disusun untuk membantu mahasiswa diploma, sarjana maupun pascasarjana yang mempelajari pemuliaan tanaman terutama mengenai teknik-teknik perbanyakan tanaman secara in
vitro. Bagi mahasiswa diploma, teknik kultur jaringan tanaman
memberikan bekal keterampilan yang sangat bermanfaat apabila mereka nantinya bekerja dalam membantu peneliti di lembaga penelitian atau perusahaan swasta. Bagi mahasiswa program sarjana dan pascasarjana, teknik kultur jaringan tanaman sangat bermanfaat untuk memperlancar kegiatan penelitian pemuliaan tanaman secara in vitro. Para peneliti pada berbagai lembaga penelitian pertanian dan para praktisi, dapat pula memanfaatkan buku ini dalam rangka memperlancar kegiatan penelitian terutama yang berkaitan dengan bidang ini.
Penyusunan materi dalam buku ini didasarkan pada pengalaman penulis dalam mengajar Pengantar Kultur Jaringan Tanaman dan Dasar Pemuliaan Tanaman pada program sarjana, Pemuliaan Tanaman Lanjut dan Bioteknologi Pertanian pada program pascasarjana Universitas Halu Oleo. Di samping itu, pengalaman dan keterampilan penulis dalam pelaksanaan kegiatan penelitian yang berkaitan dengan Kultur Jaringan Tanaman juga memperkaya isi dari buku ini. Buku ini disajikan dalam enam bab. Bab satu membahas tentang pendahuluan yang mencakup tentang terminologi, sejarah perkembangan kultur jaringan, dan manfaat kultur jaringan. Bab dua membahas tentang organisasi dan fasilitas laboratorium kultur jaringan tanaman. Bab tiga membahas tentang media tanam kultur jaringan tanaman. Bab empat membahas tentang teknik aseptis. Bab lima membahas tentang kultur sel bagi struktur yang telah terorganisasikan atau
Kultur Jaringan Tanaman iv kultur organ, dan pada bab enam membahas tentang kultur sel bagi struktur yang belum terorganisasikan atau kultur jaringan.
Akhirnya penulis buku “Kultur Jaringan Tanaman” ini, mengucapkan terima kasih kepada semua pihak yang dengan segala jerih payahnya telah membantu dalam penyelesaian penulisan naskah buku ini. Penulis berharap agar buku ini dapat dimanfaatkan dengan sebaik-baiknya oleh para mahasiswa, praktisi maupun peneliti di bidang kultur jaringan tanaman.
Kendari, Desember 2013
Kultur Jaringan Tanaman 1
Bab 1
Pendahuluan
Tumbuhan di alam bebas sangat bervariasi dan kompleks dalam melangsungkan siklus hidupnya. Untuk dapat mempertahan-kan generasinya, tumbuhan harus memperbanyak diri (membiak), baik secara vegetatif maupun secara generatif. Pembiakan secara generatif dimulai dari penyatuan antara gamet jantan dan gamet betina dari tanaman induk melalui suatu peristiwa yang disebut penyerbukan. Melalui penyerbukan, kedua gamet tersebut akan melebur dan menghasilkan sebuah sel yang disebut zigot, selanjutnya tumbuh dan berkem-bang menjadi tumbuhan lengkap.
Selain itu, sel-sel vegetatif tumbuhan seperti yang terdapat pada akar, batang, dan daun, secara alamiah juga mempunyai kemampuan yang mirip dengan zigot, yaitu dapat berkembang pada kondisi in vivo menjadi tanaman lengkap, sehingga kelangsungan generasinya tetap terjaga. Kemampuan sel-sel vegetatif selain zigot untuk berkembang menjadi tanaman utuh merupakan topik yang sangat menarik perhatian para peneliti. Topik penelitian yang sangat menarik tersebut dapat dilaksanakan dengan menggunakan teknik kultur (budidaya) jaringan atau kultur
in vitro.
1.1. Terminologi
Salah satu pembeda sel tumbuhan dengan sel hewan adalah adanya dinding sel pada sel tumbuhan. Dinding sel tumbuhan selain berfungsi memberi bentuk pada sel juga sebagai penahan (barier) mekanik yang mengisolasi sel-sel dengan lingkungan luarnya. Pada kenyataannya, sel satu dengan lainnya yang
Kultur Jaringan Tanaman 2
menyusun jaringan meskipun secara fisik di-batasi oleh membran plasma dan dinding sel, tidak terisolasi dan masih dapat berhubungan lewat plasmodesmata (symplast).
Implikasi dari kenyataan tersebut adalah adanya kontinuitas sitoplasmatik, atau dengan kata lain, informasi genetik yang terdapat dan berawal dari zigot tentulah tersebar ke seluruh sel-sel penyusun tubuh tumbuhan. Sel tumbuhan dengan demikian haruslah mengan-dung seluruh informasi yang diperlukan untuk tumbuh, berkembang dan berkembangbiak, sel demikian disebut totipoten (totipotent).
Kultur jaringan adalah suatu metode untuk mengisolasi bagian-bagian tanaman seperti sel, jaringan, atau organ, serta menumbuhkannya secara aseptis (suci patogen) di dalam atau di atas suatu medium budidaya sehingga bagian-bagian tanaman tersebut dapat memper-banyak diri dan beregenerasi menjadi tanaman lengkap kembali. Prinsip kultur jaringan terdapat pada teori sel yang dikemukakan oleh dua orang ahli Biologi dari Jerman, M.J. Schleiden dan T. Schwann. Secara implisit teori tersebut menyatakan bahwa sel tumbuhan bersifat autonom dan mempunyai totipotensi.
Sel bersifat autonom artinya dapat mengatur dirinya sendiri. Maksudnya adalah dapat melakukan metabolisme, tumbuh dan berkembang secara mandiri (independent), jika diisolasi dari jaringan induknya. Totipotensi diartikan sebagai kemampuan sel tumbuhan (baik sel somatik/vegetatif maupun sel gametik) untuk beregenerasi menjadi tanaman lengkap kembali.
Di samping kultur jaringan, kita juga mengenal istilah kultur in vitro tanaman. Istilah ini muncul karena sel, kelompok sel, atau organ tanaman tersebut tumbuh, berkembang dan beregenerasi secara aseptis pada medium di dalam wadah gelas atau plastik (tabung/botol) yang tembuspandang (transparrant). Istilah eksplan (explant) digunakan untuk menyebutkan bagian
Kultur Jaringan Tanaman 3
kecil dari tanaman (sel, jaringan, atau organ) yang digunakan untuk memulai suatu kultur.
Eksplan yang digunakan di dalam kultur jaringan harus yang masih muda (primordium), sel-selnya masih bersifat meristematis dan sudah mengalami proses diferensiasi. Sel-sel mesofil dan stomata pada daun, kambium, korteks dan lain-lain adalah bentuk-bentuk sel yang sudah mengalami diferensiasi. Pada primordia daun misalnya, sel-sel yang sudah mengalami diferensiasi tersebut hanya perlu membelah satu atau dua kali saja kemudian berhenti atau dorman (dormant), selanjutnya akan membentang. Pembelahan selselnya juga sudah diprogram untuk menghasilkan sel yang sama, misalnya sel-sel mesofil hanya akan membelah dan menghasilkan sel mesofil juga.
Dengan cara mengisolasi eksplan dari tanaman induknya, sel-sel pada eksplan yang awalnya dorman, dihadapkan pada kondisi tercekam. Kondisi ini akan mengubah pola meta-bolisme, sel akan memulai siklusnya yang baru, dan tumbuh dan berkembang di dalam kultur. Respon yang terlihat pertama kali yaitu terbentuknya jaringan penutup luka, sel-selnya terus membelah, jika pembelahannya tidak terkendali akan membentuk massa sel yang tidak terorganisasikan yang disebut kalus.
Pembelahan sel-sel yang tidak terkendali disebabkan karena sel-sel tumbuhan, yang secara alamiahnya bersifat autotrof, dikondisikan menjadi heterotrof dengan cara memberikan nutrisi yang cukup kompleks di dalam medium kultur. Sel-sel kalus ini berbeda dengan sel-sel eksplannya, sel-sel menjadi tidak terdiferensiasi, proses ini disebut dediferensiasi (kembali ke keadaan tidak terdiferensiasi).
Pada proses dediferensiasi, sel-sel pada eksplan yang tadinya dalam keadaan quiescent atau dorman, diinduksi untuk aktif kembali melakukan pembelahan. Induksi dediferensiasi dapat dilakukan dengan menambahkan zat pengatur tumbuh dari
Kultur Jaringan Tanaman 4
kelompok auksin ke dalam medium kultur. Auksin sintetis yang umum digunakan adalah 2,4-dichlorophenoxy-acetic acid (2,4-D) dengan konsentrasi maksimum 2 mgL-1.
Auksin substitusi seperti picloram
(4-amino-3,5,6-trichloropyridine-2-carboxylic acid) dan dicamba (3,6-dichloro-o-anisic acid) sering digunakan untuk induksi dediferensiasi tanaman
berkayu. Sel-sel akan terus membelah selama masih dipelihara di dalam medium induksi. Zat-zat pengatur tumbuh tersebut di atas diketahui berfungsi sebagai mutagenic agent. Sel-sel yang dipelihara terlalu lama di dalam medium induksi akan mengalami mutasi, tetapi tidak kehilangan sifat totipotensinya.
Laju pertumbuhan sel, jaringan atau organ tanaman di dalam kultur akan menurun setelah periode waktu tertentu. Umumnya segera terlihat dengan adanya gejala nekrosis (necrotic) pada eksplan. Hal ini disebabkan karena menyusutnya kadar nutrisi (nutrient) medium dan terbentuknya senyawa-senyawa racun yang dilepaskan oleh eksplan di sekitar medium. Untuk itu harus dilakukan subkultur yaitu pemindahan sel atau sel-sel, jaringan, atau organ ke dalam medium baru. Tujuan dilakukannya subkultur adalah untuk mempertahankan laju pertumbuhan sel-sel yang konstan dan untuk diferensiasi kalus. Medium baru yang digunakan dapat sama atau berbeda dengan medium semula.
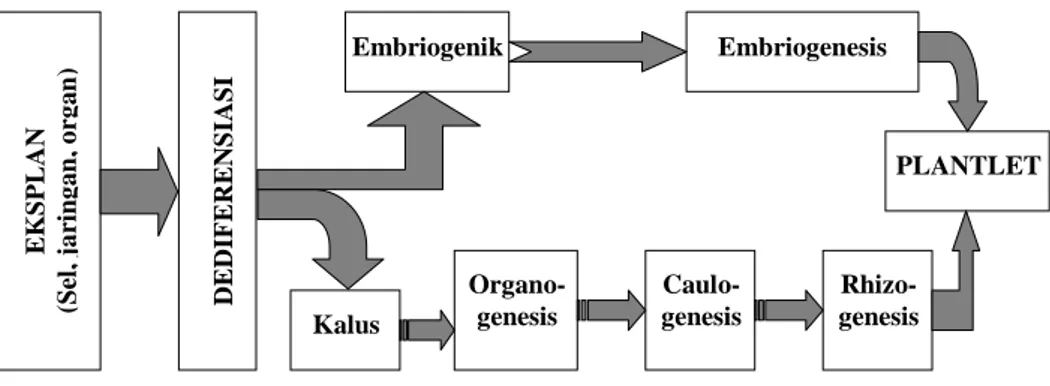
Perkembangan selanjutnya adalah terjadinya morfogenesis, yaitu proes terbentuknya organ-organ baru (de novo) yang kemudian tumbuh menjadi tanaman utuh. Tanaman kecil yang dihasilkan dengan teknik kultur jaringan disebut plantlet, pembentukan plantlet terjadi melalui dua proses yang berbeda: a. Organogenesis yaitu diferensiasi meristem unipolar,
menghasilkan ujung tunas (shoot tip) yang akan menjadi tunas melalui proses callogenesis, atau ujung akar (root tip) yang akan menjadi akar melalui proses rhizogenesis. Pada proses organogenesis diperlukan dua tahap induksi, masing-masing
Kultur Jaringan Tanaman 5
menggunakan medium dengan zat pengatur tumbuh yang berbeda. Tahap pertama biasanya adalah induksi pembentukan tunas, proses callogenesis diinduksi dengan menambahkan zat pengatur tumbuh dari golongan sitokinin ke dalam medium kultur. Tahap yang ke dua adalah induksi pembentukan akar, proses rhizogenesis ini dikerjakan dengan menambahkan zat pengatur tumbuh dari golongan auksin.
b. Embriogenesis somatik merupakan suatu proses diferensiasi meristem bipolar yang berupa bakal tunas dan akar, dua meristem yang diperlukan untuk pertumbuhan tanaman utuh. Embrio yang terbentuk akan tumbuh dan berkembaug menjadi tanaman utuh. Pertumbuhan dan perkembangan embrionya berlangsung secara bertahap melalui proses yang identik dengan proses embriogenesis zigotik, yaitu terbentuknya struktur bipolar melalui tahapan: bulat (globular), jantung (heart), torpedo, dan akhirnya berkecambah menjadi plantlet.
Morfogenesis in vitro dapat terjadi secara langsung dan tidak langsung. Secara langsung terjadi tanpa melalui tahapan kalus terlebih dahulu. Sel-sel diinduksi langsung menjadi embriogenik, hal ini dapat dikerjakan dengan menanam eksplan pada medium dengan kombinasi zat pengatur tumbuh dari kelompok auksin dan sitokinin secara simultan. Penemuan terbaru menunjukkan bahwa perlakuan heat shock pada daun Chicorium hybrida 474, dapat menginduksi sel-sel daun menjadi embriogenik. Pada sel gametik (mikrospora) induksi menjadi embriogenik dilakukan dengan memberikan stres atau cekaman.
Stres dapat diberikan secara fisik berupa cold shock atau
heat shock, dapat juga secara chemical yaitu dengan
mengkulturkan pada medium starvation (medium minimal yang hanya terdiri dari garam-garam makro dan mannitol) atau dengan memberikan stres osmotik. Sel-sel yang sudah terinduksi menjadi embriogenik identik dengan zigot, sehingga dapat melanjutkan
Kultur Jaringan Tanaman 6
petumbuhannya menjadi embrio dan tanaman lengkap.
Morfogenesis secara tidak langsung umumnya melalui tahapan kalus terlebih dahulu. Kalus yang lunak jika ditransfer ke dalam medium cair akan membentuk suspensi sel yang aktif tumbuh. Kultur sel adalah kultur dengan menggunakan sel sebagai eksplan, eksplan berasal dari sel-sel yang sudah mengalami dediferensiasi (kalus). Kalus yang digunakan sebagai eksplan pada kultur sel disebut inokulum. Kultur sel dipelihara di dalam medium cair yang diinkubasi dengan atau tanpa penggojokan. Jika proses induksi dediferensiasinya benar, maka gen-gen yang bertanggung jawab terhadap totipotensi akan berfungsi, pembelah-an sel-selnya terkendali, membentuk sel-sel ypembelah-ang terorgpembelah-anisasikpembelah-an (embrio). Embrio somatik terbentuk dari sel-sel somatik atau gametik dan bukan dari zigot. Embrio demikian disebut embrio adventif dan prosesnya disebut embriogenesis somatik. Embrio selanjutnya akan tumbuh dan berkembang menjadi tanaman utuh melalui proses yang identik dengan proses embriogenesis zigotik.
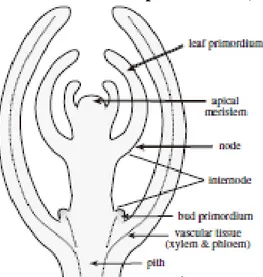
Gambar 1.1. Diagram perkembangan eksplan di dalam kultur jaringan EK S P LA N (S el , jar in ga n , or ga n ) D E DIF E RE NS IAS I Embriogenik Embriogenesis Kalus Organo-genesis Caulo-genesis Rhizo-genesis PLANTLET
Kultur Jaringan Tanaman 7
1.2. Sejarah Perkembangan Kultur Jaringan Tanaman
Membahas sejarah perkembangan kultur jaringan tidak dapat lepas dari sejarah per-kembangan pengetahuan tentang sel. Dimulai dari penemuan mikroskop oleh Zakarias Jansen pada 1590, seorang pembuat kacamata dari Belanda, yang kemudian disempurnakan oleh Anthoni van Leeuwenhoek. Penemuan dan pengembangan mikroskop memungkinkan kita melihat struktur tubuh tumbuhan secara detil, seperti yang dikemukakan oleh Robert Hooke seorang ahli matematika, dia menyamakan sel sebagai building block dari jaringan hidup.
Pada tahun 1838-1839 seorang ahli botani, M.Y. Schleiden dan Theodore Schwann (ahli zoologi) lebih memusatkan perhatiannya pada kehidupan sel yang pada akhirnya melahirkan konsep totipotensi sel. Teknik kultur jaringan yang semula digunakan untuk membuktikan teori totipotensi sel selanjutnya berkembang, selain menunjang ilmu-ilmu dasar seperti embriologi, fisiologi, biokimia dan genetika, sekarang terbukti dapat diaplikasikan pada bidang agroindustri dan farmasi.
Percobaan-percobaan untuk membuktikan bahwa sel bersifat totipoten pertama kali dilakukan oleh Gottlieb Haberlandt seorang ahli botani dari Jerman pada tahun 1898 dan dipublikasikan pada 1902. Percobaannya dilakukan dengan
mengisolasi sel daun Lamium purpureum, Erythronium,
Ornithogalum dan Tradescantia, sel yang dikulturkan tetap viabel
selama beberapa minggu tetapi tidak pernah membelah, sehingga dapat dikatakan percobaannya belum berhasil.
Kegagalan percobaan Haberlandt terutama disebabkan karena kultur dilaksanakan pada medium yang sangat sederhana dan tidak aseptis, menggunakan eksplan mesofil sel yang sudah sangat terdiferensiasi, dan tidak menggunakan zat pengatur tumbuh, pada waktu itu zat pengatur tumbuh belum diketemukan. Zat pengatur tumbuh berperan sangat penting pada proses
Kultur Jaringan Tanaman 8
pembelahan sel dan diferensiasi in vivo dan in vitro. Auksin ditemukan pada 1928-1930 oleh Went dan Thiman, sedangkan sitokinin baru ditemukan pada 1955 oleh Miller dan kawan-kawan.
Beberapa dekade setelah percobaan Haberlandt,
penelitian-penelitian kultur in vitro tumbuhan lebih ditekankan pada kultur multiselular (jaringan atau organ) sebagai eksplan. Riset ini dipelopori oleh Philip Rodney White (1939), Roger Gautheret (1939), dan Piere Nobecourt (1939). White berhasil menumbuhkan potongan ujung akar tomat (Lycopersicon
esculentum) pada medium cair yang mengandung garam-garam
anorganik, ekstrak ragi (yeast), dan sukrosa. Pada waktu yang bersamaan Gautheret dari Perancis berhasil memacu pertumbuhan potongan jaringan kambium Salix caprea membentuk kalus dengan menambahkan zat pengatur tumbuh IAA pada medium kultur. Nobecourt berhasil mengembangkan teknik kultur kalus dengan eksplan umbi akar wortel (Daucus carota).
Skoog dan Miller pada 1957 berhasil mengatur pertumbuhan akar dan tunas (organogenesis) dan kalus tembakau dengan menggunakan kombinasi auksin dan sitokinin pada medium. Pada tahun 1958, J. Reinert dan F.C. Steward berhasil membuktikan totipotensi sel pada kultur suspensi sel dengan eksplan umbi akar wortel. Di dalam kultur ditemukan adanya embrio yang strukturnya mirip dengan embrio zigotik, kemudian disimpulkan bahwa embriogenesis telah terjadi secara in vitro. Pada waktu itu masih diperdebatkan apakah munculnya embrio yang kemudian jadi plantlet tersebut berasal dari sebuah sel atau kelompok sel. Dalam perkembangannya kemudian, dengan menggunakan teknik cell tracking, terbukti bahwa plantlet berasal dari sebuah sel.
Implikasi dari penemuan sitokinin adalah dimungkin-kannya induksi pembentukan tunas secara in vitro pada berbagai
Kultur Jaringan Tanaman 9
tanaman hortikultura, sehingga dapat diaplikasikan untuk perbanyakan vegetatip (mikropropagasi). Pada kultur meristem, tanaman bebas virus dapat diperoleh dari tanaman yang sudah terinfeksi. Tanaman yang steril atau tidak dapat menghasilkan biji, dapat diperbanyak dengan mikropropagasi, teknik ini berkembang pesat antara 1960-1970.
Pertumbuhan dan perkembangan sel pada kultur dengan eksplan jaringan atau organ, tidak dapat dikontrol dengan ketat, sehingga bukan merupakan obyek eksperimen yang ideal seperti yang dicita-citakan oleh Haberlandt. Obyek yang ideal haruslah sel tunggal, sel tunggal dapat diperoleh dengan berbagai cara: (1) kultur suspensi sel, dalam hal ini sel sudah mengalami dediferensiasi, (2) mikrospora, dan (3) protoplas, yaitu sel yang sudah dihilangkan dindingnya.
Setelah percobaan-percobaan yang dilakukan oleh J. Reinert dan F.C. Steward berhasil membuktikan totipotensi sel, pada 1966 Guha dan Maheshwari berhasil memperoleh tanaman dari antera (anthers) Datura innoxia, hasil penelitianya diterbitkan di jurnal ilmiah Nature. Dari hasil pengamatannya diketahui bahwa plantlet bersifat haploid, jadi berasal dari mikrospora. Dengan perkembangan teknik kultur in vitro, pada 1972 C. Nitsch berhasil menginduksi mikrospora Datura, Nicotiana, dan
Licopersicon langsung menjadi plantlet, mikrospora diisolasi dari
antera kemudian langsung dikulturkan pada medium.
Kemajuan paling akhir dari teknik kultur in vitro adalah ditemukannya teknik kultur protoplas. Teknik ini memungkinkan diisolasinya sel tumbuhan dalam jumlah besar langsung dari tanaman, dari kalus, atau dari kultur suspensi sel. Protoplas adalah sel tumbuhan yang sudah dihilangkan dindingnya, sehingga disebut sebagai sel telanjang. Pada 1960 E.C. Cocking berhasil untuk pertamakalinya mengisolasi protoplas dari sel-sel akar dengan menggunakan enzim selulase. Cocking juga berhasil
Kultur Jaringan Tanaman 10
menunjukkan adanya regenerasi dinding sel di sekitar protoplas yang diisolasi dari jaringan loculus buah tomat.
Kemajuan yang paling berarti dicapai sekitar tahun 1970-an ketika Nagata dan Takebe berhasil menunjukkan adanya pembelahan protoplas yang diisolasi dari mesofil daun tembakau. Pembelahan ini terus berlanjut sampai terbentuknya mikrokalus. Masih pada tahun yang sama Takebe, Labib dan Melchers berhasil meregenerasikan kalus dari protoplas menjadi plantlet. Tahun-tahun sesudahnya jumlah tanaman regenerasi dari protoplas terus bertambah. Rangkaian pencapaian yang mengisi sejarah perkembangan kultur jaringan sampai saat ini dapat dirangkum sebagai berikut:
Pada tahun 1900, percobaan-percobaan awal untuk mengulturkan sel dan jaringan tanaman pada kondisi tidak aseptis. Pada era ini, formulasi permasalahan kultur sel dan jaringan oleh Haberlandt (1902), merupakan isu yang sangat dominan. Pada periode tahun 1930-1950, kultur jaringan dan kultur organ semakin berkembang yang ditandai dengan keberhasilan pelaksanaan kultur akar (organ) dan kultur jaringan secara aseptis yang menghasilkan kalus. Selain itu, penemuan auksin (suatu hormon pertumbuhan tanaman) juga merupakan keberhasilan lainnya.
Pada periode tahun 1950-1960, dicirikan dengan
keberhasilan kultur sel melalui fase organogenesis melalui kultur suspensi sel, dan embriogenesis somatik sebagai konsekuensi dari penemuan sitokinin, suatu hormon pertumbuhan tanaman selain auksin. Dalam periode 10 tahun berikutnya yaitu tahun 1960-1970, teknologi propagasi in vitro yang meliputi teknik mikropropagasi, menghasilkan tanaman bebas virus, dan pengawetan plasma nutfah mewarnai periode ini. Selain itu, haploidisasi secara in vitro, juga menunjukkan keberhasilan pelak-sanaannya, meliputi: (1) kultur antera (embryogenesis serbuk sari), (2) kultur mikrospora (androgenesis), (3) kultur ovule (gynogenesis), (4) hibridisasi
Kultur Jaringan Tanaman 11
interspesifik, dan (5) kultur embrio.
Selama periode tahun 1970-1980, prestasi lain yang cukup menakjubkan adalah keberhasilan dalam: (1) isolasi protoplas, (2) kultur protoplas, (3) tanaman regenerasi dari protoplas, (4) fusi protoplas, dan (5) hibridisasi somatik. Sejak tahun 1980 hingga sekarang, genetika sel somatik dan rekayasa genetika menjadi inti dari kemajuan kultur in vitro. Genetika sel somatik meliputi: variasi somaklon, dan teknologi pemuliaan tanaman melalui teknik mutasi secara in vitro. Sementara itu, dalam rekayasa genetika, identifikasi gen (teknologi rekombinasi DNA), isolasi gen, cloning gen, transformasi sel, ekspresi gen, dan tanaman transgenik, merupakan kegiatan-kegiatan inti yang utama dan semakin pesat.
1.3. Manfaat Teknik Kultur Jaringan
Teknik kultur jaringan yang semula ditujukan untuk penelitian dasar di bidang biologi, terutama pembuktian totipotensi sel, sekarang telah berkembang sedemikian pesatnya sehingga dapat dipergunakan untuk keperluan-keperluan yang lain terutama di bidang agribisnis dan farmasi.
a. Di bidang agribisnis
Aplikasi yang nyata dari teknik kultur jaringan tumbuhan adalah dapat menekan biaya produksi karena dapat menghasilkan bibit dalam jumlah banyak pada waktu yang relatif singkat, tidak memerlukan lahan yang terlalu luas, tidak tergantung pada iklim, bebas hama dan penyakit sehingga dapat diangkut kemana saja melewati batas-batas negara, tanpa melalui proses karantina. Hal yang lebih penting lagi, karena merupakan perbanyakan vegetatif, maka keturunannya akan sama dengan induknya.
Survey yang dilaksanakan di negeri Belanda menunjukkan, laboratorium mikropropagasi komersial pada tahun 1988 telah
Kultur Jaringan Tanaman 12
menghasilkan tanaman yang diperbanyak secara klonal sebanyak 65 juta (Pierik, 1988). Sementara itu, di Indonesia mikropropagasi klonal telah sangat membantu program Hutan Tanaman Industri, pohon yang berhasil dikembangkan dengan metode ini antara lain Jati (Tectona grandis) dengan kemampuan multiplikasi 5-6
plantlet atau dalam kurun waktu satu tahun dari satu eksplan dapat
diperoleh sekitar 15 juta anakan.
b. Di bidang farmakologi dan industri kimia
Metabolit sekunder merupakan bahan baku obat yang berasal dari bahan alam nabati, biasanya metabolit sekunder jenis ini diperoleh dari tumbuhan dengan cara penyaringan (ekstraksi). Cara ini tidak praktis karena diperlukan lahan yang luas untuk menumbuhkan tanaman tersebut. Melalui teknik kultur in vitro, sel-sel dan jaringan tanaman dapat dimanipulasikan sedemikian rupa seperti yang dapat dilakukan pada proses fermentasi. Bedasarkan hal tersebut kultur sel dapat merupakan sumber metabolit sekunder yang memiliki nilai ekonomi tinggi di samping kultur kalus.
c. Untuk mendapatkan hibrida-hibrida baru melalui silangan somatis
Sel-sel tubuh tanaman jika dihilangkan dindingnya akan didapatkan protoplas. Tersedianya protoplas memungkinkan dilakukannya persilangan intergenerik dengan teknik fusi protoplas. Protoplas dari dua jenis tanaman yang berbeda dapat difusikan dengan menggunakan medan listrik atau bahan kimia pemfusi sehingga terjadi peleburan sitoplasma dan diharapkan dapat terjadi peleburan dua inti heterokaryon.
Protoplas hasil fusi dapat diregenerasikan menjadi tanaman (hibrida) baru. Dengan fusi protoplas akan teratasi kesulitan-kesulitan yang timbul pada hibridisasi antara dua spesies, dua
Kultur Jaringan Tanaman 13
genus atau bahkan pada takson yang lebih tinggi. Penghilangan dinding sel juga memungkinkan untuk mengintroduksi organel atau potongan DNA ke dalam sel untuk merubah struktur genetisnya.
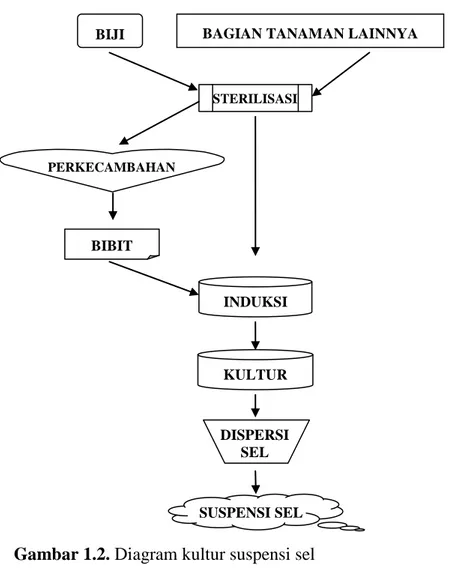
Gambar 1.2. Diagram kultur suspensi sel
BIJI BAGIAN TANAMAN LAINNYA
STERILISASI PERKECAMBAHAN BIBIT INDUKSI SUSPENSI SEL KULTUR DISPERSI SEL
Kultur Jaringan Tanaman 14
d. Untuk mendapatkan tanaman haploid
Tanaman haploid dapat diperoleh melalui kultur ovule, antera, atau mikrospora. Mikrospora adalah sel tunggal haploid, totipoten, dan tersedia dalam jumlah yang hampir tidak terbatas. Dengan teknik kultur mikrospora dapat dihasilkan tanamau haploid, penggandaan kromosom dapat dilakukan dengan agen pengganda kromosom, sehingga dapat dihasilkan tanaman haploid ganda (double haploid) yang homozigot. Tanaman haploid dan haploid ganda mempunyai nilai yang sangat berharga bagi pemulia tanaman.
Pada beberapa tanaman serealia penggandaan kromosom terjadi secara spontan, sehingga dapat langsung digunakan pada program pemuliaan tanaman. Varietas-varietas komersial telah diproduksi pada pemuliaan dengan menggunakan haploid ganda, misalnya gandum varietas Florin di Perancis (Henry dan De Buyser, 1990). Keunggulan utama dari tanaman haploid ganda tampak pada cepatnya homozigositas diperoleh, tanaman yang dihasilkan mencerminkan contoh acak dari rekombinasi gamet yang terjadi pada meiosis, dan ekspresi dari gen-gen resesif.
Untuk pengembangan varietas pada kebanyakan tanaman, tahapan kritis adalah pencapaian galur murni. Tanaman homozigot yang stabil adalah galur murni. Tanaman seperti itu digunakan sebagai varietas akhir atau sebagai induk untuk memproduksi biji hibrida. Secara tradisional, para pemulia mendapatkan tanaman homozigot dengan cara self-fertilization atau back cross, suatu proses yang memerlukan banyak waktu. Dengan teknik kultur mikrospora, sel-sel gamet jantan diinduksi menjadi embriogenik, sehingga tanaman haploid ganda dapat dihasilkan dalam satu generasi saja. Efisiensi seleksi juga dapat ditingkatkan dengan produksi tanaman haploid, karena fenotipe dari tanaman tidak tertutupi oleh efek dominan. Sifat resesif dan dominan sama-sama terekspresi dan karenanya lebih mudah diseleksi.
Kultur Jaringan Tanaman 15
e. Untuk penyimpanan plasma nutfah
Sejumlah tanaman dapat dilestarikan dengan biji, namun beberapa tanaman berbiji yang penting mempunyai biji yang terlalu besar untuk disimpan, misalnya kelapa. Beberapa tanaman lagi mempunyai biji yang kadar airnya terlalu banyak, misalnya durian, nangka sehingga tidak dapat disimpan terlalu lama. Bahkan ada tanaman yang tidak membentuk biji dan harus diperbanyak secara vegetatif, misalnya pisang. Hal-hal tersebut menjadikan cara
in vitro merupakan satu-satunya harapan sebagai jalan keluar.
Untuk penyimpanan dalam jangka pendek, pertumbuhan di dalam kultur jaringan dapat diperlambat dengan suhu rendah dan dengan penghambat osmosis. Sementara itu untuk penyimpanan jangka panjang sel-sel tumbuhan yang berupa kalus ditempatkan pada nitrogen cair dengan suhu antara 0 sampai - 198°C, sehingga metabolisme dan pertumbuhan terhenti sama sekali, proses ini disebut kriopreservasi (Cryopreservation).
f. Penyelamatan embrio
Kultur in vitro tumbuhan digunakan untuk menyelamatkan embrio yang secara normal abortif, kegagalan membentuk embrio ini disebabkan karena adanya inkompatibilitas. Pada postzygotic
incompatibility, setelah terjadi pembuahan terbentuklah zigot,
tetapi zigot ini tidak dapat diterima oleh endosperma sehingga embrio tidak dapat berkembang dan mengalami keguguran, misalnya terdapat pada hasil persilangan antara Solanum
melongena dengan S. khasianum. Embrio dapat diselamatkan
(embrio resque), dipisahkan dari tanaman induknya dan ditanam secara in vitro pada kondisi aseptik di dalam medium yang telah diketahui komposisinya.
Pada beberapa jenis tanaman, embrio dan cadangan makanannya sangat tidak berkembang sehingga tidak dapat berkecambah, misalnya pada biji anggrek, hanya terdiri dari
Kultur Jaringan Tanaman 16
kumpulan sel-sel yang sederhana. Untuk perkecambahan embrionya sangat tergantung pada suplai gula dari luar, di lingkungan alamiahnya disediakan oleh jamur Mycorrhiza yang hidup secara simbiotik di dalam biji anggrek. Karena infeksi oleh jamur ini tidak dapat terjadi pada semua biji yang terdapat di dalam buah anggrek, maka tidak semua biji dapat berkecambah. Dengan teknik kultur in vitro, biji anggrek dikecambahkan di atas medium secara aseptik, sehingga semua biji yang terdapat di dalam buah anggrek dapat berkecambah.
g. Mendapatkan tanaman bebas virus
Kultur jaringan juga dapat dipergunakan untuk menunjang penelitian penyakit tanaman terutama virus, yaitu dengan menggunakan teknik kultur meristem. Sementara itu, penggunaan praktis kultur organ dapat menunjang studi tentang infeksi
Nematoda, jamur Mycorrhiza, dan mekanisme pembentukan bintil
Kultur Jaringan Tanaman 17
Bab 2
Organisasi dan Fasilitas Laboratorium
Kultur Jaringan Tanaman
Teknik kultur jaringan (kultur in vitro) mensyaratkan kondisi steril, baik ruang, peralatan, bahan, maupun seluruh rangkaian kerjanya. Hal ini disebabkan karena pertumbuhan eksplan di dalam kultur harus selalu dalam kondisi aseptis. Untuk itu, semua tahapan pelaksanaan teknik kultur in vitro harus dilaksanakan di dalam laboratorium yang harus ditunjang oleh organisasi dan perlengkapan laboratorium yang memadai serta tata cara kerja yang teliti dari si peneliti.
Laboratorium tidak harus dibangun baru, ruang-ruang di dalam laboratorium yang sudah ada dapat direnovasi untuk keperluan kultur jaringan. Namun demikian pendirian laboratorium baru merupakan langkah yang terbaik. Laboratorium sebaiknya mempunyai pembagian ruangan yang diatur sedemikian rupa sehingga tiap kegiatan terpisah satu dengan yang lainnya, tetapi masih dapat saling berhubungan dan mudah dicapai. Dalam bagian ini akan diuraikan skema umum laboratorium kultur jaringan, prinsip dan fungsi ruang, serta peralatan yang ada di dalamnya. 2.1. Laboratorium Kultur Jaringan
Laboratorium yang baik untuk pekerjaan teknik kultur jaringan harus memenuhi kriteria: aman, bersih, dan memiliki organisasi dan penataan ruang yang sesuai. Lokasi dari laboratorium itu sendiri sebaiknya jauh dari sumber yang sering menimbulkan polusi. Kondisi bagian dalam laboratorium seperti lantai, dinding, meja, alat-alat yang digunakan, dan udara di
Kultur Jaringan Tanaman 18
ruangan laboratorium mutlak bersih. Diusahakan agar bebas dari debu, karena debu adalah sumber kontaminan yang paling potensial.
Selain itu, yang tidak menguntungkan adalah bahwa negara kita terletak di daerah beriklim tropis, debu-debu begitu banyak mendominasi ruangan udara di sekitar kita sehingga sulit untuk dihindari. Oleh karena itu sebagai upaya pembuatan laboratorium bebas debu, kita harus merancang laboratorium yang tertutup rapat tanpa ada ventilasi. Jendela-jendela dibuat permanen dari kaca (tidak bisa dibuka).
Di dalam ruangan, diberi pengatur udara (Air Conditioner,
AC) untuk mempertahankan suhunya konstan 25-28oC, dan
sebaiknya dipasang exhauster untuk menyedot debu yang ada di dalam ruangan. Lantai laboratorium juga harus dibersihkan secara rutin dengan antiseptik, meja dan dinding juga harus dibersihkan dengan larutan antiseptik. Umumnya permukaan meja dan dinding dilapisi dengan porselin supaya kedap air dan mudah dibersihkan. Ruangan di dalam laboratorium harus dijaga tetap bersih dan bebas dari debu, hewan kecil dan serangga.
Setiap orang yang akan masuk laboratorium harus melepas sepatunya dan menggantinya dengan alas kaki yang ada di dalam laboratorium serta harus mengenakan jas praktikum. Kebersihan laboratorium secara umum sangat menentukan keberhasilan kerja kultur jaringan. Sarana dasar seperti aliran listrik, air yang cukup dan gas harus dimiliki.
Pelaksanaan kerja kultur jaringan tumbuhan memiliki tahapan-tahapan dan urutan kerja yang khusus. Oleh karena itu laboratorium harus diatur sedemikian rupa sehingga ada tingkatan sterilitas ruangan sesuai dengan tahapan kerja tadi, termasuk alur keluar-masuknya pekerja di dalam laboratorium tersebut. Tahapan-tahapan kerja di dalam laboratorium kultur jaringan dibagi dalam empat kelompok yaitu:
Kultur Jaringan Tanaman 19
a. Persiapan
Merupakan tahap awal kerja kultur jaringan, dimulai dari penyiapan tanaman sebagai sumber eksplan yang ditanam di green
house, kemudian menyiapkan alat-alat, botol-botol kultur dan
pembuatan medium (meracik, merebus dan membaginya ke dalam botol-botol sampai pada sterilisasi).
b. Inokulasi
Inokulasi meliputi sterilisasi, pengambilan/pengirisan bagian tanaman yang akan dijadikan sebagai eksplan, kemudian menanamnya di dalam atau di atas medium buatan yang telah disediakan. Untuk inokulasi eksplan ini diperlukan kondisi yang absolut steril.
c. Pemeliharaan
Setelah diinokulasi, botol kultur diletakkan di rak-rak pemeliharaan di ruang inkubator untuk diikuti pertumbuhan dan perkembangannya sampai menjadi plantlet. Untuk pemeliharaan tersebut dibutuhkan ruang yang tidak perlu steril tetapi harus bersih, dengan pengatur suhu 25-28oC, dan pencahayaan dengan lampu neon (Tube Lamp, TL), 1000-3000 lux.
d. Aklimatisasi
Aklimatisasi merupakan proses penyesuaian/adaptasi
plantlet dari kondisi heterotrof di dalam botol kultur ke kondisi
autotrof yang dapat ditanam pada kondisi alamiahnya di tanah. Proses aklimatisasi dilaksanakan di dalam green house dengan memberikan perlakuan kelembaban, intensitas cahaya dan temperatur. Setelah melampaui masa aklimatisasi, tanaman dapat dibawa keluar dari green house untuk ditanam di lapangan.
Masing-masing tahapan pekerjaan tersebut harus terpisah satu dengan lainnya dan dengan menggunakan peralatan tersendiri. Berdasarkan adanya urutan tahapan kerja seperti tersebut di atas,
Kultur Jaringan Tanaman 20
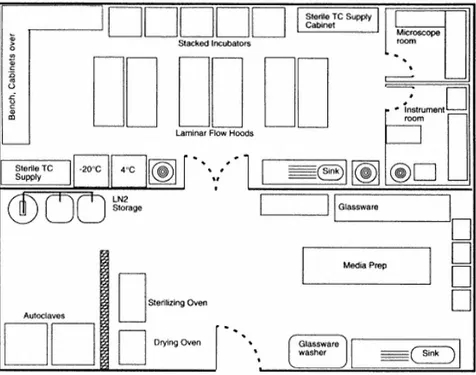
maka dasar penataan ruang laboratorium adalah urutan kegiatan dan sterilitas ruangan. Oleh karena itu pembagian ruangan laboratorium yang baik meliputi: (1) ruang persiapan, (2) ruang transfer (inokulasi) atau ruang steril, (3) ruang kultur (inkubator dan ruang plantlet), dan (4) ruang aklimatisasi (Gambar 2.1). (1) Ruang persiapan
Ruangan persiapan dipergunakan sebagai tempat untuk mempersiapkan eksplan, medium dan alat-alat. Ruang persiapan biasanya dibagi menjadi beberapa ruangan kecil yang dipergunakan untuk menyimpan medium dan alat-alat yang sudah steril, untuk menyimpan alat-alat gelas, bahan-bahan kimia dan pembuatan medium (ruang timbang), dan ruangan untuk mencuci. Persiapan eksplan yang dilakukan meliputi pencucian, dan pemotongan/pembuangan bagian-bagian tanaman yang tidak dipergunakan, serta perlakuan awal untuk mengurangi kontaminan yang ada di permukaan tanaman. Persiapan medium meliputi penimbangan bahan kimia medium, pengenceran medium, penuangan ke dalam wadah kultur dan sterilisasi. Sesuai dengan fungsinya, fasilitas yang dibutuhkan di dalam ruangan ini adalah meja tempat meletakkan alat-alat pemanas, meja untuk alat-alat timbang, meja untuk bekerja dan tempat mencuci, semua meja adalah statis dari beton dan beralas porselin.
Peralatan yang diletakkan di dalam ruangan ini terdiri dari: (1) oven, (2) magnetic stirrer dengan atau tanpa pemanas, (3) alat-alat gelas standar: labu takar berbagai ukuran pipet pasteur, (4)
erlenmeyer berbagai ukuran, gelas piala pengaduk gelas wadah
kultur: botol, tabung reaksi, cawan petri, (5) lemari alat-alat gelas, (6) alat-alat untuk mencuci, (7) rak-rak pengering, (8) alat-alat diseksi: spatula, pisau, scalpel, pinset, gunting, cutter, (9) borrer berbagai ukuran, (10) blender, (11) bidistilling water, (12) agarose
dispenser, (13) kompor gas, (14) autoclave, (15) lampu bunsen
Kultur Jaringan Tanaman 21
dan media ke ruang lain, dan (17) growth chamber, untuk praper-lakuan dingin pada tanaman berbunga, khususnya yang akan dipergunakan untuk kultur mikrospora.
Gambar 2.1. Penataan Ruangan Laboratorium Kultur Jaringan Tanaman
(2) Ruang timbang
Ruangan ini dipergunakan untuk tempat menyimpan bahan-bahan kimia medium dan mempersiapkan medium kultur. Persiapan medium kultur meliputi penimbangan bahan kimia medium, pengenceran larutan stok, membagi-bagi dalam botol kultur dan sterilisasi. Ruang timbang berhubungan langsung dengan ruang persiapan. Fasilitas yang diperlukan dalam ruangan ini adalah meja kerja dan meja untuk alat-alat timbang beralas porselin. Peralatan yang diletakkan di ruangan ini terdiri dari: (1) timbangan analitik, (2) lemari es dan freezer untuk menyimpan
Kultur Jaringan Tanaman 22
larutan stok, (3) hot plate dengan magnetic stirrer, (4) bunsen dengan kaki tiga, (5) pH meter, (6) lemari bahan kimia dan alat-alat (aluminum foil, kertas timbang, kertas saring, dsb.), (7) hood tempat penimbangan bahan-bahan kimia yang karsinogenik, dan (8) blender/homogenizer.
(3) Ruang stok
Ruang stok dipergunakan untuk menyimpan alat-alat steril dan medium yang sudah jadi (steril). Di dalam pelaksanaan teknik kultur jaringan, sebelum penanaman eksplan maupun sub-kultur dilakukan, medium kultur harus sudah disiapkan minimum tiga hari sebelum diperlukan. Medium yang sudah jadi harus disimpan di dalam ruangan yang dingin dan gelap. Fasilitas yang diperlukan di ruangan ini berupa meja kerja beralas porselin. Ruang stok harus berhubungan langsung dua arah, satu arah dengan ruang persiapan (setelah media disterilisasi di ruang persiapan, dapat langsung dibawa ke ruangan ini), dan arah yang lain dengan ruang transfer atau ruang steril, ruangan ini meskipun tidak harus steril tetapi kebersihannya harus tetap terjaga.
Alat-alat yang terdapat di ruangan ini meliputi: (1) kereta dorong, (2) rak-rak untuk meletakkan medium steril, dan (3) oven untuk menyimpan alat-alat steril.
(4) Ruang steril/transfer
Ruang transfer merupakan ruangan dimana semua kegiatan aseptis dimulai. Kegiatan yang dilakukan meliputi: sterilisasi, isolasi bagian-bagian tanaman dan penanaman eksplan dalam medium. Kegiatan subkultur, sterilisasi medium dengan ultra-filtrasi juga dilakukan di ruangan ini. Ruangan ini mutlak steril, sehingga sedapat mungkin bebas dari debu dan hewan kecil, dinding ruangan dilapis porselin atau bahan lain yang kedap air dan mudah dibersihkan. Ruangan ini juga dilengkapi dengan tempat cuci tangan sehingga memudahkan petugas yang akan
Kultur Jaringan Tanaman 23
memulai dengan pekerjaan aseptis, pengatur suhu (AC), lampu
ultra violet dan lampu TL biasa. Ruang transfer harus terisolasikan
sedemikian rupa tetapi masih dapat berhubungan dengan ruang stok, ruang inkubasi, dan ruang mikroskop. Pintu penghubung harus selalu dalam keadaan tertutup.
Ruang transfer dilengkapi dengan alat-alat sebagai berikut: (1) laminar air flow cabinet (LAFC), peralatan utama untuk melakukan pekerjaan aseptis, (2) dissecting microscope, (3) cart yang selalu disemprot dengan alkohol 70%, (4) alat-alat diseksi:
scalpel, pinset, spatula, gunting, jarum, (5) millipore filter, (6) syrink, (7) hand sprayer untuk alkohol, (8) tempat alkohol, (9)
bunsen burner/lampu alkohol/bacticinerator, (10) entkas, (11) timbangan kecil, (12) electrofusion chamber, (13) vacum pump, dan (14) centrifuge, untuk proses isolasi mikrospora dan protoplas. (5) Ruang inkubasi/kultur
Ruang kultur merupakan ruang besar dengan kemungkinan perluasan bila diperlukan. Kebersihannya harus diperhatikan dan sedapat mungkin dihindari terlalu banyak keluar-masuknya orang-orang yang tidak berkepentingan. Ruangan ini dipergunakan untuk memelihara eksplan yang telah ditanam pada medium secara aseptis. Kultur yang telah tumbuh dan memperbanyak diri, secara terarur harus disubkultur, tergantung dari jenis eksplan dan tipe kultur. Subkultur dilakukan setiap 3-6 minggu sekali, hal ini berarti tiap bulan ada pelipatan jumlah kultur.
Botol-botol kultur diatur dengan menempatkannya pada rak-rak terbuka yang bertingkat (3-4 tingkat) dengan lampu
fluorescent, jarak tiap tingkat 40-50 cm. Jarak antara rak harus
diatur sedemikian rupa sehingga memudahkan lalulintas pemeriksa kultur. Di dalam ruang kultur, lingkungan fisik diatur sedemikian rupa sehingga mendukung pertumbuhan yang optimal. Untuk itu perlu ada pengaturan terhadap suhu dan cahaya. Unsur-unsur dari
Kultur Jaringan Tanaman 24
cahaya yang perlu diperhatikan adalah kualitas, lama penyinaran, dan intensitas cahaya.
Kualitas cahaya. Cahaya putih merupakan cahaya yang
baik untuk pertumbuhan kultur. Lampu fluorescent (TL) biasa digunakan sebagai sumber cahaya dalam ruang kultur. Keseimbangan spektrum lampu fluorescent sangat baik dan efisien dalam penggunaan energi bila dibandingkan dengan lampu pijar. Bentuk lampu memungkinkan penyebaran cahaya yang baik, dengan panas yang dikeluarkan relatif rendah, bila transformer dapat diletakkan di luar ruang kultur. Pada lampu pijar hampir 90% merupakan enersi panas sehingga mempengaruhi suhu ruangan. Pada ruang kultur juga dapat diberikan campuran lampu pijar dan f1uorescent secara bersamaan.
Intensitas cahaya. Intensitas cahaya yang baik dari lampu
fluorescent adalah antara 100-400 foot candle (l000-4000 lux).
Intensitas cahaya diatur dengan menempatkan sejumlah lampu dengan kekuatan tertentu pada jarak antara 40-50 cm dari tabung kultur pada luas area tertentu.
Lama penyinaran. Seberapa lama cahaya harus diberikan
pada eksplan sehingga berpengaruh positif terhadap
pertumbuhannya, sangat tergantung dari jenis tanaman dan respon yang diinginkan. Untuk proses morfogenesis, umumnya diperlukan pencahayaan terus menerus, sebaliknya untuk induksi kalus umumnya tidak memerlukan pencahayaan. Untuk pertumbuhan
plantlet, yang segera akan dilakukan aklimatisasi, umumnya
memerlukan periode penyinaran selama 14-16 jam. Panjang penyinaran diatur dengan alat automatic timer switch atau timer.
Suhu. Suhu di dalam ruang kultur yang baik adalah pada
suhu normal yaitu antara 25-28°C. Pengaturan suhu dilakukan dengan menggunakan AC, karena ruang kultur merupakan ruang tertutup yang sedikit sekali mempunyai aliran udara bebas. Beberapa perlakuan khusus kadang-kadang memerlukan suhu
Kultur Jaringan Tanaman 25
rendah (18-20°C), sehingga diperlukan adanya growth chamber yang dapat diatur suhu dan pencahayaannya.
Alat-alat yang diperlukan di dalam ruang kultur adalah: (1) rak-rak kultur 3-4 tingkat dengan lampu fluorescent, jarak tiap tingkat 40-50 cm, (2) timer untuk mengatur lama penyi-naran, (3) AC untuk mengontrol suhu ruangan, (4) binocular microscope dan
loupe/kaca pembesar, (5) tangga aluminium untuk melihat kultur
di rak yang tinggi, (6) shaker, untuk inkubasi kultur dengan medium cair.
(6) Ruang mikroskop
Ruangan ini dipergunakan untuk pengamatan dan analisa selama kultur berjalan, reaksi suatu kultur dalam media perlakuan sering diikuti sejak awal inisiasi. Untuk membedakan morfologi eksplan atau struktur internal pada kultur mikrospora, sel dan protoplas yang terjadi pada awal perkembangannya, diperlukan bantuan mikroskop. Untuk keperluan tersebut dipergunakan
binocular microscope (stereoscope), inverted microscope, fluorescent microscope, yang dilengkapi dengan peralatan untuk
fotografi. Penelitian-penelitian yang lebih canggih seperti fusi protoplas, microinjection DNA atau organel ke dalam sel atau protoplas, memerlukan mikroskop dengan mikro manipulator. Ruangan ini harus senantiasa kering/tidak lembab dan bersih, untuk pengoperasian fluorescent microscope, diperlukan ruangan yang gelap total. Meja dari beton untuk tempat meletakkan mikroskop diperlukan di dalam ruangan ini.
Alat-alat yang terdapat di dalam ruangan ini adalah: (1)
inverted microscope, (2) stereoscope, (3) student microscope, (4) fluorescent microscope, (5) micromanipulator, (6) alat-alat
fotografi, dan (7) alat-alat untuk pengamatan sitologis, misalnya gelas preparat dan penutup, jarum, microtome dan sebagainya.
Kultur Jaringan Tanaman 26
Bab 3
Media Tanam Kultur Jaringan Tanaman
Salah satu faktor penentu keberhasilan pelaksanaan kerja kultur jaringan adalah pemberian nutrisi dalam jumlah dan perbandingan yang benar pada medium kultur. Medium yang dipergunakan pada kultur in vitro tumbuhan ada bermacam-macam. Pemilihan medium tergantung pada jenis tanaman yang digunakan, selera, tujuan serta perhitungan masing-masing peneliti. Isi dan komposisi medium kultur dirancang secara khusus untuk tujuan yang berbeda. Medium MS, singkatan dari nama penemunya, Murashige dan Skoog atau LS, singkatan dari Linsmaier dan Skoog merupakan medium yang sangat banyak digunakan untuk kultur kalus dan regenerasi berbagai tanaman, medium ini mengandung garam-garam mineral dengan konsentrasi tinggi dan senyawa N dalam bentuk ammonium dan nitrat; medium B5 (Gamborg) banyak digunakan untuk kultur suspensi sel tanaman leguminosae.Nitsch dan Nitsch (NN), dan N6 (Chu) banyak digunakan untuk serealia dan tanaman lain; medium WPM (Lloyd dan McCown) untuk kultur jaringan tanaman berkayu; Vacin dan Went (VW) dan Knudson (C) banyak digunakan untuk anggrek; medium Kao dan Michayluk digunakan untuk kultur protoplas Cruciferae,
Gramineae dan Leguminosae. Pada dasarnya tidak ada satu macam
medium kultur yang dapat memberikan pertumbuhan optimal untuk semua sel, penggantian medium atau salah atau komponen medium seringkali diperlukan untuk merespon setiap tipe pertumbuhan dari satu macam eksplan. Studi literatur sangat diperlukan untuk mengembangkan atau memodifikasi medium kultur, modifikasi dari medium kultur yang telah ada umumnya
Kultur Jaringan Tanaman 27
didasarkan pada trial and error.
3.1. Komponen Dasar Medium Kultur Jaringan
Pada prinsipnya medium diberikan kepada sel-sel tanaman
in vitro dengan maksud memberikan nutrisi sesuai dengan
kebutuhan sel-sel tanaman tersebut secara alami sebagai tanaman utuh yang tumbuh di alam. Tumbuhan di alam bebas bersifat autotrof, memerlukan nutrisi sederhana yang terdapat di dalam tanah berupa garam-garam mineral dan air untuk meneruskan siklus hidupnya. Hal ini dapat dipahami karena sebagian terbesar tubuh tumbuhan tersusun atas unsur-unsur penyusun zat anorganik tersebut. Pada kultur in vitro tumbuhan, untuk keperluan hidupnya, sel-sel pada eksplan juga memerlukan nutrisi yang komposisinya jauh lebih komplek karena eksplan sedikit banyak telah kehilangan sifat autotrofnya.
Komponen dasar medium kultur dapat bermacam-macam, secara umum medium kultur jaringan harus mengandung unsur-unsur sebagai berikut:
a. Garam-garam anorganik: (1) unsur makro: C, H, O, N, S, P, K,
Ca, dan Mg; (2) unsur mikro: Cl, S, Mo, Zn, Cu, Fe, dan Co;
b. Zat-zat organik: (1) gula, (2) Myo-Inositol, (3) vitamin, (4)
asam-asam amino, dan (5) zat pengatur tumbuh;
c. Substansi organik komplek: (1) air kelapa, (2) ekstrak
buah-buahan, (3) ekstrak ragi (yeast), (4) pepton, (5) tripton, dan (6) hydrolisat kasein;
d. Bahan pemadat: (1) agar-agar, (2) gelrite, (3) phytagel, dan (4)
sea plaque agarose;
e. pH, dan
Kultur Jaringan Tanaman 28
Kebutuhan zat-zat anorganik
Unsur makro. Air merupakan zat terbanyak pada tubuh tumbuhan,
oleh karena itu air juga merupakan bagian terbesar di dalam medium kultur. Air selain sebagai bahan untuk membentuk material tubuh, juga sebagai medium untuk reaksi-reaksi kimia dan fisika. Air juga berguna untuk transpor dan distribusi zat-zat yang terlarut di dalamnya. Pada medium kultur jaringan digunakan air murni yang sudah mengalami demineralisasi, deionisasi dan didestilasi dengan gelas dua kali.
Kebutuhan garam-garam mineral di dalam jaringan kurang lebih sama dengan tanaman lengkap. Garam-garam mineral merupakan gabungan unsur-unsur esensial makro dan mikro. Konsentrasi optimum dari tiap-tiap komponen untuk mencapai kecepatan pertumbuhan yang maksimal sangat bervariasi. Menurut Gamborg dan Shylluk (1981) biasanya berkisar 25-60 mM.
Unsur makro dibutuhkan dalam jumlah cukup besar, pada umumnya diberikan dalam bentuk persenyawaan. George dan Sherrington (1984) menyebutkan beberapa persenyawaan nutrisi makro yang umum digunakan pada medium kultur jaringan, antara lain: KNO3; NH4NO3; Ca(NO3).4H2O; NaNO3; CaCl2.2H2O;
MgSO4.7H2O; KCl; KH2PO4; NH4H2PO4; NaH2PO4.2H2O;
Na2SO4; (NH4)2SO4; NH4Cl; K2SO4.
Nitrogen (N). Nitrogen diberikan dalam bentuk
persenyawaan yang bermacam-macam, antara lain: KNO3;
NH4NO3; Ca(NO3).4H2O; NaNO3; NH4H2PO4; (NH4)2SO4;
NH4Cl. Kebutuhan terbesar adalah untuk menyusun asam-asam
nukleat, protein, sebagai koenzim atau persenyawaan lain yang mengandung N seperti klorofil, alkaloid, derivat purin dan pirimidin dan beberapa hormon endogen. Sumber nitrogen pada medium kultur adalah ion ammonium (NH4)+ dan nitrat (NO3)-.
Jumlah ion ammonium yang digunakan berkisar antara 2-8 mM, sedangkan nitrat berkisar antara 25-40 mM. Pengambilan unsur
Kultur Jaringan Tanaman 29
nitrat memerlukan pH rendah, sebaliknya pengambilan ammonium menyebabkan pembebasan H- sehingga medium menjadi asam. Medium Murashige dan Skoog (MS) menyediakan nitrogen dalam bentuk garam NH4N03, ini merupakan strategi yang baik dan
mempunyai keuntungan ganda, karena selain sumber N-nya lengkap juga dalam bentuk garam efeknya terhadap penurunan pH medium berkurang (George dan Sherrington, 1984).
Fosfor (P). Fosfor diberikan pada medium kultur jaringan
dalam bentuk persenya-waan KH2PO4 atau K2HPO4; NH4H2PO4;
NaH2PO4. Ion PO4- total yang diberikan pada medium bervariasi
antara 0,5 - 20 mM.L-1. Unsur P di dalam sel diubah menjadi persenya-waan RNA dan DNA, zat-zat yang sangat penting yang bertanggung jawab atas sifat-sifat keturunan. Unsur P diperlukan sebagai aktifator enzim untuk memacu pertumbuhan pada jaringan meristematik. Kelebihan unsur P dapat menghambat pertumbuhan eksplan, karena akan terjadi persaingan penyerapan dengan unsur lain seperti seng (Zn), besi (Fe) dan tembaga (Cu).
Kalium (K). Kalium diberikan pada medium dalam bentuk
KNO3; KH2PO4 atau K2HPO4, KCl dan K2SO4. Ion K+ total yang
diberikan pada medium bervariasi antara 1,837 - 25,180 mM.L-1. Unsur K sangat diperlukan untuk memacu pembelahan sel, sintesa karbohidrat dan protein, pembuatan klorofil serta untuk mereduksi nitrat (Kyte, 1983). Kalium berpengaruh pada hidratasi, menambah atau mengurangi hidratasi pada misel sehingga mempengaruhi masuknya nutrien ke dalam sel.
Sulfur (S). Sulfur atau belerang diberikan pada medium
dalam bentuk: MgSO4.7H2O; (NH4)2SO4; K2S04; FeSO4.7H2O;
MnSO4.4H2O; ZnSO4.7H2O; CuSO4.5H2O. Pemberian bele-rang
berkisar antara 0,75-3,00 mM.L-1. Sulfur ada di dalam beberapa molekul protein dan enzim yang selain berguna untuk memacu perkembangan akar, juga berguna untuk ketahanan atau proteksi tubuh tumbuhan. Belerang diserap dalam bentuk SO4-, antara lain
Kultur Jaringan Tanaman 30
dijadikan aneurin, biotin, persenyawaan asam amino yang ada belerangnya misalnya, cystein dan methionin.
Calsium (Ca). Kalsium atau kapur diberikan pada medium
dalam bentuk: Ca(NO3).4H2O; CaCl2H2O; Ca3(PO4). Pemberian
ion Ca berkisar antara 1-3 mM.L-1. Pemakaian Ca-nitrat ada kelemahannya karena sangat higroskopis, sehingga di dalam wadahnya seringkali dijumpai kristalnya berair. Sebaiknya Ca-nitrat dibuat larutan stok dan disimpan di dalam kulkas. Ca-fosfat juga ada kelernahannya yaitu tidak mudah larut. Untuk melarutkannya, sejumlah tertentu Ca-fosfat dimasukkan ke dalam
Erlenmeyer 50 ml, kemudian diberi tetes HCl 0,1 N, campuran ini
digojok sambil dipanasi sampai larut (tampak jernih). Kalsium diperlukan untuk pembentukan dinding primitif, sebagai Ca-pectat yaitu bagian integral dari dinding sel, penting sebagai kation selular dan kofaktor enzim. Kalsium mempengaruhi hidratasi, permeabilitas dan penyerapan nutrien. Kalsium juga empengaruhi tingginya pH, menetralissasikan racun, misalnya pada asam oksalat. Asam oksalat dengan Ca akan menjadi Ca-oksalat berbentuk kristal dan diisolasi atau dimumifikasikan di dalam sel tertentu menjadi sel-sel kristal.
Magnesium (Mg). Magnesium terutama diberikan pada
medium dalam bentuk MgSO4.7H2O. Magnesium diperlukan
sebagai elemen utama dalam pembentukan klorofil, berperan penting sebagai aktivator enzim terutama dalam proses fosforilasi dan sintesis protein degan cara membentuk komplek enzim-substrat.
Unsur mikro. Unsur hara mikro adalah unsur yang diperlukan
dalam jumlah sedikit. Fungsinya belum diketahui secara pasti, tetapi tidak adanya zat-zat ini dapat menyebabkan kelainan pertumbuhan. Air dan bahan kimia yang tingkat kemurniannya rendah seringkali terkontaminasi oleh unsur hara mikro. Bentuk persenyawaan hara mikro yang umum digunakan pada beberapa
Kultur Jaringan Tanaman 31
medium kultur menurut George dan Sherrington (1984) adalah: MnSO4.4H2O; ZnSO4.7H2O; H3BO3; KI; CuSO4.5H2O;
NaMoO4.2H2O; CoCl2.6H2O; FeCl3.6H2O; Fe III citrate;
FeSO4.7H2O; NaFeEDTA; Na2EDTA.2H2O; Fe(SO4)3; Fe III
tartrate.
Besi (Fe). Besi diperlukan dalam jumlah sedikit lebih
banyak daripada unsur mikro yang lain, berikan dalam bentuk
chelat. Pemberian Fe bersama-sama dengan NaEDTA
dimaksudkan agar besi tetap pada jangkauan pH yang luas dalam jangka waktu yang lama hingga dapat diserap oleh jaringan tanaman. Fe berperan penting dalam sintesis klorofil, konversi energi pada fotosintesis dan respirasi dengan melakukan reduksi oksidasi, bagian dari sitokrom. Besi diberikan pada medium kultur jaringan berupa FeCl3.6H2O; Fe III trate; FeSO4.7H2O;
NaFeEDTA 2H2O; Fe(SO4); Fe III tartrate.
Boron (Bo). Boron diberikan pada medium kultur sebagai
asam borat (boric acid, H3BO3). Berperan dalam translokasi
karbohidrat, juga terlibat dalam diferensiasi seluler dan per-kembangan. Ikatan boron organis memungkinkan adanya diferensiasi dan penyusunan struktur halus dari dinding sel sehingga memudahkan transport karbohidrat dan penyerapan ion ke dalam sel; sebagai aktifator dan inaktifator bagi zat pengatur tumbuh. Kalau boron kurang, zat pengatur tumbuh menjadi terlalu banyak sehingga menghambat pertumbuhan.
Molybdenum (Mo). Molibdenum diberikan pada medium
sebagai sodium molybdat (Na2MoO4.2H2O), berpartisipasi pada
konversi nitrogen ke ammonia dan fiksasi nitrogen, ikut dalam metabolisme protein, sintesis asam askorbat, dan kofaktor enzim.
Manganese (Mn). Manganese merupakan elemen esensial
yang terdapat pada membran kloroplas, berperan sebagai aktivator enzim dengan bertindak sebagai perantara pada proses fosforilasi atau sebagai gugus redoks Mn2+. Bahan pembentuk klorofil dan
Kultur Jaringan Tanaman 32
aktif dalam fotosintesis, metabolisme protein dan pembentukan vitamin C. Pada medium kultur diberikan dalam bentuk MnSO4.
Cobalt (Co). Cobalt merupakan e1emen dari molekul
vitamin B kompleks, esensial untuk fiksasi nitrogen. Pada medium kultur jaringan diberikan dalam bentuk persenyawaan Cobalt
Chloride (CoCl2).
Zincum (Zn). Zincum berperan sebagai aktivator enzim,
penyusun khlorofil, pemacu pembentukan zat pengatur tumbuh terutama IAA. Pada medium kultur jaringan diberikan dalam bentuk zinc sulphate (ZnSO4).
Cuprum (Cu). Cuprum merupakan bagian dari enzim, Cu
bereaksi menjadi komponen phenolase, lactase dan askorbat
oksidase. Ikut ambil bagian dalam proses fotosintesis dan reduksi
nitrit. Cuprum diberikan pada medium kultur jaringan dalam bentuk Cupric sulfate (CuSO4 5H2O).
Chlorine (Cl). Chlorine sebagai ion berpengaruh terhadap
aktifitas enzim, memacu proses fotosintesis. Chlorine diberikan pada medium kultur jaringan berupa Calcium Chloride (CaCl2).
3.2. Kebutuhan zat-zat organik
Zat-zat organik adalah persenyawaan yang mengandung karbon, ditambahkan pada medium kultur jaringan berupa gula, myo-inositol, vitamin, asam-asam amino dan zat pengatur tumbuh. Zat-zat organik tersebut biasanya tidak diberikan pada tanaman karena tanaman dapat mensintesis sendiri, tetapi pada kultur in
vitro, karena eksplan yang digunakan umumnya berukuran sangat
kecil dan tidak mampu mensintesis sendiri semua zat-zat organik tersebut, maka zat-zat organik harus ditambahkan pada medium.
Gula. Tumbuhan di alam bebas mencukupi kebutuhan gula
dengan mengasimilasi CO2 pada roses fotosintesa, dengan
pertolongan klorofil dan sinar matahari, dijadikan glukosa, kemudian dijadikan pati, selulose dan persenyawaan-persenyawaan
Kultur Jaringan Tanaman 33
lain. Pada kultur in vitro, sel dan jaringan tumbuhan belum sempurna dalam melakukan asimilasi fotoautotrof, sehingga di perlukan gula sebagai sumber karbon dan energi. Selain sebagai sumber energi bagi sel dan jaringan, gula juga berfungsi sebagai penjaga keseimbangan tekanan osmotik potensial di dalam medium. Gula pada umumnya diberikan pada medium kultur berupa sukrosa atau komponen-komponennya seperti mono-sakarida glukosa atau fruktosa. Sukrosa pada medium kultur ditambahkan sebanyak 30 g.L-l. Glukosa atau D-glukosa biasanya ditambahkan dengan konsentrasi 20- 30 g.L-1, tergantung dari jenis
eksplan. Sukrosa ternyata lebih berpengaruh dalam perkembangan kalus, sedangkan pengaruhnya terhadap organogenesis belum dapat dipastikan (George dan Sherrington, 1984). Pada kultur mikrospora beberapa spesies tanaman digunakan maltosa. Maltosa dihidrolisis lebih lambat dibandingkan dengan sukrosa, ini memberi pengaruh yang lebih baik pada mikrospora yaitu dapat memacu embriogenesis (Indrianto et al., 1999).
Myo-Inositol. Myo-Inositol ditambahkan pada medium
untuk membantu diferensiasi dan pertumbuhan jaringan. Myo-Inositol ikut serta dalam beberapa reaksi metabolik penting yang berhubungan dengan. pembelahan sel. Myo-Inositol merupakan perantara pada perubahan glukosa menjadi asam galakturonat, juga sebagai prazat untuk pektin dan penyusun dinding sel.
Vitamin. Vitamin ditambahkan pada medium untuk
mempercepat pertumbuhan, diferensiasi kalus. Vitamin berfungsi sebagai kofaktor atau bagian dari molekul kofaktor dari reaksi-reaksi enzimatis penting, vitamin juga bertungsi protektif. Seperti halnya zat pengatur tumbuh, vitamin juga mempengaruhi (menstimulasi) inisiasi, pertumbuhan dan perkembang-an akar. George dan Sherrington (1984) memasukkan beberapa macam vitamin yang umum digunakan pada berbagai medium dasar, antara lain: Thiamin-HCl, Nicotinic acid, Pyridoxin-HCl,
Ca-D-Kultur Jaringan Tanaman 34 panthothenate, Folic acid, Choline chloride, dan Riboflavin, yang
sesemuanya merupakan anggota dari vitamin B kompleks.
Ascorbic acid dan adenin juga sering ditambahkan pada medium.
Vitamin labil terhadap pemanasan, dianjurkan untuk selalu menggunakan filter steril jika akan ditambahkan pada medium.
Thiamin merupakan vitamin yang esensial terdapat pada hampir
semua medium kultur jaringan tumbuhan yang cenderung mempercepat pembelahan sel pada meristem akar tetapi tidak berpengaruh terhadap pemanjangan sel. Thiamin merupakan bagian prostetik yang terdapat di dalam sel, berperan sebagai koenzim dalam reaksi yang menghasilkan enersi dari karbohidrat dan memindahkan enersi. Thiamin diberikan dalam jumlah yang bervariasi dari kira-kira 0,1 sampai 30 mg.L-1 (Doods dan Roberts, 1983). Nicotinic acid (niacin) penting dalam reaksi-reaksi enzimatis di samping peranannya sebagai prekursor dari beberapa alkaloid. Ascorbic acid sering ditambahkan pada medium, terutama untuk mencegah terjadinya pencoklatan (browning) pada permukaan irisan jaringan yang disebabkan karena terjadinya reaksi oksidasi senyawa polyphenol menjadi quinon yang berwarna coklat sehingga vitamin di sini berfungsi sebagai antioksidan.
Asam-asam amino. Asam amino merupakan sumber N
organik, penyusun protein dan asam nukleat, lebih cepat diserap oleh sel dan jaringan tanaman dari pada N anorganik di dalam medium kultur jaringan. Adapun asam amino yang umum ditambahkan pada medium adalah: Glutamine, Glycine, L-Cyteine, L-Arginine, L-Aspartic acid, dan L-Methionine.
Zat pengatur tumbuh. Selain nutrisi, zat pengatur tumbuh
sangat diperlukan sebagai komponen medium bagi pertumbuhan, perkembangan dan diferensiasi. Zat pengatur tumbuh aktif pada konsentrasi rendah dan diproduksi di dalam tubuh tanaman itu sendiri (endogen). Untuk keperluan kultur jaringan, telah dibuat zat pengatur tumbuh sintetik. Tanpa zat pengatur tumbuh,
Kultur Jaringan Tanaman 35
pertumbuhan eksplan akan terhambat bahkan mungkin tidak tumbuh sama sekali. Zat pengatur tumbuh dikelompokkan ke dalam beberapa grup: Auksin, Sitokinin, Gibberellin, Abscisic acid, dan Ethylene.
Auksin. Indole-3-acetic acid (IAA) merupakan auksin
alamiah yang terdapat pada sebagian besar tumbuhan. Disintesis dari tryptophane terutama di primordia daun, daun muda dan pada kecambah. IAA di transport dari sel ke sel dengan arah basipetal (dari pucuk ke akar). IAA berperan dalam mempengaruhi pemanjangan sel; pembelahan sel; diferensiasi jaringan vaskuler; inisiasi pembentukan akar; mempengaruhi dominasi apikal; zona absisi pada daun dan buah; pembungaan; pemasakan buah, dan lain-lain. IAA mudah larut dalam alkohol. Penggunaan IAA pada medium kultur kerap kali kurang menguntungkan karena mudah rusak oleh cahaya, oksidasi enzimatik dan pemanasan pada saat proses sterilisasi dengan autoclave. Penggunaan auksin sintetik lebih menguntungkan karena lebih stabil. Auksin sintetik yang umum digunakan pada medium adalah: 2,4-dichlorophenoxyacetic
acid (2,4-D); l-naphthaleneacetic acid (NAA) dan indole-3-butyric acid (IBA). Beberapa persenyawaan seperti dicamba (3,6-dichloro-O-anisic acid) dan picloram
(4-amino-3,5,6-trichloro-2-pyridinecarboxilic acid) pada konsentrasi tinggi merupakan
herbisida, digunakan sebagai auksin substitusi.
Kultur in vitro tumbuhan yang pada mulanya memerlukan auksin eksogen untuk pertumbuhannya, secara gradual atau bahkan secara tiba-tiba dapat hilang dan tidak memerlukan auksin lagi, hal yang demikian disebut sebagai habituasi terhadap auksin. Penggunaan auksin secara tunggal pada umumnya sudah cukup mampu untuk menginduksi pembentukan dan pertumbuhan kalus, tetapi untuk beberapa tanaman yang rekalsitran akan lebih membantu jika menggunakan lebih dari satu jenis auksin secara simultan.
Kultur Jaringan Tanaman 36
Pada kultur jaringan tanaman monokotil, terutama rumput-rumputan dan palma, juga pada kultur in vitro umbi akar wortel, memerlukan auksin sintetik seperti 2,4-D dengan dosis yang cukup tinggi. Penghilangan atau pengurangan kadar auksin pada sub kultur berikutnya dapat memacu produksi embrio somatik atau organ adventiv. Pertumbuhan kultur juga dapat dipacu dengan penambahan substansi yang dapat mengatur tingkatan IAA endogen misalnya, dopamine dapat menghambat aktifitas IAA oksidase sehingga tidak terjadi oksidasi terhadap IAA. Akibatnya, pertumbuhan jaringan dan organ pada kultur in vitro menjadi lebih baik. Penghambat sintesis auksin seperti 5-hydroxy-nitrobenzyl
bromide (HNB) dan 7-azaindole memacu embriogenesis somatik
pada kultur kalus citrus yang telah mengalami habituasi.
Sitokinin. Sitokinin adalah derivat dari adenin, kinetin (6-furfuryl-aminopurin) dan zeatin adalah sitokinin alami yang umum
digunakan secara meluas pada medium kultur. Sitokinin disintesis melalui modifikasi biokimia dari adenin, terjadi pada ujung akar dan biji yang tumbuh. Kebalikan dari auksin, sitokinin ditransport melalui xylem dari akar ke pucuk. Sitokinin hanya aktif jika ada auksin, pemberian sitokinin bersama auksin pada medium kultur dapat memacu pembelahan sel dan morfogenesis. Sitokinin mempengaruhi transport auksin, pertumbuhan kuncup lateral (mematahkan dominasi apikal), perkembangan daun, menghambat proses penuaan daun dan mempengaruhi perkembangan kloroplas. Sitokinin sintetik seperti N-6-benzyl-aminopurine (BAP) lebih sering digunakan pada medium kultur jaringan.
Phenylurea, substansi aktif yang terdapat pada air kelapa
mempunyai efek yang sama dengan zeatin, penggunaannya memerlukan konsentrasi yang lebih tinggi. Thidiazuron (N-enyl-N-1,2,3-thiazol-5-ylurea), yang secara komersial digunakan sebagai
defoliant, karena kemampuannya untuk menstimulasi produksi ethylene, dapat digunakan untuk memacu pembentukan dan
Kultur Jaringan Tanaman 37
proliferasi tunas in vitro. Substansi lain yang mempunyai aktifitas seperti sitokinin adalah endosperma cair pada kecambah jagung.
Diferensiasi selular dan morfogenesis in vitro terutama dikendalikan oleh interaksi antara konsentrasi auksin dan sitokinin yang diberikan pada medium kultur. Manipulasi rasio auksin: sitokinin dapat mempengaruhi organogenesis, pada perbandingan auksin sitokinin yang tinggi memacu pembentukan akar, perbandingan yang sebaliknya akan memacu pembentukan tunas. Jika perbandingan auksin sitokinin seimbang hanya terbentuk kalus.
Gambar 3. 1. Efek auksin + sitokinin (George dan Sherrington, 1984)
Ada beberapa perkecualian:
a. Proliferasi tunas aksiler pada beberapa spesies tanaman dapat dipacu dengan auksin bersama sitokinin.
b. Induksi kalus pada beberapa monokotil dapat dipacu pada medium yang ditambahkan auksin dengan konsentrasi tinggi tanpa sitokinin.
Kultur Jaringan Tanaman 38
dengan auksin konsentrasi rendah atau tanpa auksin.
Gibberelin (GA). Pada 1926 Kurasawa mendapatkan
kecambah padi yang tumbuh abnormal karena terinfeksi oleh sejenis jamur Gibberella fujikuroy. Substansi yang menyebabkan pertumbuhan seedling padi menjadi sangat cepat (abnormal) tadi diketahui sebagai gibberelic acid (GA3). GA merupakan zat
pengatur tumbuh yang dalam bentuk larutan pada suhu tinggi mudah kehilangan sifatnya sebagai zat pengatur tumbuh. GA merupakan keluarga persenyawaan yang didasarkan pada struktur
entgibberellane. Ada 34 GA yang telah diidentifikasi secara kimia,
beberapa diantaranya ditemukan pada embrio dimana dapat memicu produksi alfa amilase yang dapat mengubah cadangan makanan pada biji menjadi gula sehingga dapat digunakan oleh embrio untuk pertumbuhannya. GA disintesis dari asam mevalonat pada jaringan muda dari tunas dan biji yang sedang berkecambah, ditransport di dalam xylem dan phloem. GA berpengaruh pada pertumbuhan batang, pembesaran dan pembelahan sel, induksi perkecambahan biji, produksi enzim selama perkecambahan, dan pembentukan bunga. Seperti halnya auksin, GA juga dapat memacu pembentukan akar.
George dan Sherrington (1984) mengatakan bahwa pemacuan pembentukan akar dapat terjadi karena GA dapat menyebabkan peningkatan jumlah auksin endogen pada medium kultur yang biasa digunakan adalah GA3.
Kultur Jaringan Tanaman 39
Tabel 3.1. Zat pengatur tumbuh yang umum digunakan pada kultur jaringan
Zat Pengatur Tumbuh Singkatan Berat Molekul
Absisic acid ABA 264,3
Indole-3-acetic acid IAA 175,2
Naphthalene ecetic acid NAA 186,2
2,4-Dichlorophenoxy acetic acid 2,4-D 221,04
Indole-3-butyric acid IBA 203,2
6-Purfurylaminopurine Kinetin 215,2 6-Benzylaminopurine BA 225,2 N6-(∆2-isopentenyl)-adenine 2iP 203,3 Trans-6-(4-hydroxy-3-methylbut-2-enyl) aminopurine Zeatin 219,2
Gibberellic acid GA3 346,4
Abscisic acid (ABA). Abscisic acid adalah persenyawaan
tunggal dengan berat molekul 264,31 larut dalam NaHCO3 cair,
kloroform, aceton dan ether. ABA disintesis dari asam mevalonat
pada daun-daun tua terutama sebagai respon terhadap stres air (kekeringan). ABA ditransport dari daun melalui phloem, ABA dapat bergerak ke akar di dalam phloem dan kemudian kembali ke pucuk melalui xylem. ABA berperan pada penutupan stomata, transport fotosintat ke arah biji-biji yang sedang tumbuh. Pada kultur in vitro tumbuhan, ABA digunakan untuk menginduksi embriogenesis mikrospora, ABA juga dapat menghambat proses perkecambahan yang terlalu dini pada embrio somatik .
Ethylene. Ethylene adalah zat pengatur tumbuh yang
berbentuk gas, disintesis dari methionine di dalam berbagai jaringan tumbuhan sebagai respon terhadap stres. Pada umum-nya, gas ethylene disintesis pada jaringan-jaringan yang mengalami