ISOLASI SENYAWA DITERPENOIDA DARI EKSTRAK
METANOL DAUN TUMBUHAN MERAMBUNG
(Vernonia arborea Buch-Ham.)
TESIS
Oleh :
MANIUR ARIANTO SIAHAAN
087006033/KIM
PROGRAM PASCA SARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ISOLASI SENYAWA DITERPENOIDA DARI EKSTRAK
METANOL DAUN TUMBUHAN MERAMBUNG
(Vernonia arborea Buch-Ham.)
TESIS
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar
Magister Sains Dalam Program Studi Ilmu Kimia Pada Fakultas
Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Oleh
MANIUR ARIANTO SIAHAAN
087006033/KIM
PROGRAM PASCA SARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENGESAHAN TESIS
Judul Tesis
:
ISOLASI SENYAWA DITERPENOIDA DARI EKSTRAK METANOL DAUN TUMBUHAN MERAMBUNG (Vernonia arborea Buch-Ham.)Nama : MANIUR ARIANTO SIAHAAN
Nomor Pokok
: 087006033
Program Studi
: Magister Kimia
Fakultas :
Matematika
dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Menyetujui
Komisi Pembimbing
(Prof.Dr. Tonel Barus) (Lamek Marpaung, M.Phil, Ph.D)
Ketua Anggota
Ketua Program Studi Ilmu Kimia Dekan FMIPA
PERNYATAAN ORISINALITAS
ISOLASI SENYAWA DITERPENOIDA DARI EKSTRAK
METANOL DAUN TUMBUHAN MERAMBUNG
(Vernonia arborea Buch-Ham.)
TESIS
Dengan ini saya menyatakan bahwa saya mengakui semua karya
tesis ini adalah hasil kerja saya sendiri kecuali kutipan dan
ringkasan yang tiap satunya telah dijelaskan sumbernya dengan
benar.
Medan, 10 Agustus 2010
PERNYATAAN PERSETUJUAN PUBLIKASI
KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Sumatera Utara, saya yang bertanda tangan di bawah ini:
N a m a : Maniur Arianto Siahaan
N I M : 087006033
Program Studi : Magister Kimia
Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan
kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (
Non-Exclusive Royalty Free Right) atas Tesis/Disertasi saya yang berjudul: Isolasi Senyawa Diterpenoida dari Ekstrak Metanol Daun Tumbuhan Merambung (Vernonia arborea Buch-Ham.)
Beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti
Non-Eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih
media, memformat, mengelola dalam bentuk data-base, merawat dan
mempublikasikan Tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarnya.
Medan, 10 Agustus 2010
RIWAYAT HIDUP
DATA PRIBADI
Nama Lengkap berikut gelar : Maniur Arianto Siahaan, Ssi
Tempat dan Tanggal Lahir : Gonting, 27 Oktober 1976
Alamat Rumah : Jl. Ngumban Surbakti Gg. Bahagia
Kompleks Fans Truly No. 101 Tanjung
Sari, Medan
Telepon : 081370005553
Email : ha51an@hotmail.com
Instansi Tempat Bekerja : Kopertis Wilayah I
Alamat Kantor : Tanjung Sari, Medan
DATA PENDIDIKAN
SD : SD Negeri Lobusiregar Tamat : 1989
SMP : SMP Negeri 3 Siborongborong Tamat : 1992
SMA : SMA Negeri Siborongborong Tamat : 1995
Strata-1 : FMIPA USU Tamat : 2001
KATA PENGANTAR
Segala puji, hormat dan syukur kepada Tuhan Pencipta Langit dan Bumi yang dengan segala kehendakNya penulis dapat merampungkan penelitian dan dapat melaporkan hasilnya dalam tesis ini.
Terima kasihku kepada ayahanda yang telah dipanggil Tuhan untuk selama-lamanya, atas kasih sayangnya yang tulus seumur hidupnya kepada setiap kami anak-anaknya. Begitu juga dengan Ibunda yang selalu tulus menyayangi, dengan pengorbanannya yang luar biasa khususnya kepada saya pribadi, yang setiap hari selalu mendoakan kami anak-anaknya agar berhasil dan semakin rendah hati.Tuhanlah yang akan memberikan berkat umur panjang, kesehatan dan kekuatan kepada Ibunda tercinta. Hormat dan terimakasih kepada abang dan kakak saya, Rosma Siahaan, Risda Siahaan, Charles Siahaan, Elvis Leonard Siahan, Tumbur Siahaan beserta keluarga, begitu juga kepada istri saya Tiur Nuria Lusia Situngkir yang saya sayangi. Tuhan kita Yesus Kristus yang akan memberkati, mengangkat kita menjadi pemenang dalam kehidupan ini.
Dengan segala kerendahan hati, penulis mengucapkan terima kasih sebesar-besarnya kepada :
1. Rektor Universitas Sumatera Utara, Prof. Dr. dr. Syahril Pasaribu,
DTM&H, M.Sc (CTM), Sp. A(K) atas kesempatan yang diberikan kepada kami untuk mengikuti dan menyelesaikan pendidikan Program Magister.
2. Bapak Prof. Dr. Tonel Barus selaku dosen pembimbing I dan Bapak
Lamek Marpaung, M.Phil, Ph.D. selaku dosen pembimbing II yang telah banyak memberikan pengarahan dan bimbingan hingga terselesaikannya penelitian dan penulisan tesis ini.
3. Bapak Prof.Basuki Wirjosentono, MS,Ph.D dan Bapak Prof.Dr.Harry
Agusnar, M.Sc.,M.Phil selaku Ketua dan Sekretaris Jurusan Program Studi Kimia Pasca Sarjana Universitas Sumatera Utara.
4. Bapak dan Ibu Dosen yang telah memberikan waktu untuk mengarahkan
dan memotivasi selama masa studi penulis di Pasca Sarjana Universitas Sumatera Utara.
5. Pemerintah Republik Indonesia melalui Dikti atas beasiswa BPPS yang
penulis terima selama perkuliahan program pasca sarjana di Universitas Sumatera Utara.
6. Bapak dan Ibu pegawai administrasi di kantor program pasca sarjana
USU Medan.
7. Ibu Ivan Elisabeth Purba, M.Kes selaku Ketua STIKES Mutiara
Indonesia, Bapak Burhan dari STIKES Mutiara Indonesia yang telah banyak membantu penulis, serta semua staf STIKES Mutiara Indonesia tempat penulis mengajar.
8. Kepala, Staf dan seluruh asisten Laboratorium Kimia Bahan Alam, yang
9. Rekan-rekan seperjuangan mahasiswa program studi Kimia Pasca Sarjana Universitas Sumatera Utara tahun 2008, Sri Widyaningsih, Andi Chandra, Meilani, Kasman Edi, Kak Ani,Bu Yun, Kak Re dan Pak Bagus.
10.Kepada Bapak Rusmana dan Achmad Darmawan selaku staf administrasi
dan analis di Pusat Penelitian Kimia LIPI Serpong-Tangerang, yang telah membantu penulis dalam menganalisis sampel.
11.Rekan-rekan di Bimbingan Belajar One Science Institute (OSCI) yang
melayani dengan sepenuh hati dan totalitas, Nangin’06, Jefri, Lasker, Novri, Tumpak, Selvy, Anand, Rega,beserta seluruh siswa angkatan pertama OSCI.
Penulis menyadari bahwa tesis ini masih banyak kekurangan, karena keterbatasan penulis baik dalam literatur maupun pengetahuan. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun demi kesempurnaan thesis ini dan semoga bermanfaat bagi yang membaca.
Medan, 10 Agustus 2010 Penulis
ISOLASI SENYAWA DITERPENOIDA DARI EKSTRAK
METANOL DAUN TUMBUHAN MERAMBUNG
(Vernonia arborea Buch-Ham.)
ABSTRAK
Isolasi senyawa terpenoida yang terkandung di dalam daun tumbuhan
Merambung (Vernonia arborea Buch-Ham.) telah dilakukan dengan cara
ekstraksi maserasi dengan menggunakan pelarut metanol. Ekstrak metanol yang diperoleh dipekatkan dan diekstraksi partisi dengan n-heksan. Fraksi n-heksana
dipekatkan dan dikromatografi kolom menggunakan fasa gerak CHCl3 : MeOH
(80 : 20)v/v dan fasa diam Silika gel 40 (70-230 mesh ASTM). Senyawa yang
telah dimurnikan diperoleh dalam bentuk gum berwarna cokelat 55 mg. Senyawa ini diidentifikasi dengan menggunakan spektroskopi Ultraungu-Tampak (UV-Vis,. Spektroskopi Infra Merah (FT-IR), Spektrofotometer Resonansi Magnetik
Inti Proton (1H-RMI) dan Spektrofotometer Resonansi Magnetik Inti Karbon
(13C-RMI) . Dari data hasil spektrum tersebut dapat disimpulkan bahwa senyawa tersebut adalah senyawa diterpenoida.
ISOLATION OF DITERPENOID COMPOUND FROM
THE METHANOL EXTRACT OF THE LEAVES OF
MERAMBUNG
(Vernonia arborea Buch-Ham.)
ABSTRACT
Terpenoid compound was isolated from the leaves of Merambung (Vernonia
arborea Buch-Ham.) by using maceration technique with solvent of methanol.
Methanol extract that gained from the maceration was concentrated and partition extracted with n-hexane. Methanol fraction put into column chromatography, elucidated with mobile phase CHCl3 : MeOH (80 : 20)v/v and
stationary phase is Silica gel 40 (70-230 mesh) ASTM. The compound was purified like gum form and gained about 55 mg . The compound was analised by using Spectroscopy Ultraviolet-Visible (UV-Vis), Infra Red (FT-IR),Nuclear Magnetic Resonance Proton (1H-NMR )and Carbon-13 Nuclear Magnetic Resonance (13C-NMR). Data from the spectrum showed that the compound could be considered one of the diterpenoid compound.
DAFTAR ISI
Halaman
KATA PENGANTAR i
ABSTRAK iii
ABSTRACT iv
DAFTAR ISI v
DAFTAR LAMPIRAN viii
DAFTAR TABEL ix
BAB I. PENDAHULUAN 1.1. Latar Belakang 1
1.2. Perumusan Masalah 2
1.3. Tujuan Penelitian 2
1.4. Manfaat Penelitian 2
1.5. Lokasi Penelitian 2
1.6. Metodologi Penelitian 3
BAB II. TINJAUAN PUSTAKA 2.1. Tumbuhan Merambung 4
2.2. Senyawa Terpenoida 5
2.2.1. Hemiterpenoid 5
2.2.2. Monoterpenoid 5
2.2.3. Seskuiterpenoid 6
2.2.4. Diterpenoid 7
2.2.5. Triterpenoid 8
2.2.6. Tetraterpenoid 8
2.2.7. Terpenoid campur 9
2.3. Biosintesis Senyawa Terpenoid 9
2.4. Senyawa Diterpenoid 12
2.4.1. Diterpen Alisiklis 13
2.4.2. Diterpen Monosiklik 14
2.4.3. Diterpen Disiklik 15
2.4.4. Diterpen Trisiklik 16
2.5. Teknik Pemisahan 2.5.1. Pemisahan Kimia 18
2.5.2. Pemisahan Fisika 18
2.6. Ekstraksi 18
2.6.1. Tujuan Ekstraksi 19
2.6.2. Prinsip Ekstraksi 19
2.6.2.1. Prinsip Maserasi 19
2.6.2.3. Prinsip Sokletasi 20
2.6.2.4. Prinsip Refluks 21
2.6.2.5. Prinsip Destilasi Uap Air 21
2.6.2.6. Prinsip Rotavapor 21
2.6.2.7. Prinsip Ekstraksi Cair-cair 22
2.6.2.8. Prinsip Kromatografi lapis Tipis 22
2.6.2.9. Prinsip Penampakan Noda 22
2.7. Kromatografi 23
2.7.1. Kromatografi Lapisan Tipis 24
2.7.1.1. Pembuatan Lapisan Tipis 25
2.7.2. Kromatografi Kolom 27
2.7.2.1. Pengisian Kolom 27
2.7.3. Kromatografi Preparatif 27
2.7.4. Harga Rf 29
2.8. Teknik Spektroskopi 30
2.8.1. Spektroskopi Infra Merah (IR) 30
2.8.2. Spektrofotometri 1H-NMR 32
2.8.3. Spektroskopi 13C-NMR 35
BAB III. METODA PENELITIAN
3.1. Alat-alat 38
3.2. Bahan-bahan 39
3.3. Prosedur Penelitian 39
3.3.1. Penyediaan Sampel 39
3.3.2. Uji Pendahuluan terhadap Ekstrak daun tumbuhan
Merambung 39
3.3.2.1. Uji Busa 39
3.3.2.2. Skrining Fitokimia 39
3.3.2.3. Analisis KLT 40
3.3.3. Prosedur untuk memperoleh Senyawa Kimia dari Ekstrak
Daun Tumbuhan Merambung 40
3.3.4. Isolasi Senyawa Terpenoida dengan
Kromatografi Kolom 41
3.3.5. Uji Kemurnian Hasil Kromatografi dengan KLT 41
3.3.6. Analisis Spektroskopi Senyawa Hasil Isolasi 42
3.3.6.1. Analisis Senyawa Hasil Isolasi dengan
Spektroskopi UV-Visible 42 3.3.6.2. Analisis Senyawa Hasil Isolasi dengan
Spektroskopi FT-IR 42
3.3.6.3. Analisis Senyawa Hasil Isolasi dengan
Spektroskopi 1H-NMR 42
3.3.6.4. Analisis Senyawa Hasil Isolasi dengan
Spektroskopi 13C-NMR 42
BAB IV. HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian 44
4.2. Pembahasan 46
BAB V. KESIMPULAN DAN SARAN
5.1. Kesimpulan 50
5.2. Saran 51
DAFTAR PUSTAKA 52
DAFTAR LAMPIRAN
No. Keterangan halaman
1. Lampiran A: Foto Daun Tumbuhan Merambung 54
2. Lampiran B: Determinasi Tumbuhan Merambung 55
3. Lampiran C: Kromatogram Lapisan Tipis Ekstrak
Metanol daun Tumbuhan Merambung dengan
penampakan noda dibawah sinar ultraviolet 56
4. Lampiran D: Kromatogram Lapisan Tipis Ekstrak
n-Heksana daun Tumbuhan Merambung hasil kromatografi
dengan penampakan noda dibawah sinar ultraviolet 57
5. Lampiran E: Spektrum Ultraviolet-Tampak (UV-Vis)
Senyawa hasil isolasi 58
6. Lampiran F: Spektrum Inframerah (FT-IR)
senyawa hasil isolasi 59
7. Lampiran G: Spektrum Resonansi Magnetik Inti Proton
(1H-NMR) senyawa hasil isolasi 60
8. Lampiran H: Spektrum Resonansi Magnetik Karbon
(13C-NMR) senyawa hasil isolasi 61
DAFTAR TABEL
No Keterangan halaman
ISOLASI SENYAWA DITERPENOIDA DARI EKSTRAK
METANOL DAUN TUMBUHAN MERAMBUNG
(Vernonia arborea Buch-Ham.)
ABSTRAK
Isolasi senyawa terpenoida yang terkandung di dalam daun tumbuhan
Merambung (Vernonia arborea Buch-Ham.) telah dilakukan dengan cara
ekstraksi maserasi dengan menggunakan pelarut metanol. Ekstrak metanol yang diperoleh dipekatkan dan diekstraksi partisi dengan n-heksan. Fraksi n-heksana
dipekatkan dan dikromatografi kolom menggunakan fasa gerak CHCl3 : MeOH
(80 : 20)v/v dan fasa diam Silika gel 40 (70-230 mesh ASTM). Senyawa yang
telah dimurnikan diperoleh dalam bentuk gum berwarna cokelat 55 mg. Senyawa ini diidentifikasi dengan menggunakan spektroskopi Ultraungu-Tampak (UV-Vis,. Spektroskopi Infra Merah (FT-IR), Spektrofotometer Resonansi Magnetik
Inti Proton (1H-RMI) dan Spektrofotometer Resonansi Magnetik Inti Karbon
(13C-RMI) . Dari data hasil spektrum tersebut dapat disimpulkan bahwa senyawa tersebut adalah senyawa diterpenoida.
ISOLATION OF DITERPENOID COMPOUND FROM
THE METHANOL EXTRACT OF THE LEAVES OF
MERAMBUNG
(Vernonia arborea Buch-Ham.)
ABSTRACT
Terpenoid compound was isolated from the leaves of Merambung (Vernonia
arborea Buch-Ham.) by using maceration technique with solvent of methanol.
Methanol extract that gained from the maceration was concentrated and partition extracted with n-hexane. Methanol fraction put into column chromatography, elucidated with mobile phase CHCl3 : MeOH (80 : 20)v/v and
stationary phase is Silica gel 40 (70-230 mesh) ASTM. The compound was purified like gum form and gained about 55 mg . The compound was analised by using Spectroscopy Ultraviolet-Visible (UV-Vis), Infra Red (FT-IR),Nuclear Magnetic Resonance Proton (1H-NMR )and Carbon-13 Nuclear Magnetic Resonance (13C-NMR). Data from the spectrum showed that the compound could be considered one of the diterpenoid compound.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Bangsa Indonesia telah lama mengenal dan menggunakan obat tradisional,
misalnya dari tumbuhan, binatang dan mineral. Penggunaan tumbuh-tumbuhan
tersebut sebagai ramuan obat untuk penyakit-penyakit tertentu. Ini merupakan
suatu bukti bahwa didalam ramuan obat tersebut terdapat senyawa-senyawa
kimia yang sangat berkhasiat. ( Hariana, 2004)
Tumbuh-tumbuhan termasuk salah satu sumber bahan alam hayati yang
memegang peranan penting sebagai sumber zat kimia berkhasiat yang terdapat
dialam. Kimia bahan alam selalu menarik perhatian para ahli kimia untuk
mencari senyawa baru.
Senyawa kimia beserta derivat-derivatnya yang bermanfaat untuk kehidupan
pada tumbuhan merupakan proses yang sangat menarik untuk dipelajari sehingga
mendorong perhatian peneliti untuk mengenal dan mengetahui struktur senyawa
hasil isolasi senyawa kimia yang terkandung pada tumbuhan. Indonesia termasuk
salah satu negara yang mempunyai banyak tumbuhan berkhasiat. Salah satu
tumbuhan tersebut adalah Merambung,yang lebih sering disebut Sembung Jawa
(Vernonia arborea Buch-Ham.) Bagian yang sering digunakan sebagai obat adalah daun, akar yang berfungsi sebagai obat luar pada luka, terpukul, bisul,
koreng, kulit gatal-gatal.
(http://www.smallcrab.com/kesehatan/25-healthy/410-manfaat-daun-sembung).
Penelitian terhadap tumbuhan ini belum banyak dilakukan. Namun dari studi
Manjunatha, 2005, menyimpulkan bahwa ekstrak metanol daun Vernonia arborea memberikan efek aktivitas penyembuhan luka yang baik.
Dari hasil fitokimia yang dilakukan terhadap daun tumbuhan Vernonia
arborea dengan menggunakan pereaksi-pereaksi terpenoida memberikan hasil yang positif.
1.2. Perumusan Masalah
Bagaimana cara mengisolasi senyawa diterpenoida dari daun tumbuhan
Merambung (V. arborea Buch-Ham.)
1.3. Tujuan Penelitian
Untuk dapat mengisolasi senyawa diterpenoida yang terdapat dalam daun
tumbuhan Merambung.
1.4. Manfaat Penelitian
Untuk memberikan informasi tentang senyawa diterpenoid dari ekstrak daun
tumbuhan Merambung kepada orang-orang yang mendalami kimia organik bahan
alam.
Untuk menambah sumber senyawa diterpenoida dari tumbuhan.
1.5. Lokasi Penelitian
1. Tempat pengambilan sampel
Sampel yang digunakan diambil dari koleksi tanaman Lamek Marpaung, di jalan
Karya Wisata komplek Johor Indah Permai Blok H-15.
2. Tempat Penelitian
Penelitian dilakukan di Laboratorium kimia bahan alam, FMIPA, Universitas
Sumatera Utara, sedangkan analisis spektrum FT-IR, 1H-NMR dan 13C-NMR
1.6. Metodologi Penelitian
Untuk mengisolasi senyawa diterpenoid digunakan daun tumbuhan
merambung, berupa serbuk halus kering sebanyak 2000 gram. Tahap awal
dilakukan uji skrining fitokimia dengan menggunakan pereaksi-pereaksi untuk
senyawa terpenoida, yaitu pereaksi Lieberman-Burchard yang memberikan warna
merah jingga atau ungu dan uji noda pada KLT dari ekstrak metanol dengan
menggunakan pereaksi Cerium(IV) Sulfat sebagai pemfiksasi.
Tahap isolasi yang dilakukan:
1. Ekstraksi Maserasi
2. Ekstraksi Partisi
3. Analisis Kromatografi Lapis Tipis
4. Analisis Kromatografi Kolom
Tahapan analisis hasil isolasi yang dilakukan adalah:
1. Analisis Kromatografi Lapis Tipis, untuk menentukan harga Rf
2. Identifikasi dengan menggunakan Spektrometri Infra Merah (FT-IR),
1
BAB II
TINJAUAN PUSTAKA
Bangsa Indonesia telah lama mengenal pengobatan secara
tradisional,misalnya dengan tumbuhan,binatang dan mineral. Penggunaan
tumbuh-tumbuhan tersebut sebagai ramuan obat untuk penyakit-penyakit
tertentu,ini merupakan suatu bukti bahwa di dalam ramuan obat tersebut terdapat
senyawa-senyawa kimia yang berkasiat. Keaneka ragaman tumbuhan yang
terdapat di Indonesia merupakan salah satu kekayaan alam yang perlu untuk di
budidayakan.Tumbuh-tumbuhan ini dapat digunakan sebagai bahan obat hasil
alam yang mengandung zat-zat kimia yang terdapat di alam.
Penggunaan ramuan obat-obatan yang berasal dari tumbuh-tumbuhan sampai
saat ini masih banyak dikembangkan oleh sebagian masyarakat yang kita kenal
sebagai jamu,baik jamu yang berupa sirup maupun bubuk. Ini membuktikan
bahwa didalam ramuan obat-obatan tersebut mengandung senyawa-senyawa
kimia yang berkasiat mengobati penyakit(Hariana, 2004)
2.1. Merambung (Vernonia arborea Buch-Ham. )
Nama umum Indonesia : Merambung, Hamirung, sembung dedek (Jawa)
(http://www.plantamor.com/index.php?plant=1469)
Klasifikasi
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Famili : Asteraceae
Genus : Vernonia
Species : Vernonia arborea Buch-Ham
2.2 Senyawa Terpenoida
Senyawa terpenoida berasal dari molekul isoprene CH2=C(CH3)-CH=CH2
dan kerangka karbonnya dibangun oleh penyambungan dua atau lebih satuan C5
ini. Kedua senyawa – senyawa itu dibagi – bagi menjadi beberapa golongan
berdasarkan jumlah satuan yang terdapat di dalam senyawa tersebut; dua (C10),
tiga (C15), empat (C20), enam (C30), atau delapan (C40) satuan. Terpenoida terdiri
atas beberapa macam senyawa, mulai dari komponen minyak atsiri, yaitu
monoterpenoida dan seskuiterpenoida yang mudah menguap (C10 dan C15),
diterpena yang lebih sukar menguap (C20), sampai senyawa yang tidak menguap,
yaitu triterpenoida dan sterol (C30), serta pigmen karotenoida (C40 ). (Harborne,
JB.1987)
Berikut ini merupakan tipe dari terpenoid:
2.2.1. Hemiterpenoid
Contohnya prenol, asam isovalerat.
Isoprena terdapat langka dalam tumbuhan tetapi memang terdapat dalam
dedaunan. Contoh lain dari hemiterpenoid ini adalah isoamilalkohol,iso
valeraldelhida, asam senesioat, asam tiglat, asam angelat dan asam -furoat.
2.2.2. Monoterpenoid
Contohnya geraniol.
Monoterpenoid terbentuk dari dua satuan isoprena dan biasanya mempunyai
minyak atsiri dan mempunyai makna ekonomi besar sebagai bau-rasa,
wewangian dan pelarut. Monoterpenoid khas berupa cairan tak berwarna, tidak
larut dalam air, dapat disuling uap dan berbau harum. Contoh monoterpenoid lain
seperti mirsena, lavandol, geranial, keton artemisia, perinia, α-felandrena,
pulegon, menton, mentofuran, mentol, 1,8 sinesol, eukarvon, kripton, safranal,
nepelakton, askaridol dan lain-lain.
2.2.3. Seskuiterpenoid
Contohnya farnesol, kurkumen, bisabolol.
Seskuiterpenoid adalah senyawa C15 biasanya dianggap berasal dari tiga
satuan isoprena. Seperti monoterpenoid, seskuiterpenoid terdapat sebagai
komponen minyak atsiri yang tersuling uap dan berperan penting dalam aroma
kepada buah dan bunga. Kegunaan kaidah isoprena secara umum dan
kadang-kadang kekecualian yang disebutkan terdahulu berlaku juga untuk golongan ini.
Anggota seskuiterpenoid asiklik ialah farnesol dengan alkohol yang tersebar luas.
Farnesol pirofosfat merupakan senyawa antara kunci dalam biosintesis terpenoid.
Sebagian besar seskuiterpenoid monosiklik mempunyai kerangka farnesol yang
tertutup membentuk cincin anggota 6. Contoh seskuiterpenoid yaitu -bisabolena,
zingiberena, lanseol, ar-turmeron, perezon dan asam (S)-absisat.
Salah satu seskuiterpenoid monosiklik terpenting adalah asam absisat,
hormon yang melawan efek giberelin dan menghambat pertumbuhan kuncup.
Sejumlah senyawa C13 berasal dari seskuiterpenoid telah diketahui penyebabnya
bermakna bau-rasa buah. Banyak senyawa seskuiterpenoid yang diketahui
mempunyai efek fisiologi terhadap hewan dan tumbuhan. Sementara beberapa
senyawa seskuiterpenoid ada yang mengandung gugus fungsi lakton yang
beracun yang merupakan kandungan tumbuhan obat. Senyawa lain bekerja
sebagai penolak serangga dan insektisida, beberapa merangsang pertumbuhan
tumbuhan, dan bekerja sebagai fungisida. Selain gugus fungsi lakton juga
dialdehida ini menyebabkan beberapa tumbuhan pedas dan juga aktif sebagai
penolak serangga.
Contoh seskuiterpenoid monosiklik biasa adalah humulen, zerumbon, elemol
dan nootkatin. Seskuiterpenoid bisiklik seperti α-kadinena, guaiol, -selinena,
eudesmol, santonin, kesil alkohol, vetivon dan artabsin. Seskuiterpenoid tidak
biasa seperti iresin, karyofilena, eremofilon, akoron, sedrol, kuparena, tujopsena.
2.2.4. Diterpenoid
Contohnya kafestol
Diterpenoid merupakan senyawa C20 yang berasal dari empat satuan
isoprenoid. Karena titik didihnya yang tinggi biasanya diterpenoid tidak
ditemukan dalam minyak atisri tumbuhan meskipun diterpenoid bertitik didih
rendah pun. Senyawa ini ditemukan dalam damar, eksudat berupa gom dan dalam
fraksi bertitik didih tinggi seperti damar yang tersisa setelah penyulingan minyak
atsiri. Misalnya, rosin yang tersisa setelah penyulingan terpentin pinus kaya akan
diterpenoid.
Diterpenoid mencakup beberapa senyawa dari segi fisiologi sangat menarik
seperti golongan hormon tumbuhan yang dikenal sebagai giberelin. Seperti
seskuiterpenoid, diterpenoid mencakup banyak senyawa yang bekerja sebagai
fungisida, racun terhadap hewan, penolak serangga dan sebagainya. Senyawa ini
dapat bersifat karsinogen.
Beberapa senyawa ini mempunyai efek racun atau efek penolakan terhadap
serangga sementara senyawa lainnya menarik serangga. Beberapa senyawa
mempunyai aktivitas antivirus, sebagai fungisida dan pembentukannya disulut
oleh infeksi fungus. Satu senyawa dari kemangi mempunyai aktivitas hormon
remaja. Forskolin dari Coleus forskohli merupakan pengaktif khas adenilat
siklase. Partenolida dari parthenum tanacetum berguna untuk mengobati migrain
karena menghambat pelepasan serotonin.
Contoh senyawa diterpenoid adalah fitol, asam giberelat, α-kamforena,
2.2.5. Triterpenoid
Contohnya lanosterol, bahan dasar bagi senyawa-senyawa steroid.
Triterpenoid memiliki atom C30. Triterpenoid tersebar luas dalam damar,
gabus dan kutin tumbuhan. Damar adalah asam triterpenoid yang sering
bersama-sama dengan gom polisakarida dalam damar gom. Triterpenoid alkohol juga
terdapat bebas dan sebagai glikosida.
Triterpenoid asiklik yang penting hanya hidrokarbon skualena yang diisolasi
untuk pertama kali dari minyak hati ikan hiu tetapi juga ditemukan dalam
beberapa malam epikutikula dan minyak nabati (minyak zaitun). Senyawa
triterpenoid yang paling dikenal seperti lanosterol yang terdapat dalam lemak
wol, khamir dan beberapa senyawa tumbuhan tinggi. Triterpenoid tetrasiklik
seperti alkohol eufol dari euphorbia sp dan asam elemi dari canarium commune.
Triterpenoid yang terpenting ialah triterpenoid pentasiklik. Senyawa ini
ditemukan dalam tumbuhan seprimitif sphagnum tetapi yang paling umum adalah
pada tumbuhan berbiji, bebas dan glikosida. Triterpenoid nonglikosida sering
ditemukan sebagai ekskresi dan dalam kutikula bekerja sebagai pelindung atau
menimbulkan ketahanan terhadap air.
Beberapa macam aktivitas fisiologi dari triterpenoid yang merupakan
komponen aktif dari tumbuhan telah digunakan sebagai tumbuhan obat untuk
penyakit diabetes, gangguan menstruasi, patukan ular, gangguan kulit, kerusakan
hati dan malaria.
2.2.6. Tetraterpenoid
Tetraterpenoid yang paling dikenal adalah karotenoid-pigmen larut dalam
lemak berwarna kuning sampai merah terdapat pada semua tumbuhan dan dalam
lemak berbagai jenis jaringan. Pigmen hidrokarbon disebut karoten dan
turunannya yang teroksigenasi disebut xantofil. Dikenal juga tetraterpenoid
Karotenoid sebagai reseptor cahaya untuk fototropisme. Sebagai pigmen
bunga karotenoid mungkin berperan dalam menarik serangga tetapi sebagian
besar perhatian dicurahkan pada fungsinya sebagai pigmen daun. Senyawa ini
terdapat pada kloroplas dan terikat secara longgar pada protein.Karotenoid yang
paling tersebar luas adalah - karoten.
2.2.7. Terpenoid campur
Terpenoid campur adalah aneka golongan senyawa yang tampaknya
terbentuk terutama dari satuan isoprena tetapi mengandung atom karbon
tambahan atau jumlah atomnya kurang dari seharusnya. Kelompok paling umum
dari golongan ini adalah furan alam.
( http://www.scribd.com/doc/28436179/Terpenoid-dari-bahan-hayati-laut)
2.3. Biosintesis Senyawa Terpenoida
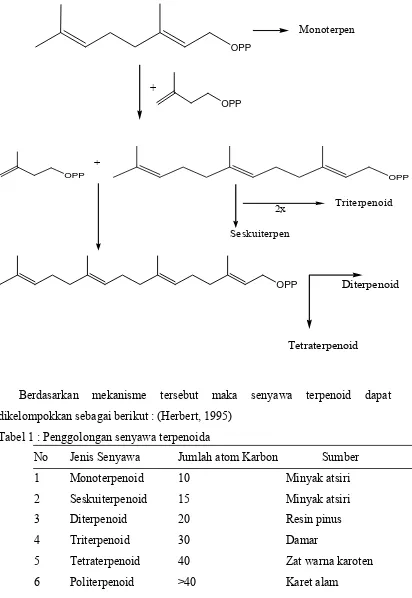
Secara umum biosintesa dari terpenoid dengan terjadinya 3 reaksi dasar yaitu :
1. Pembentukan isopren aktif berasal dari asam asetat melalui asam mevalonat
2. Penggabungan kepala dan ekor dua unit isopren akan membentuk mono-,
seskui-, di-, sester- dan poli-terpenoid
3. Penggabungan ekor dan ekor dari unit C-15 atau C-20 menghasilkan
triterpenoid dan steroid
Mekanisme dari tahap-tahap reaksi biosintesa terpenoid adalah asam asetat
setelah diaktifkan oleh koenzim A melakukan kondensasi jenis Claisen
menghasilkan asam asetoasetat. Senyawa yang dihasilkan ini dengan asetil
koenzim A melakukan kondensasi jenis aldol menghasilkan rantai karbon
bercabang sebagaimana ditemukan pada asam mevalonat. Reaksi-reaksi
berikutnya adalah fosforilasi, eliminasi asam fosfat dan dekarboksilasi
menghasilkan Isopentenil pirofosfat (IPP) yang selanjutnya berisomerisasi
isopren aktif bergabung secara kepala ke ekor dengan DMAPP dan
penggabungan ini merupakan langkah pertama dari polimerisasi isopren untuk
menghasilkan terpenoid. Penggabungan ini terjadi karena serangan elektron dari
ikatan rangkap IPP terhadap atom karbon dari DMAPP yang kekurangan elektron
diikuti oleh penyingkiran ion pirofosfat yang menghasilkan Geranil pirofosfat
(GPP) yaitu senyawa antara bagi semua senyawa monoterpenoid.
Penggabungan selanjutnya antara satu unit IPP dan GPP dengan mekanisme
yang sama menghasilkan Farnesil pirofosfat (FPP) yang merupakan senyawa
antara bagi semua senyawa seskuiterpenoid. senyawa diterpenoid diturunkan dari
Geranil-Geranil Pirofosffat (GGPP) yang berasal dari kondensasi antara satu unit
IPP dan GPP dengan mekanisme yang sama.
Mekanisme biosintesis senyawa terpenoid adalah sebagai berikut :
H3C C SCoA
O
+
H3C C SCoA
O
H3C C
H2 C O C SCoA O
H3C C
H2
C C SCoA
OH O
CH2 C SCoA
O H3C C
H2
C C OH
OH O
CH2 CH2 OH
H3C C
H2
C H2C OPP
CH2
H3C C CH CH2 OPP
CH3
IPP DMAPP
OPP
+
OPP
OPP
Monoterpen
OPP
+
OPP
+
OPP
Triterpenoid
Seskuiterpen 2x
OPP Diterpenoid
Tetraterpenoid
Berdasarkan mekanisme tersebut maka senyawa terpenoid dapat
[image:28.612.136.548.83.681.2]dikelompokkan sebagai berikut : (Herbert, 1995)
Tabel 1 : Penggolongan senyawa terpenoida
No Jenis Senyawa Jumlah atom Karbon Sumber
1 Monoterpenoid 10 Minyak atsiri
2 Seskuiterpenoid 15 Minyak atsiri
3 Diterpenoid 20 Resin pinus
4 Triterpenoid 30 Damar
5 Tetraterpenoid 40 Zat warna karoten
2.4. Senyawa Diterpenoida
Senyawa diterpenoid merupakan senyawa yang beraneka ragam yang
mempunyai kerangka karbon C20 yang berasal dari 4 unit isopren. Barangkali,
satu-satunya diterpenoid yang tersebar di semesta ialah senyawa induk asiklik
dari deret senyawa tersebut, yaitu fitol, yang terdapat sebagai bentuk ester dalam
molekul klorofil. Ada 3 kelas diterpenoid : diterpena damar, diterpena racun, dan
gliberil (Harborne, 1987)
CH2OH
Struktur fitol
Diterpena damar, meliputi senyawa seperti asam abietat dan asam agatat
yang terdapat dalam damar tumbuhan mutakhir dan tumbuhan fosil (Thomas,
1970). Di alam senyawa damar ini berfungsi sebagai pelindung ketika
dikeluarkan sebagai eksudat dari kayu pepohonan atau sebagai getah tumbuhan
herba. Asam abietat terdapat luas dalam damar gimnospermae, terutama dalam
pinus. Berbagai damar ‘kopal’ pada tumbuhan kacang-kacangan mengandung
sederetan diterpena yang berlainan, salah satu contoh adalah asam hardwikat.
COOH
O
Sekelompok diterpena racun ialah grayanatoksin, contohnya grayanatoksin-1
yang terdapat dalam daun kebanyakan jenis Rhododendron dan Kalmia. Daun
tersebut beracun oleh adanya senyawa tersebut.
Kelas diterpenoid yang ketiga adalah giberelin, segolongan hormon yang
merangsang pertumbuhan secara umum dan diketahui sangat tersebar luas pada
tumbuhan. Asam giberalat adalah giberelin paling dikenal, tetapi sebenarnya
lebih dari 60 senyawa dalam deret ini sekarang telah dikenal. Secara kimia
mereka sangat erat berkaitan, jadi, sukar dipisahkan dan dibedakan. Satu-satunya
cara penentuan yang memuaskan adalah KGC-SM. (Harborne, 1987)
Senyawa diterpenoid merupakan senyawa yang mempunyai 20 atom karbon
dan dibangun oleh 4 unit isopren. senyawa ini mempunyai bioaktifitas yang
cukup luas yaitu sebagai hormon pertumbuhan tanaman, podolakton inhibitor
pertumbuhan tanaman, antifeedant serangga, inhibitor tumor, senyawa pemanis,
anti fouling dan anti karsinogen. Senyawa diterpenoid dapat berbentuk asiklik,
bisiklik, trisiklik dan tetrasiklik dan tatanama yang digunakan lebih banyak
adalah nama trivial.
Diterpen adalah senyawa bahan alam yang mengandung 20 atom karbon,
yang secara luas terdapat dalam tumbuhan damar, yang berasal dari
pohon-pohonan. Beberapa senyawa diterpen telah dikenal sejak bertahun-tahun lalu,
walaupun baru dipelajari mendalam pada akhir-akhir ini. Beberapa kelompok
dari diterpen diklasifikasi secara konvensional dengan dasar adanya cincin
karbon. (Pinder, 1960)
2.4.1. Diterpen Alisiklis
Fitol, adalah diterpen alkohol C20H40O, yang dikembangkan oleh Willstatter
menjadi fragmen alkohol dari molekul-molekul klorofil dan kebanyakan di
isolasi dari tumbuhan jelatang. Fitol merupakan alkohol primer tak jenuh
mengandung 1 ikatan rangkap dan merupakan senyawa alisiklis. Pada ozonolisis
gugus CH3CO- (reaksi haloform). Keton ini dapat ditulis C16H33COCH3, dan fitol
dapat dituliskan dengan struktur parsial:
C16H33 C = CH . CH
2OH
CH3
Fitol
2.4.2. Diterpen Monosiklik
Vitamin A1, dikenal dalam lemak alam dan minyak (misalnya, mentega,
minyak hati ikan, minyak ikan pecak) merupakan senyawa penting yang
dibutuhkan oleh hewan untuk pertumbuhan. Pada tahun 1942 vitamin A1 dalam
kondisi kristalin dari minyak ikan pecak dengan menggunakan metode
kromatografi dan destilasi molekuler. Vitamin A1, C20H30O adalah alkohol
primer dengan oksidasi akan menghasilkan aldehid bersesuaian, C20H28O.
Molekul ini memiliki 5 ikatan rangkap.
CH=CH. C = CH. CH = CH . C = CH . CH2OH
CH3 CH3
Vitamin A1
Vitamin A2, dengan rumus C20H28O, merupakan alkohol primer dan memiliki
sifat kimia yang mirip dengan vitamin A1.
CH=CH. C = CH. CH = CH . C = CH . CH2OH
CH3 CH3
Kamforen, dengan rumus C20H32, merupakan diterpen hidrokarbon yang
ditemukan dalam fraksi didih yang lebih tinggi dari minyak kamfor. Diperoleh
dengan destilasi fraksinasi, mengandung 4 ikatan rangkap tidak terkonyugasi.
Kamforen
2.4.3. Diterpen Disiklik
Sclareol, dengan rumus C20H36O2, merupakan diterpen disiklik dengan
bentuk kristal, yang ditemukan dalam Salvia sclarea L. Di isolasi dengan
ekstraksi pelarut dari daun.
OH
OH
Sclareol
Manool, memiliki rumus C20H34O, merupakan diterpenoid bisiklik alkohol
tersier yang terkandung dalam minyak esensial yang berasal dari kayu pohon
OH
Manool
Asam Agatendikarboksilat, diterpen ini berupa asam, dijumpai dalam berbagai
jenis damar. Merupakan asam dikarboksilat, C20H30O4, mengandung 2 ikatan
etilen, salah satunya dalam keadaan berkonyugasi dengan satu grup karboksil.
COOH COOH
Asam Agatendikarboksilat
2.4.4. Diterpen Trisiklik
Asam Abietat, dengan rumus C20H30O2, merupakan asam tak jenuh,
memiliki 2 ikatan rangkap, yang berkonyugasi.
HO2C CH3
Asam Dekstropimarat, dengan rumus C20H30O2.
HO2C
Asam dekstropimarat
Ferruginol, sugiol dan hinokiol, adalah 3 jenis diterpen trisiklik fenolik.
OH
OH
Ferruginol Sugiol
HO
OH
Fikhtelit, merupakan hidrokarbon diterpen trisiklik jenuh, terdapat dalam fossil
resin. Merupakan kristal padat, dengan titik lebur 46 oC.
Fikhtelit
(Hanson, J.R, 1998)
2.5. Teknik Pemisahan
Tujuan dari teknik pemisahan adalah untuk memisahkan komponen yang
akan ditentukan berada dalam keadaan murni, tidak tercampur dengan
komponen-komponen lainnya. Ada 2 jenis teknik pemisahan :
2.5.1. Pemisahan Kimia
Pemisahan ini berdasarkan adanya perbedaan yang besar dari sifat-sifat kimia
komponen dalam campuran yang akan dipisahkan.
2.5.2. Pemisahan Fisika
Pemisahan ini berdasarkan pada perbedaan-perbedaan kecil dari sifat-sifat fisik
antara senyawa-senyawa yang termasuk dalam suatu golongan. (Muldja, 1995).
2.6. Ekstraksi
Ekstraksi adalah penyarian zat-zat aktif dari bagian tumbuhan. Adapun
tujuan dari ekstraksi yaitu untuk menarik komponen kimia yang terdapat dalam
2.6.1. Tujuan Ekstraksi
Tujuan ekstraksi adalah untuk menarik semua komponen kimia yang terdapat
dalam sampel. Ekstraksi ini didasarkan pada perpindahan massa komponen zat
padat ke dalam pelarut dimana perpindahan mulai terjadi pada lapisan antar
muka, kemudian berdifusi masuk ke dalam pelarut.
Secara umum, terdapat beberapa keadaan dalam menentukan tujuan ekstraksi:
Senyawa kimia telah diketahui identitasnya untuk diekstraksi dari tumbuhan. Dalam kasus ini, prosedur yang telah dipublikasikan dapat diikuti dan dibuat
modifikasi yang sesuai untuk mengembangkan proses atau menyesuaikan
dengan kebutuhan pemakai.
Bahan diperiksa untuk menemukan kelompok senyawa kimia tertentu,
misalnya terpenoid, alkaloid, flavanoid atau saponin, meskipun struktur kimia
sebetulnya dari senyawa ini bahkan keberadaannya belum diketahui. Hal ini
diikuti dengan uji kimia atau kromatografik yang sesuai untuk kelompok
senyawa kimia tersebut.
Sifat senyawa yang akan diisolasi belum ditentukan sebelumnya dengan cara
apapun. Situasi ini (utamanya dalam program skrining) dapat timbul jika
tujuannya adalah untuk menguji organisme, baik yang dipilih secara acak
atau didasarkan pada penggunaan tradisional untuk mengetahui adanya
senyawa dengan aktivitas biologi khusus.( Sudjadi, 1986)
2.6.2. Prinsip ekstraksi
2.6.2.1. Prinsip Maserasi
Penyarian zat aktif yang dilakukan dengan cara merendam serbuk sampel ke
dalam cairan penyari yang sesuai selama tiga hari pada temperatur kamar
terlindung dari cahaya, cairan penyari akan masuk ke dalam sel melewati dinding
dalam sel dengan di luar sel. Larutan yang konsentrasinya tinggi akan terdesak
keluar dan diganti oleh cairan penyari dengan konsentrasi rendah (proses difusi).
Peristiwa tersebut berulang sampai terjadi keseimbangan konsentrasi antara
larutan di luar sel dan di dalam sel. Selama proses maserasi dilakukan
pengadukan dan penggantian cairan penyari setiap hari. Endapan yang diperoleh
dipisahkan dan filtratnya dipekatkan.
2.6.2.2. Prinsip Perkolasi
Penyarian zat aktif yang dilakukan dengan cara serbuk sampel dimaserasi
selama 3 jam, kemudian sampel dipindahkan ke dalam bejana silinder yang
bagian bawahnya diberi sekat berpori, cairan penyari dialirkan dari atas ke bawah
melalui sampel tersebut, cairan penyari akan melarutkan zat aktif dalam sel-sel
sampel yang dilalui sampai keadan jenuh. Gerakan ke bawah disebabkan oleh
karena gravitasi, kohesi, dan berat cairan di atas dikurangi gaya kapiler yang
menahan gerakan ke bawah. Perkolat yang diperoleh dikumpulkan, lalu
dipekatkan.
2.6.2.3. Prinsip Sokletasi
Penarikan komponen kimia yang dilakukan dengan cara serbuk sampel
ditempatkan dalam klonsong yang telah dilapisi kertas saring sedemikian rupa,
cairan penyari dipanaskan dalam labu alas bulat sehingga menguap dan
dikondensasikan oleh kondensor bola menjadi molekul-molekul cairan penyari
yang jatuh ke dalam klonsong menyari zat aktif di dalam sampel dan jika cairan
penyari telah mencapai permukaan sifon, seluruh cairan akan turun kembali ke
labu alas bulat melalui pipa kapiler hingga terjadi sirkulasi. Ekstraksi sempurna
ditandai bila cairan di sifon tidak berwarna, tidak tampak noda jika di KLT, atau
sirkulasi telah mencapai 20-25 kali. Ekstrak yang diperoleh dikumpulkan dan
2.6.2.4. Prinsip Refluks
Penarikan komponen kimia yang dilakukan dengan cara sampel dimasukkan
ke dalam labu alas bulat bersama-sama dengan cairan penyari lalu dipanaskan,
uap-uap cairan penyari terkondensasi pada kondensor bola menjadi
molekul-molekul cairan penyari yang akan turun kembali menuju labu alas bulat, akan
menyari kembali sampel yang berada pada labu alas bulat, demikian seterusnya
berlangsung secara berkesinambungan sampai penyarian sempurna, penggantian
pelarut dilakukan sebanyak 3 kali setiap 3-4 jam. Filtrat yang diperoleh
dikumpulkan dan dipekatkan.
2.6.2.5. Prinsip Destilasi Uap Air
Penyarian minyak menguap dengan cara sampel dan air ditempatkan dalam
labu berbeda. Air dipanaskan dan akan menguap, uap air akan masuk ke dalam
labu sampel sambil mengekstraksi minyak menguap yang terdapat dalam sampel,
uap air dan minyak menguap yang telah terekstraksi menuju kondensor dan akan
terkondensasi, lalu akan melewati pipa alonga, campuran air dan minyak
menguap akan masuk ke dalam corong pisah, dan akan memisah antara air dan
minyak atsiri.
2.6.2.6. Prinsip Rotavapor
Proses pemisahan ekstrak dari cairan penyarinya dengan pemanasan yang
dipercepat oleh putaran dari labu alas bulat, cairan penyari dapat menguap 5-10º
C di bawah titik didih pelarutnya disebabkan oleh karena adanya penurunan
tekanan. Dengan bantuan pompa vakum, uap larutan penyari akan menguap naik
ke kondensor dan mengalami kondensasi menjadi molekul-molekul cairan pelarut
2.6.2.7. Prinsip Ekstraksi Cair-Cair
Ekstraksi cair-cair (corong pisah) merupakan pemisahan komponen kimia di
antara 2 fase pelarut yang tidak saling bercampur di mana sebagian komponen
larut pada fase pertama dan sebagian larut pada fase kedua, lalu kedua fase yang
mengandung zat terdispersi dikocok, lalu didiamkan sampai terjadi pemisahan
sempurna dan terbentuk dua lapisan fase cair, dan komponen kimia akan terpisah
ke dalam kedua fase tersebut sesuai dengan tingkat kepolarannya dengan
perbandingan konsentrasi yang tetap.
2.6.2.8. Prinsip Kromatografi Lapis Tipis
Pemisahan komponen kimia berdasarkan prinsip adsorbsi dan partisi, yang
ditentukan oleh fase diam (adsorben) dan fase gerak (eluen), komponen kimia
bergerak naik mengikuti fase gerak karena daya serap adsorben terhadap
komponen-komponen kimia tidak sama sehingga komponen kimia dapat
bergerak dengan kecepatan yang berbeda berdasarkan tingkat kepolarannya, hal
inilah yang menyebabkan terjadinya pemisahan.
2.6.2.9. Prinsip Penampakan Noda
a. Pada UV 254 nm
Pada UV 254 nm, lempeng akan berflouresensi sedangkan sampel akan
tampak berwarna gelap. Penampakan noda pada lampu UV 254 nm adalah karena
adanya daya interaksi antara sinar UV dengan indikator fluoresensi yang terdapat
pada lempeng. Fluoresensi cahaya yang tampak merupakan emisi cahaya yang
dipancarkan oleh komponen tersebut ketika elektron yang tereksitasi dari tingkat
energi dasar ke tingkat energi yang lebih tinggi kemudian kembali ke keadaan
b. Pada UV 366 nm
Pada UV 366 nm noda akan berflouresensi dan lempeng akan berwarna
gelap. Penampakan noda pada lampu UV 366 nm adalah karena adanya daya
interaksi antara sinar UV dengan gugus kromofor yang terikat oleh auksokrom
yang ada pada noda tersebut. Fluoresensi cahaya yang tampak merupakan emisi
cahaya yang dipancarkan oleh komponen tersebut ketika elektron yang tereksitasi
dari tingkat energi dasar ke tingkat energi yang lebih tinggi kemudian kembali ke
keadaan semula sambil melepaskan energi. Sehingga noda yang tampak pada
lampu UV 366 terlihat terang karena silika gel yang digunakan tidak
berfluororesensi pada sinar UV 366 nm.
c. Pereaksi Semprot H2SO4 10%
Prinsip penampakan noda pereaksi semprot H2SO4 10% adalah berdasarkan
kemampuan asam sulfat yang bersifat reduktor dalam merusak gugus kromofor
dari zat aktif simplisia sehingga panjang gelombangnya akan bergeser ke arah
yang lebih panjang (UV menjadi VIS) sehingga noda menjadi tampak oleh mata.
(Sudjadi, 1986 dan http://medicafarma.blogspot.com/2008/11/ekstraksi.html)
2.7. Kromatografi
Kromatografi adalah suatu teknik pemisahan tertentu dengan menggunakan
dua fasa yaitu fasa diam dan fasa gerak. Pemisahan tergantung pada gerakan
relatif dari dua fasa ini. Cara- cara kromatografi dapat digolongkan sesuai dengan
sifat- sifat dari fasa gerak, yang dapat berupa zat padat atau zat cair. Jika fasa
tetap berupa zat padat maka cara tersebut dikenal sebagai kromatografi serapan
(absorption chromatography) dan jika zat cair maka kromatografi tersebut
Berbagai metode kromatografi memberikan cara pemisahan paling kuat di
laboratorium kimia. Gagasan dasarnya sederhana untuk dipahami; caranya
beragam, mulai dari cara yang sederhana sampai yang agak rumit dari segi kerja
dan peralatan, dan metode ini dapat dipakai untuk setiap jenis senyawa.
(Sastrohamidjojo,H.,1996)
2.7.1. Kromatografi Lapisan Tipis
Kromatografi Lapisan Tipis (KLT) dapat dipakai dengan dua tujuan. Yang
pertama, dipakai selayaknya sebagai metode untuk mencapai hasil kualitatif,
kuantitatif dan preparatif. Kedua dipakai untuk menjajaki sistem pelarut dan
sistem penyangga yang akan dipakai dalam kromatografi kolom atau
kromatografi cair kinerja tinggi.
Teknik kromatografi lapis tipis (KLT) dikembangkan oleh Egon Stahl
dengan menghamparkan penyerap pada lempeng gelas, sehingga merupakan
lapisan tipis. KLT merupakan kromatografi serapan, tetapi dapat juga merupakan
kromatografi partisi karena bahan penyerap telah dilapisi air dari udara. Sistem
ini segera popular karena memberikan banyak keuntungan, misalnya peralatan
yang diperlukan sedikit, murah, sederhana, waktu, analisis cepat dan daya pisah
cukup baik. (Sudjadi, 1986)
Pada hakikatnya Kromatografi Lapisan Tipis melibatkan dua peubah: sifat
fasa diam atau sifat lapisan dan sifat fase gerak atau campuran pelarut
pengembang. Fasa diam dapat berupa serbuk halus yang berfungsi sebagai
permukaan penyerap (kromatografi cair-padat) atau berfungsi sebagai penyangga
untuk lapisan zat cair (kromatografi cair- cair). Fasa diam pada KLT sering
disebut penyerap, walaupun sering berfungsi sebagai penyangga untuk lapisan zat
cair di dalam sistem kromatografi cair- cair. Hampir segala macam serbuk dapat
dipakai sebagai penyerap pada KLT, yaitu: silika gel (asam silikat), alumina
(aluminium oksida), kiselgur (tanah diatome), dan selulosa. Fasa gerak dapat
2.7.1.1. Pembuatan Lapisan Tipis
Dalam pembuatan lapisan tipis digunkan plat-plat kaca yang memiliki
ukuran 20 x 5 cm atau 20 x 20 cm, dan ukuran ini dianggap “standart”. Plat ini
dicuci terlebih dahulu dengan air dan detergen kemudian dikeringkan dengan
aseton. Selanjutnya membuat penyerap menjadi bubur dengan air, biasanya
dalam perbandingan x gram penyerap dan 2x ml air. Bubur diaduk dengan baik
dan dibentangkan di atas plat kaca dengan berbagai cara. Tebal “standart” adalah
250 mikron. Lapisan-lapisan yang lebih tebal (0,5 – 2,0 mm) digunakan untuk
pemisahan-pemisahan yang sifatnya besar, dengan menggunakan penyerap
hingga 250 mg untuk plat dengan ukuran 20 x 20 cm. Salah satu keukaran
dengan lapisan tebal ialah adanya tendensi mengelupas bila
kering.(Sastrohamidjojo, 2001)
Beberapa contoh penyerap yang digunakan untuk pemisahan dalam
kromatografi lapis tipis adalah sebagai berikut :
1. Silika gel
Ada beberapa jenis silika gel, yaitu :
a. Silika gel G
Silika gel G adalah silika gel yang mengandung 13 % kalsium sulfat sebagai
perekat. Jenis silika gel ini biasanya mengandung ion logam, terutama ion besi.
Kandungan ion besi dapat dihilangkan dengan mengembangkan plat TLC silika
gel G dengan sstem pelarut metanol : asam HCl pekat 9 : 1.
b. Silika gel H
Perbedaan silika gel G dan silika gel H ialah, bahwa silika gel H tidak
menngandung perekat kalsium sulfat. Silika gel H dipakai untuk pemisahan yang
c. Silika gel PF
Jenis silika gel ini diketemukan belakangan, yang dibuat sedemikian rupa
sehingga senyawa-senyawa organik terikat pada plat ini dapat mengadakan
fluoresensi. Oleh karena itu visualisasinya dapat dikerjakan dengan
menempatkan plat yang telah dikembangkan di dalam ruangan gelap atau dengan
sinar ultra violet yang bergelombang pendek.
2. Alumina
Penggunaan alumina dalam TLC, yang semula diperkenalkan oleh peneliti
dari Cekoslowakia, tidak sesering silika gel. Sebenarnya alumina netral
mempunyai kemampuan untuk memisahkan bermacam-macam senyawa, seperti
terpena, alkaloid, steroid, dan senyawa-senyawa alisklik, alifatik, serta aromatik.
Sebagai zat perekat alumina tidak mengandung zat perekat, memepunyai sifat
alkalis dan dapat digunakan baik tanpa maupun dengan aktivasi.
(Keese,R. dkk, 1982)
3. Kieselguhr
Kieselguhr merupakan adsorben yang lebih lemah dari silika gel dan
alumina, oleh karena itu lebih cocok untuk memisahkan senyawa-senyawa polar.
(Adnan, M., 1997)
Menurut Markham, KLT memiliki peranan penting dalam metoda pemisahan dan
isolasi yaitu :
a. Mencari pelarut untuk kromatografi kolom
b. Analisis fraksi yang diperoleh dari kromatografi kolom
c. Menyigi arah atau perkembangan reaksi seperti hidrolisis atau metilasi
d. Identifikasi flavonoida secara ko-kromatografi
2.7.2. Kromatografi Kolom
Sistem bertekanan rendah biasanya terbuat dari kaca yang dilengkapi dengan
keran jenis tertentu pada bagian bawahnya untuk mengatur aliran pelarut. Ukuran
keseluruhan kolom sungguh beragam, tetapi biasanya panjangnya sekurang-
kurangnya 10 kali garis tengah dalamnya dan mungkin saja sampai 100 kali.
Pada kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita
pada bagian atas kolom penyerap yang berada dalam tabung kaca, tabung logam
atau bahkan tabung plastik. Pelarut (fasa gerak) dibiarkan mengalir melalui
kolom karena aliran yang disebabkan oleh gaya berat atau didorong oleh tekanan.
Pita senyawa linarut bergerak melalui kolom dengan laju yang berbeda, memisah
dan dikumpulkan berupa fraksi ketika keluar dari alas kolom.(Gritter,R.J,1991)
2.7.2.1. Pengisian Kolom
Pengisian kolom harus dikerjakan dengan seragam.Setelah adsorben
dimasukkan dapat diseragamkan kepadatannya dalam kolom dengan
menggunakan vibrator atau dengan plunger (pemadat). Selain itu dapat juga
dikerjakan dengan memasukkan adsorben dalam bentuk larutan (slurry) dan
partikelnya dibiarkan mengendap. Pengisian kolom yang tidak seragam akan
menghasilkan rongga-rongga di tengah-tengah kolom. Cara untuk mengatasi
masalah ini adalah dengan mengadakan back fushing , sehingga terjadi
pengadukan, yang seterusnya dibiarkan lagi mengendap. Pada bagian bawah
(dasar) dan atas dari isian kolom diberi wol kaca (glass wool) atau sintered glass
disc untuk menyangga isian. Bila kolom telah diberi bahan isian, permukaan
cairan tidak boleh dibiarkan turun dibawah permukaan bahan isian bagian atas,
karena akan memberikan peluang masuknya gelembung udara masuk ke kolom.
(Adnan,M., 1997)
2.7.3. Kromatografi Preparatif
Salah satu metode pemisahan yang memerlukan pembiayaan yang paling
preparatif (KLTP). Walaupun KLTP dapat memisahkan bahan alam dalam
jumlah gram, sebagian besar pemakaian hanya dalam jumlah milligram. KLTP
bersama-sama dengan kromatografi kolom terbuka, masih dijumpai dalam
sebagian besar publikasi mengenai isolasi bahan alam, terutama dari laboratorium
yang tidak dilengkapi dengan cara pemisahan modern. Akan tetapi, seperti yang
akan diterangkan kemudian, tertdapat banyak masalah pada KLTP.
¾ Penyerap
Dalam KLTP digunakan ketebalan adsorbent yang paling sering dipakai
yaitu 0,5-2 mm. ukuran plat kromatografi biasanya 20 x 20 cm atau 20 x 40
cm. Peneyerap yang paling umum ialah silika gel dan dipakai untuk
pemisahan campuran senyawa lipofil maupun campuran senyawa hidrofil.
¾ Penotolan Cuplikan
Cuplikan dilarutkan dalam sedikit pelarut sebelum ditotolkan pada plat
KLTP. Pelarut yang baik ialah pelarut atsiri/organik (heksana,
diklorometana, etil asetat), karena jika pelarut kurang atsiri maka akan
terjadi pelebaran pita. Konsentrasi cuplikan harus sekitar 5-10%.
¾ Pemilihan Fase Gerak
Pilihan pelarut ditentukan berdasarkan pemeriksaan pendahuluan memakai
KLT analitik. Karena ukuran partikel penyerap kira-kira sama, pelarut yang
dipakai pada plat KLT dapat dipakai langsung pada KLTP. Pengembangan
pelat KLTP biasanya dilakukan dalam bejana kaca yang dapat menampung
beberapa plat.
¾ Isolasi senyawa yang sudah terpisah
Kebanyakan penyerap KLTP mengandung indikator fluoresensi yang
membantu mendeteksi kedudukan pita yang terpisah sepanjang senyawa
menimbulkan masalah yaitu bereaksi dengan asam kadang-kadang bahakan
dengan asam asetat.
Untuk senyawa yang tidak menyerap sinar UV, ada beberapa pilihan :
a). Menyemprot dengan air
b). Menutup pelat dengan sepotong kaca menyemprot salah satu sisi dengan
pereaksi semprot
c). Menambahkan senyawa pembanding. (Hostettman,K.,1995)
2.7.4. Harga Rf ( Retension factor)
Identifikasi dari senyawa-senyawa yang terpisah pada lapisan tipis lebih baik
dikerjakan dengan pereaksi lokasi kimia dan reaksi warna. Lazimnya identifikasi
menggunakan harga Rf meskipun harga-harga Rf dalam lapisan tipis kurang tepat
bila dibandingkan pada kertas.
Dapat didefenisikan sbb :
Harga Rf adalah =
Faktor-faktor yang memepengaruhi gerakan noda dalam kromatografi lapis
tipis yang juga mempengaruhi harga Rf :
1). Struktur kimia dari senyawa yang dipisahkan
2). Sifat dari penyerap dan derajat aktifitasnya
3). Tebal keraataan dari lapisan penyerap
4). Pelarut (dan derajat kemurniannya) fasa gerak
5). Derajat kejenuhan dari uap
6). Jumlah cuplikan yang digunakan
7). Suhu
8). Kesetimbangan
2.8. Teknik Spektroskopi
Teknik spektroskopi adalah salah satu teknik analisis kimia – fisika yang
mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik.
Ada dua macam instrumen pada teknik spektroskopi yaitu spektrometer dan
spektrofotometer. Instrumen yang memakai monokromator celah tetap pada
bidang fokus disebut sebagai spektrometer. Apabila spektrometer tersebut
dilengkapi dengan detektor yang bersifat fotoelektrik maka disebut
spektrofotometer. (Muldja, 1955).
Informasi Spektroskopi Inframerah menunjukkan tipe – tipe dari adanya
gugus fungsi dalam satu molekul, Resonansi Magnet Inti yang memberikan
informasi tentang bilangan dari setiap tipe dari atom hidrogen. Ini juga
memberikan informasi yang menyatakan tentang alam serta lingkungan dari
setiap tipe dari atom hidrogen. Kombinasinya dan data yang ada kadang – kadang
menentukan struktur yang lengkap dari molekul yang tidak diketahui. (Pavia,
1979).
Walaupun spektrum infra-merah merupakan kekhasan sebuah molekul secara
menyeluruh, gugus- gugus atom tertentu memberikan penambahan pita- pita pada
kerapatan tertentu, ataupun didekatnya, apa pun bangun molekul selebihnya.
Keberlakuan seperti itulah yang memungkinkan kimiawan memperoleh informasi
tentang struktur yang berguna serta mendapatkan acuan bagi peta umum
frekuensi gugus yang khas. ( Silverstain, 1986)
2.8.1. Spektroskopi Infra Merah (IR)
Spektroskopi infra merah digunakan untuk menentukan spektrum infra
merah suatu senyawa hingga memberikan gambaran mengenai berbagai gugus
fungsional dalam sebuah molekul organik. Hal ini terjadi bila sinar infra merah
dilewatkan melalui cuplikan senyawa organik, maka sejumlah frekuensi diserap
persen adsorbansi atau persen transmitansi lawan frekuensi maka akan dihasilkan
suatu spektrum infra merah.
Penggunaan spektroskopi infra merah pada bidang kimia organik hampir
menggunakan daerah 650 – 4000 cm-1. Daerah dengan frekuensi lebih rendah
dari 650 cm-1 disebut infra merah jauh, dan daerah dengan frekuensi lebih tinggi
4000 cm-1, disebut infra merah dekat. Masing-masing daerah tersebut lebih jauh
dan lebih dekat dengan spektrum tampak. Infra merah jauh mengandung sedikit
serapan yang bermanfaat bagi orang organik dan serapan tersebit dikaitkan
dengan perubahan-perubahan rotasi dalam molekul. Infra merah dekat terutama
menunjukkan serapan-serapan harmonik overtone dari vibrasi pokok yang
terdapat pada daerah normal. Instrumen yang digunakan untuk mengukur resapan
radiasi infra merah pada berbagai panjang gelombang disebut spektrofotometer
infra merah.(Sastrohamidjojo, 1996)
Radiasi infra merah ditemukan oleh Sir William Hercshel pada tahun 1880, yang melaporkan penemuannya kepada Royal Society. Pada waktu itu para
saintis belum memahami secara jelas keadaan transisi. Daerah inframerah terletak
antara spektrum electromagnetic cahaya tampak dan spektrum radio; yakni antara
4.000-400 cm-1. Mulai tahun 1903 William dan N. Coblentz mahasiswa di Cornel University memperbaiki teknik-teknik percobaan dan menyusun sederetan
spektra serapan zat murni.
a. Ada beberapa daerah penyerapan terpenting dalam Spektrum Infra Merah :
1. Daerah vibrasi regang hidrogen : 3.700-2.700 cm-1.
• 3.700 – 3.100 cm-1, serapan oleh vibrasi regang O-H dan N-H.
Serapan oleh vibrasi lentur O-H biasanya terdapat pada
bilangan gelombang lebih besar dan pita serapannya dalam
spektrum sering lebih lebar dari pita serapan N-H.
• 3.200 – 2.850 cm-1, daerah vibrasi regang C-H alifatik. 2. Daerah vibrasi regang ikatan ganda tiga, 2.700 – 1.850 cm-1
Gugus fungsional yang menyerap di daerah ini terbatas, karena itu ada atau
3. Daerah ikatan ganda dua, 1.950 – 1.550 cm-1
Vibrasi regang untuk ikatan ganda dua, yaitu :
• - C = C , - C = N -, 1690 – 1600 cm-1
• 1.650 – 1.450 cm-1, puncak serapan dalam daerah ini memberi
keterangan yang penting mengenai cincin aromatik.
4. Daerah sidik jari “finger print”, 1.500 – 700 cm-1
Beberapa frekuensi gugusan (group frequency) juga bisa ditemukan di daerah
sidik jari ini : C-O-C (vibrasi regang) dalam eter, ester kira-kira 1.200 cm-1 dan
vibrasi regang C-Cl pada 700 – 800 cm-1 . Pada bilangan gelombang dibawah
1.200 cm-1 terdapat puncak-puncak serapan beberapa gugusan anorganik seperti :
sulfat, fosfat, nitrat dan karbonat.
b. Vibrasi kerangka suatu molekul (skeletal vibrations)
Vibrasi kerangka terletak di derah spektrum lebih dari 1.500 cm-1.
Kelompik-kelompok vibrasi di daerah spektrum kecil dari 1.500 cm-1 adalah :
a. Vibrasi regang (stretching) ikatan ganda yang tidak mengandung atom C
b. Vibrasi regang ikatan tunggal
c. Vibrasi-vibrasi lentur (bending)
(Noerdin, 1985)
2.8.2. Spektrofotometri Resonansi Magnetik Inti Proton ( 1H-NMR )
Spektrometri Resonansi Magnetik Inti (Nuclear Magnetic Resonance, NMR)
merupakan alat yang berguna pada penentuan struktur molekul organik. Teknik
ini memberikan informasi mengenai berbagai jenis atom hidrogen dalam
molekul. Struktur NMR memberikan informasi mengenai lingkungan kimia
atom hidrogen, jumlah atom hidrogen dalam setiap lingkungan dan struktur
gugusan yang berdekatan dengan setiap atom hidrogen. (Cresswell, 1982,).
Sesuai dengan namanya, resonansi magnet inti (RMI) berhubungan dengan
magnet dari berbagai inti yang ada dan untuk menduga letak inti tersebut dalam
molekul (Sudjadi,1985).
Spektroskopi RMI proton pada hakikatnya merupakan sarana untuk
menentukan struktur senyawa organik dengan mengukur momen magnet atom
hidrogennya. Pada kebanyakan senyawa, atom hidrogen terikat pada gugus yang
berlainan (seperti –CH2-, -CH3, -CHO,-NH2,-CHOH-) dan spektrum RMI proton
merupakan rekaman sejumlah atom hidrogen yang berada dalam keadaan
limgkungan yang berlainan tersebut (Harbone, 1987).
Dengan spektrometer resonansi magnetik inti proton dapat ditentukan
banyaknya jenis lingkungan atom hidrogen yang berbeda yang ada dalam
molekul, beberapa hidrogen pada masing-masing jenis lingkungan hidrogen, serta
berapa banyak atom hidrogen yang ada pada atom karbon tetangga. Pada
spektrometer resonansi magnetik inti proton, kebanyakan proton pada spektra
NMR proton menunjukkan adsorpsi antara 0 – 10 ppm (δ) di bawah TMS, hanya
beberapa seperti proton aldehida dan karboksilat yang menunjukkan puncak
diluar jangka ini.
Kegunaan yang besar dari resonansi magnetik inti adalah karena tidak setiap
proton dalam molekul beresonansi pada frekuensi yang sama. Hal ini disebabkan
oleh kenyataan bahwa berbagai proton dalam molekul dikelilingi oleh elektron
dan menunjukkan sedikit perbedaan lingkungan elektronik dari satu proton
dengan proton yang lain. Proton-proton dilindungi oleh elektron-elektron yang
mengelilinginya. Di dalam medan magnet, perputaran medan magnet valensi dari
proton menghasilkan medan magnet yang melawan medan magnet yang
digunakan. Sehingga setiap proton dalam molekul dilindungi dari medan magnet
yang digunakan yang mengenainya, besarnya perlindungan ini tergantung pada
kerapatan elektron yang mengelilinginya. Makin besar kerapatan yang
mengelilingi inti, maka makin besar pula medan magnet yang dihasilkan yang
melawan yang digunakan. Akibat secara keseluruhan inti/proton merasakan
digunakan adalah tetrametilsilan, (CH3)4Si, juga disebut TMS yang
proton-protonnya menyerap pada ujung kanan dalam spektrum NMR. Senyawa ini
dipilih karena proton-proton dari gugus metil jauh lebih terlindungi bila
dibandingkan dengan kebanyakan senyawa-senyawa yang diketahui. (Silverstein,
1988)
Senyawa yang paling lazim dan paling berguna dipakai sebagai acuan adalah
tetrametilsilana (TMS). Senyawa ini mempunyai beberapa kelebihan; lamban
secara kimia, isotop magnet, serta larut dalam kebanyakan pelarut organik; TMS
meberikan puncak serapan tajam tunggal serta menyerap pada medan lebih tinggi
daripada semua proton organik. (Silverstein, 1986).
Si CH3
H3C
CH3
CH3
Tetrametilsilana
Pada spektormetri NMR integrasi sangat penting. Harga integrasi
menunjukkan daerah atau luas puncak dari tiap-tiap proton. Sedangkan luas
daerah atau luas puncak tersebut sesuai dengan jumlah proton. Dengan demikian
perbandingan tiap integrasi proton sama dengan perbandingan jumlah proton
dalam molekul. (Muldja, 1955)
Di dalam medan magnet, perputaran elektron-elektron valensi dari proton
menghasilkan medan magnet yang melawan medan magnet yang digunakan.
Hingga setiap proton dalam molekul dilindungi dari medan magnet yang
digunakan dan bahwa besarnya perlindungan ini tergantung pada kerapatan
elektron yang mengelilingnya. Makin besar kerapatan elektron yang mengelilingi
digunakan. Akibat secara keseluruhan adalah inti/proton merasakan adanya
pengurangan medan yang mengenainya. (Sastrohamdijojo, 1996)
Untuk banyak senyawa, banyak peak yang terpisah secara spin-spin dalam
absorpsi NMR dari suatu proton tertentu (atau sekelompok proton ekuivalen).
Dapat diramalkan dengan mencacah proton-proton tetangga (n) yang tak
ekuivalen dengan proton yang sedang di bahas dan menambah satu pada n itu.
Aturan ini disebut aturan n+1. proton-proton yang sama pergeseran kimianya
tidak saling membelah (split) isyarat mereka. Hanya proton yang bertetangga
yang geseran kimianya berlainan, akan mengakibatkan pemisahan.
Untuk mendapat spektrum yang baik, cuplikan harus merupakan cairan atau
larutan tidak kental. Pelarut yang dapat melarutkan cuplikan sampai 10 % sudah
cukup dan merupakan pelarut aprotik (yang tidak memberikan sinyal NMR).
Biasanya dipergunakan pelarut organik yang terderasi, seperti CCl4, CS2, CDCl3,
C6D6, D2O, (CD3)3SO, (CD3)2CO dan (CCl3)2COO. (Silverstein, 1986)
2.8.3. Spektroskopi NMR 13C
Spektroskopi proton atau 1H, memberikan informasi struktural mengenai
atom-atom hidrogen dalam sebuah molekul organik. Spektroskopi NMR karbon
13 atau 13C menghasilkan informasi struktur mengenai karbon-karbon dalam
sebuh molekul organik.
Dalam spektroskopi 1H-NMR kita bekerja dengan isotop hidrogen alamiah
99,985 %, atom hidrogen alamiah 1H. Namun 98,9 % atom karbon dalam alam
adalah 13C, suatu isotop karbon yang intinya tidak mempunyai spin. Karbon -13
hanya merupakan 1,1 % atom karbon yang terdapat dalam alam. Disamping itu
transisi dari paralel ke paralel dari suatu inti 13C adalah transisi energi rendah,
akibatnya spektra 13C-NMR hanya dapat diperoleh dengan spektrometer yang
sangat sensitif. Akhir-akhir ini spektrometer ini tersedia secara meluas dan
Terdapat dua tipe utama spektra 13C, spektra yang menunjukkan pola
pemisahan spin-spin 13C-1H dan spektra yang tidak menunjukkan pola itu. Kedua
tipe spektra ini sering digunakan secara berhubungan. Dalam keduanya TMS
sebagai bahan pembanding-dalam, dan geeran-geseran kimia diukur ke bawah
medan dari peak TMS ini. Geseran-geseran kimia dalam 13C-NMR jauh lebih
besar dari geseran yang dijumpai dalam 1H-NMR, dimana pergeseran kimia
mulai 0 – 220 ppm.
Kebanyakan proton dalam spektra 1H-NMR menunjukkan absorpsi antara 0
– 10 ppm (δ) di bawah medan TMS, hanya beberapa seperti proton aldehida dan
karboksilat yang menunjukkan peak di luar jangka ini. Absorpsi karbon-13
dijumpai dengan angka 0 – 220 ppm di bawah medan dari TMS. Jangka geseran
kimia yang lebar inilah merupakan faktor lain yang menyederhanakan spektra 13C
dibandingkan dengan spektra 1H, dalam spektra 13C peluang tumpang tindihnya
BAB III
METODOLOGI PENELITIAN
3.1. Alat-alat
1. Gelas ukur 50 ml pyrex
2. Gelas Beaker 250 ml pyrex
3. Gelas Erlenmeyer 250 ml pyrex
4. Corong saring
5. Corong pisah 500 ml Durant
6. Kolom khromatografi Pyrex
7. Tabung reaksi
8. Plat skrining
9. Neraca Analitis Mettler PM 480
10.Hair dryer Miyako
11.Rotari evaporator Buchi B-480
12.Labu alas 500 ml Pirex
13.Alat pengukur titik lebur
14.Statif dan klem
15.Spatula
17.Batang pengaduk
18.Pipet tetes
19.Botol vial
20.Bejana KLT
21. Plat KLT
22. Pipa kapiler
23. Plat KLT Preparatif E.Merck
24.Spektrofotometer FT-IR Shimadzu
25.Spektrometer NMR ECA 500 MHz
26.Penangas air
3.2. Bahan-bahan
1. Daun tumbuhan merambung (Vernonia arborea Buch-Ham.)
2. Metanol Destilasi
3. N-Heksana Teknis
4. Etil Asetat Teknis
5. Kloroform p.a. Merck
6. Silika Gel 60GF254