DARI 1,3 SIKLOHEKSANADION DAN 4-KLOROBENZALDEHID DENGAN KATALIS KALIUM HIDROKSIDA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Anintia Mara Christy NIM : 078114143
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
SINTESIS SENYAWA 2-(4´-KLOROBENZILIDENA)SIKLOHEKSANADION DARI 1,3 SIKLOHEKSANADION DAN 4-KLOROBENZALDEHID DENGAN
KATALIS KALIUM HIDROKSIDA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Anintia Mara Christy NIM : 078114143
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iii
SINTESIS SENYAWA 2-(4´-KLOROBENZILIDENA)SIKLOHEKSANADION DARI 1,3 SIKLOHEKSANADION DAN 4-KLOROBENZALDEHID DENGAN
KATALIS KALIUM HIDROKSIDA
Skripsi yang diajukan oleh: Anintia Mara Christy
NIM : 078114143
telah disetujui oleh:
Pembimbing Utama
v
Orang mulia akan mempelajari sesuatu yang belum dipelajarinya dan tak akan berhenti sampai dipahaminya
Orang yang tulus tidak hanya sadar akan dirinya; tetapi dengan kemampuannya, ia mampu menyempurnakan orang lain
Keberhasilan tercapai karena belajar dan latihan terus menerus Confucius
Bagaimanapun sulitnya tugas, jika kamu tidak berusaha
melaksanakannya bagaimana kamu tahu bahwa kamu tidak dapat melakukannya
Lie Li
Segala perkara dapat kutanggung dalam Dia yang memberi kekuatan kepadaku
(Filipi 4: 13)
Karya ini penulis persembahkan kepada : “Papa dan Mama” atas semua dukungan materi dan spiritual yang
diberikan
“Adik-adikku” yang kusayangi “Almamaterku” yang membesarkan aku
vi
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma: Nama : Anintia Mara Christy
Nomor Mahasiswa : 07 8114 143
Demi perkembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul:
SINTESIS SENYAWA 2-(4´-KLOROBENZILIDENA)SIKLOHEKSANADION DARI 1,3 SIKLOHEKSANADION DAN 4-KLOROBENZALDEHID DENGAN KATALIS KALIUM HIDROKSIDA
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya ataupun memberi royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenamya. Dibuat di Yogyakarta
Pada tanggal: 8 Februari 2011 Yang menyatakan
vii
Puji syukur kepada Tuhan atas berkat dan kasih-Nya yang memberikan
kekuatan bagi penulis untuk menyelesaikan skripsi yang berjudul “Sintesis Senyawa
2-(4´-klorobenzilidena)sikloheksanadion dari 1,3-Sikloheksanadion dan
4-klorobenzaldehid dengan Katalis Kalium Hidroksida” dengan baik. Skripsi ini
disusun untuk memenuhi salah satu syarat dalam memperoleh gelar Sarjana Strata Satu Program Studi Farmasi (S. Farm.) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Skripsi ini tersusun berkat bantuan dari berbagai pihak, oleh karena itu penulis menyampaikan ucapan terimakasi kepada:
1. Ipang Djunarko, M.Si., Apt., selaku Dekan Fakultas Farmasi, Universitas Sanata Dharma Yogyakarta.
2. Jeffry Julianus, M.Si., selaku dosen pembimbing yang telah memberikan bimbingan dan pengarahan kepada penulis sekaligus sebagai dosen penguji atas segala masukan, kritik, dan sarannya.
3. Dra. M. M. Yetty Tjandrawati, M. Si. selaku dosen penguji atas segala masukan, kritik dan sarannya.
viii
5. Rini Dwi Astuti, M.Si, Apt., selaku kepala laboratorium Farmasi, atas ijin yang diberikan kepada penulis untuk melakukan penelitian di laboratorium Farmasi.
6. Christine Patramurti, M.Si. Apt, atas bantuannya kepada tim peneliti dalam melakukan penelitian atas beberapa masukan, kritik, dan saran yang telah diberikan kepada tim penelitii.
7. Staf Laboratorium Fakultas Farmasi Universitas Sanata Dharma yang telah menemani dan membantu penulis selama melakukan penelitian.
8. Teman-teman yang sering menemani penulis ngobrol : Tiwi, Lia, Yunita, Dinar, Siwi, Eka, Oki, Reka, Evina, Cintya, Aji, Nana, Ridho, Ferdian, Sin-sin atas dukungan dan semangatnya
9. Teman-teman satu tim penelitian : Ardi, Wiwid, dan Fandri, atas dukungan dan bantuannya selama penulis melakukan penelitian
10.Inta, Santi, Ipin, sebagai sahabat yang selalu memberikan doa dan semangat kepada penulis.
11.Jefta Teguh Saroso yang selalu bersedia menemani penulis dalam suka maupun duka, dan tanpa lelah untuk selalu memberikan masukan yang membangun kepada penulis dalam menghadapi setiap persoalan dan dalam menyikapi beberapa hal.
ix
kekurangan mengingat keterbatasan kemampuan dan pengetahuan penulis. Untuk itu penulis mengharapkan saran dan kritik yang membangun dari semua pihak. Akhir kata semoga skripsi ini dapat berguna bagi pembaca.
x
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 1 Januari 2011 Penulis
xi
Halaman
HALAMAN SAMPUL ……….. i
HALAMAN JUDUL ……….. ii
HALAMAN PERSETUJUAN PEMBIMBING ……… iii
HALAMAN PENGESAHAN ……… iv
HALAMAN PERSEMBAHAN ……… v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS...………. vi
PRAKATA ………. vii
PERNYATAAN KEASLIAN KARYA ………. x
DAFTAR ISI ... xi
DAFTAR TABEL ……….. xv
DAFTAR GAMBAR ……….. xvi
DAFTAR LAMPIRAN ……….. xviii
INTISARI ………... xvix
ABSTRACT ………. xx
BAB I. PENGANTAR ……….. 1
A. Latar Belakang ………... 1
1. Permasalahan ………... 4
2. Keaslian penelitian ………... 4
xii
B. Tujuan Penelitian ……… 5
BAB II. PENELAAHAN PUSTAKA ……… 6
A. Kurkumin sebagai Senyawa Penuntun (Senyawa Induk) ……….. 6
B. Sintesis Senyawa 2-(4´-klorobenzilidena) sikloheksanadion …… 7
C. Analisis Pendahuluan ……… 9
1. Pemeriksaan organoleptis ………... 9
2. Pemeriksaan kelarutan ……… 9
D. Pemurnian dan Pemeriksaan Kemurnian Senyawa Hasil Sintesis 10 1. Rekristalisasi ……….. 10
2. Pemeriksaan titik lebur ………... 12
3. Kromatografi Lapis Tipis (KLT) ………. 14
4. Gas Chromatography-Mass Spectra (GC-MS) ………... 15
E. Elusidasi Struktur ………. 15
1. Spektrofotometri Inframerah (IR) ……….. 15
2. Spektroskopi Massa ……… 17
F. Landasan Teori ………. 20
G. Hipotesis ………... 21
BAB III. METODE PENELITIAN ………... 22
A. Jenis dan Rancangan Penelitian ………... 22
B. Definisi Operasional ………. 22
C. Bahan Penelitian ………... 22
xiii
E. Tata Cara Penelitian ………. 23
1. Sintesis 2,4 Klorobenzilidena sikloheksanadion ……… 23
2. Isolasi senyawa hasil sintesis ……….. 24
3. Kristalisasi (pendesakan padatan) ……….. 24
4. Analisis senyawa hasil sintesis ………... 25
5. Elusidasi struktur senyawa hasil sintesis ……… 26
F. Analisis Hasil ………... 27
1. Rendemen ……….. 27
2. Analisis pendahuluan ………. 28
3. Pemeriksaan kemurnian senyawa hasil sintesis ……….. 28
4. Elusidasi struktur ……… 28
BAB IV. HASIL DAN PEMBAHASAN ………... 29
A. Sintesis 2-(4’-klorobenzilidena) sikloheksanadion ……… 29
B. Analisis Pendahuluan ………. 35
1. Pemeriksaan organoleptis ……… 35
2. Pemeriksaan kelarutan ………. 36
3. Pemeriksaan senyawa hasil sintesis dengan kromatografi lapis Tipis (KLT) ……….. 37
4. Uji titik lebur senyawa hasil sintesis ……… 39
C. Elusidasi Struktur Senyawa Hasil Sintesis ………. 40
xiv
2. Pengujian senyawa hasil sintesis dengan GC-MS ……… 43
BAB V. KESIMPULAN DAN SARAN ……… 52
A. Kesimpulan ……… 52
B. Saran ……….. 52
DAFTAR PUSTAKA ……… 53
LAMPIRAN ………. 55
xv
Tabel I. Istilah kelarutan menurut Farmakope Indonesia IV ……….. 10
Tabel II. Perbandingan organoleptis senyawa hasil sintesis dengan starting ma-
terial ……… 35
Tabel III. Perbandingan kelarutan senyawa hasil sintesis dengan starting ma-
terial ……… 36
Tabel IV. Keterangan gambar kromatogram senyawa hasil sintesis ………… 38
Tabel V. Interpretasi spektra inframerah senyawa hasil sintesis ………. 41
xvi
DAFTAR GAMBAR
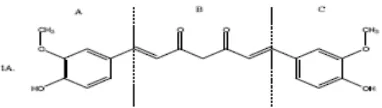
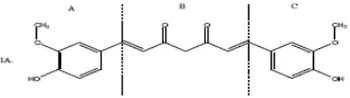
Gambar 1. Senyawa kurkumin sebagai senyawa penuntun dibagi menjadi tiga
gugus farmakofor A, B, dan C ……… 2
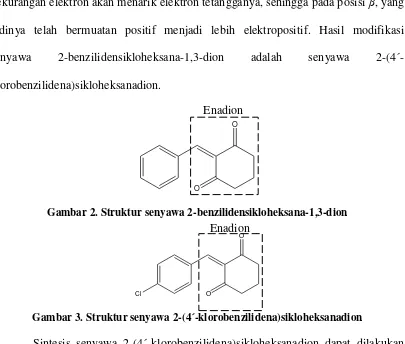
Gambar 2. Struktur senyawa 2-benzilidensikloheksana-1,3-dion ……… 3
Gambar 3. Struktur senyawa 2-(4´-klorobenzilidena)sikloheksanadion …….. 3
Gambar 4. Senyawa kurkumin sebagai senyawa penuntun dibagi menjadi tiga gugus farmakofor A, B, dan C ……… 6
Gambar 5. Macam ikatan yang dipengaruhi oleh frekuensi ………. 16
Gambar 6. Penataan ulang McLafferty ………. 20
Gambar 7. Reaksi umum sintesis senyawa 2-(4´-klorobenzilidena) siklohek- sanadion dengan katalis basa KOH ………. 21
Gambar 8. Dua hidrogen α pada 1,3-sikloheksandion ……….. 29
Gambar 9. 4-klorobenzaldehid ………. 29
Gambar 10. Mekanisme reaksi pembentukan ion enolat ……… 30
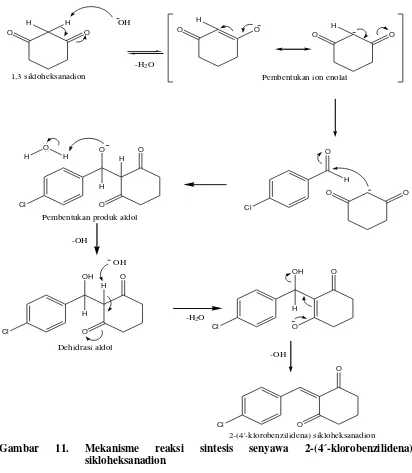
Gambar 11. Mekanisme reaksi sintesis senyawa 2-(4´-klorobenzilidena) Sikloheksanadion ……… 31
Gambar 12. Foto senyawa hasil sintesis dan starting material ………. 35
Gambar 13. Kemungkinan interaksi yang terjadi antara senyawa senyawa 2-(4´-klorobenzilidena) sikloheksanadion dengan kloroform ... 37
Gambar 14. Kromatogram senyawa hasil sintesis ……….. 38
xvii
Gambar 17. Spektra Infra merah 1,3-sikloheksanadion ………... 42
Gambar 18. Kromatogram Gas-Chromatography senyawa hasil sintesis … 44 Gambar 19. Spektra Mass Spektroscopy senyawa hasil sintesis pada wak-
tu retensi 19,656 ……….. 44 Gambar 20. Interpretasi pelepasan molekul senyawa 2,4-(klorobenzilidena)
sikloheksanadion menjadi fragmen-fragmennya ……….. 47 Gambar 21. Spektra Mass Spektroscopy senyawa hasil sintesis pada wak-
tu retensi 26,568 menit ……… 48 Gambar 22. Struktur senyawa (4 Z)-4-(4-klorobenzilidena)-2-(3-oksosiklo-
heks-1-enil)sikloheksan-1,3-dion (hasil reaksi samping) ……... 48 Gambar 23. Interpretasi pelepasan molekul senyawa 2,4-(klorobenzilidena)
sikloheksanadion menjadi fragmen-fragmennya ………. 49 Gambar 24. Mekanisme reaksi pembentukan (4 Z)-4-(4-klorobenzilidena)-2
xviii
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan crude product senyawa hasil sintesis dan perkiraan
Rendemen ………. 50
Lampiran 2. Kromatogram KLT senyawa hasil sintesis dan perhitungan Rf… 52 Lampiran 3. Perhitungan kepolaran fase gerak KLT dan log P senyawa hasil Sintesis………. ……… 52
Lampiran 4. Hasil uji titik lebur ……… 53
Lampiran 5. Spektra IR senyawa hasil sintesis ……….. 54
Lampiran 6. Spektra Infra Merah Senyawa 1,3-sikloheksanadion dan interpretasi gugusnya ……… 61
Lampiran 7. Spektra Infra Merah Senyawa 4-klorobenzaldehid dan interpretasi gugusnya ………. 62
Lampiran 8. Kromatogram GC senyawa hasil sintesis ……….. 63
Lampiran 9. Spektra massa senyawa hasil sintesis ……… 64
xix INTISARI
Senyawa 2-benzilidensikloheksana-1,3-dion dilaporkan dapat beraktivitas sebagai inhibitor angiogenesis. Salah satu senyawa yang dapat dikembangkan sebagai inhibitor angiogenesis adalah 2-(4´-klorobenzilidena)sikloheksanadion. Senyawa ini merupakan modifikasi dari 2-benzilidensikloheksana-1,3-dion, dengan menambahkan gugus kloro pada cincin benzenanya. Gugus kloro diduga dapat memperkuat aktivitas senyawa 2-(4´-klorobenzilidena)sikloheksanadion sebagai inhibitor angiogenesis karena dapat membuat posisi beta menjadi semakin positif.
Sintesis 2-(4´-klorobenzilidena)sikloheksanadion dilakukan dengan mereaksikan 1,3 sikloheksanadion 3mmol dan 4-klorobenzaldehid 3mmol menggunakan katalis KOH melalui reaksi kondensasi aldol silang. Analisis untuk senyawa hasil sintesis meliputi: uji organoleptis, uji kelarutan, uji Kromatografi Lapis Tipis (KLT), uji titik lebur, elusidasi struktur dengan spektroskopi infra-red (IR) dan kromatografi gas-spektrometri massa (GC-MS), dan uji kualitatif dengan menghitung crude product.
Senyawa hasil sintesis berupa serbuk halus, berwarna putih, tidak berbau, larut dalam kloroform dan tidak larut dalam aquadest, agak larut dalam metanol dan etanol, jarak lebur antara 217-2210C dan crude product 0,363g. Hasil uji KLT dengan fase gerak kloroform : etil asetat (9 : 1) dan fase diam silika gel GF254 adalah Rf
sebesar 0,370. Berdasarkan hasil kromatogram GC senyawa hasil sintesis, terlihat bahwa selain terdapat senyawa 2-(4´-klorobenzilidena)sikloheksanadion sebesar 10,27%, juga terdapat senyawa hasil reaksi samping yaitu (4Z)-4-(4-klorobenzilidena)-2-(3-oksosikloheks-1-enil)sikloheksan-1,3-dion sebesar 89,07%. Keberadaan dua senyawa tersebut dipertegas melalui hasil spektra IR dan MS.
xx ABSTRACT
Compound of 2-benzilidenecyclohexane-1,3-dion is known to have activity as an angiogenesis inhibitor. One of compound which can be developed as angiogenesis inhibitor is 2-(4´-chlorobenzilidene)cyclohexanadion. This compound was modificated from 2-benzilidenecyclohexane-1,3-dion by adding cloro group on
benzene. Cloro’s group predicted to increase the activity 2 -(4´-chlorobenzilidene)cyclohexanadion as an angiogenesis inhibitor because can cause the beta position became more positive.
Synthesis 2-(4´-chlorobenzilidene)cyclohexanadion carried out using cyclohexane-1,3-dion 3mmol and 4-clorobenzaldehyde 3mmol with potassium hydroxide as the catalyst through crossed aldol condensation reaction. Analysis of compound synthesizing by : organoleptic test, solubility test, Thin Layer Chromatograpy test, melting point test, and elucidation with Infra Red (IR) spectroscopy and Gas Chromatography-Mass Spectroscopy (GC-MS) and quantitative test involved the calculation of the crude product.
The result of this synthesis is a compound with fine powder form, white colors, odorless, soluble in chloroform, slightly soluble in aquadest, freely soluble in methanol and ethanol, melting point between 217-2210C, the crude product is 0,363g. TLC test with chloroform : acetic ethyl (9 : 1) as mobile phase and gel silica GF254
with Rf value was 0,370. Based on the results of the GC chromatograms of compounds synthesized, we have seen that in addition to compound 2-(4´-chlorobenzilidene)cyclohexanadion amounted to 10,27%, there are also compounds the side reactions are (4Z)-4-(4-clorobenzilidene)-2-(3-oxocyclohex-1-enil)cyclohexane-1,3-dion amount of 89,08%. The presence of two compounds were confirmed by the results of IR and MS spectra.
1
PENGANTAR
A. Latar Belakang
Angiogenesis merupakan suatu proses pembentukan pembuluh darah baru, yang dalam kondisi normal akan sangat penting peranannya dalam memproduksi sel, pengembangan dan penyembuhan luka. Akan tetapi, proses ini juga diketahui merupakan satu hal yang berperan penting dalam pertumbuhan dan metastasis suatu tumor. Tumor tidak dapat membesar lebih dari 1-2 mm jika tidak memiliki vaskularisasi yang baik. Zona 1-2 mm merupakan jarak maksimal nutrisi dan oksigen yang berasal dari pembuluh darah dapat terdifusikan ke jaringan sekitarnya. Ukuran tumor yang lebih besar dari 1-2 mm memerlukan suatu neovaskularisasi (angiogenesis). Oleh karena itu, pada dasarnya pertumbuhan tumor sangat dipengaruhi oleh keseimbangan faktor angiogenik dan faktor yang dapat menghambat angiogenik (Chrestella, 2009). Proses angiogenesis untuk dapat mempertahankan pertumbuhan tumor didukung oleh dua faktor, yaitu Vascular Endothelial Growth Factor (VEGF) dan Basic Fibroblast Growth Factor (bFGF) (Anonim, 2003).
2
penghambatan antara 87,1% - 98,2% pada konsentrasi 3μg/mL dan antara 90,4% -
98,1% pada konsentrasi 6μg/mL.
Gambar 1. Senyawa kurkumin sebagai senyawa penuntun dibagi menjadi tiga gugus
farmakofor A, B, dan C (Robinson et al., 2003)
Senyawa lain yang diduga memiliki aktivitas sebagai inhibitor angiogenesis adalah 2-benzilidensikloheksana-1,3-dion, telah berhasil disintesis oleh Istyastono E.P, Nunung Y., dan Jumina (2009). Salah satu senyawa yang dapat dikembangkan sebagai inhibitor angiogenesis adalah senyawa 2-(4´-klorobenzilidena)sikloheksanadion. Senyawa ini merupakan modifikasi struktur dari senyawa 2-benzilidensikloheksana-1,3-dion, yaitu dengan menambahkan gugus kloro pada cincin aromatiknya. Adanya penambahan gugus kloro ini diduga dapat meningkatkan aktivitas senyawa 2-benzilidensikloheksana-1,3-dion sebagai inhibitor angiogenesis. Pada dasarnya senyawa 2-benzilidensikloheksana-1,3-dion dapat
beraktivitas sebagai inhibitor angiogenesis karena memiliki atom C-beta (β) positif, akibat pengaruh adanya gugus C=O. Gugus kloro yang ditambahkan pada cincin aromatiknya diduga akan dapat meningkatkan aktivitasnya sebagai inhibitor angiogenesis. Gugus kloro merupakan gugus penarik elektron sehingga elektron pada
kekurangan elektron akan menarik elektron tetangganya, sehingga pada posisi β, yang tadinya telah bermuatan positif menjadi lebih elektropositif. Hasil modifikasi senyawa 2-benzilidensikloheksana-1,3-dion adalah senyawa 2-(4´-klorobenzilidena)sikloheksanadion.
O
O
Gambar 2. Struktur senyawa 2-benzilidensikloheksana-1,3-dion
Cl
O
O
Gambar 3. Struktur senyawa 2-(4´-klorobenzilidena)sikloheksanadion
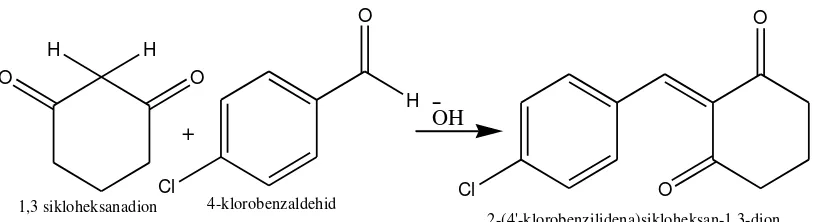
Sintesis senyawa 2-(4´-klorobenzilidena)sikloheksanadion dapat dilakukan dengan mereaksikan 1,3 sikloheksanadion dan 4 klorobenzaldehid dengan katalis basa kalium hidroksida (KOH). Reaksi yang terjadi pada sintesis 2-(4´-klorobenzilidena)sikloheksanadion adalah reaksi kondensasi aldol silang.
Katalis diperlukan dalam sintesis untuk menurunkan energi aktifasi suatu reaksi sehingga dapat mempersingkat suatu reaksi. Dengan kata lain, kecepatan suatu reaksi organik dapat ditingkatkan dengan adanya suatu katalis. Pada sintesis 2-(4´-klorobenzilidena) sikloheksanadion digunakan katalis basa KOH yang merupakan suatu basa kuat. Penggunaan KOH pada penelitian ini adalah karena adanya basa
4
KOH akan membuat hidrogen pada posisi alfta (α) yang dimiliki oleh 1,3 -sikloheksanadion lebih dapat tertarik sehingga akan dihasilkan suatu intermediet ion enolat yang lebih reaktif dan reaksi kondensasi aldol silang dapat berlangsung dengan cepat serta rendemen yang dihasilkan akan lebih banyak.
1. Permasalahan
Apakah 2-(4´-klorobenzilidena) sikloheksanadion dapat disintesis dari 1,3 sikloheksanadion dan 4-kloro benzaldehid dengan menggunakan katalis kalium hiroksida (KOH)?
2. Keaslian Penelitian
Sejauh pengetahuan peneliti, sintesis senyawa 2-(4´-klorobenzilidena) sikloheksanadion dari 1,3 sikloheksanadion dan 4-kloro benzaldehid dengan menggunakan katalis kalium hidroksida berdasarkan prinsip reaksi kondensasi aldol silang belum pernah dilakukan.
3. Manfaat Penelitian
a. Penulisan ini dapat memberikan manfaat teoritis, yaitu untuk :
b. Manfaat metodologinya adalah untuk:
Memberikan pengetahuan tentang cara sintesis 2-(4´-klorobenzilidena) sikloheksanadion dengan menggunakan reaksi kondensasi aldol silang.
c. Manfaat praktisnya adalah untuk:
Memberikan informasi tentang adanya pengembangan senyawa analog kurkumin yang dapat meningkatkan aktifitas farmakologinya.
B. Tujuan Penelitian
6 BAB II
PENELAAHAN PUSTAKA
A.Kurkumin sebagai Senyawa Penuntun (Senyawa Induk)
Robinson et al. (2003) membagi molekul kurkumin menjadi tiga bagian farmakofor yaitu bagian A, B, dan C. Bagian A dan C merupakan gugus aromatis dan B adalah ikatan dien-dion. Dua gugus aromatis tersebut baik simetris maupun tidak simetris menentukan potensi ikatan antara senyawa obat dengan reseptor. Oleh karena itu modifikasi dilakukan pada farmakofor A, B dan C. Modifikasi pada farmakofor A dan C adalah dengan mensubstitusi cincin aromatis pada farmakofor tersebut dengan gugus yang lain. Beberapa hasil pengujian membuktikan bahwa analog kurkumin dengan modifikasi pada farmakofor A dan C dengan substituen berbeda maupun modifikasi pada farmakofor B menjadi monoketon, menunjukkan hasil modifikasi memiliki potensi penghambatan pertumbuhan sel kanker yang lebih baik/poten dari kurkumin itu sendiri.
Gambar 4. Senyawa kurkumin sebagai senyawa penuntun dibagi menjadi tiga gugus
farmakofor A, B, dan C (Robinson et al., 2003)
dapat dihasilkan dari reaksi kondensasi antara suatu senyawa aldehid dengan suatu senyawa yang mengandung gugus karbonil melalui reaksi kondensasi dengan menggunakan katalis asam atau basa (Fessenden dan Fessenden, 1994).
Robinson et al. (2003) telah membuktikan perubahan gugus struktur β -diketon pada struktur kurkumin menjadi ikatan α,β tak jenuh monoketon menjadikan senyawa analog kurkumin dapat beraktivitas sebagai penghambat sel kanker, bahkan pada beberapa senyawa menunjukkan aktivitas yang lebih baik dibandingkan kurkumin. Berdasarkan analisis hubungan struktur dan aktivitas dibuktikan bahwa struktur dienon simetris memiliki potensi lebih baik untuk dikembangkan sebagai senyawa antikanker.
B. Sintesis Senyawa 2-(4´-klorobenzilidena) sikloheksanadion
Senyawa 2-(4´-klorobenzilidena) sikloheksanadion dapat disintesis dari starting material 1,3 sikloheksanadion dan 4-kloro benzaldehid dengan katalis basa
KOH. Senyawa 1,3 sikloheksanadion merupakan senyawa golongan keton sedangkan 4-klorobenzaldehid adalah suatu aldehid aromatis dengan substituen golongan halogen, yaitu kloro.
8
reaksi kondensasi aldol silang adalah suatu senyawa enon berkonjugasi alfa-beta (Fessenden dan Fessenden, 1994).
Di dalam suasana basa KOH, hidrogen alfa pada 1,3 sikloheksanadion akan terdeprotonasi membentuk ion enolat yang berperan sebagai nukleofil. Pembentukan ion enolat akan meningkatkan nukleofilisitas dari C alfa 1,3 sikloheksanadion dan dapat beresonansi membentuk karbanion yang kemudian menyerang atom C karbonil dari 4-kloro benzaldehid. Dari reaksi tersebut akan terbentuk produk senyawa aldol yang mudah terhidrasi sehingga menghasilkan senyawa enon 2-(4´-klorobenzilidena) sikloheksanadion.
kuat ini cukup kuat untuk menarik atom H pada posisi alfa pada senyawa 1,3-sikloheksanadion.
C. Analisis Pendahuluan
Analisis hasil ditujukan untuk mengetahui karakteristik dari senyawa hasil reaksi. Analisis pendahuluan yang dilakukan antara lain adalah:
1. Pemeriksaan Organoleptis
Uji ini merupakan uji yang paling sederhana dan memuat paparan mengenai suatu zat secara umum meliputi bentuk, warna, dan bau. Dalam pemeriksaan organoleptis tidak dapat digunakan menjadi suatu bukti yang cukup kuat sebagai syarat baku. Akan tetapi secara tidak langsung pemeriksaan ini dapat membantu dalam penilaian pendahuluan terhadap zat yang bersangkutan (Dirjen POM RI, 1995).
Pemeriksaan organoleptis berfungsi sebagai panduan awal yang dapat menyatakan senyawa hasil sintesis sudah terbentuk, dimana pada uji ini akan dapat diketahui perbedaan senyawa hasil sintesis dengan starting material dari segi karakteristik fisiknya (bentuk, warna, dan bau).
2. Pemeriksaan Kelarutan
10
kelarutan, kemurnian zat yang diperiksa dan pelarut harus benar-benar terjamin karena adannya sedikit pengotor dapat menyebabkan terjadinya variasi hasil (Jenkins, G.L., Knevel, A. M., Digangi, F.E., 1965).
Tabel I. Istilah kelarutan menurut Farmakope Indonesia IV Istilah Kelarutan Jumlah bagian pelarut (ml)
yang digunakan untuk melarutkan 1 bagian zat
(gram) Sangat mudah larut Kurang dari 1
Mudah larut 1 sampai 10
Larut 10 sampai 30
Agak sukar larut 30 sampai 100
Sukar larut 100 sampai 1000
Sangat sukar larut 1000 sampai 10.000 Praktis tidak larut Lebih dari 10.000
(Dirjen POM RI, 1995)
D. Pemurnian dan Pemeriksaan Kemurnian Senyawa Hasil Sintesis 1. Rekristalisasi
Tujuan yang paling utama dari rekristalisasi adalah untuk mengkristalkan kembali suatu senyawa dalam bentuk kristal yang baik, bukan dalam bentuk endapan yang halus yang dapat menarik kotoran karena permukaannya yang luas. Maka untuk menghindarkan adanya kotoran yang mengganggu proses rekristalisasi, pengotor harus larut dalam pelarut untuk rekristalisasi agar pengotor tidak akan ikut mengkristal (Bresnick, 1996).
Metode rekristalisasi ada beberapa macam dan digunakan sesuai dengan kondisi atau sifat dari zat yang akan direkristalisasi. Beberapa metode rekristalisasi tersebut antara lain adalah :
a. Mengkristalkan kembali secara langsung dari cairan pelarut. Metode ini dilakukan dengan melarutkan zat ke dalam suatu pelarut kemudian disaring dan dikristalkan dengan cara didiamkan pada suhu dingin.
b. Mengkristalkan kembali dengan asam dan basa. Prinsip dari metode ini adalah pembentukan kristal dengan menetralkan sifat senyawa. Senyawa yang sesuai direkristalisasi dengan metode ini adalah senyawa-senyawa yang bersifat asam atau basa. Senyawa yang bersifat asam dilarutkan dalam natrium hidroksida atau amonium hidroksida encer kemudian direkristalisasi dengan mentralisir pelarut. Senyawa yang bersifat basa dilarutkan dalam asam klorida atau asam sulfat kemudian direkristalisasi dengan menetralisir pelarut.
12
melakukan metode ini adalah dengan melarutkan senyawa yang akan direkristalisasi dalam suatu pelarut, kemudian dipilih pelarut kedua yang bercampur sempurna denagn pelarut pertama namun tidak dapat melarutkan senyawa yang direkristalisasi. Zat akan mengendap setelah penambahan pelarut kedua pada pelarut pertama.
Ada beberapa syarat yang harus dipenuhi oleh suatu pelarut agar dapat digunakan untuk merekristalisasi dengan hasil yang optimal. Pelarut yang baik untuk merekristalisasi adalah :
a. Dapat melarutkan senyawa dalam jumlah banyak pada pemanasan suhu tinggi dan sedikit melarutkan pada pemanasan suhu rendah.
b. Harus dapat melarutkan pengotor dengan segera pada temperature rendah atau tidak sama sekali dapat melarutkan atau hanya dapat sedikit melarutkan.
c. Dapat menghasilkan bentuk kristal yang baik dari senyawa yang dimurnikan serta mudah dipisahkan dari bahan utama (mempunyai titik didih yang relatif rendah). d. Pelarut dengan cara bagaimanapun tidak boleh bereaksi dengan senyawa yang
direkristalisasi (Reksohadiprojo, 1996).
2. Pemeriksaan Titik Lebur
suhu tetap dinaikkan terus maka molekul akan rusak dan berubah menjadi cairan (Bradstatter, 1971).
Pemeriksaan titik lebur dapat memberikan informasi mengenai kemurnian dari suatu produk hasil sintesis. Ketajaman jarak lebur senyawa merupakan criteria kemurnian suatu senyawa. Pada umumnya suatu senyawa dinyatakan murni bila jarak leburnya tidak lebih dari 2°C. Rentangan lebih besar dari harga ini dapat dikatakan senyawa kurang murni (MacKenzie, 1967).
Ada beberapa faktor yang mempengaruhi titik lebur senyawa padat, antara lain adalah :
d. Ikatan antar molekul. Semakin kuat ikatan antar molekul dari suatu senyawa, maka akan semakin besar energi yang diperlukan untuk memecahnya dan dengan kata lain titik lebur akan semakin tinggi. Ikatan yang dimaksud adalah ikatan hidrogen dan ikatan Van der Waals.
e. Kesimetrian. Apabila suatu molekul senyawa merupakan suatu senyawa yang simetri, maka energi yang akan diserap akan lebih banyak sehingga semakin simetri suatu senyawa, akan semakin tinggi pula titik leburnya. f. Ukuran molekul. Molekul yang berukuran lebih besar pada umumnya melebur pada suhu yang lebih tinggi.
14
h. Adanya pengotor. Adanya pengotor menyebabkan titik lebur menjadi lebih rendah atau lebih tinggi dari bahan yang murni, sehingga hal tersebut akan menyebabkan peleburan yang tidak nyata (Reksohadiprodjo, 1996).
3. Kromatografi Lapis Tipis (KLT)
Metode ini menggunakan dua fase, yaitu fase diam dan fase gerak yang memiliki kepolaran yang berbeda. Fase gerak akan bergerak naik melalui fase diam oleh karena gaya kapilaritas. Berdasarkan hal tersebut dapat dinyatakan jarak rambat senyawa pada fase diam (Rf) dapat digunakan sebagai cerminan polaritas suatu senyawa (Bresnick, 1996).
Metode ini digunakan untuk mengetahui apakah senyawa hasil sintesis sudah terbentuk atau belum (analisis secara kualitatif) (Gasparic and Churacek, 1978). Senyawa hasil sintesis ditotolkan pada plat KLT silika gel GF254 dan dielusi bersama
dengan pembanding starting material, yaitu 1,3 sikloheksanadion dan 4-klorobenzaldehid. Terbentuknya senyawa baru diindikasikan ketika pada totolan senyawa hasil sintesis menunjukkan Rf yang berbeda dengan Rf starting material.
4. Gas Chromatography-Mass Spectra (GC-MS)
Kromatografi gas merupakan instrumen analitis yang memberikan informasi baik kualitatif maupun kuantitatif mengenai komponen suatu sampel. Sedangkan spektroskopi massa merupakan suatu instrumen yang dapat memberikan informasi mengenai bobot molekul suatu senyawa.
Metode kromatografi gas dan spektrometri massa memberikan keuntungan saat keduanya digunakan secara bersamaan. Proses pemisahan dilakukan oleh kromatografi gas, sedangkan proses identifikasi dan kuantitatif dilakukan oleh spektrometri massa. Keuntungan dari kromatografi gas-spektrometri massa antara lain adalah metode ini dapat digunakan untuk hampir semua jenis analit, memiliki batas deteksi yang rendah, dan memberi informasi penting tentang spektra massa dari suatu senyawa organik (Dean, 1995).
E. Elusidasi Struktur
Elusidasi struktur penting dilakukan untuk mengetahui secara lebih benar mengenai struktur senyawa hasil sintesis yang telah diperoleh. Elusidasi struktur yang akan dilakukan antara lain adalah dengan :
1. Spektrofotometri Inframerah (IR)
16 mengulir (stretch) atau menekuk (blend). Apabila frekuensi energi elektromagnetik inframerah yang dilewatkan pada suatu molekul sama dengan frekuensi mengulur atau menekuknya ikatan, maka energi tersebut akan diserap. Serapan inilah yang dapat direkam oleh detektor pada spektrofotometri inframerah (Bresnick, 1996).
Gambar 5. Macam ikatan yang dipengaruhi oleh frekuensi
Ahli kimia telah mempelajari banyak sekali senyawa organik dan telah dapat menghubungkan macamnya ikatan dengan panjang gelombang atau frekuensi dari absorbs sinar infra merahnya. Karena itu, untuk dapat menentukan apakan suatu senyawa mengandung suatu macam ikatan, misalnya O-H, perlu dilakukan pengukuran energi absorpsi dari senyawa tersebut pada panjang gelombang atau frekuensi yang sesuai untuk ikatan tersebut. Apabila senyawa yang diukur tersebut mengabsorpsi energi yang ditentukan, hal itu berarti ikatan O-H ada dalam struktur senyawa, akan tetapi jika energi tidak diabsorpsi maka ikatan O-H tidak ada dalam struktur senyawa (Fessenden dan Fessenden, 1994)
fungsional. Ikatan nonpolar relative (ikatan C-C dan C-H dalam molekul organik) menyebabkan absorpsi yang lemah. Pada ikatan polar seperti C=O menunjukkan absorpsi yang kuat. Setiap jenis gugus fungsi dalam sebuah molekul mempunyai rentang daerah serapan yang berbeda-beda, sebagai contohnya adalah pada gugus O-H (alkohol), absorpsi inframerahnya menunjukan pola yang jelas pada 3200-3500 cm
-1
; gugus –O-CH3 (eter) menunjukkan peak pada 2830-2815 dan 1460-1450 cm-1
dengan intensitas lemah-sedang; senyawa yang mengandung gugus C=O (karbonil) menunjukkan absorpsi yang kuat dan nyata pada frekuensi 1650-1800 cm-1, dan masih banyak lagi (Fessenden dan Fessenden, 1994).
2. Spektroskopi Massa
18
Spektra massa merupakan grafik antara kelimpahan relatif fragmen bermuatan positif terhadap perbandingan massa/ muatan (m/z). Pecahnya suatu molekul atau ion menjadi fragmen-fragmen bergantung pada kerangka karbon dan gugus fungsional yang ada. Oleh karena itu, struktur dan massa fragmen memberikan petunjuk mengenai struktur molekul induknya. Selain itu, spektra massa digunakan juga untuk menentukan bobot molekul suatu senyawa (Fessenden dan Fessenden, 1986).
Dalam spektrum massa, setiap peak menyatakan suatu fragmen molekul secara spesifik. Fragmen-fragmen tersebut disusun sedemikian rupa sehingga peak-peak tertata menurut kenaikan m/z dari kiri ke kanan dalam spektra. Intensitas peak
sebanding dengan kelimpahan relatif dari fragmen-fragmen, dan tergantung pada stabilitas relatif fragmenya. Peak yang tertinggi pada spektra disebut peak dasar (base peak) dan intensitasnya sebesar 100%. Peak dasar dihasilkan dari ion molekul, akan tetapi lebih sering dihasilkan dari suatu fragmen yang lebih kecil (Silverstein, R.M., Bassler G.C, dan Morril T.C, 1991).
Bentuk-bentuk dasar fragmentasi dan aturan-aturan yang berhubungan dengan proses fragmentasi adalah sebagai berikut :
a. Pemutusan ikatan σ dalam gugus alkana. Hal ini dapat terjadi karena terdapat energi eksitasi yang terkonsentrasi pada pemutusan ikatan hingga dapat terionisasi.
c. Aturan elektron genap. Aturan ini menyatakan bahwa spesies yang memiliki elektron genap biasanya tidak akan pecah menjadi dua spesies yang mengandung elektron ganjil (spesies radikal dan ion radikal), karena energy total dari hasil campuran akan sangat tinggi. Spesies dengan elektron genap lebih sering terpecah menjadi ion lain dan molekul netral.
d. Efek suatu heteroatom atau gugus karbonil. Ikatan C-C dekat dengan
heteroatom (posisi α terhadap heteroatom) sering terpecah meninggalkan
muatan pada fragmen yang mengandung heteroatom yang mempunyai elektron yang tidak berikatan untuk menstabilkan resonansinya. Tipe fragmentasi ini disebut pembelahan-α (α-fission) (Sastrohamidjojo, 2001). e. Efek percabangan. Adanya percabangan pada suatu rantai hidrogen menghasilkan fragmentasi yang terjadi terutama pada cabang, kerena ion radikal sekunder dan karbokation sekunder akan lebih stabil daripada yang primer. Stabilitas karbokation adalah faktor yang lebih penting daripada stabilitas radikal bebas.
f. Hilangnya sebuah molekul kecil. Molekul kecil yang stabil seperti H2O,
CO2, CO dan C2H4 dapat terlepas dari sebuah ion molekuler. Sebagai
contohnya sebuah alkohol mudah kehilangan H2O. Eliminasi H2O dari
kebanyakan alkohol sangat mudah sehingga peak ion molekuler tersebut tidak dapat dijumpai dalam spektra.
20
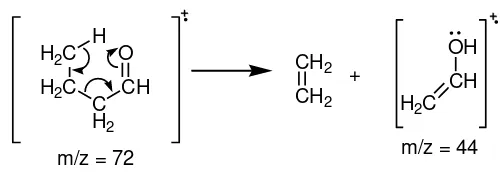
ulang McLafferty. Dalam penataan ulang ini, akan dilepaskan suatu alkena dari ion molekuler tersebut (Fessenden dan Fessenden, 1986).
Gambar 6. Penataan ulang McLafferty
F. Landasan Teori
O
H H
O
Cl
O
H
O
O
+ OH
Cl
1,3 sikloheksanadion 4-klorobenzaldehid
2-(4'-klorobenzilidena)sikloheksan-1,3-dion
Gambar 7. Reaksi umum sintesis senyawa 2-(4´-klorobenzilidena) sikloheksanadion dengan katalis basa KOH
G. Hipotesis
22 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam penelitian eksperimental deskriptif non-analitik. Pada penelitian ini tidak ada perlakuan pada subjek uji dan hanya dipaparkan fenomena yang terjadi yang tidak terdapat hubungan sebab akibat.
B. Definisi Operasional
1. Starting material adalah bahan yang digunakan untuk penelitian. Reaktan yang digunakan dalam penelitian ini adalah 4 kloro benzaldehida dan 1,3-sikloheksandion.
2. Katalis adalah suatu senyawa yang digunakan dalam reaksi untuk meningkatkan laju reaksi kimia. Dalam penelitian ini digunakan katalis kalium hidroksida. 3. Senyawa target adalah senyawa yang diharapkan terbentuk dari reaksi. Senyawa
target yang diharapkan terbentuk adalah senyawa 2-(4´-klorobenzilidena) sikloheksanadion.
C. Bahan Penelitian
D. Alat Penelitian
Pemanas Listrik dan pengaduk magnetik (Herdolph MR 2002), pengering (Memmert Oven Model 400), neraca analitik (Mextler PM 100), thermophan (Electrothermal 9100), seperangkat alat gelas, klem, statif, termometer, corong Buchner, vacuum pump, mikropipet, baskom, kertas saring, dropple plate,
seperangkat alat reflux (labu alas bulat dan pendingin alihn), waterbath, shaker, lampu UV254 nm, spektrometer IR (IR Shimadzu Prestige-21), kromatografi
gas-spektrometer massa (Shimadzu QP 2010S).
E. Tata Cara Penelitian
1. Sintesis 2,4 Klorobenzilidena sikloheksanadion a. Pembuatan larutan KOH 2% b/v
KOH sebanyak 0,200 gram dilarutkan dalam aquades 1 mL. Larutan tersebut dimasuukan ke dalam labu takar 10 mL dan ditambah etanol hingga mencapai batas tanda.
b. Pembuatan larutan 1,3 sikloheksanadion
1,3 sikloheksanadion 3,0 mmol (0,33 gram) dimasukkan ke dalam erlenmeyer 50 mL dan dilarutkan dengan 10 mL larutan KOH 2% b/v. c. Pembuatan larutan 4-klorobenzaldehid
24
d. Sintesis senyawa 2-(4´-klorobenzilidena) sikloheksanadion
Larutan 1,3 sikloheksanadion dan larutan 4 klorobenzaldehid dicampur kemudian dimasukkan ke dalam labu alas bulat (LAB) leher tiga yang telah dirangkaikan dalam rangkaian sistem refluks. Campuran larutan tersebut dipanaskan di atas waterbath pada suhu 850C dan direfluks selama 2 jam. Senyawa hasil sintesis dimasukkan dalam erlemeyer 100 mL dan diekstraksi.
2. Isolasi senyawa hasil sintesis
Larutan hasil sintesis ditambah asam asetat glasial 20 mL terlebih dahulu, kemudian aquades 20 mL. Campuran tersebut diisolasi dengan cara dikocok pada alat pengocok (shaker) selama 30 menit.
3. Kristalisasi (pendesakan padatan)
4. Analisis senyawa hasil sintesis a. Pemeriksaan organoleptis
Senyawa hasil sintesis diamati sifat fisiknya, yang meliputi bentuk, warna, dan bau.
b. Pemeriksaan kelarutan
Senyawa hasil sintesis sebanyak 10 mg dimasukkan ke dalam tabung reaksi, kemudian ditambahkan dengan aquades tetes demi tetes, amati kelarutannya. Lakukan dengan prosedur yang sama menggunakan pelarut lain yaitu etanol dan kloroform. Kemudian bandingkan kelarutannya dengan starting material yang digunakan, yaitu 1,3-sikloheksanadion, terephtalaldehid, dan 4 kloro benzaldehid.
c. Pemeriksaan titik lebur
Sedikit kristal hasil sintesis dimasukkan ke dalam electrothermal capillary tubes, kemudian dimasukkan ke dalam alat pengukur titik lebur
(thermophan). Amati peleburan kristalnya dan catat suhu waktu pertama kali melebur hingga kristal melebur seluruhnya.
a. Kromatografi Lapis Tipis (KLT)
26
Fase gerak yang digunakan adalah kloroform:etil asetat (9:1) dan pengembangan dilakukan dengan jarak rambat 10 cm.
b. Gas Chromatography-Mass Spectroscopy (GC-MS)
Pemeriksaan kemurnian senyawa hasil sintesis dilakukan dengan kromatografi gas dengan kondisi alat: suhu injector 300°C, jenis kolom Rtx-5MS, panjang kolom 30 meter, suhu kolom diprogram 100-300°C, gas pembawa helium, tekanan 22 kPa, kecepatan alir fase gerak 0,5 ml/menit, dan detektor ionisasi nyala. Cuplikan senyawa hasil sintesis dilarutkan dalam kloroform, kemudian diinjeksikan kedalam injektor pada alat kromatografi gas. Aliran gas dari gas pengangkut helium akan membawa cuplikan yang sudah diuapkan masuk kedalam kolom Rtx-5MS yang dilapisi fase cair dimethylpolysiloxane. Selanjutnya cuplikan diukur oleh detektor hingga
diperoleh suatu kromatogram.
5. Elusidasi struktur senyawa hasil sintesis a. Spektrofotometri inframerah
spektra inframerah dari senyawa yang bersangkutan. Bilangan gelombang yang digunakan 400-4000 nm.
b. Spektrometri massa
Uap cuplikan senyawa hasil sintesis yang keluar dari kolom kromatografi gas dialirkan ke dalam kamar pengion pada spektromoter massa untuk ditembak dengan seberkas elektron hingga terfragmentasi. Jenis pengionan yang digunakan adalah EI (Electron Impact) 70 eV. Fragmen-fragmen akan melewati lempeng mempercepat ion dan didorong menuju tabung analisator, dimana partikel-partikel akan dibelokkan dalam medan magnet dan menimbulkan arus pada kolektor yang sebanding dengan kelimpahan relatif setiap fragmennya. Kelimpahan relatif setiap fragmen akan dicatat dan menghasilkan data spektra massa.
F. Analisis Hasil 1. Rendemen
Berat senyawa hasil sintesis ditimbang dan dibandingkan dengan berat senyawa berdasar teori, kemudian dikalikan 100%. Perhitungan rendemen ini dilakukan setelah didapatkan kristal murni hasil sintesis (yang telah dikeringkan).
28
2. Analisis Pendahuluan
Analisis pendahuluan senyawa hasil sintesis berdasarkan data organoleptis dan pemeriksaan kelarutan.
3. Pemeriksaan Kemurnian Senyawa Hasil Sintesis
Pemeriksaan kemurnian senyawa hasil sintesis berdasarkan data pemeriksaan titik lebur, kromatografi lapis tipis (KLT), dan GC-MS.
4. Elusidasi Struktur
29
HASIL DAN PEMBAHASAN
A.Sintesis 2-(4΄-klorobenzilidena) sikloheksanadion
Sintesis 2-(4΄-klorobenzilidena)sikloheksanadion dilakukan dengan mereaksikan sikloheksana-1,3-dion dan 4-klorobenzaldehid melalui reaksi kondensasi aldol silang. Sikloheksana-1,3-dion merupakan suatu senyawa yang mempunyai gugus keton dan hidrogen alfa (hidrogen α), dan 4-klorobenzaldehid merupakan senyawa yang memiliki gugus aldehid. Kedua senyawa tersebut sangat memungkinkan untuk bereaksi melalui reaksi kondensasi aldol silang membentuk
2-(4΄-klorobenzilidena)sikloheksanadion.
Gambar 8. Dua hidrogen α pada sikloheksana-1,3-dion
Cl
H O
Gambar 9. 4-klorobenzaldehid
Hidrogen α pada sikloheksana-1,3-dion bersifat asam, sehingga adanya
katalisator yang bersifat basa, dalam hal ini kalium hidroksida (KOH), hidrogen α
O O
H H
30
akan dilepaskan dan akan membentuk suatu atom karbon alfa (karbon α) bermuatan parsial negatif atau terbentuk ion enolat. Dengan terbentuknya ion enolat tersebut, maka sikloheksanadion akan memiliki sifat sebagai nukleofil yang akan menyerang atom karbon karbonil yang dimiliki oleh 4-klorobenzaldehid yang bermuatan parsial positif yang diakibatkan dari induksi elektron oleh oksigen dan adanya resonansi.
O bar 10. Mekanisme reaksi pembentukan ion enolat
O
Gambar 11. Mekanisme reaksi sintesis senyawa 2-(4´-klorobenzilidena)
sikloheksanadion
32
dibutuhkan konsentrasi KOH yang cukup rendah adalah untuk mencegah adanya kemungkinan terjadinya reaksi self condensation yang akan mendorong terbentuknya produk sampingan.
Setelah selesai dilakukan pembuatan ion enolat, kemudian direaksikan dengan 4-klorobenzaldehid untuk membentuk 2-(4´-klorobenzilidena)sikloheksanadion dengan cara merefluks campuran larutan selama 2 jam. Pada proses refluks, uap dari starting material yang direaksikan akan terkondensasi menjadi cairan dan akan turun untuk kembali bereaksi dalam larutan, sehingga dengan kondisi tersebut akan terbentuk suatu sistem dengan kestabilan termondinamika yang terjaga dengan baik. Oleh karena itu reaksi akan berjalan lebih sempurna, dan kemungkinan dihasilkannya suatu produk akan lebih besar.
Penambahan campuran asam asetat glasial : aquades (1 : 1) ini selain untuk mengisolasi senyawa juga untuk menghilangkan sifat basa dari larutan. Hal ini dibuktikan dengan pengujian pH larutan, dimana setelah ditambahkan campuran asam asetat glasial : aquades (1 : 1), pH larutan menjadi asam, yaitu pada pH 3. Setelah dilakukan penambahan campuran pengisolasi, ternyata hasil sintesis masih tetap dalam bentuk cairan. Oleh karena itu perlu dilakukan pendesakan dengan aquades dingin untuk membantu munculnya bentuk padat dari senyawa 2-(4΄ -klorobenzilidena)sikloheksanadion. Dalam hal ini diperkirakan senyawa 2-(4΄ -klorobenzilidena)sikloheksanadion merupakan senyawa yang kurang polar sehingga adanya penambahan aquades tidak akan melarutkan senyawa hasil sintesis namun akan mendesak senyawa hasil sintesis untuk membentuk suatu padatan. Setelah diperkirakan tidak ada lagi padatan yang terdesak oleh aquades, dilakukan penyaringan, pengeringan dan penimbangan serbuk kering.
Pendesakan dengan aquades dingin ini adalah salah satu metode rekristalisasi, namun dengan metode ini tidak dapat dihasilkan suatu kristal yang murni. Oleh karena itu, penimbangan hasil serbuk kering yang didapatkan tidak dapat dihitung sebagai suatu rendemen, melainkan sebagai crude product. Dari hasil penelitian, dengan perbandingan mol 1,3-s xikloheksanadion dan 4-klorobenzaldehid sebesar 1 : 1 diperoleh rata-rata crude product sebesar 0,363 gram.
-34
klorobenzilidena)sikloheksanadion adalah sukar terbentuknya ion enolat karena
adanya halangan sterik yang cukup besar yang melingkupi atom hidrogen α pada
senyawa 1,3-sikloheksanadion. Adanya halangan sterik tersebut menjadikan atom
hidrogen α sukar untuk ditarik oleh ion OH- dari basa KOH yang ditambahkan
sehingga ion enolat menjadi sukar terbentuk. Akan tetapi, dengan sifat kebasaan dari
KOH yang cukup kuat, kemungkinan hidrogen α sukar tertarik oleh ion OH- adalah
sangat kecil, sehingga pada reaksi ini tetap akan terbentuk ion enolat.
Faktor lain yang mungkin dapat berpengaruh adalah adanya peristiwa self-condentation. Hal ini dipengaruhi oleh sifat elektrofilisitas dari atom C karbonil pada
B. Analisis Pendahuluan 1. Pemeriksaan organoleptis
Hasil pemeriksaan organoleptis yang meliputi bentuk, warna dan bau senyawa hasil sintesis dibandingkan dengan starting material, yaitu sikloheksan-1,3-dion dan 4-klorobenzaldehid ditunjukkan pada tabel II dan juga foto pada gambar 12. Tabel II. Perbandingan organoleptis senyawa hasil sintesis dengan starting
material Pemeriksaan Senyawa
hasil sintesis
Sikloheksan-1,3-dion 4-klorobenzaldehid
Bentuk Serbuk halus Serbuk halus Serbuk Kristal
Warna Putih Krem Putih
Bau Tidak berbau Khas Khas (menyengat)
A. B. C.
Gambar 12. Foto senyawa hasil sintesis dan starting material
Keterangan gambar : A : senyawa hasil sintesis B : 1,3-sikloheksanadion C : 4-klorobenzaldehid
36
2. Pemeriksaan kelarutan
Pemeriksaan kelarutan senyawa hasil sintesis dilakukan untuk mengetahui kelarutan senyawa dalam pelarut polar atau nonpolar dan juga berfungsi sebagai acuan dalam memilih pelarut dalam pemeriksaan dengan metode Kromatografi Lapis Tipis (KLT) maupun dengan instrument Gas Chromatography-Mass Spectroscopy (GC-MS).
Hasil pemeriksaan kelarutan menggunakan pelarut aquades, metanol, etanol, kloroform, aseton, dan piridin terhadap senyawa hasil sintesis dan starting material ditunjukkan pada tabel III.
Tabel III. Perbandingan kelarutan senyawa hasil sintesis dengan starting material
Pelarut Senyawa hasil sintesis Sikloheksan-1,3-dion 4-klorobenzaldehid Aquades Praktis tidak larut Larut Sangat sukar larut Metanol Agak sukar larut Mudah larut Larut
Etanol Agak sukar larut Mudah larut Larut
Kloroform Mudah larut Larut Larut
C Cl H Cl
Cl
O
O Cl
Kelarutan senyawa hasil sintesis dalam kloroform, selain karena pengaruh dari atom karbon yang terkandung, juga dikarenakan adanya interaksi dipo-dipol antara gugus kloro dari senyawa hasil sintesis dengan atom C dari kloroform. Interaksi tersebut dijelaskan pada gambar berikut (gambar 13) :
Gambar 13. Kemungkinan interaksi yang terjadi antara senyawa senyawa 2-(4´-klorobenzilidena) sikloheksanadion dengan kloroform
38
Dari penelitan diperoleh data sebagai berikut :
Gambar 14. Kromatogram Senyawa Hasil Sintesis Keterangan:
Uji KLT menggunakan fase diam gel GF254, fase gerak kloroform : etil asetat (9 : 1),
jarak pengembangan 15 cm, pengamatan bercak dilakukan di bawah sinar UV254
Tabel IV. Keterangan gambar kromatogram senyawa hasil sintesis
Bercak Senyawa Rf
A 4-klorobenzaldehid 0,665
B 1,3-sikloheksanadion 0,025
C hasil sintesis (2-(4´-klorobenzilidena) sikloheksanadion) 0,370 Berdasarkan kromatogram tersebut dapat dilihat bahwa masing-masing totolan menghasilkan bercak tunggal setelah pengembangan sistem KLT. Pada cahaya visual, bercak senyawa hasil sintesis dan starting material tidak tampak. Setelah diamati di bawah sinar UV254nm, bercak senyawa hasil sintesis dan starting material tampak
yang ditotolkan merupakan suatu senyawa murni. Oleh karena itu perlu dibuktikan lebih lanjut dengan uji selanjutnya.
4. Uji titik lebur senyawa hasil sintesis
Pengujian titik lebur dilakukan terhadap senyawa hasil sintesis yang sudah direkristalisasi, atau dengan kata lain dilakukan terhadap senyawa yang sudah dimurnikan. Dari pengujian titik lebur diketahui bahwa titik lebur senyawa hasil sintesis adalah 217-2210C. Jarak titik lebur tersebut cukup besar, yaitu 40C. Hal tersebut menunjukkan bahwa senyawa hasil sintesis belum seratus persen merupakan senyawa murni. Suatu senyawa dikatakan murni jika jarak titik lebur tidak lebih dari 20C (MacKenzei, 1967).
40
C. Elusidasi Struktur Senyawa Hasil Sintesis 1. Pengujian senyawa hasil sintesis dengan spektroskopi IR
Spektroskopi inframerah (spektroskopi IR) digunakan untuk mengetahui gugus-gugus fungsional yang terdapat dalam suatu senyawa. Spektra IR senyawa hasil sintesis ditujukkan pada gambar berikut ini (gambar 15).
Gambar 15. Spektra Infra merah senyawa hasil sintesis
gelombang 3410,15 cm-1. Gugus karbonil yang terkonjugasi dengan suatu alkena tampak pada bilangan gelombang 1604,77 cm-1. Selain itu, ada pula pita dari spektra tersebut yang menunjukkan adanya gugus sikloheksana pada bilangan gelombang 2924,09 cm-1. Ikatan C=C alkena yang terkonjugasi dengan fenil ditunjukkan oleh pita yang terletak pada bilangan gelombang 1650 cm-1 (Sastrohamidjojo, 2001), namun tidak terlihat pada hasil spektra IR yang diperoleh. Dan interpretasi yang terakhir adalah adanya ikatan C-Cl yang terletak pada posisi para, yang ditunjukkan oleh pita pada bilangan gelombang 1111,0 cm-1.
Tabel V. Interpretasi spektra inframerah senyawa hasil sintesis Bilangan gelombang - 825,53 - Lemah - Gugus aromatik tersubstitusi
42
spektra starting material. Berikut adalah gambar spektra IR starting material dan tabel yang dapat menunjukkan adannya perbedaan antara senyawa hasil sintesis dengan starting material.
Gambar 16. Spektra Infra merah 4-klorobenzaldehid (Kinugasa. S., Tanabe, K., Tamura, T., 2009a).
Dari spektra tersebut dapat diinterpretasikan adanya gugus C-O aldehid pada bilangan gelombang 1699 cm-1 dan aromatik pada 1919 cm-1 dengan overtone pada bilangan gelombang 3089 cm-1. Gugus aromatik tersubstitusi para juga dapat terlihat pada bilangan gelombang 841 cm-1 dan ikatan C-Cl pada posisi para terlihat pada bilangan gelombang 1094 cm-1.
Gambar 17. Spektra Infra merah 1,3-sikloheksanadion (Kinugasa. S., Tanabe, K., Tamura, T., 2009b).
1402 cm-1. Dari kedua spektra IR starting material tersebut, terlihat ada perbedaan dengan spektra IR senyawa hasil sintesis. Perbedaan tersebut dijelaskan pada tabel berikut ini :
Tabel VI. Perbedaan Interpretasi Spektra Starting Material dengan Senyawa Hasil Sintesis
Gugus Fungsi 1,3-sikloheksanadion 4-klorobenzaldehid Senyawa hasil sintesis
Akan tetapi hasil interpretasi spektra IR tentang gugus fungsional belum cukup kuat untuk menyatakan senyawa yang dihasilkan dari hasil sintesis merupakan 2,4-(klorobenzilidena)sikloheksanadion. Oleh karena itu, untuk lebih meyakinkan lagi bahwa senyawa yang diperoleh sudah merupakan senyawa 2,4-(klorobenzilidena)sikloheksanadion perlu didukung adanya data spektra MS.
2. Pengujian senyawa hasil sintesis dengan GC-MS
44
Gambar 18. Kromatogram Gas-Chromatography senyawa hasil sintesis
Gambar 19. Spektra Mass Spektroscopy senyawa hasil sintesis pada waktu retensi
19,656
Elusidasi struktur senyawa hasil sintesis dengan spektroskopi massa yang dikombinasikaan dengan kromatografi gas atau yang sering disebut GC-MS memiliki keuntungan, yaitu dapat memisahkan senyawa target dari senyawa lain yang mungkin bercampur dengan senyawa hasil sintesis, dengan kromatografi gas, sebelum dideteksi lebih lanjut dengan spektrometer massa. Dengan adanya proses pemisahan tersebut, diharapkan spektra massa yang dihasilkan benar-benar merupakan spektra dari senyawa hasil sintesis.
C
\
D
\
E
\
F
Dari gambar 18, terlihat bahwa senyawa hasil sintesis mempunyai tiga peak dengan waktu retensi 19,656 menit, 23,446 menit, dan 26,568 menit, dengan Area Under Curve (AUC) terbesar ada pada waktu retensi 26,568 menit. Munculnya tiga peak pada kromatogram menunjukkan bahwa sampel senyawa hasil sintesis belum murni.
Peak dengan waktu retensi 19,656 menit memiliki ion molekul dengan m/z =
236, dimana m/z tersebut sesuai dengan bobot molekul senyawa 2,4-(klorobenzilidena)sikloheksanadion, yaitu 236 g/mol. Kemurnian peak yang menunjukkan senyawa 2,4-(klorobenzilidena)sikloheksanadion adalah sebesar 10,27%.
Pada pembahasan sebelumnya, dari proses sintesis didapatkan rata-rata crude product sebesar 0,363 gram. Setelah diketahui kemurnian dari senyawa
2,4-(klorobenzilidena)sikloheksanadion adalah 10,27% dari total sampel yang diuji, maka dapat dikatakan bahwa rendemen yang dihasilkan dari proses sintesis adalah sebesar 5,23%. Pada gambar 16 terlihat beberapa nilai m/z dengan intensitas yang bervariasi. Fragmen dengan intensitas 100% adalah ion yang paling stabil dan peaknya disebut base peak. Ion dengan nilai m/z = 199 merupakan ion dengan kelimpahan paling
besar dan ion ini merupakan ion molekul yang paling stabil.
46
yang mengalami pelepasan senyawa isotop klorin (Cl dengan M.W=37). Pada peak C merupakan fragmentasi lanjutan dari ion [C13H11O2]+ dengan melepaskan molekul
C2H4 menghasilkan ion [C11H8O]+ pada m/z = 86. Setelah mengalami fragmentasi
ion, selanjutnya ion yang terbentuk juga akan terfragmentasi lagi, dan hal tersebut terbaca pada peak D dengan m/z = 72. Fragmen ini terbentuk setelah ion [C11H8O]+
mengalami pelepasan ion [CO]+. Molekul netral yang terbentuk kemudian akan terfragmentasi lagi melepaskan molekul C2H2O sehingga membentuk peak dengan
m/z = 51 (peak E). Selanjutnya molekul tersebut masih akan terfragmentasi melepaskan C2H2 membentuk suatu molekul C6H6 (m/z= 75) yang ditunjukkan oleh
O
Gambar 20. Interpretasi pelepasan molekul senyawa
2,4-(klorobenzilidena)sikloheksanadion menjadi
fragmen-fragmennya
48
O
Cl O
O
spektroskopi massanya, pada peak ketiga ini memiliki ion molekul dengan m/z = 331, oleh karena itu, senyawa ini memiliki bobot molekul sebesar 331 g/mol.
Gambar 21. Spektra Mass Spektroscopy senyawa hasil sintesis pada waktu retensi
26,568 menit
Perkiraan struktur senyawa yang merupakan hasil reaksi samping dari proses sintesis ini adalah produk sampingan yang dihasilkan dari reaksi sintesis yang terjadi adalah :
Gambar 22. Struktur senyawa (4 Z)-4-(4-klorobenzilidena)-2-(3-oksosikloheks-1-enil)sikloheksan-1,3-dion (hasil reaksi samping)
Agar dapat menjelaskan secara lebih lengkap hasil spektra MS pada waktu retensi 26,568 menit dan mempertegas bahwa senyawa yang terbentuk akibat reaksi samping adalah senyawa (4 klorobenzilidena)-2-(3-oksosikloheks-1-enil)sikloheksan-1,3-dion, maka akan dijabarkan usulan fragmentasi yang terjadi pada senyawa (4
Z)-4-(4-klorobenzilidena)-2-(3-oksosikloheks-1-enil)sikloheksan-1,3-dion. Dan fragmentasinya
O
Gambar 23. Interpretasi pelepasan molekul senyawa (4 Z)-4-(4-klorobenzilidena)-2-(3-oksosikloheks-1-enil)sikloheksan-1,3-dion (hasil reaksi samping) menjadi
50
Senyawa tersebut terbentuk karena adanya reaksi self-condentation antar senyawa 1,3-sikloheksanadion. Reaksi self-condentation ini terjadi karena pada senyawa 1,3-sikloheksanadion selain memiliki sisi nukleofil juga memiliki sisi elektrofil (pada atom C karbonilnya). Elektrofil pada C karbonil dari 1,3 sikloheksanadion lebih kuat daripada elektrofil pada C karbonil dari 4-klorobenzaldehid. Hal tersebut yang menyebabkan ion enolat yang terbentuk akan lebih sering menyerang atom C karbonil dari 1,3-sikloheksanadion daripada menyerang atom C karbonil dari 4-klorobenzaldehid (Fessenden dan Fessenden, 1986). Setelah terjadi reaksi self-condensation, atom karbon α lain pada 1,3-sikloheksanadion akan menyerang atom C karbonil dari 4-klorobenzaldehid, sehingga terbentuklah senyawa (4 Z)-4-(4-klorobenzilidena)-2-(3-oksosikloheks-1-enil)sikloheksan-1,3-dion. Senyawa hasil reaksi samping ini diperkirakan juga memiliki aktivitas sebagai inhibitor angiogenesis karena memiliki atom C pada posisi beta yang bermuatan elektropositif,
seperti yang dimiliki oleh senyawa 2-(4´-(klorobenzilidena)sikloheksanadion, yang juga diperkirakan memiliki aktivitas sebagai inhibitor angiogenesis.
O H H O
52 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Senyawa 2-(4´-(klorobenzilidena)sikloheksanadion dapat terbentuk dari hasil sintesis antara 1,3-sikloheksanadion dan 4-klorobenzaldehid dengan menggunakan katalis kalium hidroksida dengan hasil kermurnian pada kromatogram GC sebesar 10,27%. Dari hasil sintesis juga terbentuk hasil reaksi samping berupa senyawa (4Z)-4-(4-klorobenzilidena)-2-(3-oksosikloheks-1-enil)siklohkesan-1,3-dion dengan hasil kemurnian pada kromatogram GC sebesar 89,07%.
B. Saran
1. Perlu dilakukan optimasi proses sintesis, misalnya urutan pencampuran, suhu, dan waktu untuk bereaksi, agar dapat memperoleh senyawa hasil reaksi dengan rendemen yang lebih besar dan reaksi yang lebih cepat.
DAFTAR PUSTAKA
Anonim, 2003, Angiogenesis, The Leukemia & Lymphoma Society New York. Anwar, C., Pranowo, H. D., dan Wahyuni, T. D., 1994, Pengantar Praktikum Kimia
Organik, UGM Press, Yogyakarta, 73, 189.
Bradstatter, M. K., 1971, Thermomicroscopy’s Analysis of Pharmaceutical, Pergamon Press, London, 1-10.
Bresnick, S. D., 1996, Intisari Kimia Organik, Hipokrates, Jakarta, 96-97, 101-107. Chrestella, J., 2009, Neoplasma, Departemen Patologi Anatomi Fakultas Kedokteran
Universitas Sumatera Utara, Medan, 2-6.
Dean, J. A., 1995, Analytical Chemistry Handbook, McGraw-Hill. Inc., New York, pp 13, 26.
Direktorat Jenderal Pengawasan Obat dan Makanan RI, 1995, Farmakope Indonesia, jilid IV, Departemen Kesehatan Republik Indonesia, Jakarta, 1125.
Fessenden, R.J. and Fessenden, J.S., 1986, Kimia Organik, Jillid 1, Penerbit Erlangga, Surabaya, 314-351.
Fessenden, R.J. and Fessenden, J.S., 1994, Kimia Organik, Jilid 2, Penerbit Erlangga, Jakarta, 179-183.
Gasparic, J., and Churacek J., 1978, Laboratory Handbook of Paper and Thin Layer Chromatography, Ellis Horwood Limited, England, pp 63.
Istyastono, E. P, Nunung, Y, dan Jumina, 2009, Sintesis Senyawa Berpotensi sebagai Inhibitor Angiogenesis : 2-Benziliden Sikloheksana-1,3-dion, Majalah Farmasi Indonesia (MFI), 20(1), 2.
Jenkins, G.L., Knevel, A. M., Digangi, F. E., 1965, Quantitative Pharmaceutical Chemistry, Sixth Edition, McGraw-Hill Book Company, New York.
54
Kinugasa, S., Tanabe, K., Tamura, T., 2009a, Spectral Database for Organic Compounds, AIST, http://riodb01.ibase.aist.go.jp/sdbscgi-bin/cre_frame_disp.cgi.spectrum_type=ir&sdbsno=1285, diakses pada tanggal 27 Desember 2010
Kinugasa, S., Tanabe, K., Tamura, T., 2009b, Spectral Database for Organic Compounds, AIST, http://riodb01.ibase.aist.go.jp/sdbscgi-bin/direct_frame_top.cgi, diakses pada tanggal 27 Desember 2010
MacKenzie, 1967, Experimental Organic Chemistry, 3rd Edition, Prentice-Hall Inc., Englewood Cliffs, New Jersey.
Pretsch, Erno, Philippe Buhlmann, Martin Badertscher, 2009, Structure Determination of Organic Compounds Tables of Spectral Data, 4th edition, Springer-Verlag, Berlin, 269-324.
Reksohadiprodjo, M.S., 1996, Kuliah dan Praktika Kimia Farmasi Preparatif : seri Kimia Fisika Organik, 7-12, 35-37, Fakultas Farmasi UGM, Yogyakarta. Robinson, T. P., Ehlers, T., Hubbard IV, R. B., Bai Xianhe, Arbiser, J. L., Goldsmith,
D. J, and Bowen, J.P., 2003, Design, Synthesis, and Biological Evaluation of Angiogenesis Inhibitors: Aromatic Enone and Dienone Analogues of Curcumin, Bioorg. Med. Chem. Lett, 13, 115-117.
Sastrohamidjodjo, H., 2001, Spektroskopi, Penerbit Liberty, Yogyakarta, 11, 99-100, 163-164.
LAMPIRAN
Lampiran 1 : Perhitungan crude product senyawa hasil sintesis dan senyawa hasil reaksi samping dan perkiraan rendemen
O O
BM senyawa hasil sintesis = 236 g/mol Crude product yang diperoleh :
- Percobaan I = 0,407 gram - Percobaan II = 0,343 gram - Percobaan III = 0,338 gram Rata-rata crude product = 0,363 gram
Persen kemurnian yang diperoleh dari kromatogram GC untuk senyawa hasil sintesis adalah 10,27% dari total crude product. Dengan begitu perkiraan jumlah senyawa murni hasil sintesis adalah sebesar 0,037 gram, sehingga persen rendemennya adalah sebesar 5,23%.
Berat teoritis senyawa hasil sintesis = mol x BM
56
O O
+
Cl
OH O
O Cl
3 mmol 3 mmol 3 mmol
+ H2O KOH
O
O
Persen kemurnian yang diperoleh dari kromatogram GC untuk senyawa hasil reaksi samping adalah 89,07% dari total crude product. Dengan begitu perkiraan jumlah senyawa murni hasil sintesis adalah sebesar 0,323 gram, sehingga persen rendemennya adalah sebesar 5,23%.
Berat teoritis senyawa hasil sintesis = mol x BM
Lampiran 2 : Kromatogram KLT senyawa hasil sintesis dan perhitungan Rf Uji KLT pada penelitian ini dilakukan dengan menggunakan fase gerak kloroform : etil asetat (9 : 1) dan menggunakan fase diam silika gel GF254.
Dari penelitan diperoleh data sebagai berikut :
Gambar 13. Kromatogram Senyawa Hasil Sintesis Keterangan:
Uji KLT menggunakan fase diam gel GF254, fase gerak kloroform : etil asetat
(9:1), jarak pengembangan 15 cm, pengamatan bercak dilakukan di bawah sinar UV254.
Tabel 3. Keterangan gambar kromatogram senyawa hasil sintesis
Bercak Senyawa Rf
A 4-klorobenzaldehid 0,665
B 1,3-sikloheksanadion 0,025
58
Lampiran 3 : Perhitungan kepolaran fase gerak KLT dan Log P senyawa hasil sintesis
Kepolaran P΄AB= ΦAPA+ ΦBPB
Keterangan :
- ΦA = fraksi pelarut A
- ΦB = fraksi pelarut B
- P = polaritas fraksi
- P΄ = polaritas campuran pelarut
Kepolaran fase gerak kloroform : etil asetat (9 : 1) adalah - Polaritas kloroform = 4,1
- Polaritas etil asetat = 4,4 P΄ = (9/10 x 4,1) + (1/10 x 4,4)
= 3,69 + 0,44 = 4,13
Log P senyawa hasil sintesis
O O
Cl
60