SINTESIS ASETIL EUGENOL
DARI EUGENOL DAN ANHIDRIDA ASAM ASETAT DENGAN KATALIS NATRIUM HIDROKSIDA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Florentinus Dika Octa Riswanto NIM : 078114055
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
SINTESIS ASETIL EUGENOL
DARI EUGENOL DAN ANHIDRIDA ASAM ASETAT DENGAN KATALIS NATRIUM HIDROKSIDA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Florentinus Dika Octa Riswanto NIM : 078114055
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iii
Persetujuan Pembimbing
SINTESIS ASETIL EUGENOL
DARI EUGENOL DAN ANHIDRIDA ASAM ASETAT DENGAN KATALIS NATRIUM HIDROKSIDA
Florentinus Dika Octa Riswanto NIM : 078114055
telah disetujui oleh:
Pembimbing
(Jeffry Julianus, M.Si.)
v
vi
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Apabila di kemudian hari ditemukan indikasi plagiarisme dalam naskah ini, maka saya bersedia menanggung segala sanksi sesuai peraturan perundang-undangan yang berlaku.
Yogyakarta, 13 Januari 2011 Penulis
vii
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Florentinus Dika Octa Riswanto No mahasiswa : 078114055
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah yang berjudul :
“Sintesis Asetil Eugenol dari Eugenol dan Anhidrida Asam Asetat dengan Katalis Natrium Hidroksida”
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan memublikasikannya di internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama mencantumkan nama saya sebagai Penulis.
Demikian pernyataan ini saya buat dengan sebenarnya. Dibuat di Yogyakarta
Pada tanggal 21 Februari 2011
Yang menyatakan
viii PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas berkat dan karunia-Nya Penulis dapat menyelesaikan skripsi yang berjudul “Sintesis Asetil Eugenol dari Eugenol dan Anhidrida Asam Asetat dengan Katalis Natrium Hidroksida”
sebagai salah satu syarat untuk mencapai gelar sarjana pada Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penulis menyadari bahwa keberhasilan penulisan skripsi ini tidak lepas dari dukungan serta bantuan berbagai pihak. Pada kesempatan ini Penulis mengucapkan penghargaan dan terima kasih kepada:
1. Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Jeffry Julianus, M. Si. selaku dosen pembimbing atas bimbingan serta pengarahannya baik selama penelitian maupun penyusunan skripsi ini.
3. Dra. M.M. Yetty Tjandrawati, M.Si. selaku penguji atas segala masukan, kritik, dan sarannya.
4. Lucia Wiwid Wijayanti, M.Si. selaku penguji atas segala masukan, kritik, dan sarannya.
5. Ambar Novika Wijayanti atas cinta dan kasih sayang yang selalu menjadi motivasi bagi Penulis untuk terus berusaha menjadi lebih baik.
6. Keluarga Pakdhe FX. Haryono di Condong Catur atas bantuan serta dukungan baik moriil maupun materiil selama ini.
ix
8. Wawan „Jinguk‟, Dani, Devi, Maya, dan Yosi sebagai rekan kerja proyek atas segala dorongan, motivasi, serta bantuan dalam penelitian bersama ini.
9. Rekan kontrakan serta pacar-pacarnya: Daniel dan Yemima, Dani dan Riris, Wicak dan Riza, serta Heru atas kekeluargaan yang penuh cinta selama ini. 10. Sobat “12 Dewa”: Toro, Nana Upil, Sano, Ticubiz, Cosa, Yossy, Bimo,
Ping-Ping, Katrin, Dama, dan Ucup atas persahabatan yang tak tergantikan.
11. Lala, Ius, Lia, Ridho, Pace, Tere, Benny, Cinthya, Siska, Edhi, Yosafat, Seno, dan Bella atas kekompakan dan kebersamaan selaku rekan belajar serta kelompok laporan selama Penulis menjalani perkuliahan.
12. Rekan-rekan angkatan 2007 khususnya FST 2007 serta kelas B 2007 atas persahabatan dan kekompakan selama perkuliahan maupun praktikum.
13. Pak Parlan, Mas Kunto, dan Mas Bimo atas bantuannya selama Penulis bekerja di laboratorium Kimia Organik, Kimia Analisis, dan Kimia Analisis Instrumen.
14. Segenap rekan dan pihak-pihak yang membantu namun tidak dapat disebutkan satu persatu.
Akhir kata, Penulis menyadari bahwa karya penulisan skripsi ini masih jauh dari sempurna. Oleh karena itu, Penulis sangat membutuhkan saran dan kritik yang membangun demi kesempurnaan skripsi ini. Semoga skripsi ini dapat bermanfaat dan memberikan sumbangsih yang berguna bagi perkembangan ilmu pengetahuan.
x DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
PERNYATAAN KEASLIAN KARYA ... vi
PERNYATAAN PERSETUJUAN PUBLIKASI ... vii
PRAKATA ... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
INTISARI ... xvii
ABSTRACT ... xviii
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 3
2. Keaslian Penelitian ... 3
3. Manfaat Penelitian ... 4
B. Tujuan Penelitian ... 4
1. Tujuan umum ... 4
xi
BAB II PENELAAHAN PUSTAKA ... 5
A. Eugenol sebagai Antiinflamasi ... 5
B. Asetil Eugenol ... ... 6
C. Reaksi Esterifikasi Eugenol ... 7
D. Kromatografi Lapis Tipis ... 9
E. Kromatografi Gas ... 10
F. Elusidasi Struktur ... 11
1. Spektroskopi Inframerah ... 11
2. Spektroskopi Resonansi Magnet Inti Proton ... 13
3. Spektrometri Massa ... 15
G. Landasan Teori ... 16
H. Hipotesis … ... 17
BAB III METODE PENELITIAN ... 18
A. Jenis dan Rancangan Penelitian ... 18
B. Definisi Operasional ... 18
C. Variabel Penelitian ... 18
D. Bahan Penelitian ... 19
E. Alat Penelitian ... 19
F. Tata Cara Penelitian ... 19
1. Sintesis Asetil Eugenol ... 19
2. Pemurnian Asetil Eugenol ... 20
3. Pemisahan Asetil Eugenol dari Pelarut Kloroform ... 20
xii
5. Elusidasi Struktur Senyawa Hasil Sintesis ... 21
a. Spektroskopi Inframerah ... 21
b. Spektroskopi Resonansi Magnet Inti Proton ... 21
c. Spektrometri Massa ... 22
G. Analisis Hasil ... 22
1. Pemeriksaan Pendahuluan Senyawa Hasil Sintesis ... 22
2. Elusidasi Struktur Senyawa Hasil Sintesis ... 22
3. Perhitungan Rendemen ... 22
BAB IV PEMBAHASAN ... 23
A. Sintesis Asetil Eugenol ... 23
B. Rendemen ... 26
C. Uji Pendahuluan ... 27
1. Uji Organoleptis ... 27
2. Uji Kromatografi Lapis Tipis (KLT) ... 27
3. Uji Kromatografi Gas ... 28
D. Elusidasi Struktur ... 29
1. Spektroskopi Inframerah ... 30
2. Spektroskopi Resonansi Magnet Inti Proton ... 32
3. Spektrometri Massa ... 36
BAB V KESIMPULAN DAN SARAN ... 38
A. Kesimpulan ... 38
xiii
xiv
DAFTAR TABEL
Tabel I. Data Organoleptis Senyawa Hasil Sintesis dan Eugenol... 27 Tabel II. Analisis Gugus dari Spektra Inframerah Senyawa Hasil
xv
DAFTAR GAMBAR
Gambar 1. Gambaran sisi aktif COX-1 dan COX-2 ... 2
Gambar 2. Struktur eugenol ... 5
Gambar 3. Reaksi esterifikasi fenol pada kondisi basa ... 7
Gambar 4. Struktur anhidrida asam asetat ... 8
Gambar 5. Pengaruh katalis dalam penurunan energi pengaktifan ... 9
Gambar 6. Reaksi pembentukan asetil eugenol ... 16
Gambar 7. Reaksi pembentukan asam asetat dan natrium asetat dari anhidrida asam asetat dengan natrium hidroksida ... 24
Gambar 8. Mekanisme reaksi pembentukan asetil eugenol ... 25
Gambar 9. Reaksi pemecahan asetil eugenol menjadi natrium eugenolat dan asam asetat ... 26
Gambar 10. Kromatogram kromatografi lapis tipis ... 28
Gambar 11. Kromatogram kromatografi gas senyawa hasil sintesis ... 29
Gambar 12. Spektra inframerah senyawa hasil sintesis ... 31
Gambar 13. Pencacahan tipe proton asetil eugenol ... 32
Gambar 14. Spektra resonansi magnet inti proton senyawa hasil sintesis .. 34
Gambar 15. Spektra massa senyawa hasil sintesis pada waktu retensi 13,213 menit ... 36
xvi
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan Rendemen Asetil Eugenol ... 42
Lampiran 2. Dokumentasi Penelitian ... 43
Lampiran 3. Spektra Inframerah Senyawa Hasil Sintesis ...……... 44
Lampiran 4. Spektra RMI Senyawa Hasil Sintesis ... 45
Lampiran 5. Spesifikasi Kromatografi Gas-Spektrometer Massa ... 46
Lampiran 6. Kromatogram Kromatografi Gas Senyawa Hasil Sintesis ... 47
Lampiran 7. Spektra Massa Senyawa Hasil Sintesis pada Waktu Retensi 10,158 menit ... 48
Lampiran 8. Spektra Massa Senyawa Hasil Sintesis pada Waktu Retensi 13,213 menit ... 49
Lampiran 9. Spektra Inframerah Senyawa Eugenol ... 50
xvii
SINTESIS ASETIL EUGENOL
DARI EUGENOL DAN ANHIDRIDA ASAM ASETAT DENGAN KATALIS NATRIUM HIDROKSIDA
INTISARI
Eugenol terbukti memiliki aktivitas antiinflamasi yang dihubungkan dengan kemampuan menghambat pembentukan prostaglandin pada jalur siklooksigenase 2 (COX-2). Meskipun demikian, eugenol memiliki struktur molekul yang relatif kecil dan kurang meruah sehingga dapat pula menghambat enzim siklooksigenase 1 (COX-1). Oleh karena itu perlu dilakukan modifikasi terhadap struktur eugenol dengan menambahkan gugus asetil sehingga dihasilkan asetil eugenol (4-alil-2-metoksifenil asetat). Penambahan gugus asetil melalui reaksi esterifikasi akan membuat struktur senyawa eugenol menjadi lebih besar sehingga dapat meningkatkan selektivitas penghambatan pembentukan prostaglandin pada jalur COX-2 serta dapat meningkatkan aktivitas antiinflamasinya.
Sintesis asetil eugenol dilakukan dengan mereaksikan senyawa eugenol (0,0323 mol) dan anhidrida asam asetat (0,0969 mol) dengan katalis natrium hidroksida 10%. Senyawa hasil sintesis dianalisis dengan uji organoleptis, uji kromatografi lapis tipis, kromatografi gas, elusidasi struktur dengan spektroskopi inframerah, spektroskopi resonansi magnet inti proton, dan spektrometri massa.
Senyawa hasil sintesis berupa cairan berwarna merah tua dan berbau cengkeh. Pada uji kromatografi lapis tipis senyawa hasil sintesis mempunyai nilai Rf sebesar 0,80 yang berbeda dengan Rf eugenol sebesar 0,67. Berdasarkan hasil
elusidasi struktur dengan spektroskopi inframerah, spektroskopi resonansi magnet inti proton, dan spektrometri massa menunjukkan bahwa senyawa hasil sintesis adalah asetil eugenol yang mempunyai bobot molekul 206 g/mol dan rumus molekul C12H14O3. Rendemen kasar asetil eugenol yang dihasilkan sebesar
86,87%.
xviii
SYNTHESIS OF ACETYL EUGENOL
FROM EUGENOL AND ACETIC ACID ANHYDRIDE WITH SODIUM HYDROXIDE AS CATALYST
ABSTRACT
Eugenol proved to have anti-inflammatory activity associated with the ability to inhibit the formation of prostaglandins on path of cyclooxygenase 2 (COX-2). However, eugenol has molecular structure which is relatively small and less bulky so it can also inhibit the cyclooxygenase 1 enzyme (COX-1). Therefore it is necessary modifications to the structure of eugenol by adding acetyl groups to produce acetyl eugenol (4-allyl-2-methoxyphenyl acetate). The addition of acetyl groups through esterification reaction will make the structure of eugenol compounds become larger so it can increase the selectivity of inhibition of prostaglandin formation in path of COX-2 and can increase its anti-inflammatory activity.
Synthesis of acetyl eugenol eugenol performed by reacting compound (0.0323 mol) and acetic acid anhydride (0.0969 mol) with 10% sodium hydroxide catalyst. The result of organoleptic test were analyzed, thin layer chromatography, gas chromatography, structure elucidation with infrared spectroscopy, proton nuclear magnetic resonance spectroscopy, and mass spectrometry.
The result of the synthesis was a crimson liquid that smelling of cloves. Thin layer chromatographic analysis of compounds synthesized having Rf value
of 0.80 which is different from eugenol Rf of 0.67. Based on the results of
structure elucidation with infrared spectroscopy, proton nuclear magnetic resonance spectroscopy, and mass spectrometry showed that the compound is synthesized acetyl eugenol which has a molecular weight of 206 g/mol and molecular formula C12H14O3. Crude rendemen of acetyl eugenol obtained was
86,87%.
1 BAB I PENGANTAR
A. Latar Belakang
Tanaman cengkeh (Syzygium aromaticum L.) yang berasal dari Maluku sudah banyak dibudidayakan untuk diambil bunga dan minyaknya. Minyak cengkeh di Indonesia kegunaannya masih sangat terbatas sebagai minyak gosok untuk penyembuh rasa sakit. Sebagai obat tradisional, cengkeh memiliki khasiat mengatasi sakit gigi, mual, muntah, kembung, masuk angin, sakit kepala, dan radang lambung (Tarigan, 2009).
2
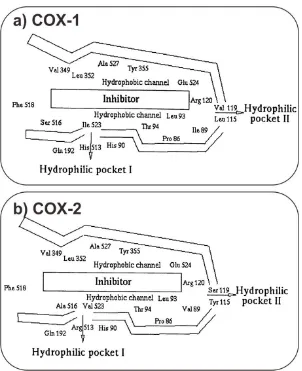
Gambar 1. Gambaran sisi aktif COX-1 dan COX-2 (Fabiola dkk., 2001)
3
parsial negatif (𝛿-) dapat bereaksi dengan atom C karbonil yang bermuatan parsial positif (𝛿+) yang terdapat pada anhidrida asam asetat.
Penggunaan katalis natrium hidroksida yang bersifat basa akan menyebabkan pembentukan nukleofil yaitu ion eugenolat sehingga reaksi dapat berjalan lebih cepat dan efektif. Hal ini mengakibatkan terjadinya peningkatan nukleofilisitas sehingga penyerangan atom C karbonil pada anhidrida asam asetat dapat berlangsung lebih mudah. Oleh karena itu, diharapkan rendemen yang dihasilkan lebih banyak.
1. Permasalahan
a. Apakah asetil eugenol (4-alil-2-metoksifenil asetat) dapat disintesis dari eugenol dan anhidrida asam asetat dengan katalis natrium hidroksida? b. Berapakah rendemen asetil eugenol (4-alil-2-metoksifenil asetat) hasil
sintesis dari eugenol dan anhidrida asam asetat dengan katalis natrium hidroksida?
2. Keaslian Penelitian
Penelitian terkait sintesis asetil eugenol pernah dilakukan oleh Bulan (2004) pada “Reaksi Asetilasi Eugenol dan Oksidasi Metil Iso Eugenol” dengan asam sulfat sebagai katalis, Manoppo (2010) pada “Isolasi Eugenol dari Bunga Cengkeh dan Sintesis Eugenil Asetat” dengan natrium asetat sebagai katalis, dan Carrasco dkk. (2008) pada “Eugenol and Its Synthetic
4
dari eugenol dan anhidrida asam asetat dengan katalis natrium hidroksida belum pernah dilakukan.
3. Manfaat Penelitian
a. Manfaat teoritis. Penelitian ini diharapkan dapat memperkaya ilmu pengetahuan pada jalur-jalur modifikasi senyawa eugenol.
b. Manfaat metodologis. Penelitian ini diharapkan dapat menjadi salah satu metode alternatif untuk sintesis senyawa turunan eugenol dengan metode esterifikasi gugus hidroksi pada molekul eugenol.
B. Tujuan
1. Penelitian ini bertujuan untuk mensintesis asetil eugenol (4-alil-2-metoksifenil asetat) dari eugenol dan anhidrida asam asetat dengan katalis natrium hidroksida.
5 BAB II
PENELAAHAN PUSTAKA
A. Eugenol sebagai Antiinflamasi
Minyak cengkeh (Eugenia caryophyllata) mengandung banyak eugenol.
Carrophyllene tersedia dalam jumlah yang sedikit dalam senyawa terpen lainnya. Eugenol merupakan fenol atau senyawa aromatis hidroksi (Tarigan, 2009).
Eugenol diperoleh dari minyak cengkeh, berbentuk cairan tidak berwarna atau kuning pucat dengan bobot molekul 164,20 g/mol. Eugenol memiliki bau cengkeh kuat, menusuk, dan rasa pedas. Bila terpapar udara warna eugenol menjadi lebih tua dan mengental. Eugenol sukar larut dalam air, larut dengan etanol, kloroform, eter, dan minyak lemak. Kelarutan eugenol adalah 1 bagian volume larut dalam 2 bagian volume etanol 70%. Bobot jenis eugenol antara 1,064 g/mL dan 1,070 g/mL (Budavari, 2001).
Gambar 2. Struktur eugenol
Eugenol sebagai komponen utama dari minyak cengkeh telah terbukti memiliki aktivitas antiinflamasi yang dihubungkan dengan penghambatan pembentukan prostaglandin pada jalur siklooksigenase 2 (COX-2) (Öztürk dan Özbek, 2005).
6
Duarte, 2004). Gugus ini merupakan gugus reaktif yang dapat bereaksi dalam reaksi esterifikasi sebagai nukleofil dan akan menyerang elektrofil pada molekul asam karboksilat (Fessenden dan Fessenden, 1986b).
B. Asetil Eugenol
Asetil eugenol dapat disintesis dengan mereaksikan eugenol dengan anhidrida asam asetat melalui reaksi esterifikasi. Struktur eugenol mengandung gugus –OH yang terikat pada cincin benzena, memungkinkan penggunaannya dalam mensintesis eugenil asetat (Manoppo, 2010).
Pada penelitian Bulan (2004) dilakukan sintesis asetil eugenol dengan mereaksikan eugenol dengan anhidrida asam asetat menggunakan katalis asam sulfat. Hasil pengamatan kromatografi lapis tipis pada pembuatan asetil eugenol diperoleh harga Rf dari hasil percobaan adalah 0,48 sedangkan harga Rf standard
0,33. Hasil analisa kromatografi gas terdapat dua puncak yang berdekatan puncak pertama adalah eugenol dengan persentase 31% dan puncak kedua asetil eugenol dengan persentase 69%.
7
Pada penelitian Carrasco dkk. (2008) dilakukan sintesis asetil eugenol dengan mereaksikan eugenol dengan anhidrida asam asetat menggunakan katalis piridin.
C. Reaksi Esterifikasi Eugenol
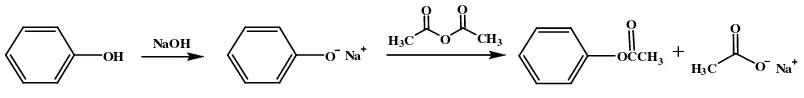
Ester-ester fenil dapat dibuat dengan menggunakan kondisi asam atau kondisi basa. Pada kondisi basa, mula-mula dibuat garam natrium dari fenol dan kemudian diolah dengan anhidridanya (Fessenden dan Fessenden, 1986b).
OH
Gambar 3. Reaksi esterifikasi fenol pada kondisi basa
Esterifikasi fenol seperti pada eugenol tidak melibatkan pemaksapisahan ikatan C-O yang kuat dari fenol tetapi bergantung pada pemaksapisahan ikatan OH. Esterifikasi suatu fenol dapat dengan suatu asam karboksilat atau dengan derivat asam karboksilat yang lebih reaktif seperti anhidrida asetat. Esterifikasi dengan asam karboksilat rendemennya yang lebih kecil sehingga digunakan derivatnya yang lebih reaktif supaya rendemen yang dihasilkan banyak (Fessenden dan Fessenden, 1986a).
8
gugus pergi yang baik, mudah diserang oleh air. Namun karena kereaktifannya tinggi, turunan asam karboksilat ini sangat berharga dalam sintesis senyawa organik lainnya (Fessenden dan Fessenden, 1986b).
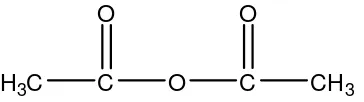
Anhidrida asam asetat lebih reaktif daripada asam karboksilat dan dapat digunakan untuk mensintesis keton, ester atau amida. Hal ini dikarenakan anhidrida asam asetat merupakan turunan asam karboksilat dalam bentuk ester sehingga memiliki gugus pergi (leaving group) yang lebih baik bila dibandingkan dengan asam karboksilat (Fessenden dan Fessenden, 1986b).
H3C C O C CH3
O O
Gambar 4. Struktur anhidrida asam asetat
Anhidrida asam asetat (C4H6O3) memiliki bobot molekul 102,9 g/mol
dengan persentase atom C 47,06%, atom H 5,92%, atom O 47,02%, setara dengan 117,64% asam asetat. Merupakan cairan yang sangat reaktif, berbau asetat kuat, mudah terbakar, titik nyala pada 130° F, titik lebur -73° C, titik didih 139°C, mudah larut air, membentuk asam asetat, dengan alkohol membentuk etil asetat, dan larut dalam kloroform dan eter (Budavari, 1989).
9
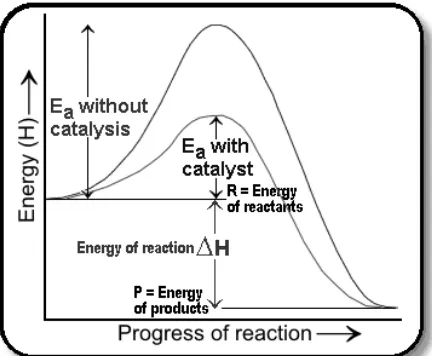
jalan dengan energi pengaktifan yang lebih rendah supaya molekul yang energinya tidak tinggi dapat bereaksi (Keenan, Kleinfelter, dan Wood, 1980).
Gambar 5. Pengaruh katalis dalam penurunan energi pengaktifan (Delpierre dan Sewell, 2011)
Eugenol direaksikan terlebih dahulu dengan katalis natrium hidroksida yang bersifat basa. Katalis basa yang digunakan dalam reaksi substitusi nukleofilik asil akan mengubah nukleofil lemah (-OH) menjadi nukleofil O- yang lebih kuat atau basanya sendiri (-OH) dapat bertindak sebagai reagen nukleofilik kuat (Sykes, 1985).
D. Kromatografi Lapis Tipis
10
standarnya. Senyawa yang murni akan memberikan bercak tunggal pada berbagai fase gerak dengan berbagai tingkat kepolaran dan mempunyai harga Rf yang sama
dengan senyawa standarnya (Gasparic dan Churacek, 1978).
Proses KLT dapat diubah-ubah dengan memodifikasi fase diam atau dengan mengubah kepolaran fase gerak yang digunakan, dimana mengubah kepolaran fase gerak lebih mudah dilakukan. Polaritas fase gerak diubah dengan cara menambahkan fase gerak lain sehingga diperoleh kepolaran yang tepat untuk memisahkan campuran senyawa (Gritter, Bobbit, dan Scharting, 1991).
E. Kromatografi Gas
Kromatografi gas merupakan metode yang dinamis untuk pemisahan dan deteksi senyawa-senyawa organik yang mudah menguap dan senyawa-senyawa gas anorganik dalam suatu campuran. Prinsip dasar kromatografi gas melibatkan volatilisasi atau penguapan sampel dalam inlet injektor, pemisahan komponen-komponen dalam campuran dan deteksi tiap komponen-komponen dengan detektor (Rohman, 2009).
Data kromatografi gas biasanya terdiri dari waktu retensi, atau waktu tambat berbagai komponen campuran. Waktu retensi diukur mulai dari titik penyuntikan sampai titik maksimum puncak dan sangat khas untuk senyawa tertentu pada kondisi tertentu (kolom, suhu, gas pembawa, dan laju aliran) (Gritter dkk., 1991).
11
sinyal elektronik. Sinyal elektronik detektor akan sangat berguna untuk analisis kualitatif maupun kuantitatif terhadap komponen-komponen yang terpisah di antara fase diam dan fase gerak (Rohman, 2009). Data kualitatif digunakan untuk mendeteksi ada berapa komponen yang terelusi sedangkan data kuantitatif menunjukkan kebanyakan luasan dari puncak yang terelusi sebanding dengan massa komponen yang terelusi (Sastrohamidjojo, 2005).
F. Elusidasi Struktur
Elusidasi struktur suatu molekul organik dapat menggunakan spektroskopi inframerah, spektroskopi resonansi magnet inti proton, dan spektrometri massa.
1. Spektroskopi Inframerah
Spektroskopi inframerah merupakan spektroskopi ikatan ulur (streching) dan ikatan tekuk (bending) karena sejumlah energi pada radiasi inframerah merupakan energi yang berpindah ke ikatan ulur maupun ikatan tekuk (Suggs, 2002). Banyaknya energi yang diserap oleh suatu ikatan bergantung pada perubahan dalam momen ikatan seperti vibrasi atom-atom yang saling berikatan. Perubahan dalam momen ikatan yang lebih besar mengakibatkan serapan sejumlah energi juga lebih besar (Fessenden dan Fessenden, 1986a).
12
tidaknya serapan pada frekuensi tertentu merupakan penanda ada tidaknya gugus fungsional tertentu. Penggunaan spektroskopi inframerah pada bidang kimia organik mengunakan daerah dari 650-4000 cm-1. Daerah dengan frekuensi lebih rendah 650 cm-1 disebut inframerah jauh dan daerah dengan frekuensi lebih tinggi dari 4000 cm-1 disebut inframerah dekat (Sastrohamidjojo, 2001).
Inti-inti atom yang terikat oleh ikatan kovalen mengalami getaran (vibrasi) atau osilasi (oscillation), dengan cara serupa dengan dua bola yang terikat oleh suatu pegas. Bila molekul meresap radiasi inframerah, energi yang diserap menyebabkan peningkatan amplitudo getaran atom-atom yang terikat tersebut. Oleh karena itu, molekul ini berada dalam keadaan vibrasi tereksitasi (excited vibration state, energi yang terserap ini akan dibuang dalam bentuk panas bila molekul itu kembali ke keadaan dasar) (Fessenden dan Fessenden, 1986a).
Suatu ikatan dalam sebuah molekul dapat mengalami berbagai macam osilasi sehingga suatu ikatan tertentu dapat menyerap energi pada lebih dari satu panjang gelombang. Misalnya, suatu ikatan O-H menyerap energi pada kira-kira 3330 cm-1 (3,0 μm); energi pada panjang gelombang ini dapat menyebabkan kenaikan vibrasi ulur (stretching vibration) ikatan O-H itu. Suatu ikatan O-H itu juga menyerap energi pada kira-kira 1250 cm-1 (8,0 μm); energi pada panjang gelombang ini menyebabkan kenaikan vibrasi tekuk (bending vibration) (Fessenden dan Fessenden, 1986a).
13
pita serapan yang berbeda. Sejumlah vibrasi yang mempunyai frekuensi sama maka pita-pita serapannya akan saling tumpang tindih (Sastrohamidjojo, 2001).
2. Spektroskopi Resonansi Magnet Inti Proton
Spektroskopi resonansi magnetik inti (RMI) proton merupakan cara yang mampu memberi keterangan mengenai struktur molekul dengan mengkaji sifat magnet atom-atom tertentu dalam molekul. Spektroskopi resonansi magnet inti dapat dilakukan pada inti yang memiliki sebuah momen magnet (Pine, 1980). Spektroskopi RMI didasarkan pada penyerapan gelombang radio oleh inti-inti tertentu dalam molekul organik, apabila molekul ini berada dalam medan magnet yang kuat (Fessenden dan Fessenden, 1986a).
Seperti halnya elektron, inti atom-atom tertentu dapat dianggap berputar. Inti atom hidrogen mempunyai satu proton yang dianggap berputar, dan dalam melakukan putarannya inti tersebut dipandang sebagai sebuah batang magnet kecil. Bila sejumlah proton ditempatkan dalam medan magnet, beberapa proton akan terletak searah sedangkan beberapa yang lain terletak berlawanan arah terhadap medan magnet yang digunakan. Proton yang terletak searah dengan medan magnet dianggap lebih stabil. Dibutuhkan energi untuk “membalik”
magnet proton kecil ke arah yang lebih tidak stabil yang berlawanan arah dengan medan magnet. Apabila inti yang berputar ini dikenai radiasi elektromagnetik pada frekuensi yang tepat (frekuensi radio), proton yang berenergi spin lebih rendah dapat menyerap energi dan akan “meloncat” ke keadaan spin berenergi
14
Pergerakan elektron mengelilingi proton akan menciptakan medan magnet tersendiri. Medan magnet ini terletak searah sedemikian rupa sehingga melawan medan magnet yang diberikan. Dengan demikian, pengaruh medan magnet yang dirasakan oleh proton akan berkurang dan proton dikatakan terperisai. Apabila sirkulasi elektron (terutama elektron-π) menginduksi suatu medan yang memperkuat medan yang diberikan, proton tersebut dinyatakan tak terperisai.
Suatu senyawa standar digunakan sebagai pembanding terhadap senyawa yang diuji. Tetrametil silan (TMS) sering digunakan sebagai standar internal. Proton metil pada senyawa ini sangat terperisai sehingga menghasilkan pemisahan energi yang realtif kecil antara kedua status spin. Dengan demikian, energi frekuensi radio yang dibutuhkan agar proton beresonansi relatif lebih rendah. Standar TMS selalu ditandai dengan 0 hertz (Hz), sedangkan frekuensi lain dinyatakan sesuai dengan banyaknya hertz yang menunjukkan jarak dari sinyal TMS. Resonansi sering kali dinyatakan sebagai δ atau part per million (ppm)
(Bresnick, 1996).
Hidrogen-hidrogen benzena dikatakan terlindungi oleh anisotropi diamagnetik dari cincin. Dalam terminologi elektromagnetik medan isotropik salah satu kerapatan yang sama dimana-mana atau dalam distribusi sferis simetris; medan anisotropik adalah “tidak isotropik” atau “tidak sama”, medan magnetik
yang diberikan (Ho) adalah anisotropik di dekat molekul benzena, karena
15
pada cincin benzena dipengaruhi oleh tiga medan magnet yaitu medan magnet kuat yang diberikan oleh elektromagnet dari spektrometer RMI dan dua medan yang lebih lemah, satu yang disebabkan oleh lindungan biasanya oleh elektron valensi di sekitar proton, dan yang lain disebabkan anisotropi yang dihasilkan oleh elektron-elektron sistem cincin. Efek anisotropi inilah yang mengakibatkan proton-proton benzena mempunyai pergeseran kimia yang lebih besar daripada yang diharapkan (Sastrohamidjojo, 2001).
3. Spektrometri Massa
Dalam spektrometri massa, molekul-molekul organik ditembak dengan berkas elektron dan diubah menjadi ion-ion bermuatan positif yang bertenaga tinggi (ion-ion molekular atau ion-ion induk), yang dapat pecah menjadi ion-ion yang lebih kecil (ion-ion pecahan atau ion-ion anak); lepasnya elektron dari molekul menghasilkan radikal kation dan proses ini dinyatakan sebagai M→M+.
Ion molekular M+ biasanya terurai menjadi sepasang fragmen/pecahan yang dapat berupa radikal dan ion, atau pecahan molekul kecil dan radikal kation (Sastrohamidjojo, 2001).
Kromatografi gas dan spektrometri massa merupakan teknik dengan kompatibilitas tinggi. Pada kedua teknik tersebut, sampel berada pada fase uap dan kedua berhubungan dengan kesamaan jumlah sampel (biasanya kurang dari 1 ng) (Hites, 1997).
16
dilakukan oleh kromatografi gas, sedangkan proses identifikasi dan kuantitatif dilakukan oleh spektrometri massa. Keuntungan dari kromatografi gas-spektrometri massa antara lain metode ini dapat digunakan untuk hampir semua jenis analit, memiliki batas deteksi yang rendah, dan memberi informasi penting tentang spektrum massa dari suatu senyawa organik (Dean, 1995).
G. Landasan Teori
Reaksi esterifikasi fenol merupakan reaksi pembentukan suatu ester dari asam karboksilat maupun turunannya dengan suatu senyawa fenolik. Dalam hal ini, anhidrida asam asetat yang merupakan turunan asam karboksilat berperan sebagai agen pengasilasi sedangkan eugenol merupakan suatu senyawa fenolik. Sintesis asetil eugenol (4-alil-2-metoksifenil asetat) didasarkan pada reaksi esterifikasi fenol dimana anhidrida asam asetat direaksikan dengan eugenol dengan katalis natrium hidroksida.
Dengan menggunakan katalis basa yaitu natrium hidroksida, diharapkan kecepatan reaksinya akan meningkat. Katalis basa yang digunakan dalam reaksi substitusi nukleofilik asil akan mengubah nukleofil lemah menjadi nukleofil yang lebih kuat sehingga reaksi berjalan lebih cepat dan rendemen yang dihasilkan lebih banyak.
17
H. Hipotesis
1. Asetil eugenol dapat disintesis dari eugenol dan anhidrida asam asetat dengan katalis natrium hidroksida.
18 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk penelitian deskriptif non-eksperimental karena tidak dilakukan perlakuan terhadap subyek uji dan hanya memaparkan fenomena yang terjadi.
B. Definisi Operasional
1. Starting material adalah senyawa yang digunakan dalam sintesis yang merupakan senyawa awal, dalam hal penelitian ini adalah eugenol dan anhidrida asam asetat.
2. Molekul target adalah senyawa yang diharapkan terbentuk pada penelitian yaitu asetil eugenol (4-alil-2-metoksifenil asetat).
3. Katalis adalah senyawa yang digunakan dalam reaksi untuk meningkatkan laju reaksi kimia. Dalam penelitian ini digunakan katalis natrium hidroksida 10%.
C. Variabel
19
D. Bahan Penelitian
Eugenol (p.a., Sigma), anhidrida asam asetat (p.a., Merck), aquadest, kloroform (teknis, Brataco), etil asetat (p.a., Merck), toluena (p.a., Merck), natrium hidroksida (p.a., Merck), es batu, dan silika gel 60 GF254 (Merck).
E. Alat Penelitian
Erlenmeyer bertutup (Pyrex), hot plate magnetic stirrer (Heidolph MR
2002), termometer, timbangan elektrik (Mextler PM 100), penangas air (Memmert Water Bath, WB 7-45), lampu UV (Desaga, Germany), spektrofotometer IR (IR Shimadzu Prestige-21), spektrometer 1H-NMR (1H-NMR JEOL-MY60), kromatografi gas-spektrometer massa (Shimadzu QP 2010S), mikropipet (Socorex), dan Beaker glass (Pyrex).
F. Tata Cara Penelitian 1. Sintesis Asetil Eugenol
20
2. Pemurnian Asetil Eugenol
Senyawa hasil sintesis segera diekstraksi dengan natrium hidroksida 5% dingin sebanyak dua kali masing-masing dengan 10 mL kemudian diambil fase kloroformnya.
3. Pemisahan Asetil Eugenol dari Pelarut Kloroform
Fase kloroform dipanaskan di atas penangas air pada suhu 120°C selama 45 menit. Kloroform dibiarkan menguap kemudian diperoleh senyawa hasil sintesis.
4. Pemeriksaan Pendahuluan Senyawa Hasil Sintesis
a. Uji organoleptis. Senyawa hasil sintesis diamati warna dan baunya, serta diperbandingkan dengan warna dan bau eugenol.
b. Identifikasi dengan kromatografi lapis tipis. Larutan pembanding (starting material) dan senyawa hasil sintesis ditotolkan sebanyak 3µ L pada lempeng KLT dengan fase diam silika gel GF254 tebal 0,25 mm dan fase gerak
toluen:etil asetat (95:5) dengan jarak rambat 10 cm. Bercak diamati di bawah sinar UV pada panjang gelombang 254 nm dan dihitung harga Rf-nya.
21
cuplikan diukur oleh detektor dan dihasilkan suatu kromatogram. Kondisi instrumen kromatografi gas meliputi suhu injector 310° C, jenis kolom Rastek
RXi-5MS (30m) suhu kolom 100° C, gas pembawa helium, tekanan 22,0 kPa, kecepatan alir fase gerak 80,1 mL/menit.
5. Elusidasi Struktur Senyawa Hasil Sintesis
Proses elusidasi struktur senyawa hasil sintesis dengan spektroskopi inframerah, spektroskopi resonansi magnet inti proton, dan spektrometri massa pada penelitian ini dilakukan oleh petugas laboratorium kimia organik Fakultas MIPA, Universitas Gadjah Mada, Yogyakarta. Prinsip kerjanya secara umum adalah sebagai berikut.
a. Spektroskopi inframerah. Senyawa hasil sintesis sebanyak kurang lebih 1-10 mg diteteskan diantara dua buah lempeng garam natrium klorida hingga dihasilkan suatu film yang tebalnya 0,01 mm atau kurang dan terjadi perlekatan kedua lempeng. Selanjutnya dilakukan pengukuran dengan spektrofotometer inframerah.
b. Spektroskopi resonansi magnet inti proton. Senyawa hasil sintesis sebanyak kurang lebih 10-50 mg dimasukkan ke dalam tabung dan ditambah pelarut deuterated chloroform (CDCl3) serta beberapa tetes tetrametilsilana
22
c. Spektrometri massa. Cuplikan senyawa dimasukkan dengan menyentuhkan pipet mikro ke injector port. Tabung berisi cuplikan dipompa dengan es kering lalu dihangatkan dengan menguapkan cuplikan ke sistem masukan.Pada ruang pengion spektrometer massa senyawa ditembakkan seberkas elektron menggunakan alat pengionan Electron Impact (EI) 70 eV sehingga terjadi fragmentasi. Kelimpahan relatif setiap fragmen akan dicatat dan menghasilkan data spektra massa.
G. Analisis Hasil
1. Pemeriksaan Pendahuluan Senyawa Hasil Sintesis a. Uji Organoleptis
b. Kromatografi Lapis Tipis c. Kromatografi Gas
2. Elusidasi Struktur Senyawa Hasil Sintesis a. Spektroskopi inframerah
b. Spektroskopi resonansi magnet inti proton c. Spektrometri massa
3. Perhitungan Rendemen
Perhitungan rendemen dilakukan dengan rumus sebagai berikut:
Rendemen = berat senyawa hasil percobaan
23 BAB IV
HASIL DAN PEMBAHASAN
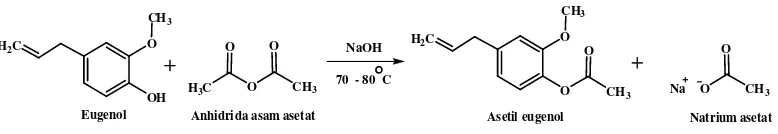
A. Sintesis Asetil Eugenol
Senyawa asetil eugenol (4-alil-2-metoksifenil asetat) dapat disintesis dengan mereaksikan eugenol dan anhidrida asam asetat menggunakan katalis natrium hidroksida berdasarkan reaksi esterifikasi senyawa fenol. Gugus hidroksi (-OH) yang terdapat pada molekul eugenol mengalami substitusi oleh gugus asetil (-COCH3) dari anhidrida asam asetat sehingga dihasilkan suatu ester yaitu asetil
eugenol.
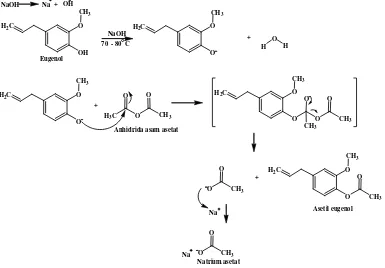
Pada penelitian ini eugenol sebagai starting material direaksikan terlebih dahulu dengan katalis natrium hidroksida 10% pada suhu 70-80° C disertai pengadukan, baru kemudian ditambahkan anhidrida asam asetat. Reaksi pembentukan ester melalui reaksi antara senyawa fenol dengan turunan asam karboksilat berjalan sangat lambat untuk menghasilkan suatu ester (Griffin, 1969). Penggunaan katalis natrium hidroksida bertujuan untuk menghasilkan ion eugenolat yang berperan sebagai nukleofil dalam reaksi substitusi sehingga terjadi peningkatan kereaktifan eugenol dan reaksi dapat berjalan lebih cepat.
24
bereaksi dengan anhidrida asam asetat membentuk asam asetat serta natrium asetat (Gambar 7).
Gambar 7. Reaksi pembentukan asam asetat dan natrium asetat dari anhidrida asam asetat dengan natrium hidroksida
Setelah ion eugenolat terbentuk, dilakukan penambahan anhidrida asam asetat ke dalam campuran secara berlebih. Tujuan dilakukannya penambahan anhidrida asam asetat berlebih ini adalah mendapatkan asetil eugenol yang optimum dimana seluruh ion eugenolat habis bereaksi sehingga dihasilkan rendemen asetil eugenol yang tinggi.
25
Gambar 8. Mekanisme reaksi pembentukan asetil eugenol
Hasil reaksi yang diperoleh adalah suatu cairan berwarna merah tua. Senyawa hasil sintesis diisolasi dengan cara diekstraksi menggunakan kloroform dan diambil fase klorofomnya. Ekstraksi ini didasarkan pada kelarutan senyawa asetil eugenol yang menjadi tujuan sintesis lebih larut ke dalam pelarut nonpolar sedangkan natrium hidroksida sisa dan natrium asetat yang terbentuk akan terpisah karena lebih larut dalam pelarut polar.
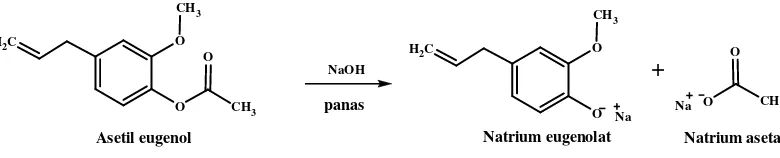
26
terjadinya pemecahan asetil eugenol membentuk natrium eugenolat dan natrium asetat (Griffin, 1969).
Gambar 9. Reaksi pemecahan asetil eugenol menjadi natrium eugenolat dan natrium asetat
Fase kloroform senyawa hasil sintesis dipanaskan di atas penangas air dalam lemari asam pada suhu 120° C. Hal ini dilakukan untuk memisahkan asetil eugenol terhadap pelarut kloroform supaya diperoleh senyawa hasil sintesis murni tanpa adanya pelarut. Pemanasan dilakukan pada suhu 120° C supaya kloroform yang titik didihnya 61° C menguap seluruhnya. Meskipun dilakukan pemanasan pada suhu tinggi asetil eugenol tidak akan menguap karena titik didihnya tinggi yaitu 281° C (Sigma-Aldrich, 2010).
Hal yang perlu diperhatikan dalam tahap penguapan klorofom ini adalah campuran harus bebas dari adanya molekul air. Jika dalam campuran tersebut terdapat molekul air dan dipanaskan pada suhu tinggi maka dapat terjadi reaksi hidrolisis asetil eugenol menjadi natrium eugenolat dan natrium asetat seperti pada gambar 9.
B. Rendemen
27
reaksi substitusi nukleofilik terkait suhu dan waktu reaksi yang optimum. Hasil ini juga merupakan rendemen kasar karena masih adanya campuran pada senyawa hasil sintesis.
C. Uji Pendahuluan 1. Uji Organoleptis
Uji organoleptis dilakukan dengan membandingkan bentuk warna, dan bau antara senyawa hasil sintesis yang diperkirakan asetil eugenol dengan eugenol sebagai starting material. Data hasil uji organoleptis dapat dilihat pada tabel I berikut.
Tabel I. Data Organoleptis Senyawa Hasil Sintesis dan Eugenol
Karakteristik Eugenol Senyawa Hasil Sintesis
Bentuk Cair Cair
Warna Kuning pucat Merah tua
Bau Aroma khas cengkeh Aroma khas engkeh
Dari tabel I dapat dilihat adanya perbedaan karakteristik warna antara eugenol dengan senyawa hasil sintesis. Hal ini mengindikasikan terjadinya perubahan struktur senyawa eugenol yang sebelumnya berwarna kuning pucat menjadi berwarna merah tua. Oleh karena itu dapat diperkirakan telah terbentuk suatu senyawa baru yang berbeda dengan eugenol.
2. Uji Kromatografi Lapis Tipis (KLT)
Uji kromatografi lapis tipis (KLT) dilakukan untuk mengetahui kemurnian dari senyawa hasil sintesis. Uji KLT menggunakan fase diam silika gel GF254 dan fase gerak toluen : etil asetat (95:5) dengan jarak rambat 10 cm dan
28
Gambar 10. Kromatogram kromatografi lapis tipis
Dari gambar 10 dapat diketahui bahwa senyawa eugenol sebagai pembanding menunjukkan bercak ungu dengan Rf 0,67; sedangkan senyawa hasil
sintesis menunjukkan bercak berwarna ungu dengan Rf 0,80. Uji KLT ini belum
dapat sepenuhnya dijadikan dasar untuk menjamin bahwa senyawa hasil sintesis merupakan senyawa asetil eugenol akan tetapi nilai Rf yang berbeda dengan
eugenol serta terbentuknya bercak tunggal dapat membuktikan bahwa senyawa hasil sintesis merupakan senyawa yang berbeda dari eugenol.
3. Uji Kromatografi Gas
Uji kromatografi gas bertujuan untuk untuk mengetahui komponen senyawa dalam hasil sintesis. Dari hasil kromatogram yang diperoleh (Gambar 11) menunjukkan masih adanya dua puncak yang muncul pada waktu retensi
Keterangan: A = Eugenol
B = Senyawa hasil sintesis Fase diam = Silika gel GF254 Merck
29
10,158 menit dan 13,213 menit. Hal ini mengindikasikan masih adanya dua senyawa dalam campuran hasil sintesis. Jika ditinjau dari persen area puncak pertama besarnya 4,12% sedangkan puncak kedua besarnya 95,88%. Oleh karena itu, dapat disimpulkan bahwa senyawa hasil sintesis belum murni karena masih terdiri dari dua senyawa yang masih tercampur.
Gambar 11. Kromatogram kromatografi gas senyawa hasil sintesis
D. Elusidasi Struktur
Proses elusidasi struktur yang dilakukan meliputi spektroskopi inframerah, spektroskopi resonansi magnet inti proton dan spektrometri massa. Spektroskopi inframerah dilakukan dengan tujuan mengidentifikasi gugus-gugus fungsional pada senyawa hasil sintesis kemudian dibandingkan dengan starting
30
1. Spektroskopi Inframerah
Gugus-gugus fungsional pada senyawa hasil sintesis dapat dianalisis dengan spektroskopi inframerah. Gambar 12 menunjukkan spektra inframerah senyawa hasil sintesis.
Dari spektra inframerah senyawa hasil sintesis dihasilkan empat profil pita representatif yang menunjukkan gugus-gugus fungsional pada senyawa tersebut. Pita A pada bilangan gelombang 3471,87 cm-1 menunjukkan adanya gugus O-H (fenol bebas) yang terdapat pada eugenol dan merupakan gugus fungsional yang membedakan eugenol dan asetil eugenol. Pada senyawa hasil sintesis masih terdapat serapan pada bilangan gelombang ini artinya pada senyawa hasil sintesis masih terdapat eugenol. Eugenol ini bisa saja terbentuk dalam senyawa hasil sintesis akibat metode pemurnian yang kurang optimal. Sama seperti pada spektra eugenol, pada spektra senyawa hasil sintesis pita B juga terbentuk dan menunjukkan adanya gugus alkena (C=C) ditandai dengan adanya serapan sedang pada bilangan gelombang 1604,77 cm-1.
Seperti halnya pita B, pita C juga terdapat pada kedua spektra yang dibandingkan dan menunjukkan adanya serapan pada bilangan gelombang 1512,19 cm-1 memberikan informasi bahwa senyawa yang dianalisis merupakan senyawa aromatis dengan adanya ikatan C=C. Pita D menunjukkan adanya gugus (C-O) eter ditandai dengan munculnya serapan pada bilangan gelombang pada 1195,87cm-1.
31
antara serapan yang dihasilkan oleh eter maupun yang oleh serapan yang dihasilkan oleh ikatan C-O ester asam karboksilat pada struktur senyawa hasil sintesis. Pita E merupakan pita vibrasi yang tidak dihasilkan pada spektra inframerah senyawa eugenol. Pita vibrasi ini mengindikasikan adanya ikatan C=O pada gugus ester ditandai dengan serapan tajam pada bilangan gelombang 1766,80 cm-1.
Tabel II. Analisis Gugus dari Spektra Infra Merah Senyawa Hasil Sintesis (Silverstein, Bassler, dan Morrill, 1986)
Pita Bilangan Gelombang
(cm-1) Gugus Fungsional
A 3471,87 -OH Fenolik
B 1604,77 (C=C) Alkena
C 1512,19 (C=C) Aromatis
D 1195,87 (C-O) Ester
E 1766,80 (C=O) Ester
Gambar 12. Spektra inframerah senyawa hasil sintesis
Hasil elusidasi struktur senyawa hasil sintesis dengan spektroskopi inframerah menunjukkan bahwa telah terdapat gugus fungsional ester pada
A
B
C
32
senyawa hasil sintesis yang tidak terdapat pada eugenol. Hal ini menunjukkan senyawa hasil sintesis merupakan senyawa yang tidak sama dengan starting
material. Spektra pada gambar 12 juga menunjukkan bahwa gugus-gugus fungsional yang terdapat pada asetil eugenol ditemukan dalam senyawa hasil sintesis. Hal ini semakin menguatkan dugaan bahwa senyawa hasil sintesis adalah asetil eugenol yang merupakan senyawa target.
2. Spektroskopi Resonansi Magnet Inti Proton
Spektroskopi resonansi magnet inti proton digunakan untuk mengidentifikasi tipe serta jumlah proton yang terdapat dalam senyawa hasil sintesis. Jika ditinjau dari senyawa target yang akan dibuat yaitu asetil eugenol, terdapat tujuh tipe proton dengan pencacahan seperti pada gambar 13.
C
Gambar 13. Pencacahan tipe proton asetil eugenol
33
1,5 ppm (Fessenden dan Fessenden, 1986a) akan tetapi terjadi suatu efek imbasan yang yang menyebabkan proton G memberikan serapan di bawah medan pada δ
2,2 ppm.
Proton F merupakan proton pada karbon yang terhibridisasi sp3 dan terikat pada atom karbon yang diapit oleh gugus alkena serta cincin aromatis yang terhibridisasi sp2. Hal ini menyebabkan proton F menjadi kurang terperisai sehingga memberikan serapan pada δ 3,2 ppm. Proton E merupakan proton pada
atom karbon yang terikat pada atom oksigen dan terhibridisasi sp3. Adanya atom oksigen yang bersifat elektronegatif mengakibatkan elektron dari proton E tertarik ke atom oksigen sehingga proton E kurang terperisai dan memberikan serapan pada δ 3,7 ppm.
Proton D merupakan proton pada atom karbon alkena dan terhibridisasi
sp2. Hal ini menyebabkan proton D menjadi kurang terperisai sehingga memberikan serapan pada δ 5,2 ppm. Proton C juga merupakan proton pada atom
karbon alkena dan terhibridisasi sp2 akan tetapi proton C memberikan serapan pada geseran kimia yang lebih rendah (δ 5,7 ppm). Hal ini dapat terjadi karena proton C juga terikat pada atom karbon lain yang terhibridisasi sp3 sehingga adanya efek induksi menyebabkan geseran kimia meningkat meskipun tetap terpengaruh adanya efek imbasan dari alkena.
34
hidrogen-hidrogen benzena (Sastrohamidjojo, 2001). Proton B dan proton A merupakan proton yang terikat pada karbon yang terhibridisasi sp2 aromatis dan sama-sama terkena pengaruh efek anisotropik sehingga memberikan serapan jauh di bawah medan (Fessenden dan Fessenden, 1986a). Meskipun demikian, kedua proton ini bukan merupakan suatu ekivalen karena proton A lebih dekat terhadap atom oksigen yang terikat pada karbonil yang sifatnya menarik elektron sedangkan proton B berada di sebelah atom karbon yang lebih jauh dari karbon karbonil. Hal ini menyebabkan proton B memberikan serapan pada δ 6,7 ppm
sedangkan proton A memberikan serapan 7,2 ppm.
Gambar 14. Spektra resonansi magnet inti proton senyawa hasil sintesis
35
sintesis adalah 1:2:1:2:3:2:3. Data ini sesuai dengan profil proton senyawa asetil eugenol.
Tabel III. Hasil Interpretasi Spektra RMI Proton
Geseran Kimia (ppm)
36 disimpulkan bahwa senyawa hasil sintesis merupakan asetil eugenol. Hal ini dapat dibuktikan dengan adanya profil proton G pada karbon yang terikat pada karbonil gugus ester yang terbentuk akibat reaksi esterifikasi dan profil proton ini tidak terdapat pada eugenol sebagai starting material.
3. Spektrometri Massa
Spektrometri massa berperan dalam penentuan bobot molekular dan pola fragmentasi senyawa hasil sintesis. Asetil eugenol secara teoritis memiliki bobot molekul sebesar 206 g/mol. Gambar 15 berikut menyajikan spektra massa senyawa hasil sintesis.
Gambar 15. Spektra massa senyawa hasil sintesis pada waktu retensi 13,213 menit
37
memiliki bobot molekul m/z = 164 merupakan pemecahan ikatan ester asetil eugenol. Mekanisme fragmentasi asetil eugenol dapat dilihat pada gambar 16.
H3C
Gambar 16. Usulan mekanisme reaksi fragmentasi asetil eugenol
38 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Senyawa asetil eugenol (4-alil-2-metoksifenil asetat) dapat disintesis dari eugenol dan anhidrida asam asetat menggunakan katalis natrium hidroksida. 2. Rendemen kasar asetil eugenol (4-alil-2-metoksifenil asetat) hasil sintesis dari
eugenol dan anhidrida asam asetat menggunakan katalis natrium hidroksida sebesar 86,87% dengan persen area puncak sebesar 95,88% ditunjukkan sebagai hasil kromatografi gas. Hasil sintesis belum murni sepenuhnya karena masih terdapat eugenol dengan persen area puncak sebesar 4,12%.
B. Saran
1. Perlu dilakukan optimasi temperatur dan lama waktu reaksi agar diperoleh kondisi optimal untuk sintesis asetil eugenol sehingga dihasilkan rendemen serta kemurnian yang lebih tinggi.
39
DAFTAR PUSTAKA
Bresnick, 1996, High-Yield Organic Chemistry, diterjemahkan oleh Hadian Kotong, Penerbit Hipokrates, Jakarta, 101-107.
Budavari, S., 1989, Merck Index: An Encyclopedia of Chemicals, Drugs, and Biological, 11th ed., Merck & Co., Inc., USA, 7.
Budavari, S., 2001, Merck Index: An Encyclopedia of Chemicals, Drugs, and Biological, 13th ed., Merck & Co., Inc., USA, 239, 612.
Bulan, R., 2004, Reaksi Asetilasi Eugenol dan Oksidasi Metil Iso Eugenol, Laporan Penelitian, Program Studi Teknik Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara, Medan.
Carrasco, H., Espinoza, L., Cardile, V., Gallardo, C., Carrasco, W., Lombardo, L., dkk., 2008, Eugenol and its synthetic analogues inhibit cell growth of human cancer cells (Part I), http://www.scielo.br/scielo.php?pid=S0103-50532008000300024&script=sci_arttext, diakses pada tanggal 13 Januari 2011.
Dean, J.A., 1995, Analitycal Chemistry Handbook, McGraw-Hill, New York, 13.26-13.27.
Delpierre, G.R., dan Sewell, B.T., 2011, Catalysis, http://www.physchem.co.za/OB12-che/catalysis.htm, diakses pada tanggal 13 Januari 2011.
Fabiola, G.F., Damodharan, L., Pattabhi, V., dan Nagarajan, K., 2001, Cyclooxygenase-2 – An Attractive Target for fruitful Drug Design, Current Science, 80(1), 26-34.
Fessenden, R. J. dan Fessenden, J. S., 1986a, Organic Chemistry, diterjemahkan oleh Pudjaatmaka, A.H., Edisi ketiga, Jilid I, Penerbit Erlangga, Jakarta, 315, 327, 332, 335, 485.
Fessenden, R. J. dan Fessenden, J. S., 1986b, Organic Chemistry, diterjemahkan oleh Pudjaatmaka, A.H., Edisi ketiga, Jilid II, Penerbit Erlangga, Jakarta, 80-84, 118-128.
40
Griffin, R., 1969, Modern Organic Chemistry, International Student Edition, McGraw-Hill Kogakusha LTD., Tokyo, 334-337.
Gritter, J.R., Bobbit, J. M., dan Scharting, A. E., 1991, Introduction of Chromatography, diterjemahkan oleh Padmawinata, K., Edisi II, Penerbit ITB, Bandung, 109-112.
Hites, R.A., 1997, Gas Chromatography Mass Spectrometry, Handbook of Instrumental Techniques for Analitycal Chemistry, Prentice Hall, New Jersey, 609-626.
Keenan, C.W., Kleinfelter, D.C., dan Wood, J.H., 1980, General College Chemistry, diterjemahkan oleh Pudjaatmaka, A.H., Edisi keenam, Jilid I, Penerbit Erlangga, Jakarta, 521-522.
Lahlou, S., Interaminense, L.F., Magalhães, P.J., Leal-Cardoso, J.H., Duarte, G.P., 2004, Cardiovascular effects of eugenol, a phenolic compound present in many plant essential oils, in normotensive rats, J Cardiovasc Pharmacol., 43(2), 250-257.
Manoppo,Y., 2010, Isolasi Eugenol dari Bunga Cengkeh dan Sintesis Eugenil Asetat, http://molucasablog.blogspot.com/2010/06/isolasi-eugenol-dari-bunga-cengkeh-dan.html, diakses pada tanggal 13 Januari 2011.
Ntamila, M., dan Hassanali, A., 1976, Isolation of Oil of Clove Oil and Separation of Eugenol and Acetyl Eugenol, An instructive experiment for beginning chemitryunder graduates, 53(4), 263.
Pine, S., Hendrickson, J., Cram, D., Hammond, G., 1980, Organic Chemistry, diterjemahkan oleh Joedodibroto, R., Edisi keempat, Jilid I, Penerbit ITB, Bandung, 152.
Öztürk, A., dan Özbek, H., 2005, An Animal Model of Anti-inflammatory Activity, Caryophyllata Essential Oil, 159-162.
Rohman, A., 2009, Kromatografi untuk Analisis Obat, Graha Ilmu, Yogyakarta, 181-186.
Sastrohamidjojo, H., 2001, Spektroskopi, Edisi ketiga, Penerbit Liberty, Yogyakarta, hal. 45, 82-85, 99-100.
41
Sigma-Aldrich, 2010, Eugenyl Acetate,
http://www.sigmaaldrich.com/catalog/ProductDetail.do?D7=0&N5=SEAR CH_CONTACT_PNO%7CBRAND_KEY&N4=W246905%CALDRICH& N25=0&QS=ON&F, diakses pada tanggal 11 Januari 2011.
Silberberg, M.S., 2006, Chemistry The Molecular Nature of Matter and Change, 4th edition, McGraw-Hill, New York, 694-695.
Silverstein, R.M., Bassler, G.C., dan Morrill, T.C., 1986, Spectrometric Identification of Organic Compunds, diterjemahkan oleh Hartono, dan Purba, A.V., Penerbit Erlangga, Jakarta, 95-135.
Suggs, J., 2002, Organic Chemistry, Barron‟s Educational Series, New York, 50, 205.
Sykes, P., 1985, A Guide Book to Mechanisms in Organic Chemistry,diterjemahkan oleh Hartono, A.J., Sugiharjo, C.J., Broto, S.K.L., dan Sukartini, Edisi 6, Penerbit Gramedia, Jakarta, 268-269.
Tarigan, H.Y.S., 2009, Sintesis 4-Alil-2-Metoksi Fenil Laurat melalui Reaksi Transesterifikasi antara 4-Alil-2-Metoksi Fenil Asetat dengan Metil Laurat, Skripsi, Universitas Sumatra Utara, Medan, 9-13.
University of Birmingham, 2010a, Eugenol Infra Red Spectrum,
http://www.chem.bham.ac.uk/schools/eugenolir.htm, diakses tanggal 27 Desember 2010.
University of Birmingham, 2010b, Eugenol Proton NMR Spectrum,
42
LAMPIRAN
Lampiran 1. Perhitungan Rendemen Asetil Eugenol
O
Perhitungan massa teoritis asetil eugenol: Kerapatan eugenol = 1,06 g/mL Mol eugenol = Mol asetil eugenol Mol asetil eugenol = 0,0323 mol
43
Lampiran 2. Dokumentasi Penelitian A. Senyawa Hasil Sintesis
44
45
Lampiran 4. Spektra RMI Senyawa Hasil Sintesis (diukur dengan 1H-NMR JEOL-MY60)
46
47
48
49
50
Lampiran 9. Spektra Inframerah Senyawa Eugenol
51
Lampiran 10. Spektra Resonansi Magnet Inti Proton Senyawa Eugenol
52
BIOGRAFI PENULIS