LAPORAN UJI KUALITATIF
KARBOHIDRAT, LEMAK, DAN PROTEIN
Praktikum Biokimia
Disusun oleh:
Jovine Marcella Kurniawan
511510006
UNIVERSITAS MA CHUNG
UJI KUALITATIF KARBOHIDRAT
PENDAHULUAN
Karbohidrat merupakan senyawa yang terbentuk dari molekul karbon, hidrogen dan oksigen. Sebagai salah satu jenis zat gizi, fungsi utama karbohidrat adalah penghasil energi di dalam tubuh. Tiap 1 gram karbohidrat yang dikonsumsi akan menghasilkan energi sebesar 4 kkal dan energi hasil proses oksidasi (pembakaran) karbohidrat ini kemudian akan digunakan oleh tubuh untuk menjalankan berbagai fungsi-fungsinya seperti bernafas, kontraksi jantung dan otot serta juga untuk menjalankan berbagai aktivitas fisik seperti berolahraga atau bekerja (Winarno, 2004).
Karbohidrat dibagi menjadi beberapa jenis, yakni monosakarida, disakarida, dan karbohidrat kompleks. Monosakarida merupakan jenis karbohidrat sederhana yang terdiri dari 1 gugus cincin. Contoh dari monosakarida yang banyak terdapat di dalam sel tubuh manusia adalah glukosa, fruktosa dan galaktosa.
Gambar 1. Struktur glukosa (kiri), galaktosa (tengah), dan fruktosa (kanan).
Disakarida merupakan jenis karbohidrat yang banyak dikonsumsi oleh manusia di dalam kehidupan sehari-hari. Setiap molekul disakarida akan terbentuk dari gabungan 2 molekul monosakarida. Contoh disakarida yang umum digunakan dalam konsumsi sehari-hari adalah sukrosa yang terbentuk dari gabungan 1 molekul glukosa dan fruktosa dan juga laktosa yang terbentuk dari gabungan 1 molekul glukosa dan galaktosa (Winarno, 2004).
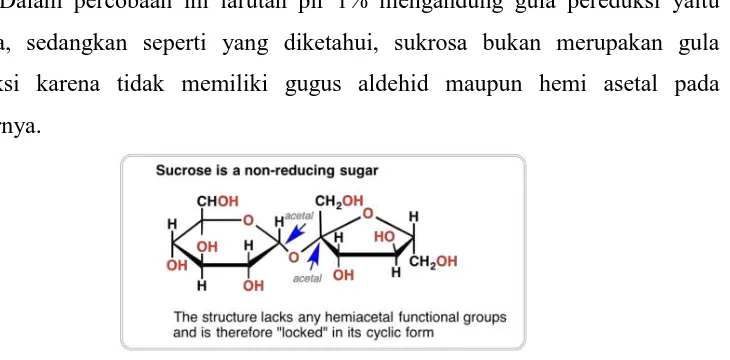
Sukrosa terhidrolisis oleh enzim invertase menghasilkan α-D-glukosa dan β-D-fruktosa. Campuran gula ini disebut gula inversi, lebih manis daripada 8 sukrosa. Jika diperhatikan strukturnya, karbon anomerik (karbon karbonil dalam monosakarida) dari glukosa maupun fruktosa di dalam air tidak digunakan untuk berikatan sehingga keduanya tidak memiliki gugus hemiasetal. Akibatnya, sukrosa dalam air tidak berada dalam kesetimbangan dengan bentuk aldehid atau keton sehingga sukrosa tidak dapat dioksidasi. Sukrosa bukan merupakan gula pereduksi. Keberadaan senyawa karbohidrat dapat dianalisa dengan dilakukan uji kualitatif, prinsip analisa diantaranya dijelaskan secara singkat sebagai berikut sebagai berikut (Sudarmadji dkk., 1986):
1. Uji Molisch: dengan prinsip karbohidrat direaksikan dengan a-naftol dalam alkohol kemudian ditambah dengan asam sulfat pekat melalui dinding tabung, uji positif ditandai apabila terbentuk cincin ungu.
2. Uji Fehling: pereaksi terdiri dari Cu-sulfat dalam suasana alkalis, NaOH, ditambah Chelating Agent (kalium natrium tartrat). Sampel ditambah pereaksi dan dipanaskan adanya endapan berwarna merah cokelat menunjukkan adanya gula reduksi.
3. Uji tollens: uji ini mengandalkan terbentuknya endapan cermin perak yang berasal dari gugus aktif pada pereksi tollens yaitu Ag2O yang bila tereduksi
akan menghasilkan endapan perak. Endapan perak ini akan menempel pada dinding tabung reaksi yang akan menjadi cermin perak. Aldehid dioksidasi menjadi anion karboksilat . ion Ag+ dalam reagensia tollens direduksi menjadi logam Ag. Uji positif ditandai dengan terbentuknya cermin perak pada dinding dalam tabung reaksi. Reaksi dengan pereaksi tollens mampu meng ubah ikatan C-H pada aldehid menjadi ikatan C-O.
Sebagai mahasiswa kimia, khususnya di bidang pangan, pengetahuan analisa kandungan karbohidrat menjadi penting. Adanya percobaan uji kualitatif karbohidrat dapat menjadi latihan sederhana mahasiswa dalam menganalisa pangan. TUJUAN
mengandung karbohidrat dan yang tidak mengandung karbohidrat apabila dilakukan uji molisch, uji fehling dan uji tollens.
METODOLOGI Bahan
Larutan sukrosa 10%, larutan pir 1%, air, reagen molisch, H2SO4, larutan fehling A
dan B, reagen tollens. Alat
Pipet tetes, tabung reaksi, penangas api, penjepit tabung reaksi. Diagram alir langkah kerja
Uji Molisch:
Uji Fehling:
Uji Tollens:
Diletakkan dalam tabung reaksi
Ditambah 1ml larutan a-naftol dalam alkohol 1%
Ditambah H2SO4 pekat perlahan dengan pipet tetes melalui dinding
tabung
Diamkan dan amati perubahan yang terjadi 1ml larutan pir 1% 1ml larutan sukrosa 10% 1ml air
Hasil
Diletakkan dalam tabung reaksi Ditambah 1ml larutan fehling A Ditambah 1ml larutan fehling B Dikocok hingga homogen
Dipanaskan di atas penangas api hingga mendidih 1ml larutan pir 1% 1ml larutan sukrosa 10%
1ml air
Hasil
Diletakkan dalam tabung reaksi Ditambah 1ml reagen Tollens Dikocok hingga homogen
Dipanaskan di atas penangas api hingga mendidih 1ml larutan pir 1% 1ml larutan sukrosa 10%
1ml air
DATA PENGAMATAN
Seluruh sampel berubah menjadi berwarna biru muda.
Tollens 1 mL sampel Bening bening Bening Ditambah 1 mL
pereaksi tollens
Muncul endapan kecoklatan didasar tabung reaksi.
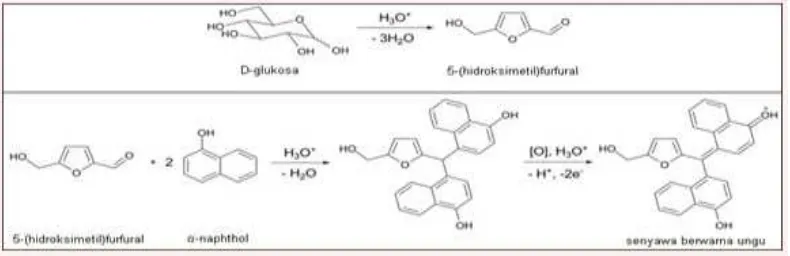
Prinsip dari uji molisch ini adalah reaksi dehidrasi karbohidrat oleh asam sulfat dan alfa naftol yang akan membentuk senyawa kompleks berwarna ungu. Dimana asam sulfat berfungsi sebagai pembentukan senyawa furfural dan sebagai agen kondensasi. Uji positif dari uji ini adalah terbentuknya cincin berwarna ungu. Uji molisch ini sendiri adalah untuk menguji kandungan karbohidrat pada suatu sampel, jadi semua sampel yang mengandung karbohidrat hasil ujinya positif (Brown, 1994).
Gambar 4. Hasil uji positif molisch untuk uji kualitatif karbohidrat menunjukkan terbentuknya cincin ungu.
dengan asam tersebut menjadi furfural, sementara golongan heksosa menjadi hidroksi-multifurfural menggunakan asam organik pekat. Pereaksi Molisch yang terdiri dari α-naftol dalam alkohol akan bereaksi dengan furfural tersebut membentuk senyawa kompleks berwarna ungu. Monosakarida akan bereaksi lebih cepat daripada disakarida dan polisakarida karena pada monosakarida langsung bisa mengalami dehidrasi dengan asam sulfat membentuk furfural, sementara pada disakarida harus diubah dahulu menjadi monosakarida baru bisa dihidrolisis oleh asam sulfat membentuk furfural (Brown, 1994).
Berikut adalah mekanisme yang terjadi:
Gambar 5. Reaksi yang terjadi pada uji molisch terhadap karbohidrat.
Dari data hasil percobaan yang telah dilakukan dapat disimpulkan bahwa kedua sampel yaitu larutan pir 1% yang mengandung fruktosa dan larutan sukrosa 10% bereaksi positif terhadap uji molisch ini. Hal ini sudah sesuai dengan literatur yang menyatakan bahwa sukrosa dan merupakan suatu karbohidrat sehingga dapat bereaksi positif pada uji molisch.
Mula-mula sampel yang berupa larutan pir 1% dan larutan sukrosa 10% dimasukkan pada masing-masing tabung reaksi sebanyak 1 ml. Selanjutnya pada masing-masing tabung reaksi ditambah reagen molisch, kemudian ditambahkan H2SO4. Penambahan H2SO4 ini bertujuan sebagai agen kondensing dan pembentuk
disebabkan oleh reaksi dehidrasi karbohidrat oleh asam sulfat yang berfungsi untuk menghidrolisis ikatan pada sakarida untuk menghasilkan furfural. Furfural ini kemudian bereaksi dengan reagent Molisch, α-naphthol membentuk cincin yang berwarna ungu (Brown, 1994).
Uji Fehling
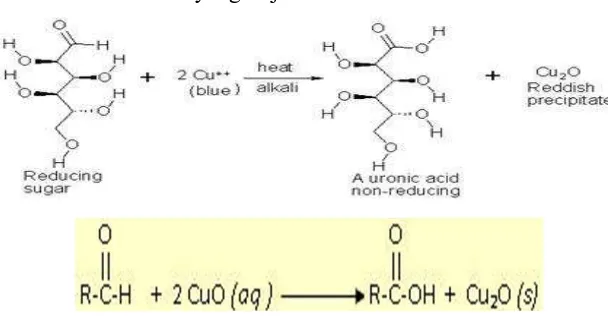
Uji fehling menggunakan pereaksi fehling yang terdiri dari campuran kupri sulfat, Na-K-tartrat dan natrium hidroksida dengan gula pereduksi dan dipanaskan akan terbentuk endapan yang berwarna merah kecoklatan.Uji fehling ini digunakan untuk mengetahui adanya kandungan gula pereduksi dalam karbohidrat. Gula pereduksi adalah karbohidrat yang dapat mereduksi senyawa pengoksidasi lemah seperti Cu dalam pereaksi fehling. Agar berfungsi sebagai gula pereduksi, karbohidrat harus mempunyai fungsi aldehid atau gugus fungsi hemi asetal yang dapat membuka menjadi aldehid (Brown, 1994).
Dalam percobaan ini larutan pir 1% mengandung gula pereduksi yaitu fruktosa, sedangkan seperti yang diketahui, sukrosa bukan merupakan gula pereduksi karena tidak memiliki gugus aldehid maupun hemi asetal pada strukturnya.
Gambar 6. Sukrosa bukan merupakan jenis gula pereduksi.
Apabila larutan sampel ditambah pereaksi fehling (A+B) dan kemudian dipanaskan menunjukkan terbentuknya endapan merah kecoklatan maka larutan sampel tersebut mengandung gula pereduksi karena mampu mereduksi pereaksi fehling. Hasil uji positif adanya gula pereduksi terdapat pada sampel larutan pir 1%, ditandai dengan adanya endapan kemerahan dari terbentuknya senyawa Cu2O. Sedangkan
air dan larutan sukrosa 10% menghasilkan uji negatif, karena tidak adanya gugus aldehid atau hemi asetal yang menandakan keberadaan gula pereduksi dalam sampel yang dapat mengoksidasi pereaksi fehling untuk membentuk Cu2O (Dawn,
Berikut adalah reaksi yang terjadi:
Gambar 7. Reaksi uji fehling pada senyawa gula pereduksi.
Uji Tollens.
Uji tollens merupakan salah satu uji yang digunakan untuk membedakan senyawa aldehid dan senyawa keton. Dalam percobaan digunakan pereaksi tollens yaitu dengan mencampurkan 1 ml AgNO3 kemudian 2 tetes NaOH 10 % ( tetes
demi tetes) sehingga menghasilkan pengoksidasi ringan yaitu larutan basa dari perak nitrat. Untuk mencegah pengendapan ion perak sebagai oksida pada suhu tinggi, maka ditambahkan beberapa tetes larutan amonia, amonia membentuk kompleks larut air dengan ion perak (Brown, 1994).
Pada percobaan terhadap larutan pir 1%, pada saat ditambahkan dengan pereaksi tollens terjadi perubahan warna larutan menjadi coklat keruh dan tebentuk endapan berwarna hitam. Kemudian dipanaskan terjadi lagi perubahan yaitu warna larutan abu-abu keruh dan terbentuknya endapan cermin perak pada dinding tabung reaksi dan endapan berwarna kehitaman. Dari pengamatan ini dapat dinyatakan bahwa kedua sampel mengandung senyawa aldehid, karena pada dasar tabung reaksi mengkilat yang menunjukkan adanya endapan cermin perak. Endapan cermin perak ini berasal dari gugus aktif pada pereksi tollens yaitu Ag2O yang bila
Uji tollens biasanya lebih menghasilkan uji positif pada senyawa yang mengandung gugus aldehid dibandingkan dengan keton. Hasil percobaan dihasilkan senyawa larutan sukrosa 10% lebih berwarna abu-abu, kurang ditemukan endapan hitam. Sukrosa dalam air tidak berada dalam kesetimbangan dengan bentuk aldehid atau keton sehingga sukrosa tidak dapat dioksidasi. Sehingga uji karbohidrat pada senyawa seperti sukrosa yang tidak memiliki gugus aldehid akan cenderung menghasilkan hasil uji negatif, sama seperti air. Berikut adalah contoh reaksi senyawa karbohidrat bergugus keton yang dilakukan uji tollens (Brown, 1994):
Gambar 8. Reaksi yang terjadi pada uji tollens untuk menentukkan gugus aldehid atau keton yang terkandung dalam sampel.
KESIMPULAN
Uji kualitatif karbohidrat dapat dilakukan dengan melakukan uji molisch, uji fehling dan uji tollens. Untuk mengetahui dalam sampel terdapat karbohidrat atau tidak, dapat dilakukan uji molisch, di mana uji positif molisch akan menghasilkan cincin ungu dari terbentuknya senyawa kompleks furfural pada seluruh jenis karbohidrat (baik gula pereduksi dan non-pereduksi maupun monosakarida, disakarida hingga polisakarida). Untuk mengetahui jenis gula pereduksi pada karbohidrat, dapat dilakukan uji fehling. Uji ini dapat mengetahui adanya gula pereduksi dengan menghasilkan endapan merah bata apabila direaksikan dengan reagen fehling akibat terbentuknya endapan Cu2O. Selain itu,
DAFTAR PUSTAKA
Brown, W. H. 1994. Study Guide for Introduction to Organic Chemistry. Jakarta: EGC.
Dawn, B. M. 2000. Biokimia Kedokteran Dasar. Jakarta: EGC.
Sudarmadji, Slamet, Haryono, B., dan Suhardi. 1986. Analisa Bahan Makanandan Pertanian. Yogyakarta: Pusat Antar Universitas Ilmu Pangan dan Gizi.
UJI KUALITATIF LEMAK
PENDAHULUAN
Lemak atau lipid merupakan senyawa ester asam lemak dengan gliserol yang kadang-kadang mengandung gugus lain. Lipid tidak larut dalam air, tetapi larut dalam pelarut organik seperti eter, aseton, kloroform, dan benzene. Berdasarkan kemiripan struktur kimia yang dimiliki, lipid dibagi menjadi beberapa golongan, yaitu asam lemak, lemak dan fosfolipid (Brown, 1994).
Lemak dan minyak merupakan zat makanan yang penting untuk menjaga kesehatan tubuh manusia. Selain itu lemak dan minyak juga merupakan sumber energi yang lebih efektif dibanding dengan karbohidrat dan protein. Lemak merupakan bahan padat pada suhu ruang disebabkan kandungannya yang tinggi akan asam lemak jenuh yang tidak memiliki ikatan rangkap, sehingga mempunyai titik lebur yang lebih tinggi, sedangkan minyak merupakan bahan cair pada suhu ruang disebabkan tingginya kandungan asam lemak yang tidak jenuh, yang memiliki satu atau lebih ikatan rangkap diantara atom-atom karbonnya, sehingga mempunyai titik lebur yang rendah (Winarno, 2004).
Penentuan adanya lipida atau lemak dalam suatu bahan dapat dilakukan dengan berbagai macam analisa. Salah satunya adalah dengan menggunakan analisa kualitatif untuk menentukan adanya lipida atau tidak yaitu uji penyabunan, uji salkowski, dan uji lieberman buchard. Uji Salkowski dan uji lieberman buchard merupakan uji kualitatif yang dilakukan untuk mengidentifikasi keberadaan kolesterol (Brown, 1994).
TUJUAN
Tujuan dilakukannya percobaan uji kualtitatif lemak adalah untuk memahami prosedur uji kualitatif lemak dengan benar serta mengetahui karakteristik lemak saat diuji dengan uji salkowski, liberman buchard dan juga saponifikasi.
METODOLOGI Bahan
Larutan pir 1%, minyak goreng, air, NaOH 0,5 N, aquadest, etanol, NaCl jenuh, asam sulfat pekat, kloroform, reagen lieberman-bunchard (asetat anhidrida:asam sulfat pekat 30:1, v/v).
Alat
Tabung reaksi, pipet, penangas api, vortex. Diagram alir langkah kerja
Uji penyabunan:
Uji Salkowski:
Diletakkan dalam tabung reaksi Ditambah 1ml larutan NaOH 0,5N Ditambah 1ml larutan etanol
Dipanaskan di atas air mendidih selama 15 menit Ditambah 2ml larutan NaCl jenuh
1ml larutan pir 1% 1ml minyak
1ml air
Hasil
Diletakkan dalam tabung reaksi Ditambah 1ml larutan kloroform Di-vortex hingga homogen
Ditambah 1ml larutan H2SO4 pekat
Diamati perubahan warna yang terjadi Hasil
Uji Lieberman-Buchard: Diletakkan dalam tabung reaksi
Ditambah 1ml larutan kloroform Di-vortex hingga homogen
Ditambah 1ml larutan asam asetat anhidrida : asam sulfat pekat 30:1 (v/v)
Diamati perubahan warna yang terjadi 0,5 ml larutan pir 1% 0,5 ml minyak goreng 0,5 ml air
PEMBAHASAN
Uji Penyabunan
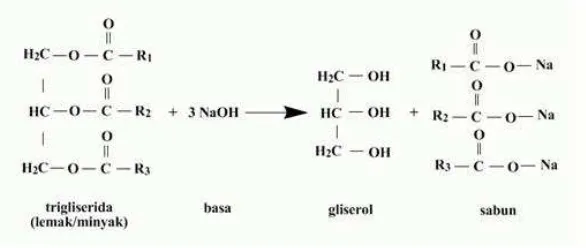
Penyabunan merupakan reaksi hidrolisis lemak oleh alkali, di mana dihasilkan gliserol dan garam alkali asam lemak yang disebut sebagai sabun. Larutan uji yang digunakan adalah NaOH 0,5N dan NaCl jenuh. Mula-mula sampel dicampur dengan larutan NaOH dan alkohol, kemudian dipanaskan selama 15 menit. Hasilnya terbentuk dua fase, di mana ketika fase tersebut dicampur dengan NaCl jenuh, terbentuk endapan seperti emulsi yang berbuih (Dawn, 2000).
Prinsip kerja penyabunan adalah mereaksikan minyak atau lemak dengan basa alkali berlebih yang telah diketahui konsentrasinya, dan menghasilkan gliserol dan sabun sebagai produknya. Sampel minyak goreng pada uji lemak penyabunan mengahasilkan uji positif yang ditandai dengan adanya emulsi berbuih pada bagian tengah larutan setelah ditambahkan NaCl jenuh. Sedangkan, pada air dan larutan pir 1% tidak ditemukan adanya emulsi buih dan larutan tetap bening, sehingga kedua sampel tersebut menghasilkan negatif, tidak ditemukan kandungan minyak atau lipid pada sampel. Berikut adalah prinsip uji kualitatif penyabunan (Keenan, 1991):
Gambar 1. Reaksi penyabunan lemak.
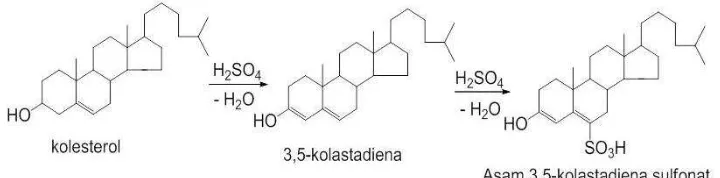
Uji Salkowski
terbentuk cincin berwarna coklat yang menunjukkan bahwa terdapat reaksi antara kolesterol dengan asam sulfat pekat (Brown, 1994).
Gambar 2. Reaksi uji salkowski pada lemak.
Sampel minyak goreng yang dilakukan uji salkowski menghasilkan uji positif yang ditandai dengan munculnya cincin coklat, sedangkan sampel larutan pir 1% dan air tetap berwarna bening, tidak terdapat kolestrol.
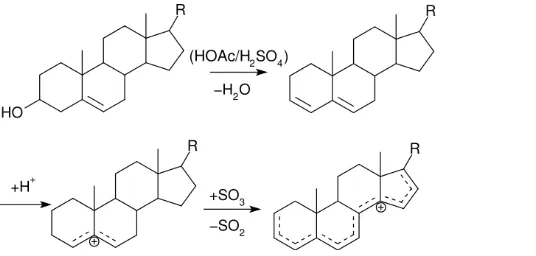
Uji Lieberman-Buchard
Gambar 3. Reaksi uji lemak dengan lieberman-buchard.
Pada percobaan uji lieberman-buchard pada sampel air dan larutan pir 1%, hasil akhir uji ini membuat warna larutan tidak berubah atau tetap bening. Tidak terjadi reaksi antara reagen lieberman-buchard dengan kolestrol sehingga tidak terbentuk larutan berwarna hijau.
KESIMPULAN
Uji lemak dapat dilakukan dengan melakukan uji penyabunan, uji salkowski dan juga uji lieberman-buchard. Untuk mengetahui ada tidaknya kandungan lemak pada sampel, langkah termudah adalah dengan dilakukan reaksi penyabunan, di mana akan dihasilkan larutan emulsi berbuih sebagai uji positifnya. Untuk mengetahui ada tidaknya kandungan senyawa kolestrol yang berbahaya bagi tubuh, dapat dilakukan uji salkowski dan uji lieberman-buchard. Meskipun sama-sama merupakan uji kualitatif lemak khususnya kolestrol pada minyak, uji lieberman-buchard lebih bermanfaat untuk menganalisa kandungan kolestrol pada minyak, sebab selain dapat menentukkan ada tidaknya kolestrol, kepekatan larutan berwarna hijau yang dihasilkan sebagai uji positif juga dapat menjadi tanda seberapa banyak atau tingginya jumlah kolestrol dalam minyak.
DAFTAR PUSTAKA
Brown, W. H. 1994. Study Guide for Introduction to Organic Chemistry. Jakarta: EGC.
Dawn, B. M. 2000. Biokimia Kedokteran Dasar. Jakarta: EGC. Keenan. 2001. Kimia untuk Universitas. Jakarta: Erlangga.
UJI KUALITATIF PROTEIN
PENDAHULUAN
Protein merupakan senyawa kompleks yang dihasilkan dari polimerisasi asam asam amino yang terikat satu sama lain melalui ikatan peptida. Protein merupakan senyawa yang sangat penting dalam sistem kehidupan karena protein memainkan peran yang sangat vital dalam semua aktivitas sel-sel tubuh makhluk hidup. Protein dignakan untuk dukungan struktural, penyimpanan, transport substansi lain, pergerakan dan pertahanan melawan substansi asing. Sebagai contoh, fibrosa mempunyai peran yang sangat penting dalam menyangga atau melindungi tubuh, sedangkan protein globuler seperti albumain memiliki peranan dalam aliran darah untuk penahan tekanan osmosis (Almatsier, 2010).
Semua protein terdiri dari rantai polipeptida yang memiliki struktur tertentu dalam tiga dimensi. Struktur protein terdiri dari 3 macam yaitu sekunder, tersier, dan kuartener. Pada struktur tersier, terdapat ikatan hidrogen, ikatan disulfida atau ikatan ionik. Struktur pada protein menentukan sifat-sifat protein baik daya larutnya maupun peranannya sebagai enzim suatu reaksi. Jika dari ketiga ikatan itu pecah maka rantai polipeptida akan diubah bentuknya yang mempunyai sifat yang berbeda. Proses yang terjadi ini disebut dengan dinaturasi dan disebabkan oleh pemanasan, larutan asam atau basa atau dengan molekul polar (Almatsier, 2010).
Uji kualitatif protein dapat dilakukan berdasarkan uji warna atau melalui uji endapan. Uji warna meliputi Ninhidrin, Biuret, Reduksi Sulfur, Xantroprotein, dan Millon Nasse. Sedangkan untuk uji pengendapan biasanya menggunakan garam logam. Sangat penting untuk memastikan kandungan protein dari makanan yang dikonsumsi. Dengan melakukan uji kualitatif protein, dapat diketahui keberadaan protein dalam makanan dengan cepat dan mudah.
TUJUAN
METODOLOGI
Bahan
Larutan pir 1%, air, albumin, HCl, NaOH, HNO3 pekat, CH3COOH, CuSO4, reagen
folin dan reagen millon. Alat
Penangas api, pipet tetes, dan tabung reaksi. Diagram alir langkah kerja
Uji denaturasi dengan pemanasan:
Uji denaturasi dengan penambahan asam-basa:
Uji reaksi protein dengan asam kuat dan asam lemah: Diletakkan dalam tabung reaksi
Dipanaskan di penangas air mendidih hingga menggumpal Diamkan dan amati perubahan yang terjadi
0,5 ml larutan pir 1% 0,5 ml albumin 0,5 ml air
Hasil
Masing-masing sampel diletakkan ke dalam 2 tabung reaksi (total ada 6 tabung reaksi).
Tiga jenis sampel pertama ditambahkan 0,5 ml HCl, tiga jenis sampel kedua ditambahkan 0,5 ml NaOH. Diamkan dan amati perubahan yang terjadi
0,5 ml larutan pir 1% 0,5 ml albumin 0,5 ml air
Hasil
Masing-masing sampel diletakkan ke dalam 2 tabung reaksi (total ada 6 tabung reaksi).
Tiga jenis sampel pertama ditambahkan 0,5 ml HNO3,
tiga jenis sampel kedua ditambahkan 0,5 ml CH3COOH.
Diamkan dan amati perubahan yang terjadi 0,5 ml larutan pir 1% 0,5 ml albumin 0,5 ml air
Uji Biuret:
Uji Xanthoprotein:
Uji Folin Ciocalteu:
Uji Millom (uji spesifik tirosin):
Masing-masing sampel diletakkan ke dalam tabung reaksi.
Ditambahkan NaOH encer 0,5 ml.
Ditambahkan CuSO4 0,5 ml, kemudian dikocok.
Diamkan dan amati perubahan yang terjadi 0,5 ml larutan pir 1% 0,5 ml albumin 0,5 ml air
Hasil
Masing-masing sampel diletakkan ke dalam tabung reaksi.
Ditambahkan HNO3 pekat 0,5 ml.
Kemudian dikocok.
Diamkan dan amati perubahan yang terjadi 0,5 ml larutan pir 1% 0,5 ml albumin 0,5 ml air
Hasil
Masing-masing sampel diletakkan ke dalam tabung reaksi.
Ditambahkan reagen follin 0,5 ml. Kemudian dikocok.
Diamkan dan amati perubahan yang terjadi 0,5 ml larutan pir 1% 0,5 ml albumin 0,5 ml air
Hasil
Masing-masing sampel diletakkan ke dalam tabung reaksi.
Ditambahkan reagen millon 0,5 ml. Kemudian dikocok.
Diamkan dan amati perubahan yang terjadi 0,5 ml larutan pir 1% 0,5 ml albumin 0,5 ml air
Biuret 0,5 ml sampel Bening. Bening. Bening. Ditambahkan
NaOH encer 0,5 ml
Bening. Bening. Bening.
Ditambahkan
Millon 0,5 ml sampel Bening. Bening. Bening. Ditambahkan
reagen millon 0,5 ml, lalu dikocok.
Larutan berubah warna menjadi putih, tampak ada endapan, keruh.
Larutan tetap bening.
Larutan tetap bening.
PEMBAHASAN
Uji denaturasi dengan pemanasan, dan perubahan pH (asam-basa)
Denaturasi merupakan sebuah proses di mana protein ataupun asam nukleat kehilangan struktur tersier atau sekunder dengan penerapan beberapa tekanan eksternal atau senyawa, seperti asam kuat atau basa, atau adanya pengaruh pemberian panas.
Gambar 1. Denaturasi protein menyebabkan struktur protein tersier terbuka menjadi struktur primer.
Protein yang terdenaturasi hampir selalu mengalami kehilangan fungsi biologis. Ciri-ciri protein mengalami denaturasi dapat dilihat dari berbagai hal, salah satunya dari perubahan struktur, di mana protein yang terdenaturasi mengalami pembukaan lipatan pada bagian-bagian tertentu, selain itu kelarutan protein dalam air juga akan berkurang. Selain itu, masing-masing penyebab denaturasi protein akan mengakibatkan ciri denaturasi yang spesifik (Hawab, 2004).
bertambah. Bertambahnya energi kinetik molekul akan mengacaukan ikatan-ikatan hidrogen. Selain itu, bentuk dari protein yang tidak teratur dapat menjadi tanda bahwa protein yang terdenaturasi mengalami peningkatan entropi. Pemanasan juga dapat mengakibatkan kemampuan protein untuk mengikat air menurun dan menyebabkan terjadinya koagulasi (Hawab, 2004).
Telur mngandung 74% air dan menyediakan semua asam amino esensial bagi manusia terutama padabagian putihnya (albumen). Sedangkan bagian kuningnya (yolk) merupakan sumber lemak. Telur juga menyediakan sejumlah penting vitamin termasuk vitamin A, D, E, K dan vitamin-vitamin B serta asam folat. Telur juga mengandung sejumlah mineral penting seperti kalsium, besi, fosfor, magnesium, dan kalium (Almatsier, 2010). Pada percobaan yang dilakukan pada albumin, hasil uji positif sesuai dengan literatur, di mana pemberian panas membuat protein putih telur menjadi keruh dan tidak larut dalam air, sedangkan untuk uji terhadap air dan larutan pir 1% tidak terjadi kekeruhan dan endapan, sehingga dapat dikatakan pada kedua sampel tersebut tidak mengandung protein. Berikut adalah reaksi pada saat protein dipanaskan:
Gambar 2. Reaksi yang terjadi pada saat protein dipanaskan.
Saat protein dipanaskan, dari struktur tersier atau sekunder akan berubah menjadi susunan terkecil asam aminonya, dan pada hasil yang dapat diamati dapat dilihat kelarutan protein berkurang.
Gambar 3. Reaksi yang terjadi antara protein dengan pelarut asam HCl dan basa NaOH.
Proses penambahan asam atau basa kuat akan mengakibatkan terbentuknya ikatan antata gugus N dan gugus COO- pada protein. Pada percobaan, penambahan NaOH pada albumin tidak membuat protein terdegradasi, hal ini diperkirakan NaOH belum bereaksi sempurna dengan albumin sehingga tidak tampak munculnya kekeruhan. Pemanasan atau pemberian suhu dirasa perlu untuk dilakukan sebagai katalis untuk mempercepat reaksi antara NaOH dengan albumin, namun dengan suhu yang tidak terlalu tinggi (sekitar 30 hingga 35ºC). Sama seperti uji denaturasi protein dengan suhu, sampel air dan larutan pir 1% tetap bening dan tidak ada reaksi yang terjadi, sehingga dapat dikatakan kedua sampel tersebut tidak mengandung protein.
Selain penambahan dengan asam HCl dan basa NaOH, penambahan HNO3
Gambar 4. Reaksi yang terjadi pada saat aromatik asam amino direaksikan dengan asam nitrat pekat.
Selain itu, ketika sampel albumin ditambahkan CH3COOH, menurut
literatur seharusnya sampel albumin muncul endapan putih. Namun hasil percobaan tidak didapatkan munculnya endapan putih. Hal ini dapat terjadi karena tidak adanya pemberian suhu sebagai katalis, ataupun kurangnya jumlah penambahan asam asetat sehingga reaksi kurang dapat berlangsung.
Gambar 5. Uji protein dengan asam asetat.
Sama seperti uji denaturasi protein albumin yang lain, uji pada sampel air dan larutan pir 1% tidak menunjukkan hasil positif, di mana larutan tetap bening.
Uji Biuret
Pendeteksian ada tidaknya ikatan peptida yang membentuk suatu protein dilakukan dengan uji biuret. Reagen biuret dibuat dari campuran larutan tembaga sulfat dengan natrium hidroksida (Winarno, 2004).
Uji positif ditandai dengan munculnya warna merah muda sampai ungu. Tes biuret (tes Piotrowski) adalah tes kimia yang digunakan untuk mendeteksi adanya ikatan peptida. Dengan adanya peptida, ion tembaga (II) membentuk kompleks koordinasi berwarna ungu dalam larutan alkali. Reagen ion tembaga, dengan muatan +2, dikurangi menjadi muatan +1 dengan adanya ikatan peptida, menyebabkan perubahan warnanya. Uji biuret tidak spesifik terhadap protein dikarenakan semua Cu2+ dapat berikatan dengan gugus amida bukan hanya protein. Berikut adalah
reaksi yang terjadi pada protein saat dilakukan uji biuret (Brown, 1994):
Gambar 7. Reaksi antara urea (atau bisa juga protein) dengan tembaga sulfat dalam larutan alkali menghasilkan endapan ungu.
Uji Follin
Prinsip metode Folin-Ciocalteu adalah reaksi oksidasi dan reduksi kolorimetrik untuk mengukur semua senyawa fenolik dalam sampel uji, dalam hal ini adalah protein. Pereaksi Folin-Ciocalteu merupakan larutan kompleks ion polimerik yang dibentuk dari asam fosfomolibdat dan asam hetero-polifosfotungstat. Pereaksi ini terbuat dari air, natrium tungstat, natrium molibdat, asam fosfat, asam klorida, litium sulfat, dan bromin. Prinsip metode Folin-Ciocalteu adalah oksidasi gugus fenolik hidroksil. Pereaksi ini mengoksidasi fenolat garam alkali, mereduksi asam heteropoli menjadi suatu kompleks molibdenum-tungsten. Fenolat hanya terdapat pada larutan basa, tetapi pereaksi Folin-Ciocalteu dan produknya tidak stabil pada kondisi basa. Hasil positif uji follin ini menghasilkan larutan berwarna biru (Brown, 1994).
Pada percobaan yang dilakukan, sampel albumin, air dan larutan pir 1% sama-sama tidak menghasilkan warna biru, di mana warna larutan yang terbentuk adalah kuning. Yang membedakan antara sampel albumin (protein) dengan air dan larutan pir 1% adalah pada larutan albumin terlihat keruh dan ada endapan, sedangkan kedua sampel lain bening. Hal ini dapat menjadi tanda keberadaan protein, meskipun tidak spesifik. Berikut adalah penjelasan uji folin:
Gambar 8. Uji protein folin.
Uji Millon
dilakukan untuk mengetahui ada tidaknya protein dalam suatu sampel. Berikut ilustrasi uji millon untuk analisa kualitatif protein:
Gambar 9. Bahan, alat, dan ilustrasi percobaan uji millon pada albumin.
Pada hasil percobaan, sampel albumin yang ditambahkan dengan reagen millon terbentuk endapan putih keruh, sedangkan pada sampel air dan larutan pir 1% tidak bereaksi apa-apa ditandai dengan larutan tetap berwarna bening. Hal ini sesuai dengan literatur, di mana protein yang direaksikan dengan reagen millon awalnya akan menghasilkan larutan keruh dengan ada endapan putih. Namun, karena dalam prosedur percobaan tidak dituliskan penambahan perlakuan pemanasan, hasil uji positif millon pada albumin yang dapat diamati hanya sampai munculnya endapan putih, tidak sampai menghasilkan warna merah. Uji millon cocok untuk menguji ada tidaknya senyawa fenol dalam sampel, namun apabila terdapat senyawa protein yang memiliki aromatik asam amino, akan menghasilkan hasil uji yang positif pula. KESIMPULAN
Uji kualitatif protein dapat dilakukan dengan berbagai cara, seperti uji denaturasi dengan suhu, perubahan pH, uji xanthoprotein, uji biuret, uji folin dan uji millon. Karakteristik protein saat didenaturasi oleh suhu, larutan asam HCl dan basa NaOH adalah terbentuknya endapan putih keruh, sedangkan penambahan asam pekat HNO3 menyebabkan warna larutan menjadi berwarna kuning. Uji biuret
DAFTAR PUSTAKA
Almatsier, S. 2010. Prinsip Dasar Ilmu Gizi. Jakarta: Gramedia Pustaka.
Brown, W. H. 1994. Study Guide for Introduction to Organic Chemistry. Jakarta: EGC.
Hawab, M. 2004. Pengantar Biokimia. Bogor: Bayu Media Publishing.
Sudarmadji, Slamet, Haryono, B., dan Suhardi. 1986. Analisa Bahan Makanandan Pertanian. Yogyakarta: Pusat Antar Universitas Ilmu Pangan dan Gizi.