ABSTRAK
Metabolisme kafein pada orang jawa terjadi secara lambat sehingga berpotensi menyebabkan toksisitas, oleh karena itu penting untuk dilakukan Therapeutic Drug Monitoring (TDM). TDM dilakukan untuk menentukan dosis obat yang efektif dalam darah sehingga dapat memonitor terjadinya toksisitas. TDM perlu pengembangan metode baru untuk analisis kafein pada orang jawa sehingga dapat digunakan untuk analisis rutin. Tujuan dari penelitian ini untuk mengembangkan metode baru untuk analisis kafein dalam sampel darah jawa menggunakan Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik. Standar internal (SI) yang digunakan dalam penelitian ini adalah asetanilida. Pengembangan metode yang dilakukan dalam penelitian ini adalah optimasi komposisi fase gerak dan kecepatan alir fase gerak. Optimasi komposisi fase gerak menggunakan aqua bidestilata:metanol dengan perbandingan 40:60; 50:50; dan 60:40 serta kecepatan alir 0,5 mL/menit dan 1,0 mL/menit. Fase diam yang digunakan adalah Phenomenex® C18 kolom (dimensi 250 x 4,6 mm, ukuran partikel 5 μm). Deteksi UV dilakukan setelah pemisahan kromatografi pada 255 nm. Parameter yang digunakan pada penelitian ini adalah nilai faktor tailing, resolusi, waktu retensi, HETP dan koefisien variansi (CV) dari nilai faktor tailing, waktu retensi dan HETP. Hasil penelitian menunjukkan komposisi fase gerak yang optimal adalah aquabidestilata: metanol (50:50) dan laju alir optimum fase gerak adalah 1,0 mL / menit.
ABSTRACT
A slow metabolism of caffeine in Javanese increases its potential of toxicity,
therefore it is important to do Therapeutic Drug Monitoring (TDM). TDM is aimed to determine drug level in the blood, so it can control toxicity. TDM needs a
development of new methods for the analysis of caffeine in the Javanese, so it can be applied for routine analysis. The aim of this study was developing new method for analysis of caffeine in javanese blood sample using reverse phase High Performance Liquid Chromatography (HPLC). Internal standard (IS) used in this research was acetanilide. The method development performed in this research were optimization of mobile phase composition and its flow rate. The optimization of mobile phase
composition using re-distiled water : methanol in the ratio of 40:60; 50:50; and 60:40 then a flow rate 0.5 mL/minute and 1,0 mL/minute. The stationary phase being used was Phenomenex® C18 column (dimensions 250x4.6 mm, particle size 5 m). The UV
detection was performed after chromatographic separation at 255 nm. The Parameter being used in this study are value of tailing factor, resolution, retention time, HETP and the coefficient of variance (CV) of those individual parameters. The results indicated that the optimum mobile phase composition was re-destiled water : methanol (50:50) with optimum flow rate of mobile phase is 1.0 mL/minute.
OPTIMASI METODE BIOANALISIS KAFEIN DALAM SAMPEL DARAH ORANG JAWA DENGAN METODE KROMATOGRAFI CAIR KINERJA
TINGGI FASE TERBALIK
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Jonathan Ronny Kurniawan NIM : 138114126
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
OPTIMASI METODE BIOANALISIS KAFEIN DALAM SAMPEL DARAH ORANG JAWA DENGAN METODE KROMATOGRAFI CAIR KINERJA
TINGGI FASE TERBALIK
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Jonathan Ronny Kurniawan NIM : 138114126
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
HALAMAN PERSEMBAHAN
Kupersembahkan karya ini untuk
Tuhan Yesus Kristus yang selalu memberikan hal yang terbaik
untukku,
Orang tua ku yang telah mengasihi aku dan membesarkan
aku dari aku kecil dengan penuh kasih sayang,
Sahabat-sahabatku yang selalu mendukungku,
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi saya yang berjudul
“Optimasi Metode Bioanalisis Kafein dalam Sampel Darah Orang Jawa dengan
Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik” tidak memuat karya atau
bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, dengan mengikuti ketentuan sebagaimana layaknya karya ilmiah.
Apabila di kemudian hari ditemukan indikasi plagiarisme dalam naskah ini, maka saya bersedia menanggung segala sanksi sesuai peraturan perundang-undangan yang berlaku.
Yogyakarta, 9 Januari 2017 Penulis
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma : Nama : Jonathan Ronny Kurniawan
Nomor Mahasiswa : 138114126
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
“OPTIMASI METODE BIOANALISIS KAFEIN DALAM SAMPEL DARAH ORANG JAWA DENGAN METODE KROMATOGRAFI CAIR KINERJA TINGGI FASE TERBALIK”
Beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di Internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal : 9 Januari 2017
Yang menyatakan
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa, atas berkat, cinta kasih dan penyertaan-Nya penulis dapat menyelesaikan penelitian dan penyusunan naskah skripsi yang berjudul “Optimasi Metode Bioanalisis Kafein dalam Sampel Darah Orang Jawa dengan Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik”. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S.Farm) di Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
Penulis menyadari bahwasannya dalam penyusunan naskah ini tidak lepas dari bantuan dan dukungan berbagai pihak, oleh karena itu pada kesempatan ini penulis hendak menyampaikan terimakasih kepada :
1. Ibu Aris Widayati, M.Si., Ph.D., Apt., selaku Dekan Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
2. Ibu Dr. Christine Patramurti, M.Si., Apt., selaku dosen pembimbing utama atas kesabaran, bimbingan, pengarahan, dan dukungan selama penelitian hingga penyusunan naskah skripsi ini.
3. Bapak Florentinus Dika Octa Riswanto, M.Sc., selaku dosen pembimbing pendamping atas kesabaran, bimbingan, pengarahan, dan dukungan selama penelitian hingga penyusunan naskah skripsi ini.
4. Bapak Maywan Hariono, M.Si., Ph.D., Apt., selaku dosen penguji yang telah memberikan kritik dan saran yang membangun hingga skripsi ini tersusun. 5. Ibu Dr. Dewi Setyaningsih, M.Sc., Apt., selaku dosen penguji yang telah
memberikan kritik dan saran yang membangun hingga skripsi ini tersusun. 6. Ibu Dita Maria Virginia, S.Farm., M.Sc., Apt., selaku Dosen Pembimbing
Akademik atas bimbingan selama ini.
8. Keluarga tersayang Bapak Sugiono, Ibu Veronica Setyawati, Kakak Jessica Novia Fransisca dan Linda Evelina Larisa, atas segala kasih, cinta, nasehat, saran, dukungan, dan doa yang selalu mengiringi langkah penulis.
9. Teman skripi bioanalisis kafein, Suryatmoko Agung, terimakasih untuk dukungan dan bantuannya selama ini.
10. Sahabat-sahabat penulis, Kadek Ida Krisnadewi, Ivana Tunggal, RR Kirana Andranilla, Yohanes Medika, Lia Elisa, Cindy dan Regina Eva Angelista, terimakasih untuk kebersamaan yang terjalin, semangat dan dukungan selama ini. 11. Teman-teman “Kos Wiratha” atas kebersamaannya selama ini.
12. Serta semua pihak yang telah banyak membantu penulis dalam menyelesaikan naskah skripsi ini, namun tidak dapat penulis sebutkan satu per satu.
Penulis menyadari bahwa tidak ada manusia yang sempurna, demikian juga untuk skripsi ini yang masih jauh dari kata sempurna. Oleh karena itu penulis mengharapkan adanya kritik dan saran yang membangun, sehingga skripsi ini dapat berguna bagi perkembangan ilmu pengetahuan serta bagi para pembaca.
Yogyakarta, Desember 2016
ABSTRAK
Metabolisme kafein pada orang jawa terjadi secara lambat sehingga berpotensi menyebabkan toksisitas, oleh karena itu penting untuk dilakukan Therapeutic Drug Monitoring (TDM). TDM dilakukan untuk menentukan dosis obat yang efektif dalam darah sehingga dapat memonitor terjadinya toksisitas. TDM perlu pengembangan metode baru untuk analisis kafein pada orang jawa sehingga dapat digunakan untuk analisis rutin. Tujuan dari penelitian ini untuk mengembangkan metode baru untuk analisis kafein dalam sampel darah jawa menggunakan Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik. Standar internal (SI) yang digunakan dalam penelitian ini adalah asetanilida. Pengembangan metode yang dilakukan dalam penelitian ini adalah optimasi komposisi fase gerak dan kecepatan alir fase gerak. Optimasi komposisi fase gerak menggunakan aqua bidestilata:metanol dengan perbandingan 40:60; 50:50; dan 60:40 serta kecepatan alir 0,5 mL/menit dan 1,0 mL/menit. Fase diam yang digunakan adalah Phenomenex® C18 kolom (dimensi 250 x 4,6 mm, ukuran partikel 5 µm). Deteksi UV dilakukan setelah pemisahan kromatografi pada 255 nm. Parameter yang digunakan pada penelitian ini adalah nilai faktor tailing, resolusi, waktu retensi, HETP dan koefisien variansi (CV) dari nilai faktor tailing, waktu retensi dan HETP. Hasil penelitian menunjukkan komposisi fase gerak yang optimal adalah aquabidestilata: metanol (50:50) dan laju alir optimum fase gerak adalah 1,0 mL / menit.
ABSTRACT
A slow metabolism of caffeine in Javanese increases its potential of toxicity, therefore it is important to do Therapeutic Drug Monitoring (TDM). TDM is aimed to determine drug level in the blood, so it can control toxicity. TDM needs a development of new methods for the analysis of caffeine in the Javanese, so it can be applied for routine analysis. The aim of this study was developing new method for analysis of caffeine in javanese blood sample using reverse phase High Performance Liquid Chromatography (HPLC). Internal standard (IS) used in this research was acetanilide. The method development performed in this research were optimization of mobile phase composition and its flow rate. The optimization of mobile phase composition using re-distiled water : methanol in the ratio of 40:60; 50:50; and 60:40 then a flow rate 0.5 mL/minute and 1,0 mL/minute. The stationary phase being used was Phenomenex® C18 column (dimensions 250x4.6 mm, particle size 5m). The UV
detection was performed after chromatographic separation at 255 nm. The Parameter being used in this study are value of tailing factor, resolution, retention time, HETP and the coefficient of variance (CV) of those individual parameters. The results indicated that the optimum mobile phase composition was re-destiled water : methanol (50:50) with optimum flow rate of mobile phase is 1.0 mL/minute.
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
Pembuatan larutan baku kafein ... 3
Pembuatan larutan standar internal (SI) ... 3
Penentuan panjang gelombang pengamatan kafein dan SI ... 3
Optimasi sistem Kromatografi Cair Kinerja Tinggi (KCKT) ... 4
DAFTAR TABEL
Tabel I. Nilai tailing factor dan waktu retensi dari kafein dan kandidat SI (asetanilida, nikotinamida, papaverin) pada optimasi………..………..………....8 Tabel II. Nilai tf dan tR kafein dan SI pada berbagai tingkat…...………..………...12
DAFTAR GAMBAR
Gambar 1. Kromatogram tumpang tindih antara blanko plasma dengan senyawa kafein dan beberapa kandidat SI (asetanilida, nikotinamida dan papaverin) menggunakan sistem KCKT yang optimum (fase diam kolom C18:250 x
4,6 mm, 5µm; fase gerak campuran aquabidestilata : metanol dengan perbandingan 60:40; kecepatan alir 1,0 mL/menit………7 Gambar 2. Tumpang tindih spektrum senyawa kafein dan asetanilida. Pembacaan
absorbansi menggunakan spektrofotometer UV pada panjang gelombang
200nm - 400nm……….………8
Gambar 3. Kromatogram senyawa: Kafein dan SI Asetanilida dalam sampel plasma menggunakan sistem KCKT yang optimum (fase diam C18:250 x 4,6 mm,
5µm; fase gerak campuran aquabidestilata : metanol dengan perbandingan 50:50; kecepatan alir 1,0 mL/menit; detektor UV 255 nm………...9 Gambar 4. Interaksi senyawa kafein dan SI asetanilida dengan fase
diam…...……..………..………..………..………..…10
Gambar 5. Senyawa kafein dan SI asetanilida dengan gugus polarnya serta interaksinya dengan fase gerak aquabidestilata (H2O) dan metanol
DAFTAR LAMPIRAN
Lampiran 1. Surat ijin penelitian skripsi oleh dinas perizinan kota Yogyakarta …...15 Lampiran 2. Hasil pembacaan absorbansi senyawa kafein dan SI asetanilida
menggunakan spektrofotometer UV.…… ………....………16 Lampiran 3. Hasil pembacaan absorbansi senyawa kafein dan SI papaverin
menggunakan spektrofotometer UV………...………..……….…17 Lampiran 4. Hasil pembacaan absorbansi senyawa kafein dan SI nikotinamida
menggunakan spektrofotometer UV……….……….……18 Lampiran 5. Sertifikat analisis working standar kafein………...……19 Lampiran 6. Surat permohonan ijin penelitian dan pengambilan data…...…….……20 Lampiran 7. Surat permohonan bahan penelitian dari PMI kota Yogyakarta…….…21 Lampiran 8. Kuisioner donor darah ………..…………..………22 Lampiran 9. Campuran kafein dan nikotinamida mengunakan fase gerak
aquabidestilata:metanol (40:60) kecepatan alir 0,5 mL/menit ...……..26
Lampiran 10. Campuran kafein dan nikotinamida mengunakan fase gerak
aquabidestilata:metanol (50:50) kecepatan alir 0,5 mL/menit ..…...…27 Lampiran 11. Campuran kafein dan nikotinamida mengunakan fase gerak
aquabidestilata:metanol (60:40) kecepatan alir 0,5 mL/menit .………28 Lampiran 12. Campuran kafein dan nikotinamida mengunakan fase gerak
Lampiran 13. Campuran kafein dan nikotinamida mengunakan fase gerak
aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit………..30 Lampiran 14. Campuran kafein dan nikotinamida mengunakan fase gerak
aquabidestilata:metanol (60:40) kecepatan alir 1,0 mL/menit …….…31 Lampiran 15. Kromatogram papaverin 4 g/mL mengunakan fase gerak
aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit ...…..…32 Lampiran 16. Kromatogram papaverin 4 g/mL mengunakan fase gerak
aquabidestilata:metanol (60:40) kecepatan alir 1,0 mL/menit …….…33 Lampiran 17. Kromatogram asetanilida 8 g/mL mengunakan fase gerak
aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit …….…34
Lampiran 18. Kromatogram asetanilida 8 g/mL mengunakan fase gerak
aquabidestilata:metanol (60:40) kecepatan alir 1,0 mL/menit …….…35
Lampiran 19. Kromatogram blanko plasma A mengunakan fase gerak
aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit …….…36
Lampiran 20. Kromatogram blanko plasma B mengunakan fase gerak
aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit …….…37 Lampiran 21. Kromatogram blanko plasma C mengunakan fase gerak
aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit …….…38
Lampiran 22. Kromatogram blanko plasma D mengunakan fase gerak
Lampiran 23. Kromatogram blanko plasma E mengunakan fase gerak
aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit …….…40
Lampiran 24. Seri 1 (kafein 1,6 g/mL dan asetanilida 4 g/mL) replikasi 1
mengunakan fase gerak aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit ...….………..…….…….…….…….…….…….…….…41 Lampiran 25. Seri 1 (kafein 1,6 g/mL dan asetanilida 4 g/mL) replikasi 2
mengunakan fase gerak aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit ...….………..…….…….…….…….…….…….…….…42 Lampiran 26. Seri 1 (kafein 1,6 g/mL dan asetanilida 4 g/mL) replikasi 3
mengunakan fase gerak aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit ...….………..…….…….…….…….…….…….…….…43 Lampiran 27. Seri 2 (kafein 8 g/mL dan asetanilida 8 g/mL) replikasi 1
mengunakan fase gerak aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit .….………....…….…….…….…….…….…….…….…44 Lampiran 28. Seri 2 (kafein 8 g/mL dan asetanilida 8 g/mL) replikasi 2
mengunakan fase gerak aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit .….………....…….…….…….…….…….…….…….…45 Lampiran 29. Seri 2 (kafein 8 g/mL dan asetanilida 8 g/mL) replikasi 3
Lampiran 30. Seri 3 (kafein 18 g/mL dan asetanilida 12 g/mL) replikasi 1
mengunakan fase gerak aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit .….………....…….…….…….…….…….…….…….…47 Lampiran 31. Seri 3 (kafein 18 g/mL dan asetanilida 12 g/mL) replikasi 2
mengunakan fase gerak aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit .….………....…….…….…….…….…….…….…….…48 Lampiran 32. Seri 3 (kafein 18 g/mL dan asetanilida 12 g/mL) replikasi 3
mengunakan fase gerak aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit .….………....…….…….…….…….…….…….…….…49 Lampiran 33. Kromatogram Uji Kesesuaian Sistem 1 (kafein 12 g/mL dan
asetanilida 8 g/mL) mengunakan fase gerak aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit .….………....…….… ……….…50 Lampiran 34. Kromatogram Uji Kesesuaian Sistem 2 (kafein 12 g/mL dan
asetanilida 8 g/mL) mengunakan fase gerak aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit .….………....…….… ……….…51 Lampiran 35. Kromatogram Uji Kesesuaian Sistem 3 (kafein 12 g/mL dan
asetanilida 8 g/mL) mengunakan fase gerak aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit .….………....…….… ……….…52 Lampiran 36. Kromatogram Uji Kesesuaian Sistem 4 (kafein 12 g/mL dan
Lampiran 37. Kromatogram Uji Kesesuaian Sistem 5 (kafein 12 g/mL dan
asetanilida 8 g/mL) mengunakan fase gerak aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit .….………....…….… ……….…54 Lampiran 38. Kromatogram Uji Kesesuaian Sistem 6 (kafein 12 g/mL dan
asetanilida 8 g/mL) mengunakan fase gerak aquabidestilata:metanol (50:50) kecepatan alir 1,0 mL/menit .….………....…….… ……….…55 Lampiran 39. Perhitungan konsentrasi larutan seri pada tahap optimasi pemisahan
kafein dan SI asetanilida dalam plasma .….………....…….……….….56 Lampiran 40. Perhitungan konsentrasi larutan seri pada tahap uji kesesuaian sistem
………....57
Lampiran 41. Contoh perhitungan konsentrasi kafein dan asetanilida dari
PENDAHULUAN
Kafein merupakan zat psikoaktif dan juga berperan sebagai stimulan sistem saraf pusat (Joewana, 2005). Konsumsi kafein yang berlebihan menyebabkan peningkatan hormon stress, peningkatan tekanan darah, cemas, pusing, kelelahan dan gangguan tidur (Pedak, 2009). Waktu paruh dari kafein adalah 3,5 jam, tetapi metabolisme kafein pada orang yang memiliki penyakit liver atau ibu hamil lebih lambat sehingga waktu paruhnya lebih lama (Key dan Hayes, 1996). Kecepatan metabolisme obat dipengaruhi oleh beberapa faktor, yaitu induksi enzim, inhibisi enzim, usia, penyakit, dan faktor genetik (Neal, 2006). Kecepatan metabolisme obat dipengaruhi oleh faktor genetik, salah satunya adalah perbedaan komposisi enzim pada ras/suku yang berbeda sehingga menyebabkan perbedaan kemampuan metabolisme obat.
Pada penelitian jurnal oleh Alvi dan Hammami (2011) dilakukan analisis kafein dalam plasma sintetik menggunakan fase gerak kalium fosfat dan asetonitril dengan perbandingan 83:17. Panjang gelombang pada penelitian tersebut diatur sebesar 274 nm. Waktu retensi senyawa kafein yang dihasilkan < 10 menit, namun resolusi antara puncak senyawa kafein dengan puncak senyawa lain yang berdekatan sehingga belum memenuhi persyaratan analisis. Plasma sintetik yang digunakan pada penelitian tersebut kurang representatif jika digunakan untuk aplikasi TDM pada orang jawa karena sampel plasma sintetik memiliki komposisi yang berbeda dengan sampel darah orang jawa. Hasil analisis akan lebih representatif jika menggunakan sampel darah orang jawa.
Pada penelitian skripsi oleh Irmanto (2008) dilakukan analisis kafein menggunakan instrumen KCKT fase terbalik dengan fase gerak aquabidestilata dan metanol. Penelitian tersebut diawali dengan tahap optimasi. Fase gerak aquabidestilata dan metanol pada penelitian tersebut dijadikan acuan sebagai fase gerak pada penelitian ini.
Berdasarkan review artikel oleh Patil (2012), disebutkan beberapa penelitian tentang analisis kafein menggunakan berbagai sampel seperti minuman kopi, plasma sintetik, campuran obat dan teh. Berdasarkan review tersebut, analisis senyawa kafein dapat dilakukan dengan menggunakan metode KCKT fase terbalik, metode KCKT elusi gradien dan metode UHPLC. Pada penelitian ini juga digunakan metode KCKT fase terbalik.
Pengembangan metode diperlukan untuk kepentingan analisis kafein. Pengembangan metode ini dilakukan melalui dua tahapan yaitu optimasi metode dan validasi metode. Sebelum dilakukan validasi metode perlu dilakukan tahapan optimasi terlebih dahulu. Penelitian yang dilakukan yaitu optimasi pada sistem KCKT untuk mendapatkan parameter optimasi yang optimal. Parameter optimasi tersebut meliputi nilai resolusi senyawa kafein dan SI asetanilida dengan senyawa lain yang puncaknya berdekatan, tailing factor (kafein dan SI asetanilida) , waktu retensi (kafein dan SI asetanilida), nilai HETP (kafein dan SI asetanilida), dan nilai koefisien variansi (CV) dari tailing factor, waktu retensi dan HETP untuk kafein dan SI asetanilida.
METODE PENELITIAN Bahan
Alat
KCKT Shimadzu LC-2010C dengan detektor sinar UV, kolom C18 merek
Phenomenex® (250 x 4,6 mm, ukuran partikel 5µm), seperangkat komputer (merek Dell B6RDZIS Connexant system RD01-D850 A03-0382 JP France S.A.S, printer HP Deskjet 1000 J110a), Spektrofotometer UV Shimadzu UV-1800, milipore, ultrasonikator Retsch tipe : T460 (Schwing 1 PXE, FTZ-Nr, C-066/83, HF-frequ:35 kHz), timbangan analitik SCALTEC (max 60/210 g, min 0,001 g; d = 0,01/0,1 mg), penyaring Whatman 0,45 µm, alat vakum GAST, sentrifugator Thermo scientific Heraeus Pico 17/21 dan peralatan-peralatan gelas.
Metode
Optimasi pemisahan senyawa kafein dan SI pada sistem KCKT fase terbalik dilakukan dengan berbagai komposisi fase gerak yang terdiri dari campuran aquabidestilata : metanol dengan perbandingan 40:60; 50:50 dan 60:40. Selain
perbandingan komposisi fase gerak, dilakukan juga optimasi kecepatan alir fase gerak pada 0,5 dan 1,0 mL/menit. Volume injeksi sejumlah 20 L. Plasma darah yang didapatkan dari PMI kota Yogyakarta disimpan pada pendingin dengan temperatur -70 oC.
Pembuatan Larutan Stok dan Intermediet Kafein
Sejumlah kafein ditimbang seksama lebih kurang sebanyak 20 mg dan dilarutkan pada pelarut metanol 50% dalam labu takar volume 5 mL sehingga didapat larutan stok kafein dengan konsentrasi 4 mg/mL. Dari larutan stok kafein, dibuat larutan intermediet kafein dengan konsentrasi 800 g/mL. Larutan stok dan intermediet kafein selalu dibuat baru.
Pembuatan Larutan Standar Internal (SI)
Pada penelitian ini dilakukan optimasi pemilihan SI, adapun SI yang digunakan adalah nikotinamida, papaverin dan asetanilida. Masing-masing SI tersebut ditimbang seksama lebih kurang sebanyak 20 mg dan dan dilarutkan pada pelarut metanol 50% dalam labu takar volume 5 mL sehingga didapat konsentrasi 4 mg/mL. Untuk memudahkan pengenceran di tahap selanjutnya maka dibuat larutan intermediet SI dengan konsentrasi 320 g/mL. Larutan stok dan intermediet masing-masing kandidat SI selalu dibuat baru. Penentuan Panjang Gelombang Pengamatan Kafein dan SI dengan Spektrofotometer UV
Larutan seri kafein dibuat dengan cara mengencerkan larutan intermediet kafein 800
µg/mL. Masing-masing larutan seri kafein tersebut dibaca absorbansinya menggunakan spektrofotometer UV pada panjang gelombang antara 200-400 nm.
Larutan seri SI dibuat dengan cara mengencerkan larutan intermediet SI 320 g/mL menggunakan pelarut metanol 50% sehingga didapatkan konsentrasi 4, 8, dan 12 µg/mL untuk SI asetanilida; 10, 15, dan 20 µg/mL untuk SI nikotinamida; dan 2, 4, dan 6 µg/mL untuk SI papaverin. Masing-masing larutan seri SI tersebut dibaca absorbansinya menggunakan spektrofotometer UV pada panjang gelombang antara 200-400 nm. Spektrum yang dihasilkan ditumpang tindihkan, lalu dipilih panjang gelombang pengamatan yang akan digunakan untuk deteksi pada sistem KCKT baik pada kafein maupun SI.
Optimasi Sistem KCKT
Optimasi pemilihan standar internal. Larutan kerja kafein dibuat dengan mengencerkan larutan intermediet kafein 800 g/mL menggunakan pelarut metanol 50 % sehingga didapatkan konsentrasi larutan kafein 10 µg/mL. Larutan disaring menggunakan milipore lalu diawaudarakan menggunakan ultrasonikator sehingga larutan kerja kafein siap diinjeksikan ke sistem KCKT.
Larutan kerja SI dibuat dengan mengencerkan larutan intermediet SI 320 g/mL menggunakan pelarut metanol 50 % sehingga didapatkan konsentrasi larutan SI 8 µg/mL untuk SI asetanilida; 10 g/mL untuk SI nikotinamida dan 4 g/mL untuk SI papaverin. Larutan di saring menggunakan milipore lalu diawaudarakan menggunakan ultrasonikator sehingga larutan kerja SI siap diinjeksikan ke sistem KCKT.
SI yang menghasilkan tailing factor dan pemisahan puncak terbaik dari senyawa lain yang berdekatan dipilih untuk dijadikan SI pada penelitian ini.
Optimasi komposisi fase gerak dan kecepatan alir dalam pelarut. Kromatogram larutan kerja kafein dan larutan kerja SI yang didapat pada tahap optimasi pemilihan standar internal ditumpang tindih, lalu diamati waktu retensi, tailing factor dan pemisahan puncaknya. Komposisi fase gerak dan kecepatan alir yang menghasilkan waktu retensi, tailing factor dan pemisahan puncak terbaik dipilih untuk digunakan pada penelitian ini.
Optimasi pemisahan kafein dan SI Asetanilida dalam plasma. Diambil plasma darah sebanyak 600 µL, kemudian dipindahkan ke dalam tube, lalu ditambahkan 200 µL larutan seri SI asetanilida, dan 200 µL larutan seri kafein. dan divortex selama 30 detik. Adapun konsentrasi larutan seri kafein dan larutan seri SI asetanilida yang ditambahkan yaitu larutan seri kafein 32 µg/mL dengan larutan seri SI asetanilida 80 µg/mL; larutan seri kafein 160 µg/mL dengan larutan seri SI asetanilida 160 µg/mL; dan larutan seri kafein 360 µg/mL dengan seri SI asetanilida 240 µg/mL. Dari tube tersebut, larutan diambil sebanyak 500 µ L lalu ditambahkan metanol sebanyak 1500 µ L dalam tabung sentrifugasi sehingga didapatkan volume total 2000 µL. Lalu tabung sentrifugasi divortex selama 30 detik dan disentrifugasi selama 10 menit dengan kecepatan 10000 rpm. Cairan supernatan dipisahkan, kemudian disaring dengan millipore. Selanjutnya dilakukan diawaudarakan menggunakan ultrasonikator selama 5 menit sehingga supernatan siap di injeksikan ke sistem KCKT.
Sejumlah 20,0 L masing-masing supernatan yang telah disiapkan, diinjeksikan pada sistem KCKT dengan komposisi fase gerak dan kecepatan alir optimum. Kromatogram yang dihasilkan lalu diamati bentuk puncak nya dengan melihat nilai waktu retensi, tailing factor (tf) serta nilai Rs dari kafein maupun SI dengan senyawa lain yang berdekatan.
Kondisi sistem KCKT dikatakan optimum jika kromatogram yang dihasilkan mempunyai nilai tf <2; Rs >2,0 serta tR < 10 menit. SI yang menghasilkan parameter optimum terbaik
dipilih untuk dijadikan SI pada penelitian ini. Uji Kesesuaian Sistem KCKT
1500 µ L dalam tabung sentrifugasi. Sehingga didapatkan volume total 2000 µ L. Lalu tabung sentrifugasi divortex selama 30 detik dan disentrifugasi selama 10 menit dengan kecepatan 10000 rpm. Cairan supernatan dipisahkan, kemudian di millipore. Selanjutnya diawaudarakan menggunakan ultrasonikator selama 5 menit. Supernatan siap di injeksikan ke sistem KCKT.
Sejumlah 20,0 L masing-masing supernatan yang telah disiapkan tersebut, diinjeksikan pada sistem KCKT sebanyak 6 kali replikasi dengan komposisi fase gerak dan kecepatan alir optimum.
Pengamatan dilakukan pada panjang gelombang pengamatan kemudian diamati kromatogram kafein hasil pemisahan dan dilihat nilai waktu retensi (kafein dan SI asetanilida), nilai tf (kafein dan SI asetanilida), Rs kafein dengan puncak senyawa lain
yang terdekat, Rs SI asetanilida dengan puncak senyawa lain yang terdekat, nilai CV dari waktu retensi (kafein dan SI asetanilida) dan nilai CV dari tf (kafein dan SI asetanilida).
Kondisi sistem KCKT dikatakan optimum jika kromatogram yang dihasilkan mempunyai nilai tf <2; Rs >2,0 serta tR < 10 menit.
HASIL DAN PEMBAHASAN
Sampel biologis yang dianalisis pada penelitian ini berupa sampel plasma darah dari subjek keturunan suku jawa. Penggunaan sampel plasma darah orang keturunan suku jawa penting sehingga metode analisis menjadi lebih spesifik.
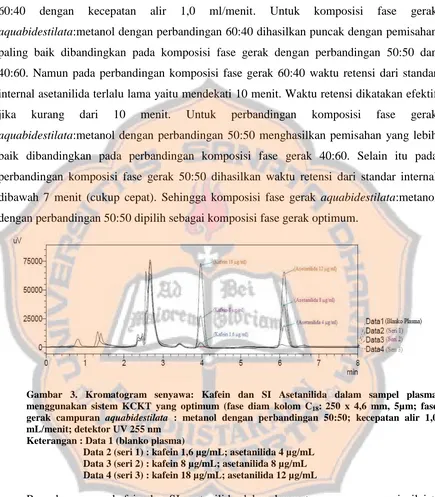
Optimasi pemilihan standar internal dilakukan sebelum optimasi sistem KCKT. Optimasi sistem KCKT pada penelitian ini dilakukan dengan optimasi berbagai perbandingan komposisi fase gerak aquabidestilata : metanol dan optimasi kecepatan alir fase gerak campuran aquabidestilata : metanol. Kandidat standar internal yang dioptimasi adalah asetanilida, nikotinamida dan papaverin. Berdasarkan kromatogram yang dihasilkan pada Gambar 1, senyawa nikotinamida tidak dapat dijadikan standar internal karena memiliki puncak yang bertabrakan dengan puncak senyawa dalam blanko plasma. Puncak senyawa asetanilida dan papaverin terpisah dari puncak noise dalam blanko plasma. Puncak senyawa papaverin yang dihasilkan memiliki waktu retensi yang dekat dengan puncak senyawa kafein, sedangkan puncak senyawa asetanilida memiliki waktu retensi yang cukup jauh dengan senyawa kafein sehingga senyawa asetanilida dipilih sebagai SI pada penelitian ini.
Gambar 1. Kromatogram tumpang tindih antara blanko plasma dengan senyawa kafein dan beberapa kandidat SI (asetanilida, nikotinamida dan papaverin) menggunakan sistem KCKT yang optimum (fase diam kolom C18:250 x 4,6 mm, 5µm; fase gerak campuran aquabidestilata :
metanol dengan perbandingan 60:40; kecepatan alir 1,0 mL/menit
Gambar 2. Tumpang tindih spektrum senyawa kafein dan asetanilida. Pembacaan absorbansi menggunakan spektrofotometer UV pada panjang gelombang 200nm - 400nm
Komposisi fase gerak yang dioptimasi pada sistem KCKT yaitu perbandingan komposisi fase gerak aquabidestilata:metanol dengan perbandingan 40:60; 50:50 dan 60:40 dengan kecepatan alir 1,0 ml/menit. Untuk komposisi fase gerak aquabidestilata:metanol dengan perbandingan 60:40 dihasilkan puncak dengan pemisahan
paling baik dibandingkan pada komposisi fase gerak dengan perbandingan 50:50 dan 40:60. Namun pada perbandingan komposisi fase gerak 60:40 waktu retensi dari standar internal asetanilida terlalu lama yaitu mendekati 10 menit. Waktu retensi dikatakan efektif jika kurang dari 10 menit. Untuk perbandingan komposisi fase gerak aquabidestilata:metanol dengan perbandingan 50:50 menghasilkan pemisahan yang lebih
baik dibandingkan pada perbandingan komposisi fase gerak 40:60. Selain itu pada perbandingan komposisi fase gerak 50:50 dihasilkan waktu retensi dari standar internal dibawah 7 menit (cukup cepat). Sehingga komposisi fase gerak aquabidestilata:metanol dengan perbandingan 50:50 dipilih sebagai komposisi fase gerak optimum.
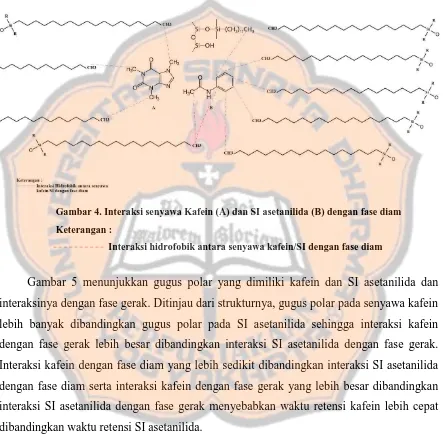
Gambar 3. Kromatogram senyawa: Kafein dan SI Asetanilida dalam sampel plasma menggunakan sistem KCKT yang optimum (fase diam kolom C18:250 x 4,6 mm, 5µm; fase
gerak campuran aquabidestilata : metanol dengan perbandingan 50:50; kecepatan alir 1,0 mL/menit; detektor UV 255 nm
Keterangan : Data 1 (blanko plasma)
Data 2 (seri 1) : kafein 1,6 µg/mL; asetanilida 4 µg/mL Data 3 (seri 2) : kafein 8 µg/mL; asetanilida 8 µg/mL Data 4 (seri 3) : kafein 18 µg/mL; asetanilida 12 µg/mL
Puncak senyawa kafein dan SI asetanilida dalam kromatogram mempunyai nilai tf
kurang dari 2, hal ini menunjukkan bahwa kafein dan SI asetanilida tidak cukup kuat tertahan dalam kolom dan dapat keluar serentak dari kolom (Snyder dkk., 2010). Nilai tR
kafein dan SI asetanilida pada Gambar 3 adalah kurang dari 10 menit. Hal ini menunjukkan bahwa kedua senyawa tersebut dapat keluar dengan cepat dari kolom. Nilai tR senyawa kafein lebih cepat dibandingkan senyawa SI asetanilida, hal ini disebabkan
dan fase gerak yang digunakan. Pada penelitian ini digunakan metode KCKT fase terbalik, sehingga semakin polar suatu senyawa maka interaksi dengan fase geraknya semakin kuat dan dapat dikatakan waktu retensinya semakin cepat.
Gambar 4 menunjukkan interaksi kafein atau SI asetanilida dengan fase diam. Interaksi kafein dengan fase diam lebih sedikit dibandingkan interaksi SI asetanilida dengan fase diam.
Gambar 4. Interaksi senyawa Kafein (A) dan SI asetanilida (B) dengan fase diam
Keterangan :
Interaksi hidrofobik antara senyawa kafein/SI dengan fase diam
Gambar 5. Senyawa Kafein (A) dan SI Asetanilida (B) dengan gugus polarnya ( ) serta interaksinya dengan fase gerak aquabidestilata (H2O) dan metanol (CH3OH)
Keterangan :
Interaksi kafein/SI dengan pelarut aquabidestilata Interaksi kafein/SI dengan pelarut metanol
Hasil kromatogram untuk senyawa kafein dan SI asetanilida menunjukkan pemisahan puncak yang sempurna dengan puncak senyawa lain yang berdekatan. Hal ini ditunjukkan dengan nilai Rs > 2,0 mengidentifikasikan bahwa puncak senyawa dapat terpisah dengan baik dengan senyawa lain yang puncaknya berdekatan (Snyder dkk., 2010).
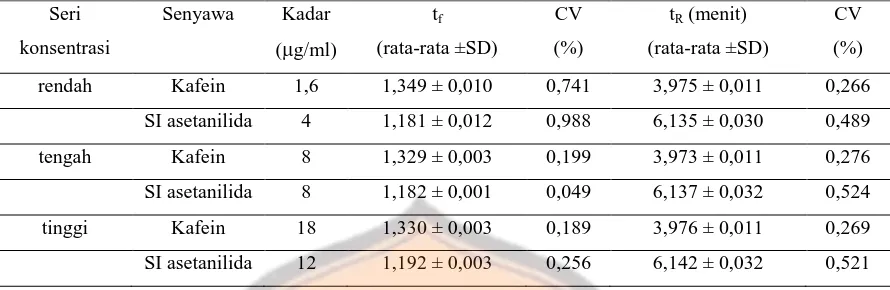
Pada tahap optimasi pemisahan kafein dan SI asetanilida dalam sampel plasma, digunakan 3 seri konsentrasi kafein maupun SI asetanilida menggunakan fase gerak aquabidestilata dan metanol dengan perbandingan 40:60; 50:50 dan 60:40 serta kecepatan
alir 0,5mL/menit dan 1,0 mL/menit. Penggunaan 3 seri konsentrasi bertujuan untuk membandingkan tinggi puncak kromatogram sebagai acuan seberapa besar kadar yang akan digunakan pada tahap validasi metode. Nilai tailing factor dan waktu retensi yang didapatkan dari sistem KCKT fase terbalik dengan fase gerak perbandingan aquabidestilata:metanol dengan perbandingan 50:50 dan kecepatan alir 1,0 ml/menit telah
Tabel II. Nilai tf dan tR kafein dan SI pada berbagai tingkat
Keterangan : masing-masing senyawa dalam setiap kadar direplikasi sebanyak 3 kali.
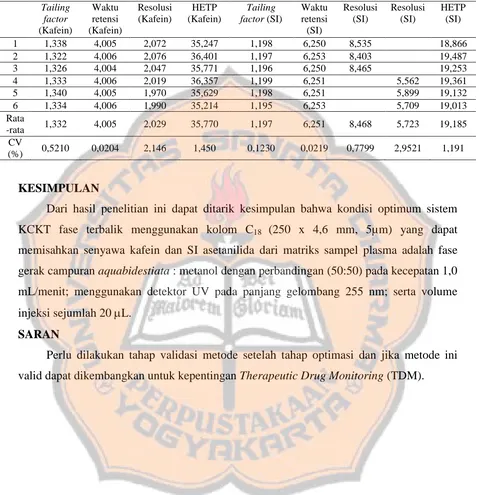
Berdasarkan uji kesesuaian sistem didapatkan rata-rata nilai tailing factor kafein yaitu 1,332; rata-rata waktu retensi kafein adalah 4,005 menit, rata-rata resolusi kafein dengan senyawa lain yang puncaknya terdekat yaitu 2,029, rata-rata nilai tailing factor SI (asetanilida) yaitu 1,197, rata-rata waktu retensi SI (asetanilida) adalah 6,251, rata-rata resolusi SI (asetanilida) dengan senyawa lain yang puncaknya terdekat untuk replikasi 1, 2 dan 3 yaitu 8,468 sedangkan rata-rata resolusi SI dengan senyawa lain yang puncaknya terdekat untuk replikasi 4, 5 dan 6 yaitu 5,723. Nilai resolusi SI (asetanilida) pada replikasi 1, 2 dan 3 jauh berbeda dengan nilai resolusi SI (asetanilida) pada replikasi 4, 5 dan 6 karena puncak terdekat dari SI asetanilida pada replikasi 1, 2 dan 3 merupakan puncak senyawa kafein yang memiliki waktu retensi sekitar 4,0 menit, sedangkan puncak terdekat dari SI asetanilida pada replikasi 4, 5 dan 6 terdapat puncak senyawa lain pada waktu retensi sekitar 4,4 menit. Pada replikasi 4, 5 dan 6 terbaca puncak noise blanko plasma pada waktu retensi sekitar 4,4 menit, sedangkan pada replikasi 1, 2 dan 3 tidak terbaca puncak noise pada waktu retensi sekitar 4,4 menit. Hal tersebut menyebabkan resolusi pada uji kesesuaian sistem untuk SI pada replikasi 1, 2 dan 3 memiliki nilai resolusi yang lebih tinggi dibandingkan resolusi uji kesesuaian sistem pada replikasi 4, 5 dan 6. Berdasarkan penjelasan tersebut dapat dikatakan bahwa metode ini telah memenuhi kriteria tailing factor yang baik yaitu dibawah 2,0; waktu retensi yang efektif yaitu dibawah 10 menit dan
Tabel III. Data nilai tailing factor kafein dan SI (asetanilida), nilai waktu retensi kafein dan SI (asetanilida), nilai resousi kafein dan SI (asetanilida), dan nilai HETP kafein dan SI (asetanilida) pada
uji kesesuaian sistem
Dari hasil penelitian ini dapat ditarik kesimpulan bahwa kondisi optimum sistem KCKT fase terbalik menggunakan kolom C18 (250 x 4,6 mm, 5µm) yang dapat
memisahkan senyawa kafein dan SI asetanilida dari matriks sampel plasma adalah fase gerak campuran aquabidestiata : metanol dengan perbandingan (50:50) pada kecepatan 1,0 mL/menit; menggunakan detektor UV pada panjang gelombang 255 nm; serta volume injeksi sejumlah 20 L.
SARAN
DAFTAR PUSTAKA
Alvi, S.N., dan Hammami, M., M, 2011. Validated HPLC Method for Determination of Caffeine Level in Human Plasma using Synthetic Plasma: Application to Bioavailability Studies, Journal of Chromatographic Science. (49), 292-296.
Anonim, 2012. CYP2A6, https://www.pharmgkb.org/gene/PA121?tabType=tabVip, diakses pada 11 November 2016.
Gandjar, I.G., dan Rohman, A., 2007. Kimia Farmasi Analisis. Penerbit Pustaka Pelajar, Yogyakarta, 242-246, 326-327, 379-381, 385-386, 388.
Irmanto, A.R., 2008, Validasi Penetapan Kadar Campuran Parasetamol, Propifenazon dan Kafein dengan Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik. Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta, 33-70.
Joewana, S., 2005. Gangguan Mental dan Perilaku Akibat Penggunaan Zat Psikoaktif. Edisi 2, Penerbit Buku Kedokteran EGC, Jakarta, 71.
Kang, J.S., dan Lee, M.H., 2009. Overview of Therapy Drug Monitoring, The Korean Journal of Internal Medicine. (24), 1-10.
Kee, J.L., dan Hayes, E.L., 1996. Farmakologi Pendekatan Proses Keperawatan. Penerbit Buku Kedokteran EGC, Jakarta, 200.
Neal, M.J., 2006. At a Glance Farmakologi Medis, Erlangga Medical Series. Edisi V, Jilid 1, Jakarta, 14-15.
Patil, P.N., 2012. Caffein in Various Sample and Their Analysis HPLC, International Journal of Pharmaceutical Sciences Review and Article. (18), 76-83.
Patramurti, C., Sugiyanto., Nurrochmad A., dan Martono, S., 2015. Polymorphisme of Cytochrome P450 2A6 (CYP2A6*1 and CYP2A6*4) Among Javanese Indonesian Smoker and Non Smoker, Indonesian Journal of Pharmacy. (26), 11-19.
Pedak, M., 2009. Metode Supernol Menaklukkan Stress. Penerbit Hikmah, Jakarta, 109. Snyder, L.R., Kirkland, J.J., dan Dolan, J.W., 2010. Introduction to Modern Liquid
LAMPIRAN
Lampiran 9. Campuran kafein dan nikotinamida mengunakan fase gerak
Lampiran 10. Campuran kafein dan nikotinamida mengunakan fase gerak
Lampiran 11. Campuran kafein dan nikotinamida mengunakan fase gerak
Lampiran 12. Campuran kafein dan nikotinamida mengunakan fase gerak
Lampiran 13. Campuran kafein dan nikotinamida mengunakan fase gerak
Lampiran 14. Campuran kafein dan nikotinamida mengunakan fase gerak
Lampiran 15. Kromatogram papaverin 4 g/mL mengunakan fase gerak
Lampiran 16. Kromatogram papaverin 4 g/mL mengunakan fase gerak
Lampiran 17. Kromatogram asetanilida 8 g/mL mengunakan fase gerak
Lampiran 18. Kromatogram asetanilida 8 g/mL mengunakan fase gerak
Lampiran 19. Kromatogram blanko plasma A mengunakan fase gerak
Lampiran 20. Kromatogram blanko plasma B mengunakan fase gerak
Lampiran 21. Kromatogram blanko plasma C mengunakan fase gerak
Lampiran 22. Kromatogram blanko plasma D mengunakan fase gerak
Lampiran 23. Kromatogram blanko plasma E mengunakan fase gerak
Lampiran 39. Perhitungan konsentrasi larutan seri pada tahap optimasi pemisahan kafein dan SI asetanilida dalam plasma
Larutan seri kafein/SI sebanyak 200 L diencerkan menjadi 1000 L (pengenceran 5 kali) 1000 L tersebut diambil 500 L lalu diencerkan menjadi 2000 L (pengenceran 4 kali) sehingga siap diinjeksikan pada sistem KCKT
Total pengenceran : 5 x 4 = 20 kali pengenceran M1 V1 = M2 V2
Dari larutan seri kafein :
32 g/mL x 200 L = 6,4 g/mL x 1000 L 6,4 g/mL x 500 L = 1,6 g/mL x 2000 L
Jadi konsentrasi kafein yang diinjek pada sistem KCKT yaitu 1,6 g/mL
160 g/mL x 200 L = 32 g/mL x 1000 L 32 g/mL x 500 L = 8 g/mL x 2000 L
Jadi konsentrasi kafein yang diinjek pada sistem KCKT yaitu 8 g/mL
360 g/mL x 200 L = 72 g/mL x 1000 L 72 g/mL x 500 L = 18 g/mL x 2000 L
Jadi konsentrasi kafein yang diinjek pada sistem KCKT yaitu 18 g/mL Dari larutan seri SI Asetanilida :
80 g/mL x 200 L = 16 g/mL x 1000 L 16 g/mL x 500 L = 4 g/mL x 2000 L
Jadi konsentrasi SI asetanilida yang diinjek pada sistem KCKT yaitu 4 g/mL
160 g/mL x 200 L = 32 g/mL x 1000 L 32 g/mL x 500 L = 8 g/mL x 2000 L
Jadi konsentrasi SI asetanilida yang diinjek pada sistem KCKT yaitu 8 g/mL
240 g/mL x 200 L = 48 g/mL x 1000 L 48 g/mL x 500 L = 12 g/mL x 2000 L
Lampiran 40. Perhitungan konsentrasi larutan seri pada tahap uji kesesuaian sistem Larutan seri kafein/SI sebanyak 200 L diencerkan menjadi 1000 L (pengenceran 5 kali) 1000 L tersebut diambil 500 L lalu diencerkan menjadi 2000 L (pengenceran 4 kali) sehingga siap diinjeksikan pada sistem KCKT
Total pengenceran : 5 x 4 = 20 kali pengenceran M1 V1 = M2 V2
Dari larutan seri kafein :
240 g/mL x 200 L = 48 g/mL x 1000 L 48 g/mL x 500 L = 12 g/mL x 2000 L
Jadi konsentrasi kafein yang diinjek pada sistem KCKT yaitu 12 g/mL Dari larutan seri SI Asetanilida :
160 g/mL x 200 L = 32 g/mL x 1000 L 32 g/mL x 500 L = 8 g/mL x 2000 L
Lampiran 41. Contoh perhitungan konsentrasi kafein dan asetanilida dari
penimbangan, perhitungan konsentrasi larutan stok dan perhitungan konsentrasi larutan intermediet
Perhitungan konsentrasi larutan stok kafein/SI
20 mg kafein/SI dilarutkan dengan pelarut hingga 5 mL Konsentrasi larutan stok kafein/SI = 20 mg / 5 mL = 4 mg/mL
Perhitungan konsentrasi larutan intermediet kafein 800 g/mL
1000 L larutan stok kafein 4 mg/mL diencerkan dengan pelarut hingga 5 mL Konsentrasi larutan intermediet kafein = 4 mg/mL x 1000 L / 5mL = 800 g/mL
Perhitungan konsentrasi larutan intermediet asetanilida 320 g/mL
BIOGRAFI PENULIS
Penulis skripsi dengan judul “Optimasi Metode Bioanalisis Kafein dalam Sampel Darah Orang Jawa dengan Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik” memiliki nama lengkap Jonathan Ronny