LAPORAN PRAKTIKUM KIMIA FISIK I PERCOBAAN IX
ENTALPI DAN ENTROPI PELEBURAN
OLEH:
NAMA : MUH. YAMIN A. STAMBUK : F1C1 08 049 KELOMPOK : III
ASISTEN PEMBIMBING : IMA ISMAIL
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS HALUOLEO
KENDARI 2009
ENTALPI DAN ENTROPI PELEBURAN A. TUJUAN PERCOBAAN
Adapun tujuan pada praktikum ini adalah :
1. Memperkenalkan perbedaan kurva pendinginan cairan murni dan larutan. 2. Memperlihatkan peristiwa penurunan titik beku yang disebabkan penambahan
zat terlarut.
3. Menghitung entropi dan entalpi pembekuan dengan menggunakan persamaan van’t Hoff.
B. LANDASAN TEORI
Siklus Born-Haber dan proses-proses yang menghasilkan entalpi pembentukan standar, ΔHf° pada pembentukan oksida piroklor (A3+)2(B4+)2O7. Tahap-tahap I, II, III, dan IV merupakan Siklus Born-Haber. Tahaptahap V dan VI merupakan tahap pembentukan dari unsur-unsurnya menjadi oksida-oksida biner dan akhirnya menjadi oksida piroklor. Untuk mengubah unsur A, B dan molekul O2 menjadi atom-atomnya diperlukan energi atomisasi, dan perubahan entalpinya disebut entalpi atomisasi, ΔHatom (I); atom-atom A, B dan O kemudian diubah menjadi A3+ dan B4+ memerlukan entalpi ionisasi (jumlah entalpi ionisasi pertama, kedua, dan ketiga untuk ion A; jumlah entalpi ionisasi pertama, kedua, ketiga dan keempat untuk atom B), ΔHion, dan O2- menghasilkan entalpi afinitas, ΔHaf (II); selanjutnya ion-ion ini bergabung membentuk kisi struktur oksida piroklor yang menghasilkan entalpi kisi, ΔHL (III); Jumlah dari perubahan-perubahan entalpi tahap I, II dan III adalah entalpi
pembentukan standar, ΔH°f (IV). Bila tidak ada data ΔH°f, data entalpi
pembentukan oksida A, ΔH°f(A2O3(s)) dan oksida B, ΔH°f(2BO2(s)) (V), serta entalpi pembentukan oksida piroklor A2B2O7(s) dari oksida A dan B, ΔH°fox (VI) dapat digunakan (Suhendar, et al., 2006).
Proses tak reversibel (seperti pendinginan hingga mencapai temperatur yang sama dengan temperatur lingkungan dan pemuaian bebas dari gas) adalah proses spontan, sehingga proses itu disertai dengan kenaikan entropi. Kita dapat menyatakan bahwa proses tak reversibel menghasilkan entropi. Sedangkan proses reversibel adalah perubahan yang sangat seimbang, dengan sistem dalam keseimbangan dengan lingkungannya pada setiap tahap. Setiap langkah yang sangat kecil di sepanjang jalannya bersifat reversibel dan terjadi tanpa menyebarkan energi secara kacau, sehingga juga tanpa kenaikan entropi; proses reversibel tidak menghasilkan entropi, melainkan hanya memindahkan entropi dari satu bagian ke bagian lain (Atkins, 1986).
Untuk proses isoternal dan reversibel, perubahan entropi total dan sistem dan sekelilingnya sama dengan nol. Demikian pula perubahan entropi untuk proses siklus sama dengan nol. Proses-proses reversibel selalu berjalan sangat lama. Ini berarti proses-proses yang terjadi pada waktu yang pendek brupa proses irreversibel dan tentu saja diikuti dengan kenaikan entropi dari sistemnya sendiri atau sistem dan sekitarnya (Sukardjo, 2002).
Entropi zat padat bertambah apabila ia melebur menjadi cair dan semakin tinggi apabila zat cair berubah menjadi gas. Sistem dan lingkungan pada
suhu peralihan T dimana kedua fasa berada dalam keseimbangan pada tekanan 1 atm. Pada tiik peralihan, perpindahan energi diantara sistem dan lingkungan adalah terbalik. Pada tekanan tetap.Titik lebur dari sebuah benda padat adalah suhu di mana benda tersebut akan berubah wujud menjadi benda cair. Ketika dipandang dari sisi yang berlawanan (dari cair menjadi padat) disebut titik beku. Pada sebagian besar benda, titik lebur dan titik beku biasanya sama. Contoh, titik lebur dan titik beku dari "raksa" adalah 234,32 kelvin (-38,83 °C atau -37,89 °F) Namun, beberapa subtansi lainnya memiliki temperatur beku <--> cair yang berbeda. contohnya "agar-agar", mencair pada suhu 85 °C (185 °F) dan membeku dari suhu 32-40°C (89,6 - 104 °F); fenomena ini dikenal sebagai hysteresis (http/id.Wikipedia.org).
Entalpi yang berhubungan erat dengan energi dalam, juga tidak dapat diukur, tetapi hanya dapat didefinisikan dengan cara lain sehingga menjadi fungsi keadaan. Untuk keadaan sistem tertentu terhadap nilai H yang khas. Ciri lain dari fungsi keadaan adalah bahwa selisih nilai fungsi dua keadaan yang berbeda besarnya khas. Energi dalam yang telah dijelaskan sebagai seluruh energi berkaitan dengan partikel-partikel materi di dalam sistem, adalah sesuatu yang tidak dapat diukur. Tetapi, energi-dalam hanya tergantung pada keadaan yang merupakan ciri suatu sistem dan tidak pada bagaimana keadaan-keadaan tersebut dicapai. Kondisi suatu sistem mengacu pada keadaannya, dan setiap sifat yang hanya tergantung pada keadaan dari suatu sistem disebut fungsi keadaan (Petrucci, 1987).
C. ALAT DAN BAHAN 1. Alat
Alat yang digunakan pada percobaan ini adalah : - Tabung reaksi - Termometer 0-100 (± 0.1 0C) - Pengaduk - Gelas piala 400 ml - Pemanas listrik - Stopwatch - Penjepit tabung - Neraca analitik 2. Bahan
Bahan yang digunakan dalam percobaan ini adalah - Naftalena
- Difenilamina - Aquades - Kertas tisue
D. PROSEDUR KERJA
Prosedur kerja yang dilakukan pada percobaan ini adalah: Naftalena
- ditimbang sebanyak 6 gram - dimasukkan dalam tabung reaksi
- dipanaskan dengan cara dimasukkan ke dalam gelas kimia berisi air panas (90oC)
sampai semua naftalena mencair
- diangkat lalu dimasukkan dalam selongsong pada gelas piala berisi bahan isolasi (tisu) - diamati suhu pada thermometer tiap 30 detik - ditentukan titik beku naftalena
E. HASIL PENGAMATAN
Adapun hasil pengamatan yang diperoleh dalam percobaan ini antara lain :
1. Tabel Pengamatan
Titik beku naftalena = 68oC
- ditambahkan 1,5 gram difenilamina ke dalam tabung
- dipanaskan dengan cara memasukkan ke dalam gelas piala yang berisi air panas (90oC) hingga semua naftalena dan
difenilamina mencair
- diangkat lalu dimasukkan dalam selongsong pada gelas piala berisi bahan isolasi
- diamati suhu pada termometer tiap 30 detik - ditentukan titik beku naftalena +
difenilamina
- diulangi percobaan dengan penambahan 1,5 gram difenilamina sebanyak 3 kali.
Titik beku 6 gram naftalena + 1,5 gram difenilamina = 62oC
No t (menit)Waktu Naftalena murniT (oC) Penambahan difenilamina ke-1 (oC) Penambahan difenilamina ke-2 (oC) 1. 30 76 68 63 2. 30 76 69 62 3. 30 76 67 60,5 4. 30 76 66 59,5 5. 30 76 65 59 6. 30 76 65 58 7. 30 76 64 57,5 8. 30 64 57 9. 30 63 56,5 10. 30 63 56 11. 30 62,5 55,5 12. 30 62 55 13. 30 62 54 14. 54 15. 53,5 Naftalena murni :
Diketahui : Massa naftalena = 6 gram Mr naftalena = 128 g/mol
Mol naftalena = mol
mol g gram Mr massa 0,0469 / 128 6 = = Xnaftalena = 0,0469 1 0469 , 0 = mol mol
Penambahan difenilamina ke-I :
Diketahui : Massa difenilamina I = 1,5 gram
Mol difenilamina = mol
mol g gram Mr massa 0,0089 / 5 , 168 5 , 1 = =
Dalam larutan tersebut terdapat 0,0469 mol naftalena dan 0,0089 mol diefenilamina maka,
Mol total = 0,0469 mol + 0,0089 mol = 0,0558 mol Xnaftalena = 0,0558 0,8405 047 , 0 = mol mol
Penambahan difenilamina ke-II : Massa difenilamina ke-II = 1,5 gram Massa total difenilamina = 3 gram, jadi :
Mol difenilamina = mol
mol g gram Mr Massa 0178 , 0 / 5 , 168 3 = =
Dalam larutan tersebut terdapat 0,0469 mol naftalena dan 0,0178 mol difenilamina maka,
Mol total = 0,0469 mol + 0,068 mol = 0,0647 mol Xnaftalena = 0,0647 0,7249 047 , 0 = mol mol Tabel Data
No. Kategori Naftalena murni Larutan I Larutan II 1 2 3 4 5 6 7 Berat Naftalena (g) Mol Naftalena (mol) Berat difenilamina (g) Mol difenilamina (mol) Mol total (mol)
Fraksi mol C10H8 Ln X C10H8 6 0,0469 0,0469 1 0 6 0,0469 1,5 0,0089 0,0558 0,8405 -0,1741 6 0,0469 3,0 0,0178 0,0647 0,7249 -0,3217
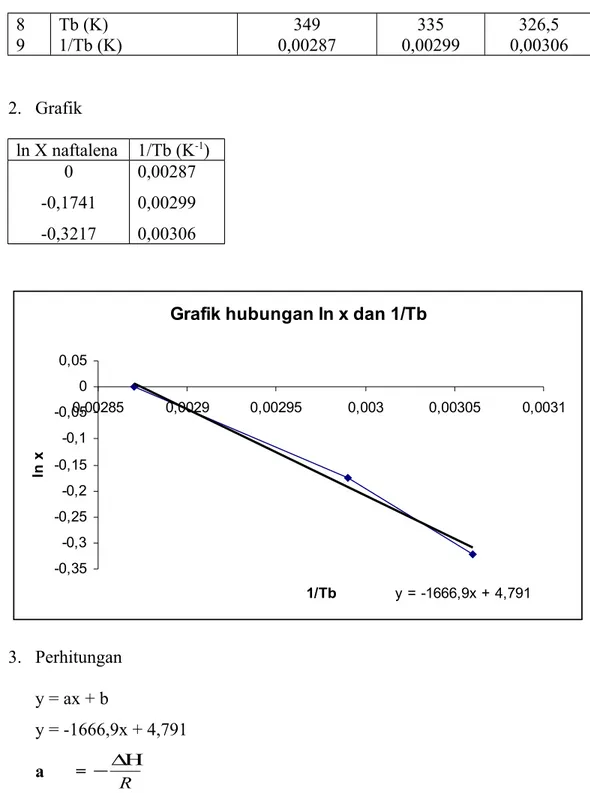
8 9 Tb (K) 1/Tb (K) 349 0,00287 335 0,00299 326,5 0,00306 2. Grafik ln X naftalena 1/Tb (K-1) 0 -0,1741 -0,3217 0,00287 0,00299 0,00306
Grafik hubungan ln x dan 1/Tb
y = -1666,9x + 4,791 -0,35 -0,3 -0,25 -0,2 -0,15 -0,1 -0,05 0 0,05 0,00285 0,0029 0,00295 0,003 0,00305 0,0031 1/Tb ln x 3. Perhitungan y = ax + b y = -1666,9x + 4,791 a = R ∆Η − ∆Η = - a x R = -(-1666,9) x 8,314 J/mol.K = 13858,6066 J/mol.K a = R S ∆
S
∆ = b x R
= 4,791 x 8,314 J/mol.K = 39,832374 J/mol.K F. PEMBAHASAN
Entalpi yang berhubungan erat dengan energi dalam, juga tidak dapat diukur, tetapi hanya dapat didefinisikan dengan cara lain sehingga menjadi fungsi keadaan. Untuk keadaan sistem tertentu terhadap nilai H yang khas. Ciri lain dari fungsi keadaan adalah bahwa selisih nilai fungsi dua keadaan yang berbeda besarnya khas. Energi dalam yang telah dijelaskan sebagai seluruh energi berkaitan dengan partikel-partikel materi di dalam sistem, adalah sesuatu yang tidak dapat diukur. Tetapi, energi-dalam hanya tergantung pada keadaan yang merupakan ciri suatu sistem dan tidak pada bagaimana keadaan-keadaan tersebut dicapai. Kondisi suatu sistem mengacu pada keadaannya, dan setiap sifat yang hanya tergantung pada keadaan dari suatu sistem disebut fungsi keadaan.
Entalpi merupakan perubahan energi yang dibutuhkan suatu zat untuk melakukan perubahan/kerja. Sehingga entalpi peleburan merupakan banyaknya energi yang dibutuhkan untuk berubah wujud dari padat menjadi cair. Entalpi dan entropi peleburan sangat berkaitan erat dengan titik beku larutan murni dan larutan campuran. Yang menjadi ini pada percobaan ini yakni bagaimana pengaruh penambahan suatu zat terlarut dalam pelarut murni, yang mana dalam hal ini yang menjadi pelarut murni adalah naftalena sedang yang menjadi zat terlarutnya adalah difenilamina.
Pada saat mencapai titi beku, bentuk cair suatu larutan atau pelarut murni berada dalam keseimbangannya dalam bentuk padatnya. Bila suatu cairan didinginkan, maka suhunya akan turun sampai titik beku dicapai. Setelah titik beku dicapai, suhu tidak akan turun lagi sebelum semua cairan berubah menjadi padatan. Setelah seluruh cairan menjadi padatan, baru suhu akan turun lagi.
Pada percobaan kali ini yang dilakukan yaitu menetukan titik beku pelarut murni (naftalena), yang mula-mula naftalen yang telah ditimbang kemudian dicairkan terlebih dahulu dengan suhu awal 76oC, sampai menit ke
empat suhu naftalen tetap, ini berarti naftalen mencapai titik bekunya yakni pada suhu 76oC. Titik beku yang diperoleh pada percobaan ini sangat jauh berbeda
dengan titik beku naftalena sebenarnya. Di mana secara teori titik beku naftalena yaitu 80,4oC. Perbedaan titik beku antara titk beku secara teori dengan praktek yang
telah dilakukan mungkin disebabkan oleh naftalena yang digunakan dalam percobaan ini kemungkinan tidak murni lagi. Maksudnya yaitu naftalen kemungkinan telah dikotori oleh zat yang lainnya. Selain itu naftalena mungkin juga telah mengikat zat kimia lain yang berada di udara bebas pada saat akan dimasukkan kedalam gelas kimia yang telah terisolasi sehingga naftalena yang digunakan sudah tidak di murni lagi.
Pada pengamatan selanjutnya yaitu dengan mengamati penurunan titik beku larutan murni dalam hal ini naftalena dengan menambahkan zat terlarut yakni difenilamina. Pada penambahan 1,5 g difenilamina kedalam naftalena dengan proses yang sama, dicairkan terlebih dahulu dengan suhu awal 68oC,
penambahan difenilamina yang terakhir dengan jumlah yang sama penambahan pertama, sehingga difenilamina yang terkandung dalam naftalena menjadi 3 gram, diperoleh titik beku larutan menjadi semakin menurun yakni 53,5oC. Peristiwa
penurunan titik beku yang terjadi ini disebut sebagai peristiwa lewat beku. Dinamakan peristiwa lewat beku karena pada peristiwa ini cairan tersebut tidak membeku, walaupun suhunya telah melampaui titik beku atau sudah di bawah titik bekunya. Hal ini disebabkan karena titik beku difenilamina jauh lebih rendah dibanding titik beku naftalena sehingga naftalena sukar untuk membentuk kristal atau kecenderungan sulit untuk membeku.
Pada larutan, selain titik bekunya labih rendah daripada pelarut murni, juga pada saat larutan membeku, suhunya tidak tetap tetapi menurun. Dengan demikian, bagian horizontal pada kurva pendingin cairan murni, pada kurva pendingin larutan tidak lagi horizontal. Hal ini disebabkan pada saat pelarut (naftalena) mulai membeku, sisa larutan akan semakin pekat ddan semakin pekatnya larutan, titik bekunya juga semakin rendah. hal inilah yang menyebabkan titik beku larutan jauh menurun dibawah titik beku naftalena yang sebenarnya.
G. KESIMPULAN
Berdasarkan percobaan yang telah dilakukan, maka dapat ditarik beberapa kesimpulan yaitu :
1. Pada kurva pendingin cairan murni adalah horizontal karena pengambilan data yang tidak sesuai yang semestinya kurva yang dihasilkan tidak lagi horizontal.
2. Peristiwa lewat beku yang terjadi pada naftalena disebabkan karena adanya penambahan zat terlarut yakni difenilamina.
3. Nilai entropi dan entalpi secara berturut-turut adalah 13858,6066 J/mol.K, 39,832374 J/mol.K.
DAFTAR PUSTAKA Atkins, 1986. Kimia Fisika. Erlangga. Jakarata
Petrucci, R. 1987. Kimia Dasar Jilid II. Erlangga. Jakarta.
Suhendar, D. & Ismunandar. 2006. Penentuan Energi Kisi Oksida-Oksida Piroklor. Journal of Physic. ITB: Bandung
Sukardjo. 2002. Kimia Fisika. Rineka Cipta. Jakarta.