VALIDASI METODE KROMATOGRAFI CAIR KINERJA TINGGI FASE TERBALIK UNTUK PENETAPAN KADAR ASAM ASKORBAT DALAM
SEDIAAN LARUTAN INJEKSI OBAT PEMUTIH KULIT MEREK “X”
INTISARI
Asam askorbat dapat digunakan sebagai agen pemutih kulit. Kadar asam askorbat dalam larutan injeksi pemutih kulit merek “X” harus memberikan efek yang diinginkan. Untuk menjamin efikasinya, maka perlu dilakukan penetapan kadar asam askorbat dalam sediaan obat dengan metode yang telah divalidasi.
Penelitian bersifat deskriptif non eksperimental, asam askorbat dianalisis menggunakan sistem Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik dengan fase diam Phenomenex® C18 (250 x 4,6 mm, 5 µm) dan fase gerak
campuran metanol : 0,01 M bufer fosfat dengan penambahan larutan 0,1 M asam fosfat hingga pH 3 (40 : 60) dengan kecepatan alir 0,9 mL/menit dan menggunakan detektor UV-244 nm. Parameter validasi yang digunakan adalah selektivitas, linieritas, akurasi, presisi, dan rentang.
Hasil penelitian menunjukkan parameter selektivitas terpenuhi, akurasi dan presisi yang baik pada konsentrasi tinggi (konsentrasi asam askorbat = 120 µg/mL) dengan % recovery = 100,50–101,01% dan RSD = 0,28%. Linieritas yang dihasilkan pada metode ini telah memenuhi syarat dengan nilai r = 0,9989 pada konsentrasi asam askorbat 50–150 µg/mL.
VALIDATION METHOD OF REVERSE PHASE HIGH PERFORMANCE LIQUID CHROMATOGRAPHY FOR THE ASSAY OF ASCORBIC ACID
IN THE WHITENING SKIN INJECTION BRAND “X”
ABSTRACT
Ascorbic acid can be used as agent for skin whitening. Ascorbic acid level
inside skin whitening “X” injection should give the desired effect. To ensures the efficacy, it’s necessary to determine the ascorbic acid level in the dosage form
with a method that has already been validated.
This research is descriptive non exprimental. Ascorbic acid is using Reversed High Performance Liquid Chromatography (HPLC) with stationary phase Phenomenex® C18 (250 x 4.6 mm, 5 µm) and mobile phase methanol : 0.01
M phosphoric buffer adjusting to pH 3 with 0.1 M phosphoric acid (40 : 60), flowrate 0.9 mL/min and detection with UV at 244 nm. Validation parameter used in this research are selectivity, linierity, acuration, precision, and range.
This results of the study showed that selectivity reversed-phase HPLC method is reach, accuracy and precision are at high concentration (120 µg/mL) with % recovery = 100.50–101.01% and RSD = 0.28%. The good linierity for ascorbic acid with values (r) of 0.9989 at 50–150 µg/mL.
i
VALIDASI METODE KROMATOGRAFI CAIR KINERJA TINGGI FASE TERBALIK UNTUK PENETAPAN KADAR ASAM ASKORBAT DALAM
SEDIAAN LARUTAN INJEKSI OBAT PEMUTIH KULIT MEREK “X”
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Farmasi
Diajukan oleh:
Rosalia Lestari
NIM : 128114133
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
Halaman Persembahan
Matius 11:28 “Marilah kepadaku, hai kamu yang letih lesu dan berbeban berat
Aku akan memberi kelegaan kepadamu”
Kupersembahkan untuk:
Tuhan, mama, papa,
vii
PRAKATA
Puji dan syukur penulis haturkan ke hadirat Tuhan Yang Maha Esa karena
atas berkat dan rahmat-Nya yang telah diberikan selama proses pengerjaan skripsi
ini dari awal hingga akhir, sehingga penelitian dan penyusunan skripsi yang berjudul “Validasi Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik untuk
Penetapan Kadar Asam Askorbat dalam Sediaan Larutan Injeksi Obat Pemutih
Kulit Merek “X” dapat berjalan dengan lancar dan terselesaikan dengan baik.
Skripsi ini disusun sebagai salah satu syarat untuk meraih gelar sarjana farmasi (S.
Farm.) di Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
Dalam pelaksanaan penelitian hingga selesainya penyusunan skripsi ini,
penulis mendapat banyak dukungan dan bantuan dari berbagai pihak. Oleh karena
itu, penulis mengucapkan terima kasih kepada:
1. Aris Widayati, M.Si., Apt., Ph.D. selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma, Yogyakarta.
2. Prof. Dr. Sudibyo, M.S., Apt. dan Florentinus Dika Octa Riswanto, M.Sc.
selaku Dosen Pembimbing yang bersedia membimbing, memberi masukan
dan jalan keluar serta saran yang sangat bermanfaat dalam menyelesaikan
penelitian ini hingga penyusunan naskah skripsi.
3. Dr. Christine Patramurti, M.Si., Apt. dan Jeffry Julianus, M.Si. selaku dosen
penguji yang telah memberikn saran dan kritik yang membangun dalam
penyusunan skripsi.
4. Jeffry Julianus, M.Si. selaku dosen pembimbing akademik atas
viii
Fakultas Farmasi Universitas Sanata Dharma Yogyakarta yang telah
mendampingi, membagi ilmu, dan pengalamannya yang sangat bermanfaat
dalam bidang farmasi.
5. Seluruh Staf laboratorium kimia Fakultas Farmasi Universitas Sanata
Dharma terutama Mas Bimo, Mas Ottok, Mas Kethul yang telah banyak
membantu dan bersedia direpotkan selama penulis menyelesaikan penelitian
skripsi.
6. Mama, papa, mbak Tiwi, kak Kumala, Wulan, dan Elen yang telah
mendoakan dan terus memberikan semangat agar cepat menyelesaikan
skripsi dan kuliah.
7. Petra Annie Anjani dan Eunike Lystia Florentien Kelana Jeversoon sebagai
teman sekelompok skripsi yang telah berjuang bersama-sama dari awal
penyusunan skripsi hingga selesai.
8. Teman-teman semua yang telah membantu, mendukung, menyemangati
penulis. Semua pihak yang tidak dapat disebutkan satu per satu yang telah
membantu penulis dalam menyelesaikan penelitian ini. Terima kasih atas
dukungannya.
Penulis menyadari bahwa masih banyak kekurangan di dalam skripsi ini. Oleh
karena itu, segala kritik dan saran yang membangun, sangat penulis harapkan.
Semoga skripsi ini dapat membantu dan bermanfaat bagi pembaca dan dapat
berguna bagi perkembangan ilmu pengetahuan.
ix
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI... vi
PRAKATA ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xviii
INTISARI ... xix
ABSTRACT ... xx
BAB I PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Tujuan Penelitian ... 5
BAB II PENELAAHAN PUSTAKA... 6
A. Asam Askorbat ... 6
x
C. Larutan Penyangga (Bufer) ... 10
D. Kromatografi Cair Kinerja Tinggi (KCKT) ... 11
E. Validasi Metode Analisis ... 13
F. Landasan Teori ... 16
G. Hipotesis ... 17
BAB III METODELOGI PENELITIAN ... 18
A. Jenis dan Rancangan Penelitian ... 18
B. Variabel Penelitian ... 18
1. Variabel bebas ... 18
2. Variabel tergantung ... 18
3. Variabel pengacau terkendali ... 18
C. Definisi Operasional ... 19
D. Bahan Penelitian ... 19
E. Alat Penelitian ... 20
F. Tatacara Penelitian ... 20
1. Pembuatan asam fosfat 0,1 M ... 20
2. Pembuatan bufer fosfat 0,01 M ... 20
3. Pembuatan fase gerak ... 20
xi
5. Pembuatan larutan baku asam askorbat yang digunakan untuk
penentuan panjang gelombang maksimum ... 21
6. Penentuan panjang gelombang maksimum asam askorbat dengan spektrofotometer UV-Vis ... 21
7. Pembuatan seri larutan baku asam askorbat ... 22
8. Preparasi larutan sampel ... 22
9. Preparasi adisi baku dalam sampel untuk penentuan akurasi dan presisi .. 22
10. Validasi metode analisis ... 23
11. Uji kestabilan larutan baku ... 24
G. Analisis Hasil ... 24
1. Selektivitas ... 24
2. Linieritas ... 24
3. Akurasi ... 25
4. Presisi ... 25
5. Rentang ... 25
6. Uji Kestabilan Larutan Baku ... 26
BAB IV HASIL DAN PEMBAHASAN ... 27
A. Pembuatan Fase Gerak ... 27
B. Pembuatan Larutan Baku Asam Askorbat ... 29
xii
D. Analisis Kualitatif Berdasarkan Waktu Retensi (tR) Asam Askorbat... 31
E. Validasi Metode Analisis ... 33
1. Selektivitas ... 33
2. Linieritas ... 35
3. Akurasi ... 36
4. Presisi ... 38
5. Rentang ... 38
F. Uji Kestabilan Larutan Baku ... 38
BAB V KESIMPULAN DAN SARAN ... 40
A. Kesimpulan ... 40
B. Saran ... 40
DAFTAR PUSTAKA ... 41
xiii
DAFTAR TABEL
Tabel I. Penelitian Asam Askorbat Menggunakan Metode Kromatografi
Cair Kinerja Tinggi (KCKT) ... 4
Tabel II. Kategori metode pengujian validitas ... 14
Tabel III. Parameter validasi yang dipersyaratkan ... 14
Tabel IV. Kriteria persen recovery yang diperbolehkan ... 15
Tabel V. Kriteria persen relative standard deviation (% RSD) yang diperbolehkan pada beberapa level analit ... 16
Tabel VI. Hasil perhitungan % recovery dan % RSD baku asam askorbat... 37
xiv
DAFTAR GAMBAR
Gambar 1. Struktur Asam Askorbat (Moffat et al., 2011) ... 6
Gambar 2. Skema eksitasi elektron (Gandjar dan Rohman, 2007) ... 8
Gambar 3. Interaksi asam askorbat dengan fase diam oktadesilsilan ... 28
Gambar 4. Interaksi asam askorbat dengan fase gerak metanol : bufer fosfat .... 28
Gambar 5. Spektra penentuan panjang gelombang maksimum asam askorbat .. 30
Gambar 6. Gugus kromofor dan auksokrom asam askorbat ... 31
Gambar 7. Kromatogram baku asam askorbat ... 32
Gambar 8. Kromatogram sampel ... 32
Gambar 9. Kromatogram asam askorbat yang terpisah ... 34
Gambar 10. Asam askorbat dan produk degradasinya ... 34
Gambar 11. Metil paraben... 35
Gambar 12. Propil paraben ... 35
Gambar 13. Etiket sampel ... 46
Gambar 14. Kromatogram asam askorbat yang terpisah ... 47
Gambar 15. Kromatogram baku asam askorbat 50 µg/mL Replikasi I ... 49
Gambar 16. Kromatogram baku asam askorbat 75 µg/mL Replikasi I ... 50
Gambar 17. Kromatogram baku asam askorbat 100 µg/mL Replikasi I ... 50
Gambar 18. Kromatogram baku asam askorbat 125 µg/mL Replikasi I ... 51
Gambar 19. Kromatogram baku asam askorbat 150 µg/mL Replikasi I ... 51
Gambar 20. Kromatogram baku asam askorbat 50 µg/mL Replikasi II ... 52
Gambar 21. Kromatogram baku asam askorbat 75 µg/mL Replikasi II ... 52
xv
Gambar 23. Kromatogram baku asam askorbat 125 µg/mL Replikasi II ... 53
Gambar 24. Kromatogram baku asam askorbat 150 µg/mL Replikasi II ... 54
Gambar 25. Kromatogram baku asam askorbat 50 µg/mL Replikasi III ... 54
Gambar 26. Kromatogram baku asam askorbat 75 µg/mL Replikasi III ... 55
Gambar 27. Kromatogram baku asam askorbat 100 µg/mL Replikasi III ... 55
Gambar 28. Kromatogram baku asam askorbat 125 µg/mL Replikasi III ... 56
Gambar 29. Kromatogram baku asam askorbat 150 µg/mL Replikasi III ... 56
Gambar 30. Kurva baku asam askorbat replikasi I ... 57
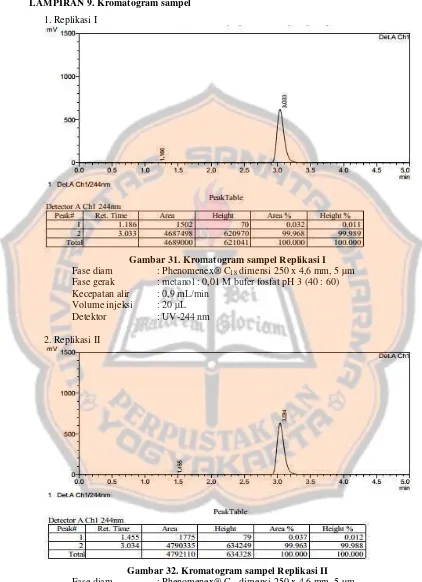
Gambar 31. Kromatogram sampel Replikasi I ... 58
Gambar 32. Kromatogram sampel Replikasi II ... 58
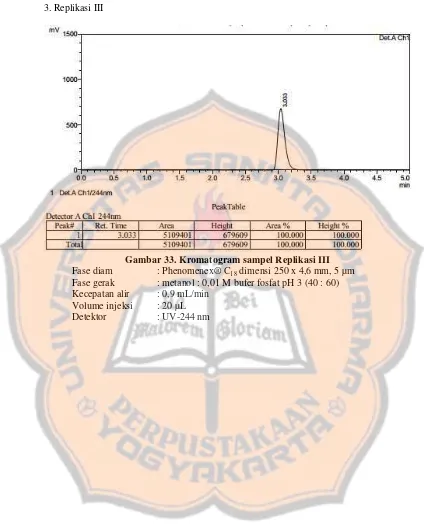
Gambar 33. Kromatogram sampel Replikasi III ... 59
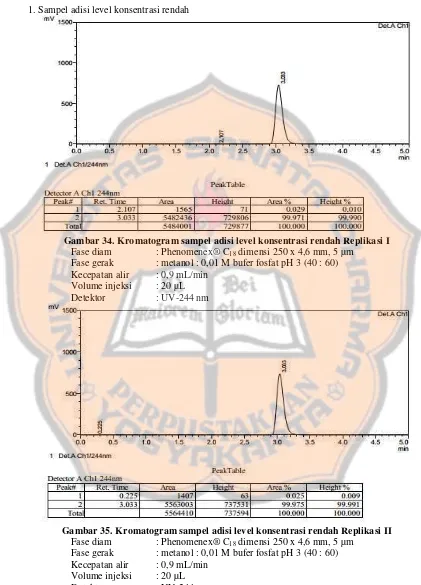
Gambar 34. Kromatogram sampel adisi level konsentrasi rendah Replikasi I ... 60
Gambar 35. Kromatogram sampel adisi level konsentrasi rendah Replikasi II .... 60
Gambar 36. Kromatogram sampel adisi level konsentrasi rendah Replikasi III ... 61
Gambar 37. Kromatogram sampel adisi level konsentrasi sedang Replikasi I ... 61
Gambar 38. Kromatogram sampel adisi level konsentrasi sedang Replikasi I ... 62
Gambar 39. Kromatogram sampel adisi level konsentrasi sedang Replikasi I ... 62
Gambar 40. Kromatogram sampel adisi level konsentrasi tinggi Replikasi I ... 63
Gambar 41. Kromatogram sampel adisi level konsentrasi tinggi Replikasi II ... 63
Gambar 42. Kromatogram sampel adisi level konsentrasi tinggi Replikasi III .... 64
Gambar 43. Kromatogram uji stabilitas larutan baku 50 µg/mL pada jam ke-0 .. 67
Gambar 44. Kromatogram uji stabilitas larutan baku 50 µg/mL pada jam ke-1 .. 67
xvi
Gambar 46. Kromatogram uji stabilitas larutan baku 50 µg/mL pada jam ke-3 .. 68
Gambar 47. Kromatogram uji stabilitas larutan baku 50 µg/mL pada jam ke-4 .. 69
Gambar 48. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-0 69
Gambar 49. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-1 70
Gambar 50. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-2 70
Gambar 51. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-3 71
Gambar 52. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-4 71
Gambar 53. Kromatogram uji stabilitas larutan baku 150 µg/mL pada jam ke-0 72
Gambar 54. Kromatogram uji stabilitas larutan baku 150 µg/mL pada jam ke-1 72
Gambar 55. Kromatogram uji stabilitas larutan baku 150 µg/mL pada jam ke-2 73
Gambar 56. Kromatogram uji stabilitas larutan baku 150 µg/mL pada jam ke-3 73
Gambar 57. Kromatogram uji stabilitas larutan baku 150 µg/mL pada jam ke-4 74
Gambar 58. Kromatogram uji stabilitas larutan baku 50 µg/mL pada jam ke-0 . 74
Gambar 59. Kromatogram uji stabilitas larutan baku 50 µg/mL pada jam ke-1 .. 75
Gambar 60. Kromatogram uji stabilitas larutan baku 50 µg/mL pada jam ke-2 .. 75
Gambar 61. Kromatogram uji stabilitas larutan baku 50 µg/mL pada jam ke-3 .. 76
Gambar 62. Kromatogram uji stabilitas larutan baku 50 µg/mL pada jam ke-4 .. 76
Gambar 63. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-0 77
Gambar 64. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-1 77
Gambar 65. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-2 78
Gambar 66. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-3 78
Gambar 67. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-4 79
xvii
Gambar 69. Kromatogram uji stabilitas larutan baku 150 µg/mL pada jam ke-1 80
Gambar 70. Kromatogram uji stabilitas larutan baku 150 µg/mL pada jam ke-2 80
Gambar 71. Kromatogram uji stabilitas larutan baku 150 µg/mL pada jam ke-3 81
Gambar 72. Kromatogram uji stabilitas larutan baku 150 µg/mL pada jam ke-4 81
Gambar 73. Kromatogram uji stabilitas larutan baku 50 µg/mL pada jam ke-0 .. 82
Gambar 74. Kromatogram uji stabilitas larutan baku 50 µg/mL pada jam ke-1 .. 82
Gambar 75. Kromatogram uji stabilitas larutan baku 50 µg/mL pada jam ke-2 .. 83
Gambar 76. Kromatogram uji stabilitas larutan baku 50 µg/mL pada jam ke-3 .. 83
Gambar 77. Kromatogram uji stabilitas larutan baku 50 µg/mL pada jam ke-4 .. 84
Gambar 78. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-0 84
Gambar 79. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-1 85
Gambar 80. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-2 85
Gambar 81. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-3 86
Gambar 82. Kromatogram uji stabilitas larutan baku 100 µg/mL pada jam ke-4 86
Gambar 83. Kromatogram uji stabilitas larutan baku 150 µg/mL pada jam ke-0 87
Gambar 84. Kromatogram uji stabilitas larutan baku 150 µg/mL pada jam ke-1 87
Gambar 85. Kromatogram uji stabilitas larutan baku 150 µg/mL pada jam ke-2 88
Gambar 86. Kromatogram uji stabilitas larutan baku 150 µg/mL pada jam ke-3 88
xviii
DAFTAR LAMPIRAN
LAMPIRAN 1. Certificate of Analysis Baku Pembanding Asam Askorbat ... 45
LAMPIRAN 2. Etiket sampel “X” ... 46
LAMPIRAN 3. Kromatogram resolusi pemisahan asam askorbat dan puncak di sebelahnya pada sampel 47 LAMPIRAN 4. Data penimbangan kalium dihidrogen fosfat ... 48
LAMPIRAN 5. Data penimbangan baku asam askorbat ... 48
LAMPIRAN 6. Skema pembuatan larutan baku asam askorbat dan perhitungan kadar larutan baku... 48
LAMPIRAN 7. Kromatogram kurva baku asam askorbat ... 49
LAMPIRAN 8. Data Kurva baku asam askorbat ... 57
LAMPIRAN 9. Kromatogram sampel ... 58
LAMPIRAN 10. Kromatogram sampel adisi ... 60
LAMPIRAN 11. Data AUC sampel dan AUC sampel adisi, perhitungan % recovery, perhitungan konsentrasi baku yang terukur, perhitungan RSD baku asam askorbat yang terukur ... 65
LAMPIRAN 12. Kromatogram baku asam askorbat untuk pengujian stabilitas larutan baku ... 67
xix
VALIDASI METODE KROMATOGRAFI CAIR KINERJA TINGGI FASE TERBALIK UNTUK PENETAPAN KADAR ASAM ASKORBAT DALAM
SEDIAAN LARUTAN INJEKSI OBAT PEMUTIH KULIT MEREK “X”
INTISARI
Asam askorbat dapat digunakan sebagai agen pemutih kulit. Kadar asam askorbat dalam larutan injeksi pemutih kulit merek “X” harus memberikan efek yang diinginkan. Untuk menjamin efikasinya, maka perlu dilakukan penetapan kadar asam askorbat dalam sediaan obat dengan metode yang telah divalidasi.
Penelitian bersifat deskriptif non eksperimental, asam askorbat dianalisis menggunakan sistem Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik dengan fase diam Phenomenex® C18 (250 x 4,6 mm, 5 µm) dan fase gerak
campuran metanol : 0,01 M bufer fosfat dengan penambahan larutan 0,1 M asam fosfat hingga pH 3 (40 : 60) dengan kecepatan alir 0,9 mL/menit dan menggunakan detektor UV-244 nm. Parameter validasi yang digunakan adalah selektivitas, linieritas, akurasi, presisi, dan rentang.
Hasil penelitian menunjukkan parameter selektivitas terpenuhi, akurasi dan presisi yang baik pada konsentrasi tinggi (konsentrasi asam askorbat = 120 µg/mL) dengan % recovery = 100,50–101,01% dan RSD = 0,28%. Linieritas yang dihasilkan pada metode ini telah memenuhi syarat dengan nilai r = 0,9989 pada konsentrasi asam askorbat 50–150 µg/mL.
xx
VALIDATION METHOD OF REVERSE PHASE HIGH PERFORMANCE LIQUID CHROMATOGRAPHY FOR THE ASSAY OF ASCORBIC ACID
IN THE WHITENING SKIN INJECTION BRAND “X”
ABSTRACT
Ascorbic acid can be used as agent for skin whitening. Ascorbic acid level inside skin whitening “X” injection should give the desired effect. To ensures the efficacy, it’s necessary to determine the ascorbic acid level in the dosage form with a method that has already been validated.
This research is descriptive non exprimental. Ascorbic acid is using Reversed High Performance Liquid Chromatography (HPLC) with stationary phase Phenomenex® C18 (250 x 4.6 mm, 5 µm) and mobile phase methanol : 0.01
M phosphoric buffer adjusting to pH 3 with 0.1 M phosphoric acid (40 : 60), flowrate 0.9 mL/min and detection with UV at 244 nm. Validation parameter used in this research are selectivity, linierity, acuration, precision, and range.
This results of the study showed that selectivity reversed-phase HPLC method is reach, accuracy and precision are at high concentration (120 µg/mL) with % recovery = 100.50–101.01% and RSD = 0.28%. The good linierity for ascorbic acid with values (r) of 0.9989 at 50–150 µg/mL.
1
BAB I PENGANTAR
A. Latar Belakang
Asam askorbat telah dikembangkan menjadi berbagai macam produk
obat, salah satunya sebagai sediaan injeksi pemutih kulit. Produk pemutih kulit
dapat menunjang kecantikan kulit, sehingga produk ini diminati oleh banyak
konsumen. Produk tersebut digunakan untuk mencerahkan kulit, baik dengan
meratakan warna kulit maupun merawat kulit sehingga terhindar dari masalah
pigmentasi seperti bintik-bintik hitam, melasma, tanda bekas hamil dan keriput.
Beberapa agen pemutih kulit yang saat ini sering digunakan adalah arbutin,
vitamin C (asam askorbat), kojic acid, licorice extract, burner root extract,
Scutellaria extract dan mulberry (Thongchai et al., 2007). Asam askorbat
digunakan dalam produk pemutih kulit karena kemampuannya sebagai
antioksidan yang dapat mengikat radikal bebas sehingga mencegah terbentuknya
melanin pada kulit, dan asam askorbat memiliki kemampuan untuk melindungi
kulit dari bahaya radiasi UV (Arbab dan Eltahir, 2010).
Peningkatan konsumsi produk pemutih kulit saat ini membuat banyak
produsen yang memproduksi produk-produk pemutih kulit dengan harga produk
yang relatif murah dan mengandung asam askorbat yang relatif tinggi, contohnya
sediaan larutan injeksi obat pemutih kulit merek “X” mengandung asam askorbat
1000 mg per ampul. Jika jumlah asam askorbat tidak sesuai dengan yang tertera
pada label, maka konsumen akan dirugikan dari sudut efikasi. Menurut
askorbat tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari yang tertera
pada label. Oleh karena itu, perlu dilakukan penetapan kadar asam askorbat dalam
produk pemutih kulit yang mengandung asam askorbat relatif tinggi untuk
menjamin efikasi produk. Produk sediaan injeksi intravena memiliki
bioavailabilitas yang tinggi dibandingkan dengan sediaan peroral (Lullmann, et
al., 2000), sehingga asam askorbat dalam sediaan intravena bekerja lebih efisien
dan sediaan ini lebih diminati oleh konsumen daripada sediaan peroral.
Analisis asam askorbat pernah diteliti sebelumnya yaitu pada
pengembangan dan validasi metode kuantifikasi asam askorbat dengan
menggunakan metode KCKT fase terbalik oleh Ullah, Shafqat, Arshad Hussain,
Javid Ali, Khaliqurrehman dan Asad Ullah (2012) dengan judul “A Simple and
Rapid HPLC Method for Analysis of Vitamin-C in Local Packed Juices of
Pakistan”, penelitian lain mengenai asam askorbat dilakukan oleh Wang,
A-Ching, Shu-Hui Cheng, Ceshing Sheu dan Chang-Chin Kwan (2011) dengan judul “Simultaneous Determination of Five Whitening Agents by Ion-Pair
Reversed-Phase High Perfomance Liquid Chromatogrpahy”.
Pengembangan metode dilakukan melalui tiga tahapan, yaitu: optimasi
metode, validasi metode dan aplikasi metode untuk penetapan kadar asam
askorbat dalam sampel injeksi pemutih kulit (Supriyanto, 2014). Optimasi metode
analisis untuk penetapan kadar asam askorbat dalam sediaan larutan injeksi obat
pemutih kulit merek “X” telah dilakukan oleh Jeversoon (2016) dengan kondisi
KCKT yang optimal menggunakan fase gerak campuran metanol : 0,01 M bufer
C18 (250 x 4,6 mm, 5 µm), dan deteksi UV-244 nm. Validasi metode merupakan
langkah yang penting untuk dilakukan dalam tahap penetapan kadar supaya dapat
memberikan hasil yang terpercaya dan dapat dipertanggungjawabkan.
1. Perumusan masalah
Apakah metode penetapan kadar asam askorbat dalam sediaan larutan
injeksi obat pemutih kulit merek “X” dengan kromatografi cair kinerja tinggi
(KCKT) fase terbalik menggunakan fase gerak campuran metanol : 0,01 M bufer
fosfat pH 3 (40 : 60) dengan kecepatan alir 0,9 mL/menit, fase diam
Phenomenex® C18 (250 x 4,6 mm, 5 µm), dan deteksi UV-244 nm memenuhi
persyaratan validitas yang meliputi selektivitas, linearitas, akurasi, presisi, dan
rentang?
2. Keaslian penelitian
Pengembangan dan validasi metode kuantifikasi asam askorbat dengan
menggunakan metode KCKT fase terbalik pernah dilakukan oleh Ullah et al.
(2012), dan Wang et al. (2011) yang terangkum dalam Tabel I. Terdapat beberapa
perbedaan penelitian yang peneliti lakukan dengan penelitian sebelumnya, yaitu
pada fase gerak, jenis kolom, panjang gelombang, dan sampel yang digunakan.
Kelebihan penelitian ini adalah sampel yang digunakan merupakan sediaan injeksi
pemutih kulit yang belum pernah diteliti oleh penelitian terdahulu. Pada penelitian
ini peneliti menggunakan metode KCKT fase terbalik dengan menggunakan fase
gerak campuran metanol : 0,01 M bufer fosfat pH 3 (40 : 60) dengan kecepatan
UV-244 nm, dan sampel asam askorbat dalam sediaan larutan injeksi obat
pemutih kulit merek “X”.
Tabel I. Penelitian Asam Askorbat Menggunakan Metode Kromatografi Cair Kinerja Tinggi (KCKT)
Peneliti (tahun) Judul Penelitian Parameter yang digunakan
Shafqat Ullah, Hussain Arshad, Javid Ali, Khaliqurrehman, and Asad Ullah (2012)
A Simple and Rapid HPLC Method for Analysis of Vitamin-C in Local Packed Juices of Pakistan
Kolom Inertsil ODS-3 C18 (250 mm x 4,6 mm), fase gerak metanol : bufer fosfat (20 : 80, v/v) pH 3±0,1 dengan kecepatan alir 1,0 mL/menit, dan panjang gelombang 240 nm
A-Ching Wang, Shu-Hui Cheng, Ceshing Sheu, and Chang-Chin Kwan (2011)
Simultaneous
Determination of Five Whitening Agents by Ion-Pair Reversed-Phase High Perfomance Liquid Chromatogrpahy
Kolom Inertsil ODS-3V (250 mm x 4,6 mm, 5 µm), fase gerak asetonitril : larutan bufer campuran (50 mM natrium fosfat monobasic dihidrat dan 2 mM n-heksadesiltrimetil amonium bromida) dengan elusi gradien komposisi asetonitril : larutan bufer campuran (99 : 1, v/v) dari menit 0 hingga menit ke-20, (70 : 30 v/v) dari menit ke-21 hingga menit 40, (1 : 99 v/v) dari menit ke-41, dengan pH 4,5 dan panjang gelombang 270 nm
Sejauh yang telah peneliti ketahui, penelitian dengan judul Validasi Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik Untuk Penetapan Kadar Asam Askorbat Dalam Sediaan Larutan Injeksi Obat Pemutih Kulit Merek “X” belum pernah dilakukan sebelumnya. Dengan demikian, jika dilihat dari permasalahan yang ada dalam penelitian ini, maka dapat dikatakan bahwa
3. Manfaat Penelitian
a. Manfaat metodologis. Penelitian ini diharapkan dapat memberikan
sumbangan ilmiah tentang penggunaan metode KCKT fase terbalik yang telah
divalidasi dalam penetapan kadar asam askorbat dalam sediaan larutan injeksi
obat pemutih kulit merek “X”.
b. Manfaat praktis. Hasil penelitian ini diharapkan metode KCKT fase
terbalik yang telah dioptimasi dan divalidasi ini dapat dipergunakan/diaplikasikan
pada penetapan kadar asam askorbat dalam sediaan larutan injeksi obat pemutih
kulit merek “X”.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui validitas metode KCKT fase
terbalik dengan sistem yang telah dioptimasi sebelumnya memenuhi persyaratan
validasi yang meliputi selektivitas, linearitas, akurasi, presisi, dan rentang,
sehingga dapat digunakan pada penetapan kadar asam askorbat dalam sediaan
6
BAB II
PENELAAHAN PUSTAKA
A. Asam Askorbat
Asam askorbat (Gambar 1) yang secara kimia dikenal sebagai
(2R)-2-[(1S)-1,2-Dihydroxyethyl]-4,5-dihydroxyfuran-3-one merupakan senyawa
berbentuk kristal tidak berwarna atau berbentuk serbuk kristal berwarna putih
atau kuning pudar. Asam askorbat dengan rumus kimia C6H8O6 memiliki berat
molekul 176,1 gram/mol, pKa = 4,2; 11,6 (pada suhu 25oC), dan
log P (oktanol/air) = 1,8. Kelarutan dalam air 1 : 3, dalam etanol 1 : 30, dalam
metanol 1 : 10, dan dalam propilen glikol 1 : 20. Dapat larut dalam aseton, tidak
larut dalam benzena, kloroform, eter, petroleum eter, minyak, lemak, dan pelarut
lemak (Moffat et al., 2011). Asam askorbat sensitif terhadap cahaya dan mudah
teroksidasi (Ahuja dan Dong, 2005).
Gambar 1. Struktur Asam Askorbat (Moffat et al., 2011)
Asam askorbat dapat digunakan sebagai agen pemutih kulit (Thongchai
et al., 2007). Dosis asam askorbat adalah 0,2-3 g per hari (Moffat et al., 2011).
Asam askorbat digunakan dalam produk pemutih kulit karena kemampuannya
sebagai antioksidan yang dapat mengikat radikal bebas sehingga mencegah
untuk melindungi kulit dari bahaya radiasi UV. Keuntungan inilah yang
mendasari pemakaian asam askorbat dalam produk pemutih kulit (Arbab dan
Eltahir, 2010).
Sediaan injeksi pemutih kulit merek “X” memiliki kandungan yang
terdiri dari asam askorbat, metil paraben, propil paraben, natrium hidroksida, dan
aqua for injection. Metil paraben merupakan pengawet berbentuk serbuk tak
berwarna yang memiliki nilai log P 2,0 dan kelarutan 1 : 400 dalam air. Propil
paraben merupakan pengawet serbuk tak berwarna yang memiliki nilai log P 3,0
dan kelarutan 1 : 2500 dalam air (Moffat et al., 2011). Natrium hidroksida sebagai
agen untuk penyesuaian pH hingga mencapai 5,5-7,0 untuk menjamin stabilitas
sediaan injeksi asam askorbat dan pH larutan mendekati pH darah yaitu 7,4
supaya bila sediaan diinjeksikan ke tubuh tidak terasa sakit (Sulistiyaningsih,
2007).
Penelitian mengenai agen pemutih kulit juga dilakukan oleh Ullah et al.
(2012) dan Wang et al. (2011) yang terangkum dalam Tabel I. Perbedaan
penelitian yang peneliti lakukan dengan penelitian sebelumnya terletak pada fase
gerak, jenis kolom, panjang gelombang, dan sampel yang digunakan. Pada
penelitian ini, peneliti menggunakan metode KCKT fase terbalik dengan fase
gerak campuran metanol : 0,01 M bufer fosfat pH 3 (40 : 60) dengan kecepatan
alir 0,9 mL/menit, fase diam Phenomenex® C18 (250 x 4,6 mm, 5 µm), deteksi
UV-244 nm, dan sampel asam askorbat dalam sediaan larutan injeksi obat
B. Spektrofotometri Ultraviolet
Prinsip spektrofotometri ultraviolet (UV) adalah pengukuran suatu
interaksi antara radiasi elektromagnetik dan molekul atau atom dari suatu zat kimia pada panjang gelombang (λ) 190-380 nm (Direktorat Jenderal Pengawasan
Obat dan Makanan Republik Indonesia, 1995). Serapan atom menyebabkan
paralihan atau transisi elektronik, yaitu peningkatan energi elektron dari keadaan
dasar (ground state) ke satu atau lebih tingkat energi yang lebih tinggi (Gambar 2)
atau tereksitasi (excited state). Transisi terjadi jika energi yang dihasilkan oleh
radiasi sama dengan energi yang diperlukan untuk melakukan transisi (Watson,
2000). Radiasi elektromagnetik pada sinar ultraviolet dan sinar tampak memiliki
suatu energi yang merambat dalam bentuk gelombang. Jarak linier antara titik
pada satu gelombang dengan titik yang berada pada gelombang terdekatnya
[image:30.595.85.515.219.625.2]disebut sebagai panjang gelombang (Watson, 2000).
Gambar 2. Skema eksitasi elektron (Gandjar dan Rohman, 2007)
Molekul-molekul yang memerlukan energi yang lebih sedikit untuk
mengeksitasi elektron maka akan menyerap energi pada panjang gelombang yang
lebih banyak untuk mengeksitasi elektron maka akan menyerap energi pada
panjang gelombang yang lebih pendek (Fessenden and Fessenden, 1997). Jumlah
energi yang diserap oleh molekul-molekul disebut sebagai absorban. Hukum
Lambert-Beer menunjukkan bahwa absorbansi suatu senyawa dipengaruhi oleh
absorptivitas molar, tebal kuvet dan konsentrasi molekul senyawa analit (Gandjar
dan Rohman, 2007). Hukum Lambert-Beer dinyatakan dalam persamaan:
A = b c (1)
Keterangan: A = absorbansi
= absorptivitas molar (M-1. cm-1)
b = tebal kuvet (cm)
c = konsentrasi molekul dalam senyawa analit (Gandjar dan Rohman, 2007)
Nilai absorptivitas molar tergantung pada suhu, pelarut, struktur molekul,
dan panjang gelombang radiasi. Dikatakan sebagai absorptivitas molar ( ) apabila
konsentrasi molekul zat analit dalam satuan Molar (M), namun jika konsentrasi
molekul zat analit dalam satuan persen berat/volume (g/100 mL), maka
absorptivitas ditulis dengan . Nilai absorptivitas menunjukkan sensitivitas
senyawa untuk diukur menggunakan spektrofotometer UV-Vis. Semakin besar
nilai suatu senyawa, maka semakin sensitif senyawa tersebut untuk
dideteksi dan diukur menggunakan spektrofotometer UV-Vis (Gandjar dan
Rohman, 2007). Hubungan antara dengan dapat dilihat dalam persamaan:
= x
(2)
Keterangan: = absorptivitas molar (M-1. cm-1)
= absorptivitas molekul dalam satuan konsentrasi (g/100 mL)
Asam askorbat (antioksidan) dapat menyerap radiasi pada daerah
ultraviolet karena senyawa ini memiliki gugus kromofor dan auksokrom yang
ditunjukkan pada Gambar 6 (Ahuja dan Dong, 2005). Kromofor adalah gugus
fungsional tak jenuh yang dapat menyerap radiasi pada daerah ultraviolet dan
sinar tampak (Gandjar dan Rohman, 2007), sedangkan auksokrom adalah gugus
jenuh yang bila terikat pada kromofor dapat mengubah panjang gelombang dan
intensitas serapan maksimum (Sastrohamidjojo, 2001). Asam askorbat dalam
larutan asam pada panjang gelombang 243 nm memiliki nilai absorptivitas:
=556a. Nilai tersebut dapat menunjukkan bahwa senyawa asam askorbat
dapat dideteksi dengan spektrofotometer UV-Vis. Nilai absorptivitas molar
asam askorbat adalah 9791,15 M-1.cm-1. Nilai tersebut menunjukkan bahwa
asam askorbat akan mengalami transisi dan dapat diaplikasikan pada
daerah ultraviolet (Rohman dan Gandjar, 2007).
C. Larutan Penyangga (Bufer)
Bufer dapat mencegah perubahan pH yang disebabkan oleh penambahan
baik sedikit asam ataupun sedikit basa. Larutan bufer dapat dibuat dengan
mencampurkan asam lemah atau basa lemah dengan garamnya masing-masing.
Ketahanan bufer dipengaruhi oleh pH larutan yang dibuat karena jika pH larutan
bufer sama dengan pKa asam atau basa yang membentuknya maka bufer dapat
bekerja dengan baik (Snyder Kirkland, and Dolan, 2010).
Menurut Snyder et al. (2010) terdapat beberapa faktor yang perlu
kapasitas bufer, kelarutan komponen bufer, stabilitas bufer, dan serapan bufer
pada daerah UV pada sistem KCKT. Kemampuan suatu bufer untuk
mempertahankan pH disebut sebagai kapasitas bufer. Hal ini dipengaruhi oleh
nilai pKa asam atau basa lemah penyusun bufer, dan kapasitas bufer berada dalam
rentang pH±1,0 unit dari nilai pKa asam atau basa lemah penyusun bufer tersebut.
Nilai pKa buffer fosfat adalah 2,1 dan kapasitas buffer fosfat dalam rentang
pH 1,1–3,1 (Kazakevich and Lobrutto, 2007). Menurut Kromidas (2005) nilai UV
cut-off bufer fosfat 50 mM dengan nilai pH = 2,0-3,0 adalah pada panjang
gelombang 210 nm.
D. Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi Cair Kinerja Tinggi (KCKT) merupakan salah satu metode
analisis untuk pemisahan suatu campuran senyawa kimia. Pemisahan pada sistem
KCKT terjadi akibat adanya interaksi antara zat analit dengan fase diam dan fase
gerak yang kemudian akan menghasilkan perbedaan waktu migrasi dari zat analit
(Kazakevich and Lobrutto, 2007). Ada dua jenis KCKT dalam analisis, yaitu
KCKT fase normal dan KCKT fase terbalik. KCKT fase normal menggunakan
fase diam bersifat lebih polar daripada fase geraknya, sedangkan KCKT fase
terbalik menggunakan fase diam bersifat lebih non-polar daripada fase geraknya
(Snyder et al., 2010).
Salah satu keunggulan KCKT dibandingkan dengan kromatografi gas
yaitu dapat digunakan untuk menganalisis senyawa yang tidak menguap atau tidak
tahan panas tanpa peruraian (Direktorat Jenderal Pengawasan Obat dan Makanan
spektrofotometri yaitu pada sensitifitas dan selektivitas dalam kemampuan
pemisahannya (Ahuja dan Dong, 2005).
Instrumen KCKT terdiri atas kolom, detektor, wadah fase gerak, pompa,
injector, dan komputer atau perekam data (Ahuja dan Dong, 2005). Salah satu
jenis kolom KCKT fase terbalik yang sering digunakan adalah tipe C18 yang
tersusun oleh suatu penyangga silika gel (SiO2). Pada bagian permukaan silika
terdapat gugus-gugus hidroksil (-OH), sehingga silika gel relatif bersifat polar.
Silica gel dapat dimodifikasi dengan menutup gugus silanol dengan hidrokarbon
rantai panjang untuk menghilangkan gugus hidroksil. Kebanyakan fase diam
dengan penyusun silica memiliki rentang pH yang dapat ditoleransi pada pH 2-7
(Kazakevich and Lobrutto, 2007).
Detektor KCKT digolongkan menjadi dua golongan, yaitu golongan
detektor universal dan golongan detektor spesifik. Beberapa karakteristik detektor
adalah memiliki respon yang cepat dan reprodusibel terhadap analit, memiliki
sensitifitas tinggi, stabil dalam pengoperasiannya, dan sinyal yang dihasilkan
berbanding lurus dengan konsentrasi analit dalam sampel (Gandjar dan Rohman,
2007). Detektor UV merupakan salah satu jenis detektor spesifik yang mendeteksi
analit secara spesifik sesuai panjang gelombang yang digunakan. Detektor UV
dapat digunakan dalam sistem KCKT untuk senyawa-senyawa yang memiliki
serapan pada panjang gelombang 200-400 nm (Snyder, Kirkland, and Glajch,
1997).
Fase gerak yang digunakan harus bersih, tidak berinteraksi dengan analit,
bercampur dan berpengaruh pada daya elusi dan resolusi. Pada KCKT, daya elusi
dan resolusi ditentukan oleh polaritas seluruh pelarut, polaritas fase diam, dan
sifat komponen sampel. Komposisi fase gerak akan mempengaruhi pemisahan dan
waktu retensi analit. Sebelum digunakan, fase gerak harus disaring terlebih dahulu
untuk menghilangkan partikel-partikel kecil. Adanya gas dalam fase gerak juga
harus dihilangkan, karena gas akan mengganggu analisis, terutama mengacaukan
bagian pompa dan detektor (Rohman, 2009). Perlu diperhatikan agar nilai UV
cut-off fase gerak tidak mengganggu pembacaan hasil analit pada detektor UV. Nilai
UV cut-off metanol adalah 205 nm (Kazakevich and Lobrutto, 2007).
E. Validasi Metode Analisis
Validasi metode analisis merupakan suatu prosedur untuk membuktikan
apakah suatu metode analisis telah memenuhi persyaratan yang ditentukan,
sehingga hasil analisis dapat dipertanggungjawabkan (Unites States
Pharmacopeial Convention, 2007). Suatu metode perlu divalidasi jika metode
tersebut baru dikembangkan untuk analisis senyawa tertentu, revisi dari metode
yang sudah baku untuk menyesuaikan dengan perkembangan, metode baku
dilakukan di laboratorium yang berbeda oleh analis berbeda atau dikerjakan
dengan alat yang berbeda, untuk membandingkan kesetaraan antara dua metode
(Rohman, 2009).
United States Pharmacopeia (USP, 2007) dan International Conference
on Harmonization (ICH, 2005) menyatakan bahwa tidak selalu semua parameter
untuk mengevaluasi validasi metode harus diuji. Menurut The United States
dapat dikelompokkan menjadi empat kategori (Tabel II). Pengelompokkan
kategori tergantung pada sifat uji yang dilakukan untuk tujuan validasi metode
[image:36.595.83.516.204.684.2]analisis.
Tabel II. Kategori metode pengujian validitas (United States pharmacopeial Convention, 2007)
Kategori Keterangan
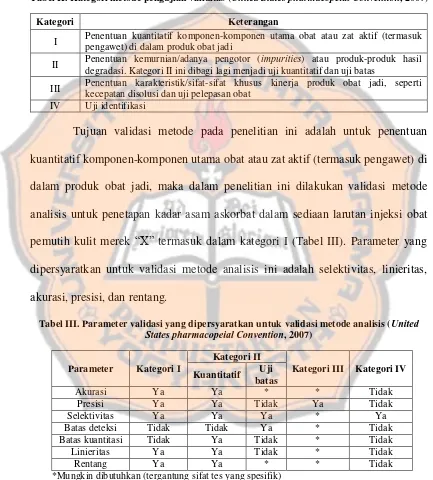
I Penentuan kuantitatif komponen-komponen utama obat atau zat aktif (termasuk pengawet) di dalam produk obat jadi
II Penentuan kemurnian/adanya pengotor (impurities) atau produk-produk hasil degradasi. Kategori II ini dibagi lagi menjadi uji kuantitatif dan uji batas
III Penentuan karakteristik/sifat-sifat khusus kinerja produk obat jadi, seperti kecepatan disolusi dan uji pelepasan obat
IV Uji identifikasi
Tujuan validasi metode pada penelitian ini adalah untuk penentuan
kuantitatif komponen-komponen utama obat atau zat aktif (termasuk pengawet) di
dalam produk obat jadi, maka dalam penelitian ini dilakukan validasi metode
analisis untuk penetapan kadar asam askorbat dalam sediaan larutan injeksi obat
pemutih kulit merek “X” termasuk dalam kategori I (Tabel III). Parameter yang
dipersyaratkan untuk validasi metode analisis ini adalah selektivitas, linieritas,
akurasi, presisi, dan rentang.
Tabel III. Parameter validasi yang dipersyaratkan untuk validasi metode analisis (United States pharmacopeial Convention, 2007)
Parameter Kategori I
Kategori II
Kategori III Kategori IV Kuantitatif Uji
batas
Akurasi Ya Ya * * Tidak
Presisi Ya Ya Tidak Ya Tidak
Selektivitas Ya Ya Ya * Ya
Batas deteksi Tidak Tidak Ya * Tidak
Batas kuantitasi Tidak Ya Tidak * Tidak
Linieritas Ya Ya Tidak * Tidak
Rentang Ya Ya * * Tidak
*Mungkin dibutuhkan (tergantung sifat tes yang spesifik)
Selektivitas adalah kemampuan suatu metode untuk mengukur dengan
Selektivitas dapat dibuktikan melalui pemisahan puncak-puncak berdekatan
dengan perhitungan nilai resolusi (Rs). Bila hasil perhitungan nilai Rs
menunjukkan angka 1,0 berarti puncak kromatogram analit tidak terpisah sampai
ke baseline, nilai Rs = 1,5 menunjukkan puncak analit telah terpisah sampai
baseline, dan nilai Rs > 1,5 menunjukkan puncak analit telah terpisah sempurna
satu sama lain (Gandjar dan Rohman, 2007).
Akurasi adalah kedekatan antara nilai kadar terukur (nilai rata-rata hasil
analisis) dengan nilai kadar sebenarnya yang diterima. Akurasi dapat dijadikan
sebagai penunjuk kesalahan sistematik (Rohman, 2009). Akurasi dikatakan baik
bila memiliki nilai % recovery antara 98,0-102,0% (Tabel IV) untuk kadar analit
[image:37.595.86.511.203.613.2]10-100% (Gonzalez dan Herrador, 2007).
Tabel IV. Kriteria persen recovery yang diperbolehkan pada beberapa level analit (Gonzalez dan Herrador, 2007)
Analit (%) Fraksi analit Unit Rentang recovery (%)
100 1 100% 98-102
10 10-1 10% 98-102
1 10-2 1% 97-103
0,1 10-3 0,1% 95-105
0,01 10-4 100 ppm 90-107
0,001 10-5 10 ppm 80-110
0,0001 10-6 1 ppm 80-110
0,00001 10-7 100 ppb 80-110
0,000001 10-8 10 ppb 60-115
0,0000001 10-9 1 ppb 40-120
Presisi adalah ukuran kedekatan antara serangkaian hasil analisis yang
diperoleh dari beberapa kali pengukuran sampel. Konsep presisi diukur dengan
koefisien variasi (KV) atau standar deviasi relatif (RSD) (Rohman, 2009). Suatu
metode dikatakan memiliki keterulangan/presisi yang baik jika memiliki nilai
Tabel V. Kriteria persen RSD yang diperbolehkan pada beberapa level analit (Gonzalez dan Herrador, 2007)
Analit (%) Fraksi analit Unit % RSD Horwitz % RSD AOAC
100 1 100% 2 1,3
10 10-1 10% 2,8 1,8
1 10-2 1% 4 2,7
0,1 10-3 0,1% 5,7 3,7
0,01 10-4 100 ppm 8 5,3
0,001 10-5 10 ppm 11,3 7,3
0,0001 10-6 1 ppm 16 11
0,00001 10-7 100 ppb 22,6 15
0,000001 10-8 10 ppb 32 21
0,0000001 10-9 1 ppb 45,3 30
Linieritas adalah kemampuan metode analisis memberikan respon secara
langsung dan proporsional terhadap konsentrasi analit dalam sampel. Data respon
dan konsentrasi analit yang diperoleh, dimasukkan ke dalam persamaan
matematika untuk mendapatkan linieritas antara konsentrasi dan respon analit
(USP, 2007). Persyaratan linieritas yang dapat diterima adalah jika memenuhi
nilai koefisien korelasi (r) ≥ 0,998 (Kazakevich dan Lobrutto, 2007).
Rentang merupakan interval antara kadar terendah hingga kadar tertinggi
yang dapat diukur secara kuantitatif dengan menggunakan metode analisis
tertentu dan menghasilkan linieritas, akurasi dan presisi yang baik (Rohman,
2009).
F. Landasan Teori
Asam askorbat merupakan salah satu agen pemutih kulit yang dapat
diformulasikan sebagai larutan injeksi. Asam askorbat mudah terdegradasi oleh
oksigen, paparan cahaya, peningkatan suhu, dan katalis logam. Jumlah asam
askorbat dalam produk injeksi pemutih kulit perlu untuk dipastikan kesesuaiannya
untuk memvalidasi metode KCKT fase terbalik yang dapat dipergunakan dalam
penetapan kadar asam askorbat dalam sediaan larutan injeksi obat pemutih kulit
merek “X”.
Asam askorbat dapat dipisahkan dari matriks sampel larutan injeksi obat
pemutih kulit berdasarkan perbedaan kepolarannya dan interaksi antara analit,
fase gerak, dan fase diam dalam sistem KCKT. Asam askorbat memiliki gugus
kromofor dan auksokrom pada strukturnya, dalam larutan asam pada panjang
gelombang 243 nm dengan detektor UV memiliki nilai =556a dan nilai
=9791,15 M-1.cm-1, sehingga sistem KCKT fase terbalik dengan detektor UV dapat diaplikasikan untuk analisis kadar asam askorbat dalam larutan injeksi obat
pemutih kulit merek “X”.
Validasi metode perlu dilakukan untuk menjamin bahwa hasil aplikasi
menggunakan metode yang telah dioptimasi, dapat dipercaya dan
dipertanggungjawabkan. Validasi metode analisis yang peneliti lakukan termasuk
dalam kategori 1, sehingga parameter validasi yang diuji meliputi akurasi, presisi,
selektivitas, linieritas dan rentang.
G. Hipotesis
Validasi metode KCKT fase terbalik dengan fase diam Phenomenex®
C18 (250 x 4,6 mm, 5 µm) dan fase gerak metanol : 0,01 M bufer fosfat dengan
penambahan larutan 0,1 M asam fosfat hingga pH 3 (40 : 60), pada penetapan
kadar asam askorbat dalam larutan injeksi obat pemutih kulit merek “X” dapat
memenuhi persyaratan parameter-parameter validasi yaitu selektivitas, linieritas,
18
BAB III
METODELOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Jenis dan rancangan penelitian ini adalah deskriptif non eksperimental,
karena pada penelitian ini tidak dilakukan manipulasi pada subjek uji dan hanya
menggambarkan keadaan yang ada.
B. Variabel Penelitian 1. Variabel bebas
Variabel bebas pada penelitian ini adalah sistem KCKT yang telah
dioptimasi yang meliputi komposisi fase gerak dan kecepatan alir fase gerak yang
telah dioptimasi.
2. Variabel tergantung
Variabel tergantung pada penelitian ini adalah parameter validasi metode
analisis yang meliputi selektivitas, linieritas, akurasi, presisi, dan rentang.
3. Variabel pengacau terkendali
Kemurnian pelarut yang digunakan, untuk mengatasinya digunakan
pelarut dengan kemurnian tinggi, yaitu pelarut pro analysis. Kemurnian baku
asam askorbat yang digunakan, untuk mengatasinya digunakan baku yang telah
C. Definisi Operasional
1. Sistem KCKT yang digunakan terdiri dari fase diam berupa kolom
Phenomenex® (250 x 4,6 mm, ukuran partikel 5 µm) dan fase gerak campuran
metanol : 0,01 M bufer fosfat dengan penambahan larutan 0,1 M asam fosfat
hingga pH 3 (40 : 60).
2. Baku asam askorbat yang divalidasi adalah baku yang tercantum pada
Certificate of Analysis (CoA).
3. Penelitian yang dilakukan termasuk dalam validasi metode katergori I, yaitu
metode yang digunakan untuk analisis kualitatif dan kuantitatif komponen
utama dalam suatu matriks. Validasi yang dilakukan meliputi pengukuran
terhadap parameter validasi yaitu selektivitas, linieritas, akurasi, presisi, dan
rentang.
D. Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah reference standard
asam askorbat (Supelco) dengan kemurnian 98,7% yang tertera pada CoA di
Lampiran 1, metanol grade HPLC (E.Merck), asam fosfat 85% (E.Merck),
kalium dihidrogen fosfat p.a (E.Merck), akua demineralisata (PT. Brataco),
penyaring Whatman 0,45µm, dan produk pemutih kulit merek “X” yang
E. Alat Penelitian
Alat yang digunakan dalam penelitian ini adalah seperangkat alat KCKT
dengan detektor ultraviolet, Shimadzu LC-2010C, kolom C18 merek
Phenomenex® (250 x 4,6 mm, 5 µm), seperangkat komputer (merek Dell
B6RDZ1S Connexant system RD01-D850 A03-0382 JP France S.A.S, printer HP
Deskjet D2566 HP-024-000 625730), UV-Vis Spechtrophotometer SP-3000plus
merek OPTIMA dengan detektor silicon photo diode, milipore, ultrasonikator
Refsch, Tipe : T460 (Schwing 1 PXE, FTZ-Nr. C-066/83, HF-Frequ:35 kHz),
timbangan analitik SCALTEC (max 60/210 g, min 0,001 g), alat vakum GAST,
dan seperangkat alat gelas yang lazim digunakan di laboratorium analisis.
F. Tatacara Penelitian 1. Pembuatan asam fosfat 0,1 M
Larutan H3PO4 85% diambil sebanyak 0,3 mL, kemudian diencerkan
dengan akua demineralisata 25,0 mL sehingga konsentrasi H3PO4 menjadi 0,1 M.
2. Pembuatan bufer fosfat 0,01 M
Dilarutkan 0,68 g KH2PO4 dalam 500 mL akua demineralisata, kemudian
pH diatur dengan penambahan asam fosfat 0,1 M hingga mencapai pH 3.
3. Pembuatan fase gerak
Fase gerak dibuat dengan mencampur antara metanol dan 0,1 M bufer
fosfat pH 3,0 (40 : 60). Campuran fase gerak tersebut disaring dengan penyaring
Whatman 0,45 µm yang dibantu dengan pompa vakum kemudian didegassing
4. Pembuatan larutan stok dan intermediate asam askorbat
a. Pembuatan larutan stok asam askorbat. Ditimbang saksama 20,0 mg asam
askorbat, dilarutkan dalam metanol : bufer fosfat pH 3 (40 : 60) hingga 10,0
mL sehingga kadar lebih kurang 2000 µg/mL.
b. Pembuatan larutan baku intermediate asam askorbat. Sebanyak 1,25 mL
larutan stok diambil dan diencerkan dengan metanol : bufer fosfat pH 3
(40 : 60) hingga 25,0 mL sehingga diperoleh konsentrasi larutan
intermediate 100 µg/mL.
5. Pembuatan larutan baku asam askorbat yang digunakan untuk penentuan panjang gelombang maksimum
Dibuat larutan seri dengan 3 konsentrasi berbeda yaitu 40; 50; dan 60
µg/mL dengan mengencerkan 4,0; 5,0; dan 6,0 mL larutan intermediate
menggunakan metanol : bufer fosfat pH 3 (40 : 60) hingga 10,0 mL.
6. Penentuan panjang gelombang maksimum asam askorbat dengan spektrofotometer UV-Vis
Masing-masing konsentrasi larutan seri baku asam askorbat 40; 50; dan
60 µg/mL dengan pelarut campuran metanol : bufer fosfat pH 3 (40 : 60), discan
antara panjang gelombang 200-400 nm dengan spektrofotometer UV-Vis.
Spektrum yang dihasilkan akan menunjukkan panjang gelombang maksimum
7. Pembuatan seri larutan baku asam askorbat
Diambil sejumlah 250; 375; 500; 625 dan 750 µL larutan stok asam
askorbat (2000 µg/mL), kemudian dimasukkan ke dalam labu takar 10,0 mL dan
ditambahkan metanol : bufer fosfat pH 3 (40 : 60) hingga tanda batas, sehingga
didapatkan konsentrasi sebesar 50; 75; 100; 125 dan 150 µg/mL. Larutan disaring
dengan millipore dan didegassing dengan ultrasonicator selama 15 menit,
kemudian diinjek ke sistem KCKT fase terbalik hasil optimasi Jeversoon (2016).
8. Preparasi larutan sampel
Sediaan larutan injeksi obat pemutih kulit merek “X” yang mengandung
200 mg/mL asam askorbat, diambil sebanyak 50 µL dan dimasukkan ke dalam
labu takar 10 mL, diencerkan dengan metanol : bufer fosfat pH 3 (40 : 60) sampai
tanda batas sehingga diperoleh konsentrasi asam askorbat 1000 µg/mL sebagai
larutan stok sampel, kemudian diambil sebanyak 1,4 mL dan dimasukkan ke
dalam labu takar 10 mL, diencerkan dengan metanol : bufer fosfat pH 3 (40 : 60)
sampai tanda batas sehingga diperoleh konsentrasi asam askorbat 140 µg/mL.
Larutan sampel disaring dengan menggunakan milipore dan didegassing dengan
ultrasonicator selama 15 menit.
9. Preparasi adisi baku dalam sampel untuk penentuan akurasi dan presisi
Diambil sejumlah 1,0; 3,0 dan 5,0 mL larutan intermediate asam askorbat
100 µg/mL, kemudian dimasukkan ke dalam labu takar 10,0 mL dan ditambahkan
1,4 mL stok sampel asam askorbat 200 µg/mL ke dalam masing-masing labu takar
dan diencerkan dengan metanol : bufer fosfat pH 3 (40 : 60) hingga batas tanda.
15 menit, kemudian diinjek ke sistem KCKT fase terbalik hasil optimasi
Jeversoon (2016).
10. Validasi metode analisis
a. Penentuan selektivitas. Sejumlah 20,0 µL larutan sampel yang telah
disaring dengan millipore dan didegassing dengan ultrasonicator selama
15 menit, diinjek ke sistem KCKT fase terbalik hasil optimasi Jeversoon
(2016). Dihitung nilai Rs dari puncak yang diperoleh.
b. Penentuan linieritas. Sejumlah 20 µL larutan baku asam askorbat dengan
konsentrasi 50; 75; 100; 125 dan 150 µg/mL yang telah disaring dengan
millipore dan didegassing dengan ultrasonicator selama 15 menit,
diinjek ke sistem KCKT fase terbalik hasil optimasi Jeversoon (2016).
Replikasi dilakukan sebanyak tiga kali dan dihitung nilai r (koefisien
korelasi).
c. Penentuan akurasi dan presisi adisi baku dalam sampel. Sejumlah 20 µL
larutan sampel dan larutan sampel yang telah ditambahkan larutan baku
asam askorbat (sampel adisi) dengan konsentrasi asam askorbat sebesar
80; 100; dan 120 µg/mL yang telah disaring dengan millipore dan
didegassing dengan ultrasonicator selama 15 menit, diinjek ke sistem
KCKT fase terbalik hasil optimasi Jeversoon (2016). Replikasi dilakukan
sebanyak tiga kali dan dihitung nilai % recovery dan koefisien variasi.
d. Penentuan rentang. Rentang konsentrasi sampel uji yang memenuhi
11. Uji kestabilan larutan baku
Larutan baku asam askorbat dengan konsentrasi 50; 100 dan 150 µg/mL
yang telah disaring dengan millipore dan didegassing dengan ultrasonicator
selama 15 menit, diinjek ke sistem KCKT fase terbalik hasil optimasi Jeversoon
(2016) dalam jam yang berbeda untuk dilihat seberapa besar perubahan
konsentrasi yang dihasilkan dari masing-masing larutan baku. Konsentrasi diukur
dalam pengukuran selama 4 jam. Dihitung nilai persen perubahan yang diperoleh.
G. Analisis Hasil 1. Selektivitas
Selektivitas ditentukan dari kemampuan metode KCKT fase terbalik
yang telah dioptimasi untuk memisahkan asam askorbat dalam larutan injeksi
pemutih kulit. Selektivitas ditentukan dengan parameter resolusi (Rs) dengan
rumus:
(2)
Keterangan: Rs = resolusi
tR1 = waktu retensi puncak analit pertama
tR2 = waktu retensi puncak analit kedua
W1 = lebar dasar puncak pertama
W2 = lebar dasar puncak kedua
Nilai Rs > 1,5 menunjukkan puncak analit telah tepisah sempurna satu
sama lain (Gandjar dan Rohman, 2007).
2. Linieritas
Linieritas dinyatakan dengan koefisien korelasi (r). Konsentrasi larutan
kromatogram sehingga diperoleh nilai r dari persamaan y = bx + a. Persyaratan
linieritas yang dapat diterima adalah jika memenuhi nilai r ≥ 0,998 (Kazakevich
and Lobrutto, 2007).
3. Akurasi
Akurasi metode dinyatakan dengan nilai % recovery adisi baku yang
dihitung dengan rumus:
(3)
Keterangan: Xn = Konsentrasi larutan n setelah adisi
Xo = Konsentrasi tanpa adisi (blanko) X’ = Konsentrasi adisi (perhitungan manual)
Akurasi dikatakan baik bila memiliki nilai % recovery antara
98,0-102,0% untuk kadar analit 10-100% (Gonzalez dan Herrador, 2007).
4. Presisi
Presisi dihitung sebagai standar deviasi relatif (RSD) atau koefisien
variasi (RSD), dengan rumus perhitungan:
(4)
Keterangan: RSD = standar deviasi relatif
SD = standar deviasi
Suatu metode dikatakan memiliki keterulangan/presisi yang baik jika
memiliki nilai RSD ≤ 2,0% untuk kadar analit 100% (Gonzalez dan Herrador,
2007).
5. Rentang
Rentang konsentrasi sampel uji yang memenuhi persyaratan linieritas,
6. Uji Kestabilan Larutan Baku
Uji kestabilan larutan baku asam askorbat dihitung dari nilai persen
perubahan, dengan rumus perhitungan:
% perubahan = |
| x 100% (5)
Keterangan: Xn = konsentrasi akhir
Xo = konsentrasi awal
Suatu larutan baku dikatakan stabil apabila persen perubahan yang
27
BAB IV
HASIL DAN PEMBAHASAN
A. Pembuatan Fase Gerak
Fase gerak yang digunakan dalam sistem KCKT fase terbalik adalah
campuran metanol dan 0,01 M bufer fosfat pH 3 dengan perbandingan 40 : 60 dan
kecepatan alir 0,9 mL/menit. Campuran metanol dan bufer fosfat bersifat polar
sedangkan kolom Phenomenex® C18 yang digunakan sebagai fase diam bersifat
lebih nonpolar, sehingga metode KCKT ini merupakan metode KCKT fase
terbalik. Sistem elusi fase gerak yang digunakan dalam penelitian adalah isokratik
karena pada sistem ini tidak dilakukan perubahan perbandingan selama proses
elusi. Prinsip kerja KCKT adalah memisahkan solut karena adanya perbedaan
kecepatan elusi saat melewati kolom KCKT. Pemisahan ini terjadi karena adanya
interaksi antara analit, fase diam, dan fase gerak (Rohman, 2009). Interaksi yang
terjadi diantara fase diam dan asam askorbat adalah interaksi gaya London, yang
ditunjukkan pada Gambar 3. Interaksi gaya London ini merupakan gaya tarikan
lemah yang disebabkan oleh dipol induksi sesaat pada suatu atom yang terjadi
karena pergerakan elektron dalam suatu orbital (Levita dan Mustarichie, 2012).
Interaksi asam askorbat dan fase gerak (metanol dan bufer fosfat) merupakan
interaksi hidrogen yang ditunjukkan pada Gambar 4. Interaksi hidrogen
merupakan interaksi dipol-dipol yang terbentuk antara suatu hidrogen yang terikat
pada gugus yang memiliki atom elektronegatif dengan suatu atom elektronegatif
Interaksi gaya London
Gambar 3. Interaksi asam askorbat dengan fase diam oktadesilsilan
Gambar 4. Interaksi asam askorbat dengan fase gerak metanol : bufer fosfat
Larutan bufer fosfat terdiri dari KH2PO4, aqua demineralisata, dan asam
fosfat. Aqua demineralisata digunakan sebagai pelarut karena air ini bebas ion
atau mineral karena ion seperti ion tembaga dan besi, ion hidroksida dan kuinon
dapat menyebabkan kecepatan degradasi asam askorbat menjadi asam
dehidroaskorbat meningkat (Wechtersbach and Cigic, 2007). Metanol dan bufer
fosfat digunakan sebagai fase gerak karena dapat melarutkan asam askorbat
dengan baik, tidak berinteraksi dengan analit, tidak toksik, dan memiliki nilai UV
cut-off jauh dari panjang gelombang asam askorbat, metanol memiliki nilai UV
cut-off 205 nm (Rohman dan Gandjar), sedangkan nilai UV cut-off bufer fosfat di
pH dalam kolom dapat relatif stabil sehingga waktu retensi yang dihasilkan oleh
senyawa asam askorbat menjadi reprodusibel selama tiga menit.
Fase gerak disaring terlebih dahulu menggunakan kertas saring Whatman
dengan bantuan pompa vakum untuk menghilangkan partikel-partikel kecil yang
dapat menyumbat kolom, kemudian fase gerak didegassing dengan ultrasonicator
untuk menghilangkan gelembung-gelembung udara yang dapat menggangu
pengukuran. Larutan metanol dan bufer fosfat masing-masing ditempatkan di
dalam chamber fase gerak dengan kapasitas 500 mL.
B.Pembuatan Larutan Baku Asam Askorbat
Baku asam askorbat yang digunakan merupakan reference standard
Supelco dengan kemurnian 98,7%. Larutan baku asam askorbat dibuat dengan
cara melarutkan baku asam askorbat dalam metanol : 0,01 M bufer fosfat pH 3
(40 : 60) yang berperan pula sebagai fase gerak dalam metode KCKT fase terbalik
ini. Fase gerak yang digunakan bersifat polar karena sebagian besar terdiri dari
metanol dan air, sehingga dapat melarutkan asam askorbat yang bersifat polar
pula, selain itu metanol dan 0,01 M bufer fosfat memenuhi syarat sebagai pelarut,
yaitu murni, dapat melarutkan asam askorbat dengan baik, tidak berinteraksi
dengan analit, dan tidak toksik. Komposisi pelarut dan fase gerak yang digunakan
sama, sehingga dapat bercampur dan tidak membutuhkan waktu yang lama untuk
membentuk puncak yang stabil.
Larutan baku asam askorbat dibuat dalam volume 10 mL untuk
menghemat pelarut yang digunakan. Konsentrasi larutan stok asam askorbat yang
baku 50; 75; 100; 125 dan 150 µg/mL. Larutan seri baku digunakan dalam
pembuatan kurva baku asam askorbat. Sebelum larutan seri baku dimasukkan ke
dalam vial dan diinjek ke sistem KCKT, larutan tersebut disaring terlebih dahulu
menggunakan millipore untuk menghilangkan partikel-partikel kecil yang dapat
menyumbat kolom, dan didegassing untuk menghilangkan gelembung-gelembung
udara yang dapat menggangu pengukuran.
C. Penentuan Panjang Gelombang Pengamatan Asam Askorbat
Pengukuran panjang gelombang maksimum dilakukan pada tiga
konsentrasi yang berbeda, yaitu 40; 50 dan 60 µg/mL menggunakan pelarut
campuran metanol : 0,01 M bufer fosfat pH 3 (40 : 60). Penggunaan tiga level
konsentrasi bertujuan untuk membuktikan bahwa perubahan konsentrasi sampai
batas tertentu tidak menyebabkan perubahan panjang gelombang maksimum dan
dapat menunjukkan semakin besar konsentrasi yang diukur maka puncak spektra
yang dihasilkan semakin tinggi (berbanding lurus). Spektra asam askorbat dapat
[image:52.595.86.513.227.706.2]dilihat pada Gambar 5.
Gambar 6. Gugus kromofor dan auksokrom asam askorbat
Pada Gambar 5 terjadi kenaikkan tinggi spektra seiring dengan kenaikkan
konsentrasi. Panjang gelombang maksimum asam askorbat menurut Moffat et al.
(2011) adalah 243 nm, sedangkan pada pengukuran didapatkan panjang
gelombang maksimum adalah 244 nm. Asam askorbat dapat memberikan serapan
di daerah UV karena senyawa ini memiliki gugus kromofor dan auksokrom
seperti pada Gambar 6. Menurut Farmakope Indonesia edisi V (2014), pergeseran
panjang gelombang yang digunakan dalam rentang 1 nm dari panjang gelombang
teoritis yaitu di daerah 242-244 nm, sehingga panjang gelombang 244 nm dapat
digunakan dalam pengukuran menggunakan KCKT fase terbalik.
D. Analisis Kualitatif Berdasarkan Waktu Retensi (tR) Asam Askorbat
Sampel injeksi obat pemutih kulit merek “X” memiliki beberapa
kandungan senyawa yang tertera pada label produk, yaitu: asam askorbat, natrium
hidroksida, metil paraben, propil paraben, dan aqua pro injection. Tes identifikasi
dalam sistem KCKT ini menggunakan nilai waktu retensi dari senyawa asam
askorbat yang terdapat dalam baku asam askorbat. Tes ini bertujuan untuk
membuktikan adanya asam askorbat dalam sampel injeksi obat pemutih kulit merek “X”. Di dalam sampel, asam askorbat dapat diketahui dari nilai waktu
retensi asam askorbat yang diperoleh merupakan waktu analit untuk melewati fase
diam dengan bantuan fase gerak.
Gambar 7. Kromatogram baku asam askorbat Fase diam : Phenomenex® C18 dimensi 250 x 4,6 mm, 5 µm Fase gerak : metanol : 0,01 M bufer fosfat pH 3 (40 : 60) Kecepatan alir : 0,9 mL/min
Volume injeksi : 20 µL Detektor : UV-244 nm
Gambar 8. Kromatogram sampel Parameter KCKT= Gambar 7
Sistem KCKT pada penelitian ini menggunakan sistem KCKT terbalik
sehingga asam askorbat yang bersifat polar memiliki waktu retensi yang singkat
karena sistem KCKT yang digunakan merupakan sistem KCKT fase terbalik.
3,033 menit, dan pada Gambar 8 (kromatogram sampel) terdapat puncak pada
3,033 menit pula. Hal ini menunjukkan bahwa di dalam sampel injeksi pemutih kulit merek “X” terdapat asam askorbat, sesuai yang tertera pada label produk
tersebut.
E. Validasi Metode Analisis
Validasi metode analisis perlu dilakukan untuk menjamin bahwa hasil
aplikasi metode yang telah dioptimasi dapat dipercaya dan
dipertanggungjawabkan. Validasi metode analisis yang peneliti lakukan termasuk
dalam kategori 1, sehingga parameter validasi yang diuji meliputi selektivitas,
linieritas, akurasi, presisi, dan rentang.
1. Selektivitas
Selektivitas adalah kemampuan suatu metode untuk mengukur dengan
akurat respon analit di antara seluruh komponen sampel (Harmita, 2004). Menurut
Gandjar dan Rohman (2007), puncak analit telah terpisah sempurna satu sama lain
jika nilai Rs > 1,5.
Hasil penelitian dengan menggunakan metode KCKT fase terbalik
dengan fase diam Phenomenex® C18 dan fase gerak metanol : 0,01 M bufer fosfat
dengan penambahan larutan 0,1 M asam fosfat hingga pH 3 (40 : 60) pada
panjang gelombang 244 nm didapatkan nilai Rs hasil pemisahan asam askorbat
terhadap puncak di sebelahnya dalam sampel pada waktu retensi 3,095 menit
sebesar 11,443 (Gambar 9) yang menunjukkan bahwa analit terpisah sempurna
Gambar 9. Kromatogram asam askorbat yang terpisah dengan puncak di sebelahnya Parameter KCKT = Gambar 7
Kelemahan pada penelitian ini yaitu tidak dilakukan penginjekan larutan
plasebo dan pembanding asam dehidroaskorbat (degradan utama dari asam
askorbat). Menurut Deutsch dalam Nováková, Solichová, and Solich (2008),
larutan asam dehidroaskorbat memberikan nilai absorbansi kecil pada panjang
gelombang di atas 220 nm, senyawa asam dehidroaskorbat (Gambar 10) memiliki
kepolaran yang mirip dengan asam askorbat. Asam dehidroaskorbat memiliki
gugus kromofor yang lebih pendek daripada asam askorbat, sehingga senyawa ini
memiliki nilai panjang gelombang yang lebih pendek pula daripada nilai panjang
gelombang asam askorbat. Panjang gelombang yang digunakan pada penelitian ini
pada 244 nm dengan konsentrasi asam askorbat yang tinggi, sehingga berdasarkan
teori dapat disimpulkan bahwa asam dehidroaskorbat tidak memberikan gangguan
yang bermakna pada puncak asam askorbat.
Di dalam sampel terdapat metil paraben, propil paraben, dan NaOH. Jika
plasebo diinjekkan dalam sistem KCKT fase terbalik pada panjang gelombang
244 nm ini, maka NaOH tidak terdeteksi, puncak metil paraben dan propil
paraben memiliki waktu retensi yang lebih