i
OL SULFAT DALAM SEDIAAN SIRUP ME
AKAN KROMATOGRAFI CAIR KINERJA
FASE TERBALIK
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
ii
OL SULFAT DALAM SEDIAAN SIRUP ME
AKAN KROMATOGRAFI CAIR KINERJA
FASE TERBALIK
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
v
PERSEMBAHAN
“
The sooner you step away from your comfort zone,
The sooner You’ll realize that it really wasn’t all that comfortable.”
Eddie Harris Jr.
Bagi Dialah, yang dapat melakukan jauh lebih banyak dari pada
yang kita doakan atau pikirkan, seperti yang ternyata dari kuasa
yang bekerja didalam kita
viii
PRAKATA
Puji syukur penulis hanturkan kepada Tuhan atas segala kasih karunia
yang telah diberikan sehingga skripsi berjudul “Penetapan Kadar Guaifenesin
yang Tercampur dengan Salbutamol Sulfat dalam Sediaan sirup Merek “X”
Menggunakan Kromatografi Cair Kinerja Tinggi Fase Terbalik” yang disusun
untuk kepentingan memenuhi persyaratan dalam memperoleh gelar Sarjana Strata
Satu Program Studi Farmasi (S. Farm.) dapat diselesaikan dengan baik.
Penulis menyadari bahwa dalam penulisan skripsi ini banyak berbagai
pihak-pihak yang telah memberikan kontribusi. Oleh karena itu, pada kesempatan ini
penulis mengucapkan terimakasih kepada:
1. Dekan Fakultas Farmasi Universitas Sanata Dharma yang telah
mengijinkan penulis menjalankan pembelajaran selama masa studi.
2. Prof. Dr. Sudibyo Martono, M.S., Apt. selaku Dosen Pembimbing Skripsi
yang telah membimbing, selalu mendampingi, dan memberikan saran
selama penyusunan skripsi.
3. Jeffry Julianus, M.Si. selaku Dosen Penguji yang telah memberikan kritik
dan saran selama penyusunan skripsi.
4. Florentinus Dika Octa Riswanto, M.Sc. selaku Dosen Penguji yang telah
memberikan kritik dan saran selama penyusunan skripsi.
5. Dr. Sri Yuliani, M.Si., Apt.selaku Kepala Penanggungjawab Laboratorium
Fakultas Farmasi yang telah memberikan ijin dalam penggunaan fasilitas
ix
6. Phebe Hendra M.Si., Apt., Ph.D. selaku dosen pendamping akademik yang
telah membimbing penulis selama studi di Fakultas Farmasi Universitas
Sanata Dharma.
7. Seluruh Dosen Fakultas Farmasi Universitas Sanata Dharma atas ilmu,
nasihat, dan bimbingan yang telah diberikan.
8. Laboran laboratorium Fakultas Farmasi yang telah membantu penulis
dalam proses pelaksanaan penelitian di laboratorium.
9. Mamaku tersayang yang selalu memberikan doa, perhatian dan motivasi
dalam studi dan penyusunan skripsi.
10. Teman-teman skripsi yang berjuang bersama penulis Agustinus Hendy
Larsen dan Aries Mulyawanatas doa, kerjasama, bantuan, kesabaran, dan
semangat dalam penyusunan skripsi.
11. Kenny Ricardo atas masukan ilmu, dan waktu yang telah diberikan saat
penelitian dalam penyusunan skripsi
12. Sahabat sekaligus keluarga Juliana, Olivia Christie, Daniel Pradipta,
Enggar Nugraheni P., Priscilla Diana Vivi Vionita, Angelia Rosari,
Christian Gunawan, Gabriela Indri, Brigitta Rosalia, dan Raisa Ruga atas
doa, kebersamaan dalam suka dan duka, motivasi, nasihat dan semangat
yang diberikan.
13. Teman-teman sekelas FST A 2010 dan seluruh angkatan Farmasi 2010 atas
x
14. Semua pihak yang tidak dapat penulis sebutkan satu persatu atas
kontribusinya sehingga penulis dapat menyelesaikan studi dan skripsi
xi
DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN... iv
HALAMAN PERSEMBAHAN ...v
HALAMAN PERNYATAAN KEASLIAN KARYA ... vi
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... vii
PRAKATA... viii
A. Latar Belakang...1
1. Perumusan Masalah...3
2. Keaslian Penelitian...3
3. Manfaat Penelitian ... ...4
xii
H. Kromatografi Cair Kinerja Tinggi (KCKT) ...14
1. Definisi dan Instrumentasi...14
a. Wadah Fase Gerak dan Fase Gerak...15
b. Pompa...16
c. Tempat Penyuntikan Sampel...16
d. Kolom...17
e. Fase Diam ...19
f. Detektor ...20
2. Analisis Kualitatif dan Kuantitatif...21
I. Larutan Bufer...22
J. Landasan Teori...22
K. Hipotesis...23
BAB III METODOLOGI PENELITIAN...24
A. Jenis dan Rancangan Penelitian ...24
B. Variabel Penelitian ...24
C. Definisi Operasional ...24
D. Bahan Penelitian...25
E. Alat Penelitian ...25
F. Tata Cara Penelitian ...26
1. Pembuatan Asam Fosfat 0,1 M...26
xiii
3. Pembuatan Fase Gerak ...26
4. Pembuatan Larutan Baku Salbutamol Sulfat dan Guaifenesin untuk Penentuan Panjang Gelombang...27
a. Pembuatan Larutan Baku Salbutamol Sulfat...27
b. Pembuatan Larutan BakuGuaifenesin...27
5. Penetapan λ MaksimumSalbutamol Sulfat dan Guaifenesin Menggunakan Spektrofotometer UV-Vis...27
6. Pembuatan Larutan Baku Salbutamol Sulfat ...28
a. Pembuatan Larutan Stok Salbutamol Sulfat...28
b. Pembuatan Larutan Intermediet Salbutamol Sulfat ...28
7. Pembuatan Larutan Baku Guaifenesin...28
8. Pembuatan Seri Larutan Baku Campuran Salbutamol Sulfat dan Guaifenesin ...28
9. Pengujian Stabilitas Baku Pembanding ...29
10. Pembuatan Kurva Baku Salbutamol Sulfat dan Guaifenesin...29
11. Pengambilan Sampel ...30
12. Keseragaman Volume ...30
13. Preparasi Sampel ...30
a. Pembuatan Larutan Stok Sampel ...30
b. Pembuatan Larutan Sampel...31
14. Penetapan Kadar Sampel...31
G. Analisis Hasil ...31
BAB IV HASIL DAN PEMBAHASAN... 33
A. Pembuatan Fase Gerak...33
B. Penentuan PanjangGelombang (λ) Maksimum Salbutamol Sulfat dan Guaifenesin... 34
C. Pengukuran Stabilitas Baku Pembanding...37
D. Pembuatan Kurva Baku Guaifenesin... 39
E. Pengambilan Sampel... 40
xiv
G. Analisis Kuantitatif ... 47
BAB V KESIMPULAN DAN SARAN... 49
A. Kesimpulan...48
B. Saran ... 48
DAFTAR PUSTAKA ...50
LAMPIRAN ...52
xv
DAFTAR TABEL
Tabel 1Hasil Pengukuran Stabilitas Baku Pembanding Guaifenesin... 38
Tabel 2. Hasil Pengukuran Stabilitas Baku PembandingSalbutamol Sulfat... 38
Tabel 3. Hasil Pengukuran Persamaan Kurva Baku Guaifenesin... 39
Tabel 4. Data Keseragaman Volum Sampel Sirup merek“X”... 41
Tabel 5. Data Waktu Retensi Baku Salbutamol Sulfat, Baku Guaifenesin danSampel... 44
xvi
DAFTAR GAMBAR
Gambar 1. Struktur Salbutamol Sulfat...7
Gambar 2. Struktur Guaifenesin...9
Gambar 3. Diagram Skematik Alat Spektrofotometer...10
Gambar 4 . Monokromator...11
Gambar 5 . Spektrum Elektromagnetik...13
Gambar 6. Diagram Skematik Alat KCKT...15
Gambar 7. Diagram Kolom KCKT...17
Gambar 8. Pemisahan Sampel...18
Gambar 9. Interaksi Silika dengan Fase Diam...19
Gambar 10. Gugus Kromofor dan Auksokrom Salbutamol Sulfat... 34
Gambar 11. Gugus Kromofor dan Auksokrom Guaifenesin... 35
Gambar 12. Spektra Salbutamol Sulfat pada 3 Seri Konsentrasi dalam Pelarut Metanol...35
Gambar 13. Spektra Guaifenesin pada 3 Seri Konsentrasi dalam Pelarut Metanol...36
Gambar 14. SpektraOverlappingSalbutamol Sulfat dan Guaifenesin dalam Pelarut Metanol ...36
Gambar 15. Kurva Baku Guaifenesin... 40
Gambar 16. Kromatogram Baku Salbutamol Sulfat Konsentrasi 1,2 µg/mL... 42
Gambar 17. Kromatogram Baku Guaifenesin Konsentrasi 54,0 µg/mL... 43
xvii
Gambar 19. Interaksi Salbutamol Sulfat dengan Fase Diam... 44
Gambar 20. Interaksi Guaifenesin dengan Fase Diam... 45
Gambar 21. Interaksi Salbutamol Sulfat dengan Fase Gerak... 45
xviii
DAFTAR LAMPIRAN
Lampiran 1.Certificate of Analysis(CoA) Baku Salbutamol Sulfat... 53
Lampiran 2.Certificate of Analysis(CoA) Guaifenesin... 55
Lampiran 3. Spektra Panjang Gelombang Pengamatan... 58
Lampiran 4. Kromatogram Stabilitas Baku Pembanding Salbutamol Sulfat 5 Maret 2014... 61
Lampiran 5. Kromatogram Stabilitas Baku Pembannding Salbutamol Sulfat 6 Maret 2014... 64
Lampiran 6. Kromatogram Stabilitas Baku Pembanding Salbutamol Sulfat 7 Maret 2014... 67
Lampiran 7. Kromatogram Stabilitas Baku Pembanding Guaifenesin 6 Maret 2014... 70
Lampiran 8. Kromatogram Stabilitas Baku Pembanding Guaifenesin 7 Maret 2014... 73
Lampiran 9. Kromatogram Stabilitas Baku Pembanding Guaifenesin 8 Maret 2014... 76
Lampiran 10. Data Penimbangan Baku Guaifenesin... 78
Lampiran 11. Kromatogram Seri Larutan Baku Guaifnesin Replikasi 1... 79
Lampiran 12. Kromatogram Seri Larutan Baku Guaifenesin Replikasi 2... 84
Lampiran 13. Kromatogram Seri Larutan Baku Guaifnesin Replikasi 3... 89
xix
Lampiran 15. Kurva Baku Guaifenesin... 96
Lampiran 16. Data Persamaan Kurva Baku Guaifenesin... 96
Lampiran 17. Data Pengukuran Berat Jenis Sampel... 98
Lampiran 18. Data Hasil Keseragaman Volume... 99
Lampiran 19. Data Perhitungan Keseragaman Volume... 99
Lampiran 20. Kromatogram Sampel Replikasi 1... 100
Lampiran 21. Kromatogram Sampel Replikasi 2... 101
Lampiran 22. Kromatogram Sampel Replikasi 3... 102
Lampiran 23. Kromatogram Sampel Replikasi 4... 103
Lampiran 24. Kromatogram Sampel Replikasi 5... 104
Lampiran 25. Kromatogram Sampel Replikasi 6... 105
Lampiran 26. Perhitungan Kadar Sampel dengan Persamaan Kurva Baku... 106
Lampiran 27. Data Perhitungan Penetapan Kadar... 106
Lampiran 28. Perhitungan RSD Guaifenesin dalam Sampel... 107
xx
INTISARI
Batuk kronik merupakan jenis batuk yang terjadi dengan disertai asma.
Angka kejadiantimbulnya asma pada batuk kronik sekitar 24–29%. Sediaan sirup
merek “X” adalah salah satu obat untuk terapi batukdisertai asma yang
mengandung kombinasi salbutamol sulfat dan guaifenesin. Tujuan penelitian ini
adalah untuk mengetahui kesesuaian kadar salbutaol sulfat dan guaifenesin yang
terukur dengan kadar yang tertera pada etiket dalam rangka penjaminan mutu
suatu produk obat.
Penelitian bersifat non eksperimental deskriptif karena tidak dilakukan
manipulasi dan perlakuan terhadap subjek uji. Penetapan kadar guaifenesin yang
tercampur dengan salbutamol sulfat dalam sediaan sirup merek “X”dilakukan
menggunakan metode Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik.
Fase diam yang digunakan adalah C18dimensi 250 x 4,6 mm, 5µm Shimadzu
columnShimpack dan fase gerak yang digunakan adalah campuran metanol : 0,01 M bufer kalium dihidrogen fosfat pH 3,0 (40:60) dengan kecepatan alir 1,0
mL/menit.
Hasil pengujian stabilitas baku pembanding salbutamol sulfat memiliki %
perbedaan ≥2% (tidak stabil) dan pengujian stabilitas baku pembanding
guaifenesin memiliki % perbedaan≤2% (stabil), sehingga penetapan kadar hanya
dilakukan untuk guaifenesin. Kadarguaifenesin yang tertera pada etiket adalah50
mg/5mL (1 %b/v) dengan rentang keberterimaan 90-110% (45-55mg/5mL) dan
kadar terukur yang diperoleh adalah 48,44 mg/5mL dengan RSD 0,70%. Kadar
Guaifenesin yang terukur sesuai dengan kadar guaifensin yang tertera pada label.
Kata Kunci : salbutamol sulfat, guaifenesin, sirup ekpektoran merek “X”,
xxi
ABSTRACT
Chronic cough is one kind of cough occuring accompanied with asthma.
The number of the occurance of asthma in chronic cough is about 24– 29%. The
preparation of syrup brand “X” is one kind of medicine for cough with asthma
therapy which contains a combination of salbutamol sulfate and guaiphenesin.
The objective of this research is to find out the suitability of the content of
salbutamol sulfate and guaifenesinmeasuredwiththe contentindicated onthe labelin
order toguaranteethe quality of adrugproduct.
The research is non-experimental descriptive because it does not do the
manipulation and treatment toward the test subjects. The assay of guaifenesin
mixed with salbutamol sulphate in the solution dosage form merk “X” is done
using a method of reversed phase High PerformanceLiquid Chromatography
(HPLC). Stationary phase used is C18dimension 250 x 4.6 mm, 5µm Shimadzu
column Shimpack and mobile phase used is a mixed methanol: 0.01 M
potassiumdihydrogenphosphatebufferpH3.0(40:60)with the flow speed 1.0
mL/minute.
The result of stability test for working standard of salbutamo sulfate have
% of difference ≥ 2 % (unstable) and stability test for working standard of
guaiphenesin have % of difference ≤ 2 % (stable), with the result that the assay
do for guaiphenesin only. The content of guaifenesin printed on the label is 50
mg/5mL (1 %b/v)with the range of acceptance is 90-110 % (45-55 mg/5mL) and
the content measuredis 48.44 mg/5mL with RSD 0.70%. The content of
guaifenesin measured is appropriate with the content of guaifenesin printed on the
label.
Keywords : salbutamolsulfate, guaifenesin, an expectorantsyrupbrand “X”,
1
BAB I
PENDAHULUAN
A. Latar Belakang
Batuk adalah salah satu respon tubuh yang terjadi apabila terdapat iritan
yang masuk dalam tenggorokan dan saluran pernafasan (Djunarko dan
Hendrawati, 2011). Pada batuk kronik sering disertai timbulnya asma, angka
kejadian timbulnya asma pada batuk kronik sekitar 24 –29% (Dicpinigaitis, Peter
V., 2014).Asma adalah gangguan inflamasi kronik pada saluran pernafasan. Asma
termasuk lima besar penyakit penyebab kematian di dunia yang bervariasi antara
5-30% (Oemiati dkk., 2010).Batuk yang disertai asma terjadi karena pengentalan
lendir pada lapisan epitel di saluran pernafasan, sehingga jalannya udara
terhambat (Dicpinigaitis, Peter V., 2014). Penggunaan ekspektoran dan antiasma
merupakan penanganan pilihan untuk terapi batuk disertai asma, karena
pemberian ekspektoran membantu mengencerkan dahak sehingga mudah
dikeluarkan dan penggunaan antiasma dapat meningkatkan bronkoselektivitas.
Sediaan sirup merek “X” adalah salah satu obat untuk terapi batukdisertai asma
yang mengandung kombinasi salbutamol sulfat dan guaifenesin. Salbutamol sulfat
adalah agonis β2 yang merupakan bronkodilator. Mekanisme kerja agonis β2
adalah menstimulasi reseptor β2-adregenik untuk mengaktifkan adenil siklase,
sehingga AMP (asam 3,5 adenilat) siklik intrasel meningkat dan menyebabkan
relaksasi otot polos pada saluran pernafasan (Jyothi dkk., 2012). Guaifenesin
dikeluarkan (Djunarko dan Hendrawati, 2011). Untuk menjamin keamanan dan
efektivitas sediaan sirup sebagai obat batuk ekspektoran yang frekuensi
penggunaannya dalam terapi cukup sering, perlu dilakukan penetapan kadar
salbutamol sulfat dan guaifenesin yang merupakan zat aktif dari sediaan sirup
tersebut dengan metode analisis yang valid.
Penelitian mengenai salbutamol sulfat dan guaifenesin sudah pernah
dilakukan oleh Walode dkk. (2013) dalam pengembangan dan validasi metode
kromatografi cair kinerja tinggi(KCKT) untuk salbutamol sulfat dan guaifenesin
dalam sediaan sirup. Metode yang digunakan adalah kromatografi cair kinerja
tinggi (KCKT) sistem fase terbalik dengan fase diam C18dan fase gerak asetonitril
: 0,05M bufer fosfat pH 3,0 dengan triethylamine0,1 % (36:64) pada kecepatan
alir 0,8 mL/menit dan panjang gelombang 225 nm dengan kondisi suhu konstan
18oC. Pada penelitian tersebut dihasilkan pemisahan yang baik antara salbutamol
sulfat dan guaifenesin.
Penelitian yang akan dilakukan adalah menetapkan kadar guaifenesin yang
tercanpur dengan salbutamol sulfat dalam sediaan sirup merek“X”menggunakan
metode kromatografi cair kinerja tinggi (KCKT) fase terbalik. Metode tersebut
dipilih untuk analisisguaifenesin dan salbutamol sulfat, karena metode ini
merupakan metode yang selektif dan memberikan hasil yang baik dalam
memisahkan senyawa-senyawa multikomponen. KCKT yang digunakan
merupakan sistem fase terbalik karena fase diam C18yang digunakan bersifat non
polar dan fase gerak campuran metanol : 0,01 M bufer kalium dihidrogen fosfat
hasil optimasi dan telah divalidasi. Analisis guaifenesin dan salbutamol sulfat
dilakukan untuk menjamin keamanan dan efektivitas dari sediaan sirup merek“X”
dengan melihat kesesuaian kadar yang terukur dengan kadar yang tertera pada
etiket.
1. Perumusan Masalah
Berdasarkan latar belakang di atas, maka dapat disusun permasalahan
sebagai berikut:
a. Berapakah kadarguaifenesin yang tercampur dengan salbutamol sulfat
dalam sediaan sirup merek“X”?
b. Apakah kadarguaifenesin yang terukur dengan metode kromatografi
cair kinerja tinggi fase terbalik sesuai dengan guaifenesin yang tertera
pada kemasan sediaan sirup merek“X”?
2. Keaslian Penelitian
Berdasarkan penelusuran literatur yang telah dilakukan, telah
diperoleh jurnal berjudul “Stability Indicating RP-HPLC Method For
Simultaneous Estimation Of Salbutamol Sulphate and Guaifenesin” oleh
Walode dkk. (2013). Metode kuantifikasi salbutamol sulfat dan guaifenesin
ini menggunakan metode KCKT. Pada penelitian tersebut digunakan fase
gerak campuran asetonitril : 0,05M bufer fosfat pH 3,0 dengan 0,1 %
triethylamine (36:64 v/v) dan laju alir fase gerak 0,8 mL/menit dengan
3. Manfaat Penelitian
a. Manfaat Metodologis
Hasil penelitian ini diharapkan dapat memberikan sumbangan
ilmiah berupa metode analisis guaifenesin dan salbutamol sulfatpada
sediaan sirup menggunakan kromatografi cair kinerja tinggi fase
terbalik.
b. Manfaat Praktis
Hasil penelitan diharapkan dapat menambah informasi mengenai
kadar guaifenesin yang tercampur dengan salbutamol sulfat dalam
sediaan sirup menggunakan metode kromatografi cair kinerja tinggi
fase terbalik.
B. Tujuan Penelitian
Tujuan penelitian ini adalah untuk:
a. Mengetahui kadar guaifenesin yang tercampur dengan salbutamol sulfat
dalam sediaan sirupmerek “X” menggunakan metode kromatografi cair
kinerja tinggi fase terbalik.
b. Mengetahui kesesuaian antara kadar terukur guaifenesin dengan kadar
5
BAB II
PENELAAH PUSTAKA
A. Batuk
Batuk adalah mekanisme tubuh dalam mengeluarkan benda asing yang ada
dalam saluran pernafasan bagian atas. Batuk yang biasanya disebabkan oleh
adanya alergi dan pengeluran lendir disebut batuk berdahak, sementara batuk yang
disebabkan oleh adanya benda asing yang mengiritasi tenggorokan disebut batuk
kering (Puspitasari, 2010).
Pengobatan untuk setiap jenis batuk berbeda. Obat untuk batuk berdahak
adalah ekspektoran yang merupakan pengencer dahak sehingga dahak dapat
dengan mudah dikeluarkan. Obat untuk batuk kering adalah antitusif yang
menekan rangsang batuk sehingga frekuensi batuk berkurang (Puspitasari, 2010).
B. Asma
Asma merupakan gangguan inflamasi pada saluran jalannya udara yang
melibatkan banyak sel dan komponennya. Serangan asma bersifat mendadak dan
disebabkan oleh faktor yang tidak diketahui atau yang diketahui seperti paparan
alergen, virus, atau polutan. Keparahan penyakit asma ditentukan oleh fungsi
paru. Pada individu yang rentan terhadap inflamasi dapat menyebabkan episode
berulang dari bengek, sesak nafas, sempit dada, dan batuk. Proses inflamasi yang
mengakibatkan pembebasan mediator inflamasi seperti histamin, faktor
kemotaksis eosinofil dan neutrofil, prostaglandin, dan faktor pengaktivasi
platelet (PAF). Mediator inflamasi akan menginduksi konstriksi otot polos dan
bronkospasme dan berperan dalam edema mukosa dengan meningkatkan
produksi mukus yang viskositasnya cenderung tinggi sehingga menghambat
jalannya udara yang tersusun oleh syaraf parasimpatik, simpatik, dan syaraf
inhibisi nonadergenik. Otot polos pada jalan udara dipelihara oleh aktivitas
eferen vagal dengan memperantarai brokokonstriksi. Otot polos pada jalan udara
mengandung reseptor β-adregernik yang menyebabkan bronkodilatasi (Sukandar
dkk., 2009).
C. Sirup
Menurut Farmakope Indonesia edisi III, sediaan sirup merupakan sediaan cair
yang berupa larutan yang mengandung sakarosa, kecuali dinyatakan lain, kadar
sakarosa, C12H22O11, tidak kurang dari 64,0% dan tidak lebih dari 66,0% (Dirjen
POM RI, 1979). Rasa manis dari sakarosa dalam sirup dapat menutupi rasa tidak
enak dari obat, sehingga sirup sangat efektif untuk sistem penghantaran obat bagi
anak-anak. Sakarosa merupakan gula yang banyak digunakan pada sirup, tetapi
pada beberapa kasus dapat digantikan dengan pemanis lainnya yang bukan gula
Gambar
Salbutamol su
xilena-α,α׳-diol sulfat
molekul576,70 g/mol
dan tidak lebih dari 101,
Pemerian salbutamol
kelarutannya mudah
dan dalam eter (Dirje
memiliki λ maksimum
memiliki λ maksimum
sulfat (oktanol/air) = 0,6
Salbutamol sul
kuat yang bekerja p
merupakan agonis β2
dkk., 2009).
Penelitian m
Kromatografi Cair K
D. Salbutamol Sulfat
ar 1. Struktur Salbutamol Sulfat (British Pharmacop
ol sulfat atau garam α׳-[(tert-butilamino)metil
fat memiliki rumus molekul (C13H21NO3)2.H2SO
ol. Salbutamol sulfat mengandung tidak kura
i 101,0% (C13H21NO3)2.H2SO4 dihitung terhada
ol sulfat merupakan serbuk putih atau
h larut dalam air, sukar larut dalam etanol, da
irjen POM RI, 1995).Salbutamol sulfat dalam
um 276nm dengan nilai = 71a dan dalam
um 245nm dengan nilai = 510a. Nilai log
= 0,6 serta nilai pKa 9,3 dan 10,3 (Moffat dkk., 2011
ol sulfat merupakan agonisβ2yang adalah bronkodi
pada reseptor β2-adregenik. Salbutamol sul
β2 aksi pendek yang digunakan jika terjadi g
n mengenai analisis salbutamol sulfat denga
Kinerja Tinggi (KCKT) dilakukan oleh be
di gejala (Sukandar
gan mengunakan
Martis dan Gangrade (2011) melakukan analisis salbutamol sulfat dan
beklometason dipropionat dalam formulasi sediaan Rotacapsdengan metode
Kromatografi Cair Kinerja Tinggi fase terbalik dengan deteksi pada panjang
gelombang 230nm menggunakan fase diam C18 dan fas gerak air : asetonitril
(40:60). Muraldhiran dan Kumar (2012) pengembangan metode dan validasi
untuk salbutamol dengan KCKT fase terbalik dengan deteksi pada panjang
gelombang 276nm menggunakan fase diam C18dan fase gerak asetonitril : 50mm
amonium asetat pH 7,0 (80:20) dengan kecepatan alir 1,0 mL/min. Jyothi,
VenuGopal, dan Rao (2012) pengembangan dan validasi metode KCKT untuk
analisis salbutamol sulfat dan ipratropium bromida dalam sediaan inhalasi yang
menggunakan fase diam C18dan fase gerak 0,05 M buffer fosfat pH 3,5 : metanol
(40:60) dengan deteksi pada panjang gelombang 226 nm dan kecepatan alir 0,6
mL/min. Walode, Deshpande dan Deshpande (2013) melakukan analisis
salbutamol sulfat dan guaifenesin dengan metode KCKT fase terbalik
menggunakan fase diam C18 dan fase gerak campuran asetonitril : 0,05M bufer
fosfat pH 3,0 dengan 0,1 %triethylamine (36:64 v/v) dan laju alir fase gerak 0,8
mL/menit dengan deteksi pada panjang gelombang 225 nm dalam kondisi suhu
E. Guaifenesin
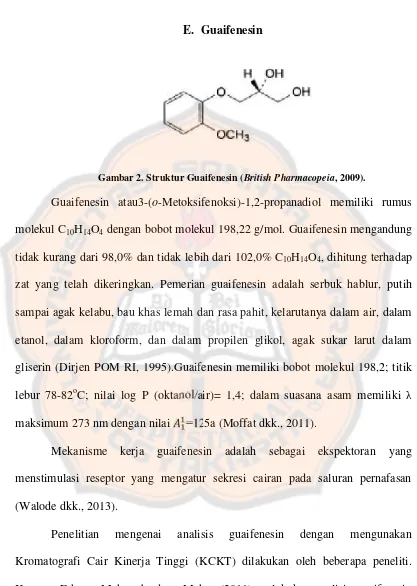
Gambar 2. Struktur Guaifenesin (British Pharmacopeia, 2009).
Guaifenesin atau3-(o-Metoksifenoksi)-1,2-propanadiol memiliki rumus
molekul C10H14O4dengan bobot molekul 198,22 g/mol. Guaifenesin mengandung
tidak kurang dari 98,0% dan tidak lebih dari 102,0% C10H14O4, dihitung terhadap
zat yang telah dikeringkan. Pemerian guaifenesin adalah serbuk hablur, putih
sampai agak kelabu, bau khas lemah dan rasa pahit, kelarutanya dalam air, dalam
etanol, dalam kloroform, dan dalam propilen glikol, agak sukar larut dalam
gliserin (Dirjen POM RI, 1995).Guaifenesin memiliki bobot molekul 198,2; titik
lebur 78-82oC; nilai log P (oktanol/air)= 1,4; dalam suasana asam memiliki λ
maksimum 273 nm dengan nilai =125a (Moffat dkk., 2011).
Mekanisme kerja guaifenesin adalah sebagai ekspektoran yang
menstimulasi reseptor yang mengatur sekresi cairan pada saluran pernafasan
(Walode dkk., 2013).
Penelitian mengenai analisis guaifenesin dengan mengunakan
Kromatografi Cair Kinerja Tinggi (KCKT) dilakukan oleh beberapa peneliti.
Korany, Fahmy, Mahgoub, dan Maher (2011) melakukan analisis guaifenesin
dalam kombinasi obat batuk dan demam dengan metode KCKT menggunakan
perbandingan pada pH 3,2, 6,2, dan 3,8. Walode, Deshpande dan Deshpande
(2013) melakukan analisis salbutamol sulfat dan guaifenesin dengan metode
KCKT fase terbalik menggunakan fase diam C18 dan fase gerak campuran
asetonitril : 0,05M bufer fosfat pH 3,0 dengan 0,1 % trietilamin (36:64 v/v) dan
laju alir fase gerak 0,8 mL/menit dengan deteksi pada panjang gelombang 225 nm
dalam kondisi suhu konstan 180C.
F. Spektrofotometri UV-Vis
Instumentasi yang digunakan untuk mempelajari serapan atau emisi
radiasi elektromagnetik sebagai fungsi panjang gelombang disebut
“spektrometer” atau spektrofotometer. Komponen-komponen pokok
spektrofotometer meliputi sumber tenaga radiasi yang stabil, sistem yang terdiri
atas lensa-lensa, cermin, dan celah-celah, monokromator untuk mengubah radiasi
menjadi komponen-komponen panjang gelombang tunggal; tempat cuplikan yang
transparan; dan detektor radiasi yang dihubungkan dengan pencatat
(Sastrohamidjojo, 2001).
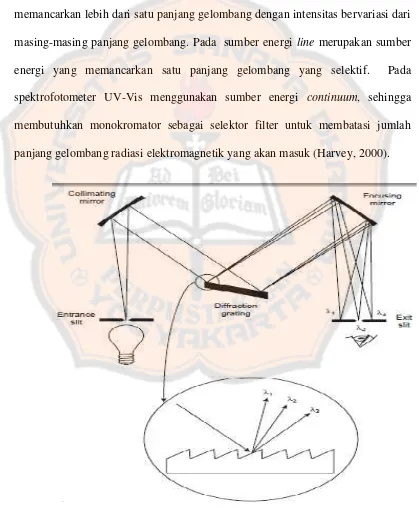
Sumber energi pada spektrofotometer harus dapat memberikan intensitas
radiasi elektromagnetik secara stabil pada daerah spektrum elektromagnetik.
Sumber energi dibagi menjadi dua yaitu sumber energi continuum dan sumber
energi line. Sumber energi continuum merupakan sumber energi yang
memancarkan lebih dari satu panjang gelombang dengan intensitas bervariasi dari
masing-masing panjang gelombang. Pada sumber energi line merupakan sumber
energi yang memancarkan satu panjang gelombang yang selektif. Pada
spektrofotometer UV-Vis menggunakan sumber energi continuum, sehingga
membutuhkan monokromator sebagai selektor filter untuk membatasi jumlah
panjang gelombang radiasi elektromagnetik yang akan masuk (Harvey, 2000).
Panjang gelombang radiasi yang masuk melalui monokromator akan
melewati sampel. Pada saat panjang gelombang radiasi melewati sampel akan
terjadi pengurangan sejumlah radiasi, sehingga panjang gelombang radiasi yang
keluar dan ditangkap oleh detektor akan lebih kecil dari panjang gelombang
radiasi yang masuk. Banyaknya jumlah radiasi yang berkurang berbanding lurus
dengan konsentrasi analit dalam sampel (Harvey, 2000).
Serapan sinar UV dan sinar tampak (visibel) pada umumnya
mengakibatkan eksitasi elektron-elektron, akibatnya panjang gelombang pita yang
terserap dapat dihubungkan dengan elektron yang mungkin ada dalam suatu
molekul (Gandjar dan Rohman, 2007).
Serapan cahaya oleh molekul pada daerah spektrum ultraviolet dan sinar
tampak tergantung pada struktur elektronik molekul. Spektrum ultraviolet dan
sinar tampak senyawa-senyawa organik berkaitan erat dengan transisi-transisi
diantara tingaktan-tingkatan energi elektronik, karena hal ini serapan radiasi
ultraviolet/terlihat sering dikenal sebagai spektroskopi elektronik. Panjang
gelombang serapan merupakan ukuran pemisahan tingkatan-tingkatan tenaga
orbital-orbital yang bersangkutan. Energi yang paling tinggi diperoleh bila
elektron-elektron dalam ikatan σ tereksitasi yang menimbulkan serapan dalam
daerah dari 120 hingga 200 nm. Daerah ini dikenal sebagai daerah ultraviolet
Gambar 5 . Spektrum Elektromagnetik (Harvey, 2000).
G. Penyiapan Sampel
Penyiapan sampel dalam analisis sangat penting karena untuk mengetahui
kadar atau konsentrasi suatu senyawa tertentu dalam sampel hanya dilakukan
terhadap sejumlah kecil sampel. Berdasarkan prinsipnya dikenal dua macam cara
pengambilan sampel dalam analisis yaitu:
1. Pengambilan sampel random (cuplikan random, cuplikan acak)
Cara pengambilan sampel ini dilakukan terhadap bahan yang serba sama
(homogen) atau dianggap serba sama. Misalnya larutan sejati,batchtablet,
dan ampul.
Cara pengambilan sampel ini dilakukan jika bahan tidak homongen.
Dalam hal ini sampel harus diambil dari tiap bagian-bagian yang
berbeda-beda dari setiap wadah (atas, tengah, bawah, samping kanan, samping kiri,
dan sebagainya). Masing-masing sampel harus dicampur homogen
kemudian diambil secara random (Gandjar dan Rohman, 2007).
H. Kromatografi Cair Kinerja Tinggi (KCKT)
1. Definisi dan Instrumentasi
Kromatografi cair kinerja tinggi atau KCKT atau biasa juga disebut
dengan HPLC (High Performance Liquid Chromatography) merupakan
teknik pemisahan yang diterima secara luas untuk analisis dan pemurnian
senyawa tertentu dalam suatu sampel. KCKT merupakan metode yang
tidak destruktif dan dapat digunakan baik untuk analisis kuantitatif
maupun kualitatif (Ganjar dan Rohman, 2007).
Pada sistem KCKT sampel akan dibawa masuk ke dalam kolom
oleh fase gerak. Proses pemisahan komponen dalam sampel terjadi karena
adanya interaksi yang berbeda antara komponen dalam sampel dengan fase
gerak dan fase diam yang berada di dalam kolom (Harvey, 2000).
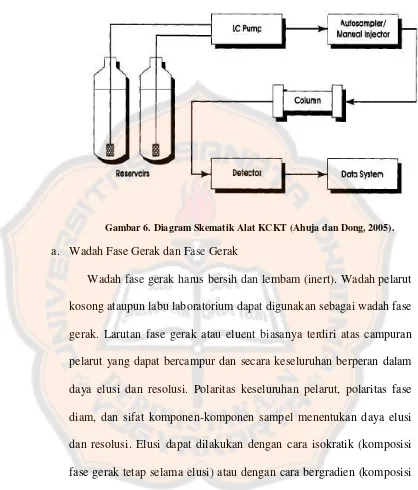
Instrumentasi KCKT pada dasarnya terdiri atas delapan komponen
pokok yaitu: wadah fase gerak, sistem penghantaran fase gerak (pompa),
alat untuk memasukkan sampel (tempat injeksi), kolom, detektor, wadah
penampung buangan fase gerak, tabung penghubung, dan suatu komputer
Gambar 6. Diagram Skematik Alat KCKT (Ahuja dan Dong, 2005).
a. Wadah Fase Gerak dan Fase Gerak
Wadah fase gerak harus bersih dan lembam (inert). Wadah pelarut
kosong ataupun labu laboratorium dapat digunakan sebagai wadah fase
gerak. Larutan fase gerak atau eluent biasanya terdiri atas campuran
pelarut yang dapat bercampur dan secara keseluruhan berperan dalam
daya elusi dan resolusi. Polaritas keseluruhan pelarut, polaritas fase
diam, dan sifat komponen-komponen sampel menentukan daya elusi
dan resolusi. Elusi dapat dilakukan dengan cara isokratik (komposisi
fase gerak tetap selama elusi) atau dengan cara bergradien (komposisi
fase gerak berubah-ubah selama elusi). Elusi bergradien digunakan
untuk meningkatkan resolusi campuran yang kompleks terutama jika
sampel memiliki kisaran polaritas yang lebar. Fase gerak sebelum
digunakan harus disaring terlebih dahulu untuk menghindari
partikel-partikel kecil. Fase gerak juga harus diultrasonikasi (penghilangan
terutama di pompa dan detektor sehingga akan mengacaukan analisis.
Pada saat menyiapkan pelarut untuk fase gerak sangat dianjurkan
menggunakan pelarut, bufer, dan reagen dengan kemurnian yang
sangat tinggi. Adanya pengotor dalam fase gerak dapat menyebabkan
gangguan pada sistem kromatografi (Gandjar dan Rohman, 2007).
b. Pompa
Pompa yang cocok digunakan untuk KCKT adalah pompa yang
mempunyai syarat sebagaimana syarat wadah pelarut, yaitu: pompa
harus inert terhadap fase gerak. Bahan yang umum digunakan untuk
pompa adalah gelas, baja tahan karat, teflon, dan batu nilam. Pompa
yang digunakan seharusnya mampu memberikan tekanan sampai 5000
psi dan mampu mengalirkan fase gerak dengan kecepatan alir 3
mL/menit. Untuk tujuan preparatif, pompa yang digunakan harus
mampu mengalirkan fase gerak dengan kecepatan 20 mL/menit.
Tujuan penggunaan pompa adalah unuk menjamin proses
penghantaran fase gerak berlangsung secara tepat, reprodusibel,
konstan, dan bebas dari gangguan. Ada 2 jenis pompa dalam KCKT
yaitu: pompa dengan tekanan konstan, dan pompa dengan aliran fase
gerak yang konstan (Gandjar dan Rohman, 2007).
c. Tempat Penyuntikan Sampel
Sampel-sampel cair dan larutan disuntikkan secara langsung ke
dalam fase gerak yang mengalir di bawah tekanan menuju kolom
katup teflon yang dilengkapi dengan keluk sampel (sample loop)
internal atau eksternal. Pada saat penyuntikkan, katup diputar sehingga
fase gerak mengalir melewati keluk sampel dan mengalir sampai ke
kolom. Kelebihan penyuntikan sampel akan dikeluarkan ke pembuang
(Gandjar dan Rohman, 2007).
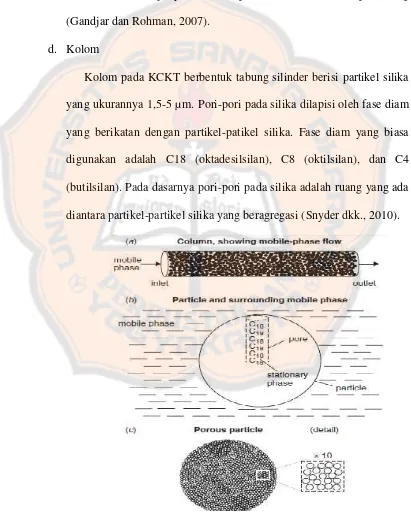
d. Kolom
Kolom pada KCKT berbentuk tabung silinder berisi partikel silika
yang ukurannya 1,5-5 µm. Pori-pori pada silika dilapisi oleh fase diam
yang berikatan dengan partikel-patikel silika. Fase diam yang biasa
digunakan adalah C18 (oktadesilsilan), C8 (oktilsilan), dan C4
(butilsilan). Pada dasarnya pori-pori pada silika adalah ruang yang ada
diantara partikel-partikel silika yang beragregasi (Snyder dkk., 2010).
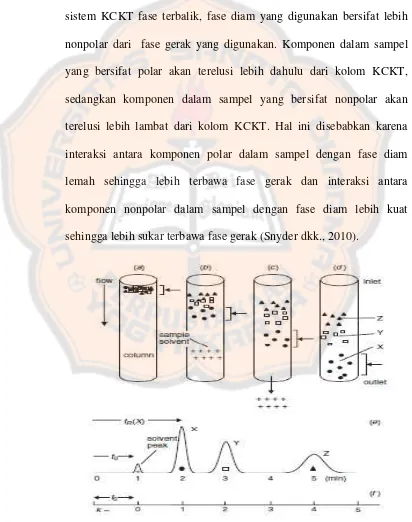
Pada kolom KCKT terjadi proses pemisahan antar komponen
dalam sampel. Pemisahan terjadi berdasarkan interaksi yang terjadi
antara komponen dalam sampel dengan fase gerak dan fase diam. Pada
sistem KCKT fase terbalik, fase diam yang digunakan bersifat lebih
nonpolar dari fase gerak yang digunakan. Komponen dalam sampel
yang bersifat polar akan terelusi lebih dahulu dari kolom KCKT,
sedangkan komponen dalam sampel yang bersifat nonpolar akan
terelusi lebih lambat dari kolom KCKT. Hal ini disebabkan karena
interaksi antara komponen polar dalam sampel dengan fase diam
lemah sehingga lebih terbawa fase gerak dan interaksi antara
komponen nonpolar dalam sampel dengan fase diam lebih kuat
sehingga lebih sukar terbawa fase gerak (Snyder dkk., 2010).
e. Fase Diam
Fase diam yang banyak digunakan pada KCKT adalah silika yang
dimodifikasi secara kimiawi, silika yang tidak dimodifikasi, atau
polimer-polimer stiren dan divinil benzen. Permukaan silika adalah
polar dan sedikit asam karena adanya residu gugus silanol (Si-OH).
Silika dapat dimodifikasi secara kimiawi dengan menggunakan reagen
seperti klorosilan. Gugus silanol akan bereaksi dengan klorosilan dan
mengganti gugus silanol dengan gugus fungsional. Hasil modifikasi
tersebut adalah silika fase terikat yang stabil terhadap hidrolisis, karena
adanya ikatan siloksan (Si-O-Si).
Interaksi antara silika dengan fase diam stabil pada pH diatas 2. R
merupakan gugus metil yang terikat, banyakanya gugus metil yang
terikat akan menentukan sifat kepolaran. Fase diam bersifat polar
apabila gugus metil yang terikat pendek dan bersifat semakin non polar
apabila gugus metil yang terikat semakin panjang (Ahuja dan Dong,
2005).
Gambar 9. Interaksi Silika dengan Fase Diam (Ahuja dan Dong, 2005).
Oktadesilsilan (ODS atau C18) merupakan fase diam yang paling
dengan kepolaran rendah, sedang, dan tinggi. Oktil atau rantai alkil
yang lebih pendek lagi lebih sesuai untuk solut polar (Gandjar dan
Rohman, 2007).
f. Detektor
Detektor KCKT yang ideal memiliki karakteristik sebagai berikut:
1. Memiliki respon terhadap solut yang cepat dan reprodusibel
2. Memiliki sensitivitas yang tinggi, mampu mendeteksi solut
pada kadar yang sangat kecil
3. Stabil pada pengoperasiannya
4. Memiliki sel volume yang kecil sehingga mampu
meminimalkan pelebaran pita.
5. Signal yang dihasilkan berbanding lurus dengan konsentrasi
solut pada kisaran yang luas (kisaran dinamis linier)
6. Tidak peka terhadap perubahan suhu dan kecepatan alir fase
gerak (Gandjar dan Rohman, 2007).
Pada KCKT ada dua jenis detektor, yaitu:
1. Detektor Pemisahan
Teknik pengukuran ini menggunakan detektor universal
yang dapat mendeteksi banyak komponen. Detektor akan
mengukur setiap komponen yang terbawa oleh fase gerak.
Salah satu detektor pemisahan adalah detektor indek bias.
Keunggulan detektor pemisahan adalah dapat mendeteksi
kolom akan terdeteksi sehingga menjadi kurang
selektif(Rohman, 2009).
2. Detektor Spesifik sampel
Teknik pengukuran ini didasarkan pada karakter sampel
yang unik. Detektor akan mendeteksi keunikan dari karakter
sampel, contohnya pengukuran komponen sampel yang
mengabsorpsi sinar uv panjang gelombang spesifik(Snyder
dkk., 2010).
2. Analisis Kualitatif dan Kuantitatif
Analisis kualitatif KCKT dilakukan berdasarkan data wakturetensi
(tR) dengan membandingkan antara data retensi solut sampel dengan data
retensi baku yang sesuai (senyawa yang diketahui pada kondisi yang sama
yaitu dalam kondisi alat yang stabil dengan perbedaan waktu antar
keduanya sekecil mungkin (Gandjar dan Rohman, 2007).
Analisis kuantitatif KCKT dilakukan dengan data luas puncak atau
dengan tinggi puncak. Luas puncak dan tinggi puncak berbanding
langsung dengan banyaknya solut yang dianalisis, jika dilakukan pada
kisaran detektor yang linier. Pengukuran luas puncak dilakukan dengan
mengukur luas sebagai hasil kali tinggi puncak dan lebar pada setengah
tinggi (W1/2). Pengukuran tinggi puncak dilakukan dengan mengukur jarak
dari garis dasar ke puncak maksimum, penyimpangan dari garis dasar
diimbangi dengan interpolasi garis dasar antara awal dan akhir puncak
I. Larutan Bufer
Larutan bufer atau larutan penyangga adalah larutan yang memiliki pH
konstan yaitu dapat mempertahankan pH dari pengenceran, penambahan sedikit
asam atau sedikit basa (Ashari, 2006).
Kapasitas bufer merupakan kemampuan suatu bufer untuk
mempertahankan pH, tergantung pada nilai pKa, konsentrasi bufer, dan pH fase
gerak. Kapasitas bufer akan menurun ketika ada perbedaan nilai pKa bufer dengan
pH fase gerak yang diinginkan. Bufer yang digunakan sebaiknya memiliki nilai
pKa dalam rentang ±1,0 unit dari pH fase gerak yang diinginkan (Snyder dkk.,
2010).
J. Landasan Teori
Salbutamol sulfat dan guaifenesin merupakan kombinasi obat batuk sirup
ekspektoran yang sering digunakan untuk terapi batuk yang disertai asma. Obat
batuk sirup ekspektoran ini termasuk golongan obat keras yang penggunaannya
harus dengan resep dokter sehingga perlu dilakukan penetapan kadar salbutamol
sulfat dan guaifenesin dengan metode analisis yang tepat dan telah divalidasi
sebagai kontrol kualitas produk. Metode Kromatografi Cair Kinerja Tinggi
(KCKT) merupakan metode analisis dengan selektivitas dan sensitivitas yang
tinggi, sehingga mampu memisahkan senyawa-senyawa multikomponen dengan
kadar kecil. Metode KCKT yang digunakan dalam penetapan kadar salbutamol
valid. Salbutamol sulfat dan guaifenesin memiliki gugus kromofor pada rumus
bangunnya yang cukup untuk digunakan pada deteksi secara KCKT-UV.
K. Hipotesis
1. Sediaan sirup merek “X” mengandung guaifenesin tidak kurang dari
90,0% dan tidak lebih dari 110,0% dari yang tertulis pada label
kemasan (USP30-NF25,2007).
2. Kadar guaifenesin yang terukur sesuai dengan kadar guaifenesin yang
24
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini mengikuti jenis penelitian non eksperimental deskriptif
karena tidak ada intervensi terhadap subyek uji.
B. Variabel Penelitian
1. Variabel bebas pada penelitian ini adalah sediaan sirup merek “X” yang
mengandung salbutamol sulfat dan guaifenesin
2. Variabel tergantung pada penelitian ini adalah kadar salbutamol sulfat dan
guaifenesin dalam sediaan sirup merek“X”
3. Variabel pengganggu pada penelitian ini adalah:
a. Kemurnian pelarut, sehingga digunakan pelarut pro analysis yang
memiliki kemurnian tinggi.
b. Kemurnian baku pembanding salbutamol sulfat dan guaifenesin yang
digunakan, untuk mengatasinya digunakan baku yang telah terjamin
kualitasnya seperti tercantum padaCertificate of Analysis(CoA).
C. Definisi Oprasional
1. Sistem Kromatografi Cair Kinerja Tinggi yang digunakan pada penelitian
ini menggunakan kolom fase diam C18 dimensi 250 x 4,6 mm,5µm, fase
dengan penambahan asam fosfat 0,1M pada komposisi 40:60 dan
kecepatan alir 1,0 mL/min hasil optimasi yang telah divalidasi.
2. Sampel obat batuk yang digunakan adalah sediaan sirup merek “X” yang
mengandung salbutamol sulfat 1,2 mg dan guaifenesin 50 mg setiap 5 mL
dengan nobatchRF 2001.
3. Kadar salbutamol sulfat dan guaifenesin dinyatakan dalam satuan % b/v.
D. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini memiliki kualitas pro
analysis, kecuali dinyatakan lain yakni baku pembanding salbutamol sulfat
(Supriya Lifescience, No. batch SSL/SS/0312030, kemurnian 98,83%) (PT. Ifars
Pharmaceutical and Lab), baku baku pembanding guaifenesin (No. kontrol
205158, kemurnian 99,88%), metanol kualitaspro analysis(E. Merck), akuabides
(laboratorium kimia analisis USD) dan sediaan sirup merek“X”.
E. Alat Penelitian
Alat yang digunakan adalah seperangkat Kromatografi Cair Kinerja
Tinggi (KCKT) fase terbalik yang terdiri: pompa (merek Shimadzu LC-2010C)
dengan sistem elusi gradien, detektor ultraviolet (UV) merek Shimadzu
LC-2010C, kolom C18dimensi 250 x 4,6 mm, 5µm merek Shimadzu column
komputer (merek Dell B6RDZ1S Connexant system RD01-D850 A03-0382 JP
France S.A.S, printer HP Deskjet D2566 HP-024-000 625730),UV/Vis
Spectrophotometer SP-3000plus merek OPTIMA dengan detektor silicon photo
diode, alat ultrasonikatorRefsch., Tipe : T460 (Schwing.1 PXE, FTZ-Nr.
C-066/83, HF-Frequ.:35 kHz), membran filter Whatman ukuran pori 0,45 µm dan
diameter 47 mm, timbangan analitik Ohaus Carat Series PAJ 1003 (max60/120 g,
min 0,001 g, d=0,01/0,1 mg), millipore, seperangkat alat gelas yang biasa
digunakan di laboratorium analisis.
F. Tata Cara Penelitian
1. Pembuatan Asam Fosfat 0,1 M
Larutan pekat H3PO4 dengan konsentrasi 85% diambil sebanyak
1,2 mL, kemudian diencerkan dengan akuabides 100,0 mL sehingga
konsentrasi H3PO4menjadi 0,1M.
2. Pembuatan Bufer Kalium Dihidrogen Fosfat 0,01M
Sebanyak 0,68 g KH2SO4ditimbang seksama dan dilarutkan dalam
akuabides hingga 500,0 mL sehingga konsentrasi menjadi 0,01 M,
kemudian pH diatur dengan penambahan asam fosfat 0,1 M hingga
mencapai pH 3,0.
3. Pembuatan Fase Gerak
Fase gerak dibuat dari campuran metanol : 0,01 M bufer kalium
gerak tersebut disaring dengan kertas saring Whatman dengan bantuan
pompa vakum, kemudian diultrasonikasi selama 15 menit.
4. Pembuatan Larutan Baku Salbutamol Sulfat dan Guaifenein untuk
Penentuan Panjang Gelombang
a. Pembuatan Larutan Baku Salbutamol Sulfat
Larutan baku salbutamol sulfat konsentrasi 1000 µg/mL dibuat
dengan menimbang secara seksama baku salbutamol sulfat sebanyak
10,0 mg dan dilarutkan dengan metanol ke dalam labu takar 10,0 mL
hingga tanda, kemudian dibuat larutan seri dengan 3 konsentrasi
berbeda yaitu 100; 300; dan 600 µg/mL dengan mengencerkan 1,0;
3,0; dan 6,0 mL larutan stok tersebut dengan metanol hingga 10,0 mL.
b. Pembuatan Larutan BakuGuaifenesin
Larutan baku guaifenesin konsentrasi 400µg/mL dibuat dengan
menimbang secara seksama baku guaifenesin sebanyak 20,0 mg dan
dilarutkan dengan metanol dalam labu ukur 10,0 mL hingga tanda,
kemudian dibuat larutan seri dengan 3 konsentrasi berbeda yaitu 20;
60; dan 100 µg/mL dengan mengencerkan 0,5; 1,5; dan 2,5 mL larutan
stok tersebut dengan metanol hingga 10,0 mL.
5. Penetapan Panjang Gelombang(λ) Maksimum Salbutamol Sulfat dan
Guaifenesin dengan Spektrofotometer UV-Vis
Masing-masing konsentrasi larutan seri baku salbutamol sulfat
spektrofotometer UV-Vis. Nilai λ maksimum merupakan λ yang
memberikan serapan terbesar dan sama pada tiap konsentrasi dari tiga seri
larutan baku salbutamol sulfat dan guaifenesin.
6. Pembuatan Larutan Baku Salbutamol Sulfat
a. Pembuatan Larutan Stok Salbutamol Sulfat
Larutan stok salbutamol sulfat konsentrasi 200 μg/mL dibuat dengan menimbang secara seksama baku salbutamol sulfat sebanyak
10,0 mg dan diencerkan dengan metanol ke dalam labu takar 50,0 mL
hingga tanda.
b. Pembuatan Larutan Intermediet Salbutamol Sulfat
Larutan intermediet salbutamol sulfat konsentrasi 20μg/mL dibuat dengan mengambil sebanyak 500,0 µ L larutan stok salbutamol
sulfat denganmicropipetdan dimasukkan ke dalam labu takar 5,0 mL,
kemudian diencerkan dengan metanol hingga tanda
7. Pembuatan Larutan Baku Guaifenesin
Larutan stok guaifenesin konsentrasi 900 μg/mL dibuat dengan menimbang secara seksama baku guaifenesin sebanyak 22,5 mg dan
diencerkan dengan metanol dalam labu takar 25,0 mL hingga tanda.
8. Pembuatan Seri Larutan Baku Campuran Salbutamol Sulfat dan
Guaifenesin
Seri larutan baku campuran salbutamol sulfat dan guafenesin
konsentrasi (0,8 dan 36); (1 dan 45); (1,2 dan 54); (1,4 dan 63); dan (1,6
700,0; 800,0µL larutan intermediet salbutamol sulfat dan mengambil
sebanyak 400,0; 500,0; 600,0; 700,0; 800,0µL larutan baku guaifenesin
dengan micropipet dan masing-masing dimasukkan ke dalam labu takar
10,0 mL, kemudian diencerkan dengan metanol hingga tanda. Larutan
kemudian disaring denganmilliporedan diultrasonikasi selama 15 menit.
9. Pengujian Stabilitas Baku Pembanding
Pengujian stabilitas baku pembanding menggunakan tiga seri
larutan baku salbutamol sulfat konsentrasi 0,8; 1,2; 1,6 µg/mL dan
guaifenesin konsentrasi 36; 54; 72 µg/mL yang telah disaring dengan
milipore dan diultrasonikasi selama 15 menit. Tiga seri larutan baku
salbutamol sulfat dan guaifenesin masing-masing konsentrasi diinjeksikan
sejumlah 20 µL pada sistem KCKT fase terbalik dengan komposisi fase
gerak campuran metanol : 0,01 M bufer kalium dihidrogen fosfat pH 3,0
(40:60) dan kecepatan alir 1,0 mL/menit hasil optimasi. Pengujian
stabilitas baku pembanding dilakukan selama tiga hari.
10. Pembuatan Kurva Baku Salbutamol Sulfat dan Guaifenesin
Pembuatan kurva baku salbutamol sulfat dan guaifenesin
menggunakan seri larutan baku campuan salbutamol sulfat dan guaifenesin
konsentrasi (0,8 dan 36); (1 dan 45); (1,2 dan 54); (1,4 dan 63); dan (1,6
dan 72) μg/mL yang telah disaring dengan millipore dan diultrasonikasi selama 15 menit. Seri larutan baku campuran salbutamol sulfat dan
guaifenesin masing-masing konsentrasi diinjeksikan sejumlah 20 µL pada
metanol : 0,01 M bufer kalium dihidrogen fosfat pH 3,0 (40:60) dan
kecepatan alir 1,0 mL/menit hasil optimasi. Berdasarkan kromatogram
akan diperoleh luas area salbutamol sulfat dan guaifenesin untuk
masing-masing konsentrasi seri larutan baku campuran. Deteksi luas area ini
kemudian diplotkan terhadap konsentrasi seri larutan baku campuran
salbutamol sulfat dan guaifenesin untuk memperoleh regresi linear dengan
persamaan y = bx + a dengan kriteria keberterimaan (r) ≥ 0,998
(Kazakevich dan Lobrutto, 2007).
11. Pengambilan Sampel
Pengambilan sampel dilakukan dengan mengambil 10 unit sediaan
sirup secara acak yang mewakili satu batch dari produksi sediaan sirup
merek“X”kemudian dicampur menjadi satu hingga homogen.
12. Keseragaman volume
Keseragaman volume menggunakan piknometer untuk mengetahui
berat jenis sampel dengan standar air yang memiliki berat jenis 0,997
g/mL pada suhu 250C. Pengukuran berat jenis sampel dikakukan replikasi
sebanyak tiga kali.
13. Preparasi Sampel
a. Pembuatan Larutan Stok Sampel
Sediaan sirup merek “X” mengandung 1,20 mg salbutamol
sulfat dan 50,0 mg guaifenesin tiap 5,0 mL.Larutan stok sampel
homogen menggunakan micropipet sebanyak 250,0 µL kemudian
dimasukkan ke dalam labu ukur 5,0 mL dan diencerkan dengan
metanol hingga tanda.
b. Pembuatan Larutan Sampel
Larutan sampel konsentrasi 1,2 µg/mL salbutamol sulfat
dan 50,0μg/mL guaifenesin dibuat dengan mengambil larutan stok sampel menggunakan micropipet sebanyak 500,0 µL kemudian
dimasukkan ke dalam labu ukur 5,0 mL dan diencerkan dengan
metanol hingga tanda. Larutan sampel disaring menggunakan
milliporedan diultrasonikasi selama 15 menit.
14. Penetapan Kadar Sampel
Larutan sampel yang telah dipreparasi diinjeksikan sejumlah 20 µL
ke sistem KCKT yang telah dioptimasi dan divalidasi.Berdasarkan
kromatogram sampel akan diperoleh AUC salbutamol sulfat dan
guaifenesin dari masing replikasi. Selanjutnya AUC
masing-masing sampel di masukkan ke persamaan regresi linear bakusalbutamol
sufat dan guaifenesin yang diperoleh dari hasil validasi, sehingga
diperoleh kadar salbutamol sulfat dan guaifenesin dalam sampel.
G. Analisis Hasil
Analisis kualitatif dilakukan dengan membandingkan waktu retensi
sampel dengan waktu retensi baku salbutamol sulfat dan guaifenesin. Analisis
persamaan regresi linear y = bx + a yang diperoleh dari kurva baku salbutamol
sulfat dan guaifenesin hasil validasidengan kriteria keberterimaan (r) ≥ 0,998
(Kazakevich dan Lobrutto, 2007). Kadar yang diperoleh dalam satuan %
b/v.Selanjutnya dilakukan analisis dengan melihat apakah dalam sediaan sirup
merek “X” mengandung salbutamol sulfat dan guaifenesin tidak kurang dari
90,0% dan tidak lebih dari 110,0% dari yang tertulis pada label kemasan
33
BAB IV
HASIL DAN PEMBAHASAN
Penetapan kadar salbutamol sulfat dan guaifenesin dalam sediaan sirup
merek “X” menggunakan metode kromatografi cair kinerja tinggi fase terbalik
yang telah dioptimasi dan divalidasi. Pada tahap optimasi diperoleh komposisi
fase gerak yang optimal untuk pemisahan salbutamol sulfat dan guaifenesin yaitu
campuran metanol : 0,01 M kalium dihidrogen fosfat pH 3,0 (40:60). Fase gerak
tersebut menghasilkan pemisahan baku campuran dengan waktu retensi
salbutamol sulfat 2,91 menit dan guaifenesin 8,75 menit (Mulyawan, 2014).
Pada tahap validasi metode diperoleh hasil guaifenesin memiliki rentang
validitas yang memenuhi persyaratan linearitas pada seri 36,0-72,0 µg/mL,
akurasi dan presisi padalevel 100% yaitu konsentrasi 50 µg/mL (Hendy,2014).
A. Pembuatan Fase Gerak
Fase gerak yang digunakan dalam penelitian ini adalah fase gerak yang
diperoleh dari hasil optimasi yaitu metanol : 0,01M bufer kalium dihidrogen fosfat
pH 3,0 (40:60). Pada optimasi fase gerak telah dihasilkan pemisahan salbutamol
sulfat dan guaifenesin yang baik dan optimal dengan resolusi 5,87. Sistem
kromatografi yang digunakan adalah fase terbalik dimana fase diam C18 bersifat
lebih non polar dari fase gerak campuran metanol : 0,01 M bufer kalium
B. Penentuan Panjang Gelombang (λ) maksimum Salbutamol sulfat dan
Guaifenesin
Penetapan λ pengamatan bertujuan untuk mengetahui λ yang memberikan
serapan optimal untuk salbutamol sulfat dan guaifenesin. Penentuan λ pengamatan
dilakukan dengan mengamati λ overlapping antara salbutamol sulfat dan
guaifenesin. Pengukuran λ maksimum salbutamol sulfat dan guaifenesin
dilakukan dengan tiga seri konsentrasi. Hal ini dilakukan untuk melihat kenaikan
respon serapan terhadap kenaikan konsentrasi sehingga dapat dipastikan bahwa
panjang gelombang yang diperoleh milik salbutamol sulfat dan gaifenesin.
Salbutamol sulfat menggunakan seri konsentrasi 100; 300; dan 600 µg/mL dan
guaifenesin menggunakan seri konsentrasi 20; 60; dan 100 µg/mL. Pembacaan
serapan dilakukan menggunakan spektofotometer UV-Vis pada λ 200-400 nm
karena λ salbutamol sulfat dan guaifenesin berada dalam rentang tersebut. Suatu
senyawa dapat diukur serapannya pada daerah UV jika memiliki gugus kromofor
dan auksokrom. Berikut adalah gambar gugus kromofor dan auksokrom
salbutamol sulfat dan guaifenesin:
Gambar 11. Gugus Kromofor dan Auksokrom Guaifenesin
Berikut hasil spektra salbutamol sulfat dan guaifenesin yang diperoleh,
serta spektraoverlappingsalbutamol sulfat dan guifenesin:
Gambar 12. Spektra Salbutamol Sulfat pada 3 Seri Konsentrasi dalam Pelarut Metanol
600µg/mL
300µg/mL
Gambar 13. Spektra Guaifenesin pada 3 Seri Konsentrasi dalam Pelarut Metanol
Gambar 14. SpektraOverlappingSalbutamol Sulfat dan Guaifenesin dalam Pelarut Metanol
100µg/mL
60µg/mL
20µg/mL 274 nm
Berdasarkan profil spektra yang diperoleh pada penelitian ini, λ
maksimum salbutamol sulfat adalah 278 nm dan guaifenesin adalah 274 nm. Hasil
λ maksimum ini diperoleh dengan melihat kenaikan respon serapan yang
sebanding dengan kenaikan konsentrasi. Secara teoritis pada suasana asam
salbutamol sulfat memiliki λ maksimum 276 nm dan guaifenesin memilki λ
maksimum 273 nm (Moffat dkk., 2011). Pergeseran λ yang terjadi untuk
salbutamol sulfat adalah 2 nm dan guaifenesin adalah 1 nm, sehingga λ
maksimum yang diperoleh pada penelitian ini dapat diterima karena pergeseran λ
yang terjadi masih memenuhi pesyaratan yaitu tepat pada atau dalam batas 2 nm
(Dirjen POM, 1995). Berdasarkan profil spektra overlapping salbutamol sulfat
dan guaifenesin dapat diketahui λ overlapping yang digunakan sebagai λ
pengamatan yaitu 275 nm.
C. Pengukuran Stabilitas Baku Pembanding
Pada penelitian ini dilakukan pengukuran stabilitas larutan baku untuk
mengetahui stabilitas dari baku yang digunakan. Pengukuran stabilitas larutan
baku menggunakan tiga seri konsentrasi yaitu 0,6 ; 1,2 ; 1,6 µg/mL untuk
salbutamol sulfat dan 36; 54; 72 µg/mL untuk guaifenesin dan dilakukan selama
tiga hari.Pelarut yang digunakan adalah metanol karena dapat melarutkan
salbutamol sulfat dan guaifenesin. Metanol memenuhi persyaratan sebagai pelarut
yaitu dapat melarutkan analit, tidak bereaksi dengan analit, dapat bercampur
dengan fase gerak, dan tidak toksik.Pengukuran stabilitas larutan baku dilakukan
pegukuran dari masing-masing konsentrasi. Baku pembanding dikatakan stabil
apabila persen perbedaan yang diperoleh ≤ 2% (Ahuja dan Dong, 2005).Berikut
hasil pengukuran untuk mengetahui stabilitas larutan:
Tabel 1. Hasil Pengukuran Stabilitas baku Guaifenesin
Tabel 2. Hasil Pengukuran Stabilitas Baku Salbutamol Sulfat
Larutan baku salbutamol sulfat % Perbedaan
AUC
0,79064 12429 13008 11721 4,66 5,69
1,18596 14296 14288 12919 0,06 9,63
1,58128 16943 18411 18209 8,66 7,47
Berdasarkan hasil pengukuran, pada guaifenesin didapatkan kurva baku dengan
nilai koefisien korelasi (r = 0,9997) sehingga persen perbedaan dapat dilihat
berdasarkan konsentrasinya. Baku guaifenesin dinyatakan stabil karena memiliki
% perbedaan kadar ≤ 2%. Pada salbutamol sulfat tidak dilakukan pembuatan
kurva baku karena baku pembanding yang digunakan telah melewati tanggal
kadaluwarsa sehingga persen perbedaan dilihat berdasarkan nilai AUC.Baku
salbutamol sulfat dinyatakan tidak stabil karena memiliki % perbedaan AUC≥
Larutan baku guaifenesin % Perbedaan
Konsentrasi
35,957 430299 35,351 428289 35.200 432367 35.507 0,47 0,48
53,953 674301 53.728 674835 53.769 674079 53.712 0,08 0,03
2%. Karena ketidakstabilan baku salbutamol sulfat pada penelitian ini analisis
kuantitatif hanya dilakukan untuk guaifenesin.
D. Pembuatan Kurva Baku Guaifenesin
Lautan baku guaifenesin dibuat dalam lima seri konsentrasi. Lima seri
konsentrasi larutan baku ini digunakan untuk membuat kurva baku sehingga
konsentrasi dengan area dibawah kurva (AUC). Konsentrasi seri larutan baku
guaifenesin yang digunakan adalah 36; 45; 54; 63 ; dan 72 µg/mL. Persamaan
kurva baku yang diperoleh digunakan untuk menetapkan kadar guaifenesin dalam
sampel sirup merek “X”. Parameter yang digunakan untuk menentukan linearitas
adalah koefisien korelasi (r)≥ 0,998 (Kazakevich dan Lobrutto, 2007).Penentuan
persamaan kurva baku guaifenesin dilakukan dengan menggunakan lima seri
larutan baku dan tiga kali replikasi, persamaan kurva baku yang diperoleh adalah
sebagai berikut:
Tabel 3. Hasil Pengukuran Pesamaan Kurva baku Guaifenesin
Replikasi 1 Replikasi 2 Replikasi 3 Konsentrasi 35,940 416750 35,957 430299 35,957 434389 44,926 542221 44,946 563166 44,946 565020 53,911 690626 53,935 674301 53,935 676218 62,896 779459 62,924 790499 62,924 791864 71,882 903167 71,914 913892 71,914 917741 A -59598,246 A -42280,037 A -39082,532 B 13467,384 B 13288,380 B 13277,580
r 0,99746 r 0,99963 r 0,99967
Persamaan kurva baku yang digunnakan untuk penetapan kadar
Y = 13277,580x-39082,532 karena memiliki nilai r yang paling besar yaitu
0,9967. Nilai r merupakan koefisien korelasi yang menyatakan hubungan antara
respon
dengan konsentrasi larutan. Korelaasi yang baik antara respon dengan Konsentrasi
dapat dilihat dari kurva dimana dengan bertambahnya konsentrasi maka respon
yang dihasilkan juga meningkat dan membentuk garis yang linier. Kurva
hubungan antara AUC sebagai respon dengan konsentrasi guaifenesin adalah:
Gambar 15. Kurva Baku Guaifenesin
E. Pengambilan Sampel
Sampel yang digunakan pada penelitian ini adalah sediaan sirup merek
“X” yang mengandung 1, 20 mg salbutamol sulfat dan 50,0 mg guafenesin setiap
5,0 mL. Penelitian ini menggunakan 10 unit sediaan yang diambil secara acak
dengan nomor batchRF2001 untuk ditetapkan kadarnya menggunakan metode
kromatografi cair kinerja tinggi fase terbalik dengan fase gerak metanol : 0,01 M
bufer fosfat pH 3,0 (40:60) dan kecepatan alir 1,0 mL/min. Berikut adalah hasil
keseragaman volume sampel sirup merek“X”:
Tabel 4. Data Keseragaman Volume Sampel Sirup merek“X”
No Bobot
1 224,4 100,2 124,2 98,807 2 225,2 99,8 125,4 99,761 3 226,4 100,7 125,7 100,000 4 224,7 100,1 124,6 99,125 5 225,6 100,3 125,3 99,682 6 225,9 100,4 125,5 99,841 7 226,2 100,6 125,6 99,920 8 225,4 100,3 125,1 99,523 9 225,7 100,8 124,8 99,284 10 226,1 100,4 125,7 100,000
Rata-rata (×) 99,594
SD 0,405
RSD 0,41 %
Uji keseragaman volume dilakukan pada 10 unit sampel sirup merek “X”
dengan nomor batch yang sama. Volume sampel diperoleh dari konversi berat isi
sampel dalam kemasan dengan menghitung berat jenis sampel menggunakan
piknometer. Berat jenis sampel yang diperoleh adalah 1,257 g/mL. Sampel yang
digunakan memiliki volume pada etiket 100 mL. Berdasarkan hasil yang
diperoleh semua volume sampel masuk dalam rentang 90-110% (USP30-NF25,
2007) dan nilai RSD yang diperoleh ≤ 2% (Gonzalez dan Herrador, 2007),
sehingga sampel yang digunakan dinyatakan memiliki volume yang sesuai dengan
F. Analisis Kualitatif
Analisis kualitatif dilakukan dengan membandingkan waktu retensi
salbutamol sulfat dan guaifenesin antara baku dan sampel. Berikut kromatogram
baku dan sampel:
Nama sampel : Baku salbutamol sulfat 1,2 µg/mL Fase diam : C18 dimensi 250 x 4,6 mm, 5µm
Fase gerak : metanol : bufer fosfat 0,01M pH 3 (40:60) Kecepatan alir : 1,0 mL/menit
Volume injeksi : 20 µL Detektor : UV-275 nm
Nama sampel : Baku guaifenesin 54 µg/mL Fase diam : C18 dimensi 250 x 4,6 mm, 5µm
Fase gerak : metanol : bufer fosfat 0,01M pH 3 (40:60) Kecepatan alir : 1,0 mL/menit
Volume injeksi : 20 µL Detektor : UV-275 nm
Gambar 17. Kromatogram Baku Guaifenesin Konsentrasi 54,0 µg/mL
Fase diam : C18 dimensi 250 x 4,6 mm, 5µm
Fase gerak : metanol : bufer fosfat 0,01M pH 3 (40:60) Kecepatan alir : 1,0 mL/menit
Volume injeksi : 20 µL Detektor : UV-275 nm
Gambar 18. Kromatogram sampel
Tabel 5. Data Waktu Retensi Baku Salbutamol Sulfat, Baku Guaifenesin
dan Sampel
Perbedaan waktu retensi salbutamol sulfat dan guaifenesin terjadi karena
adanya perbedaan interaksi yang terjadi antara masing-masing zat dengan fase
diam dan fase gerak sesuai prinsip pemisahan dari kromatografi cair kinerja
tinggi. Interaksi yang terjadi adalah:
Gambar 20. Interaksi Guaifenesin dengan Fase Diam
Gambar 22. Interaksi Guaifenesin dengan Fase Gerak
Pada penelitian ini, sistem KCKT yang digunakan adalah fase terbalik
dimana fase diam bersifat lebih non polar dibanding fase gerak. Analit yang
bersifat polar akan terelusi lebih dahulu sedangkan yang bersifat non polar akan
berinteraksi lebih oleh fase diam. Berdasarkan interaksi yang terjadi guaifenesin
memiliki interaksi yang lebih banyak dengan fase diam sehingga waktu retensinya
lebih lama dibandingkan sabutamol sulfat. Hal ini juga menunjukkan bahwa
guaifenesin bersifat lebih non polar dari salbutamol sulfat. Hasil waktu retensi
yang sama antara baku dengan sampel menyatakan bahwa dalam sampel sirup
G. Analisis Kuantitatif
Analisis kuantitatif dilakukan dengan menghitung kadar guaifenesin dalam
sampel yang mengandung 50 mg guaifenesin setiap 5 mL (1 %b/v). Sampel yang
digunakan sejumlah 10 unit dengan nomor batch yang sama dan dilakukan
replikasi sebanyak enam kali. Pada penelitian ini dilakukan 2 tahap preparasi
sampel dengan faktor pengenceran 200 kali. Tahap pertama adalah pembuatan
larutan stok sampel dengan konsentrasi guaifenesin 500,0 µg/mL. Tahap kedua
adalah pembuatan larutan sampel dengan konsentrasi guaifenesin 50 µg/mL dari
larutan stok sampel. Respon yang dihasilkan berupa nilai AUC yang kemudian
disubtitusikan kedalam persamaan kurva baku guaifenesin = 13277,580 −
39082,532, sehingga diperoleh kadar guaifenesin sebagai berikut:
Tabel 6. Hasil Pengukuran Kadar Sampel Sirup Merek“X”
Replikasi tR
1 8,016 611026 48,9628 9792,5600 0,9793 48,965 2 8,029 606857 48,6488 9729,7600 0,9730 48,650 3 8,017 605170 48,5218 9704,3600 0,9704 48,520 4 8,020 603116 48,3671 9673,4200 0,9637 48,185 5 7,990 602166 48,2955 9659,1000 0,9659 48,295 6 8,016 611906 49,0291 9805,8200 0,9806 48,030
Rata-rata (×) 48,44 mg/5mL
SD 0,3406
RSD 0,70 %
Rentang kadar yang diperbolehkan untuk sediaan sirup yang mengandung
guaifenesin adalah 90-110% dari kadar yang tertera pada lebel kemasan
sampel sirup merek “X”penelitian ini adalah 45 – 55 mg/5ml. Berdasarkan hasil
pengukuran diperoleh rentang kadar 48,03–48,97 mg/5mL, maka dapat diyatakan
tidak ada satupun sampel yang berada diluar rentang yang dipersyaratkan. Nilai
RSD yang diperoleh yaitu 0,70% memenuhi persyaratan yang ditentukan yaitu≤
4% (Gonzalez dan Herrador, 2007), sehingga dapat dinyatakan bahwa kadar
guaifenesin terukur sesuai dengan kadar guaifenesin yang tertera pada label
49
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Kadar guaifenesin yang diperoleh adalah 48,44± 0,34 mg/5mL.
2. Kadar guaifenesin yang diperoleh sesuai dengan kadar yang tertera pada label
kemasan sediaan sirup merek “X”.
L. Saran
Penetapan kadar salbutamol sulfat dalam sediaan sirup merek “X”
menggunakan metode Kromatografi Cair Kinerja Tinggi fase terbalik
menggunakan baku pembanding yang masih stabil (belum Kadaluwarsa),
dan melakukan penetapan kadar salbutamol sulfat dan guaifenesin dalam