PROPOSAL
PENELITIAN DOSEN PEMULA UNIVERSITAS LAMPUNG
IDENTIFIKASI DENGAN PENDEKATAN POLIFASIK PADA BAKTERI ENDOFIT LAMUN YANG MEMILIKI AKTIVITAS
ANTIMIKROFOULING DARI PERAIRAN LAMPUNG
PROGRAM STUDI ILMU KELAUTAN FAKULTAS PERTANIAN
UNIVERSITAS LAMPUNG
2021
DAFTAR ISI
HALAMAN SAMPUL... i
RINGKASAN ... ii
DAFTAR ISI... iii
BAB 1. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan Khusus Penelitian ... 4
1.3. Urgensi Penelitian ... 4
1.4. Target Penemuan dan Kontribusi Pada Ilmu pengetahuan ... 4
BAB 2. TINJAUAN PUSTAKA ... 5
2.1. Landasan Ilmiah (State of the Art) ... 5
2.2. Bakteri Endofit ... 6
2.3. Bakteri Biofilm ... 6
2.4. Identifikasi Molekuler Bakteri ... 7
2.4.1. Polyketide Synthase (PKS) ... 7
2.4.2. Non Ribosomal Peptide Synthetase (NRPS) ... 8
BAB 3. METODE PENELITIAN ... 10
3.1. Bagan Alir Penelitian (Fishbone Diagram) ... 10
3.2. Pengambilan sampel ... 11
3.3. Isolasi dan Purifikasi Bakteri Endofit Lamun dan Bakteri Biofilm ... 11
3.4. Uji antagonis bakteri endofit Lamun ... 11
3.5. Ekstraksi ... 11
3.6. Identifikasi Molekuler ... 11
3.6.1. Ekstraksi DNA dan Amplifikasi PCR... 11
3.6.2. Elektroforesis ... 12
3.6.3. Sekuensing DNA ... 12
BAB 4. RENCANA ANGGARAN BIAYA DAN JADWAL PENELITIAN ... 13
4.1. Rencana Anggaran Biaya ... 13
4.2. Jadwal Penelitian ... 14
DAFTAR PUSTAKA ... 15
IDENTIFIKASI DENGAN PENDEKATAN POLIFASIK PADA BAKTERI ENDOFIT LAMUN YANG MEMILIKI AKTIVITAS
ANTIMIKROFOULING DARI PERAIRAN LAMPUNG
RINGKASAN
Lamun adalah tumbuhan berbunga (Angiospermae) yang mampu beradaptasi untuk hidup di lingkungan laut. Dilaporkan bahwa ekstrak dari lamun memiliki aktivitas sebagai penghambat bakteri yang membentuk biofilm. Proses biofouling diawali dengan pembentukan film oleh bakteri yang menempel pada permukaan benda ataupun material yang terendam di dalam laut yang disebut sebagai biofilm. Untuk meminimalisasi biofouling dilakukan pengecatan dengan mencampurkan material beracun yang tidak ramah lingkungan, maka dicari alternatif baru untuk menghambat bakteri biofilm sebagai prasyarat penempelan organisme penempel seperti teritip.
Upaya untuk mengatasi permasalahan menggunakan bakteri endofit yang bersimbion dengan lamun merupakan salah satu alternatif ramah lingkungan. Penelitian ini bertujuan untuk identifikasi bakteri endofit lamun dengan pendekatan polifasik secara biokimia, morfologi, dan molekular berbasis PCR 16S rDNA, serta mendeteksi keberadaan fragmen gen PKS – NRPS dari bakteri endofit lamun dan bakteri biofilm. Hasil yang diharapkan dari penelitian ini adalah mendapatkan isolat bakteri endopit lamun yang memiliki kandidat senyawa bioaktif baru dari laut yang nantinya dapat dijadikan alternatif dari pemecahan masalah penempelan organisme fouling.
Kata Kunci: Endofit, Polifasik, Identifikasi, Antimikrofouling.
BAB 1. PENDAHULUAN
1.1 Latar Belakang
Lamun atau seagrass adalah satu-satunya kelompok tumbuhan berbunga (Angiospermae) yang secara penuh mampu beradaptasi untuk hidup di lingkungan laut (den Hartog, 1970; Romimohtarto, 1991). Di Indonesia sampai saat ini telah tercatat 12 jenis lamun dan satu jenis lagi, Hallophilla beccarii kemungkinan dapat ditemukan.
Tumbuhan ini terbagi atas dua famili, yaitu Potamogetonaceae dan Hydrocharitaceae.
Famili Potamogetonaceae terdiri dari beberapa genus yaitu Cymodacea sp., Halodule sp, Syringodium sp.,Thalassodendron sp., Zostera sp.. Famili Hydrocharitaceae memiliki beberapa genus yaitu Enhalus sp., Halophila sp., Arlyza (2008) melaporkan bahwa delapan dari sepuluh ekstrak lamun yaitu Thalassia hemprichii, Halodule pinifolia, Syringodium isoetifolium, Cymodocea serrulata, Cymodocea rotundata, Enhalus acroides, Halophila sp., Halophila ovalis, Halophila spinulosa, Halodule uninervis dengan empat pelarut diketahui mampu menghambat pertumbuhan bakteri pembentuk biofilm yaitu Vibrio harveyi, Pseudomonas aeruginosa, Bacillus subtilis, Staphylococcus aureus, Aeromonas hydrophila. Tanaman lamun pada umumnya mempunyai morfologi luar hampir serupa. Lamun mempunyai daun-daun yang panjang, tipis dan mirip pita yang mempunyai saluran air, serta bentuk pertumbuhannya monopodial, kecuali pada Syringodium sp. bentuk daunnya silindris (Lanyon, 1986).
Arlyza (2009) meneliti bahwa Syringodium isoetifolium merupakan salah satu jenis lamun yang ekstraknya memiliki aktivitas sebagai penghambat bakteri yang membentuk biofilm. Beberapa metabolit sekunder yang dimiliki oleh lamun menunjukkan adanya aktivitas farmakologi dan merupakan alternative baru untuk bahan obat-obatan. Menurut Sammarco dan Coll (1990), metabolit sekunder pada organisme laut berperan penting dalam ekologi terutama untuk perlindungan terhadap predator, kompetisi ruang hidup, reproduksi dan antifouling. Tumbuhan lamun telah dikenal merupakan sumber yang kaya akan metabolit sekunder terutama komponen phenol. Komponen phenol telah banyak diketahui merupakan agen alelopati (zat yang dihasilkan oleh suatu organisme yang mempunyai efek organisme lain tidak hidup disekelilingnya) pada tanaman darat yang diartikan seperti fungsi ekologis yang dimungkinkan terjadi juga pada tumbuhan lamun. Beberapa penelitian telah membuktikan adanya bahan aktif yang dihasilkan oleh beberapa jenis lamun yang mempunyai aktifitas antifouling seperti pada jenis Zostera marina (Jensen et al.
1998), Thalassia testudinum (Armstrong at al. 2000; Maxey 2006), Syringodium filiforme (Maxey 2006), Enhalus acoroides (Qi 2008), Cymodocea serrulata
dan Syringodium isoetifolium (Mayavu et al. 2009). Pada lamun terdapat banyak alga yang menempel hadir sebagai epifit pada daun lamun. Terdaftar ada 113 epifit dan 120 spesies makroalga teridentifikasi ditemukan di helaian daun lamun dan komunitas lamun di Florida.
Pada lingkungan perairan tumbuhan makrofita biasanya cepat terkoloni oleh mikroorganisma seperti bakteri dan mikroalga. Selanjutnya terjadi penempelan oleh makroalga dan invertebrata. Hal ini tidak akan terjadi jika makrofita tersebut memiliki mekanisme pertahanan kimia dan fisika Menurut Larkum 1989 bahwa jangka waktu hidup bagian-bagian yang berbeda dari lamun juga akan berakibat pada diversitas dan biomas dari endofit.
Mikroba endofit adalah mikroba yang hidup di dalam jaringan tanaman pada periode tertentu dan mampu hidup dengan membentuk koloni dalam jaringan tanaman tanpa membahayakan inangnya. Pada hubungan lamun dengan bakteri endofitnya terjadi hubungan simbisis mutualisme dimana lamun mendapatkan pertahanan diri yang berupa metabolit sekunder yang merupakan bahan bioaktif yang digunakan sebagai pertahanan terhadap patogen dan organisme fouling (Marhaeni 2009). Sedangkan untuk baketri endofitnya mendapatkan nutrisi dari lamun.
Biofouling adalah penempelan dan pertumbuhan organisme pada permukaan substrat abiotik maupun biotik yang berada di bawah permukaan air. Biofouling terdiri dari mikrofouling dan makrofouling. Mikrofouling adalah kolonisasi mikroorganisme yang terbawa arus sehingga menempel pada permukaan benda padat. Makrofouling merupakan akumulasi penempelan organisme berukuran besar seperti teritip, alga hijau, cacing kapal, kerang, dan tunikata yang menempel pada material padat seperti badan kapal dan juga pada bangunan pantai (Costerton et al., 1995).
Di lingkungan laut dijelaskan bahwa, mikroorganisme terutama bakteri yang mengkolonisasi permukaan struktur bersama dengan bahan organik partikulat lainnya membentuk lapisan film pada permukaan benda yang disebut sebagai biofilm. Tahap ini merupakan tahap primer dimana mikroorganisme berperan sebagai perintis bagi organisme penempel berikutnya yang umumnya berukuran lebih besar (Sabdono (2007).
Pada pengambilan bakteri dari biofilm menggunakan kayu sengon Kayu sengon digunakan karena kayu merupakan substrat hidrofobik Donlan (2002) juga menyebutkan bahwa beberapa peneliti menemukan kalau bakteri penempel lebih cepat tumbuh pada permukaan hidrofobik dibandingkan pada permukaan hidrofilik. Selain itu kayu merupakan perwakilan dari bahan yang digunakan untuk badan kapal.
Untuk meminimalisasi jumlah penempelan biomassa fouling, biasanya dengan melakukan proses pengecatan pada suatu material yang mengandung Tributyltin (TBT).
TBT merupakan senyawa organotin yang digunakan sebagai bahan antifouling pada cat kapal untuk mencegah penempelan biota laut pada dinding kapal (Pangabean et al., 2007). Fusetani (2004) melaporkan, bahan organotin (TBT) bersifat racun terhadap banyak organisme laut. TBT mempunyai daya toksik yang luas terhadap organisme.
Inilah yang menjadi dasar mengapa TBT sangat efektif dimanfaatkan sebagai antifouling. Efek toksik yang ditimbulkan umumnya mempunyai dampak yang lebih besar terhadap organisme yang muda dibandingkan organisme yang lebih tua. Selain itu senyawa TBT dilaporkan dapat merusak sistem kekebalan tubuh dan kinerja hormon (Cukkrowska et al., 2004). TBT dapat lepas ke dalam lingkungan dan terakumulasi dalam sedimen atau biota-biota perairan seperti ikan, kerang, cumi- cumi dan burung pemakan ikan, sehingga menyebabkan adanya pengaruh negatif pada kesehatan manusia karena sifat daya racun yang sangat tinggi (Belfroid et al., 2000).
Fent (1996) dan Alzieu and Herald (1984) mengatakan bahwa penggunaan TBT dapat mengakibatkan perubahan bentuk pada tiram, dapat mengganggu kesuburan larva kepah dan perubahan bentuk kelamin (imposex) pada gastropoda. TBT pada konsentrasi di bawah 1 ng/L dapat menyebabkan gejala imposex pada biota perairan (Ramaswamy et al., 2004). Oleh karena itu, perlu dilakukannya pencarian senyawa antifouling baru yang ramah lingkungan. Sehingga dilakukan penelitian tentang tekhnologi alternatif untuk menghambat aktivitas organisme penempel tersebut tanpa merugikan lingkungan. Salah satu alternatif yang dapat dikembangkan yaitu pemanfaatan bakteri yang bersimbiosis dengan tumbuhan lamun, khususnya Syringodium isoetifolium. Kemampuan bakteri simbion tumbuhan lamun dalam menghasilkan bahan bioaktif yang berfungsi sebagai pertahanan diri inangnya sehingga karakterisasi bakteri simbion endofit hampir sama menyerupai dari karakterisasi inangnya, sehingga dapat dijadikan alternatif pencarian bahan antifoulant yang ramah lingkungan. Penggunaan bakteri endofit ini juga agar tidak menyebabkan kepunahan dan kerusakan ekosistem lamun.
Berdasarkan uraian di atas maka perlu dilakukan identifikasi dengan pendekatan polifasik pada bakteri endofit lamun yang memiliki aktivitas antimikrofouling. Dengan pendekatan polifasik, kita dapat melihat Sehingga diharapkan dapat memberikan kontribusi sebagai senyawa bioaktif baru dari laut yang nantinya dapat dijadikan alternatif dari pemecahan masalah di atas.
1.2 Tujuan Khusus Penelitian
Tujuan dari penelitian ini adalah:
1. Identifikasi bakteri endofit lamun dengan pendekatan polifasik.
2. Deteksi keberadaan gen PKS – NRPS dari bakteri endofit lamun dan bakteri biofilm yang mempunyai aktivitas antibakteri.
1.3 Urgensi Penelitian
Salah satu permasalahan yang dihadapi adalah penempelan organisme fouling pada berbagai struktur di lingkungan laut telah menimbulkan banyak kerugian bagi pelaku industri kelautan. Hal ini memerlukan adanya pencarian solusi dengan mencari potensi bakteri endofit lamun terhadap penghambatan bakteri pembentuk biofilm.
Sehingga diharapkan bakteri yang bersimbiosis dengan tumbuhan lamun dapat memberikan kontribusi sebagai senyawa bioaktif baru dari laut yang nantinya dapat dijadikan alternatif dari pemecahan masalah tersebut.
1.4 Target Penemuan dan Kontribusi pada Ilmu Pengetahuan
Penelitian ini dimaksudkan untuk identifikasi dengan pendekatan polifasik bakteri endofit Lamun yang memiliki aktivitas antibakteri biofouling. Target dari penelitian ini adalah didapatkan jenis bakteri endofit yang memiliki aktivitas antibakteri terhadap bakteri biofouling, yang akan dikaji gen PKS-NRPSnya.
BAB 2. TINJAUAN PUSTAKA
2.1. Ladasan Ilmiah (State of the Art)
Biofouling adalah penempelan dan pertumbuhan organisme pada permukaan substrat abiotik maupun biotik yang berada di bawah permukaan air. Biofouling terdiri dari mikrofouling dan makrofouling. Mikrofouling adalah kolonisasi mikroorganisme yang terbawa arus sehingga menempel pada permukaan benda padat. Makrofouling merupakan akumulasi penempelan organisme berukuran besar seperti teritip, alga hijau, cacing kapal, kerang, dan tunikata yang menempel pada material padat seperti badan kapal dan juga pada bangunan pantai (Costerton et al., 1995).
Di lingkungan laut dijelaskan bahwa, mikroorganisme terutama bakteri yang mengkolonisasi permukaan struktur bersama dengan bahan organik partikulat lainnya membentuk lapisan film pada permukaan benda yang disebut sebagai biofilm. Tahap ini merupakan tahap primer dimana mikroorganisme berperan sebagai perintis bagi organisme penempel berikutnya yang umumnya berukuran lebih besar (Sabdono (2007).
Pada pengambilan bakteri dari biofilm menggunakan kayu sengon Kayu sengon digunakan karena kayu merupakan substrat hidrofobik Donlan (2002) juga menyebutkan bahwa beberapa peneliti menemukan kalau bakteri penempel lebih cepat tumbuh pada permukaan hidrofobik dibandingkan pada permukaan hidrofilik. Selain itu kayu merupakan perwakilan dari bahan yang digunakan untuk badan kapal.
Menurut Marhaeni (2009) proses biofouling secara lebih rinci memiliki 4 tahapan yaitu :
1. Fouling diawali oleh proses dari saat objek yang terendam di air. Permukaan objek ini secara cepat mengalami akumulasi materi organik terlarut dan molekul seperti polisakarida dan fragmen protein. Fase ini dinamakan fase conditioning.
2. Secara berangsur-angsur bakteri dan diatom bersel tunggal akan menempel pada permukaan dan mulai menetap disana, membentuk lapisan (film) mikroba.
Kemampuan sel bakteri melakukan penempelan pada permulaan ini dikontrol oleh dua faktor yaitu faktor lingkungan dan faktor genetik seperti kandungan nutrien, sensor lingkungan, daya lekat.
3. Setelah penempelan awal, sel mulai tumbuh dan mulai membentuk koloni.
Selama periode ini terjadi perubahan besar seperti pembentukan lapisan exopolysacharida (EPS). Hal ini membuktikan bahwa substansi EPS ini memegang peranan penting dalam siklus penempelan bakteri pada permukaan.
Kehadiran substansi pelekat dan koloni mikroba yang kasar dan bentuknya tidak teratur, berangsur-angsur mulai menangkap banyak partikel dan organisme lain.
4. Tahap terakhir adalah penempelan organisme laut lain seperti barnakel, tunikata, kerang-kerangan, bryozoa, dan polikaeta, bersama-sama dengan pertumbuhan alga. (Wahl 1989; Takasawa et al., 1992; Clare, 1996;). Gambar 5 dibawah ini menunjukkan terjadinya proses biofouling secara umum pada suatu substrat.
2.2. Bakteri Endofit
Radji (2005) menjelaskan bahwa mikroba endofit adalah mikroba yang hidup di dalam jaringan tanaman pada periode tertentu dan mampu hidup dengan membentuk koloni dalam jaringan tanaman tanpa membahayakan inangnya. Setiap tanaman tingkat tinggi dapat mengandung beberapa mikroba endofit yang mampu menghasilkan senyawa biologi atau metabolit sekunder yang berfungsi sebagai senyawa anti bakteri selain itu diduga sebagai akibat koevolusi atau transfer genetik dari tanaman inangnya ke dalam mikroba endofit.
Kemampuan bakteri endofit memproduksi senyawa metabolit sekunder sesuai dengan tanaman inangnya merupakan peluang yang sangat besar dan dapat diandalkan untuk memproduksi metabolit sekunder dari mikroba endofit yang diisolasi dari tanaman inangnya tersebut. Dari sekitar 300.000 jenis tanaman yang tersebar di muka bumi ini, masing-masing tanaman mengandung satu atau lebih mikroba endofit yang terdiri dari bakteri dan jamur (Strobel dan Daisy, 2003).
Menurut Marhaeni (2009) mikroba endofit yang diisolasi dari tumbuhan lamun yang menghasilkan bahan bioaktif telah diketahui memiliki aktivitas yang lebih besar, bahkan dapat memiliki aktivitas yang lebih besar dibandingkan aktivitas tumbuhan inangnya. Dilihat dari segi efisiensi, hal ini sangat menguntungkan karena siklus hidup mikroba endofit lebih singkat dibandingkan siklus hidup tumbuhan inangnya, sehingga dapat menghemat waktu yang dibutuhkan untuk mendapatkan senyawa tersebut dan jumlah senyawa yang diproduksi dapat dibuat dalam skala yang besar. Dengan cara mengisoasi bakteri endofit tersebut lalu mengekstraknya.
Keuntungan lain yang dapat diperoleh yaitu menjaga kelestarian tumbuhan tersebut agar tidak dieksploitasi secara terus menerus yang akhirnya akan mengakibatkan kerusakan ekosistem laut dan kepunahan.
2.3. Bakteri Biofilm
Lappinscott et al. (1992) menyatakan bahwa susunan biofilm terbentuk saat mikroorganisme melekat pada suatu permukaan benda di perairan dan memproduksi
eksopolisakarida yang membantu dalam proses pelekatan pada permukaan. Proses pelekatan memberikan keuntungan bagi bakteri untuk hidup dalam kumpulan biofilm, termasuk untuk berlindung dari zat antimikroba. Salah satu eksopolisakarida yang diproduksi oleh bakteri pembentuk biofilm adalah glycocalyx. Bakteri tumbuh dan bekembang dalam glycocalyx membentuk mikrokoloni dan dengan cepat akan membentuk lapisan biofilm. Lappinscott et al. (1992) juga menyatakan bahwa berbagai faktor dapat mempengaruhi pelekatan bakteri pada permukaan suatu struktur, di antaranya adalah ketersediaan nutrisi, konsentrasi dari nutrien, pH, temperatur, konsentrasi elektrolit, aliran pada permukaan struktur, dan permukaan struktur itu sendiri. Banyaknya jenis bakteri yang melekat pada suatu permukaan tergantung pada faktor fisika-kimia seperti muatan elektrostatik, energi bebas permukaan, hidrofobisitas, dan kekasaran permukaan struktur.
Ong et al. (1990) mengemukakan bahwa pada beberapa bakteri mempunyai organel yang disebut holdfast. Holdfast digunakan oleh bakteri dalam memperkuat pelekatan pada permukaan suatu struktur. Sedangkan menurut Donlan (2002), pelekatan bakteri biofilm dibantu dengan fimbriae yang juga berperan dalam peningkatan hidrofobisitas sel terhadap permukaan struktur.
Biofilm secara luas bisa menyebabkan kerusakan bangunan pantai. Biofilm yang melekat pada pipa logam dapat menyebabkan korosi, sedangkan pada kayu bisa menyebabkan pelapukan. Biofouling dibagi menjadi microfouling biofilm formasi dan bakteri adhesion macrofouling adalah penyebab penempelan yang disebabkan oleh organisme yang lebih besar seperti barnacles, mussels, polychaeta, bryozoans, dan rumput laut. Bersama-sama, organisme ini membentuk sebuah komunitas fouling (Lavery, 2000).
2.4. Identifikasi Molekuler Bakteri 2.4.1. Polyketide Synthase (PKS)
Poliketida dikenal baik sebagai bagian dari jenis metabolit sekunder yang dihasilkan mikroorganisme, termasuk di dalamnya adalah agen antitumor dan antibiotik yang sangat bernilai secara medis.Poliketida tersebut merupakan senyawa bioaktif yang disintesa oleh enzim multifungsional besar yang dinamakan Polyketide Synthase (PKS) (Otsuka et al., 2004). PKS juga merupakan enzim besar yang multifungsional dengan organisasi modular. Persyaratan minimal yang dibutuhkan oleh PKS ialah tiga domain, yaitu domain acyl transferase (AT), domain ketosynthase (KS), dan domain acyl carier protein (ACP) (Otsuka et al. 2004, Xiao et al. 2006, Zucko et al.
2007).
2.4.2. Non Ribosomal Peptide Synthetase (NRPS)
Sama dengan halnya poliketida, peptida non ribosomal juga merupakan salah satu jenis metabolit sekunder yang dihasilkan bakteri yang penggunaannya dalam dunia medis sangat terkenal . Beberapa contoh antibiotik yang termasuk kedalam kelompok peptida non-ribosom adalah surfaktin, basitrasin, gramisidin, vankomisin dan siklosporin (Dewick, 2002). Watanabe (2006) menambahkan selain memiliki senyawa bioaktif yang bermanfaat sebagai antibiotik, metebolit sekunder yang dihasilkan juga bermanfaat sebagai immunosuppressive (cyclosporin A), antivirus (luzopeptin A), dan antitumor (echinomysin dan triostin A). Kemampuan suatu bakteri untuk mensintesa peptida non ribosomal juga dapat diketahui dengan menggunakan metode PCR. Sekuen yang diamplifikasi adalah sekuen yang menghasilkan enzim NRPS.
Road Map Penelitian
Gambar 1. Roadmap Penelitian Penelitian yang
sudah dilakukan / sedang
berlangsung
3. Skrining Bakteri Endofit Lamun Syringodium isoetifolium dengan Aktivitas Antimikrofouling Dari Perairan Jepara
4. Skrining Bakteri Endofit Lamun Enhalus sp. Dengan Aktivitas Antimikrofouling Dari Perairan Lampung
Tahun II (2021)
Kegiatan Luaran
2. Publikasi di Jurnal Nasional Sinta 4 (2012)
Karakterisasi senyawa bioaktif ekstrak bakteri endofit Lamun.
1. Jurnal nasional(Sinta 4) 2. Seminar nasional Tahun I (2020) Identifikasi Dengan Pendekatan Polifasik
Pada Bakteri Endofit Lamun Yang
Memiliki Aktivitas Antimikrofouling Dari Perairan Lampung
1. Jurnal nasional(Sinta 4) 2. Seminar nasional
Potensi sebagai antifouling
Identifikasi dengan pendekatan polifasik pada bakteri endofit Lamun yang memiliki aktivitas
antimikrofouling
Penelitian yang sudah dilakukan / sedang
berlangsung
1. Skrining Bakteri Endofit Lamun Syringodium isoetifolium dengan Aktivitas Antimikrofouling Dari Perairan Jepara (2011)
2. Skrining Bakteri Endofit Lamun Enhalus sp. Dengan Aktivitas Antimikrofouling Dari Perairan Lampung (2019)
Tahun II (2021)
Kegiatan Luaran
1. Publikasi di Jurnal Nasional Sinta 4 (2012)
2021 (Perairan Lampung dan Lab. Bioteknologi Fakultas Pertanian Universitas Lampung)
BAB 3. METODE PENELITIAN
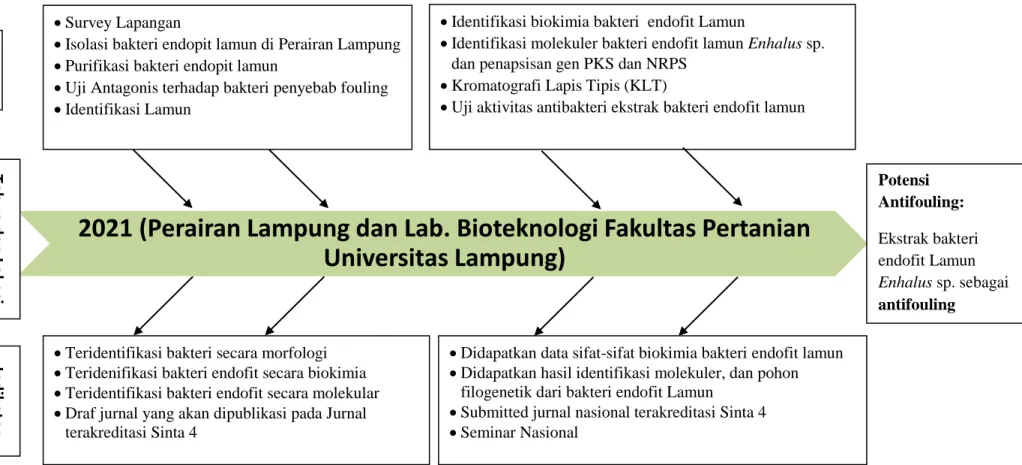
3.1. Diagram Alir Metode Penelitian (Fishbone Diagram)
Gambar 2. Fishbone diagram Metode Penelitian Kegiatan Indikator dan Luaran
Potensi Antifouling:
Ekstrak bakteri endofit Lamun Enhalus sp. sebagai antifouling
Tahun dan LokasiPenelitian
Survey Lapangan
Isolasi bakteri endopit lamun di Perairan Lampung
Purifikasi bakteri endopit lamun
Uji Antagonis terhadap bakteri penyebab fouling
Identifikasi Lamun
Identifikasi biokimia bakteri endofit Lamun
Identifikasi molekuler bakteri endofit lamun Enhalus sp.
dan penapsisan gen PKS dan NRPS
Kromatografi Lapis Tipis (KLT)
Uji aktivitas antibakteri ekstrak bakteri endofit lamun
Teridentifikasi bakteri secara morfologi
Teridenifikasi bakteri endofit secara biokimia
Teridentifikasi bakteri endofit secara molekular
Draf jurnal yang akan dipublikasi pada Jurnal terakreditasi Sinta 4
Didapatkan data sifat-sifat biokimia bakteri endofit lamun
Didapatkan hasil identifikasi molekuler, dan pohon filogenetik dari bakteri endofit Lamun
Submitted jurnal nasional terakreditasi Sinta 4
Seminar Nasional
3.2. Pengambilan Sampel
Pengambilan sampel tumbuhan lamun dilakukan dengan cara lamun S. isoetifolium dipotong menggunakan cutter. Selanjutnya sampel dimasukkan ke dalam plastik lalu disimpan dalam cool box. Sampel selanjutnya disemprot dengan air laut steril untuk membersihkan bakteri perairan yang menempel pada permukaannya. Bagian yang diambil dari lamun S. isoetifolium semua bagian lamun tersebut.
3.3. Isolasi dan Purifikasi Bakteri Endofit Lamun dan Bakteri Biofilm.
Pengambilan bakteri endofit lamun. Daun lamun dibersihkan dan disemprot dengan air laut steril, dan disemprot juga dengan alkohol 70 %. Kemudian daun ini dibelah secara membujur sehingga bagian dalam daun dapat terlihat, setelah itu bagian dalam ini disemprot dengan air laut steril dan diletakkan pada petri yang berisi media agar dengan bagian dalam daun menghadap ke arah agar. Setelah itu dilakukan inkubasi selama 2x24 jam untuk mendapatkan biakan bakteri endofit (Strobel and Daisy,2003;
Kumala, 2007). Pengambilan bakteri biofilm dilakukan dengan cara melakukan penjebakan bakteri biofilm dilakukan dengan menggunakan 4 buah kayu sengon. Kayu sengon digunakan karena kayu merupakan substrat hidrofobik Donlan (2002) juga menyebutkan bahwa beberapa peneliti menemukan kalau bakteri penempel lebih cepat tumbuh pada permukaan hidrofobik dibandingkan pada permukaan hidrofilik.
3.4. Uji antagonis bakteri endofit Lamun
Proses selanjutnya yaitu uji aktivitas antibakteri biofouling menggunakan metoda difusi agar dengan menyiapkan seri konsentrasi ekstrak mikroba simbion Reniera sp.
masing-masing 15µg/disk, dan 150 µg/disk. Kemudian dilakukan uji aktivitas antibakteri terhadap strain bakteri MDR Staphylococcus aureus dan Escherichia coli.
3.5. Ekstraksi
Ekstraksi bakteri endofit lamun dilakukan dengan merendam tiap jenis bakteri dengan larutan metanol selama 24 jam sebanyak 3 kali. Pada bakteri simbion spons disentrifius untuk memperoleh pellet yang selanjutnya dimaserasi dengan pelarut metanol. Pada jamur simbion yang diekstrak adalah miseliumnya.
3.6. Identifikasi Molekuler
3.6.1. Ekstraksi DNA dan Amplifikasi PCR
Ekstraksi DNA pada bakteri dan jamur dilakukan menggunakan metode chelex 100.
Pemilihan metode ini karena dirasa lebih mudah dan cepat. Ekstraksi dimulai dengan menanam mikroba pada media yang baru lalu diinkubasi selama 1x24 jam.
3.6.2. Elektroforesis
Prinsipnya elektroforesis adalah teknik pemisahan campuran molekul yang didasarkan pada perbedaan muatan listriknya sehingga pergerakan molekul-molekul tersebut pada suatu fase diam (stationary phase) dalam sebuah medan listrik akan berbeda-beda.
3.6.3. Sekuensing DNA
Sekuensing dilakukan untuk melihat susunan basa yang membentuk sekuens DNA.
Proses sekuensing dilakukan dengan menggunakan pewarna Big Dye terminator V3.1 dan automated DNA seqencer ABI 3130 XL Genetic Analyzer Apllied Biosystem.
BAB 4. BIAYA DAN JADWAL PENELITIAN
4.1. Anggaran Biaya
Pengadaan Alat dan Bahan
Material Justifikasi Pemakaian
Kuantitas Harga Satuan (Rp)
Harga Total (Rp)
Metanol tehnis Ekstraksi 20 L 40.000,- 800.000
Alkohol 70% Sterilisasi 1 L 25.000,- 25.000
Kapas steril Uji antibakteri 1 kg 130.000,- 130.000 Aluminium voil Uji antibakteri 4 pcs 35.000,- 140.000 Isolat Bakteri Uji Antibakteri 2 isolat 275.000,- 550.000 Media Nutrien Agar Uji antibakteri 500 gr 1.379.000,- 1.379.000 Media Nutrien Broth Uji antibakteri 500gr 1.185.000,- 1.185.000
Masker hidung Ekstraksi 1 pack 25.000,- 25.000
Yellow Tip Uji Antibakeri 1 pack 95.000,- 95.000
Blue Tip Uji Antibakeri 1 pack 85.000,- 85.000
Appendof Tempat
Konsentrasi
1 pack 150.000,- 150.000
Jangka Sorong Uji Antibakteri 1 buah 170.000,- 170.000
Pipet tetes plastik Uji antibakteri 2 buah 3.000,- 6.000
Paperdish Uji Antibakteri 4 Pack 388.750,- 1.555.000
Botol Infus Uji Toksisitas 45 pcs 20.000,- 900.000
Kertas Saring Ekstraksi 5 lembar 30.000,- 150.000
Botol Vial Tempat Ekstrak 50 pcs
3000,-
150.000 150.000
Ident Molekuler PCR 2 sampel 500.0000,- 1.000.000
SUB TOTAL (Rp) 7.700.000
ATK/BHP
Material Justifikasi Bahan Kuantitas Harga Satuan (Rp)
Harga Total (Rp)
Kertas HVS Laporan 4 rim 50.000,- 200.000
Alat Tulis Kantor ATK
Laporan 1 paket 500.000,- 500.000
Tinta Cetak 4 botol 150.000,- 600.000
SUB TOTAL (Rp) 1.300.000
Travel Expenditure Material
Justifikasi Perjalanan
Kuantitas
Harga Satuan (Rp)
Harga Total (Rp)
Sampling ke Ketapang
Sewa Kendaraan
2x
500.000, -
1.000.000
Seminar Nasional Tiket 2 orang PP 750.000,- 1.500.000
SUB TOTAL (Rp) 2.500.000
Laporan/Diseminasi/Publikasi
Kegiatan Justifikasi Kuantitas
Harga Satuan
Harga Total (Rp)
Laporan Laporan 10 buah 50.000,- 500.000
Publikasi Internasional
Jurnal 1 buah 3.000.000,- 3.000.000
SUB TOTAL (Rp) 3.500.000
TOTAL PENGGUNAAN DANA (Rp) 15.000.0000
4.2. Jadwal Penelitian
No Jenis Kegiatan Tahun 2020
1 2 3 4 5 6 7 8 9 10 11 12 1 Survey Lapangan
2 Pengambilan sampel Lamun dan isolasi bakeri endofit lamun
3 Uji antagonis terhadap bakteri penyebab fouling
4 Identifikasi Biokimia bakteri endofit lamun
5 Identifikasi Molekular bakteri endofit lamun
6 Analisa data
7 Penyusunan dan penyerahan laporan kemajuan
8 Penyusunan dan penyerahan laporan akhir
DAFTAR PUSTAKA
Arlyza, I S. 2009. Ekstrak Lamun Sebagai Sumber Alternatif Antibakteri Penghambat Bakteri Pembentuk Biofilm. Pusat Penelitian Oseanografi, LIPI: Jakarta.
Armstrong, E., G, Boyd and J. Burgess. 2000. Prevention of marine biofouling using natural compounds from marine organisms. Biotechnology Annual Review. Volume 6.
Elsevier Science.
Belfroid, A., C. Purperhart, M. and F. Ariese, 2000, Organotin Levels in Seafood, Marine Poll Bull., 40, 226-232.
Callow, M.E. dan J.A., Callow. 2002. Marine Biofouling : a Sticky Problem. Biologist, 49(1):1-5.
Costerton, J.W. 1999. Antifouling. Opportunities for Environmental Applications of Marine Biotechnology: 8 – 13.
Cukkrowska, E., L. Chimuka, H. Nsengimana, and V. Kwaramba, 2004, Application of Supported Liquid Membrane Probe for Extraction and Preconcentration of Organotin Compounds from Environmental Water Samples, Anal. Chim. Acta, 523, 141-147.
Dewick, PM. 2002. Medicinal Natural Products. 2nd
edition. University of Nottingham, UK: Jhon Wiley & Sons Ltd.
Donlan, R.M. 2002. Biofilm : Microbial Live in Surface. Emerg. Infect. Dis. 8(9):881- 890.
Fent, K. (1996): Ecotoxicology of organotin compounds. Crit. Rev. Toxicol., 26(1), 1–
117.
Fusetani N (2004) Biofouling and antifouling. Nat Prod Rep 21:94–104.
Handojo, L. 1995. Teknologi Kimia Bagian 2. Pradnya Paramita, Jakarta, 217 hlm Harborne. J.B.,1987. Metode Fitokimia , terjemahan K. Radmawinata dan I.
Heriansjah, M. 2007. Studi Awal Kerusakan Hoseline Submarine HSD PLTGU Muara Tawar Bekasi Jawa Barat. Seminar Nasional Fakultas Teknologi Kelautan.
Program Magister Bidang Keahlian Rekayasa Energi. Institut Teknologi Sepuluh Nopember: Surabaya.
Kumala, S, E B Siswanto. 2007. Isolation and Screening of Endophytic Microbes from Morinda ciliforia and their Ability to Produce Anti Microbial Substance. Microbial Indones. 1 (3): 145 – 148.
Lanyon, J. 1986. Guide to Identification of Seagrass in The Great Barrier Reef Region.
GBR. Mar. Park. Auth. Spec. Publ. Ser. (3). Queensland. Australia. III. 54 hlm.
Lappin,H., Scott, Costerton, J. W., dan Marrie, T., J. 1992. Encyclopedia of Microbiology: Biofilm and Biofouling. New York: Acedemy Press, Inc.
Lavery, Brian. 2000.Perlengkapan Kapal Perang Inggris dari 1600 - 1815. Conway Maritime Press. ISBN 0-85177-451-2
Marahiel M.A and Finking Robert. 2004. BIOSYNTHESIS OF NONRIBOSOMAL PEPTIDES. Philipps-Universit¨at Marburg, Fachbereich Chemie/Biochemie, Hans- Meerwein-Strasse, 35043 Marburg, Germany. 40 pp
Marhaeni, B. 2009. Ekobiologi Biofouling dan Potensi Bakteri SimbionTumbuhan Lamun sebagai Penghasil Antifoulant Alami. [Disertasi]. Sekolah Pascasarjana Institut Pertanian Bogor, Bogor. 101 hlm.
Marhaeni,B. Radjasa, O.K., Khoeri, M.M., Sabdono,A., Bengen D.G., Sudoyo H. 2011.
Antifouling Activity of Bacterial Symbionts of Seagrasses Againt Marine Biofilm- Forming Bacteria. Graduate School of Marine Sciences, Bogor Agricultural University.
Bogor. Indonesia.
Maxey IV, C.E. 2006. Occurrence and Distribution of Irganol 1051 and its Natural Metabolites in Biotic and Abiotic Marine Samples, having been approved in respect to style and intellectual content, is referred to you for judgment. Florida International University.
Ong, C.J., M.l.Y. Wong and J. Smit. 1990. Attachment of the Adhesive HoldfastOrganelle to the Cellular Stalk of Caulobacter crescentus. J. Bacteriol.,172(3):1448-1456.
Oscar, R.R.,E.B.Charles,K.C Jr. Allen. 1990. Organic Chemistry Laboratory.Standard and Microscale Exsperiments. Saunders College Publishing. United State. USA.
Otsuka M., Ichinose K., Fujii I., and Ebizuka Y. 2004. Cloning, Sequencing, and Functional Analysis of an Iterative Type I Polyketide Synthase Gene Cluster for Biosynthesis of the Antitumor Chlorinated Polyenone Neocarzilin in Streptomyces carzinostaticus.
Antimicrob Agents Chemother 48 (9). 3468–3476.
Panggabean, A. S., M. B. Amran, Buchari., and S. Achmad, 2007. Modified Gas- Liquid Separation for the Determination of Sn(II) with Hydride Generation- Quartz Furnace Atomic Absorption Spectrophotometry (HGQFAAS), Proc. International Conference On Chemical Sciences (ICCS-2007) UGM-USM, Yogyakarta ANL/46-1.
Radji, Maksum. 2005. Peranan Bioteknologi dan Mikroba Endofit Dalam Pengembangan Obat Herbal. Majalah Ilmu Kefarmasian. II (3): 113 – 126.
Ramaswamy, B. J., H. Tao, and M. Hojo, 2004, Contamination and Biomethylation of Organotin Compounds in Pearl/Fish Culture Areas in Japan, Anal.
Sci., 20, 45-53.
Romimohtarto, K, damn Juwana. 1999. Biologi Laut Ilmu dan PengetahuanTntang Biologi Laut. Jakarta: Djambatan, xi. 540 hlm.
Sabdono, A. 2007. Pengaruh Ekstrak Antifouling Bakteri Karang Pelagiobacter variabilis Strain USP3.37 terhadap Penempelan Barnakel. [Lap. Pen] Jurusan I lmu Kelautan. Fakult as Per ikanan dan I lmu Kelautan. Univer sit as Dipo negoro. 18 – 23 hlm.
Sammarco P.W., and J.C. Coll, 1992. Chemical adaptation in the Octocorallia:
Evolutionary considerations. Mar. Ecol. Prog. Ser. 88:93-104
Strobel GA., and B. Daisy .2003. Bioprospecting for Microbial Endophytes andTheir Natural Products. Microbiol. Mol. Biol. Rev. 67(4): 491-502.
Watanabe, Kenji. Kinya H., Alex P.P., Kento K., Akira M., Christopher N.B., Clay C.
C. Wang, Hiroki O., Hideaki O., 2006. Total biosynthesis of antitumor nonribosomal peptides in Escherichia coli. Chem Bio 2:423-428.
Zucko J, Skunca N, Curk, Zupans B, Long PF. et al. 2007. Polyketide synthase genes and the natural products potential of Dyctiostelium discoideum. Bioinformatic 23 :2543- 2549.
Xiao HC, Vater J, Piel J, Franke P, Scholz R. et al. 2006. Structural and functional characterization of three polyketide synthase genes clusters in Bacillus amyloliquefaciens FZB 42. J Bacteriol 188 :4024-4036