BAB II
TINJAUAN PUSTAKA
2.1 Domperidone 2.1.1 Sifat fisikokimia
Menurut British Pharmacopeia (2009), sifat fisikokimia domperidone adalah sebagai berikut:
Rumus struktur :
Gambar 1 Struktur domperidone
Nama Kimia : 5-kloro-1-[1-[3-(2-okso-2,3-dihidro-1H-benzimidazol-1-il) propil]piperidin-4-il]-1,3-dihidro- 2H-benzimidazol-2-on Rumus Molekul : C22H24ClN5O2
Berat Molekul : 425,9
Pemerian : Serbuk putih atau hampir putih
Kelarutan : Praktis tidak larut dalam air, larut dalam dimetilformamida, agak sukar larut dalam etanol (96%) dan dalam metanol. 2.1.2 Farmakologi
Zone) ke pusat muntah yang terdapat di sumsum-sambung (medulla oblongata) (Tan dan Rahardja, 2007).
2.2 Kromatografi
Kromatografi merupakan suatu proses pemisahan yang mana analit-analit dalam sampel terdistribusi antara dua fase, yaitu fase diam dan fase gerak. Fase diam dapat berupa bahan padat atau dalam bentuk molekul kecil atau dalam bentuk cairan yang dilapiskan pada pendukung padat atau dilapiskan pada dinding kolom. Fase gerak dapat berupa gas atau cairan (Rohman, 2009).
Saat ini kromatografi merupakan teknik pemisahan yang paling umum dan paling sering digunakan dalam bidang kimia analisis kualitatif, kuantitatif, atau preparatif dalam bidang farmasi, lingkungan, industri, dan sebagainya. Kromatografi merupakan suatu teknik pemisahan yang menggunakan fase diam (stationary phase) dan fase gerak (mobile phase) (Gandjar dan Rohman, 2007). 2.2.1 Penggunaan Kromatografi
Menurut Gritter, dkk., (1985) penggunaan kromatografi adalah sebagai berikut: - Pemakaian untuk tujuan kualitatif mengungkapkan ada atau tidak adanya senyawa tertentu dalam cuplikan.
- Pemakaian untuk tujuan kuantitatif menunjukkan banyaknya masing-masing komponen campuran.
- Pemakaian untuk tujuan preparatif untuk memperoleh komponen campuran dalam jumlah memadai dalam keadaan murni.
2.2.2 Klasifikasi Kromatografi
dibedakan menjadi : (a) kromatografi adsorbsi; (b) kromatografi partisi; (c) kromatografi pasangan ion; (d) kromatografi penukar ion (e) kromatografi eksklusi ukuran dan (f) kromatografi afinitas (Johnson dan Stevenson, 1977; Rohman, 2009).
Berdasarkan pada alat yang digunakan, kromatografi dapat dibagi atas: (a) kromatografi kertas; (b) kromatografi lapis tipis, yang kedua sering disebut kromatografi planar; (c) kromatografi cair kinerja tinggi (KCKT) dan (d) kromatografi gas (KG) (Johnson dan Stevenson, 1977; Rohman, 2009).
2.3 Kromatografi Cair Kinerja Tinggi
Kromatografi cair kinerja tinggi (KCKT) merupakan sistem pemisahan dengan kecepatan dan efisiensi yang tinggi. Hal ini karena didukung oleh kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang sangat sensitif dan beragam. KCKT mampu menganalisa berbagai cuplikan secara kualitatif maupun kuantitatif, baik dalam komponen tunggal maupun campuran (Ditjen POM, 1995).
KCKT merupakan teknik pemisahan yang diterima secara luas untuk analisis dan pemurnian senyawa tertentu dalam suatu sampel pada sejumlah bidang antara lain: farmasi, lingkungan dan industri-industri makanan (Munson, 1984).
2.3.1 Jenis KCKT
Berdasarkan pada kedua pemisahan ini, sering kali KCKT dikelompokkan menjadi KCKT fase normal dan KCKT fase terbalik. Berdasarkan mekanisme interaksi antara analit dengan fase diam, kromatografi cair dapat dibagi menjadi 4 metode, yakni: kromatografi fase normal (normal phase chromatography) atau disebut juga kromatografi adsorpsi (adsorption chromatography), kromatografi fase balik (reversed-phase chromatography), kromatografi penukar ion (ion-exchange chromatography) dan kromatografi eksklusi ukuran (size-exclusion chromatography) (Gandjar dan Rohman, 2007).
Kromatografi fase balik menggunakan fase diam dari silika yang dimodifikasi secara kimiawi. Fase diam yang paling popular digunakan adalah oktadesilsilan (ODS atau C18) yang relatif non polar sedangkan fase geraknya relatif lebih polar daripada fase diam. Kondisi kepolaran kedua fase ini merupakan kebalikan dari kromatografi fase normal sehingga disebut kromatografi fase balik (Meyer, 2010).
2.3.2 Proses Pemisahan dalam Kolom Kromatografi Cair
Pemisahan analit dalam kolom kromatografi berdasarkan pada aliran fase gerak yang membawa campuran analit melalui fase diam dan perbedaan interaksi analit dengan permukaan fase diam sehingga terjadi perbedaan waktu perpindahan setiap komponen dalam campuran (Meyer, 2010).
Gambar 2 Ilustrasi proses pemisahan yang terjadi di dalam kolom KCKT (Meyer, 2010)
Masuknya eluen (fase gerak) yang baru ke dalam kolom akan menimbulkan kesetimbangan baru, molekul sampel dalam fase gerak diadsorpsi sebagian oleh permukaan fase diam berdasarkan pada koefisien distribusinya, sedangkan molekul yang sebelumnya diadsorpsi akan muncul kembali di fase gerak (Gambar 2). Setelah proses ini terjadi berulang kali, kedua komponen akan terpisah. Komponen ● yang lebih suka dengan fase gerak akan berpindah lebih cepat daripada komponen ▲ yang cenderung menetap di fase diam, sehingga komponen ● akan muncul terlebih dahulu dalam kromatogram, kemudian diikuti oleh komponen ▲ (Meyer, 2010).
2.3.3 Parameter Penting dalam Kromatografi Cair 2.3.3.1 Tinggi dan Luas Puncak
puncak dipengaruhi oleh banyak faktor seperti misalnya faktor tambat, suhu kolom serta cara injeksi sampel (Ornaf dan Dong, 2005).
2.3.3.2 Waktu tambat
Periode waktu antara penyuntikan sampel dan puncak maksimum yang terekam oleh detector disebut sebagai waktu tambat/retention time (tR). Waktu tambat dari suatu komponen yang tidak ditahan/dihambat oleh fase diam disebut sebagai waktu hampa/void time (t0). Waktu tambat merupakan fungsi dari laju alir fase gerak dan panjang kolom. Jika fase gerak mengalir lebih lambat atau kolom semakin panjang, waktu hampa dan waktu tambat akan semakin besar, dan sebaliknya bila fase gerak mengalir lebih cepat atau kolom semakin pendek, maka waktu hampa dan waktu tambat akan semakin kecil (Meyer, 2010).
2.3.3.3 Faktor Kapasitas
Waktu tambat dipengaruhi oleh laju alir, ukuran kolom dan parameter yang lain. Oleh karena itu, diperlukan suatu ukuran derajat tambatan dari analit yang lebih independen yaitu faktor kapasitas (k’). Faktor kapasitas dihitung dengan membagi waktu tambat bersih (t’R) dengan waktu hampa (t0) seperti yang dapat dilihat pada rumus berikut ini (Ornaf dan Dong, 2005).
Faktor tambat yang disukai berada diantara nilai 1 hingga 10. Jika nilai k terlalu kecil menunjukkan bahwa analit terlalu cepat melewati kolom sehingga tidak terjadi interaksi dengan fase diam dan oleh karena itu tidak akan muncul dalam kromatogram. Sebaliknya nilai k yang terlalu besar mengindikasikan waktu analisis akan panjang (Meyer, 2010).
Faktor kapasitas dipengaruhi oleh perbandingan komposisi fase gerak yang digunakan sehingga akan dihasilkan resolusi dan waktu retensi dari puncak-puncak kromatogram yang berbeda pada setiap perbandingan komposisi fase gerak (Snyder, dkk., 2010).
2.3.3.4 Selektivitas
Kemampuan system kromatografi dalam memisahkan/membedakan analit yang berbeda dikenal sebagai selektivitas (α). Selektivitas umumnya tergantung
pada sifat analit itu sendiri, interaksinya dengan permukaan fase diam serta jenis fase gerak yang digunakan (Meyer, 2010).
Selektivitas ditentukan sebagai rasio perbandingan dua faktor kapasitas dari analit yang berbeda. Selektivitas ditentukan dengan rumus sebagai berikut:
Nilai selektivitas yang didapatkan dalam sistem KCKT harus lebih besar dari 1 (Ornaf dan Dong, 2005).
2.3.3.5 Efisiensi Kolom
Nilai lempeng akan semakin tinggi jika ukuran kolom semakin panjang, hal ini berarti proses pemisahan yang terjadi semakin baik. Hubungan proporsionalitas antara nilai lempeng dengan panjang kolom disebut sebagai nilai HETP/High Equivalent of a Theoretical Plate. Pengerjaan HPLC yang baik adalah mendapatkan nilai HETP yang kecil untuk nilai N yang maksimum dan efisiensi kolom yang tertinggi (Snyder, dkk., 2010).
Parameter yang dapat mempengaruhi nilai lempeng antara lain waktu tambat puncak, ukuran partikel kolom, laju alir fase gerak, suhu kolom, viskositas fase gerak dan berat molekul analit. FDA (Food and Drug Administration) merekomendasikan agar tiap analisis KCKT yang valid mempunyai nilai lempeng lebih besar dari 2000 (Meyer, 2010).
2.3.3.6 Resolusi
Resolusi merupakan derajat pemisahan dari dua puncak analit yang bersebelahan (Ornaf dan Dong, 2005).
2.3.3.7 Faktor Ikutan dan Faktor Asimetri
Puncak kromatogram dalam kondisi ideal akan memperlihatkan bentuk Gaussian dengan derajat simetris yang sempurna (Ornaf dan Dong, 2005). Namun kenyataannya dalam praktik kromatografi, puncak yang simetris secara sempurna jarang dijumpai. Jika diperhatikan dengan cermat, maka hampir setiap puncak dalam kromatografi memperlihatkan tailing dalam derajat tertentu (Dolan, 2003).
Gambar 3 Tiga jenis puncak (Meyer,2010)
Ada dua cara yang digunakan untuk pengukuran derajat asimetris puncak, yakni faktor ikutan dan faktor asimetri. Faktor ikutan/tailing factor (Tf) seperti yang diterangkan dalam Farmakope Amerika Serikat Edisi Ketiga puluh dihitung dengan menggunakan lebar puncak pada ketinggian 5% (W0,05), rumusnya dituliskan sebagai berikut:
Dengan nilai a dan b merupakan setengah lebar puncak pada ketinggian 5% seperti yang ditunjukkan pada Gambar 4.
Sementara itu, faktor asimetri/asymmetry factor(As) dihitung dengan rumus sebagai berikut:
Namun nilai a dan b dalam perhitungan faktor asimetri merupakan setengah lebar puncak pada ketinggian 10% seperti yang ditunjukkan di Gambar 4. Jika nilai a sama dengan b, maka faktor ikutan dan asimetri bernilai 1. Kondisi ini menunjukkan bentuk puncak yang simetris sempurna (Dolan, 2003). Bila puncak berbentuk tailing, maka kedua faktor ini akan bernilai lebih besar dari 1 dan sebaliknya bila puncak berbentuk fronting, maka faktor ikutan dan asimetri akan bernilai lebih kecil dari 1 (Hinshaw, 2004).
2.3.4 Instrumen KCKT
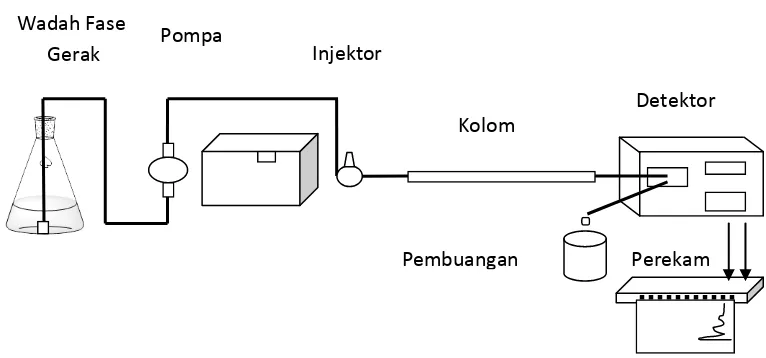
Instrumen KCKT tersusun atas 6 bagian dasar, yakni wadah fase gerak (reservoir), pompa (pump), tempat injeksi sampel (injector), kolom (coloumn), detector (detector) dan perekam (recorder) (McMaster, 2007). Ilustrasi instrument dasar KCKT dapat dilihat pada Gambar 5.
Gambar 5 Instrumen Dasar KCKT (McMaster, 2007)
Injektor Pompa
Wadah Fase
Gerak
Detektor
Perekam Pembuangan
2.3.4.1 Wadah Fase Gerak
Wadah fase gerak harus bersih dan lembam (inert). Wadah pelarut kosong ataupun labu laboratorium dapat digunakan sebagai wadah fase gerak. Wadah ini biasanya dapat menampung fase gerak antara 1 sampai 2 liter pelarut. Fase gerak sebelum digunakan harus dilakukan degassing (penghilangan gas) yang ada pada fase gerak, sebab adanya gas akan berkumpul dengan komponen lain terutama dipompa dan detektor sehingga akan mengacaukan analisis (Gandjar dan Rohman, 2007).
2.3.4.2 Pompa
Pompa yang cocok digunakan untuk KCKT adalah pompa yang mempunyai syarat sebagaimana syarat wadah pelarut yakni : pompa harus inert terhadap fase gerak. Bahan yang umum dipakai untuk pompa adalah gelas, baja tahan karat, teflon, dan batu nilam. Pompa yang digunakan sebaiknya mampu memberikan tekanan sampai 6000 psi dan mampu mengalirkan fase gerak dengan kecepatan alir 0,1-10 ml/menit. Tujuan penggunaan pompa atau sistem penghantaran fase gerak adalah untuk menjamin proses penghantaran fase gerak berlangsung secara tepat, konstan dan bebas dari gangguan. Ada dua jenis pompa dalam KCKT yaitu: pompa dengan tekanan konstan dan pompa dengan aliran fase gerak yang konstan. Tipe pompa dengan aliran fase gerak yang konstan sejauh ini lebih umum dibandingkan dengan tipe pompa dengan tekanan konstan (Gandjar dan Rohman, 2007).
2.3.4.3 Injektor
a. Hentikan aliran/stop flow
Aliran dihentikan, injeksi dilakukan pada sistem tertutup dan aliran dilanjutkan lagi. Teknik ini bisa digunakan karena difusi di dalam aliran kecil dan resolusi tidak dipengaruhi.
b. Septum
Injektor-injektor langsung ke aliran fase gerak, umumnya sama dengan yang digunakan pada kromatografi gas. Injektor ini dapat digunakan pada kinerja sampai 60-70 atmosfir. Tetapi septum ini tidak tahan dengan semua pelarut-pelarut kromatografi cair. Di samping itu, partikel kecil dari septum yang terkoyak (akibat jarum injektor) dapat menyebabkan penyumbatan.
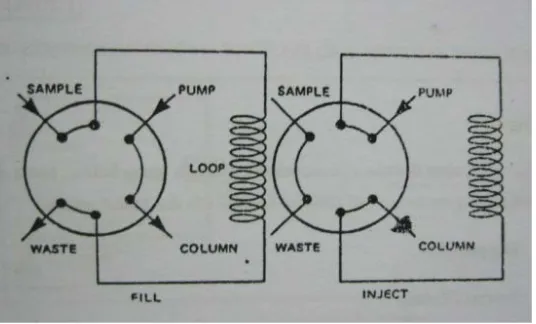
c. Katup putaran (loop valve)
Injektor ini umumnya digunakan untuk menginjeksi volume lebih besar daripada 10 µl dan sekarang digunakan dengan cara automatis (dengan adaptor khusus, volume-volume lebih kecil dapat diinjeksikan secara manual). Pada posisi LOAD, sampel loop (cuplikan dalam putaran) diisi pada tekanan atmosfir. Bila katup difungsikan, maka cuplikan di dalam putaran akan bergerak ke dalam kolom.
2.3.4.4 Kolom
Menurut Johnson dan Stevenson (1977), kolom adalah jantung kromatografi. Berhasil atau gagalnya suatu analisis tergantung pada pemilihan kolom dan kondisi percobaan yang sesuai. Kolom dapat dibagi menjadi dua kelompok :
a. Kolom analitik : diameter khas adalah 2 – 6 mm. Panjang kolom tergantung pada jenis kemasan. Untuk kemasan pellikular, panjang yang umumnya adalah 50 – 100 cm. Untuk kemasan poros mikropartikulat, umumnya 10 – 30 cm. Dewasa ini ada yang 5 cm.
b. Kolom preparatif : umumnya memiliki diameter 6 mm atau lebih besar dan panjang kolom 25 – 100 cm.
2.3.4.5 Detektor
Suatu detektor dibutuhkan untuk mendeteksi adanya komponen cuplikan dalam aliran yang keluar dari kolom. Detektor-detektor yang baik memiliki sensitifitas yang tinggi, gangguan (noise) yang rendah, kisar respons linier yang luas, dan memberi tanggapan/respon untuk semua tipe senyawa. Suatu kepekaan yang rendah terhadap aliran dan temperatur sangat diinginkan, tetapi tidak selalu dapat diperoleh (Johnson dan Stevenson, 1977).
detektor ionisasi nyala, detektor elektrokimia dan lain-lain juga telah digunakan (Johnson dan Stevenson, 1977).
2.3.4.6 Perekam
Alat pengumpul data seperti komputer, integrator, rekorder dihubungkan dengan detektor. Alat ini akan mengukur sinyal elektronik yang dihasilkan oleh detektor lalu mem-plotkannya sebagai suatu kromatogram yang selanjutnya dapat dievaluasi oleh seorang analis (Rohman, 2009).
2.3.5 Fase Gerak
Dalam kromatografi cair komposisi pelarut atau fase gerak adalah satu variabel yang mempengaruhi pemisahan. Terdapat keragaman yang luas dari fase gerak yang digunakan dalam semua mode KCKT, tetapi ada beberapa sifat-sifat yang diinginkan yang mana umumnya harus dipenuhi oleh semua fase gerak (De Lux Putra, 2007).
Menurut Johnson dan Stevenson (1977), fase gerak harus: • Murni, tidak ada pencemar/kontaminan
• Tidak bereaksi dengan pengemas • Sesuai dengan detektor
• Melarutkan cuplikan
• Mempunyai viskositas rendah
• Tersedia di perdagangan dengan harga yang pantas
detektor dapat menghasilkan banyak gangguan sehingga data tidak dapat digunakan.
2.3.6 Fase Diam
Oktadesil silika (ODS atau C18) merupakan fase diam yang paling banyak digunakan karena mampu memisahkan senyawa-senyawa dengan kepolaran yang rendah, sedang maupun tinggi (Gandjar dan Rohman, 2007).
Sekarang ini, gel silika ODS atau fase-fase sejenis seperti gel silika oktil digunakan untuk >80% analisis farmasi namun fase-fase lain hanya digunakan jika diperlukan selektivitas khusus, misalnya untuk senyawa-senyawa yang sangat mudah larut dalam air atau untuk pemisahan bioanalisis yang menjadi penting karena matriks sampel tersebut menghasilkan banyak puncak yang mengganggu (Watson, 2009).
2.3.7 Elusi Gradien dan Isokratik
Menurut Gritter, dkk., (1985), elusi pada kromatografi cair kinerja tinggi dapat dibagi menjadi dua sistem yaitu:
1. Sistem elusi isokratik
Pada sistem ini, elusi dilakukan dengan satu macam atau lebih fase gerak dengan perbandingan tetap (komposisi fase gerak tetap selama elusi). 2. Sistem elusi gradien
Pada sistem ini, elusi dilakukan dengan campuran fase gerak yang perbandingannya berubah-ubah dalam waktu tertentu (komposisi fase gerak berubah-ubah selama elusi).
2.4 Validasi Metode
parameter tertentu, berdasarkan percobaan laboratorium, untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004).
Validasi metode menurut United States Pharmacopeia (USP) dilakukan untuk menjamin bahwa metode analisis akurat, spesifik, reprodusibel dan tahan pada kisaran analit yang akan dianalisis. Suatu metode analisis harus divalidasi untuk verifikasi bahwa parameter-parameter kinerjanya cukup mampu untuk mengatasi masalah dalam analisis. Parameter analisis yang ditentukan pada validasi adalah akurasi, presisi, batas deteksi, batas kuantitasi, spesifikasi, linieritas dan rentang, kekasaran (Ruggedness) dan ketahanan (Robutness).
2.4.1 Akurasi (Kecermatan)
Akurasi merupakan ketelitian metode analisis atau kedekatan antara nilai terukur dengan nilai sebenarnya. Akurasi dinyatakan dalam persen perolehan kembali (% recovery) (Harmita, 2004).
2.4.2 Presisi (Keseksamaan)
Presisi merupakan ukuran keterulangan metode analisis yang diperoleh dari beberapa kali pengukuran pada sampel yang sama dan biasanya diekspresikan sebagai Relatif Standar Deviasi (RSD) (Gandjar dan Rohman, 2007).
2.4.3 Batas Deteksi (limit of detection, LOD)
2.4.4 Batas Kuantitasi (limit of quantitation, LOQ)