ISOLASI DAN IDENTIFIKASI TURUNAN SENYAWA FENOLIK DARI KULIT TUMBUHAN BAWANG PEKING (Allium cepa L.)
SKRIPSI
NINA NOVRINA LASE 150802043
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2019
ISOLASI DAN IDENTIFIKASI TURUNAN SENYAWA FENOLIK DARI KULIT TUMBUHAN BAWANG PEKING (Allium cepa L.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar sarjana sains
NINA NOVRINA LASE 150802043
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2019
PENGESAHAN SKRIPSI
Judul : Isolasi dan Identifikasi Turunan Senyawa Fenolik Dari Kulit Tumbuhan Bawang Peking (Allium cepa L.)
Kategori : Skripsi
Nama : Nina Novrina Lase
Nomor Induk Mahasiswa : 150802043
Program Studi : Sarjana (S1) Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di Medan, Oktober 2019
Ketua Program Studi, Pembimbing,
Dr. Cut Fatimah Zuhra,M.Si Dr. Lamek Marpaung, M.Phil
NIP: 197404051999032001 NIDK: 8871680018
PERNYATAAN ORISINALITAS
ISOLASI DAN IDENTIFIKASI TURUNAN SENYAWA FENOLIK DARI KULIT TUMBUHAN BAWANG PEKING (Allium cepa L.)
SKRIPSI
Saya menyatakan bahwa skripsi ini adalah karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing masing disebutkan sumbernya.
Medan, Oktober 2019
Nina Novrina Lase
150802043
ISOLASI DAN IDENTIFIKASI TURUNAN SENYAWA FENOLIK DARI KULIT TUMBUHAN BAWANG PEKING (Allium cepa L.)
ABSTRAK
Isolasi turunan senyawa fenolik yang terdapat pada kulit tumbuhan bawang peking (Allium cepa L.)telah dilakukan secara ekstraksi maserasi dengan pelarut metanol. Ekstrak pekat metanol dilarutkan dengan aquadest dan dipartisi dengan etil asetat. Kemudian ekstrak pekat etil asetat dilarutkan dengan metanol dan dipartisi dengan n-heksana. Kemudian ekstrak pekat metanol dianalisa dengan kromatografi lapis tipis sebelum kromatografi kolom dan didapat eluen yang sesuai untuk pemisahan adalah kloroform : metanol. Ekstrak metanol dipisahkan dengan kromatografi kolom dengan eluen kloroform : metanol 90:10; 80:20 (v/v). Senyawa yang diperoleh dimurnikan dengan kromatografi lapis tipis prepratif menghasilkan padatan amorf sebanyak 8,9 mg harga Rf = 0,54 dengan eluen kloroform : etil asetat 80;20 (v/v) . Uji kemurnian senyawa yang diperoleh dilakukan dengan kromatografi lapis tipis menunjukkan noda tunggal menggunakan eluen kloroform : etil asetat 80;20 (v/v) dan benzena : etil asetat 80:20 (v/v). Selanjutnya senyawa yang diperoleh dianalisis dengan Spektrofotometer UV-Visible, Inframerah (FT-IR) dan Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR). Dari data spektroskopi menunjukkan bahwa turunan senyawa fenolik dari metil galat yaitu 3,5- dihidroksimetilbenzoat.
Kata Kunci : Kulit Bawang Peking, Allium cepa L, 3,5-dihidroksimetilbenzoat, spektroskopi
ISOLATION AND IDENTIFICATION DERIVATIVE PHENOLIC COMPOUNDS FROM PEKING ONION SKIN (Allium cepa L.)
ABSTRACT
Isolation of phenolic derivative compound from peking onion skin(Allium cepa L.) maceration technique with methanol solvent. The concentration extract of methanol dissolved with aquadest and partition extracted with ethyl acetate. Then concentrate extract of ethyl acetate dissolved with methanol solvent, and partition with n-heksane. Then the concentrated methanol extract was analyzed by thin layer chromatography before column chromatography and obtained an appropriate eluent for separation was chloroform : methanol 90:10; 80:20 (v/v).. The compounds wa purified with a thin layer preparative produce amorphous solids with weight 8,9 mg with Rf = 0,54with eluent chloroform : ethyl acetate 80:20 (v/v) , The test purity of compounds is done by thin layer chromatography show sigle spot with eluent chloroform : ethyl acetate 80:20 (v/v) and benzene : acetate 80:20 (v/v). The next, compound was further identified by Spectroscopy UV-Visible, Spectroscopy (FT-IR) and Proton Nuclear Magnetic Resonancy Spectroscopy (1H-NMR). Spectroscopic data show that the phenolic compound derived from methyl gallat is 3,5- dihdroxymethylbenzoate.
Keywords: Peking Onion Skin, Allium cepa L, 3,5-dihdroxymethylbenzoate, spectroscopy
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Pengasih dan Maha Penyayang, dengan limpah karunia-Nya Penulis dapat menyelesaikan penyusunan skripsi ini dengan judul Isolasi dan Identifikasi Turunan Senyawa Fenolik dari Kulit Tumbuhan Bawang Peking.
Terimakasih penulis sampaikan kepada Bapak Lamek Marpaung, M.Phil, Ph.D selaku pembimbing yang telah meluangkan waktunya selama penyusunan skripsi ini. Terimakasih kepada Ibu Dr. Cut Fatimah Zuhra, M.Si dan Ibu Dr. Sovia Lenny, M.Si selaku Ketua dan Sekretaris Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam USU, Dekan dan Wakil Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam USU, seluruh Staf dan Dosen program studi Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam, pegawai dan rekan-rekan kuliah.
Ucapan terimakasih yang setulusnya Penulis berikan kepada orangtua Penulis Bapak tercinta Asludin Lase dan Ibu tercinta Magdalena yang telah membesarkan serta selalu mendoakan penulis. Kepada saudara kandung penulis Kakak-kakak dan Abang yang telah menyemangati dan membantu dalam menyelesaikan skripsi ini dan terima kasih saya ucapkan kepada teman-teman seperjuangan stambuk 2015 yang telah menyemangati penulis dalam proses pengerjaan skripsi penulis. Selain itu, penulis mengucapkan terimakasih kepada sahabat jojoba yang selalu ada untuk membantu selama penelitian, dan juga tak lupa penulis ucapkan terimakasih kepada berbagai pihak yang penulis tidak dapat tuliskan satu-persatu.
Penulis menyadari bahwa skripsi ini masih memiliki banyak kekurangan.
Oleh karena itu, kritik dan saran yang membangun dari pihak pembaca sangat diharapkan demi kesempurnaan skripsi ini. Semoga skripsi ini bermanfaat bagi penelitian dan kemajuan ilmu pengetahuan untuk masa yang akan datang.
Medan, Oktober 2019
Nina Novrina Lase
DAFTAR ISI
Halaman
PENGESAHAN SKRIPSI i
PERNYATAAN ORISINALITAS ii
ABSTRAK iii
ABSTRACT iv
PENGHARGAAN v
DAFTAR ISI vi
DAFTAR TABEL viii
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN X
DAFTAR SINGKATAN Xi
BAB 1 PENDAHULUAN
1.1. Latar Belakang 1
1.2. Permasalahan 2
1.3. Tujuan Penelitian 2
1.4. Manfaat Penelitian 2
1.5 Metodologi Penelitian 2
BAB 2 TINJAUAN PUSTAKA
2.1 Tumbuhan Bawang Peking 4
2.1.1 Morfologi Tumbuhan Bawang Peking 4
2.1.2 Sistematika Tumbuhan Bawang Peking 5
2.2 Senyawa Bahan Alam 5
2.3 Senyawa Metabolit Sekunder 5
\ 2.4 Senyawa Fenolik 6
2.4.1 Klasifikasi Senyawa Fenolik 7
2.4.2 Manfaat Senyawa Fenolik 12
2.4.3 Asam Galat 13
2.5 Teknik Pemisahan 14
2.5.1 Ekstraksi 15
2.5.2 Partisi 15
2.5.3 Kromatografi 16
2.5.3.1 Kromatografi Lapis Tipis 16
2.5.3.2 Kromatografi Kolom 17
2.5.3.3 Kromatografi Lapis Tipis Preparatif 18
2.6 Teknik Spektroskopi 18
2.6.1 Spektrofotometer Ultraviolet-Visibel (UV-Vis) 19 2.6.2 Spektrofotometer Inframerah (FT-IR) 19
2.6.3 Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR) 20 BAB 3 METODE PENELITIAN
3.1 Waktu dan Tempat 22
3.2 Alat dan Bahan 22
3.2.1 Alat 22
3.2.2 Bahan 22
3.3 Prosedur Penelitian 23 20
3.3.1 Penyediaan Sampel 23
3.3.2 Uji Pendahuluan Terhadap Ekstrak Kulit Tumbuhan Bawang Peking
23 3.3.3 Ekstraksi Kulit Tumbuhan Bawang Peking 23
3.3.4 Analisi Kromatografi Lapis Tipis 24
3.3.5 Pemisahan Senyawa Fenolik dengan Kromatografi Kolom 24
3.3.6 Pemurnian 25
3.3.7 Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis (KLT)
25
3.4 Identifikasi Senyawa Hasil Isolasi 26
3.4.1 Analisa dengan Spektrofotometer UV-Visible 26 3.4.2 Analisa dengan Spektrofotometer Inframerah (FT-IR) 26 3.4.3 Analisa dengan Spektrofotometer Resonansi Magnetik Inti
Proton (1H-NMR)
26
3.5 Bagan Penelitian 27
3.5.1 Bagan Uji Fenolik dengan Pelarut Metanol 27 3.5.2 Bagan Isolasi Senyawa Fenolik dari Kulit Tumbuhan Bawang
Peking (Allium cepa L.)
28
BAB 4 HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian 30
4.2 Pembahasan 33
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 36
5.2 Saran 36
DAFTAR PUSTAKA 37
LAMPIRAN 39
DAFTAR TABEL
Nomor Tabel
Judul Halaman
2.1 Klasifikasi Senyawa Fenolik 7
2.2 Pergeseran Kimia 1H-NMR Senyawa Organik 21 4.1 Serapan Panjang Gelombang Ultraviolet-Visibel (UV-
Vis) senyawa hasil isolasi
31 4.2 Interpretasi Spektrum FT-IR Senyawa Hasil Isolasi 32 4.3 Pergeseran Kimia 1H-NMR Senyawa Hasil Kimia 33 4.4 Perbandingan Proton 1H-NMR Senyawa Isolasi dan
Senyawa Pembanding
35
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.1 Tumbuhan Bawang Peking 4
2.2 Struktur Fenol 6
2.3 Struktur Floroglukinol 8
2.4 Struktur Asam Galat 8
2.5 Struktur(a)2-hidroasetofenon, (b) Asam 2-hidroksifenil 9 2.6 Struktur (a)Asam p-kumarat, (b)p-koumaril aldehi, (c) p-
koumaril alkohol
9
2.7 Struktur Juglon 10
2.8 Struktur (a)Xanton, (b)Stilben 10
2.9 Struktur Flavonoida 11
2.10 Struktur Hinokiflavon 12
2.11 Struktur Koniferil Alkohol 12
2.12 Struktur (a) Metil Galat, (b) Fenil Galat , (c) Triaseton Asam Galat, (d) Asam Galat Metil Ester, (e) Etil Galat
14
4.1 Spektrum UV-Visibel Senyawa Hasil Isolasi 30
4.2 Spektrum Inframerah (FT-IR) senyawa hasil isolasi 31
4.3 Spektrum 1H-NMR Senyawa Hasil Isolasi 32
4.4 Struktur Turunan Senyawa Metil Galat (3,5- dihidroksimetilbenzoat)
35
DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
1 Hasil Determinasi Tumbuhan Bawang Peking (Allium cepa L.)
30 39 2 Kromatografi Lapis Tipis ekstrak Pekat Metanol Kulit
Tumbuhan Bawang Peking (Allium cepa L.) Sebelim Kromatografi Kolom
40
3 Kromatografi Lapis Tipis Ekstrak serbuk Kulit Tumbuhan Bawang Peking Setelah Penggabungan Fraksi
41 4 Kromatografi Lapis Tipis Preparatif Ekstrak serbuk Kulit
Tumbuhan Bawang Peking dengan menggunkan Lampu UV
42 5 Kromatografi Lapis Tipis Senyawa Murni Hasil Isolasi 43
6 Spektrum 1H-NMR Senyawa Hasil Isolasi 44
7 Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi 45
8 Spektrum 1H-NMR Senyawa Hasil Isolasi Pembanding Lubis dkk, 2018
46
DAFTAR SINGKATAN
FT-IR = Fourier Transform Infrared
1H-NMR = Spektrofotometer Resonansi Magnetik Inti Proton UV-Vis = Spektrofotometri Ultraviolet-Visibel
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Metabolit sekunder merupakan senyawa yang tidak sangat penting bagi eksistensi suatu individu, namun sering berperan pada kelangsungan hidup suatu spesies, dalam perjuangan menghadapi spesies-spesies lain Pada metabolisme sekunder terdapat proses yaitu proes kimia jenis lain terjadi hanya pada spesies tertentu sehingga memberikan produk yang berlainan, sesuai dengan spesiesnya.
Produk-produk metabolit sekunder disebut sebagai produk alami oleh para ahli kimia organik, misalnya senyawa-senyawa terpena, alkaloid dan fenolik (Manitto, 1981).
Banyaknya variasi kelompok fenolik kemungkinan disebabkan oleh substituent terhadap struktur kerangka utama fenol, terdapat lebih dari 8.000 jenis senyawa yang termasuk dalam golongan senyawa fenolik (Marinova et al, 2005).
Fenolik merupakan senyawa bahan alam dan kebanyakan fenolik mempunyai satu atau lebih gugus fenol, senyawa yang mengandung lebih dari satu atau lebih fenolik didalamnya disebut senyawa polifenol seperti tannin, mempunyai beberapa katekol dan floroglusinol dalam strukturnya. Senyawa fenolik umumnya ditemukan pada tumbuhan dan tidak umum ditemukan pada bakteri, jamur dan alga (Harbone, 1989).
Tumbuhan yang mengandung jumlah yang sangat besar variasi turunan dari senyawa fenolik, dilaporkan sangat bermanfaat bagi kesehatan manusia yaitu asam fenol, flavonoid, (flavonon,flavononon, flavonol, 3-flavonol, isoflavon, antosianin) lignin, dan stilben (Watson, 2014).
Sitiandaon (2015) telah melakukan studi morfologi dan produksi lima varietas dari bawang merah (Allium cepa var. ascalonicum ) yang salah satunya adalah bawang peking (Allium cepa L.). Bawang peking merupakan salah satu varietas dari tumbuhan bawang merah (A. cepa var ascalonicum) dan telah diperoleh informasi mengenai jenis varietas bawang ini dapat memberikan pengaruh yang
sangat nyata terhadap tinggi pertumbuhannya karena memiliki ketinggian paling tinggi sebesar 25,67 cm.
Ringo (2008) telah melakukan penelitian yaitu isolasi senyawa flavonoid dari kulit bawang merah (Allium cepa L.) yang mana merupakan indukan dari varietas bawang peking, berdasarkan skrining fitokimia, data spektrum UV-Vis, data spektrum inframerah dan 1H-NMR dapat diduga bahwa senyawa yang diisolasi dari kulit bawang merah (A. cepa L.) merupakan senyawa flavonoida golongan flavonol.
Sejauh ini penelitian senyawa fenolik pada kulit tumbuhan bawang peking belum banyak ditemukan dalam literatur, sehingga peneliti tertarik untuk melalukan penelitian terhadap kandungan senyawa fenolik pada kulit tumbuhan bawang peking.
1.2 Permasalahan
Turunan Senyawa fenolik apakah yang terdapat dalam kulit tumbuhan bawang peking (A. cepa L.).
1.3 Tujuan Penelitian
Untuk mengetahui turunan senyawa fenolik yang terdapat dalam kulit tumbuhan bawang peking (A. cepa L.).
1.4 Manfaat Penelitian
Dari hasil penelitian diharapkan dapat memberikan sumber informasi ilmiah pada bidang Kimia Bahan Alam Hayati khususnya tentang turunan senyawa fenolik yang terkandung dalam kulit tumbuhan bawang peking (A. cepa L.).
.
1.6 Metodologi Penelitian
Dalam penelitian ini, isolasi senyawa fenolik dilakukan terhadap kulit bawang peking kering yang sudah dihaluskan sebanyak 2000 gr. Tahap awal dilakukan uji skrining fitokimia untuk senyawa fenolik, yaitu dengan merendam kulit bawang peking menggunaan pelarut metanol setelah itu menggunakan pereaksi FeCl3 5%.
Tahap isolasi yang dilakukan adalah sampel diekstraksi maserasi dengan pelarut metanol, selanjutnya dilakukan tahap pemisahan dengan menggunakan pelarut aquadest untuk mengendapkan lemak atau senyawa organik lainnya. Tahap berikutnya adalah pemisahan tanin dengan cara ekstraksi partisi dengan menggunakan pelarut etil asetat. Selanjutnya dilakukan ekstraksi partisi dengan menggunkan pelarut n-heksan. Dilakukan analisis kromatografi lapis tipis sebelum kromatografi kolom. Pada analisis kromatografi kolom akan menghasilkan fraksi- fraksi fenolik. Fraksi-fraksi fenolik yang dihasilkan kembali dianalisis kromatografi lapis tipis, kemudian dimurnikan dengan kromatografi lapis tipis preparatif dan diuji kemurnian sehingga dihasilkan turunan senyawa fenolik yang murni yang kemudian dianalisa dengan kromatografi lapis tipis. Senyawa hasil isolasi yang diperoleh dianalisis Spektrofotometer UV-Visibel, Spektrofotometer Inframerah (FT-IR), Spektrofotometer Resonansi Magnetik Inti Proton ( 1H-NMR).
BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Bawang Peking (Allium Cepa L.)
2.1.1.Morfologi Tumbuhan Bawang Peking (Allium cepa L.)
Tumbuhan bawang peking (A. cepa L.) merupakan salah satu varietas dari bawang merah (A. cepa var. ascalonicum), yang mana bawang peking memiliki umur panen yang lama (75 hari) serta memiliki umbi yang berukuran kecil yang berwarna merah, dilihat dari bagan warna daun memiliki nilai rataan warna daun sebesar 4,56 yang berarti pada skala 4 (warna hijau). Persentasi kemampuan berbunga sebesar 2,5% dengan jumlah tanaman sebanyak 8 tanaman, dengan menggunakan uji jarak beganda duncan diperoleh jumlah helai daun sebanyak 11,98 helai, dan jumlah anakan perumpun sebanyak 2,72% anakan bawan serta memiliki tinggi pertumbuhan sebesar 25,67 cm (Sitiandaon, 2015).
Berikut Gambar 2.1 Tumbuhan Bawang Peking (A.cepa L.):
(a) (b)
Gambar 2.1 Tumbuhan Bawang Peking(a) Bawang Peking; (b) Kulit Bawang Peking
2.1.2.Sistematika Tumbuhan Kulit bawang Peking (Allium cepa L.)
Kingdom : Plantae
Divisi : Spermatophyta
Class : Monocotyledoneae
Ordo : Asparagales
Famili : Amaryllidaceae
Genus : Allium
Spesies : Allium cepa L.
Nama Lokal : Bawang Peking
(Herbarium Medanense, 2019)
2.2 Senyawa Bahan Alam
Senyawa bahan alam adalah senyawa organik yang merupakan hasil dari proses metabolisme dalam organisme hidup yang dapat juga disebut sebagai metabolit . Senyawa bahan alam dibedakan menjadi dua berdasarkan fungsi terhadap makhluk hidup pembuatnya (Saifudin, 2014) yaitu:
1. Metabolit Primer
Metabolit primer pada semua organisme sama meskipun berbeda genetiknya.
Polisakarida, protein, lemak dan asam nukleat merupakan penyusun utama makhluk hidup.
2. Metabolit Sekunder
Metabolit sekunder adalah senyawa yang disintesis oleh makhluk tumbuhan, mikrobia atau hewan melewati proses biosintesis yang digunakan untuk menunjang kehidupan namun tidak vital sebagaimana gula, asam amino dan asam lemak.
Metabolit ini memiliki aktifitas farmakologi dan biologi. Dibidang farmasi secara khusus, metabolit sekunder digunakan dan dipelajari sebagai bahan obat.
2.3 Senyawa Metabolit Sekunder
Metabolit sekunder memiliki peran pada kelangsungan hidup suatu spesies dalam perjuangan menghadapi spesies-spesies lain, misalnya sebagai zat pertahanan
dan zat penarik lawan jenisnya. Metabolit sekunder merupakan metabolit yang disintesis oleh tumbuhan, seperti senyawa terpenoid, alkaloid dan senyawa fenolik (Kristianti, dkk 2008).
2.4 Senyawa Fenolik
Senyawa fenolik adalah komponen bioaktif penting yang terkandung dalam buah dan sayuran. Senyawa fenolik dapat digolongkan menjadi lima golongan yaitu flavonoida (misal:genistein), stilbene (misal:resveratrol), asam fenolik (misal:asam kafeat) , lignin (misal:sekoisolarisiresinol), dan golongan lainnya (missal:curcumin) (Firdaus dkk, 2013).
Senyawa fenolik merupakan kelompok terbesar metabolit sekunder pada tanaman. Senyawa ini termasuk dalam alkohol aromatik karena gugus hidroksilnya selalu mendekat pada cincin benzena. Senyawa fenolik secara umum memiliki potensi sebabagi bakterisidal, antiseptik, antioksidan, dan sebagainya (Pangelly, 2006). Berikut struktur dari fenol:
Gambar 2.2 Struktur Fenol
Fenolik memiliki banyak kemiripan dengan alkohol alifatik dimana kelompok hidroksil terikat pada rantai karbon. Gugus hidroksil pada fenolik dipengaruhi oleh cincin aromatiknya dimana hidrogen pada fenolik bersifat labil menyebabkan fenol bersifat asam lemah. Senyawa fenolik dapat dikarakterisasi dari tanaman dan biasanya ditemukan dalam bentuk ester dan glikosida bukan sebagai senyawa bebas (Vermerris et al, 2006).
2.4.1 Klasifikasi Senyawa Fenolik
Adapun kelas utama dari senyawa fenolik dalam tanaman yaitu:
Tabel 2.1 Klasifikasi Kelas Utama Senyawa Fenolik berdasarkan jumlah atom Karbon
Jumlah atom
Kerangka dasar Kelas Contoh
Karbon
6 C6 Fenol sederhana
Benzokuinon
Katekol, hidrokuinon 2,6-
Dimetoksibenzokuinon
7 C6-C1 Asam fenolat p-hidroksibenzoat,
salisilat
8 C6-C2 Asetofenon 3-asetil-6-
metoksibenzaldehid Asam fenil asetat p-hidroksibenzaldehid
9 C6-C3 Asam hidroksi
sinamat
Kafeat, ferulat Fenilpropana Mirisitin, eugenol Kumarin Ubelliferon, aeskuletin Isokumarin Bergenin
Kromon Eugenin
10 C6-C4 Naptokuinon Juglone, plumbagin
13 C6-C1-C6 Xanton Mangiferin
14 C6-C2-C6 Stilbenes Asam lunularat
Antarakuinon Emodin
15 C6-C3-C6 Flavonoida Kuersetin, sianidin
Isoflavonoida Genistein
18 (C6-C4)2 Lignan Pinoresinol
Neolignan Eusiderin 30 (C6-C3-C6)2 Biflavonoida Amentoflavon,
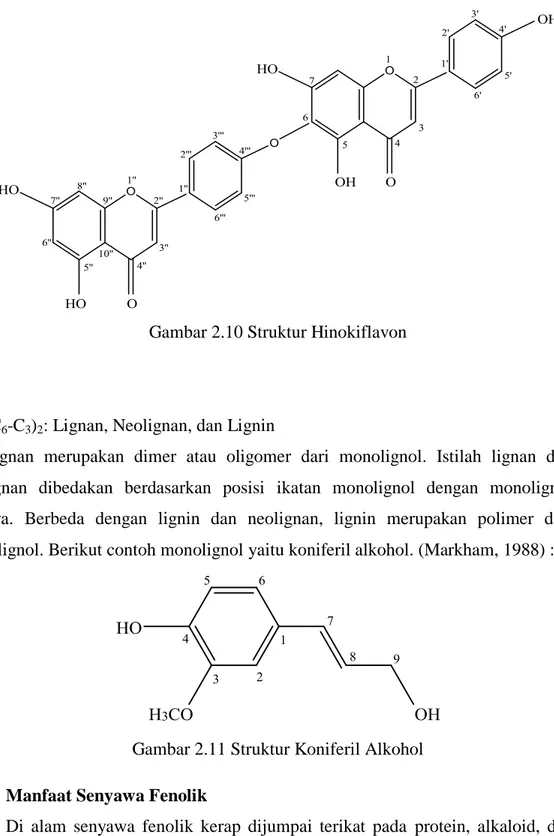
Hinokiflavon (Harborne, 1987)
1. C6 : Fenolik Sederhana
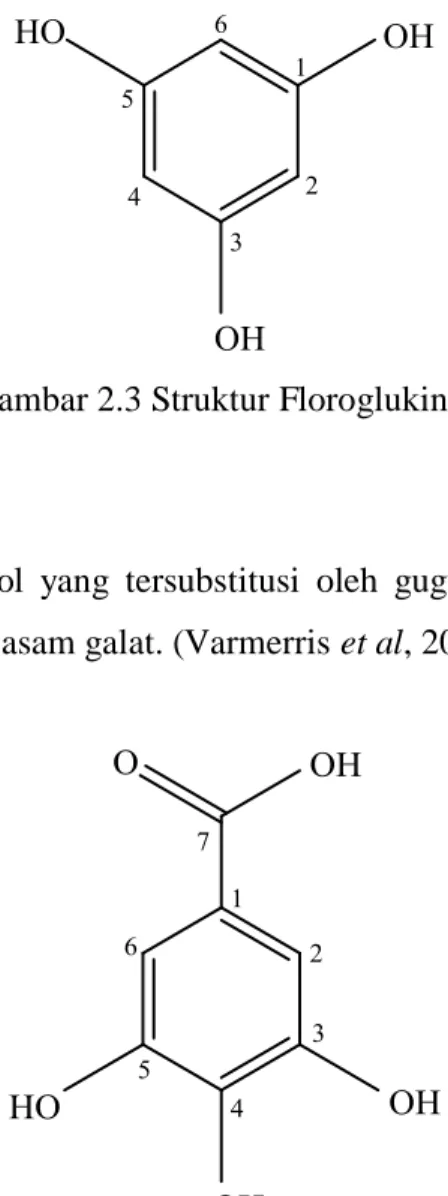
Senyawa dari gugus ini merupakan hasil substitusi dari gugus fenol, dimana substituennya dapat berupa substitusi satu atau dua gugus hidroksil pada posisi orto, meta atau para. Berikut senyawa fenolik sederhana yana tersubstitusi oleh dua gugus hidroksil. (Varmerris et al, 2006) :
Gambar 2.3 Struktur Floroglukinol
2. C6-C1 : Asam Fenolat
Asam fenolat adalah fenol yang tersubstitusi oleh gugus karboksil. Contohnya asam galat. Berikut senyawa asam galat. (Varmerris et al, 2006) :
Gambar 2.4 Strukrur Asam galat
3. C6-C2 : Asetofenon dan Asam Fenilasetat
Asetofenon dikenal dengan adanya gugus aseton yang tersubstitusi pada fenol, sedangkan asam fenilasetat memiliki gugus hidroksil yang tidak berikatan langsung dengan cincin aromatiknya. Berikut senyawa golongan asetofenon dan asam
fenilasetat. (Varmerris et al, 2006) :
(a) (b)
Gambar 2.5 Struktur (a) 2-hidroasetofenon; (b) Asam 2-hidroksifenil
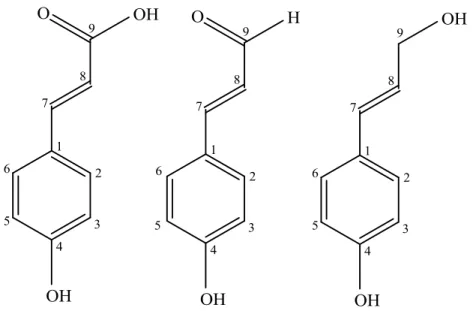
4. C6-C3 : Asam sinamat, sinamil aldehid, dan sinamil alkohol
Adapun ciri-ciri ketiganya iyalah asam sinamat memiliki ranka cincin benzen terikat pada atom karbon yang terikat dengan gugus karboksil, sinamil aldehid dan sinamil alkohol memiliki struktur yang sama dengan asam sinamat namun gugus karboksil diganti dengan gugus aldehid dan hidroksil. Berikut contoh dari ketiga senyawa tersebut. (Varmerris et al, 2006) :
(a) (b) (c)
Gambar 2.6 Struktur (a) Asam p-kumarat; (b) p-koumaril aldehid; (c) p-koumaril alkohol
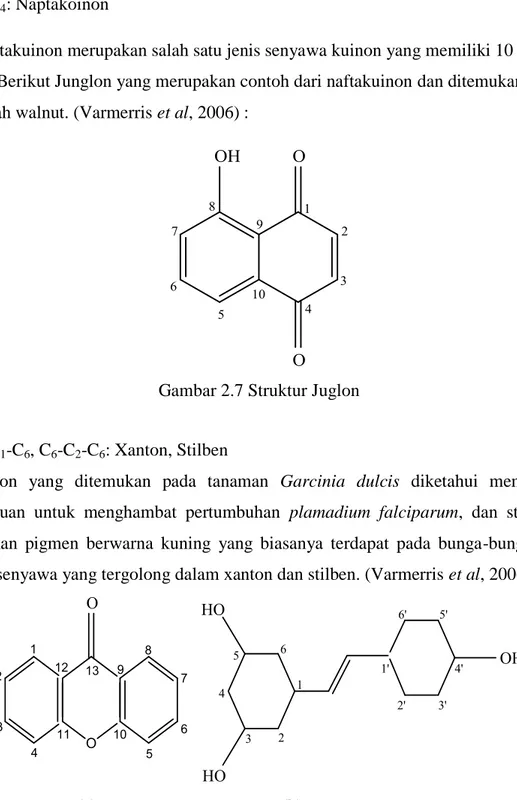
5. C6-C4: Naptakoinon
Naptakuinon merupakan salah satu jenis senyawa kuinon yang memiliki 10 atom karbon. Berikut Junglon yang merupakan contoh dari naftakuinon dan ditemukan pada buah walnut. (Varmerris et al, 2006) :
Gambar 2.7 Struktur Juglon
6. C6-C1-C6, C6-C2-C6: Xanton, Stilben
Xanton yang ditemukan pada tanaman Garcinia dulcis diketahui memiliki kemampuan untuk menghambat pertumbuhan plamadium falciparum, dan stilben merupakan pigmen berwarna kuning yang biasanya terdapat pada bunga-bungaan.
Berikut senyawa yang tergolong dalam xanton dan stilben. (Varmerris et al, 2006) :
(a) (b)
Gambar 2.8 Struktur (a) Xanton; (b) Stilben
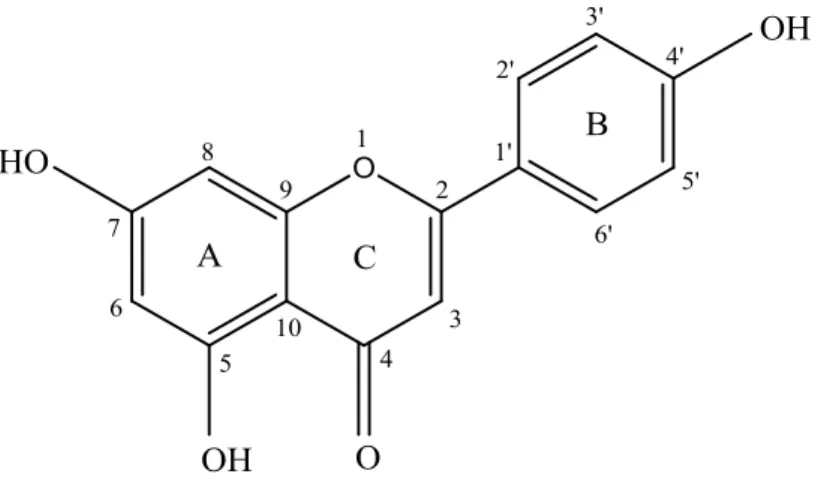
7. C6-C3-C6: Flavonoida
Flavonoida merupakan senyawa yang memiliki struktur dasar yang dibangun oleh 15 atom C(C6-C3-C6) dan terdistribusi secara merata pada tanaman yang meproduksi pigmen berwarna kuning, merah, atau biru pada bunga. Berikut struktur senyawa tersebut. (Robinson, 1995) :
Gambar 2.9 Struktur Flavonoida
8. (C6-C3-C6)2: Biflavonoida
Biflavonoida merupakan senyawa fenolik yang memiliki rangka yang disusun atas 30 atom karbon dan merupakan dimer dari flavon. Flavon merupakan salah satu anggota dari flavonoida (Vermerris et al, 2006). Flavonoida digabungkan menjadi biflavonoida bisa berjenis sama atau berbeda dan letak ikatannya berbeda-beda.
Sebagai contoh jenis ikatan eter yang sering terjadi ikatan -6,4’’’ seperti tampak pada gambar berikut. (Markham, 1988) :
Gambar 2.10 Struktur Hinokiflavon
9. (C6-C3)2: Lignan, Neolignan, dan Lignin
Lignan merupakan dimer atau oligomer dari monolignol. Istilah lignan dan neolignan dibedakan berdasarkan posisi ikatan monolignol dengan monolignol lainnya. Berbeda dengan lignin dan neolignan, lignin merupakan polimer dari monolignol. Berikut contoh monolignol yaitu koniferil alkohol. (Markham, 1988) :
Gambar 2.11 Struktur Koniferil Alkohol 2.4.2 Manfaat Senyawa Fenolik
Di alam senyawa fenolik kerap dijumpai terikat pada protein, alkaloid, dan terdapat diantara terpenoid. Aktivitas flavonoida sebagai antioksidan sudah tidak diragukan lagi karena dapt menangkap radikal bebas dengan melepaskan atom hidrogen dari gugus hidroksilnya (Ide, 2008).
Senyawa fenolik atau polifenol merupakan suatu produk hasil metabolisme sekunder tumbuhan. Fenolik berperan sebagai scavenger (pemakan) radikal peroksil
karena fenol memiliki struktur molekul penting yaitu cincin aromati dan gugus hidroksil yang mengandung hydrogen yang dapat berpindah (Yulianti, 2018).
Senyawa fenol merupakan kelas utama antioksidan yang berada dalam tumbuh-tumbuhan. Kandungan senyawa fenolik banyak diketahui sebagai terminator radikal bebas dan pada umumnya kandungan senyawa fenolik berkorelasi positif terhadap aktivitas antiradikal (Marinova et al, 2011). Polifenol berperan penting dalam stabilitas oksidasi lipid dan berhubungan langsung dengan aktivitas antioksidan (Huang et al, 2005).
2.4.3 Asam Galat
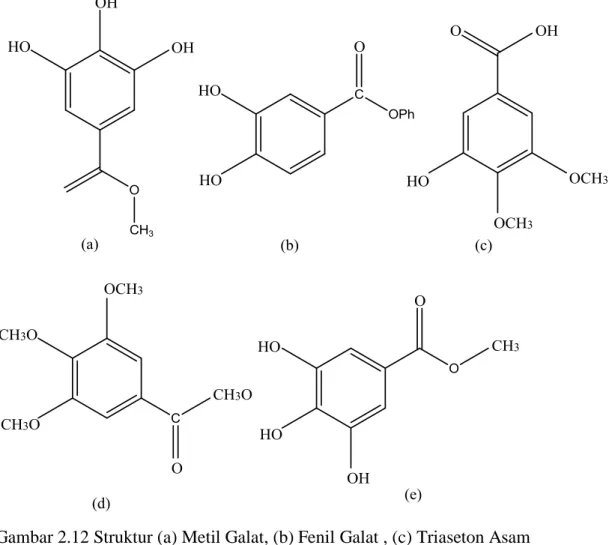
Asam galat atau nama lain 3,4,5-trihidroxyi benzoic acid merupakan salah satu seyawa fenol yang memiliki aktifitas antijamur, antivirus, memiliki kemampuan sitotoksis melawan sel kanker tanpa merusak sel tubuh lainnya, antioksidan dan agen antikarsinogenik. Kemungkinan antioksidan dari asam galat lebih kuat dari troloks, suatu analog dari vitamin E yang larut dalam air (Sohi et al, 2003). Asam galat dan sejenisna umumnya hadir dalam berbagai buah dan jumlah tanaman, selain itu sejumlah besar turunan asam galat yang disintesis juga tersedia. Berikut struktur dari beberapa turunan asam galat (Nayeem et al, 2016).
Gambar 2.12 Struktur (a) Metil Galat, (b) Fenil Galat , (c) Triaseton Asam Galat, (d) Asam Galat Metil Ester, (e) Etil Galat
2.5 Teknik Pemisahan
Teknik pemisahan bertujuan untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni, tidak tercampur dengan komponen- komponen lainnya. Ada 2 jenis teknik pemisahan yaitu:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya perbedaan yang besar dari sifat-sifat fisika komonen dalam campuran yang dipisahkan.
2. Pemisahan fisika adalah suatu tenik pemisahan yang didasarkan pada perbedaan- perbedaan kecil dari sifat-sifat fisika antara senyawwa-senyawa yang termasuk dalam suatu golongan (Muldja, 1995).
2.5.1 Ekstraksi
Ragam ekstraksi yang tepat sudah tentu bergantung pada tekstur dan kandungan air dalam kandungan air dalam tumbuhan yang diekstraksi dan pada jenis senyawa yang diisolasi. Alkohol adalah pelarut serbaguna yang baik untuk ekstraksi pendahuluan. Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan eksrak diuapkan dengan menggunakan alat rototarievaporator (Harborne, 1987).
Beberapa metode ekstraksi dapat digunakan untuk mengekstrak atau konstituen dalam suatu bahan tanaman, yang diantaranya adalah maserasi, perkolasi, ekstaraksi sokletasi, ekstraksi dengan refluks, dan didestilasi uap dalam ekstraksi padat-cair, bahan tanaman ditempatkan dalam sebuah wadah, dan dibiarkan terjadi kntak dengan pelarut. Proses yang terjadi dari seluruh proses dinamis tersebut dapat diuraikan menjadi beberapa tahap, yaitu tahap pertama pelarut akan berdifusi keluar dari sel bersama dengan metabolit (Sarker, 2006).
Tiga metode dasar pada ekstraksi car-cair adalah ekstraksi bertahap (batch), ekstraksi kontinyu, dan ekstraksi counter current. Ekstraksi bertahap adalah cara pelarut pengekstraksi yang tidak bercampur dengan pelarut semula kemudian dilakukan pengocokan sehingga terjadi keseimbangan konsentrasi zat yang akan diekstraksi pada kedua lapisan, didiamkan dan dipisahkan (Khopkar, 1990).
2.5.2 Partisi
Metode pemisahan yang mungkin paling sederhana adalah partisi, yang banyak digunakan sebagai tahap awal pemurnian ekstrak. Partisi menggunakan dua pelarut tak bercampur yang ditambahkan kedalam ekstrak tersebut, hal ini dapat dilakukan secara terus menerus dengan menggunakan dua pelarut yang tak bercampur yang kepolarannya meningkat. Partisi biasanya dilakukan melalui dua tahap:
1. Air/petroleum eter ringan (heksan) untuk menghasilkan fraksi nonpolar dilaisan organik
2. Air/diklorometan atau air/etil asetat untuk membuat fraksi agak polar dilapisan organik. Ini merupakan metode pemisahan yang mudah dan mengendalikan kelarutan bahan alam dan bukan interaksi fisik dengan medium lan (Heinrich et al, 2009).
2.5.3 Kromatografi
Kromatografi pertama kali dikembangkan oleh seorang ahli botani Rusia Michael Tswett pada tahun 1903 untuk memisahkan pigmen berwarna dalam tanaman dengan cara perkolasi ekstrak petroleum eter dalam kolom gelas yang berisi kalsium karbonat (CaCO3). Teknik kromatorafi telah berkembang dan telah digunakan untuk memisahkan dan mengkuantifikasi berbagai macam komponen yang kompleks, baik komponen organik maupun komponen anorganik (Gandjar dkk, 2007).
Kromatografi merupakan teknik untuk pemisahan dan pemisahan dari komponen solut dalam sebuah campuran. Teknik ini dilihat berdasarkan pemisahan warna atau noda campuran antara dua fase, yakni fase diam dan fase gerak pada sebuah permukaan material pendukung yang bersifat inert ataupun padatan
Ada 4 tipe kromatografi yakni:
1. Kromatografi Kolom 2. Kromatografi Lapis Tipis 3. Gas Kromatografi
4. Kromatografi Kertas
2.5.3.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis merupakan metode fisikokimia yang didasarkan atas penyerapan, partisi (pembagian), atau gabungannya. Lapisan pemisah tipis yang terdiri atas butir penyerap atau penyangga dilapiskan pada lempeng kaca, logam dan in lain-lain. Untuk mendapatkan kondisi jenuh dalam bejana kromatografi, dinding bejana dilapisi dengan lembaran kertas saring, fase gerak setinggi 5-10 mm. Bejana ditutup dan dibiarkan selama satu jam pada suhu 20-25 oC.
Dalam pemilihan pelarut yang perlu diperhatikan adalah:
1. Pelarut harus murni jika perlu disuling kembali
2. Campuran pelarut hanya boleh digunakan maksimum dua atau tiga kali 3. Komposisi campuran dapat berubah karena penyerapan atau penguapan 4. Komponen-komponen campuran pelarut dapat bereaksi satu sama lain
5. Eter atau kloroform yang digunakan mengandung 0,5% - 1% etanol sebagai stabilisator
Adsorben umum yang digunakan antara lain silika gel, alumina, tanah diatom, dan serbuk selulosa. Resin penukar ion digunakan untuk penggunaan khusus, silika gel bersifat asam dan dapat digunakan untuk kromatografi partisi dan penyerapan. Alumina bersifat basa dan terutama digunakan kromatografi penyerapan. Tanah atom bersifat netral dan digunakan sebagai penyangga untuk kromatografi partisi (Harmita, 2015).
Faktor retedasi merupakan parameter karakteristik kromatografi kerta dan kromatografi lapis tipis. Harga rf adalah ukuran kecepatan migrasi suatu komponen pada kromatografi, rf didefiniikan sebagai perbandingan jarak yang ditempuh komponen jarak yang ditempuh pelarut atau fase gerak.
e p p e
Faktor-faktor yang mempengaruhi pergerakan noda dalam KLT yang juga mempengaruhi harga Rf:
1. Struktur kimia dari senyawa yang dipisahkan 2. Sifat dari penyerap dan derajat aktivasi 3. Tebal kerataan dan lapisan penyerap 4. Pelarut dan derajat kemurnian fase gerak 5. Derajat kejenuhan dari uap
6. Jumlah cuplikan yang digunakan 7. Suhu
8. Kesetimbangan (Sastrohamidjojo, 1991) 2.5.3.2 Kromatografi Kolom
Kromatografi kolom merupakan metode kromatografi terbaik untuk pemisahan dalam jumlah besar (lebih dari 1 gram). Kromatografi kolom biasanya dibuat dengan menuangkan suspense fasa diam dan pelarut yang sesuai kedalam kolom dan dibiarkan memadat. Selanjutnya pelarut diturunkan sampai tepat pada bagian atas peyerap dan cuplikan yang akan dipisahkan diletakkan ada bagian atas
penyerap kemudian fasa gerak dimasukkan dan dibiarkan mengalir melewati kolom dan komponen campuran turun berupa pita dengan laju yang berlainan kemudian hasil pemisahan dari kolom dikumpulkan sebagai fraksi. Kromatografi kolom merupakan bentuk kromatografi cair (Gritter, 1991).
Adapun syarat adsorben yang digunakan iyalah sebagi berikut:
1. Tidak larut dalam pelarut yang digunakan 2. Inert (tidak bereaksi dengan sampel)
3. Cukup aktif sehingga memungkinkan perambatan sampel 4. Tidak berwarna agar pemisahan dapat diamati
5. Memungkinkan fase gerak mengalir dengan baik (Harmita, 2015)
2.5.3.3 Kromatografi Lapis Tipis Preparatif
Kromatografi Lapis Tipis Preparatif merupakan metode pemisahan yang sebagian besar pemakaiannya dalam jumlah mg . Cuplikan seanyak 10-10 mg dapat dipisahkan dengan lapisan silika gel atau aluminium oksida 20 x 20 cm yang tebalnya 1 mm. Kebanyakan penyerap KLTP mengandung indikator fluoresensi yang membantu mendeteksi kedudukan pita yang terpisah sepanjang senyawa yang dipisahkan menyerap sinar UV. Pita yang telah diketahui keduduknnya dikerok dari plat dengan menggunakan spatula. Senyawa harus sekitar 5 ml untuk senyawa 1 gram penyerap. Harus diperhatikan bahwa semakin lama senyawa berkontak dengan penyerap makin besar kemungkinan penguraian (Hostettmann et al, 1995).
2.6 Teknik Spektroskopi
Teknik spektroskopi adalah salah satu teknik analisis kimia-fisika yang mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik. Ada dua macam instrument pada teknik spektroskopi yaitu spectrometer dan spektrofotometer. Instrumen yang memakai monokromator celah yang tetap pada bidang focus disebut spectrometer. Apabila spektrometer dilengkapi dengan detektor yang bersifat fotoelektrik disebut sebagai spektrofotometer (Muldja, 1995).
Rumus molekul dapat ditentukan dari spektrum massa dan bentuk fregmentasinya. Gugus fungsi alami ditentukan dari spektrum inframerah. Gugus fungsi terkonjugasi dapat ditentukan dari spectrum elektrik. Struktur dapat
ditentukan berdasarkan inti proton dan karbon yang dihasilkan molekul dari spektrum 1H dan 13C NMR (Brown, 1988). Teknik spektroskopi dapat digunakan untuk menentukan senyawa yang tidak diketahui dan digunakan untuk mempelajari karakteristik ikatan dari senyawa yang diketahui (Fessenden, 1982).
2.6.1 Spektrofotometer Ultraviolet-Visibel (UV-Vis)
Pada spektroskopi UV, panjang gelombang untuk daerah ultraviolet adalah 200-270 nm dan daerah visibel adalah 400-750 nm. Radiasi dari panjang gelombong cukup untuk menaikkan elektron seperti elektron non bonding atau elektron terlibat dalam ikan phi untuk ketingkat lebih tinggi (Bhat, 2005).
Penyerapan sinar ultraviolet dan tampak oleh suatu molekul organik akan menghasilkan transisi diantara tingkat energi elektronik pada molekul tersebut, dan karenanya sering dinamakan spektrometri elektronik. Panjang gelombang serapan merupakan ukuran perbedaan tingkat-tingkat energi transisi elektronik dari orbital tersebut. Supaya elektron dalam ikatan sigma tereksitasi maka diperlukan energi paling tinggi dan akan memberikan serapan pada panjang gelombang 120-200 nm pengukurannya relatif mudah dan spektrumnya memberikan banyak keterangan (Supratman, 2010).
2.6.2 Spektrofotometer Inframerah (FT-IR)
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi getaran (vibrasi) yang berlainan. Inti-inti atom yang terikat oleh ikatan kovalen mengalami getaran (vibrasi) atau osilasi dengan cara dua bola yang terikat oleh suatu pegas. Bila molekul menyerap radiasi inframerah, energi yang diserap menyebabkan kenaikan dalam amplitude getaran atom-atom yang terikat itu. Jadi, molekul ini dalam keadaan vibrasi tereksitasi, energi yang diserap ini akan dibuang dalam bentuk panas bila molekul itu kembalike keadaan dasar. Panjang gelombang ekstrak dari absorpsi oleh suatu tipe ikatan yang berlainan (C-H, C-C, C=O, C=C, O-H, dan sebagainya) menyerap radiasi merah pada panjang gelombang yang berlainan.
Dengan demikian spektrometri inframerah dapat digunakan untuk mengidentifikasi adanya gugus fungsi dalam suatu molekul. Banyaknya energi yang diserap juga beraneka ragam dari ikatan ke ikatan. Ini disebabkan sebagian oleh perubahan dalam momen dipol (µ≠0)pada saat energi diserap. Ikaan nonpolar (seperti C-H atau C-C)
menyebabkan absorpsi lema, sedangkan ikatan polar (seperti misalnya O-H, N-H, dan C=O) menunjukkan absorpsi yang lebih kuat.
Suatu ikatan dalam sebuah molekul dapat mengalami berbagai vibrasi molekul. Secara umum terdapat dua tipe vibrasi molekul:
1. Streching (vibrasi regang/ulur: vibrasi sepanjang ikatan sehingga terjadi perpanjangan atau pemendekan ikatan.
2. Bending (vibrasi lentur/tekuk): vibrasi yang disebabkan oleh sudut ikatan sehingga terjadi perpanjangan atau pengecilan sudut ikatan.
Oleh karena itu suatu ikatan tertentu dapat menyerap energi lebih dari satu panjang gelombang. Contohya ikatan O-H menyerap energi pada frekuensi 3330 cm-
1, energi pada panjang gelombang ini menyebabkan kenaikan vibrasi regang ikatan O-H itu. Suatu ikatan OH juga menyerap kira-kira 1250 cm-1, energi pada panjang gelombang ini menyebabkan kenaikan vibrasi lentur. Tipe vibrasi yang berlain- lainan ini disebut cara vibrasi fundamental (Supratman, 2010).
2.6.3 Spektrofotometer Resonansi Magnetik Inti proton (1H-NMR)
Spektrofotometer Resonansi Magnetik Inti ( Nuclear Magnetic Resonance/
NMR) merupakan alat yang berguna pada penentuan struktur molekul organik.
Teknik ini memberikan informasi mengenai berbagai jenis atom hidrogen dalm molekul Spektrum Molekul Resonansi Inti memberikan informasi mengenai lingkungan kimia atom hidrogen jumlah atom hidrogen dalam setiap lingkungan dan struktur gugusan yang berdekatan dengan setiap atom hidrogen (Creswell, 1982).
Suatu molekul yang identik dalm lingkungan kimia akan memiliki pergeseran kimia yang sama. Dengan demikian, semua proton dari TMS atau semua proton dalam benzen, siklopentana, atau aseton memiliki nilai resonansi yang berdekatan pada nilai . Masing masing komponen akan memliki penyerapan yang tunggal dalam spektrum NMR. Proton ini dikatakan sama secara kimia. Pada kenyataannya, spektrum tidak dapat hanya dibedakan dari beberapa banyak tipe proton yang berbeda pada molekul tersebut, tetapi dapat memperlihatkan berapa banyak jenis perbedaan yang ada dalam molekul tersebut. Dalam spektrum NMR, daerah dibawah masing-masing peak adalah proposional dengan jumlah dari hidrogen yang ada pada peak tersebut.
Tabel 2.2 Pergeseran Kimia 1H-NMR Senyawa Organik pada umumnya
Metil Proton ppm Metilen Proton ppm
CH3-C 0,9 -CH2-C- 1,3
CH3-C-C=C 1,1 CH2-C-C=C 1,7
CH3-C=C 1,6 -CH2-C=C 2,3
CH3-Ar 2,3 -CH2-AR 2,7
CH3-O-Ar 2,6 -CH2-O-AR 2,9
-CH-C 1,5 -CH-C=C 2,2
(Pavia et al, 1995)
Pada beberapa spectrum NMR akan terlihat sinyal TMS pada angka nol sehingga sinyal ini tidak perlu dianalisa. TMS dipilih sebagai standart karena:
1. TMS mempunyai 12 atom hidrogen yang keseluruhannya mempunyai lingkungan kimia yang sama, sehingga menghasilkan singlet yang kuat karena mengandungbanyak atom hidrogen.
2. Elektron-elektron pada ikatan C-H dalam senyawa ini berada dekat dengan hidrogen jika disbanding dengan senyawa lain. Ini berarti inti hidrogen sangat terlindung dari medan magnet eksternal sehingga dibutuhkan medan magnet yang besar untuk membawa atom hidrogen ke kondisi resonansi (Dachriyanus, 2004).
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat
Sampel yang digunakan diperoleh dari Pasar Kedan MMTC Jl. Williem Iskandar, Medan pada bulan Maret 2019. Proses ekstraksi dan isolasi dilakukan di Laboratorium Kimia Bahan Alam hayati, Pasca Sarjana, FMIPA, Universitas Sumatera Utara (USU) pada bulan April sampai Agustus 2019. Identifikasi senyawa dilakukan pada bulan September 2019 meliputi analisa Identifikasi senyawa hasil isolasi yang meliputi analisa spektrofotometer UV-Vis, FT-IR dilakukan di Laboratorium Kimia Organik FMIPA UGM, Yogyakarta. Dan spektrofotometer 1H- NMR dilakukan di Laboratorium Penelitian Kimia ITB, Bandung
3. 2 Alat dan Bahan Penelitian 3.2.1 Alat
Adapun alat-alat yang digunakan dalam penelitian adalah: spektrofotometer ft-ir merek shimadzu, spektrofotometer 1h-nmr merek agilent 500 mhz, spektrofotometer uv-vis merek uv 1800, kolom kromatografi merek pyrex, rotarievaporator merek buchi, labu rotarievaporator merek schoot/duran dengan ukuran 1000 ml, corong kaca, corong pisah merek pyrex dengan ukuran 500 ml, gelas ukur merek pyrex, gelas erlenmeyer merek pyrex, chamber, lampu uv merek uvgl 58, neraca analitis merek mettler ae 200, penangas air, botol vial, gelas beker merek pyrex, batang pengaduk, spatula, pipet tetes, pipa kapiler, statif dan klem, alat destilasi, alat pengering.
3.2.2 Bahan
Adapun bahan-bahan yang digunakan dalam penelitian ini adalah: serbuk kulit bawang peking(s), metanol(aq) teknis, etil asetat(aq) teknis, aquadest(l), n- heksana(aq) teknis, kloroform(aq) p.a e.merck, benzena(aq) p.a merck, aseton(aq) p.a merck, silika gel 40(s) (70-90 mesh) ASTM E.merck.KgA, fecl3 5%(aq), kapas(s), plat klt silika gel 60 f254 E.merck.Art 554, plat klt preparatif 60 f254.
3.3 Prosedur Penelitian 3.3.1 Penyediaan Sampel
Sampel yang diteliti adalah kulit bawang peking berupa kulit bawang peking yang telah dibersihkan,dikeringkan,dihaluskan, sebanyak 2000 gr diperoleh dari Pasar Kedan MMTC Jl.Williem Iskandar, Medan.
3.3.2 Uji Pendahuluan Terhadap Kulit Tumbuhan Bawang Peking
Kulit tumbuhan bawang peking diidentifikasi dengan uji pereaksi warna menggunakan FeCl3 5%. Untuk membuktikan adanya senyawa fenolik yang terdapat dalam kulit tumbuhan bawang peking maka dilakukan uji pendahuluan secara kualitatif dengan reaksi warna sebagai berikut:
1. Dimasukkan 10 gram kulit tumbuhan bawang peking yang telah diris tipis-tipis ke dalam gelas erlenmeyer
2. Ditambahkan 100 mL metanol kedalam gelas erlenmeyer 3. Didiamkan selama 24 jam (sambil diaduk beberapa kali) 4. Didekantasi
5. Dimasukkan ekstrak metanol kedalam tabung reaksi 6. Ditambahkan pereaksi FeCl3 5%
7. Ekstrak metanol menghasilkan larutan berwarna hitam
3.3.3 Ekstraksi Kulit Tumbuhan Bawang Peking
Serbuk kering kulit tumbuhan bawang peking ditimbang sebanyak 2000 g, kemudian dimaserasi dengan metanol sebanyak 15 liter sampai semua sampel terendam dan dibiarkan selama 24 jam. Maserat ditampung dan dipekatkan dengan menggunakan alat rotarievaporator sehingga diperoleh ekstrak pekat metanol, kemudian diuapkan hingga semua pelarut metanol menguap.
Kemudian dilakukan pemisahan lemak dengan cara melarutkan metanol dengan menggunakan aquadest hingga negatif terhadap pereaksi FeCl3 5% dan disaring. Lalu filtrat aquadest dipartisi berulang-ulang dengan etil asetat untuk memisahkan tanin, hingga lapisan aquadest negatif terhadap pereaksi FeCl3 5%.
Lapisan etil asetat dipisahkan dari lapisan aquadest. Fraksi etil asetat kemudian dirotarievaporator lalu diuapkan hingga semua pelarut etil asetat menguap. Lalu
fraksi pekat etil asetat dilarutkan dengan metanol dan diekstaraksi partisi berulang ulang dengan n-heksana sampai lapisan n-heksana hampir bening. Lapisan metanol dipisahkan dari lapisan n-heksana, lalu dipekatkan kembali dengan rotarievaporator dan diuapkan kembali sehingga diperoleh ekstrak pekat metanol.
3.3.4 Analisa Kromatografi Lapis Tipis
Analisi kromatografi lapis tipis dilakukan terhadap ekstrak metanol dengan menggunakan fase diam silika gel 60 F254 Merck. Analisi ini dimaksudkan ntuk mencari system dan perbandingan pelarut yang sesuai untuk kromatografi kolom.
Fase gerak yang digunakan adalah campuran pelarut kloroform : metanol dengan perbandingan 90:10, 80:20, 70:30, 60:40 (v/v).
Dimasukkan kedalam 10 ml larutan fase gerak kloroform : metanol 90:10 (v/v) kedalam bejana kromatografi, kemudian dijenuhkan. Ditotolkan ekstrak pekat metanol pada plat KLT yang telah diaktifkan. Dimasukkan plat kedalam bejana yang telah berisi campuran pelarut yang telah dijenuhkan, lalu ditutup dan dielusi. Plat yang telah dielusi, dikeluarkan dari bejana, lalu dikeringkan.
Diamati noda yang terbentuk dibawah sinar UV, kemudian difiksasi dengan pereaksi FeCl3 5%. Di amati warna bercak yang timbul dan hitung harga Rf yang diperoleh. Perlakuan yang sama dilakukan untuk perbandingan pelarut kloroform : metanol dengan perbandingan 80:20, 70:30, 60:40 (v/v).
3.3.5 Pemisahan Senyawa Fenolik dengan Kromatografi Kolom
Pemisahan senyawa fenolik secara kromatografi kolom dilakukan terhadap ekstrak pekat kloroform yang telah diperoleh. Fasa diam yang digunakan adalah silika gel 40 (70-230 mesh) ASTM dan fasa gerak yaitu kloroform 100 %, campuran pelarut dengan kloroform : metanol dengan perbandingan 90:10, 80:20 (v/v).
Terlebih dahulu dirangkai alat kromatografi kolom, kemudian dibuburkan 6 g ekstrak pekat metanol dengan silika gel dengan menggunakan pelarut metanol, kemudian dimasukkan kedalam kolom yang telah berisi bubur silika gel. Lalu ditambahkan fasa gerak kloroform : metanol 90:10 (v/v) secara perlahan-lahan dan diatur agar aliran fasa yang keluar dari kolom sama banyaknya dengan penambahn fasa gerak dari atas.
Di tingkatkan kepolaran dengan menambahkan fasa gerak kloroform : metanol
80:20 (v/v). Hasil yang diperoleh ditampung dalam botol vial setiap 10 ml, lalu di KLT dan digabung fraksi dengan harga Rf yang sama dan kemudian dibiarkan pada suhu ruangan hingga terbentuk kristal jarum berwarna kuning.
3.3.6 Pemurnian
Kristal jarum berwarna kuning yang diperoleh dari hasil isolasi dengan hasil positif fraksi 20-135 dan digabungkan fraksi dengan harga Rf yang sama dengan menggunakan KLT. Dihasilkan 3 fraksi gabungan yakni fraksi I: 20-65, fraksi II: 66- 110, fraksi III: 111-135. Kemudian semua fraksi diuapkan hingga berbentuk pasta, selanjutnya dilarutkan dengan metanol untuk menentukan fraksi yang akan dilanjutkan dan untuk menentukan fasa gerak yang akan digunakan pada kromatografi lapis tipis preparatif (KLTP). Fraksi penggabungan yang dilanjutkan akan dimurnikan dengan KLTP menggunakan eluen kloroform : etil asetat 80:20 (v/v). Kemudian sampel ditotolkan pada batas bawah yang telah ditentukan, kemudian dimasukkan kedalam chamber yang telah berisi eluen dan didiamkan sampai pelarut naik hingga batas atas. Kemudian dikeringkan dan disinari dengan lampu UV. Plat digerus, lalu dilarutkan dengan metanol : etil asetat 1:1 dan disaring.
Filtrat diuji FeCl3 5% dan fraksi positif akan diuapkan hingga kering dan selanjutnya akan diuji kemurnian.
3.3.7 Uji Kemurnian Hasil Isolasi degan Kromatografi Lapis Tipis (KLT) Uji kemurnian Padatan amorf dilakukan dengan KLT yaitu dengan fasa diam silika 60 F254 dengan fasa gerak kloroform : etil asetat 80:20 (v/v) dan benzena:etil asetat 80:20 (v/v) . Dimasukkan 10 ml larutan fasa gerak kedalam bejana kromatografi lapis tipis, lalu dijenuhkan. Ditotolkan ekstrak pada plat KLT.
Dimasukkan plat KLT tersebut kedalam bejana yang telah jenuh. Setelah pelarut fasa gerak merembes sampai batas atas , plat KLT dikeluarkan dari bejana, dikeringkan, diamati dibawah sinar UV, dan difiksasi dengan menggunakan pereaksi FeCl3 5%
dalam metanol menghasilkan bercak berwarna hitam yang menunjukkan adanya senyawa fenolik dan dihitung harga Rf yang diperoleh
3.4 Identifikasi Senyawa Hasil Isolasi
Analisis kemurnian senyawa hasil isolasi dilakukan uji dengan tiga jenis spektrofotometer yaitu spektrofotometer UV-Visibel, spektrofotometer Inframerah (FT-IR), spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR).
3.4.1 Analisa dengan Spektrofotometer UV-Visibel
Analisis dengan alat Spektrofotometer Uv-Visibel dilakukan di Laboratorium Kimia Organik FMIPA UGM, Yogyakarta dengan menggunakan pelarut metanol.
Nama : Spektrofotometer UV-Visibel
Spesifikasi : Merek Shimadzu, UV 1800 Waktu Pengerjaan : 30 Agustus 2019
Teknisi Penanggung Jawab : Roch Fitni
3.4.2 Analisa dengan Spektrofotometer Inframerah (FT-IR)
Analisis dengan alat Spektrofotometer Inframerah (FT-IR) dilakukan di Laboratorium Kimia Organik FMIPA UGM, Yogyakarta dengan menggunakan pelet KBR.
Nama : Spektrofotometer FT-IR
Spesifikasi : Merek Shimadzu, Prastige 21 Waktu Pengerjaan : 30 Agustus 2019
Teknisi Penanggung Jawab : Roch Fitni
3.4.3 Analisa dengan Spektrofotometer Resonansi Magnetik Inti Proton (1H- NMR)
Analisa dengan alat Spektrofotometer Resonansi Magnetik Inti Proton (1H- NMR) dilakukan di Laboratorium Kimia Bahan Alam ITB, Bandung dengan menggunakan pelarut.
Nama : Spektrofotometer NMR
Spesifikasi : Merek Agilent, Frekuensi 500 MHz (1H), Sistem Konsol DD2
Waktu Pengerjaan : 03 September 2019 Teknisi Penanggung Jawab : Dr. Elvira Hermawati
3.5 Bagan Penelitian
3.5.1 Bagan Uji Fenolik dengan pelarut Metanol
3.5.2 Bagan Isolasi Senyawa Fenolik dari Kulit Tumbuhan Bawang Peking (Allium cepa L).
Lanjutan
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
Dari hasil uji pendahuluan dengan pereaksi warna terhadap ekstrak metanol dari kulit tumbuhan bawang peking (Allium cepa L.) menggunakan pereaksi FeCl3 5% untuk menentukan senyawa fenolik ternyata sampel positif mengandung turunan senyawa fenolik dari metal galat yaitu 3,5-dihidroksimetilbenzoat.
Hasil elusi dari perbandingan eluen kloroform : metanol 90:10 (v/v) pada fraksi 20-65, dilakukan KLT preparatif dengan eluen kloroform : etil asetat 80:20 (v/v) untuk mendapatkan senyawa murni, Sehingga diperoleh senyawa murni berupa padatan amorf seberat 8,9 mg dengan nilai Rf=0,54.
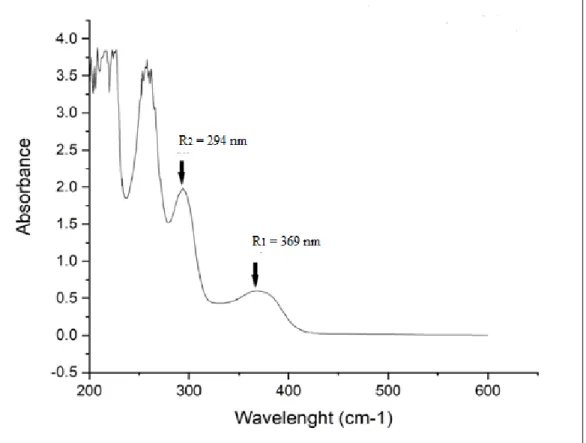
Berikut adalah spektrum UV-Visibel senyawa hasil isolasi dengan menggunakan pelarut metanol :
Gambar 4.1 Spektrum UV-Visibel Senyawa Hasil Isolasi
Tabel 4.1 Serapan panjang Gelombng Ultraviolet-Visibel (UV-Vis) senyawa hasil isolasi
Puncak Panjang gelombang Absorbansi
1 369 0,600
2 294 1,982
Berikut hasil analisis spektrofotometer FT-IR dari senyawa hasi isolasi :
Gambar 4.2 Spektrum Inframerah (FT-IR) Senyawa Hasil Isolasi
Dari analisis Spektrofotometer Inframerah (FT-IR) memberikan pita-pita serapan pada daerah bilangan gelombang (cm-1) seperti pada Tabel berikut:
Tabel 4.2 Interpretasi Spektrum FT-IR Senyawa Hasil Isolasi Bilangan
gelombang (cm-1)
Bilangan
gelombang literature (cm-1) (Pavia et al, 1979)
Intensitas Gugus fungsi
3263,56 3600-3200 Lebar
Lebar
O-H
C-H Aromatis
2924,09-2826,36 2980-2800 Lebar C-H Alifatis
1674,21 1800-1640 Tajam C=O Ester
1604,77-1458,18 1600-1475 Tajam C=C Aromatis
1296,16 1300-1100 Tajam C-O-C
Gambar 4.3 adalah hasil analisis Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dengan menggunakan pelarut metanol dan TMS sebagai standar internal:
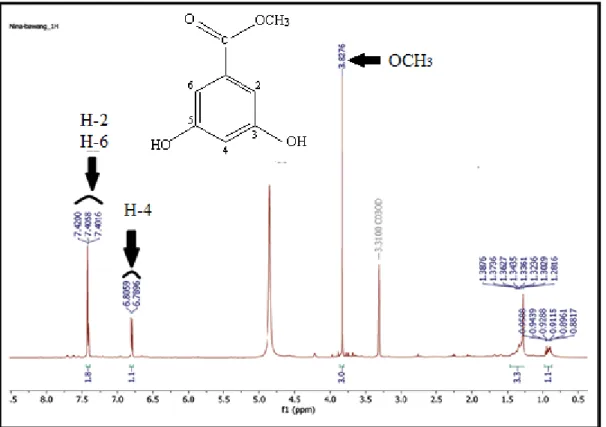
Gambar 4.3 Spektrum 1H-NMR Senyawa Hasil Isolasi
Hasil analisis Spektrofotometer Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dengan menggunakan pelarut metanol dan TMS sebagai
standar yang memberikan signal-signal pergeseran kimia dengan penjelasan pada Tabel 4.3 berikut:
Tabel 4.3 Pergeseran Kimia 1H-NMR Senyawa Hasil Isolasi
Proton H Senyawa Hasil Isolasi Puncak
H-2 & H-6 dari cincin Aromatik
7,4200 Singlet
H-4 dari cincin Aromatik 6,8059 – 6,7896 Doublet
H dari OCH3 (Metoksi) 3,8276 Singlet
4.2 Pembahasan
Dari hasil isolasi senyawa fenolik dari kulit tumbuhan bawang peking (Allium cepa L.) mulai dari proses ekstraksi maserasi dengan menggunakan pelarut metanol diperoleh ekstrak pekat sebanyak 210 gram, kemudian dilarutkan dengan menggunakan aquadest untuk pemisahan lemak, lalu diekstraksi partisi menggunakan etil asetat untuk memisahkan senyawa yang diduga merupakan tanin dan diperoleh ekstrak pekat etil asetat sebanyak 20,85 gram. Ekstrak pekat yang diperoleh dilarutkan dengan metanol, kemudian diekstraksi partisi dengan menggunakan pelarut n-heksana hingga diperoleh ekstrak pekat metanol sebanyak 17,64 gram. Dianalisis kromatografi lapis tipis sebelum komatografi kolom dan didapat perbandingan pelarut yang sesuai untuk mengisolasi senyawa fenolik dari ekstrak kulit bawang peking adalah kloroform : metanol 80:20 (v/v) yang menunjukkan pemisahan yang lebih baik dari noda yang dihasilkan. Hal ini membuktikan dengan analisis KLT yang menunjukkan adanya empat noda dengan jarak pisah antar noda yang baik (Lampiran 2). Setelah pemisahan dengan kromatografi kolom kemudian dilakukan analisis KLT untuk penggabungan fraksi dan didapatkan 3 fraksi. Fraksi yang dilanjutkan adalah fraksi yang pertama dimana berdasarkan hasil KLT setelah penggabungan (Lampiran 3) fraksi pertama menunjukkan adanya pemisahan noda yang baik dan lebih positif terhadap pereaksi FeCl3 5%, fraksi pertama yang dilanjutkan adalah sebanyak 856,9 mg lalu dianalisis KLT kembali dengan sistem pelarut kloroform : etil asetat 80:20 (v/v), yang selanjutnya dikromatografi lapis tipis preparatif dengan sistem pelarut yang cocok
adalah kloroform : etil asetat 80:20 (v/v), diamati dengan lampu UV, lalu diambil 3 noda positif yaitu noda keempat, keenam dan ketujuh (Lampiran 4). Kemudian silika gel digerus dan dielusi dengan perbandingan pelarut metanol : etil asetat 1:1 (v/v). Selanjutnya hasil elusi diuapkan hingga pelarut habis menguap, lalu di uji kemurnian dengan KLT menggunakan pelarut kloroform : etil asetat 80:20 (v/v) diperoleh noda tunggal pada fraksi ke empat yang menyatakan bahwa senyawa tersebut sudah murni dengan harga Rf=0,54 dan untuk lebih memastikannya lagi diuji kemurnian dengan menggunakan pelarut benzena : etil asetat 80;20 (v/v) (Lampiran 5). Kemudian dikristalisasi dengan pelarut aseton : n-heksana hingga terbentuk padatan amorf dengan berat 8,9 mg.
Hasil senyawa yang diisolasi menggunakan metode spektroskopi antara lain UV-Visibel digunakan untuk menentukan struktur berdasarkan adanya ikatan rangkap, FT-IR digunakan untuk menentukkan struktur berdasarkan gugus fungsi, kemudian dengan 1H-NMR digunakan untuk menentukan struktur berdasarkan jumlah proton.
Dari hasil interpretasi Spektrokopi UV-Visibel diperoleh panjang gelombang 369 pada pita I, dan 294 pada pita II namun tidak menunjukkan adanya panjang gelombang untuk senyawa fenolik dari metil galat. Dari hasil interpretasi spektrum
1H-NMR dengan menggunakan pelarut metanol dalam standar TMS (Gambar 4.3) diperoleh pergeseran kimia pada daerah = 3,8276 ppm yaitu puncak singlet menunjukkan proton –OCH3 (Lampiran 6) dan ini dapat dibandingkan dengan proton H pada NMR dari senyawa pembanding yang diisolasi dari Archidendron Jiringa yang memiliki pergeseran kimia pada daerah = 3.8142 ppm (Lampiran 8).
Hal ini juga didukung oleh Spektrum Inframerah (FT-IR) (Gambar 4.2) pada bilangan gelombang 2924,09-2862,36 cm-1 puncak menunjukkan intensitas lebar CH alifatis dan bilangan gelombang 1296,16 cm-1 menunjukkan intensitas tajam dari C- O-C. Pada daerah = 7,4200 ppm terdapat puncak singlet yang menunjukkan proton dari H-2 dan H-6, dan pada daerah = 6,8059-6,7896 ppm terdapat puncak doublet yang menunjukkan proton H posisi 4 pada cincin aromatis senyawa fenolik (Lampiran 7) dan dapat dibandingkan metil galat yang diisolasi dari Archidendron Jiringa dua proton pada posisi 2 dan 6 pada pergeseran kimia = 7,0362 ppm (Lampiran 8). Hal ini didukung adanya spektrum IR pada bilangan gelombang
1604,77 - 1458,18 cm-1 den intensitas tajam menunjukkan adanya ikatan C=C dan pada bilangan gelombang 3263,56 menunjukkan intensitas lebar dari C-H pada sistem aromatis, dan bilangan gelombang 1674,21 menunjukkan intensitas C=O tajam. Berikut tabel 4.4 perbandingan hasil senyawa isolasi dan senyawa pembanding :
Tabel 4.4 Perbandingan Proton 1H-NMR senyawa isolasi dan senyawa pembanding Proton H Senyawa Hasil Isolasi H Senyawa Pembanding H-2 & H-6 dari cincin
Aromatis
=7,4200 = 7,0362
H-4 dari cincin Aromatis = 6,8059 – 6,7896 ―
H dari OCH3 (Metoksi) = 3,8276 = 3,8142
Berdasarkan analisis data dan interpretasi yang dilakukan pada spektrum UV- Visibel, Spektrum Inframerah (FT-IR), Spektrum 1H-NMR disimpulkan bahwa kristal yang diisolasi dari kulit tumbuhan bawang peking (Allium cepa L.) diperoleh turunan senyawa fenolik dari metil galat. Berikut struktur turunan senyawa metil galat pada gambar 4.4:
Gambar 4.4 Struktur Turunan Senyawa Metil Galat (3,5-dihidroksimetilbenzoat)
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil isolasi pada kulit tumbuhan bawang peking (Allium cepa L.) sebanyak 2000 gr diperoleh kristal jarum berwarna kuning sebanyak 8,9 mg dengan harga Rf = 0,54. Hasil analisis senyawa isolasi kulit tumbuhan bawang peking dengan Spektrofotometer UV-Visibel, Spektrofotometer Inframerah (FT-IR) dan Spektrofotometer Resonansi Magnetik Inti Proton 1H-NMR menunjukkan turunan senyawa fenolik dari metil galat yaitu 3,5-dihidroksimetilbenzoat.
5.2 Saran
Kepada peneliti selanjutnya disarankan untuk melakukan analisis Spektrofotometer Karbon ( 1C-NMR) dan Spektrofotometer Massa (MS) supaya lebih mendukung struktur turunan senyawa metil galat (3,5-dihidroksimetilbenzoat).
DAFTAR PUSTAKA
Bhat, S.V., Nagasampagi, B.A., Sivakumar, M. 2005. Chemistryof Natural Products.
Naros Publishing House. New Delhi.
Brown, D.W. 1988. Organic Spectroscopy. Thomson Press. New Delhi
Cresswell, C.J, 1982. Analisis Spektrum Senyawa Organik. Edisi kedua. Penerbit ITB. Bandung
Dahriyanus. 2004. Analisis Struktur Senyawa Organik Secara Spektroskopi. Andalas Univerity Press. Padang
Firdaus, M., Prihanto, A.A., Nurdiani, R. 2013. Tanaman Bakau Biologi dan Bioaktivitas. Universitas Brawijaya Press (UB Press). Malang
Fessenden, R.J. 1982. Kimia Organik. Jilid I. Cetakan Kedua. Terjemahan. Aloysius Pudjaatmaka. Erlangga. Jakarta
Gandjar, I.G., Rohman, A. 2007. Kimia Farmasi Analsis. Pustaka Pelajar.
Yogyakarta
Gritter, R.J. 1991. Pengantar Kromatografi. Edisi Kedua. Penerbit ITB. Bandung Harbone, J.B., Mabry, T. J. 1987. Metode Fitkimia. Terbitan Kedua. Penerbit ITB
Bandung
Harmita. 2015. Analisis Fisikokimia. Volume 1 dan 2. Penerbit Buku Kedokteran.
Depok
Heinrich,M., Barnes, J., Gibbons, S., Williamson, A. 2009. Farmakognosi dan Fitoterapi. Penerbit Buku Kedokteran EGC. Jakarta Huang D, Ou B Prior RL, 2005. The Chemistry Behind Antioxidant Capacity Assay
ITB. Bandung
Ide, P. 2008. Dark Chocolate Healing. Pt Lex Media Komputido. Jakarta
Khopkar, R. 1990. Konsep Dasar Analitik. Penerbit Universitas Indonesia. Jakarta Kristanti, N.A., Aminah, S.N., Tanjung, M., Kurniadi, B. 2008. Buk Ajar Fitokima.
Airlangga University Press. Surabaya.
Lubis, M.Y., Siburian, R., Marpaung, L., Simanjuntak, P., Nasution, M.P. 2018.
Methyl Gallate From Jiringa (Archidendron Jiringa) And Antioxidant Activity. Asian Journal Of Pharmaceutical and Clinic Research. Indonesia.
347-348
Manito, P.1981. Biosintesis Produk Alami. Terjemhan Kosasi Padmawinata. ITB Press. Bandung.
Marinova, D., Ribarova, F., Atanassova, M. 2005. Total Fenolic and Total Flavonoids in Bulgarian Fruit and Vegetablesn. Technol Metal. J Univ Chem
Muldja, M.H. 1995. Analisis Instrumental. Cetakan Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. Edisi Keenam. Penerbit ITB. Bandung.
Pavia, D.L., Lampman, G.M. 1995. Introduction to Organic Laboratory Techniques A Microscale Approac. Second Edition. Sunders College. Philadelphia
Pengelly, W.L., Vuayaraghavan, S.J., Sciaky, D. 1986. Neoplatic Progression In Crown Gall In Tobacco Whitout Elevated Auxin Levels. Planta
Ringo, C.M. 2008. Isolasi Senyawa Flavonoida Dari Kulit Bawang merah (Allium cepa L.). Departemen Kimia, FMIPA, Universitas Sumatera Utara. Medan.
Saifudin, A. 2014. Senyawa Alam Metabolit Sekunder Teori, Konsep dan Pemurnia.
Deepublish. Yogyakarta
Sarker, S. 2006. Natural Product Isolation. Second Edition. Humana Press Inc. New Jersey
Sastrahamidjojo, H. 1996. Sintesis Bahan Alam. Gadjah Mada University Press,
Yogyakarta.
Sitindaon, A. 2015. Studi Morfologi dan Produks Lima Varietas Bawang Merah (Allium cepa var.asc Balonicum) di Dessa Pardomuan, Kabupaten Samosir.
Jurusan Biologi Fakultas MIPA, Universitas Negeri Medan, Medan.
Supratman, U. 2010. Elusidasi Struktur Senyawa Organik. Penerbit Widya Padjajaran. Bandung
Sohi, K.K., Mittal, N., Hundal, M.k., Khanduja, K.L. 2003. Gallic acid, and Antioxidant, Exhibits Antiapoptotic potential in Normal Human Lympocytes:
A Bcl-2 independent Mechanism. J. Nutr. Sci. Vitaminol
Vermerris, W., and Nicholson, R. 2006. Phenolic Chompound Biochemistry.
Springer. The Netherlands
Watson, R.R. 2014. Pholypenol In Plants Isolation, Purification, and Extract Preparation. Elsivier, Inc. Amsterdan
Yulianti, E.R. 2018. Pengantar Radikal Bebas dan Antioksidan. Deepublish Publisher. Yogyakarta
Lampiran 1. Hasil Determinasi Tumbuhan Bawang Peking (Allium cepa L.)
Lampiran 2. Kromatografi Lapis Tipis ekstrak Pekat Metanol Kulit Tumbuhan Bawang Peking (Allium cepa L.) Sebelum Kromatografi Kolom
Keterangan:
Fase Diam = Kiesel ge 60 F254
E = Ekstrak Pekat metanol Kulit Bawang Peking Rf = jarak noda banding jarak pelarut
Fase Gerak Jumlah Noda Rf
Kloroform : Metanol 80:20 (v/v) 4 0,92 0,84 0,68 0,34
Lampiran 3. Kromatografi Lapis Tipis Ekstrak serbuk Kulit Tumbuhan Bawang Peking Setelah Penggabungan Fraksi
Keterangan :
Fase Diam = Kiesel gel 60 F254
E = Fraksi Pekat metanol Kulit Bawang Peking Rf = jarak noda banding jarak pelarut
No Fraksi Jumlah Noda Rf
I 20-65 3 0,97
0,93 0,74
II 66-110 3 0,97
0,93 0,78
III 111-135 2 0,97
0,63