KIMIA DASAR 1
UNTUK SARJANA PENDIDIKAN ILMU PENGETAHUAN ALAM Muntholib
Diterbitkan Oleh:
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI MALANG
KATA PENGANTAR
Alhamdulillah, penyusunan KIMIA DASAR 1 UNTUK PROGRAM S1 PENDIDIKAN IPA ini dapat diselesaikan. Buku ini mengambil dua referensi utama, yaitu GENERAL CHEMISTRY: THE ESSENTIAL CONCEPTS, SIXTH EDITION (Chang and Overby, 2011) dan INTRODUCTION TO CHEMISTRY: A CONCEPTUAL APPROACH, SECOND EDITION (Bauer, Birk and Marks, 2010). Buku ini terwujud berkat kerja sama banyak pihak. Oleh sebab itu pada kesempatan ini penulis mengucapkan terima kasih yang tulus kepada: 1. Ketua Program Studi S1 Pendidikan IPA FMIPA UM, Dra. Sri Rayahu, M.Ed., Ph.D.,
yang telah mendorong penulis untuk menyelesaikan karya ini.
2. Bapak Prayitno yang secara konsisten mendorong, memotivasi dan meminta penulis untuk menyelesaikan pekerjaan ini dengan baik.
3. Saudari Yunilia, Amalia, Viruzi dan Oscar yang telah membantu penulis melakukan uji coba keterlaksanaan praktikum ini melalui Matakuliah Praktikum Kimia Dasar 1 untuk Mahasiswa S1 Pendidikan IPA FMIPA UM Semester 1 tahun kuliah 2012/2013.
4. Secara khusus penulis juga menyampaikan terima kasih kepada Istri Tercinta, Nurul Khumaidah, dan anak-anak tersayang, Mulki Auly Poetry, Malik Aljabar Muhammad dan Malik Al-Mizan Muhammad atas kesempatan yang diberikan sehingga penulis bisa menyelesaikan pekerjaan ini.
Kepada mereka berlaku janji Allah: Barang siapa berbuat baik atas dasar iman meskipun hanya sebesar atom niscaya Allah tetap akan membalasnya dengan kebaikan kelak dihari yang tiada lagi pertolongan kecuali hanya amal shalih.
Akhirnya semoga produk pengembangan ini bermanfaat dan dapat dilanjutkan untuk bahan ajar yang lain dan dengan hasil yang lebih baik. Amiin.
Malang, 8 Desember 2012 Penulis
DAFTAR ISI
KATA PENGANTAR ... 1
DAFTAR ISI ... 1
BAB 1. PENDAHULUAN ... 1
BAB 2. ATOM, MOLEKUL, DAN ION ... 29
2.1 TEORI ATOM ... 29
2.2 STRUKTUR ATOM ... 31
Elektron ... 31
Radioaktivitas ... 33
Proton dan Inti Atom ... 34
Neutron ... 36
2.3 Nomor Atom, Nomor Massa, dan Isotop ... 37
2.4 Tabel Periodik ... 39
2.5 Molekul dan Ion ... 41
Molekul ... 41 Ion ... 41 2.6 Rumus Kimia ... 42 BAB 3. STOIKIOMETRI ... 61 BAB 4. LARUTAN ... 105 BAB 5. GAS ... 165
BAB 1.
PENDAHULUAN
DESKRIPSI
Ilmu Kimia: Kimia adalah ilmu yang mempelajari tentang materi dan perubahan-perubahannya. Unsur dan senyawa adalah zat yang ambil bagian dalam transformasi kimia.
Sifat Fisika dan Kimia: Untuk mengkarakterisasi suatu zat, kita perlu mengetahui sifat fisika dan kimianya. Sifat fisika dapat diamati tanpa mengubah jenis zat, sedangkan sifat kimia hanya dapat diketahui apabila zat tersebut mengalami perubahan kimia.
Pengukuran dan Satuan: Kimia adalah ilmu kuantitatif yang membutuhkan pengukuran. Ukuran kuantitas biasanya memiliki satuan yang terkait dengan kuantitas tersebut, misalnya satuan massa, volume, kerapatan, dan satuan suhu. Satuan-satuan yang digunakan dalam kimia didasarkan pada sistem internasional (SI).
Penanganan Angka: Notasi ilmiah digunakan untuk mengekspresikan bilangan besar dan bilangan kecil. Setiap angka dalam pengukuran harus menunjukkan angka yang berarti yang disebut angka penting.
Melakukan Hitungan Kimia: Cara sederhana dan efektif untuk melakukan perhitungan kimia adalah analisis satuan. Dalam prosedur ini, persamaan diatur sedemikian rupa sehingga semua satuan dapat dihilangkan / dicoret kecuali satuan untuk jawaban akhir.
KOMPETENSI
Menentukan sifat materi dan perubahannya. Unsur dan senyawa merupakan zat yang terlibat dalam perubahan kimia.
Mendeskripsikan perbedaan antara sifat fisika dan sifat kimia. Sifat fisika dapat diamati tanpa adanya perubahan identitas suatu zat sedangkan sifat kimia hanya dapat ditunjukkan melalui perubahan kimia.
Mengukur kuantitas yang biasanya digunakan dalam pengukuran kimia; massa, volume, massa jenis, dan temperatur dan mengaplikasikan satuan yang berhungan dengannya. Satuan yang digunakan dalam kimia didasarkan pada sistem satuan internasional (SI).
Menangani notasi ilmiah yang digunakan untuk menyatakan besar dan kecilnya bilangan dan pengukuran yang mengindikasikan angka bermakna yang dikenal dengan angka penting.
Melakukan perhitungan sederhana dan efektif untuk hitungan kimia; mengatur persamaan sedemikian rupa sehingga semua satuan dapat dihilangkan / dicoret kecuali satuan untuk jawaban akhir.
TUJUAN
Mengetahui sifat materi dan perubahannya.
Memahami perbedaan antara sifat fisika dan sifat kimia.
Mengukur kuantitas yang biasanya digunakan dalam pengukuran kimia; massa, volume, massa jenis, dan temperatur dan mengaplikasikan satuan yang berhungan dengannya.
Menangani notasi ilmiah yang digunakan untuk menyatakan besar dan kecilnya jumlah dan pengukuran yang mengindikasikan angka penting, gambaran yang signifikan.
Melakukan perhitungan yang sederhana dan efektif to menunjukkan perhitungan kimia
1.1 Ilmu Kimia
Apakah ini merupakan pelajaran kimia pertama atau bukan, yang pasti Saudara telah memiliki pengetahuan tentang kimia dan pengetahuan tentang apa yang dilakukan oleh ahli kimia. Bisa jadi, Saudara berpikir bahwa kimia dipraktekkan di laboratorium oleh orang yang mengenakan jas putih yang mempelajari hal-hal yang terjadi dalam tabung reaksi. Sampai titik tertentu, deskripsi ini baik-baik saja. Kimia terkait erat dengan eksperimental dan banyak pengetahuan kimia yang berasal dari penelitian laboratorium. Namun demikian, di samping percobaan di laboratorium, saat ini ahli kimia menggunakan komputer untuk mempelajari struktur mikroskopik dan sifat kimia zat atau memanfaatkan peralatan elektronik canggih untuk menganalisis polutan dari emisi kendaraan atau zat beracun dalam tanah. Banyak aspek dalam biologi dan kedokteran yang saat ini sedang dieksplorasi pada tingkat atom dan molekul. Kimiawan berpartisipasi dalam pengembangan obat baru dan dalam penelitian pertanian. Terlebih lagi, mereka mencari solusi terhadap masalah pencemaran lingkungan dengan cara mengganti sumber energi. Kebanyakan industri, apapun produk mereka, memiliki dasar kimia. Misalnya, kimiawan mengembangkan polimer (molekul yang sangat besar) yang digunakan oleh produsen untuk membuat berbagai macam barang kebutuhan, termasuk pakaian, peralatan memasak, organ buatan, dan mainan. Karena penggunaannya beragam, kimia sering disebut sebagai "central science."
Bagaimana Mempelajari Kimia
Dibandingkan dengan mata pelajaran yang lain, kimia umumnya dianggap lebih sulit, setidaknya pada tingkat dasar. Persepsi ini memiliki beberapa alasan. Kimia memiliki kosakata yang sangat khusus. Bahkan untuk belajar pertama, belajar kimia seperti
STOIKIOMETRI 3
belajar bahasa baru. Selain itu, konsep-konsep juga abstrak. Walaupun demikian, dengan ketekunan Saudara bisa menyelesaikan perkuliahan ini dengan sukses dan bahkan mungkin dengan menyenangkan. Berikut ini beberapa saran yang dapat Saudara gunakan untuk membentuk kebiasaan belajar yang baik dan menguasai materi:
• Menghadiri perkuliahan secara teratur dan membuat catatan dengan baik.
• Jika memungkinkan, buatlah review(tinjauan) terhadap topik-topik yang Saudara pelajari dan dibahas di kelas setiap hari secara terus-menerus. Gunakan buku review ini untuk melengkapi catatan kuliah Saudara.
• Berpikirlah secara kritis. Tanyakan kepada diri Saudara apakah Saudara benar-benar
memahami makna istilah atau penggunaan persamaan yang Saudara pelajari. Cara yang baik untuk menguji pemahaman Saudara adalah dengan cara menjelaskan konsep tersebut kepada teman sekelas Saudara atau orang lain.
• Jangan ragu untuk minta tolong kepada dosen atau asisten dosen Saudara.
Saudara akan menemukan bahwa kimia tidak sekedar angka, rumus, dan teori-teori abstrak, tetapi jauh lebih bermakna dari itu semua. Kimia adalah disiplin ilmu yang logis dan penuh dengan ide-ide yang menarik dan aplikatif.
1.2 Metode Ilmiah
Semua ilmu, termasuk ilmu-ilmu sosial, menggunakan suatu pendekatan sistematis dalam penelitiannya yang disebut metode ilmiah. Sebagai contoh, seorang psikolog yang ingin tahu tentang pengaruh kebisingan terhadap kemampuan orang untuk belajar kimia dan ahli kimia yang tertarik dalam mengukur panas yang dilepaskan ketika gas hidrogen terbakar di udara mengikuti prosedur yang kira-kira sama dalam melaksanakan penyelidikan mereka. Langkah pertama adalah mendefinisikan masalah. Langkah selanjutnya termasuk melakukan percobaan, membuat pengamatan yang cermat, dan merekam informasi, atau data, tentang sistem, yaitu bagian dari alam semesta yang sedang diselidiki. (Dalam contoh ini, sistem adalah sekelompok orang yang akan dipelajari psikolog dan campuran hidrogen dan udara.) Data yang diperoleh dalam studi penelitian dapat berupa data kualitatif, yang terdiri dari pengamatan umum tentang sistem, dan data kuantitatif, mencakup angka yang diperoleh dari pengukuran berbagai sistem. Ahli kimia umumnya menggunakan simbol-simbol standar dan persamaan dalam pencatatan pengukuran dan pengamatan mereka. Representasi dalam hal ini tidak hanya menyederhanakan dalam proses menyimpan catatan, tetapi juga menyediakan dasar umum untuk komunikasi dengan ahli kimia lainnya.
Ketika percobaan telah selesai dan data telah dicatat, langkah berikutnya dalam metode ilmiah adalah interpretasi, yang berarti bahwa ilmuwan mencoba untuk menjelaskan fenomena yang diamati. Berdasarkan data yang dikumpulkan, peneliti merumuskan
hipotesis, atau penjelasan tentatif (belum pasti) untuk satu set pengamatan. Percobaan lebih lanjut direncanakan untuk menguji validitas hipotesis dengan cara sebanyak mungkin, dan proses dimulai lagi.
Setelah sejumlah data telah dikumpulkan, sering diinginkan untuk meringkas informasi
dengan lebih singkat, sebagai hukum. Dalam ilmu pengetahuan, hukum adalah
pernyataan verbal atau pernyataan matematis dari hubungan antara fenomena yang selalu sama di bawah kondisi yang sama. Misalnya, hukum kedua Sir Isaac Newton tentang gerak, yang mungkin Anda ingat dari SMA, mengatakan bahwa gaya sama dengan massa dikali percepatan suatu benda (F = ma). Hukum ini berarti bahwa peningkatan massa atau dalam percepatan suatu benda selalu meningkatkan gaya benda secara proporsional, dan penurunan massa atau percepatan selalu menurunkan gaya. Hipotesis yang dapat dipertahankan dengan banyak pengujian eksperimental dan
banyak validitas dapat berkembang menjadi teori. Teori adalah Kesatuan prinsip yang
menjelaskan tubuh fakta dan/atau hukum-hukum yang didasarkan pada mereka. Teori juga, secara terus menerus diuji. Jika suatu teori dibantah oleh eksperimen, maka harus dibuang atau diubah sehingga menjadi konsisten dengan pengamatan eksperimental. Membuktikan atau tidak membuktikan teori dapat berlangsung tahunan, bahkan berabad-abad, sebagian karena teknologi yang diperlukan tidak tersedia. Teori atom adalah contonhnya. Butuh waktu lebih dari 2000 tahun untuk keluar dari prinsip dasar kimia yang diusulkan oleh Democritus, seorang filsuf Yunani kuno.
Kemajuan ilmiah jarang terjadi, jika pernah, dibuat dengan cara kaku, langkah-demi-langkah. Beberapa kali hukum mengawali teori, kadang-kadang sebaliknya. Dua ilmuwan dapat mulai bekerja pada sebuah proyek dengan tujuan yang sama persis, tetapi dapat menggunakan pendekatan yang berbeda. Mereka akan dibuat dalam arah yang sangat berbeda. Para ilmuwan, setelah semua, manusia, dan cara mereka berpikir dan bekerja sangat dipengaruhi oleh latar belakang, pelatihan, dan kepribadian mereka. Perkembangan ilmu pengetahuan sudah tidak teratur dan kadang-kadang tidak masuk akal. Penemuan besar biasanya hasil dari kontribusi kumulatif dan pengalaman dari banyak pekerja, meskipun kredit untuk merumuskan teori atau hukum biasanya diberikan hanya pada satu individu. Ada, tentu saja, unsur keberuntungan yang terlibat dalam penemuan ilmiah, tetapi telah dikatakan bahwa "Kesempatan menganugerahi pikiran yang siap”. Pernyataan tersebut memberitahu bahwa dibutuhkan orang yang waspada dan terlatih untuk mengenali makna dari penemuan yang tak disengaja dan mengambil keuntungan penuh dari itu. Lebih sering dari itu, masyarakat hanya belajar dari terobosan ilmiah yang spektakuler. Untuk setiap kisah sukses, namun, ada ratusan kasus di mana para ilmuwan bertahun-tahun bekerja pada proyek-proyek yang pada akhirnya mengarah ke jalan buntu. Prestasi positif hanya datang setelah salah berbelok dan banyak pada langkah lambat yang mereka tidak pernah mulai. Namun, bahkan jalan buntu berkontribusi terhadap beberapa hal bagi perkembangan pengetahuan tentang alam semesta fisik secara kontinyu. Ini adalah bentuk cinta dari pencarian yang menjaga banyak ilmuwan di laboratorium.
STOIKIOMETRI 5
Materi adalah segala sesuatu yang menempati ruang dan memiliki massa, dan kimia
adalah ilmu dari materi dan perubahan materi yang terjadi. Semua materi, setidaknya
secara prinsip, dapat berada dalam tiga wujud: padat, cair, dan gas. Padatan adalah benda yang kaku dengan bentuk yang terbatas. Cairan sedikit rigid dibandingkan padatan, dapat mengalir dan mengasumsikan wadahnya. Seperti cairan, gas juga mengalir, tetapi tidak seperti cairan, gas dapat berkembang tak terbatas.
Tiga wujud materi dapat berubah tanpa mengubah komposisi zat. Setelah pemanasan, padatan (misalnya, es) akan mencair membentuk cairan (air). (Temperatur di mana transisi ini terjadi disebut titik lebur.) Pemanasan lebih lanjut akan mengubah cairan menjadi gas. (Konversi ini terjadi pada titik didih cairan.) Di sisi lain, pendinginan gas akan menyebabkan gas mengembun menjadi cairan. Bila cairan didinginkan lebih lanjut, maka akan membeku menjadi bentuk padat. Gambar 1.1 menunjukkan tiga wujud air. Perhatikan bahwa air memiliki sifat yang unik di antara zat lain pada umumnya bahwa molekul dalam keadaan cair lebih mampat dibandingkan dalam keadaan padat.
Zat dan Campuran
Zat adalah materi yang memiliki komposisi tertentu atau konstan dan sifat yang berbeda. Contohnya adalah air, perak, etanol, garam meja (natrium klorida), dan karbondioksida. Zat berbeda satu sama lain dalam komposisinya dan dapat diidentifikasi kenampakan, bau, rasa, dan sifat lainnya. Saat ini, lebih dari 20 juta zat telah diketahui, dan daftar ini akan berkembang pesat.
Campuran adalah kombinasi dari dua atau lebih zat di mana zat mempertahankan identitas mereka yang berbeda. Beberapa contohnya adalah udara, minuman ringan, susu, dan semen. Campuran tidak memiliki komposisi konstan. Oleh karena itu, sampel udara yang dikumpulkan di kota-kota yang berbeda mungkin akan memiliki komposisi yang berbeda karena perbedaan ketinggian, polusi, dan sebagainya.
Campuran dapat berupa campuran homogen atau heterogen. Ketika sesendok gula larut dalam air, komposisi campuran, setelah pengadukan yang cukup, adalah sama di seluruh larutan. Larutan ini merupakan campuran homogen. Jika pasir dicampur dengan serbuk besi, namun, butiran pasir dan serbuk besi tetap terlihat dan terpisah (Gambar 1.2). Jenis campuran ini, di mana komposisi yang tidak seragam, disebut campuran heterogen. Penambahan minyak ke dalam air menciptakan campuran heterogen yang lain karena cairan tidak memiliki komposisi yang konstan.
Gambar 1.2 (a) Campuran mengandung serbuk besi dan pasir, (b) Sebuah magnet memisahkan serbuk besi dari campuran. Teknik yang sama digunakan pada skala yang lebih besar untuk memisahkan besi dan baja dari benda bukan magnetik seperti aluminium, kaca, dan plastik.
Setiap campuran, baik homogen atau heterogen, dapat dibuat dan kemudian dipisahkan dengan cara fisika menjadi komponen murni tanpa mengubah identitas komponen. Dengan demikian, gula dapat diperoleh kembali dari air dengan memanaskan larutan dan menguapkannya hingga kering. Kondensasi uap air akan memberikan kembali
STOIKIOMETRI 7
komponen air. Untuk memisahkan campuran besi-pasir, kita dapat menggunakan magnet untuk menghilangkan serbuk besi dari pasir, karena pasir tidak tertarik magnet (lihat Gambar 1.2b). Setelah pemisahan, komponen dari campuran akan memiliki komposisi yang sama dan sifat mereka seperti semula.
Unsur dan Senyawa
Suatu zat dapat berupa unsur atau senyawa. Unsur adalah suatu zat yang tidak dapat dipisahkan menjadi zat yang lebih sederhana dengan cara kimia. Saat ini, 117 unsur telah diidentifikasi secara positif. (Lihat daftar di dalam sampul depan buku ini.) Ahli kimia menggunakan simbol abjad untuk mewakili nama-nama unsur. Huruf pertama dari simbol untuk sebuah unsur selalu berupa huruf kapital, tetapi huruf kedua tidak pernah huruf kapital. Misalnya, Co adalah simbol untuk unsur kobalt, sedangkan CO adalah rumus untuk karbon monoksida, yang terdiri dari unsur-unsur karbon dan oksigen. Tabel 1.1 menunjukkan beberapa unsur yang lebih umum. Simbol untuk beberapa unsur berasal dari nama Latin mereka, misalnya, Au dari aurum (emas), Fe dari ferrum (besi), dan Na dari natrium (sodium), meskipun sebagian besar dari mereka adalah bentuk singkatan dari nama bahasa Inggris mereka.
Table 1.1 Beberapa Unsur dan Simbolnya
Nama Simbol Nama Simbol Nama Symbol
Aluminum Al Fluorine/Florin F Oxygen/Oksigem O
Arsenic/Arsen As Gold/Emas Au Phosphorus/Fosfor P Barium/Barium Ba Hydrogen/Hidrogen H Platinum/Platina Pt Bromine/Bromin Br Iodine/Iodin I Potassium/Kalium K Calcium/Kalsium Ca Iron/Besi Fe Silicon/Silikon Si Carbon/Karbon C Lead/Timbal Pb Silver/Perak Ag Chlorine/Klorin Cl Magnesium Mg Sodium/Natrium Na Chromium
/Kromium Cr Mercury/Raksa Hg Sulfur/belerang S
Cobalt/Kobalt Co Nickel/Nikel Ni Tin/Timah Sn Copper/Tembaga Cu Nitrogen/Nitrogen N Zinc/Seng Zn Gambar 1.3 menunjukkan unsur yang paling melimpah di kerak bumi dan dalam tubuh manusia. Seperti yang Saudara lihat, hanya lima unsur (oksigen, silikon, aluminium, besi, dan kalsium) terdiri dari lebih 90 persen dari kerak bumi. Dari kelima unsur tersebut, hanya oksigen yang paling melimpah dalam sistem kehidupan.
Sebagian besar unsur dapat berinteraksi dengan satu atau lebih unsur-unsur lain untuk
membentuk senyawa. Kami mendefinisikan senyawa sebagai zat yang terdiri dari dua
atau lebih unsur kimia yang bergabung dalam proporsi tertentu. Gas hidrogen, misalnya, terbakar dalam gas oksigen membentuk air, suatu senyawa yang sifatnya jelas
berbeda dari materi awal. Air terdiri dari dua bagian hidrogen dan satu bagian oksigen. Komposisi ini tidak berubah, terlepas dari apakah air berasal dari keran di Amerika Serikat, Sungai Yangtze di Cina, atau topi es di Mars. Tidak seperti campuran, senyawa dapat dipisahkan hanya dengan cara kimia menjadi komponen murni mereka.
Gambar 1.3 (a) Kelimpahan unsur di alam dalam persen massa. Sebagai contoh, kelimpahan oksigen adalah 45,5 persen. Ini berarti bahwa dalam sampel 100 g kerak bumi, rata-rata terdapat 45,5 g unsur oksigen. (b) Kelimpahan unsur dalam tubuh manusia dalam persen massa.
Hubungan antara unsur, senyawa, dan kategori lainnya dari materi dirangkum dalam Gambar 1.5.
STOIKIOMETRI 9
1.4 Sifat Fisik dan Sifat Kimia Materi
Zat diidentifikasi dari sifat dan komposisi mereka. Warna, titik leleh, titik didih, dan kerapatan adalah sifat fisika. Sifat fisika dapat diukur dan diamati tanpa mengubah komposisi atau identitas suatu zat. Sebagai contoh, kita dapat mengukur titik leleh es dengan memanaskan balok es dan mencatat temperatur di mana es tersebut berubah menjadi air. Air berbeda dari es hanya dalam penampilan dan tidak dalam komposisi, jadi ini adalah perubahan fisika, kita dapat membekukan air untuk mendapatkan kembali es asli. Oleh karena itu, titik leleh zat adalah sifat fisik. Demikian pula, ketika kita mengatakan bahwa gas helium lebih ringan dari udara, kita mengacu pada sifat fisika.
Di sisi lain, pernyataan "gas hidrogen terbakar dalam gas oksigen untuk membentuk air" menggambarkan sifat kimia hidrogen karena untuk mengamati sifat ini kita harus melakukan perubahan kimia, dalam hal ini pembakaran. Setelah perubahan, zat asli, gas hidrogen dan gas oksigen, akan lenyap dan secara kimia berbeda dengan air yang akan mengambil tempat mereka. Kita tidak dapat memperoleh kembali hidrogen dan oksigen dari air dengan perubahan fisika seperti mendidih atau membeku.
Setiap kali kita merebus telur, kita melakukan perubahan kimia. Ketika temperatur sekitar 100°C, kuning telur dan putih telur mengalami reaksi yang mengubah tidak hanya penampilan fisik mereka tetapi susunan kimiawi mereka juga. Ketika dimakan, telur diubah lagi, oleh zat dalam tubuh yang disebut enzim. Tindakan pencernaan adalah contoh lain dari perubahan kimia. Apa yang terjadi selama proses tersebut tergantung pada sifat kimia dari enzim tertentu dan dari makanan yang terlibat.
Semua sifat terukur dari materi jatuh ke dalam dua kategori: sifat ekstensif dan sifat intensif. Nilai terukur dari sifat ektensiftergantung pada seberapa banyak materi yang sedang dipertimbangkan. Massa, panjang, dan volume merupakan sifat ektensif. Lebih banyak materi berarti lebih banyak massa. Nilai dari sifat ektensif yang sama dapat ditambahkan bersama-sama. Sebagai contoh, dua sen tembaga memiliki massa gabungan yang merupakan jumlah dari massa setiap sen, dan total volume ditempati oleh air dalam dua gelas adalah jumlah volume air dalam masing-masing gelas.
Nilai terukur dari sifat intensif tidak tergantung pada jumlah materi yang
dipertimbangkan. Temperatur merupakan sifat intensif. Misalkan kita memiliki dua gelas air pada temperatur yang sama. Jika kita menggabungkan mereka untuk membuat kuantitas tunggal air dalam gelas besar, temperatur air dengan jumlah yang lebih besar akan sama seperti itu dalam dua gelas terpisah. Tidak seperti massa dan volume, temperatur dan sifat intensif lainnya seperti titik leleh, titik didih, dan kerapatan tidak aditif.
1.5 Pengukuran
Studi kimia sangat bergantung pada pengukuran. Misalnya, ahli kimia menggunakan pengukuran untuk membandingkan sifat-sifat zat yang berbeda dan untuk menilai perubahan yang dihasilkan dari percobaan. Sejumlah perangkat umum memungkinkan kita untuk membuat pengukuran sederhana sifat zat: Penggaris mengukur panjang; buret, pipet, gelas ukur, dan labu ukur mengukur volume (Gambar 1.5); neraca mengukur massa; termometer mengukur temperatur. Instrumen ini memberikan
pengukuran sifat makroskopis, yang dapat ditentukan secara langsung. Sifat
mikroskopis, pada skala atom atau molekul, harus ditentukan oleh metode tidak langsung.
Gambar 1.5Beberapa alat ukur yang umum ditemukan di laboratorium kimia. Alat ini tidak dgambarkan ke skala relatif terhadap satu sama lain. Kita akan membahas penggunaan alat ukur di Bab 4.
Sebuah kuantitas yang diukur biasanya ditulis sebagai jumlah dengan satuan yang sesuai. Untuk mengatakan bahwa jarak antara New York dan San Francisco dengan mobil sepanjang rute tertentu adalah 5166 yang tidak berarti. Kita harus menentukan bahwa jaraknya adalah 5166 kilometer. Dalam sains, satuan sangat penting untuk menyatakan pengukuran dengan benar.
STOIKIOMETRI 11
Satuan Sistem Internasional (SI)
Selama bertahun-tahun para ilmuwan mencatat pengukuran dalam satuan metrik, yang
terkait secara desimal, yaitu dengan membagi 10. Akan tetapi, pada tahun 1960 General
Conference of Weights and Measures (Konferensi Umum Berat dan Ukuran), otoritas internasional untuk satuan, mengusulkan sebuah sistem metrik revisi disebut Satuan Sistem Internasional (disingkat SI, dari Satuan Sistem International Perancis). Tabel 1.2 menunjukkan tujuh satuan SI dasar. Semua satuan SI dari pengukuran dapat diturunkan dari satuan-satuan dasar ini. Seperti satuan metrik, satuan SI diubah dalam bentuk desimal oleh serangkaian prefiks, seperti yang ditunjukkan pada Tabel 1.3. Kami menggunakan kedua unit metrik dan SI dalam buku ini.
Table 1.2 Satuan SI Dasar
Kuantitas Dasar Satuan Simbol
Panjang meter m
Massa kilogram kg
Waktu second s
Kuat Arus Listrik ampere A
Temperatur kelvin K
Jumlah Zat mol mol
Intensitas Cahaya candela cd
Table 1.3 Awalan yang Digunakan dengan Satuan SI
Awalan Simbol Arti Contoh
tera- T 1.000.000.000.000, or 1012 1 terameter (Tm) = 1 × 1012 m giga- G 1.000.000.000, or 109 1 gigameter (Gm) = 1 × 109 m mega- M 1.000.000, or 106 1 megameter (Mm) = 1 × 106 m kilo- k 1.000, or 103 1 kilometer (km) = 1 × 103 m desi- d 1/10, or 10-1 1 desimeter (dm) = 0,1 m senti- c 1/100, or 10-2 1 sentimeter (cm) = 0,01 m mili- m 1/1.000, or 10-3 1 milimeter (mm) = 0,001 m mikro- m 1/1.000.000, or 10-6 1 mikrometer (m) = 1 × 10-6 m nano- n 1/1.000.000.000, or 10-9 1 nanometer (nm) = 1 × 10-9 m piko- p 1/1.000.000.000.000, or 10-12 1 pikometer (pm) = 1 × 10-12 m
Perhatikan bahwa awalan metrik sederhana menyatakan jumlah: 1 mm = 1 × 10-3 m
Pengukuran yang akan sering kita gunakan dalam penelitian kimia, yaitu, waktu, massa, volume, kerapatan, dan temperatur.
Massa adalah ukuran kuantitas materi suatu objek. Istilah "massa" dan "berat" sering digunakan secara bergantian, meskipun, tegasnya, mereka mengacu pada kuantitas yang berbeda. Dalam istilah ilmiah, berat adalah gaya gravitasi yang diberikan pada suatu objek. Sebuah apel yang jatuh dari pohon ditarik ke bawah oleh gravitasi bumi. Massa apel adalah konstan dan tidak tergantung pada lokasi, namun beratnya tidak. Misalnya, di permukaan bulan, berat apel hanya akan seperenam dengan yang di bumi, karena massa bulan lebih kecil. Inilah sebabnya mengapa astronot mampu melompat agak bebas di permukaan bulan meskipun dengan pakaian besar dan peralatan mereka. Massa suatu benda dapat ditentukan dengan mudah dengan neraca, dan proses ini, anehnya,
disebut berat.
Satuan SI dasar massa adalah kilogram (kg), namun dalam kimia gram lebih kecil (g) lebih mudah digunakan:
1 kg = 1000 g = 1 × 103 g
Volume
Volume adalah panjang (m) potongan kubus, sehingga satuan SI turunannya adalah
meter kubik (m3). Akan tetapi, umumnya ahli kimia bekerja dengan volume yang lebih
kecil, seperti sentimeter kubik (cm3) dan desimeter kubik (dm3):
1 cm3 = (1×10-2 m)3 = 1×10-6 m3
1 dm3 = (1×10-1 m)3 = 1×10-3 m3
Hal biasa lainnya, satuan volume non-SI adalah liter (L). Liter adalah volume yang ditempati oleh satu desimeter kubik. Ahli kimia umumnya menggunakan L dan mL untuk volume cairan. Satu liter sama dengan 1000 mililiter (mL) atau 1000 cc:
1L = 1000 mL = 1000 cm3
= 1 dm3 dan satu millimeter sama dengan satu centimeter kubik:
1 mL = 1 cm3
STOIKIOMETRI 13
Gambar 1.6 Perbandingan dua volume, 1 mL and 1000 mL.
Kerapatan (Massa Jenis)
Kerapatan adalah massa benda dibagi dengan volumenya: 𝑲𝒆𝒓𝒂𝒑𝒂𝒕𝒂𝒏 (𝒅) = 𝒎𝒂𝒔𝒔𝒂 (𝒎)
𝒗𝒐𝒍𝒖𝒎𝒆 (𝒗);
di mana d, m, dan V menunjukkan kerapatan, massa, dan volume masing-masing.
Table 1.4 Kerapatan Beberapa Zat pada Temperatur 25°C Zat Kerapatan (g/cm3) Udara* 0,001 Etanol 0,79 Air 1,00 Raksa 13,6 Garam Meja 2,2 Besi 7,9 Emas 19,3 Osmium 22,6
Perhatikan bahwa kerapatan merupakan sifat intensif yang tidak tergantung pada jumlah persen massa. Alasannya adalah bahwa V meningkat sebagaimana m, sehingga rasio
dari dua kuantitas selalu tetap sama untuk bahan tertentu.
Satuan SI turunan untuk kerapatan adalah kilogram per meter kubik (kg/m3). Satuan ini secara kaku digunakan untuk kebanyakan aplikasi kimia. Oleh karena itu, gram per sentimeter kubik (g/cm3) dan ekivalennya, gram per mililiter (g/mL), yang lebih sering digunakan untuk kerapatan padatan dan cairan. Tabel 1.4 daftar kerapatan beberapa zat.
Skala Temperatur
Ada tiga skala temperatur yang saat ini digunakan. Satuan mereka adalah °F (derajat Fahrenheit), °C (derajat Celcius), dan K (Kelvin). Skala Fahrenheit merupakan skala yang paling umum digunakan di Amerika Serikat di luar laboratorium, batas titik beku dan titik didih air secara tepat berturut-turut, 32°F dan 212°F. Skala Celcius membagi rentang antara titik beku (0°C) dan titik didih (100°C) air menjadi 100 derajat. Seperti
Tabel 1.2 menunjukkan, kelvin adalah satuan SI dasar untuk temperatur, yang
merupakan skala temperatur absolut. Absolut berarti bahwa nol pada skala Kelvin, dilambangkan dengan 0 K, adalah stemperatur terendah yang bisa dicapai secara teoritis. Di sisi lain, 0°F dan 0°C didasarkan pada perilaku dari zat sembarang yang dipilih. Gambar 1.7 membandingkan tiga skala temperatur tersebut.
Gambar 1.7 Perbandingan dari tiga skala temperatur: Skala Celsius, Fahrenheit, dan absolut (Kelvin). Perhatikan bahwa ada 100 divisi, atau 100 derajat, antara titik beku dan titik didih air pada skala Celcius, dan ada 180 divisi, atau 180 derajat, antara dua batas yang sama temperatur pada skala Fahrenheit. Skala Celsius sebelumnya disebut skala “Centigrade”. Perhatikan bahwa skala Kelvin tidak memiliki tanda derajat. Juga, temperaturnya dinyatakan dalam kelvin pernah bisa menjadi negatif.
Ukuran derajat pada skala Fahrenheit hanya 100/180 atau 5/9 dari derajat pada skala Celsius. Untuk mengubah derajat Fahrenheit ke derajat Celsius, kita menulis:
𝑥 𝐶𝑜 = ( 𝐹𝑜 − 32 𝐹𝑜 )𝑋 5 𝐶 𝑜 9 𝐹𝑜
Apa persamaan yang digunakan untuk mengubah derajat Celsius ke derajat Fahrenheit? Baik skala Celcius dan skala Kelvin memiliki satuan yang sama besarnya, yaitu, satu derajat Celcius adalah setara dengan satu Kelvin. Penelitian eksperimental telah menunjukkan bahwa nol mutlak pada skala Kelvin setara dengan 273,15°C pada skala Celcius. Dengan demikian, kita dapat menggunakan persamaan berikut untuk mengkonversi derajat Celcius ke Kelvin:
STOIKIOMETRI 15
𝑥 𝐾 = ( 𝐶𝑜 + 273,15 𝐶𝑜 )𝑋 1 𝐾 1 𝐶𝑜
1.6 Penanganan Angka
Kita sudah meninjau beberapa satuan yang digunakan dalam kimia, sekarang kita berbelok ke teknik untuk penanganan angka yang terlibat dengan pengukuran, yaitu notasi ilmiah dan angka penting.
Notasi Ilmiah
Ahli kimia sering berurusan dengan angka yang secara ekstrim besar atau kecil. Misalnya, dalam 1 g unsur hidrogen kira-kira ada
602.200.000.000.000.000.000.000
atom hidrogen, setiap atom hidrogen memiliki massa hanya 0,00000000000000000000000166 g
Angka ini sulit untuk ditangaini, dan mudah terjadi kesalahan ketika menggunakannya dalam perhitungan aritmatika. Dengan mempertimbangkan perkalian berikut:
0,0000000056 × 0,00000000048 = 0,000000000000000002688
Itu akan mudah untuk menghilangkan satu angka nol dan menambah lebih dari satu nol setelah tanda desimal. Oleh sebab itu, ketika bekerja dengan angka yang sangat besar
dan kecil, kita menggunakan sebuah sistem yang disebut notasi ilmiah. Bagaimanapun
juga ukuran besarnya, untuk semua angka dapat dinyatakan dalam bentuk: N ×10n
Dimana N adalah angka antara 1 dan 10 dan n, eksponen, adalah bilangan bulat positif atau negatif (semua angka). Beberapa angka dinyatakan dengan cara ini dikatakan ditulis dalam notasi ilmiah.
Seandainya kita diberi angka tertentu dan diminta untuk menyatakannya dalam notasi ilmiah. Secara umum, tugas ini meminta kita untuk menemukan n. Kita menghitung
angka dari tempat tanda desimal sehingga harus dipindahkan supaya angka N (antara 1
dan 10). Jika tanda desimal harus dipindahkan ke kiri, maka n adalah bilangan bulat positif; jika harus dipindahkan ke kanan, n adalah bilangan bulat negatif. Contoh berikut mengilustrasikan penggunaan dari notasi ilmiah:
(1) Menyatakan 568,762 dalam notasi ilmiah:
568,762 = 5,68762 × 102
Perhatikan bahwa tanda desimal dipindahkan ke kiri dua tempat dan n = 2.
(2) Menyatakan 0,00000772 dalam notasi ilmiah:
0,00000772 = 7,72 × 10-6
Ingat dua poin penting. Pertama, n=0 digunakan untuk bilangan yang tidak dinyatakan dalam notasi ilmiah. Misalnya, 74,6 × 100 (n =0) ekivalen dengan 74,6. Kedua, penggunaan biasanya adalah tidak termasuk superskrip ketika n=1. Dengan demikian,
notasi ilmiah untuk 74,6 is 7,46 ×10 bukan 7,46 × 101. Selanjutnya, kita
mempertimbangkan bagaimana notasi ilmiah ditangani dalam operasi aritmatika. Penjumlahan dan Pengurangan
Untuk menjumlah atau mengurangi, kita pertama-tama menuliskan setiap
kuantitas-katakan N1 dan N2 dengan eksponen sama n. Kemudian kita menggabungkan N1 dan
N2; sisa eksponen adalah sama. Perhatikan contoh berikut:
Perkalian dan Pembagian
Untuk mengalikan bilangan yang diekspresikan dalam notasi ilmiah, kita mengalikan N1 dan N2 seperti biasa, tetapi menambahkan eksponen secara bersamaan. Untuk membagi dengan menggunakan notasi ilmiah, kita membagi N1 dan N2 seperti biasa dan mengurangkan eksponennya. Contoh berikut menunjukkan bagaimana operasi ini dijalankan:
Angka Penting
Kecuali ketika semua bilangan yang terlibat adalah bilangan bulat (sebagai contoh, dalam perhitungan jumlah siswa dalam sebuah kelas), perolehan nilai yang tepat dari kuantitas penyelidikan sering tidak mungkin. Untuk alasannya, itu penting untuk
STOIKIOMETRI 17
mengindikasikan batas kesalahan dalam pengukuran melalui pengindikasian angka secara jelas dari angka penting, yang merupakan angka berarti dalam sebuah kuantitas ukuran atau perhitungan.
Ketika angka penting digunakan, digit terakhir dimengerti menjadi tidak pasti. Sebagai contoh, kita mungkin mengukur volume dari jumlah cairan yang diberikan menggunakan gelas ukur dengan skala yang memberikan ketidakpastian 1 mL dalam pengukurannya. Jika volume yang ditemukan 6 mL, maka volume sebenarnya adalah antara 5 mL hingga 7 mL. Kita menyatakan volume cairan sebagai (6 ± 1) mL. Dalam kasus ini, hanya ada satu angka penting (angka 6) yang tidak pasti plus atau minus 1 mL. Untuk keakuratan yang lebih besar, kita bida menggunakan gelas ukur yang lebih baik, sehingga volume yang kita ukur sekarang ketidakpastiannya hanya 0,1 mL. Jika sekarang volume cairan yang ditemukan 6,0 mL kita boleh mengekspresikan kuantitasnya (6,0 ± 0,1) mL, dan nilai sebenarnya berada antara 5,9 mL dan 6,1 mL. Kita dapat lebih jauh meningkatkan pengukuran alat dan memperoleh lebih angka penting, tetapi di setiap kasus, angka terakhir selalu tidak pasti; jumlah dari ketidakpastian tergantung pada alat ukur tertentu yang kita gunakan.
Gambar 1.8 menunjukkan timbangan modern. Timbangan seperti ini tersedia di banyak laboratorium kimia dasar; mereka dengan mudah mengukur massa benda untuk empat tempat desimal. Sehingga, massa yang diukur biasanya akan memiliki empat angka penting (sebagai contoh, 0,8642 g) atau lebih (sebagai contoh, 3,9745 g). Menjaga jalur dari jumlah angka penting dalam pengukuran seperti memastikan massa bahwa perhitungan melibatkan data yang akan merefleksikan ketepatan pengukuran.
Gambar1.8 A single-pan balance.
Petunjuk penggunaan angka penting
Kita harus selalu hati-hati dalam pekerjaan ilmiah untuk menuliskan angka yang sesuai dengan angka penting. Umumnya, secara wajar mudah untuk menentukan seberapa banyak angka penting yang dimilki dengan aturan berikut:
1. Beberapa angka yang tidak sama dengan nol adalah angka penting. Dengan demikian, 845 cm memiliki tiga angka penting, 1.234 kg memiliki empat angka penting, dan seterusnya.
2. Angka nol antara angka bukan nol adalah angka penting. Dengan demikian, 606 cm
berisi tiga angka penting, 40.501 kg berisi lima angka penting, dan seterusnya.
3. Angka nol yang berada di kiri angka bukan nol bukan angka penting. Tujuan angka
tersebut adalah untuk mengindikasikan penempatan tanda desimal. Sebagai contoh, 0,08 L berisi satu angka penting, 0,0000349 g berisi tiga angka penting, dan seterusnya.
4. Jika sebuah angka lebih dari 1, makan semua angka nol yang dituliskan di kanan tanda desimal dihitung sebagai angka penting. Dengan demikian, 2,0 mg memiliki dua angka penting, 40,062 mL memiliki lima angka penting, dan 3,040 dm memiliki empat angka penting. Jika angka tersebut kurang dari 1, makan hanya angka nol yang berada dia akhir bilangan dan angka nol antara angka bukan nol yang merupakan angka penting. 0,090 kg memiliki dua angka penting, 0,3005 L memiliki empat angka penting, 0,00420 menit memiliki tiga angka penting, dan seterusnya.
5. Untuk angka yang tidak mengandung tanda desimal, angka nol yang mengikutinya
(yaitu, angka nol setelaj angka bukan nol terakhir) mungkin atau tidak mungkin adalah angka penting. Dengan demikian, 400 cm mungkin memiliki satu angka penting. Kita tidak dapat tahu yang man yang benar tanpa informasi lebih. Dengan menggunakan notasi ilmiah, akan tetapi, kita menghindari kembiguan ini. Dalam kasus tertentu, kita dapat mengekspresikan angka 400 sebagai 4 × 102 untuk satu angka penting, 4,0 × 102 untuk dua angka penting atau 4,00 × 102 untuk tiga angka penting.
Aturan kedua yang merinci bagaimana menangani angka penting dalam perhitungan.
1. Dalam penjumlahan dan pengurangan, jawaban tidak dapat memiliki angka lebih di
sebelah kanan tanda desimal dibandingkan salah satu diantaranya merupakan bilangan asli. Perhatikan contoh berikut:
89,332
+ 1,1……… satu angka setelah tanda desimal 90,432 ……… dibulatkan menjadi 90,4
2,097
-0,12 ………… dua angka setelah tanda desimal 1,977 ……… dibulatkan menjadi 1,98
Langkah pembulatan angka sebagai berikut: Untuk membulatkan angka pada tanda tertentu kita dapat menurunkan secara sederhana angka yang mengikuti jika lebih kecil dari 5. Dengan demikian, 8,724 dibulatkan menjadi 8,72 jika kita hanya ingin
STOIKIOMETRI 19
dua angkan setelah tanda desimal. Jika angka berikutnya dari pembulatan angka sama dengan atau lebih besar dari 5, kira menambahkan 1 untuk angka sebelumnya. Dengan demikian, 8,727 dibulatkan menjadi 8,73 dan 0,425 dibulatkan menjadi 0,43.
2.Dalam perkalian dan pembagian, jumlah dari angka penting di hasil akhir atau hasil
bagi ditentukan dengan bilangan asli yang memilki angka terkecil dari angka penting. Contoh berikut mengilustrasikan aturan tersebut:
2,8 × 4,5039 = 12,61092 ………… dibulatkan menjadi 13 6,85
112,04= 0,0611388789………… dibulatkan menjadi 0,0611
3.Perlu diketahui bahwa angka yang tepat didapatkan dari definisi (misalnya 1 kaki =
12 inci, dimana 12 merupakan angka pasti) atau dengan menghitung jumlah benda dapat dianggap memiliki angka tak hingga dari angka penting.
Langkah pembulatan angka sebelumnya mengaplikasikan perhitungan satu langkah. Dalam perhitungan berantai, perhitungan melibatkan lebih dari satu langkah, kita dapat memperoleh jawaban yang berbeda tergantung pada seberapa kita membulatkan angka. Perhatikan perhitungan dua langkah berikut:
Langkah pertama: A × B = C Langkah kedua : C × D = E
Andaikan bahwa A = 3,66, B = 8,45, dan D = 2.11. tergantung pada dimana kita membulatkan C ke tiga (metode 1) atau empat (metode 2) angka penting, kita memperoleh jumlah yang berbeda untuk E:
Metode 1 Metode 2
3,66 × 8,45 = 30,9 3,66 × 8,45 = 30,93
30,9 × 2,11 = 65,2 30,93 × 2,11 = 65,3
Akan tetapi, jika kita sudah menghasilkan perhitungan 3,66 × 8,45 × 2,11 pada kalkulator tanpa membulatkan angka untuk jawaban sementara, kita akan memperoleh jawaban 65,3 sebagai jawaban untuk E. Meskipun, menyimpan digit angka tambahan sebelumnya dari angka penting untuk langkah sementara membantu menghilangkan kesalahan dari pembulatan, langkah ini tidak perlu untuk kebanyakan perhitungan karena perbedaan antara jawaban biasanya sangat kecil. Sehingga, untuk kebanyakan contoh dan soal di akhir bab dimana jawaban sementara dilaporkan, semua jawaban, sementara dan akhir, akan dibulatkan.
Keakuratan dan Ketepatan
Dalam diskusi pengukuran dan angka penting sangat berguna untuk membedakan
antara keakuratan dan ketepatan. Keakuratan memberitahu kita seberapa dekat
pengukuran terhadap nilai yang benar dari kuantitas yang diukur. Untuk seorang ilmuwan ada sebuah perbedaan antara keakuratan dan ketepatan. Ketepatan mengacu
pada seberapa dekatnya dua atau lebih pengukuran dari kuantitas yang sama cocok satu sama lain. (Gambar 1.9)
Gambar 1.9 Distribusi anak panah pada papan anak panah menunjukkan perbedaan antara tepat dan akurat. (a) keakuratan baik dan ketepatan baik, (b) keakuratan buruk dan katepatan baik, (c) keakuratan buruk dan ketepatan buruk. Titik biru menunjukkan posisi dari anak panah.
Perbedaan antara keakuratan dan ketepatan adalah sesuatu yang tidak menonjol tetapi penting. Seandainya, sebagai contoh, tiga siswa diminta untuk menentukan massa dari sepotong kawat tembaga. Hasil dari dua penimbangan berturut-turut oleh masing-masing siswa adalah:
Siswa A Siswa B Siswa C
1,964 g 1,972 g 2,000 g
1,978 g 1,968 g 2,002 g
Nilai Rata-rata 1,971 g 1,970 g 2,001 g
Massa yang benar dari kawat adalah 2,000 g. Sehingga, hasil siswa B lebih tepat dibandingkan hasil siswa A (1,972 g dan 1,968 g sedikit berbeda dari 1,970 g dibandingkan 1,964 g dan 1,978 g dari 1,971 g), tetapi hasil keduanya sangat tidak akurat. Hasil siswa C tidak hanya paling tepat, tetapi juga paling akurat, karena nilai rata-ratanya mendekati nilai yang benar. Pengukuran dengan keakuratan yang tinggi biasanya juga tepat. Di sisi lain, pengukuran dengan ketepatan yang tinggi belum tentu akurat. Sebagai contoh, kalibrasi meterstick secara ceroboh atau kesalahan penimbangan mungkin memberikan pembacaan ketepatan yang salah.
1.7 Bagaimana Memecahkan Masalah
Saudara sudah dikenalkan pada notasi ilmiah, angka penting, dan dimensi analisis, yang akan membantu Saudara dalam memecahkan masalah numerik. Kimia melibatkan penelitian eksperimental dan banyak masalah kuantitatif di alam. Kunci sukses dalam memecahkan masalah adalah latihan. Sebagai pelari marathon tidak dapat hanya mempersiapkan perlombaan secara sederhana dengan membaca buku saat berlari dan pemain biola tidak dapat memberikan konser yang sukses hanya melalui hafalan komposisi musik, kamu tidak dapat meyakini pemahaman kimia Saudara tanpa memecahkan masalah. Langkah berikut akan membantu untuk meningkatkan kemampuan Saudara dalam pemecahan masalah numerik:
STOIKIOMETRI 21
1.Baca pertanyaan dengan seksama. Pahami informasi yang diberikan dan apa yang ditanyakan untuk dipecahkan. Seringkali sangat membantu untuk membuat sketsa/bagan yang akan membatu Saudara untuk memvisualisasikan keadaan.
2.Temukan persamaan yang mungkin yang memiliki hubungan dengan informasi yang
diberikan dan kuantitas yang tidak diketahui. Terkadang, dalam memecahkan masalah akan melibatkan lebih dari satu langkah, dan Saudara mungkin diharapkan untuk mencari kuantitas dalam tabel yang tidak disediakan dalam soal. Dimensi analisis sering dibutuhkan untuk konversi.
3.Cek jawaban Saudara untuk kebenaran tanda, satuan, dan angka penting.
4.Bagian yang sangat penting dari memecahkan soal adalah memutuskan apakah
jawaban tersebut beralasan (masuk akal). Itu secara relatif mudah untuk menemukan tanda yang salah atau satuan yang tidak benar. Tetapi jika jumlah (katakan 8) ditempatkan di tempat yang tidak benar dalam penyebut sebagai gantinya pembilang, jawabannya akan terlalu kecil meskipun tanda dan satuan dari kuantitas perhitungan benar.
5.Salah satu jalan untuk mengecek jawaban dengan cepat adalah membuat perkiraan “ball-park”. Idenya di sini adalah untuk membulatkan angka sedemikian rupa sehingga kita menyederhanakan perhitungan. Pendekatan ini kadang-kadang disebut “back-of-the-envelope calculation” karena dapat dilakukan dengan mudah tanpa menggunakan kalkulator. Jawaban yang Saudara dapat tidak akan tepat, tetapi akan mendekati yang benar.
Ringkasan
1.Metode ilmiah merupakan sebuah pendekatan sistematis untuk penelitian yang
dimulai dengan pengumpulan informasi melalui pengamatan dan pengukuran. Dalam proses ini, hipotesis, hukum, dan teori diciptakan dan diuji.
2.Ahli kimia mempelajari materi dan zat dari mana itu disusun. Semua zat, pada prinsipnya, dapat berada dalam tiga wujud: padat, cair, dan gas. Perubahan antara tiga wujud tersebut diakibatkan oleh perubahan temperatur.
3.Zat yang paling sederhana dalam kimia adalah unsur. Senyawa dibentuk oleh
kombinasi atom-atom dari unsur yang berbeda. Zat mempunyai keduanya, sifat fisika yang dapat diamati tanpa adanya perubahan identitas zat tersebut, dan sifat kimia yang ketika ditunjukkan, mengubah identitas zat tersebut.
4.Satuan SI digunakan untuk menyatakan kuantitas fisik dalam sains, termasuk kimia,
jumlah yang dinyatakan dalam notasi ilmiah memiliki bentuk N × 10 n , dimana N
adalah antara 1 dan 10 dan n adalah bilangan bulat positif atau negatif. Notasi ilmiah membantu kita untuk menangani kuantitas yang sangat besar dan sangat kecil. Sebagian besar pengukuran kuantitas tidak teliti untuk beberapa jangkauan. Jumlah angka penting mengindikasikan ketelitian dari pengukuran.
5.Dalam metode analisis dimensi pemecahan masalah satuan dikalikan bersama-sama,
dibagi satu sama lain, atau dibatalkan seperti jumlah aljabar. Mendapatkan satuan yang benar untuk jawaban akhir yang memastikan bahwa perhitungan telah dilakukan dengan benar.
Pertanyaan dan Soal Definisi Dasar
Pertanyaan mengulang
1.1 Definisikan istilah berikut: (a) materi, (b) massa, (c) berat, (d) zat, (e) campuran.
1.2 Manakah dari pernyataan ini yang secara ilmiah benar?
“Massa dari siswa adalah 56 kg.” “Berat dari siswa adalah 56 kg.”
1.3 Berikan sebuah contoh dari campuran homogen dan sebuah contoh dari campuran
heterogen.
1.4 Apa perbedaan antara sifat fisika dan sifat kimia?
1.5 Berikan sebuah contoh dari sifat insensif dan sebuah contoh dari sifat ekstensif. 1.6 Definisikan istilah berikut: (a) unsur, (b) senyawa.
Soal
1.7 Pernyataan ini mendeskripsikan sifat fisika atau sifat kimia?
(a) Gas oksigen membantu pembakaran.
(b) Pupuk membantu meningkatkan hasil pertanian.
(c) Air mendidih di bawah 100C di pegunungan.
(d) Uranium merupakan unsur radioaktif.
1.8 Deskripsi ini merupakan perubahan fisika atau perubahan kimia?
(a) Gas helium dalam balon cenderung bocor setelah beberapa jam.
(b) Lampu senter lambat laun akan redup dan akhirnya mati.
(c) Jus jeruk beku dikembalikan ke bentuksemula dengan menambahkan air ke dalamnya.
(d) Pertumbuhan tanaman tergantung energi matahari dalam proses yang disebut
fotosintesis.
(e) Satu sendok garam larut dalam semangkuk sup.
1.9 Manakah dari sifat ini yang intensif dan manakah yang ekstensif?
(a) panjang, (b) volume, (c) temperatur, (d) massa.
1.10 Manakah dari sifat ini yang intensif dan manakah yang ekstensif?
(a) luas, (b) warna, (c) densitas.
1.11 Klasifikasikan masing-masing zat ini sebagai unsur atau senyawa:
(a) hidrogen, (b) air, (c) emas, (d) gula.
1.12 Klasifikasikan masing-masing zat ini sebagai unsur atau senyawa:
(a) natrium klorida (garam dapur), (b) helium, (c) alckhol, (d) platina.
Satuan
Pertanyaan Mengulang
1.13 Berikan satuan SI untuk ekspresi ini:
(a) panjang, (b) luas, (c) volume, (d) massa, (e) waktu, (f) gaya, (g) energi, (h) temperatur.
STOIKIOMETRI 23
1.14 Tuliskan bilangan untuk awalan ini:
(a) mega-, (b) kilo-, (c) desi-, (d) centi-, (e) mili-, (f) mikro-, (g) nano-, (h) piko-.
1.15 Definisikan kerapatan. Satuan apa yang secara normal digunakan oleh ahli kimia
untuk kerapatan? Kerapatan termasuk sifat insensif atau ekstensif?
1.16 Tuliskan persamaan untuk mengubah derajat Celsius ke derajat Fahrenheit dan derajat fahrenheit ke derajat Celsius.
Soal
1.17 Sebuah bola timah memiliki massa 1,203 × 104 g, dan volumenya 1,053 × 103 cm3
. Hitung kerapatannya.
1.18 Air raksa adalah logam yang dalam temperatur kamar berupa cairan.
Kerapatannya 13,6 g/mL. Berapa gram air raksa yang akan menempati volume 95,8 mL?
1.19 (a) secara normal, tubuh manusia dapat bertahan pada temperatur 105°F hanya untuk jangka waktu pendek tanpa bahaya permanen pada otak dan organ vital lainnya. Berapa temperatur tersebut dalam derajat Celsius?
(b) Etilen glikol adalah cairan senyawa organik yang digunakan sebagai anti beku dalam radiator mobil. Itu membeku pada 211,5°C. Hitung temperatur pembekuan tersebut dalam derajat Fahrenheit.
(c) Temperatur pada permukaan matahari kira-kira 6300°C. Berapa temperatur tersebut dalam derajat Fahrenheit?
(d) Temperatur dari kertas yang dibakar adalah 451°F. Berapa temperatur tersebut dalam derajat Celsius?
1.20 (a) Ubah temperatur berikut ke Kelvin: (i) 113°C, titik leleh belerang, (ii) 37°C, temperatur normal tubuh, (iii) 357°C, titik didih air raksa.
(b) Ubah temperatur berikut ke derajat Celsius: (i) 77 K, titik didih cairan nitrogen, (ii) 4.2 K, titik didih cairan helium, (iii) 601 K, titik leleh timah.
Notasi Ilmiah
Soal
1.21 Ekspresikan bilangan ini dalam notasi ilmiah:
(a) 0,000000027, (b) 356, (c) 0,096.
1.22 Ekspresikan bilangan ini dalam notasi ilmiah:
(a) 0,749, (b) 802,6, (c) 0,000000621.
1.23 Ubah ini ke bukan notasi ilmiah: (a) 1,523 × 104, (b) 7,78 × 10-8. 1.24 Ubah ini ke bukan notasi ilmiah: (a) 3,256 × 10-5, (b) 6.03 × 106.
1.25 Ekspresikan jawaban ini dalam notasi ilmiah:
(a) 145,75 + (2,3 × 10-1) (b) 79,500 : (2,5 × 102) (c) (7,0 × 10-3) - (8,0 × 10-4) (d) (1,0 × 104) × (9.9 × 106)
1.26 Ekspresikan jawaban ini dalam notasi ilmiah:
(b) 653 : (5,75 × 10-8) (c) 850,000 - (9,0 × 105) (d) (3,6 × 10-4) × (3,6 × 106)
Angka Penting
Soal
1.27 Berapa jumlah angka penting dalam masing-masing pengukuran kuantitas
berikut? (a) 4867 mil, (b) 56 mL, (c) 60.104 ton, (d) 2900 g.
1.28 Berapa jumlah angka penting dalam masing-masing pengukuran kuantitas
berikut? (a) 40,2 g/cm3, (b) 0,0000003 cm, (c) 70 menit, (d) 4,6 ×1019 atom.
1.29 Langsungkan operasi ini, anggaplah adalah perhitungan dari hasil percobaan, dan
ekspresikan masing-masing jawaban dalam satuan yang benar dan dengan jumlah angkaa penting yang benar:
(a) 5,6792 m + 0,6 m + 4,33 m
(b) 3,70 g - 2,9133 g
(c) 4,51 cm × 3,6666 cm
(d) (3 × 104 g + 6,827 g)/(0,043 cm3 - 0,021 cm3)
1.30 Langsungkan operasi ini, anggaplah adalah perhitungan dari hasil percobaan, dan
ekspresikan masing-masing jawaban dalam satuan yang benar dan dengan jumlah angkaa penting yang benar:
(a) 7,310 km : 5,70 km (b) (3,26 × 10-3 mg) - (7,88 × 10-5 mg) (c) (4,02 × 106 dm) + (7,74 × 107 dm) (d) (7,8 m - 0.34 m)/(1,15 s + 0,82 s) Analisis Dimensi Soal
1.31 Lakukan konversi: (a) 22,6 m ke dm, (b) 25,4 mg ke kg.
1.32 Lakukan konversi: (a) 242 lb ke mg, (b) 68,3 cm3 ke m3.
1.33 Harga emas pada hari tertentu di tahun 2009 adalah $932 per troy ounce. Berapa
harga 1,00 g emas hari itu? (1 troy ounce = 531,03 g.)
1.34 Tiga siswa (A, B, dan C) diminta untuk menentukan volume sampel metanol. Masing-masing siswa mengukur volume tiga kali dengan gelas ukur. Hasil dalam mililiter adalah: A (47,2; 48,2; 47,6); B (46,9; 47,1; 47,2); C (47,8; 47,8; 47,9). volume metanol sebenarnya adalah 47,0 mL. Siswa mana yang paling akurat? Siswa mana yang paling tepat?
1.35 Tiga siswa (X, Y, and Z) diberi tugas menentukan massa sampel besi. Masing-masing siswa membuat tiga penentuan dengan menggunakan timbangan. Hasil dalam gram adalah: X (61,5; 61,6; 61,4); Y (62,8; 62,2; 62,7); Z (61,9; 62,2; 62,1). Massa besi sebenarnya adalah 62,0 g. Siswa mana yang paling tidak tepat? Siswa mana yang paling akurat?
1.36 Pejoging lambat berlari satu mil dalam 13 menit. Hitung kecepatannya dalam: (a)
STOIKIOMETRI 25
1.37 Lakukan konversi ini:
(a) 6,0 ft orang memiliki berat 168 lb. Ekspresikan tinggi orang ini dalam meter
dan beratnya dalam kilogram. (1 lb = 453,6 g; 1 m = 3,28 ft).
(b) Batas kecepatan saat ini di beberapa negara bagian di Amerika Serikat adalah
55 mil per jam. Berapa batas kecepatan dalam kilometer per jam?
(c) Kecepatan cahaya adalah 3,0 ×1010 cm/s. Berapa mil melakukan perjalanan cahaya dalam 1 jam?
(d) Timbal adalah zat beracun. Timbal "normal" memimpin isi dalam darah manusia sekitar 0,40 bagian per juta (yaitu, 0,40 g timbal per juta gram darah). Sebuah nilai dari 0,80 bagian per juta (ppm) dianggap berbahaya. Berapa gram
timbal yang terkandung dalam 6,0 × 103 g darah (jumlah rata-rata pada orang
dewasa) jika kandungan timbalnya adalah 0,62 ppm? 1.38 Lakukan konversi ini:
(a) Tahun cahaya untuk mil (satu tahun cahaya adalah ukuran astronomi dari jarak
yang ditempuh oleh cahaya dalam satu tahun, atau 365 hari), (b) 32,4 yd ke sentimeter,
(c) 3 × 1010 cm/s ke ft/s, (d) 47,4F ke derajat Celsius,
(e) -273,15C (temperatur terendah) ke derajat Fahrenheit, (f) 71,2 cm3 ke m3,
(g) 7,2 m3 ke liter.
1.39 Aluminium adalah logam yang ringan (kerapatan = 2,70 g/cm3) digunakan dalam
konstruksi pesawat terbang, jalur transmisi daya tinggi, dan foil. Berapa kerapatannya dalam kg/m3?
1.40 Kerapatan gas amoniak di bawah kondisi tertentu adalah 0,625 g/L. Hitung kerapatannya dalam g/cm3.
Soal Tambahan
1.41 Manakah dari deskripsi yang termasuk sifat fisika dan yang termasuk sifat kimia?
(a) Besi cenderung untuk berkarat.
(b) Hujan da daerah industri cenderung bersifat asam.
(c) Molekul Hemoglobin berwarna merah.
(d) Ketika segelas air dibiarkan di bawah terik matahai, air berangsur-angsur menghilang.
(e) Karbondioksida di udara diubah ke molekul yang lebih kompleks oleh
tanaman selama fotosintesis.
1.42 Pada tahun 2004, kira-kira 87,0 miliyar pon asam sulfat diproduksi di Amerika Serikat. Ubah kuantitas ini ke ton.
1.43 Seandainya skala temperatur baru diciptakan yang titk leleh etanol (-117.3°C) dan
titik didih etanol (78.3°C) diambil sebagai 0°S dan 100°S, berturut-turut, dimana S adalah simbol untuk skala temperatur baru. Turunkan hubungan persamaan pembacaan pada skala ini untuk pembacaan skala Celsius. Apa yang akan termometer baca pada 25°C?
1.44 Dalam penentuan kerapatan batang logam berbentuk persegi, seorang siswa membuat pengukuran berikut: panjang 8,53 cm; lebar, 2,4 cm; tinggi, 1,0 cm; massa, 52,7064 g. Hitung kerapatan logam untuk jumlah angka penting yang benar.
1.45 Hitung massa dari masing-masing: (a) bola emas dengan jari-jari 10,0 cm [volume
bola dengan jari-jari r adalah V= (4/3 r3; kerapatan emas = 19,3 g/cm3), (b)
kubus platinum dengan panjang tepi 0,040 mm (kerapatan platina = 21,4 g/cm3),
(c) 50,0 mL etanol (kerapatan etanol = 0,798 g/mL).
1.46 Tabung gelas silinder sepanjang 12,7 cm dipenuhi dengan air raksa. Massa air raksa yang dibutuhkan untuk memenuhi tabung ditemukan sebesar 105,5 g. Hitung diameter dalam tabung. (kerapatan air raksa = 13,6 g/mL.)
1.47 Prosedur ini dilakukan untuk menentukan volume dari labu. Labu ditimbang
dalam keadaan kering kemudian diisi penuh dengan air. Jika massa labu kosong dan labu penuh adalah 56,12 g dan 87,39 g, berturut-turut, dan kerapatan air 0,9976 g/cm3, hitung volume labu dalam sentimeter kubik (cm3).
1.48 Perak (Ag) seberat 194,3 g ditempatkan ke dalam gelas ukur yang berisi 242,0 mL
air. Volume air sekarang terbaca 260,5 mL. Dari data ini, hitung kerapatan perak. 1.49 Percobaan yang dideskripsikan pada masalah 1.48 bersifat kasar tetapi mudah
digunakan untuk menentukan kerapatan beberapa padatan. Deskripsikan percobaan yang mirip untuk mengukur kerapatan es. Secara spesifik, apa saja keperluan untuk cairan yang digunakan dalam percobaanmu?
1.50 Kecepatan bunyi di udara pada temperatur ruang kira-kira 343 m/s. Hitung kecepatan dalam mil per jan (mph).
1.51 Termometer medisinal biasanya digunakan di rumah dapat membaca hingga
±0.1°F, sedangkan di kantor dokter mungkin keakuratannya hingga ±0.1°C. dalam derajat Celsius, ekspresikan temperatur badan dari 38,9°C .
1.52 Sebuah termometer memberikan pembacaan 24,2°C ± 0,1°C. hitung temperatur
dalam derajat Fahrenheit. Apa itu ketidakpastian?
1.53 Vanili (digunakan untuk memberi cita rasa es krim vanila dan makanan lainnya)
adalah zat yang beraroma mendeteksi dalam jumlah terkecil. Ambang batas adalah 2,0 × 10-11 g per liter udara. Jika harga saat ini dari 50 g vanili adalah $112, tentukan harga untuk mensuplai cukup vanili sehingga bau dapat terdeteksi di bangsal pesawat terbang dari volume 5,0 × 107 ft3.
1.54 Orang dewasa yang beristirahat membutuhkan kira-kira 240 mL oksigen
murni/menit dan bernafas kira-kira 12 kali per menit. Jika penghirupan udara berisi 20 persen volume oksigen dan penghembusan udara 16 persen, berapa volume udara tiap bernafas?
1.55 Volume air laut total adalah 1,5 × 1021 L. Asumsikan air laut mengandung 3,1 persen massa natrium klorida dan kerapatannya 1,03 g/mL. Hitung massa total natrium klorida dalam kilogram dan dalam ton. (1 ton = 2000 lb; lb = 453,6 g.)
1.56 Magnesium (Mg) adalah logam berharga yang digunakan dalam aloi, baterai, dan
sintesis kimia. itu sebagian besar didapat dari air laut, yang mengandung kira-kira 1,3 g Mg untuk setiap kg air laut. Hitung volume air laut (dalam liter) yang
STOIKIOMETRI 27
diperlukan untuk mengekstrak 8,0 × 104 ton Mg, yang produksi kasar tiap tahun di Amerika Serikat. (Kerapatan air laut = 1,03 g/mL.)
1.57 Seorang siswa diberi krusibel dan diminta untuk membuktikan apakah itu terbuat
dari platina murni. Pertama, dia menimbang krusibel di udara kemudian menimbangnya digantung dalam air (kerapatan = 0.9986 g/cm3). Pembacaannya berturut-turut adalah 860,2 g dan 820,2 g. Kerapatan platina adalah 21,45 g/cm3, seharusnya apa kesimpulannya berdasarkan pengukuran ini? (Petunjuk: sebuah benda yang digandul dalam sebuah cairan mengapung dengan massa cairan berkurang dari bendanya. Abaikan kekuatan mengapung udara)
1.58 Pada temperatur berapa pembacaan numerik pada termometer Celsius sama
dengan termometer Fahrenheit?
1.59 Luas permukaan dan kedalaman rata-rata Laut Pasifik berturut-turut adalah 1,8 ×
108 km2 and 3,9 × 103 m. Hitung volume air dalam laut dalam liter.
1.60 Persen kesalahan sering diekspresikan sebagai nilai absolut dari perbedaan antara
nilai sebenarnya dan nilai percobaan, dibagi nilai sebenarnya:
persen kesalahan = Nilai sebenarnya − Nilai pada percobaan
Nilai sebenarnya × 100%
dimana garis vertikal mengindikasikan nilai absolut. Hitung persen kesalahan untuk pengukuran ini: (a) kerapatan alkohol (etanol)yang ditemukan sebesar 0,802 g/mL. (nilai sebenarnya: 0,798 g/mL.) (b) massa emas dalam anting yang dianalisis 0,837 g (nilai sebenarnya: 0,864 g.).
1.61 Osmium (Os) adalah dikenal sebagai unsur paling padat (kerapatan = 22,57
g/cm3). Hitung massa dalam pon dan kilogram dari bola Os 15 cm dalam diameter
(kira-kira seukuran buah anggur). Lihat soal 1.45 untuk volume bola.
1.62 1,0 mL volume air laut mengandung kira-kira 4,0 × 10-12 emas. Volume total air
laut adalah 1,5×1021 L. Hitung jumlah total emas dalam gram yang terdapat dalam
air laut dan harganya dalam dolar, asumsikan bahwa harga emas adalah $930 per ons. Dengan banyak emas di sana, mengapa belum ada seorangpun yang kaya dengan menambang emas dari lautan?
1.63 Lapisan tipis kulit bumi, disebut kerak, mengandung hanya 0,50 persen dari massa
total bumi namun merupakan sumber hampir semua unsur (atmosfer menyediakan unsur seperti oksigen, nitrogen, dan beberapa gas lainnya). Silikon (Si) adalah unsur kedua yang kelimpahannya terbanyak di kerak bumi (27,2 persen massa).
Hitung massa silikon dalam kilogram di kerak bumi. (Massa bumi 5,9 × 1021 ton.
1 ton = 200 lb; 1 lb = 453,6 g.)
1.64 Diameter atom tembaga (Cu) kira-kira 1,3 × 10-10 m. Berapa kali kamu dapat membagi sama rata sepotong 10 cm kawat tembaga hingga tereduksi menjadi dua bagian atom tembaga? (asumsikan ada alat yang cocok untuk prosedur ini dan bahwa atom tembaga berbaris dalam satu garis lurus. Saling bersentuhan satu sama lain.) bulatkan jawabanmu ke bilangan bulat.
1.65 Satu galon bensin yang terbakar dalam mobil memghasilkan rata-rata 9,5 kg karbondioksida, yang merupakan gas rumah kaca, yaitu, menaikkan panas atmosfer bumi. Hitung produksi tahunan dari karbondioksida dalam kiligram jika ada 40 juta mobil di Amerika Serikat, dan masing-masing mobil meliputi jarak 500 mil pada rata-rata konsumsi 20 mil per galon.
1.66 Selembar aluminum (Al) foil memilki luas total 1,000 ft 2 dan massa 3,636 g. Berapa ketebalan foil in millimeter? (kerapatan Al = 2,699 g/cm3.)
1.67 Klorin digunakan untuk disinfektan kolam renang. Konsentrasi yang diterima untuk tujuan ini adalah 1 ppm klorin atau 1 g klorin per juta g air. Hitung volume larutan klorin (dalam mL) yang seharusnya pemilik tambahkan untuk kolam
renangnya jika larutan mengandung 6,0 persen klorin per massa dan ada 2 × 104
galon air dalam kolam. (1 galon = 3,79 L; kerapatan cairan = 1,0 g/mL)
1.68 Floridasi adalah proses penambahan senyawa florin pada air minum untuk
membantu mengatasi karies gigi. Konsentrasi 1 ppm florin cukup untuk tujuan. (1 ppm berarti 1 g florin per 1 juta g air). Senyawa tersebut secara normal dipilih untuk floridasi adalah natrium florida, yang juga ditambahkan ke beberapa pasta gigi. Hitung kuantitas natrium florida dalam kilogram yang dibutuhkan per tahun untuk kota dari 50.000 orang jika konsumsi air tiap hari per orang 150 galon. Berapa persen natrium florida yang dibuang jika tiap oranghanya menggunakan 6,0 L air per hari untuk minum dan memasak? (natrium florida mengandung 45,0 persen florin per massa. 1 galon = 3,79 L; 1 tahun = 365 hari; kerapatan air = 1,0 g/mL).
1.69 Dalam konservasi air, ahli kimia menyebarkan film tipis dari material inert tertentu di atas permukaan air untuk menurunkan kecepatan evaporasi air dalam reservoir. Teknik ini dirintis oleh Benjamin Franklin tiga abad yang lalu. Franklin menemukan bahwa 0,10 mL minyak dapat terpancar di atas permukaan air kira-kira 40 m2 di area. Asumsikan bahwa minyak membentuk layer tunggal, yaitu, sebuah lapisan yang hanya setebal satu molekul, perkirakan panjang
masing-masing minyak molekul dalam nanometer (1 nm = 1 × 10-9 m)
1.70 Feromon adalah senyawa yang disekresikan oleh spesies serangga betina untuk menarik. Biasanya 1,0 × 10-8 g feromon cukup untuk mencapai semua target jantan dalam radius 0,50 mil. Hitung kerapatan feromon (dalam g/L) dalam ruang silinder udara yang memilki radius 0,50 mil dan tinggi 40 kaki.
BAB 2.
ATOM, MOLEKUL, DAN ION
Deskripsi
Perkembangan Teori Atom: Penelitian tentang partikel penyusun materi telah dimulai sejak zaman kuno. Teori modern tentang atom dikemukakan oleh John Dalton yang menyatakan bahwa unsur tersusun atas partikel yang sangat kecil yang disebut atom. Atom-atom yang menyusun suatu unsur adalah identik satu dengan yang lain. Unsur yang berbeda berbeda pula jenis atom penyusunnya.
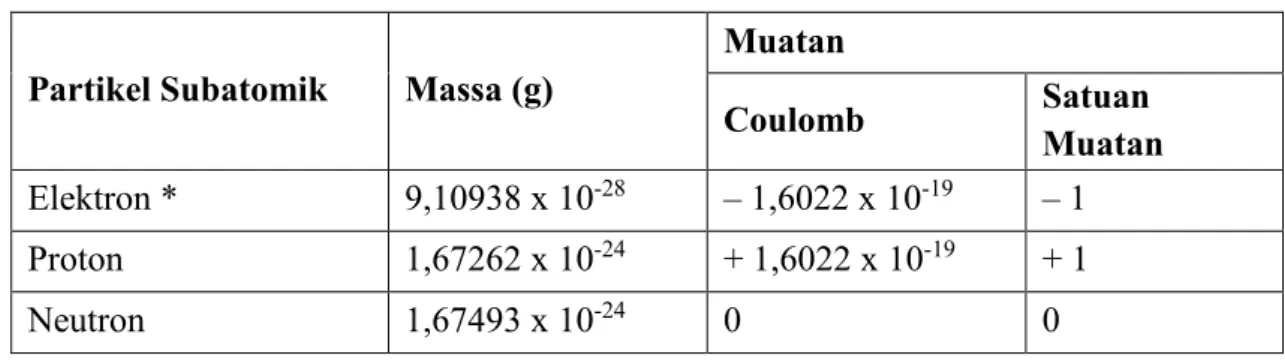
Struktur Atom : Sebuah atom terdiri dari tiga partikel dasar : proton, elektron, dan neutron. Proton bermuatan positif, elektron bermuatan negatif, dan neutron tidak ber-muatan. Proton dan neutron yang terletak di daerah yang kecil pada pusat atom yang di-sebut inti, dan elektron tersebar pada jarak tertentu di sekitar inti.
Identifikasi Atom : Nomor atom menunjukkan jumlah proton dalam inti. Atom dari unsur berbeda memiliki nomor atom yang berbeda. Isotop adalah atom dari unsur seje-nis yang memiliki jumlah neutron berbeda. Nomor massa merupakan jumlah dari proton dan neutron dalam sebuah atom.
Tabel Periodik : Unsur dapat dikelompokkan berdasarkan sifat fikika dan kimianya dalam sebuah bagan khusus yang disebut tabel periodik. Tabel periodik memungkinkan kita untuk mengklasifikasikan unsur-unsur (seperti logam, metaloid, dan nonlogam) dan saling mengaitkan sifat-sifatnya secara sistematis.
Dari Atom Hingga Ion dan Molekul : Atom-atom dari sebagian besar unsur saling berinteraksi untuk membentuk senyawa. Senyawa dapat diklasifikasikan menjadi molekul dan senyawa ionik, yang terbentuk dari ion positif (kation) dan ion negatif (anion). Rumus kimia menunjukkan jenis dan jumlah atom dalam suatu molekul atau senyawa.
Tatanama Senyawa : Penamaan dari berbagai macam senyawa anorganik diatur berdasarkan seperangkat aturan sederhana.
Senyawa Organik : Jenis senyawa organik yang paling sederhana adalah hidrokarbon.
2.1 TEORI ATOM
Pada abad ke-5 SM, seorang filsuf Yunani bernama Democritus menyatakan sebuah keyakinan bahwa semua materi terdiri dari partikel yang sangat kecil dan tidak dapat dibagi lagi. Demokritus menyebutnya sebagai atomos (tidak dapat