LAPORAN RESMI
PRAKTIKUM MIKROBIOLOGI DAN VIROLOGI
P - 1
STERILISASI DAN PEMBUATAN MEDIUM
Disusun Oleh:
Nama
: Zitta Afrida
NIM
: 1308010125
Golongan
: II
Kelompok : 3 B
LABORATORIUM MIKROBIOLOGI
FAKULTAS FARMASI
UNIVERSITAS MUHAMMADIYAH PURWOKERTO
2013
P – 1
I. TUJUAN
Setelah melakukan praktikum ini diharapkan mahasiswa dapat : 1. Mengetahui tujuan dan cara-cara sterilisasi.
2. Melakukan sterilisasi dengan menggunakan autoklaf. 3. Mengetahui penggunaan dan macam medium. 4. Membuat medium.
a) Media TSA 40 gr b) Darah domba 50 ml c) Akuadest 1000 ml
III. CARA KERJA
A. Sterilisasi Dengan Autoklaf
Tuangkan air secukupnya ke dalam sterilisator ↓
Tata alat - alat dan bahan - bahan yang akan disterilkan ↓
Letakkan tutup sterilisator pada tubuh sterilisator ↓
Buka klep pengaman ↓
Tutup klep pengaman apabila uap air mulai keluar dengan deras ↓
Pertahankan tekanan 1 atm selama 15 – 20 menit ↓
Matikan pemanasan dan tunggu sampai tekanan nol ↓
Buka pengatur klep ↓
Buang air yang bersisa dan keringkan semua bagiannya ↓
Saat mencuci tutupnya jaga agar alat pengukur tekanan tidak terkena air B. Pembuatan Medium
a. Pembuatan Medium Nutrien
Larutkan 3 gr ekstrak daging ↓
Ditimbang pepton sebanyak 5 gram ↓
Dilarutkan kedua bahan (ekstrak daging dan pepton) dalam 1000 ml aquadest sampai homogen
↓
Larutan dipanaskan dalam penangas air sampai larutan mendidih selama 5 menit
↓
Larutan didinginkan, kemudian dinetralkan dengan menggunakan NaOH 1 N sedikit demi sedikit sampai mencapai pH 7,2
(cek pH dengan menggunakan pH meter) ↓
Aquadest yang hilang selama pemanasan diganti dengan aquadest sehingga volumenya tepat 1000 ml kembali
Larutan medium tersebut disaring dengan menggunakan kapas atau kain penyaring yang bersih
↓
Disterilkan dengan menggunakan autoklaf pada tekanan 2 atm, suhu 121⁰C selama 20 menit
b. Pembuatan Medium Nurtien Agar
Disiapkan medium nutrien cair ↓
Timbang agar - agar sebanyak 15 – 20 gr untuk setiap 1 liter akuadest ↓
Masukkan agar - agar kedalam medium dan kemudian dipanaskan selama 20 - 30 menit
↓
Volume medium yang hilang selama pemanasan dikembalikan ke volume semula, bila perlu dilakukan penyesuaian pH
↓
Dalam keadaan panas, medium disaring dengan kapas atau kain saring yang bersih ↓
Medium dimasukkan ke dalam tabung reaksi steril, untuk medium agar miring diisikan 5 ml dan untuk medium agar tegak diisikan 10 ml
↓
Disterilkan pada autoklaf dengan tekanan 2 atm, suhu 121⁰C, selama 20 menit (untuk membuat agar miring, setela sterilisasi tabung diletakkan miring dengan
sudut 30⁰ terhadap bidang datar dan dibiarkan sampai medium menjadi padat, sedangkan untuk medium agar tegak, tabung reaksi diletakkan tegak)
c. Pembuatan Medium Agar Darah
Larutkan 4 gr TSA dalam 100 ml akuadest ↓
Kemudian disterilkan menggunakan autoklaf ↓
Siapkan darah domba sebanyak 5 ml ↓
Campurkan darah ke dalam media TSA ↓
Tuang ke dalam cawan petri sebanyak 5 ml ↓
Tunggu hingga memadat dan uap panas menghilang ↓
IV. HASIL
A. Gambar autoklaf beserta bagian-bagiannya
Keterangan gambar :
1. Tombol pengatur waktu mundur (timer) 2. Katup pengeluaran uap
3. pengukur tekanan 4. kelep pengaman 5. Tombol on-off 6. Termometer
7. air Lempeng sumber panas 8. Aquades (dH2O)
9. Sekrup pengaman 10. batas penambahan
V. PEMBAHASAN
Praktikum kali ini berjudul ” STERILISASI DAN PEMBUATAN MEDIUM “,yang bertujuan agar setelah dilakukannya praktikum mahasiswa diharapkan dapat megetahui tujuan dan cara - cara sterilisasi, dapat melakukan sterilisasi dengan menggunakan autoklaf, mengetahui penggunaan dan macam medium, serta dapat membuat medium.
oven yang lebih sederhana dan lebih murah dengan temperatur sekitar 160 – 170o C. Yang
kedua yaitu sterilisasi panas basah menggunakan uap air dengan menggunakan autoklaf,alat serupa pressure cooker dengan pengatur tekanan dan klep pengaman, prinsip autoklaf sendiri adalah terjadinya koagulasi yang lebih cepat dalam keadaan basah dibandingkan dalam keadaan kering. Proses sterilisasi dengan autoklaf ini dapat membunuh mikroorganisme dengan cara mendenaturasi atau memgkoagulasi protein pada enzim dan membran selmikroorganisme. Proses ini juga dapat membunuh endospora bakteri. Terdapat tiga tipe autoklaf yaitu, portable bench top, gravity displacement, dan multicycle porous – load .
Medium juga sangat diperlukan karena medium digunakan untuk mengembangbiakan milroorganisme seperti kapang, khamir, jamur, bakteri ataupu yang lainnya. Medium adalah suatu bahan yang terdiri atas campuran nutrisi yang dipakai untuk menumbuhkan mikroba,selain itu dapat puladigunakan untuk isolasi, memperbanyak, pengujian sifat -sifat fisiologi dan perhitungan jumlah mikroba. Agar mikroba dapat tumbuh dan berkembangbiak dengan baik di dalam suatu medium.maka medium tersebut harus memenuhi syarat antara lain medium harus mengandung semua nutrisi yang mudah digunakan oleh mikroba, medium harus mempunyai tekanan osmosis,tegangan muka dan pH yang sesuai, meddium tidak mengandung zat – zat yang menghambat pertumbuhan mikroba, serta medium harus steril. Pada praktikum yang dilakuka kali ini terdapat beberapa jenis medium yang dibuat antara lain medium nutrien cair dengan menggunakan ekstrak daging, medium nutrien agar tegak yang digunakan untuk melihat pertumbuhan mikroba, medium nutrien agar miring yang digunakan untuk melihat pergerakan mikroba, medium nutrien agar cawan yang digunakan untuk proses perhitungan mikroba serta medium nutrien agar darah( yang digunakan untuk menumbuhkan bakteri Neiserria dan Streptococcus, untuk menumbuhkan bakteri heterotrof, untuk membedakan bakteri berdasarkan sifatnya bisa atau tidaknya bakteri tersebut menghemolisis darah ) tetapi medium nutrien agar darah tidak dibuat dalam praktikum kali ini. Dan kelompok kami hanya membuat medium nutrien agar miring saja.
mensterilkan medium yang dibuat. Sementara bahan- bahan yang digunakan antara lain campuran antara ekstrak daging dengan agar - agar yang berfungsi sebagai sumber karbohidrat yang mengandung senyawa nitrogen yang banyak dibutuhkan oleh mikrona dan agar - agar yang berfungsi untuk memadatkan medium, NaCL yang berfungsi sebagai sumber mineral, pepton berfungsi untuk mempercepat pertumbuhan mikroba karena mengandung banyak N2, dan akuadest yang berfungsi sebagai pelarut.
Langkah kerja yang pertama yaitu kita membersihkan meja yang akan digunakan dalam praktikum dengan menggunakan alkohol, hal ini merupakan salah satu teknik aseptis yang dilakukan agar segala pekerjaan yang akan kita lakukan dalam keadaan yang steril dan terbebas dari zat yang kontaminan yang tidak diperlukan. Yang pertama dilakukan adalah pembuatan medium nutrien agar miring yang dibuat dengan cara memasukkan 1,2 gr Na ke dalam gelas beker kemudian ditambahkan akuadest sebanyak 60 ml dan diaduk sampai semua Na larut dan benar - benar homogen, setelah itu menyiapkan tabung reaksi sebanyak 12 buah, lalu masukkan sebanyak 5 ml larutan Na ke dalam tiap - tiap tabung reaksi yang telah disiapkan, setelah semua tabung reaksi terisi tutup tabung reaksi menggunakan kapas hingga benar - banar rapat sehingga tidak ada udara yang dapat masuk ke dalam tabung reaksi hal ini dilakukan agar medium tetap terjaga kemurniannya karena apabila tidak ditutup dengan rapat udara dapat masuk sedangkan udara mengandung banyak mikroorganisme dan kontaminan yang apabila masuk ke dalam tabung reaksi dapat mempengaruhi kemurnian dari medium yang dibuat serta dapat merusak medium,setelah itu ke 12 tabung tersebut dimasukkan ke dalam plastik dan diikat kencang menggunakan karet gelang.
Selanjutnya adalah pembuatan medium nutrien agar tegak yang dibuat dengan cara memasukkan 2,4 gr Na ke dalam gelas beker kemudian ditambahkan akuadest sebanyak 120 ml dan diaduk sampai semua Na larut dan benar - benar homogen, setelah itu menyiapkan tabung reaksi sebanyak 12 buah, lalu masukkan sebanyak 10 ml larutan Na ke dalam tiap -tiap tabung reaksi yang telah disiapkan, setelah semua tabung reaksi terisi tutup tabung reaksi menggunakan kapas hingga benar - benar rapat tujuannya seperti yang telah dijelaskan pada proses sebelumya,setelah itu ke 12 tabung tersebut dimasukkan ke dalam plastik dan diikat kencang menggunakan karet gelang.
rapat tujuannya seperti yang sudah dijelaskan diatas, setelah itu ke 12 tabung tersebut dimasukkan ke dalam plastik dan diikat kencang menggunakan karet gelang.
Setelah itu pembuatan medium nutrien cawan yang dibuat dengan cara memasukkan 3,6 gr Na kedalam gelas beker kemudian ditambahkan akuadest sebanyak 180 ml dan diaduk hingga homogen,setelah itu menyiapkan tabung reaksi sebanyak 12 buah, lalu masukkan sebanyak 15 ml larutan Na ke dalam tiap - tiap tabung reaksi yang telah disiapkan,setelah semua tabung reaksi terisi tutup tabung reaksi menggunakan kapas hingga benar - benar tertutup rapat tujuannya seperti yang sudah dijelaskan di atas, setelah itu ke 12 tabung reaksi tersebut dimasukkan ke dalam plastik dan diikat kencang dengan menggunakan karet gelang.
Selanjutnya adalah pembuatan medium TSA ( Tripton Soya Agar ) yang dibuat dengan cara memasukkan 3,6 gr TSA ke dalam erlenmeyer 250 ml kemudian ditambahkan akuadest sebanyak 90 ml, kemudian tutup erlenmeyer menggunakan kertas dan diikat menggunakan karet gelang. Komposisi TSA sendiri antara lain glukosa sebagai sumber gula, kasein sebagai sumber protein, kedelai sebagai sumber nutrisi seperti fungsi dari ekstrak daging, agar berfungsi untuk memadatkan medium, NaCL sebagai sumber mineral, dan fosfat sebagai penyangga.
Selanjutnya pembuatan medium NB yang dibuat dengan cara memasukkan 3,9 gr NB ke dalam gelas beker, kemudian ditambahkan akuadest sebanyak 300 ml, kemudian menyiapkan erlenmeyer sebanyak 6 buah, lalu masukkan sebanyak 50 ml larutan NB ke dalam tiap - tiap tabung reaksi, setelah itu tutup semua erlenmeyer menggunakan kertas dan diikat menggunakan karet gelang.
Setelah semua medium selesai dibuat kemudian disterilkan dengan menggunakan autoklaf. Autoklaf adalah alat pemanas tertutup yang digunakan untuk mensterilisasi suatu benda menggunakan uap bersuhu dan bertekanan tinggi (1210C, 15 lbs) selama kurang
VI. KESIMPULAN
Kesimpulan yang dapat diambil dari praktikum yang telah dilakukan adalah : 1. Setelah melakukan praktikum ini mahasiswa dapat:
a. Mengetahui tujuan dan cara-cara sterilisasi.
b. Melakukan sterilisasi dengan menggunakan autoklaf. c. Mengetahui penggunaan dan macam medium.
d. Membuat medium.
2. Sterilisasai dalam mikrobiologi merupakan proses penghilangan semua jenis organisme hidup, dalam hal ini adalah mikroorganisme ( protozoa, fungi, bakteri, mycoplasma, dan virus ) yang terdapat di atau pada suatu benda.
3. Sterilisasi dapat dilakukan dengan beberapa cara antara lain : a. Sterilisasi secara fisik
4. Metode sterilisasi yang digunakan dalam praktikum adalah metode sterilasi panas basah menggunakan autoklaf dengan temperatur diatas 100o C
5. Prinsip kerja autoklaf adalah terjadinya koagulasi yang lebih cepat dalam keadaan basah dibandingkan dalam keadaan kering, proses sterilisasi dengan autoklaf ini dapat membunuh mikroorganisme dengancara mendenaturasi atau mengkoagulasi protein pada enzim dan membran sel mikroorganisme.
6. Medium adalah suatu bahan yang terdiri atas campuran nutrisi yang dipakai untuk menumbuhkan mikroba,selain itu dapat puladigunakan untuk isolasi, memperbanyak, pengujian sifat - sifat fisiologi dan perhitungan jumlah mikroba.
7. Syarat - syarat medium yang baik :
a. Medium harus mengandung semua nutrisi yang mudah digunakan oleh
Medium nutrien agar cair dengan menggunakan ekstrak daging
Medium nutrien agar tegak
Medium nutrien agar miring
Medium NB
Medium TSA ( Tripton Soya Agar )
Medium nutrien cawan
9. Kelompok kami hanya membuat satu macam jenis medium yaitu medium agar miring.
VII. DAFTAR PUSTAKA
Agus Syahrurachman, dkk. 1993 Buku Ajar Mikroboilogi Kedokteran. Jakarta : Binarupa Aksara.
Michael Pelczar, dkk. 2008. Dasar – Dasar Mikrobiologi, Jakarta : Penerbit Universitas Indonesia.
Pratiwi, Sylvia T. 2008. Mikrobiologi Farmasi. Jakarta: Erlangga.
LAPORAN RESMI
PRAKTIKUM MIKROBIOLOGI DAN VIROLOGI
P - 2
Disusun Oleh:
Nama
: Zitta Afrida
NIM
: 1308010125
Golongan
: II
Kelompok : 3 B
LABORATORIUM MIKROBIOLOGI
FAKULTAS FARMASI
UNIVERSITAS MUHAMMADIYAH PURWOKERTO
2013
P – 2
PENANAMAN, ISOLASI DAN PENGAMATAN PERTUMBUHAN MIKROBA
I.TUJUAN
Setelah melakukan praktikum ini diharapkan mahasiswa dapat melakukan isolasi terhadap mikroba seta mengamati pertumbuhan bakteri.
II. ALAT DAN BAHAN
1. Menanam mikroba aerob A. Alat
1) Ose tumpul 2) Ose runcing 3) Lampu spiritus B. Bahan
1) Biakan murni Bacillus subtilis dalam medium nutrien cair umur 24 jam. 2) Biakan murni Escherichia coli dalam medium nutrien cair umur 24 jam. 3) Medium nutrien agar tegak, medium nutrien agar miring, dan medium
2. Isolasi mikroba A. Alat
1) Cawan petri steril B. Bahan
1) Suspensi mikroba / campuran mikroba 2) Medium nutrien agar tegak
1) Kultur bakteri E. coli dari media NA.
2) 100 ml medium pertumbuhan NB dalam 250 ml labu erlenmeyer. 3) Media tanpa bakteri sebagai blanko.
III. CARA KERJA
A. Menanam mikroba aerob a) Biakan agar tegak
Sterilkan jarum ose runcing diatas nyala api lampu spiritus ↓
Ambil biakan murni dengan benar dan dalam keadaan aseptis diatas nyala lampu spiritus
↓
Ambil inokulum menggunakan jarum ose runcing, panaskan bibir tabung lalu tutup kembali
↓
Ambil medium aga tegak, lepas kapas penutupnya kemudian tusuk medium agar tegak tersebut dengan ose inokulasi hingga 1cm di bawah permukaan tabung
secara hati - hati, panaskan bibir tabung lalu tutup kembali ↓
Pijarkan lampu ose sebelum diletakkan kembali ↓
Beri etiket pada tabung reaksi bertuliskan nama bakteri ↓
b) Biakan agar miring
Sterilkan jarum ose tumpul diatas nyala api lampu spiritus ↓
Ambil biakan murni dengan benar dan dalam keadaan aseptis diatas nyala lampu spiritus
↓
Ambil inokulum menggunakan jarum ose tumpul, panaskan bibir tabung lalu tutup kembali
↓
Ambil medium aga miring, lepas kapas penutupnya kemudian goreskan jarum ose tumpul pada permukaan medium agar miring tersebut secara hati - hati,
panaskan bibir tabung lalu tutup kembali ↓
Pijarkan lampu ose sebelum diletakkan kembali ↓
Beri etiket pada tabung reaksi bertuliskan nama bakteri ↓
Diinkubasikan pada suhu 37o C
c) Biakan cair
Sterilkan jarum ose runcing diatas nyala api lampu spiritus ↓
Ambil biakan murni dengan benar dan dalam keadaan aseptis diatas nyala lampu spiritus
↓
Ambil inokulum menggunakan jarum ose runcing, panaskan bibir tabung lalu tutup kembali
↓
Ambil medium agar cair, lepas kapas penutupnya kemudian singgungkan ujung ose tumpul yang mengandung inokulum pada permukaan medium agar cair
secara hati - hati, panaskan bibir tabung lalu tutup kembali ↓
Pijarkan lampu ose sebelum diletakkan kembali ↓
Beri etiket pada tabung reaksi bertuliskan nama bakteri ↓
Diinkubasikan pada suhu 37o C
B. Isolasi Mikroba
Cara Goresan ( Streaking plate )
Cairkan medium nutrien agar dalampenangas air, dinginkan hingga suhu 50o C
Setelah medium mencair, tuangkan medium pada cawan petri steril secara aseptik, biarkan dingin dan memadat
↓
Ambil inokulum menggunakan ose tumpul, secara aseptik dan kumudian buat goresan pada permukaan agar
↓
cawan petri yang telah ditempel etiket kemudian dibungkus dengan koran dan dibalik, kemudian diinkubasi pada suhu 37o C
↓
Setelah diinkubasi akan tampak koloni yang terpisah-pisah ↓
Satu koloni kemungkinan berasal dari satu sel mikroba yang berkembangbiak ↓
Ambil secara aseptik dari satu koloni yang mewakili satu jenis mikroba, dan disuspensikan dalam air steril
↓
Dilakukan pengecatan gram dan diamati di bawah mikroskop ↓
Pindahkan masing – masing hasil isolasi dalam medium nutrien agar miring ↓
Diinkubasi pada suhu yang sesuai selama 24-48 jam ↓
Diuji kembali kemurniannya dengan pengecatan gram ↓
Isolasi berhasil jika terdapat satu jenis mikroba saja
C. Pengamatan Pertumbuhan Mikroba
Ambil satu ose koloni bakteri Escherichia coli dari media NA ↓
Diinokulasi ke dalam media pertumbuhan NB pada labu erlenmeyer (jam ke-0) ↓
Ambil 1 ml suspensi bakteri dan dipindahkan dalam kuvet plastik (media tanpa suspensi bakteri sebagai blangko diukur pada spektrofotometer dengan panjang gelombang 600 nm, kemudian dibaca absorbansi kuvet yang berisi suspensi
bakteri) ↓
Pembacaan absorbansi diulangi tiap 3 jam selama 27 jam ↓
IV. HASIL
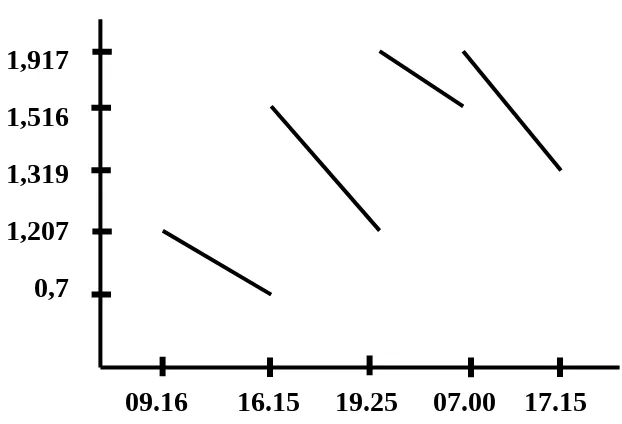
Absorbansi
1,917
1,516
1,319
1,207
0,7
09.16 16.15 19.25 07.00 17.15
Keterangan tabel:
Gambar 1.3. Tabel Absorbansi Pertumbuhan Mikroba
V. PEMBAHASAN
Praktikum kali ini berjudul ” Penanaman, Isolasi dan Pengamatan Pertumbuhan Mikroba “, yang bertujuan agar setelah dilakukannya praktikum mahasiswa diharapkan dapat melakukan penanaman dan isolasi mikroba serta mengamati pertumbuhan bakteri.
Isolasi mikroba merupakan pemisahan mikroba yang dikehendaki dari lingkungannya di alam dan menumbuhkannya sebagai biakan murni dalam medium buatan. Ada beberapa cara penanaman mikroba, tergantung pada tujuan penanaman tersebut. Yang berdasarkan bentuk dan cara penanamannya dapat dibedakan menjadi tiga macam yaitu biakan agar tegak, biakan agar miring, dan biakan cair.
Dalam proses pengisolasian mikroba ada beberapa hal penting yang perlu diperhatikan antara lain sifat – sifat spesies mikroba yang ditanam, tempat hidup atau asal mikroba tersebut, cara menanam dan cara menginokulasikannya, cara menguji bahwa mikroba yang diisolasi telah berupa biakan biakan murni dan sesuai dengan yang dimaksud, serta cara memelihara biakan murni tersebut.
mikroorganismenya, sifat media, dan kondisi pertumbuhan dari mikroorganismenya. Yang ketiga adalah fase stasioner merupakan proses berhentinya pertumbuhan mikroorganisme dan terjadinya keseimbangan antara jumlah sel yang membelah dengan jumlah sel yang mati, pada fase ini juga terjadi akumulasi produk buangan yang toksik. Dan yang terakhir adalah fase kematian, merupakan proses dimana jumlah sel yang mati meningkat, faktor penyebabnya adalah ketidaktersediannya nutrisi dan akumulasi produk buangan yang toksik.
Alat yang digunakan dalam praktikum kali ini antara lain ose runcing yang digunakan untuk mengambil mikroba biakan murni tertentu (Bacillus subtilis dan Escherichia coli) yang akan ditanam pada medium agar tegak, ose tumpul yang digunakan untuk mengambil mikroba biakan murni tertentu (Bacillus subtilis dan Escherichia coli) yang akan ditanam pada medium agar miring, lampu spiritus digunakan saat memanaskan ose dan bibir tabung berisi biakan murni maupun medium, teknik tersebut dinamakan teknik aseptis, yaitu suatu teknik untuk menghambat pertumbuhan atau mematikan mikroba, cawan petri yang digunakan sebagai tempat untuk menanam, mengisolasi, dan mengamati mikroba, inkubator yang digunakan untuk meningkatkan pertumbuhan mikroba, pipet ukur yang digunakan untuk mengambil suspensi bakteri (Bacillus subtilis) yang akan diamati absorbansinya, kuvet plastik yang digunakan sebagai tempat suspensi bakteri uji, dan spektrofotometer yang digunakan untuk pengukuran pada saat asorbansi suspensi bakteri uji dan menggunakan panjang gelombng 600 nm. Sementara bahan – bahan yang digunakan antara lain biakan murni Bacillus subtilis dalam medium nutrien cair berumur 24 jam, biakan murni Escherichia coli dalam medium nutrien cair berumur 24 jam, medium nutrien agar tegak, suspensi mikroba / campuran mikroba, kultur bakteri Escherichia coli, 100 ml medium pertumbuhan NB dalam 250 ml labu erlenmeyer, dan media tanpa bakteri sebagai blanko.
bakteri fakultatif, tidak menghasilkan spora, aerob yang dapat hidup dalam keadaan anaerob, termasuk bakteri gram negatif, memiliki lapisan luar lipopolisakarida terdiri atas membran dan lapisan peptidoglikan yang tipis terletak pada periplasma (diantara lapisan luar dan membran sitoplasmik).
bakteri Escherichia coli. Kemudian inkubasi pada suhu 37⁰C, proses pengininkubasian ini dilakukan dengan tujuan untuk mempertahankan kondisi pertumbuhan mikroba hingga mencapai kondisi maksimal pertumbuhannya, dilakukan pada suhu 37⁰C karena suhu tersebut sama dengan suhu tubuh manusia sehingga memungkinkan bakteri untuk tumbuh karena suhunya yang sesuai atau sama dengan suhu tubuh manusia.
Penanaman mikroba pada medium nutrien agar tegak ini tujuan untuk memperlama hidup mikroba, untuk lebih mudah mengambil bakteri yang digunakan, dan untuk mengamati koloni secara tunggal dan untuk membedakan bakterinya. Setelah dilakukan inkubasi pada suhu 37⁰C selama 24 jam, didapatkan hasil pada medium agar yang ditanam Bacillus subtilis, letak koloni berada di dasar dan di permukaan medium. Pada medium agar yang ditanam Escherichia coli, letak koloni berada di permukaan medium. Dari hasil ini dapat diambil kesimpulan sementara bahwa Bacillus subtilis dan Escherichia coli dalam pertumbuhannya membutuhkan oksigen untuk bertahan hidup sehingga pertumbuhan koloninya muncul pada permukaan medium dimana pada permukaan medium memungkinkan kontak langsung koloni tersebut dengan udara yang mengandung oksigen, karena Bacillus subtilis memang merupakan bakteri yang bersifat aerob, sedangkan Escherichia coli merupakan bakteri yang bersifat anaerob anaerob yang dapat tumbuh pada keadaan dimana tidak ada oksigen sama sekali sehingga letak koloninya berada pada permukaan medium. Yang kedua yaitu menggunakan agar miring sebagai tempat pembiakan cara penanamam yang dilakukan pada medium agar miring sama seperti yang dilakukan pada agar tegak, hanya saja pada pembiakan agar miring ose yang digunakan adalah ose tumpul, dan pada saat penanaman ose tumpul digoreskan pada permukaan medium agar miring tersebut. Dan setelah di inkubasikan selama 24 jam di dalam inkubator dengan suhu 370C pada kelompok kami didapatkan hasil pada biakan
mikroba yang tumbuh pada retakan medium tersebut akan sangat sulit saat dilakukan perhitungan. Dan yang ketiga menggunakan medium cair sebagai tempat pembiakan dan dilakukan dengan cara yang sama seperti pada pembiakan agar miring, dan juga menggunakan ose yang sama yaitu ose tumpul tetapi pada saat pemberian bakteri kedalam mediumnya dilakukan dengan cara menyinggungkan ujung ose tumpul yang mengandung inokulum pada permukaan medium cair tersebut. Dan Setelah di inkubasikan selama 24 jam di dalam inkubator dengan suhu 370C pada kelompok kami
mendapatkan hasil pada biakan murni bakteri Bacillus subtilis yaitu bakteri Bacillus subtilis berada di permukaan, pada biakan murni bakteri Escherichia coli yaitu bakteri Escherichia coli berada di dasar. Bacillus subtilis merupakan bakteri aerob, sehingga bakteri tersebut akan dapat hidup apabila ada oksigen atau dapat dikatakan letaknya ada dipermukaan, sedangkan bakteri Escherichia coli bersifat anaerob fakultatif yang dapat hidup pada keadaan aerob dan anaerob, jadi bakteri Escherichia coli letaknya bisa ada didasar atau di permukaan dari tabung biakan. Penanaman mikroba pada medium nutrien cair ini bertujuan untuk melihat pertumbuhan mikroba dan pergerakan mikroba.
Proses kedua yang dilakukan adalah pengisolasian mikroba dengan cara goresan / streaking plate. Yang dilakukan dengan cara yang pertama dilakukan menyiapkan medium nutrien agar setelah itu medium di cairkan dengan cara di masukkan dalam penangas air, lalu setelah medium mencair sempurna didinginkan hingga suhunya kurang lebih 500 C, Kemudian setelah medium agak dingin dituangkan pada cawan petri steril
prosesini juga harus dilakukan dalam keadaan aseptik, setelah itu biarkan medium dingin dan memadat. Setelah medium dingin dan memadat ambil inokulum menggunakan ose tumpul yang sebelumnya telah disterilkan dengan cara dipanaskan di atas nyala api lampu spiritus , setelah itu buat goresan di permukaan agar dan goresan yang membentuk zig –zag.
Pada saat penggoresan tidak boleh terputus dengan kata lain harus berlanjut hal ini dilakukan agar koloni yang nantinya terbentuk berlanjut dan tidak terputus sementara penggoresan secara zig- zag yang dilakukan bertujuan untuk melihat pergerakan bakteri yang sedang di biakkan. Setelah itu cawan petri diberi etiket dan dibungkus menggunakan kertas koran atau kertas lain seperti misalnya fotocopy dengan ukuran F4, kemudian diinkubasiakan pada suhu 370 C selama 24 jam.Dan setelah diinkubasikan
Proses yang terakhir adalah dilakukannya pengamatan pertumbuhan mikroba dengan cara yang pertama adalah mengambil satu ose koloni bakteri Escherichia coli dari media NA menggunakan ose tumpul yang sebelumnya telah di sterilkan terlebih dahulu, kemudia menginokulasikannya ke dalam media pertumbuhan NB pada labu erlenmeyer ( jam ke – 0 ), setelah itu mengambil1 ml suspensibakteri dan memindahkannyake dalam kuvet plastik, dan media tanpa suspensi bakteri digunakan sebagai blanko diukur pada spektrofotometer dengan panjang gelombang 600 nm pengukuran pada spektofotometer berguna untuk melihat kepekatan mikroba, kuvet yang dindingnya keruh diletakkan disebelah luar, sedangkan bagian yang dindingnya transparan diletakkan menghadap sinar UV, hal ini tidak boleh terbalik, karena pada dinding yang transparan akan lebih mudah menangkap sinar UV tersebut, kemudian baca adsorbansi kuvet yang berisi suspensi bakteri Escherichia coli, setelah itu diinkubasikan pada suhu 370 C dengan
tujuan seperti yang sudah di jelaskan diatas. Ulangi pembacaan absorbansi setiap 3 jam sekali selama 27 jam, hal ini dilakukan untuk mengetahui kestabilan serta mengontrol pertumbuhan bakteri setiap jamnya untuk disesuaikan dengan setiap fase pertumbuhannya.
Dan kelompok kami mendapatkan hasil yaitu pada absorbansi pertama 0,78 yang dilakukan pada pukul 09.16. Lalu pada absorbansi kedua yaitu 1,207 yang dilakukan pada pukul 16.15, kemudian pada absorbansi ke tiga yaitu 1,516 yang dilakukan pada pukul 19.25, kemudian pada absorbansi keempat yaitu 1,917 yang dilakukan pada pukul 07.00, absorbansi terakhir yang dilakukan pada pukul 17.15 yaitu 1,319.
Gambar 1.2. Kurva Absorbansi Pertumbuhan Mikroba
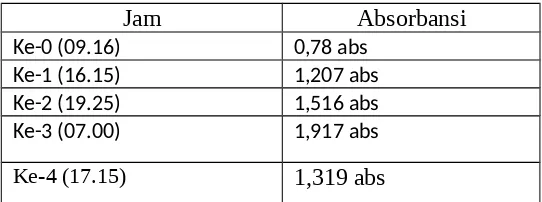
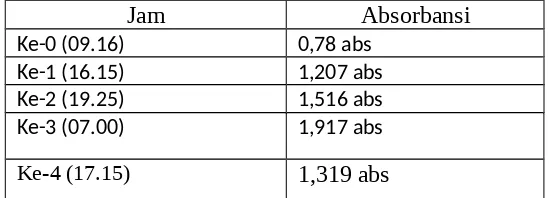
Gambar 1.3. Tabel Absorbansi Pertumbuhan Mikroba
VI. KESIMPULAN
Kesimpulan yang dapat diambil dari praktikum yang telah dilakukan adalah :
1. Setelah melakukan praktikum ini mahasiswa dapat melakukan penanaman dan isolasi mikroba serta mengamati pertumbuhan bakteri.
2. Isolasi mikroba merupakan pemisahan mikroba yang dikehendaki dari lingkungannya di alam dan menumbuhkannya sebagai biakan murni dalam medium buatan.
3. Ada beberapa hal penting yang perlu diperhatikan pada saat pengisolasian mikroba antara lain :
a) Sifat-sifat spesies mikroba yang akan di tanam. b) Tempat hidup atau asal mikroba tersebut. c) Cara menanam dan cara mengisolasikannya.
d) Cara menguji bahwa mikroba yang diisolasi telah berupa biakan murni dan sesuai dengan yang dimaksud.
e) Cara memelihara biakan murni.
4. Dalam masa pertumbuhannya bakteri mengalami empat macam fase pertumbuhan yaitu :
a) Fase lag ( awal )
d) Fase kematian
5. Pembiakan mikroba menggunakan medium nutrien agar miring bertujuan untuk melihat pergerakan mikroba, dan pembiakan mikroba pada medium nutrien agar tegak bertujuan untuk memperlama hidup mikroba dan melihat pertumbuhan mikroba, sementara pembiakan pada medium nutrien cair bertujuan untuk melihat pertumbuhan dan pergerakan mikroba.
6. B. subtilis merupakan bakteri aerob, sehingga bakteri tersebut akan dapat hidup apabila ada oksigen atau dapat dikatakan letaknya ada dipermukaan, sedangkan bakteri E. coli bersifat anaerob fakultatif yang dapat hidup pada keadaan aerob dan anaerob, jadi bakteri E. coli letaknya bisa ada didasar atau di permukaan dari tabung biakan.
7. Medium yang pecah atau rusak tidak akan menggangu proses pertumbuhan mikroba, tetapi akan menggangu pada saat proses perhitungan karena jika ada mikroba yang tumbuh pada retakan medium tersebut mikroba akan sangat sulit saat dihitung.
8. Dari praktikum kali ini didapatkan hasil absosbansi sebagai berikut :
Jam Absorbansi
Ke-0 (09.16) 0,78 abs
Ke-1 (16.15) 1,207 abs
Ke-2 (19.25) 1,516 abs
Ke-3 (07.00) 1,917 abs
VII. DAFTAR PUSTAKA
Dwijoseputro, D. 2010. Dasar-dasar mikrobiologi. Jakarta: Djambatan. Fardiaz, S. 1992. Mikrobiologi Pangan . Gramedia Pustaka Utama : Jakarta
LAPORAN RESMI
PRAKTIKUM MIKROBIOLOGI DAN VIROLOGI
P - 3
PERHITUNGAN JUMLAH MIKROBA
Disusun Oleh:
Nama
: Zitta Afrida
NIM
: 1308010125
LABORATORIUM MIKROBIOLOGI
Setelah melakukan praktikum ini diharapkan mahasiswa dapat :
1. Mengetahui cara – cara perhitungan jumlah mikroba, baik secara langsung maupun secara tidak langsung.
2. Melakukan perhitungan jumlah mikroba yang ada pada suatu bahan.
II. ALAT DAN BAHAN
1) Kultur suspensi bakteri E. coli dalam media NB umur 18 – 24 jam 2) Media NB tanpa bakteri sebagai blanko
B. Bahan
1) Sampel bahan ( air sumur ) yang akan ditentukan jumlah bakterinya 2) Medium nutrieb agar tegak
3) Medium tripton glukosa yeast agar tegak 4) Akuades steril
III. CARA KERJA
A. Menggunakan Spektrofotometer
Ambil 1 ml suspensi bakteri dan pindahkan ke dalam kuvet plastik ↓
Diencerkan bila perlu untuk mendapatkan OD 600 kurang dari 1 ↓
Sampel dimasukkan kedalam kuvet ↓
Sampel diukur OD 600 ↓
Dihitung densitas dari sel dengan menggunakan table B. Berdasarkan Total Plate Count
Ambil 1 ml sampel ↓
1 ml sampel ditambah dengan 9 ml aquadest (tabung 1) ↓
1 ml suspense tabung 1 ditambah 9 ml aquadest (tabung 2) ↓
1 ml suspense tabung 2 ditambah 9 ml aquadest (tabung 3) dan seterusnya sampai pengenceran 10‾
Medium agar dipanaskan (diambil 10 ml) ↓
Campuran medium ditambahkan dengan suspense pengenceran dalam cawan petri ↓
Digoyangkan dengan arah angka 8 secara hati-hati ↓
Dibungkus dengan kertas lalu diinkubasi selama 24 jam ↓
Didinginkan dan dihitung koloni yang tumbuh pada masing-masing cawan petri
IV. HASIL
Berdasarkan Toyal Plate Count
Pengenceran 10-5 (rep 1) Pengenceran 10-5 (rep 2)
= 6,01 CFU (coloning forming unit) B <atau 2 = rata - rata A
Jumlahbakteri = 253,5x 10
4=
2535000 sel/ml
V. PEMBAHASAN
Praktikum kali ini berjudul ” Perhitungan Jumlah Mikroba “, yang bertujuan agar setelah dilakukannya praktikum mahasiswa diharapkan dapat mengetahui cara – cara perhitungan jumlah mikroba, baik secara langsung maupun secara tidak langsung, serta dapat melakukan perhitungan jumlah mikroba yang ada pada suatu bahan.
Tetapi metode yang dilakukan pda saat praktikum adalah perhitungan jumlah mikroba secara tidak langsung (indirect method ) yang dilakukan dengan cara berdasarkan kekeruhan dan berdasarkan jumlah koloni ( plate count ).
Syarat – syarat yang harus dipenuhi pada saat perhitungan antara lain jumlah koloni dalam tiap cawan petri antara 30-300 koloni, jika memang tidak ada yang memenuhi syarat dipilih yang jumlahnya mendekati 300, tidak ada spreader (koloni yang menutup lebih besar dari setengah luas cawan petri), perbandingan jumlah bakteri dari hasil pengenceran yang lebih besar dengan pengenceran sebelumnya, jika sama atau lebih kecil dari 2 hasilnya dirata-rata, tetapi bila lebih besar dari 2 yang dipakai adalah jumlah mikroba dari hasil pengenceran sebelumnya, serta jika dengan ulangan, setelah memenuhi syarat hasilnya dirata-rata.
Alat yang digunakan dalam praktikum kali ini antara lain kuvet plastik, pipet steril, spektrofotometer, cawan petri, kapas steri,l gelas ukur, dan tabung reaksi. Sementara bahan - bahan yang digunakan adalah kultur suspensi bakteri E. coli dala media NB umur 18 – 24 jam, media NB tanpa bakteri sebagai blanko, sampel bahan yaitu air sumur yang akn ditentukan jumlah bakterinya, medium nutrien agar tegak, medium tripton glukosa yeast agar tegak, dan akuadest steril.
dindingnya keruh diletakkan disebelah luar, sedangkan bagian yang dindingnya transparan diletakkan menghadap sinar UV, hal ini tidak boleh terbalik, karena pada dinding yang transparan akan lebih mudah menangkap sinar UV tersebut. Dan didapatkan hasil pada kelompok kami yaitu 1,143 abs.
Pada tahap yang kedua yaitu perhitungan jumlah mikroba berdasarkan total plate count yang dilakukan dengan cara mengambil 1 gram sampel pada kelompok kami mendapatkan sampel air sumur, kemudian melarutkannya dalam 9 ml aquadest (tabung 1). Setelah itu 1 ml suspensi tabung 1 ditambahkan dengan 9 ml aquadest (tabung 2 sebagai pengenceran 10-1), kemudian mengambil 1 ml suspensi tabung 2 dan
ditambahkan dengan 9 ml aquadest (tabung 3 sebagai pengeceran 10-2), kemudian
mengambil 1 ml suspensi tabung 3 dan ditambahkan 9 ml aquadest (tabung 4 sebagai pengenceran 10-3), kemudian mengambil 1 ml suspensi tabung 4 dan ditambahkan 9 ml
aquadest (tabung 5 sebagai pengenceran 10-4), kemudian ambil 1 ml suspensi tabung 5
dan ditambahkan 9 ml aquadest (tabung 6 sebagai pengenceran 10-5). Kemudian pada
tabung 5 sebagai pengenceran 10-4 dituangkan ke dalam cawan petri 1 sebagai replikasi 1
dan cawan petri 2 sebagai replikasi 2. Begitu juga dengan tabung 6 sebagai pengenceran 10-5 dituangkan ke dalam cawan petri 1 sebagai replikasi 1 dan cawan petri 2 sebagai
simulasi yaitu untuk cawan petri replikasi 1 dengan pengenceran 10-4 didapat bakteri
sebanyak 236 dan pada replikasi 2 sebanyak 271 sementara untuk cawan petri replikasi 1 dengan pengenceran 10-5 didapat bakteri sebanyak 165 dan pada replikasi 2 sebanyak
140.
VI. KESIMPULAN
Kesimpulan yang dapat diambil dari praktikum yang telah dilakukan adalah :
1. Setelah melakukan praktikum ini mahasiswa dapat :
a) Mengetahui cara – cara perhitungan jumlah mikroba, baik secara langsung maupun secara tidak langsung.
b) Melakukan perhitungan jumlah mikroba yang ada pada suatu bahan.
2. Perhitungan jumlah mikroba pada suatu bahan bisa ditentukan dengan bermacam-macam cara tergantung pada bahan dan jenis mikroba yang akan ditentukan.
3. Secara umum metode perhitungan jumlah mikroba dibagi menjadi dua yaitu: a) Perhitungan secara langsung
b) Perhitungan secara tidak langsung
4. Perhitungan secara langsung meliputi:
a) Menggunakan counting chamber b) Menggunakan filter membran
5. Perhitungan secara tidak langsung meliputi:
c) Berdasarkan kekeruhan
d) Berdasarkan jumlah koloni (plate count) e) Berdasarkan analisa kimia
f) Menggunakan Most Probably Number
6. Karena bakteri tidak tumbuh pada medium yang kami buat jadi kami menggunakan data simulasi dan di dapat hasil bakteri total sebanyak 2535000 sel/ml
VII. DAFTAR PUSTAKA
Fardiaz, S. 1992. Mikrobiologi Pangan . Gramedia Pustaka Utama : Jakarta
Michael Pelczar, dkk. 2008. Dasar – Dasar Mikrobiologi, Jakarta : Penerbit Universitas Indonesia.
LAPORAN RESMI
PRAKTIKUM MIKROBIOLOGI DAN VIROLOGI
P - 4
PENGECATAN DAN MORFOLOGI MIKROBA
Disusun Oleh:
Nama
: Zitta Afrida
NIM
: 1308010125
LABORATORIUM MIKROBIOLOGI
Setelah melakukan praktikum ini diharapkan mahasiswa dapat : 1. Mengetahui tujuan dari pengecatan
1) Biakan murni B. subtilis dalam medium nutrien cair berumur 24 jam 2) Biakan murni Escherichia coli dalam medium nutrien cair berumur 24 jam 3) Larutan cat safranin atau cryistal violet
2. Pengecatan Gram
1) Biakan murni Bacillus subtilis dalam medium nutrien cair berumur 24 jam.
3) Larutan cat Kristal violet (gram A). 4) Larutan lugol iodine (gram B).
5) Larutan alcohol atau aseton (gram C). 6) Larutan cat safranin (gram D).
III. CARA KERJA
A. Pengecatan Sederhana
Bersihkan gelas objek dengan alcohol sampai bebas lemak, kemudian dipanggang sebentar dalam lampu spiritus
↓
Ambil secara aseptic 1 ose suspensi biakan Bacillus subtilis dan diratakan di atas permukaan gelas objek kira-kira 1 cm
↓
Keringanginkan preparat kemudian difiksasi dengan cara melewatkannya di atas nyala lampu spiritus
↓
Didinginkan kemudian teteskan cat safranin atau kristal violet secukupnya dan dibiarkan 1-2 menit
↓
Cuci dengan air mengalir sampai sisa cat habis kemudian dikeringanginkan ↓
Amati dengan mikroskop dengan perbesaran kuat dan gambar morfologi selnya
B. Pengecatan Gram
Bersihkan gelas objek dengan alcohol sampai bebas lemak, kemudian dipanggang sebentar dalam lampu spiritus
↓
Ambil secara aseptic 1 ose suspensi biakan Bacillus subtilis dan diratakan di atas permukaan gelas objek kira-kira 1 cm
↓
Keringanginkan preparat kemudian difiksasi dengan cara melewatkannya di atas nyala lampu spiritus
↓
Didinginkan kemudian ditetesi cat gram A sebanyak 2-3 tetes dan diamkan selama 1 menit
↓
Cuci dengan air mengalir, kemudian dikeringanginkan ↓
Teteskan cat Gram B, biarkan selama 1 menit, cuci dengan air mengalir dan keringkan
Cuci dengan larutan peluntur ( Gram C ) selama 30 deti, kemudian cuci dengan air mengalir dan keringkan
↓
Beri larutan cat penutup (gram D) selama 1 menit, cuci dengan air mengalir, dan keringanginkan
↓
Amati dengan mikroskop dengan minyak emersi kemudian gambar preparat yang diamati
IV. HASIL
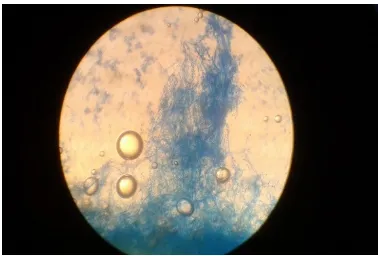
A. Pengecatan Sederhana
Escherichia coli Bacillus subtilis
Escherichia coli Bacillus subtilis
V. PEMBAHASAN
Praktikum kali ini berjudul ” Pengecatan dan Identifikasi Mikroba “, yang bertujuan agar setelah dilakukannya praktikum mahasiswa diharapkan dapat mengetahui tujuan dari pengecatan, serta melakukan pengecatan terhadap mikroba.
mikroba, baik bakteri, yeast ataupun kapang, memperjelas ukuran dan bentuk mikroba, untuk melihat struktur luar, apabila memungkinkan struktur dalam, dari mikroba, dan untuk melihat reaksi mikroba terhadap cat yang diberikan, sehingga sifat-sifat fisik dan kimia yang ada bisa dideteksi.
Pewarnaan merupakan prosedur mewarnai mikroorganisme untuk menonjolkan struktur tertentu dari mikroorganisme. Sebelum diwarnai mikroorganisme difiksasi agar terikat atau menempel pada kaca. Fiksasi merupakan proses dimana struktur internal dan eksternal dari mikroorganisme disimpan dan diikatkan pada suatu benda.
Pada praktikum kali ini dilakukan pengecatan sederhana dan pengecatan gram. Peengecatan sederhana adalah pengecatan yang dilakukan menggunakan satu macam cat saja, cat yang bisa digunakan adalah metilen blue, gentiana violet, basic fuschin atau safranin. Sedangkan pengecatan gram adalah pengecatan yang menggunakan 2 macam cat warna dan merupakan yang paling banyak digunakan dan sangat populer. Pada pengecatan gram ini melalui 4 tahap yaitu :
a) Pemberian cat utama (larutan kristal violet), pewarna ungu.
b) Pengintensifan warna dengan menambahkan warna larutan Mordan. c) Pencucian (dekolorisasi) dengan menggunakan alkohol / aseton.
d) Penambahan cat penutup (counter stain), yaitu dengan larunan safranin yg berwarna merah.
digunakan sebagai larutan pencuci, larutan cat safranin (gram D) digunakan sebagai cat penutup.
Langkah pertama yang lakukan adalah melakukan pengecatan sederhana. Hal pertama yang dilakukan adalah mengambil gelas objek, kemudian bersihkan dengan alkohol hingga bebas dari bebas lemak, kemudian dipanggang sebentar di atas api spiritus, ambil secara aseptic 1 ose suspensi biakan Bacillus subtilis dan ratakan di atas permukaan gelas ojek kira-kira 1 cm, diratakan dengan luas 1 cm bertujuan agar larutan tidak keluar dari gelas objek dan dikarenakan menyesuaikan dari luas kaca penutupnya, kemudian keringanginkan preparat tersebut setelah itu dilakukan fiksasi dengan cara melewatkannya di atas api spiritus, yang bertujuan untuk melekatkan biakan Bacillus subtilis tadi di atas gelas objek. Kemudian dinginkan, lalu teteskan Kristal violet secukupnya dan biarkan selama 1-2 menit. Cuci dengan air mengalir sampai sisa cat habis, kemudian keringanginkan. Kemudian amati menggunakan mikroskop dan gambarkan morfologi selnya. Pengecatan sederhana ini juga dilakukan pada Escherichia coli serta dilakukan dengan cara yang sama seperti pada Bacillus subtilis.
keringanginkan, lalu cuci dengan larutan peluntur ( gram C yaitu alkohol ) selam 30 detik kemudian cuci dengan air mengalir dan keringanginkan, lalu beri larutan cat penutup ( gram D yaitu safranin) selama 1 menit lalu cuci dengan air mengalir dan keringanginkan. Kemudian amati dengan mikroskop, dan terlihat warna ungu dari struktur bakterinya hal ini dikarenakan adanya peptidoglikan yang kokoh pada dinding selnya sehingga larutan kristal violet yang masuk ke dalam bakteri tidak dapat tercuci oleh alkohol dan menunjukan bahwa bakteri tersebut termasuk dalam kelompok bakteri gram positif. Pengecatan gram ini juga dilakukan pada bakteri Escherichia coli serta dilakukan dengan menggunakan cara yang sama yang dilakukan pada bakteri Bacillus subtilis. Pada bakteri Escherichia coli terlihat warna merah pada struktur bakterinya hal ini dikarenakan larutan kristal violet iodine yang masuk kedalam bakteri gram positif dapat tercuci oleh alkohol serta merusak lapisan lipopolisakarida sehingga sel bakterinya transparan hal ini menunjukan bahwa bakteri tersebut termasuk dalam kelompok bakteri gram negatif.
VI. KESIMPULAN
Kesimpulan yang dapat diambil dari praktikum yang telah dilakukan adalah :
1. Setelah melakukan praktikum ini diharapkan mahasiswa dapat mengetahui tujuan dari pengecatan serta dapat melakukan pengecatan terhadap mikroba
2. Pengecatan atau pewarnaan merupakan salah satu cara yang digunakan untuk mengamati sel-sel bakteri dan merupakan prosedur mewarnai mikroorganisme untuk menonjolkan struktur tertentu dari mikroorganisme.
struktur luar, apabila memungkinkan struktur dalam, dari mikroba, dan untuk melihat reaksi mikroba terhadap cat yang diberikan, sehingga sifat-sifat fisik dan kimia yang ada bisa dideteksi.
4. Tekhnik pengecatan yang dilakukan ada 2 yaitu pengecatan sederhana yang merupakan pengecatan yang dilakukan menggunakan satu macam cat saja, cat yang bisa digunakan adalah metilen blue, gentiana violet, basic fuschin atau safranin. Dan pengecatan gram yang merupakan pengecatan yang menggunakan 2 macam cat warna dan merupakan yang paling banyak digunakan dan sangat populer.
5. Tahap – tahap yang dilakukan pada pengecatan gram :
a) Pemberian cat utama (larutan kristal violet), pewarna ungu.
b) Pengintensifan warna dengan menambahkan warna larutan Mordan. c) Pencucian (dekolorisasi) dengan menggunakan alkohol / aseton.
d) Penambahan cat penutup (counter stain), yaitu dengan larunan safranin yg berwarna merah.
6. Bacillus subtilis termasuk dalam kelompok bakteri gram positif karena larutan kristal violet iodine yang masuk kedalam bakteri gram positif tidak dapat tercuci oleh alkohol dikarena adanya peptidoglikan yang kokoh pada dinding selnya sehingga bakterinya berwarna ungu.
7. Escherichia coli termasuk dalam kelompok bakteri gram negatif karena larutan kristal violet iodine yang masuk kedalam bakteri gram negatif tersebut dapat tercuci oleh alkohol dan alkohol tersebut merusak lapisan lipopolisakarida sel bakterinya transparan, dan berwarna merah setelah diberi safranin.
VII. DAFTAR PUSTAKA
Dwijoseputro, D. 2010. Dasar-dasar mikrobiologi. Jakarta: Djambatan.
Hadioetama, Mikrobiologi Dasar Dalam Praktek, Jakarta : PT Gramedia, 1990
LAPORAN RESMI
PRAKTIKUM MIKROBIOLOGI DAN VIROLOGI
P - 5
Disusun Oleh:
Nama
: Zitta Afrida
NIM
: 1308010125
Golongan
: II
Kelompok : 3 B
LABORATORIUM MIKROBIOLOGI
FAKULTAS FARMASI
UNIVERSITAS MUHAMMADIYAH PURWOKERTO
2013
P – 5
MORFOLOGI FUNGI I.TUJUAN
Setelah melakukan praktikum ini diharapkan mahasiswa dapat mengenali berbagai jenis jamur berdasarkan morfologinya.
II. ALAT DAN BAHAN
1. Pengamatan Mikroskopik Kapang A. Alat
1) Gelas objek 2) Jarum preparat 3) Gelas penutup B. Bahan
1) Biakan murni dari Aspergillus sp. ( digunakan sampel roti )
2) Biakan murni dari Rhizophus sp. ( digunakan sampel tempe )
3) Biakan murni dari Penicillium sp. ( digunakan sampel oncom )
4) Biakan murni dari Monillia sp.( tidak digunakan )
A. Alat
2) Larutan mounting medium metilen blue.
III. CARA KERJA
A. Pengamatan Mikroskopik Kapang
Bersihkan gelas benda dengan alcohol sampai bebas lemak dan debu kemudian teteskan1 tetes laktofenol pada bagian tengahnya
↓
Ambil biakan jamur dengan jarum preparat dan kemudian diletakkan pada gelas objek yang sudah ditetesi laktofenol
↓
Jika masa miselium mengumpul pisahkan dengan menggunakan dua buah jarum preparat
↓
Tutup dengan gelas penutup, hindari pembentukan gelombang udara di dalam preparat
↓
Amati di bawah mikroskop dengan perbesaran lemah (untuk jamur berukuran kecil seperti Penicillium sp. digunakan perbesaran sedang)
↓
Gambar dan beri keterangan yang lengkap
B. Pengamatan Morfologi Yeast (Khamir)
Bersihkan gelas benda dengan alcohol sampai bebas lemak dan debu kemudian teteskan1 tetes metilen blue pada bagian tengahnya
↓
Ambil biakan jamur dengan jarum preparat dan kemudian diletakkan pada gelas objek yang sudah ditetesi laktofenol
↓
Tutup dengan gelas penutup, hindari pembentukan gelombang udara di dalam preparat
Amati di bawah mikroskop dengan perbesaran lemah kemudian perbesaran sedang ↓
Gambar dan beri keterangan yang lengkap
IV. HASIL
A. Pengamatan Mikroskopik Kapang
Penicillium.sp pada oncom Aspergillus.sp pada roti
Rhizopus. sp pada tempe
B. Pengamatan Morfologi Yeast ( Khamir )
Saccharomyces sp.
Praktikum kali ini berjudul ” Morfologi Fungi “, yang bertujuan agar setelah dilakukannya praktikum mahasiswa diharapkan dapat mengenali berbagai jenis jamur berdasarkan morfologinya.
Jamur ( fungi ) merupakan kelompok mikroorganisme yang memiliki inti tidak berklorofil, memiliki spora, umumnya berkembang biak secara seksual dan aseksual, berbentuk filament, struktur somatiknya bercabang-cabang, dinding selnya terdiri dari selulosa, kitinatau kombinasi dari keduanya. Ada tiga golongan jamur, yaitu:
1. Kapang (jamur benang) adalah fungi yang memiliki sel tunggal dengan pembelahan sel melalui pertunasan (budding)
2. Khamir (yeast) adalah fungi yang berfilamen dan multiseluler. Ciri – ciri khamir antara lain bersel satu (uniseluler), tidak berfilamen, berbentuk oval atau bulat, tidak berflagela, berukuran lebih besar dari bakteri, lebar 1-5 mm, panjang 5-30 mm
3. Cendawan (mushroom) adalah fungi yang bersifat menguntungkan karena dapat digunakan sebagai bahan makanan.
Dalam mengamati kapang, ada beberapa hal yang harus diperhatikan, seperti: 1. Hifa : ada tidaknya sekat/septet, transparan atau keruh dan warna
2. Spora seksual: ada/ tidak , bentuk dan ukuran oospora, askospora dan basidiospora
3. Spora aseksual: ada/tidak, bentuk, ukuran, permukaan (halus, berduri, bergaris-garis) dan sporaniospora, konidiospora dan arthorospora (oidia)
4. Tubuh buah: bentuk, warna, ukuran dan letak sporaium, jumlah, laporan dan letak kepala konidia
5. Dasar tubuh buah: bentuk, warna dan ukuran dari kolumella, vesikula, dsb. 6. Tangkai badan buah: bentuk, pecabangan, permukaan, warna dari sporangiospra,
dsb.
7. Ada tidaknya bentuk khusus seperti stolen, rhitoid, sel kaki, apofise, klamidiospora,sklerotia dan sebagainya.
larutan mounting laktofenol, biakan murni Saccharomyces sp. pada medium Yeast extract Pepton Dextrose, dan larutan mounting medium metilen blue.
Langkah pertama yang dilakukan adalah pengamatan mikroskopik kapang. Kapang ( jamur benang ) adalah fungi yang berfilamen dan multiseluler. Tubuh kapang terbagi menjadi dua yaitu miselium yaitu kumpulan beberapa filamen ( hifa ), hiifa ada dua yaitu hifa vegetatif yang fungsinya untuk mendapatkan nutrisi dan hifa reproduktif yang fungsinya sebagai alat reproduksi serta spora. Hal pertama yang dilakukan adalah membersihkan gelas benda dengan alkohol sampai bebas lemak dan debu kemudian teteskan 1 tetes laktofenol pada bagian tengahnya, lalu ambil biakan murni dengan jarum preparat dan kemudian diletakkan pada gelas objek yang sudah diberi laktofenol. Jika masa misellium mengumpul pisahkan dengan dua buah jarum preparat, tutup dengan gelas penutup dan hindari pembentukan gelombang udara di dalam preparat karena dapat mengganggu pengamatan terhadap morfologi jamur. Kemudian amati di bawah mikroskop dengan pembesaran lemah. Untuk jamur berukuran kecil seperti Penicillium sp. menggunakan perbesaran sedang.
Langkah yang kedua yaitu pengamatan mikroskopik yeast (khamir). Khamir (yeast) adalah fungi yang memiliki sel tunggal dengan pembelahan sel melalui pertunasan (budding). Ciri-ciri khamir (yeast) yaitu bersel satu (uniseluler), tidak berfilamen, berbentuk oval atau bulat, tidak berflagela, berukuran lebih besar dari bakteri, lebar 1-5 mm, panjang 5-30 mm. Hal pertama yang dilakukan adalah membersihkan gelas benda dengan alcohol sampai bebas lemak dan debu kemudian teteskan 1 tetes metilen blue pada bagian tengahnya, ambil biakan murni Saccharomyces sp. dengan menggunakan ose tumpul kemudian diratakan pada gelas objek yang sudah diberi metilen blue. Tutup dengan gelas penutup dan hindari pembentukan gelombang udara di dalam preparat karena dapat mengganggu pengamatan terhadap morfologi yeast (khamir). Kemudian amati di bawah mikroskop dengan pembesaran lemah kemudian dengan perbesaran sedang.
VI. KESIMPULAN
1. Setelah melakukan praktikum ini diharapkan mahasiswa dapat mengenali berbagai jenis jamur berdasarkan morfologinya.
2. Jamur ( fungi ) merupakan kelompok mikroorganisme yang memiliki inti tidak berklorofil, memiliki spora, umumnya berkembang biak secara seksual dan aseksual, berbentuk filament, struktur somatiknya bercabang-cabang, dinding selnya terdiri dari selulosa, kitinatau kombinasi dari keduanya.
3. Ada tiga golongan jamur, yaitu : a) Kapang (jamur benang) b) Khamir (yeast)
c) Cendawan (mushroom)
4. Dalam praktikum ini dilakukan dua pengamatan mikroskopis, yaitu:
1. Pengamatan mikroskopis kapang : Penicillium. sp, Aspergillus. sp, dan Rhizopus. sp
2. Pengamatan mikroskopis morfologi khamir : Saccaromyces. sp
VII. DAFTAR PUSTAKA
Pratiwi, Sylvia T. 2008. Mikrobiologi Farmasi. Jakarta: Erlangga.
Syamsuri, Istamar. 2004. Biologi. Erlangga : Jakarta
LAPORAN RESMI
SKRINING PRIMER UNTUK MENDAPATKAN
MIKROBA RESISTEN ANTIBIOTIK
Disusun Oleh:
Nama
: Zitta Afrida
NIM
: 1308010125
Golongan
: II
Kelompok : 3 B
LABORATORIUM MIKROBIOLOGI
FAKULTAS FARMASI
UNIVERSITAS MUHAMMADIYAH PURWOKERTO
2013
P – 6
SKRINING PRIMER UNTUK MENDAPATKAN MIKROBA RESISTEN ANTIBIOTIK
I.TUJUAN
1. Melakukan berbagai teknik mikrobiologi dalam skrining (menanam, mengisolasi, dan memurnikan biakan, melakukan tes terhadap kemampuan biakan terhadap antibiotik). 2. Mendapatkan mikroorganisme yang resisten terhadap antibiotik.
II. ALAT DAN BAHAN
1) Media selektif ( Czapex dox dan antibiotik ) 2) Larutan salin ( NaCL 0,9 % )
3) Labu erlenmeyer 50 cc untuk wadah mensterilkan media B. Bahan
1) Media pertumbuhan ( Czapex dox )
3. Tahap III A. Alat
1) Cawan petri 2) Jangka sorong
3) Erlenmeyer 50 cc untuk wadah sterilisasi 4) Paper disk
B. Bahan
1) Media nutrien agar
III. CARA KERJA
A. Tahap I
Suspensikan 1 gram sampel tanah dengan 10 ml larutan salin dalam tabung steril ↓
Encerkan hingga konsentrasi 10‾5
↓
Tuangkan 0,5 ml suspensi tersebut dalam cawan petri steril yang telah dituangi media selektif padat
↓
Ratakan dengan spreader ↓
Diinkubasikan pada suhu kamar sampai praktikum selanjutnya
B. Tahap II
Pilih salah satu koloni yang dominan dan ambil dengan menggunakan ose, tanam dalam media pertumbuhan ( pada praktikum yang dilakukan menggunakan agar
darah ) ↓
Diinkubasikan pada suhu kamar sampai praktikum selanjutnya C. Tahap III
Siapkan dan sterilisasikan 10 ml media dalam erlenmeyer ↓
Tuangkan dalam cawan petri, dan ditunggu sampai membeku ↓
Pasang paper disk di atas permukaan agar ↓
Tetesi dengan 10 µl antibiotik menggunakan mikropipet ↓
Diinkubasi pada suhu 37⁰C selama 18-24 jam ↓
Ukur diameter hambatan untuk masing-masing antibiotik dengan mikroba uji ↓
Hasil diinterpretasikandengan antibiogram
IV. HASIL
B. Tahap II
C. Tahap III
Hasil perhitungan tahap 3
Penicillium = D1 = 7,9 mm
D2 = 8 mm
D3 = 7,9 mm
D4 = 7,9 mm
D = 31,7
4
= 7,925
Diameter total = 7, 925 – 6
= 1, 925
Vancomicin = D1 = 6,5 mm
D2 = 6,6 mm
D3 = 6,5 mm
D4 = 6,6 mm
D = 26, 2
4
= 6,5
Diameter total = 65 – 5
= 0, 5 mm
Sampel tanah yang terdapat bakteri,bakteri tersebut resisten terhadap vancomycin karena kurang dari 9
Praktikum kali ini berjudul ” Skrining Primer Untuk Mendapatkan Mikroba Resisten Antibiotik “, yang bertujuan agar setelah dilakukannya praktikum mahasiswa diharapkan dapat melakukan berbagai teknik mikrobiologi dalam skrining (menanam, mengisolasi, dan memurnikan biakan, melakukan tes terhadap kemampuan biakan terhadap antibiotik), serta mendapatkan mikroorganisme yang resisten terhadap antibiotik.
Skrining digunakan untuk menemukan mikroorganisme penghasil antibiotik, sampel yang digunakan dapat berasal dari berbagai sumber termasuk tanah dari berbagai tempat diuji kemampuan potensialnya dalam menghasilkan antibiotik. Proses penapisan ini terdiri dari dua tahap yaitu skrining primer dan skrining sekunder.
Tahap skrining primer meliputi : 1) Mencari sumber penghasil
2) Menumbuhkan mikroorganisme yang didapat 3) Mengisolasi dan mengoleksi mikroorganisme
3) Identifikasi mikroorganisme ( secara morfologi, kimiawi, ataupun genetik, media, dll).
4) Identifikasi substansi
Pada praktikum kali ini digunakan skrining primer.
resisten untuk keperluan penemuan mekanisme resistensi sehingga dapat ditelusuri mekanisme pencegahan dan penanggulangan resisten. Jika obat digunakan dengan dosis yang terlalu rendah, atau waktu terapi kurang lama, maka hal ini dapat menyebabkan terjadinya resistensi artinya bakteri tidak peka lagi terhadap obat yang bersangkutan
Alat - alat yang digunakan pada praktikum ini antara lain cawan petri yang digunakan untuk tempat media, tabung reaksi yang digunakan untuk tempat mencampurkan bakteri dan bahan yang lain, mikropipet dan yellow tip yang digunakan untuk membantu meneteskan suspense antibiotik ke dalam paper disk, ose tumpul yang digunakan untuk mengambil koloni pada hasil praktikum mikroskopik kapang, labu erlenmeyer yang digunakan untuk wadah mensterilkan media, jangka sorong yang digunakan untuk mengukur diameter daerah hambatan yang terbentuk du sekitar paper disk. Sementara bahan – bahan yang digunakan antara lain media selektif ( Czapec dox dan antibiotik ), larutan salin ( NaCL 0,9 % ), sampel tanah, medium nutrien agar, kultur E. coli dan B. subtilis dalam media nutrien cair berumur 24 jam, serta antibiotik.
Pada praktikum kali ini dilakukan 3 tahap, pertama dilakukan tahap pertama yang dilakukan dengan cara pertama mensuspensikan 1 gram sampel yang diambil dari tanah dengan kedalaman 30 cm dari permukaan dengan 10 ml larutan salin dalam tabung steril (larutan A), kemudian ambil 1 ml larutan A dan tambahkan dengan 9 ml aquadest (replikasi 1), ambil 1 ml larutan replikasi 1 dan tambahkan dengan 9 ml aquadest (replikasi 2), tuangkan ke dalam dua cawan petri masing-masing sama rata, tambahkan 10 µl antibotik ( penicilin ) dan medium selektif Czapec dox ke dalam masing-masing cawan petri tersebut, kemudian ratakan dengan cara menggojognya dengan arah membentuk angka delapan hingga homogen, bungkus cawan petri tersebut dengan menggunakan kertas dan inkubasi pada suhu kamar selama 1 minggu, inkubasi tidak dilakukan pada suhu 37⁰C melainkan pada suhu kamar hal ini dilakukan dengan tujuan untuk menghambat pertumbuhan dari bakteri dalam sampel tanah tersebut.
Pada tahap kedua digunakan medium nutrien agar darah yang berfungsi untuk membedakan bakteri berdasarkan sifatnya bisa atau tidaknya bakteri tersebut menghemolisis darah, membunuh bakteri heterotrof, serta menumbuhkan bakteri Neiserria dan Streptococcus. Yang dapat dibagi menjadi tiga golongan yaitu :
1. Alpha hemolisis, bakteri yang tergolong Alpha hemolitik adalah bakteri yang memiliki kemampuan parsial menghemolisis media agar darah dan mengekspresikan zona kehijauan di sekitar koloni. Contoh bakterinya adalah S. salivarius, S. constellatus dan lain- lain.
2. Beta hemolisis, bakteri beta hemolitik adalah bakteri yang mengekspresikan zona bening di sekitar koloni. Beta hemolisis juga merupakan lisis lengkap sel darah merah dan hemoglobin, darah secara lengkap digunakan oleh mikroba sehingga media yang ada koloninya menjadi tidak berwarna. Contoh bakterinya adalah S. agalactiae, Streptococcus parauberis dan lain- lain.
3. Gamma hemolisis ( non hemolitik ), adalah bakteri yang tidak mampu melisis darah pada media agar, bakteri non hemolitik lebih bersifat virulen dibandingkan beta hemolitik, dan pada gamma hemolisis tidak terjadi perubahan warna pada medium darhnya dan tetap berwarna merah. Contohnya Enterococcus, E. faecalls, dan E. faecium.
Tahap terakhir yang dilakukan adalah tahap tiga dan dilakukan dengan cara menyiapkan dan mensterilkan 10 ml media dalam erlenmeyer, kemudian setelah agak dingin campurkan dengan suspensi isolat bakteri dan homogenkan. Setelah itu tuangkan dalam cawan petri tunggu hingga dingin dan membeku. Setelah itu pasang paper disk ( dipasangi dua paper disk penicillin dan vancomycin ), kemudian diinkubasikan pada suhu 370 C selama 18 – 24 jam, setelah diinkubasikan ukur diameter hambatannya
menggunakan jangka sorong untuk masing – masing antibiotik dengan mikroba uji dan kemudian interpretasikan hasil dengan antibiogram.
VI. KESIMPULAN
Kesimpulan yang dapat diambil dari praktikum yang telah dilakukan adalah :
1. Setelah melakukan praktikum ini diharapkan mahasiswa dapat :
b) Melakukan perhitungan jumlah mikroba yang ada pada suatu bahan.
2. Antibiotik merupakan substansi yang dalam jumlah kecil dapat menghambat pertumbuhan atau membunuh mikroba.
3. Isolasi bakteri resisten antibiotik dilakukan sebagai upaya untuk menyediakan bakteri resisten untuk keperluan penemuan mekanisme resistensi sehingga dapat ditelusuri mekanisme pencegahan dan penanggulangan resisten.
4. Sampel yang digunakan yaitu sampel tanah yang tidak terjamah oleh manusia, misal dari hutan, pinggir sungai, daratan rendah dan sebagainya yang diambil pada kedalaman ± 30 cm dari permukaan tanah guna untuk mengurangi kontaminasi serta diambil seaseptis mungkin.
5. Pada tahap dua medium yang digunakan adalah medium nutrien agar darah dan tidak didapatkan bakteri yang menghemolisis darah.
6. Pada paper diks penicillium didapat diameter total zona hambat sebesar 1, 925 mm yang menunjukan bahwa sampel tanah resisten terhadap antibiotik penicillium karena zona hambat kurang dari 20 mm sehingga resisten. Sementara pada paper disk vancomycin didapat diameter total zona hambat sebesar 0, 5 mm yang menunjukan bahwa sampel tanah yang terdapat bakteri,bakteri tersebut resisten terhadap vancomycin karena kurang dari 9.
VII. DAFTAR PUSTAKA
Michael Pelczar, dkk. 2008. Dasar – Dasar Mikrobiologi, Jakarta : Penerbit Universitas Indonesia.
Pratiwi, Sylvia T. 2008. Mikrobiologi Farmasi. Jakarta: Erlangga.
LAPORAN RESMI
PRAKTIKUM MIKROBIOLOGI DAN VIROLOGI
P - 7
Disusun Oleh:
Nama
: Zitta Afrida
NIM
: 1308010125
Golongan
: II
Kelompok : 3 B
LABORATORIUM MIKROBIOLOGI
FAKULTAS FARMASI
UNIVERSITAS MUHAMMADIYAH PURWOKERTO
2013
P – 7
UJI SESITIFITAS MIKROBA TERHADAP ANTIBIOTIK ( METODE KIRBY BAUER )
I.TUJUAN
Setelah melakukan praktikum ini diharapkan mahasiswa dapat :
1. Melakukan uji sensitifitas terhadap antibiotik dengan metode Kirby Bauer.
II. ALAT DAN BAHAN
A. Alat
1) Cawan petri 2) Jangka sorong 3) Gelas ukur 10 ml
4) Paper disk
5) Erlenmeyer 50 ccuntuk wadah sterilisasi media 6) Pinset
7) Pipet dan pro pipet
B. Bahan
1) Medium nutrien agar
2) Sampel bahan yang akan ditentukan kadarnya
3) Antibiotik
III. CARA KERJA
Media yang telah disterilkan dicairkan dan ditunggu sampai suhunya kurang lebih 40⁰C, dicampurkan suspense bakteri uji
↓
Tuangkan ke cawan petri steril masing-masing 10 ml dan ditunggu sampai membeku ↓
Pasang paper disk di atas permukaan medium yang telah membeku ↓
Diinkubasikan selama 24 jam pada suhu 37⁰C ↓
Ukur diameter hambatan masing-masing antibiotik dengan mikroba uji ↓
Interpretasikan hasil dengan antibiogram
VI. HASIL
Hasil yang didapat oleh kelompok lain dengan bakteri E. coli
Zona hambat
Bakteri S. aureus
Vancomisin = D1 = 10, 4 mm
D2 = 9, 65 mm
D3 = 9, 2 mm
D4 = 10, 1 mm
D = 10, 4 + 9, 65 + 9, 2 + 10, 1
4
= 39, 35
4
= 9, 83 mm
= 9, 83 – 6
= 3, 83
Penicillin tidak ada zona hambat ( resisten )
Kesimpulan bakteri
Bakteri E. coli
D2 = 33, 5 mm
D3 = 34 mm
D4 = 34 mm
D = 133, 5
4
= 33, 375 – 6
= 27, 375 mm
Penicillin tidak ada zona hambat ( resisten )
V. PEMBAHASAN
Praktikum kali ini berjudul ” Uji Sensitifitas Terhadap Antibiotik ( Metode Kirby Bauer ) “, yang bertujuan agar setelah dilakukannya praktikum mahasiswa diharapkan dapat melakukan uji sensitifitas terhadap antibiotik dengan metode Kirby Bauer, serta menentukan mikroba uji termasuk sensitif atau resisten terhadap antibiotik yang diujikan.
Mekanisme kerja antibiotik 1. Penghambatan sintesis dinding sel
2. Antibiotik yang memiliki mekanisme penghambatan sintesis dinding sel: 3. Perusakan membran plasma
4. Penghambatan sintesis protein 5. Penghambatan sintesis asam nukleat 6. Penghambatan sintesis metabolit esensial
Saat ini banyak digunakan antibiotik untuk mengobati penyakit yang ditimbulkan oleh mikroba patogen. Antibiotik yang digunakan dalam medis bertujuan untuk menghilangkan infeksi oleh mikroba atau mencegah penyebaran infeksi. Antibiotik harus mampu menghambat atau membunuh mikroba penyebab infeksi tetapi tidak toksis terhadap inangnya. Penentuan antibiotik yang cocok untuk mengobati infeksi tertentu sangat penting dalam klinik. Penggunaan antibiotik yang tidak efektif melawan mikroba patogen merupakan tindakan yang tidak baik.
Metode Kirby Bauer adalah metode yang digunakan untuk mengetahui sensitifitas suatu mikroba terhadap antibiotik tertentu. Diameterhambatan pertumbuhan mikroba oleh antibiotik diukur dan diinterpretasikan dengan menggunakan antibiogram.
Antibiotik dibagi menjadi dua golongan yaitu antibiotik berspektrum sempit yang merupakan antibiotik yang hanya mampu menghambat satu golongan bakteri saja, contohnya hanya mampu menghambat atau membunuh bakteri Gram posotif atau Gram negatif saja, contoh obatnya antara lain gentamisin, streptomisin, klindamisin dll. Dan yang kedua adalah antibiotik berspektrum luas yang merupakan antibiotik yang dapat menghambat atau membunuh bakteri dari golongan Gram positif maupun Gram negatif, contoh antibiotik golongan ini antara lain sefalosporin, neomisin, eritromisin dll.
Kelebihan metode Kirby Bauer :
1) Metode ini mudah dilakukan karena tidak rumit dalam pengerjaannya dan efisien karena dalam satu pembenihan agar dapat menguji maksimal 12 macam antibiotik.
2) Tidak membutuhkan alat dan bahan yang banyak.