y
x
z 2s
y y
y
x x x
z z
z
2px 2py 2pz
BAB I
IKATAN KIMIA DAN STRUKTUR MOLEKUL
1. Pendahuluan 1.1. Deskripsi
Bab pertama ini membahas tentang ikatan kimia, struktur molekul dan bentuk molekul senyawa organik dan kaitannya dengan sifat-sifat fisikanya, dengan menggunakan dasar konfigurasi elektron dan struktur Lewis.
1.2. Manfaat/ Relevansi
Mengingat akan kesukaran-kesukaran yang dialami oleh mahasiswa-mahasiswa dalam menuliskan rumus struktur serta memahami sifat-sifat fisika senyawa organik, maka diperlukan pemahaman tentang ikatan kimia dan struktur molekul.
1.3. Tujuan Instruksional Khusus (TIK)
Setelah membaca bab I ini, mahasiswa mampu menjelaskan ikatan kimia, struktur molekul dan bentuk molekul senyawa organik dan kaitannya dengan sifat fisikanya.
1.4. Petunjuk Mempelajari
a. Baca dan pahami semua yang ada dalam bab ini dengan teliti.
b. Tingkatkan pemahaman dengan menambah bahan bacaan lain yang relevan.
c. Diskusi dengan teman untuk meningkatkan pemahaman.
d. Berlatih dengan tekun untuk meningkatkan pemahaman.
e. Jika ada kesulitan, bertanya kepada dosen atau narasumber lain yang relevan.
2. Penyajian
2.1. Konfigurasi Elektron dan Struktur Lewis
Unsur-unsur penting dalam kimia organik adalah karbon, hidrogen, oksigen dan nitrogen dengan nomor atom masing-masing adalah 6,1,8 dan 7. Nomor atom menunjukkan banyaknya elektron yang dimiliki atom.
Kita tidak dapat menentukan dengan tepat posisi relatif elektron terhadap inti atom. Untuk menggambarkan posisi yang paling mungkin dari setiap elektron, digunakan teori kuantum. Tiap kulit elektron suatu atom dibagi menjadi orbital atom; orbital atom adalah bagian dari ruang dimana kebolehjadian ditemukannya elektron dengan tingkat energi tertentu tinggi (90-95%).
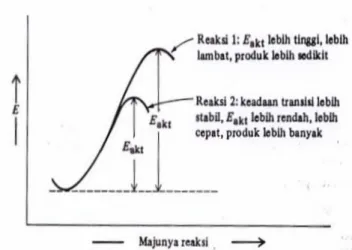
Pada tingkat energi n = 1 hanya mengandung orbital 1s yang berbentuk bulat, kebolehjadian untuk untuk menemukan elektron 1s tertinggi dalam bulatan ini. Pada tingkat energi n = 2 mengandung 1 orbital 2s dan 3 orbital 2p (2px, 2py dan 2pz). Ketiga orbital 2p mempunyai bentuk dan jarak dari inti serta energi yang sama, disebut orbital terdegenerasi. (Gambar 1.1)
Gambar 1.1 Bentuk orbital s dan p, inti berada pada sumbu koordinat
Suatu pemerian mengenai struktur elektron dari atom disebut konfigurasi elektron.
Konfigurasi elektron untuk atom H adalah 1s1, yang berarti satu elektron dalam orbital 1s.
Konfigurasi elektron atom C adalah:
2p2
n = 2 2s2 E n = 1 1s2
H. + H. H H: ...
Cl.. : .. .
:Cl.. + ..
..: Cl :Cl:
..
..
H H
H H ..
..
: :C C..
..
+ 4H.
H H: ..
.. : Cl :Cl:
..
.. .H
C C: ..:. ... . H H H
H C H O:: : :
.. ..
N N......
: : H: ...... :H
C C Soal Latihan 1.1
Tuliskan konfigurasi elektron atom 8O dan 7N.
2.2 Pengantar ke Ikatan Kimia
Karena struktur elektron berbeda-beda, maka atom-atom terikat membentuk molekul dengan berbagai cara. Pada tahun 1916, G.N. Lewis dan W. Kossel mengenalkan teori berikut:
1. Ikatan ion dihasilkan dari perpindahan elektron dari satu atom ke atom lain
2. Ikatan kovalen dihasilkan oleh penggunaan bersama sepasang elektron oleh dua atom.
3. Atom memindahkan atau membuat pasangan elektron untuk mencapai konfigurasi gas mulia (oktet).
Ikatan ion terbentuk oleh pemindahan elektron. Satu atom memberikan satu atau lebih elektron terluarnya ke atom lain. Atom yang kehilangan elektron menjadi ion positif atau kation. Atom yang mendapat elektron menjadi ion negatif atau anion. Ikatan ion terjadi dari tarikan elektrostatik antara ion-ion yang berlawanan muatan.
Contoh: pembentukan molekul NaCl dari atom Na dan Cl
Satu elektron dipindahkan dari Na ke Cl
Sekarang tiap atom mempunyai oktet lengkap
dalam kulit terluar (kulit terluar Na+ tidak ditunjukkan)
Ikatan Kovalen terbentuk oleh penggunaan bersama sepasang elektron antara dua atom. Berikut ini adalah contoh pembentukan molekul H2, Cl2 dan CH4.
Penggunaan bersama sepasang elektron antara dua atom disebut ikatan tunggal. Apabila dua atom membagi 2 pasang atau tiga pasang elektron; ikatannya disebut ikatan rangkap dan ikatan ganda tiga.
ikatan tunggal ikatan rangkap ikatan ganda tiga
Kapan atom membentuk ikatan ion dan kapan membentuk ikatan kovalen?
Ikatan ion terbentuk bila perbedaan keelektronegatifan antara dua atom lebih besar 1,7. Misal: antara atom Na (0,9) dan Cl (3,0). Sedangkan apabila beda keelektronegatifan nol (mis: antara C dengan C) atau kecil misal: antara atom C (2,5) dan H (2) maka terbentuk ikatan kovalen. [Lihat Tabel 1.1.]
2.2.1 Keelektronegatifan
Keelektronegatifan adalah ukuran kemampuan atom untuk menarik elektron luarnya atau elektron valensi. Oleh karena elektron terluar digunakan untuk ikatan, maka keelektronegatifan berguna dalam meramalkan dan menerangkan kereaktifan kimia.
Keelektronegatifan dipengaruhi oleh jumlah proton dalam inti dan jumlah kulit yang mengandung elektron. Makin banyak jumlah proton, maka makin besar muatan positif dengan demikian tarikan untuk elektron ikatan bertambah. Makin banyak kulit maka makin jauh jarak inti ke elektron terluar, sehingga tarikan inti makin lemah.
Ukuran keelektronegatifan dinyatakan dalam skala numerik yaitu Skala Pauling.
Suatu unsur yang memiliki keelektronegatifan sangat rendah (misal: Li) disebut unsur elektropositif; sedangkan yang memiliki keelektronegatifan sangat tinggi disebut unsur elektronegatif (misal: Cl).
Na.
+ ..
:Cl:.. -
Na+ atau Na Cl+ - Cl..:
...
H H
H H ..
C..
C. . : : ..
+ 4H.
. :
.C. . + 4 Cl:..
... : ..Cl.. C
Cl.. : Cl.. :..
..
Cl.. : ..
: : Tabel. 1.1 Keelektronegatifan beberapa atom
H 2,1
Li 1,0
Be 1,5
B 2,0
C 2,5
N 3,0
O 3,5
F 4,0 Na
0,9
Mg 1,2
Al 1,5
Si 1,8
P 2,1
S 2,5
Cl 3,0 Br 2,8 I 2,5
Catatan. Perhatikan atom C, N, O, F, no atom (=jumlah proton) makin banyak tetapi jumlah kulit sama (=2).
2.2.2 Banyaknya Ikatan Kovalen
Banyaknya ikatan kovalen yang dibentuk oleh sebuah atom tergantung pada banyaknya elektron tambahan yang diperlukan agar atom tersebut mencapai konfigurasi gas mulia.
Misalnya :
Atom netral hidrogen memerlukan satu elektron lagi untuk mencapai konfigurasi elektron helium, oleh karena itu hidrogen membentuk satu ikatan kovalen.
Atom netral klor memiliki 7 elektron pada kulit terluarnya, maka memerlukan satu elektron untuk mencapai konfigurasi argon; oleh karenanya atom klor membentuk 1 ikatan kovalen.
Karbon netral memiliki 4 elektron valensi, sehingga memerlukan 4 elektron untuk mencapai konfigurasi neon; maka karbon membentk 4 ikatan kovalen.
membentuk 4 membentuk 1 ikatan kovalen ikatan kovalen
membentuk 4 membentuk 1 ikatan kovalen ikatan kovalen
Contoh soal
Tulislah struktur Lewis untuk H2O dan klorometana (CH3Cl) Penyelesaian
1. Tentukan jumlah elektron valensi setiap atom: H = 1, C = 4, O = 6, Cl = 7
2. Gambarkan kerangka molekul, dengan mengingat bahwa H dan Cl hanya membentuk 1 ikatan kovalen, O membentuk 2 dan C membentuk 4.
3. Distribusikan elektron valensi sehingga setiap H mempunyai 2 elektron dan setiap atom lain mempunyai oktet.
Soal Latihan 1.2.
Gambarkan struktur titik elektron (struktur Lewis) untuk CO2, C2HF dan CCl2F2. 2.3 Muatan Formal
Sejauh ini kita hanya melihat molekul yang atomnya netral. Dalam beberapa senyawa, satu atau lebih atomnya dapat bermuatan positif maupun negatif. Karena muatan ini mempengaruhi reaksi
H O H..
:.. : H C Cl H H ..
..
..
:..: : H H H C Cl H O H
C N..
N..
N: O..
..
..
X.. : ..: O
C+
B- B
..- C ..- N..
N+
O..+ O..+
:X..: .. - .. - O:..
X..+
..
..: O O..+
..- O:..
O....
H O H + H+ H O H H ..
..
..
+
ion hidronium
kimia molekul tersebut, perlu diketahui dimana lokasi muatannya. Sebagai contoh ion hidronium, H3O+, yaitu produk reaksi satu molekul air dengan satu proton.
Struktur ini memiliki 8 elektron di sekitar oksigen dan dua elektron di sekitar setiap hidrogen supaya semua kulit valensinya lengkap. Perhatikan bahwa semua ada 8 elektron valensi. Oksigen menyumbang enam, dan setiap hidrogen menyumbang satu, sehingga totalnya mestinya adalah sembilan elektron; tetapi ion mempunyai satu muatan positif, sehingga satu elektron mestinya telah dilepaskan, sisanya adalah delapan elektron. Enam dari delapan elektron digunakan untuk membentuk tiga ikatan tunggal O-H, menyisakan sepasang elektron bebas pada oksigen.
Ion hidronium membawa muatan positif. Pertanyaan yang timbul adalah: atom mana dalam pengertian formal yang membawa muatan itu? Untuk menentukan muatan formal kita gunakan persamaan berikut untuk tiap atom dalam suatu struktur.
Muatan formal : (banyaknya e- valensi dalam sebuah atom netral) - ½ (banyaknya e- terbagi/elektron ikatan)
- (banyaknya e- valensi menyendiri/elektron bebas) Apabila diterapkan untuk ion hidronium, maka:
Atom Banyaknya e- valensi atom
netral
½ banyaknya e- ikatan
banyaknya e- bebas jumlah
tiap atom H 1 1 0 0
O 6 3 2 +1
jumlah muatan formal H3O +1 Jadi atom oksigen yang membawa muatan formal +1 dalam ion hidronium.
Dalam molekul netral jumlah muatan formal harus saling meniadakan atau berjumlah nol.
Apabila jumlah muatan suatu struktur tidak sama dengan nol, maka struktur tersebut adalah ion.
Jumlah muatan formal menyatakan muatan ion.
Ada satu cara yang lebih mudah untuk menetukan muatan formal, yaitu dengan membandingkan dengan atom yang sama yang mempunyai muatan formal = 0. Misalnya atom oksigen, muatan formalnya = 0 bila membentuk 2 ikatan kovalen dengan atom lain atau . Bila hanya membentuk 1 Ikatan kovalen dalam suatu molekul atau ion maka muatan formalnya -1 dan bila membentuk 3 buah ikatan kovalen maka muatan formalnya +1. Muatan formal beberapa atom dan ion disajikan pada Tabel 1.
Tabel 1.2 Muatan Formal beberapa Atom dan Ion
Muatan Formal No. Atom Golongan
0 +1 -1
B : 5 3
C : 6 4
N : 7 5
O : 8 6
X : (F, Cl, Br, I) 7
H H H
H H-C-C-OH H-C-C-H
H H H H
H CH3 C OH
CH3 (CH3)2CHOH adalah sama dengan
(CH3)3CCl adalah sama dengan
CH3 CH3 C Cl
CH3
CH3CH CH2 adalah sama dengan
C C H C H
H H
H H CH3C CH adalah sama dengan
H
H C C C H H
O
CH3CCH2CH3 adalah sama dengan
H
H C C C C H
H O H H
H H -
..
O.. :
: H
Contoh soal
Pada atom mana terdapat muatan formal dalam ion hidroksida (OH-)?
Penyelesaian
Rumus Lewis ion OH- adalah
Oksigen memiliki 6 elektron valensi, ada 6 elektron bebas dan 2 elektron ikatan. Muatan formal oksigen adalah 6 - (6+1) = -1. Jadi oksigen membawa muatan formal -1. Hidrogen bermuatan netral.
Soal Latihan 1.3.
Hitung muatan formal pada setiap atom dalam senyawa berikut ini:
a. amonia (NH3) c. ion amonium (NH4)+ d. ion nitronium (NO2)+
2.4 Rumus dalam Kimia Organik
Rumus struktur menunjukkan struktur dari molekul. Rumus Lewis adalah salah satu jenis rumus struktur, dimana setiap pasangan elektron yang dibagi digambarkan dengan suatu garis. Bila pasangan elektron valensi menyendiri (pasangan elektron bebas juga ditunjukkan, rumus demikian disebut rumus struktur lengkap).
Dalam rumus struktur termampatkan, ikatan tidak ditunjukkan, atom yang sama jenisnya yang terikat pada atom yang sama digabungkan menjadi satu.
CH3CH3 adalah rumus struktur termampatkan untuk
CH3CH2OH adalah rumus struktur termampatkan untuk
Bila molekul mempunyai dua atau lebih gugus atom yang identik, rumus struktur dapat dimanfaatkan lebih jauh, dengan cara menggunakan tanda kurung untuk gugus atom yang mengulang. Suskrip yang mengikuti kurung ke dua menyatakan berapa kali banyaknya seluruh gugus ditemukan pada kedudukan tersebut dalam molekul. Contoh:
Ikatan rangkap atau ganda tiga digunakan dalam rumus struktur termampatkan. Contoh:
Struktur tersingkat adalah penggunaan garis yang menyatakan kerangka karbon.
n-pentana isopentana neopentana
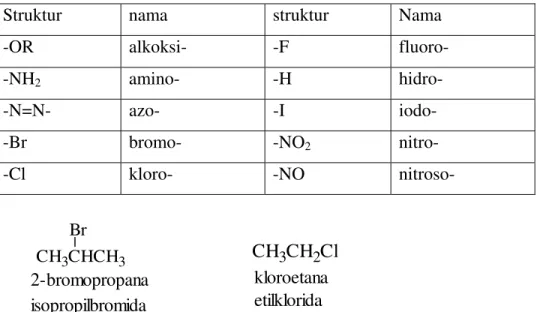
CH3CHCH2Cl CH3 a.
Cl CH3CHCl
b. c. CH3CH2CH2CH2CHCH2Cl Cl
C C CH3 CH3 CH3
CH3 d.
H H H. + H.
H OH H + OH ..
. .
..H Cl Cl.. :
...
H. +
:Z
C C. + .Z
radikal bebas homolitik
H H
H H C
H-H N N
Soal Latihan 1.4.
Untuk setiap rumus ini, tuliskan rumus yang lebih dimampatkan
Soal latihan 1. 5
Tuliskan rumus struktur lengkap untuk senyawa berikut ini (tunjukkan semua ikatan dengan garis dan pasangan elektron bebas jika ada).
a. CH3CCl2 b. (CH3)2C=C(CH2CH3)2
2.5. Pemutusan (disosiasi) Ikatan
Ada dua cara agar ikatan terdisosiasi yaitu secara homolitik dan hetrolitik.
1. Pemutusan heterolitik yaitu apabila kedua elektron dipertahankan pada satu atom. Hasilnya adalah sepasang ion. Contoh:
2. Pemutusan homolitik yaitu jika tiap atom yang turut dalam ikatan kovalen menerima satu elektron. Hasilnya adalah radikal bebas (gugus yang mempunyai elektron tidak berpasangan).
Radikal bebas secara listrik netral dan sangat reaktif. Contoh:
Panah lengkung dengan kepala lengkap ( ) digunakan untuk menunjukkan arah pergeseran sepasang elektron, sedangkan panah lengkung dengan separo kepala panah ( ) disebut kait ikan (mata kail) menunjukkan arah pergeseran satu elektron.
2.6. Molekul Polar dan Non Polar
Atom dengan bilangan keelektronegatifan yang sama atau hampir sama, bila bergabung membentuk molekul kedua atom mempunyai tarikan yang sama atau hampir sama terhadap elektron ikatan. Jenis ikatan kovalen ini disebut ikatan kovalen non polar.
H H H + H+ :_
H Cl + -
Cl: :..
H + ..
H OH H + OH+ - :.. ..
C:Z
: Z C
:Z C +
_ +
+ _
+ karbokation
karbanion heterolitik
C O
CH3 H
3 H CH
O C C 3
O C O
µ= 0 µ µ
H H O
= 1,83 D
C Cl
Cl Cl Cl
= 0
Semakin elektronegatif suatu atom, semakin besar tarikan terhadap elektron ikatan. Bila dua atom yang berbeda bergabung, tetapi tarikannya tidak cukup untuk memecahkannya menjadi ion, hasilnya adalah ikatan kovalen polar. Ikatan kovalen polar adalah suatu ikatan dengan distribusi rapat elektron yang tidak merata. Distribusi elektron dalam ikatan polar dilambangkan dengan muatan parsial positif (δ+) dan negatif (δ-) atau dengan panah bersilang ( ) yang mengarah dari ujung yang parial positif ke ujung yang parsial negatif.
2.6.1 Momen Ikatan
Momen Ikatan (satuan Debye (D) merupakan ukuran kepolaran ikatan, dihitung dari muatan, e (satuan elektrostatik) x jarak antara muatan (d) (dalam Ao). Besarnya momen ikatan beberapa ikatan tertera pada Tabel 1.3.
Tabel 1.3. Momen ikatan beberapa ikatan kovalen ikatan momen
ikatan (D)
ikatan Momen ikatan (D)
H – C 0,4 C - Cl 1,46
H – N 1,31 C – Br 1,38
H – O 1,51 C - I 1,19
C - N 0,22 C = O 2,3
C - O 0,74 C ≡ N 3,5
C - F 1,41 Soal Latihan 1.6
Gunakan panah bersilang dan muatan parsial untuk menunjukkan arah momen ikatan senyawa berikut.
a. H3C-NH2 b. H3C-OH c. H3CO-H 2.6.2 Momen Dipol
Momen dipol (µ) adalah jumlah vektor momen ikatan dalam molekul. Karena penjumlahan vektor bergantung pada besar dan arah momen ikatan. Maka momen dipol merupakan ukuran kepolaran molekul. Momen dipol beberapa senyawa organik disajikan pada Tabel 1.4. Perhatikan bahwa momen dipol CCl4 adalah nol meskipun setiap ikatan C-Cl mempunyai momen ikatan 1,46D;
hal ini disebabkan molekul CCl4 simetris; jadi momen ikatan saling meniadakan. Demikian pula molekul CO2. Namun molekul air momen ikatannya tidak saling meniadakan, maka dideduksi/diduga molekul air tidak simetris.
Tabel 1.4. Momen Dipol Beberapa Senyawa
Senyawa Momen Dipol (D) Senyawa Momen Dipol (D)
H2O 1,84 CH3OCH3 1,3
NH3 1,46
CH3Cl 1,86
2,7
CCl4 0
CO2 0
2,8 H Cl
δ+ δ−
atau H Cl
δ+
δ−
CH3 CH3
O O
CH3
CH3
δ+ atau
CH2
2
CH
2
CH
CH 2
2
CH
CH
2
CH
CH3
CH3
CH3
CH3
n-pentana t.d. 36 oC
CH3
CH3
CH3
CH3 CH3
CH3
CH3 CH3 C C
neopentana t.d. 9,5o
C
..: H
H O .. :
H H O
δ− δ+
CH O3
H
..: δ+
H O H ..: C 3
δ−
ikatan hidrogen
Soal latihan 1.7
Dengan memperhatikan tabel momen ikatan (Tabel 1.3.), hitunglah momen dipol molekul H2O.
2.7 Gaya Tarik Antar Molekul 27.1 Interaksi dipol-dipol
Molekul saling tarik menarik antar muatan yang berlainan dan tolak menolak antar muatan yang sama; tarik menarik dan tolak menolak ini akibat adanya antaraksi dipol.
Bagaimana jika molekulnya non polar? Molekul non polar saling ditarik oleh interaksi dipol-dipol lemah yang disebut gaya London. Gaya London timbul dari dipol yang diinduksi dalam satu molekul oleh molekul lain. Gambar 1.2 memperlihatkan bagaimana dipol teriduksi dapat terjadi.
Gambar 1.2 Molekul non polar dapat saling menginduksi
Interaksi berbagai dipol secara kolektif disebut gaya van der Waals. Jarak antar molekul mempengaruhi kekuatan gaya van der Waals. Bila jarak antara dua molekul besar, maka gaya tarik antar kedua molekul berkurang.
Molekul rantai lurus mempunyai jarak lebih dekat dari pada molekul bercabang sehingga gaya van der Waals lebih kuat, hal ini menyebabkan molekul rantai lurus mempunyai titik didihnya lebih tinggi dari pada molekul rantai bercabang. Contoh : molekul n-pentana dan neopentana
2.7.2 Ikatan Hidrogen
Jenis intaraksi dipol yang kuat terjadi antara molekul yang mengandung atom hidrogen yang terikat pada atom nitrogen, oksigen atau fluor. N, O dan F adalah atom yang sangat elektronegatif dan mempunyai pasangan elektron menyendiri.
Senyawa yang khas mengandung ikatan NH, OH atau FH adalah:
H O
H
..: ..
: H H O
C 3 H N
H H
.. ..
H H N H
C 3 H F..
..:
Ikatan hidrogen terbentuk antara atom hidrogen yang parsial positif dari suatu molekul dengan pasangan elektron menyendiri (bebas) dari atom suatu molekul yang elektronegatif (N, O, F).
Kekuatan ikatan hidrogen tidak sama. Ikatan hidrogen antara O dan HO lebih kuat dari N dan HN, karena gugus OH lebih polar dari pada NH.
+ - +-
elektron tertarik terhadap inti lainnya
+ - + -
dipol terinduksi
CH3 N H H
: H
H N CH3
H k urang positif ik atan hidrogen lebih lemah
C 3
.. : H H O ..:
H H O C 3
H lebih positif ik atan hidrogen lebih k uat
O CH OH
OH HO OH H
H
H H OH
2
H
gluk osa larut dalam air
sik lohek sana tak larut dalam air
: H H
3 N
CH H O
H ..:
1 2
+
H H
orbital atom 1s orbital atom 1s
H H
orbital molek ul H2
Ikatan hidrogen antara dua senyawa yang berbeda. Ada lebih dari satu kemungkinan pembentukan ikatan hidrogen.
Pengaruh Ikatan Hidrogen
Titik Didih
Senyawa dengan berat molekul yang sama, titik didihnya dapat berbeda karena adanya ikatan hidrogen. Etanol (CH3CH2OH) dan dimetil eter (CH3OCH3) mempunyai berat molekul yang sama.
Etanol mempunyai titik didih yang jauh lebih tinggi dari pada dimetil eter. Hal ini disebabkan antar molekul etanol dapat membentuk ikatan hidrogen, sedangkan dimetil eter tidak dapat membentuk ikatan hidrogen antar molekulnya.
Kelarutan
Senyawa yang dapat membentuk ikatan hidrogen dengan air, lebih mudah larut dalam air.
Glukosa mengandung banyak gugus OH dan larut baik dalam air. Sikloheksana tidak dapat membentuk ikatan hidrogen dengan air dan tidak dapat memecah ikatan hidrogen dalam air, sehingga sikloheksana tidak larut dalam air.
Soal Latihan 1.8.
Tunjukkan semua jenis ikatan hidrogen (bila ada) yang ditemukan dalam senyawa berikut.
a. CH3CH2CH2NH2 cair b. larutan CH3OH dalam H2O c. CH3CH2OCH2CH3 d. larutan CH3OCH3 dalam H2O 2.8 Ikatan Sigma dan Ikatan Pi
Ikatan kovalen dihasilkan karena pembentukan orbital molekul yang terjadi akibat satu orbital atom bertumpang tindih dengan orbital atom dari atom lain.
Tumpang tindih orbital antara atom menghasilkan orbital molekul. Ada 2 cara orbital atom saling bertumpang tindih, yaitu :
a. Tumpang tindih ujung-ujung, menghasilkan orbital molekul sigma, ikatannya isebut ikatan sigma (σ).
b. Tumpang tindih sisi-sisi, menghasilkan orbital molekul pi (π), ikatannya disebut ikatan pi (π).
Pembentukan orbital molekul ikatan antara 2 atom hidrogen membentuk ikatan σ disajikan pada Gambar 1.3.
Gambar 1.3. Pembentukan orbital molekul ikatan antara 2 atom hidrogen membentuk ikatan σ
3
CH CH2
H O..: CH CH2 O..
: H
3
etanol t.d 78,5oC ik atan hidrogen
CH CH O..
:
3 3 dimetil eter t.d. -23oC tidak ada H untuk pembentuk an ik atan hidrogen
H H
H C H H C C H H H
H H
k arbon sp3
H C C H
H H
k arbon sp2
H C C H
k arbon sp
H H H
C C C H
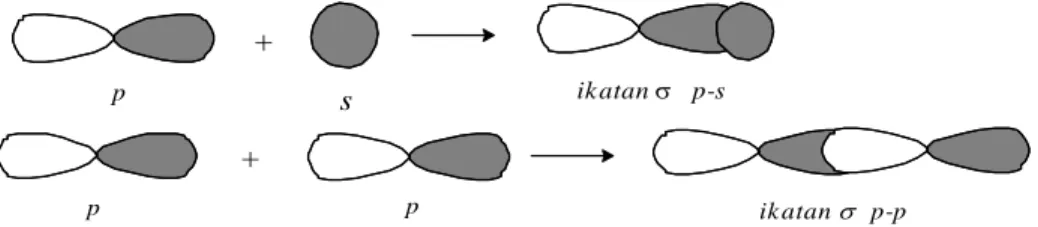
Tumpang tindih orbital yang menghasilkan ikatan σ antara orbital p dan s dan orbital p dan p ditampilkan pada Gambar 1.4.
Gambar 1.4. Tumpang tindih orbital s dan p serta pdan p yang menghasilkan ikatan sigma 2.9 Orbital Hibrida Karbon
Bila atom hidrogen menjadi bagian dari suatu molekul, maka digunakan orbital arom 1s untuk ikatan. Karbon dengan konfigurasi 1s2 2s2 2p2 mempunyai elektron valensi 4 yang merupakan elektron ikatan. Atom karbon tidak menggunakan keempat orbitalnya secara murni untuk ikatan, tetapi bercampur (hibridisasi) menurut satu dari tiga cara berikut:
1. hibridisasi sp3, digunakan untuk membentuk 4 ikatan tunggal
2. hibridisasi sp2, untuk membentuk ikatan rangkap
3. hibridisasi sp, untuk membetuk ikatan ganda tiga atau ikatan rangkap terakumulasi.
Hibridisasi memberikan ikatan yang lebih kuat karena tumpang tindih lebih besar sehingga menghasilkan molekul berenergi lebih rendah yang lebih stabil.
2.9.1 Hibridisasi sp3
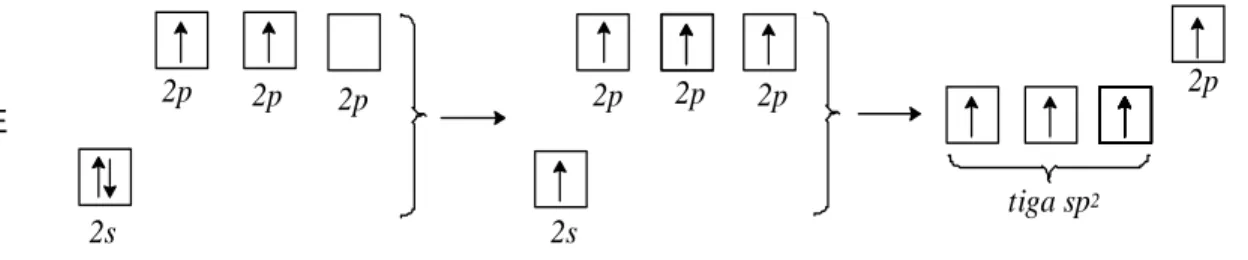
Dari bukti eksperimental, bentuk molekul metana (CH4) adalah tetrahedral. Panjang ikatan C- H dan sudut ikatan H-C-H besarnya sama; artinya keempat ikatan ekivalen. Hal ini timbul dari hibridisasi lengkap keempat orbital atomnya (1 orbital 2s dan 3 orbital 2p) sehingga menghasilkan 4 orbital sp3 yang ekivalen. Agar ini dapat terjadi, satu elektron dari 2s ditingkatkan ke orbital 2p yang kosong, kemudian bergabung menjadi 4 orbital sp3 dengan energi yang sama (agak lebih tinggi dari 2s tetapi agak lebih rendah dari 2p). Masing-masing orbital sp3 mengandung satu elektron untuk ikatan.
Pembentukan orbital sp3 digambarkan dengan diagram orbital, setiap kotak menyatakan orbital,elektron dinyatakan oleh panah, arah panah merupakan arah spin elektron.
+
p s ik atan σ p-s
+
p p ik atan σ p-p
empat sp3 orbital yang digunak an untuk ik atan e ditingkatkan
2p 2p 2p
2s
2p 2p 2p
2s
orbital atom C (orbital non-ikatan 1s yang terisi tidak ditunjukkan)
E
C
C
H
H H
H satu e dalam setiap orbital
atom atau orbital hibrida
- dua e dalam setiap orbital
molekul - H
H H
H
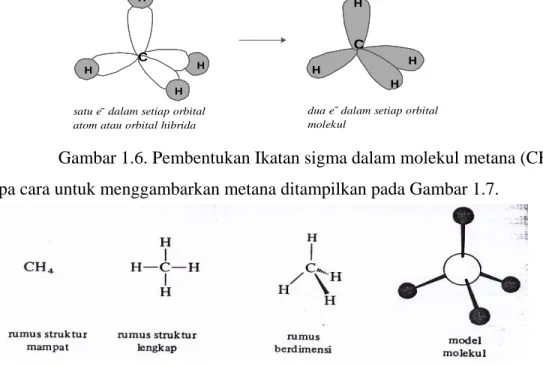
Pencampuran orbital 2s dan 2p membentuk orbital sp3 menghasilkan bentuk seperti bola bowling dengan simpul pada inti. Cuping besar digunakan untuk tumpang tindih dengan orbital dari atom yang lain, cuping kecil tidak digunakan untuk ikatan. Empat orbital hibrida sp3 mengelilingi inti karbon dengan geometri dari ikatan berbentuk tetrahedral. (Gambar 1. 5)
Gambar 1.5. orbital hibrida sp3 aton karbon
Dalam metana (CH4) masing-masing orbital sp3 dari karbon bertumpang tindih dengan orbital 1s dari hidrogen membentuk orbital molekul sp3-s yang simetris sekeliling sumbu yang lewat inti karbon dan hidrogen. Ikatan antara C dan H ini merupakan ikatan sigma. (Gambar 1.6.)
Gambar 1.6. Pembentukan Ikatan sigma dalam molekul metana (CH4) Beberapa cara untuk menggambarkan metana ditampilkan pada Gambar 1.7.
Gambar 1.7. beberapa cara untuk menggambarkan metana
Etana (CH3CH3) mengandung 2 atom karbon sp3. Kedua atom karbon in i membentuk ikatan sigma C-C dengan tumpang tindih satu orbital sp3 dari masing-masing karbon (iaktan sigma sp3- sp3). Masing-masing atom karbon mempunyai tiga orbital sp3 sisa, dan masing-masing tumpang tindih denganorbital 1s dari atom H membentuk ikatan sigma C-H. Masing-masing atom C dalam etana membentuk tetrahedral, seperti ditunjukkan dalam Gambar 1.8 dan 1. 9.
Gambar 1.8. Pembentukan Ikatan sigma sp3-sp3 dalam molekul etana (CH3CH3)
Gambar 1.9. Beberapa macam cara untuk menggambarkan etana
C C
ujung digunak an untuk ik atan
empat orbital sp3 satu orbital sp3
C
109,5o
C dengan 4 ik atan sp3
etana
H H H H H C C C
H H
H
sp3-sp3
masing-masing ik atan C-H sp3-s Contoh soal
Berikan rumus struktur lengkap (yang menunjukkan semua atom dan ikatan) untuk propana. Jenis orbital apa yang tumpang tindih membentuk masing-masing ikatan?
Penyelesaian
2.9.2 Hibridisasi sp2
Untuk membentuk orbital hibrida sp2, karbon berhibridisasi orbital 2s-nya hanya dengan dua orbital 2p-nya. Satu orbital p pada atom karbon tetap tak terhibridisasi. Karena tiga orbital atom digunakan untuk membentuk orbital sp2, maka dihasilkan tiga orbital hibrida sp2. Masing—masing orbital sp2 mempunyai bentuk yang sama seperti orbital sp3 dan mengandung satu elektron yang dapat digunakan untuk ikatan.
Tiga orbital sp2 terletak dalam satu bidang dengan sudut 120o, satu orbital p yang tidak terhibridisasi terletak tegak lurus pada bidang sp3. (lihat Gambar 1.10)
Gambar 1.10 karbon dalam keadaan hibridisasi sp2
Dalam etilena (CH2CH2) tumpang tindih satu orbital sp2 dari masing-masing atom karbon membentuk ikatan sigma C-C, dua orbital sp2 yang lain tumpang tindih dengan orbital 1s dari hidrogen membentuk ikatan sigma C-H. Setiap orbital p membentuk 2 cuping mengandung 1 elektron, tumpang tindih sisi terhadap sisi membentuk orbital ikatan yang merupakan ikatan pi.
(Gambar 1.11)
Gambar 1.11. Pembentukan ikatan sigma sp2-sp2 dan ikatan pi p-p dalam molekul etena Ikatan pi (π) :
hasil tumpang tindih orbital p, sisi terhadap sisi
mempunyai energi yang agak lebih tinggi dari pada ikatan sigma, agak kurang stabil dari pada ikatan σsp2-sp2. Ikatan pi merupakan kedudukan kereaktifan kimia.
2s
2p 2p 2p
2s 2p 2p 2p
tiga sp2
2p E
ikatan π
C
C H
H H
H
C H C
H
H
tumpang tindih tak ada tumpang tindih H
+ 68 kkal/mol
C C H
H
H
H C O
H H
H C O
OH
karbon-karbon sp2
H H H H
C H
H C C
sp3-s
sp2-s
sp2-sp2 sp3-sp2
dan p-p sp2-s
H C C H
C C H H
H H
C C C O
H H σ σ
π π
Dalam molekul CH2=CH2 energi disosiasi ikatan sigma adalah 95 kkal/mol, energi disosiasi ikatan pi 68 kkal/mol.
Beberapa molekul dengan orbital karbon hibrida sp2 antara lain sebagai berikut. Perhatikan bahwa ikatan rangkap C=O (gugus karbonil) juga memiliki orbital hibrida sp2.
Dalam rumus struktur, ikatan rangkap dinyatakan oleh dua garis identik. Perhatikan bahwa ikatan rangkap bukan identik yang sederhana, tetapi bahwa garis rangkap menggambarkan satu ikatan pi yang lemah.
Contoh soal
Jenis tumpang tindih apa yang terdapat dalam setiap ikatan CH3CH=CH2? Penyelesaian
Soal latihan 1.9
Tulis rumus struktur lengkap untuk masing-masing senyawa berikut, Jenis orbital apa yang tumpang tindih membentuk masing-masing ikatan?
a. (CH3)3CH b.CH2=C(CH3)2 c. CH2=CHCH=CH2 d.
2.9.3 Hibridisasi sp
Bila atom C dihubungkan hanya terhadap dua atom lainnya, seperti dalam asetilena ( ), keadaan hibridisasinya adalah sp. Dalam hal ini tinggal dua orbital 2p yang tidak
terhibridisasi, masing-masing dengan satu elektron.
E
2s
2p 2p 2p
2s 2p 2p
2p
dua sp
2p 2p
N H H
H H CH
H N
CH3 CH3
N CH 3
3 orbital sp yang terisi3
amonia amina
sp3-s sp3-sp3
CH3C C H
H C C H
C C
kedua orbital sp adalah linier kedua orbital p
sp sp
satu orbital sp
orbital sp yang kedua
90o
90o
orbital p saling tegak lurus dan tegak lurus terhadap orbital p
ikatan sigma orbital p dua ikatan phi
Kedua orbital sp terletak sejauh mungkin, dalam garis lurus dengan sudut 180o diantaranya.
Orbital p saling tegak lurus dan tegak lurus terhadap garis orbital sp. (Gambar 1.12)
Gambar 1.12. Karbon dalam keadaan orbital sp
Dalam asetilena, kedua atom karbon dihubungkan oleh ikatan sigma sp-sp. Masing-masing karbon juga terikat terhadap atom hidrogen oleh ikatan sigma sp-s. Kedua orbital p dari satu karbon kemudian bertumpang tindih dengan kedua orbital p dari karbon lain untuk membentuk dua ikatan pi, satu ikatan pi ada di atas dan di bawah ikatan sigma seperti ditunjukkan Gambar 1.13. Ikatan pi yang lain terletak di muka dan belakang.
Gambar 1.13. Ikatan dalam asetilena,
Soal latihan 1.10
Jenis tumpang tindih apa yang ada dalam masing-masing ikatan karbon-karbon dari ? 2.10 Orbital Hibrida Nitrogen
Secara elektronika nitrogen sama dengan karbon, dan orbital atom dari nitrogen berhibridisasi menurut cara yang sangat bersamaan dengan karbon.
Seperti ditunjukkan dalam diagram orbital di atas, perbedaan antara nitrogen dan karbon adalah satu orbital sp3 dari nitrogen sudah terisi dengan sepasang elektron, sehingga nitrogen hanya dapat membentuk tiga ikatan kovalen dengan atom lain. Amonia (NH3) mengandung atom nitrogen sp3 yang terkat pada 3 tom hidrogen. (Gambar 1.14)
Gambar 1.14. Ikatan dalam amonia dan dua amina E
empat orbital sp dari N3
2s
2p 2p 2p
H C C H CH3 C C H H C N satu ikatan σdan dua ikatan π
orbital terisi
3 O CH3 CH3
O H CH H
H O
air alkohol eter
sp - s3 sp - s3
C C C C
C C
atau atau mungkin
H H
H H
H H
A B C
Seperti halnya karbon, nitrogen juga dapat berhibridisasi sp2 dan sp. Perbedaan penting antara nitrogen dan karbon adalah satu orbital dari nitrogen terisi penuh sepasang elektron bebas.
2.11 Orbital Hibrida Oksigen
Oksigen berhibridisasi menurut cara yang sama dengan karbon dan nitrogen. Dua dari empat orbital hibrida sp3 dari oksigen sudah terisi sepasang elektron. Hibridisasi atom aksigen ditampilkan pada Gambar berikut.
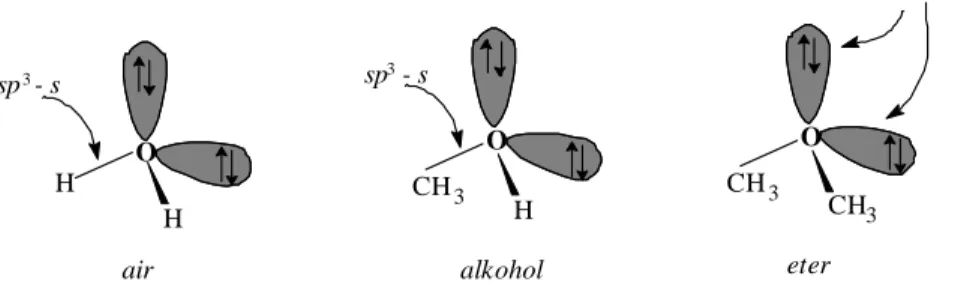
Alkohol dan eter yang analog dengan air, mengandung atom oksigen terhibridisasi sp3 dan mempunyai 2 pasang elektron valensi menyendiri, sperti ditunjukkan pada Gambar 1.14.
Gambar 1.15. ikatan dalam air, alkohol CH3OH dan eter CH3OCH3
2.12 Resonansi
Benzena adalah senyawa silkik dengan 6 atom karbon yang tergabung dalam cincin. Setiap atom karbon terhibridisasi sp2 dan cincinnya planar. Setiap atom karbon mengikat satu atom hidrogen dan setiap atom karbon juga mempunyai orbital p yang tidak terhibridisasi tegak lurus terhadap bidang ikatan σ dari cincin tersebut.
Gambar 1.16. Gambaran orbital p dari benzena
struktur ikatan σ penempatan ikatan π
(masing-masing C adalah sp2 (lingkaran menyatakan delokalisasi sempurna) dan mempunyai elektron p)
CH3CHC N: CH3
CH3CH Nsp2
..
sppandangan samping menunjuk k an orbital p
tumpang tidih sempurna
awan phi aromatik
2p 2p 2p
2s
empat orbital sp dari O3
E
X X..
X X
X.. X
CH3 N O
O O
O CH3 N
+
... .
. . .
. . .. .... .
+
- -
...
. ....
..- .. ..
+
O O CH3 N tetapi tidak
..
CH3C O..: :O:
c. - b. (CH3)3C+
a. CH3 C N:
struk tur nyata adalah gabungan dari dua struktur resonansi ini
....
-
-
+
....
.. .
. .
.
. . . ...
+
CH3 N O O O
O
CH3 N atau
O O CH3 N+
-
δ δ
-
Cl
a. CH3CHCHCH(CH3)2 b. H2O2
a. (CH3)2CHCHBrCH3 b. CH3CO2H c. CH3COCH3 d. H2C=CHCH=CHCN Dengan 6 elektron p, benzena mengandung 3 ikatan π yang dapat digambarkan menurut trumus A atau B, dimana ikatannya bergantian antara ikatan tunggal dan ikatan rangkap. Telah diketahui bahwa ikatan karbon-karbon dalam cincin benzena mempunyai panjang ikatan yang sama, berarti tidak mengandung ikatan tunggal dan rangkap yang saling bergantian. Disimpulkan bahwa keenam elektron pi terdelokalisasi sempurna dalam awan muatan elektron yang berbentuk seperti kue donat yang disebut awan pi aromatik.
Untuk menggambarkan distribusi elektron pi dalam benzena, digunakan rumus Kekule (1972) dimana kedua struktur dalam resonansi yang satu dengan yang lain. Struktur Kekule dusebut juga sebagai lambang resonansi atau struktur resonansi untuk benzena.
struktur resonansi benzena (rumus Kekule)
Struktur nyata benzena tidak bergeser antara 2 struktur yang berbeda tetapi merupakan hibrida resonansi dari dua struktur resonansi. Untuk menyatakan benzena juga digunakan segienam dengan lingkaran di dalamnya yang menyatakan awan pi aromatik.
Pergeseran Elektron
Benzena bukan satu-satunya yang rumus ikatan valensi tunggalnya kurang cocok. Gugus nitro (-NO2) adalah salah satu contoh yang baik untuk diterangkan struktur resonansinya.
Bila menulis struktur resonansi, inti-inti atom sebuah molekul tidak bertukar posisi, hanya elektron yang terdelokalisasi. Perlu diingat juga bahwa hanya elektron pi atau elektron bebas saja yang dapat terdelokalisasi.
Pergeseran dapat terjadi dengan cara sebagai berikut :
Dari suatu ikatan phi ke sebuah atom disebelahnya :
Dari suatu ikatan phi ke posisi ikatan sebelahnya :
Dari suatu atom ke posisi ikatan sebelahnya : Contoh :
Soal Untuk Dipelajari
1. Berikan rumus Lewis (rumus bintik elektron) untuk setiap struktur berikut.
2. Berikan rumus struktur lengkap (dengan menunjukkan masing-masing atom dengan menggunakan garis ikatan) untuk setiap rumus mampat senyawa berikut ini.
3. Hitung muatan formal semua atom kecuali H dalam struktur berikut ini.
c. H:C:N:C:H..
..
..
.. ..
..
H H H
H H
H
H C C N H
: H H b.
H
H C O H H
..
..
a.
a. CH3CH2 Cl b. H OH c. H NH2 d. CH3 OH e. CH3O H
a. CH3CH2CH2CH2OH atau (CH3)3COH b. HOCH2CH2OH atau CH3CH2CH2OH a. C Br b. C O c. C Cl d. C H
a. (CH3)2NH b. CH3CH2OCH3 c. (CH3)3N
d. CH3CH2F e. (CH3)2C=O f. CH3OCH2CH2OH 4. Tuliskan struktur mampat untuk setiap struktur berikut.
5. Tuliskan rumus struktur lengkap dan tunjukkan pasangan elektron valensi menyendiri (bila ada) untuk senyawa berikut ini.
a. CH3NH2 b. (CH3)3N c. (CH3)3NH+ d. (CH3)3COH e. CH2=CH2 f. H2C=O
6. Gambarkan poligon dan rumus struktur untuk sistem cincin karbon yang mengandung enam karbon cincin dan ikatan rangkap
7. Ujung mana yang positif dan mana yang negatif dari dipol setiap ikatan berikut ini
8. Tuliskan pemaksapisahan homolitik dan heterolitik senyawa berikut. (Terapkan pengetahuan anda mengenai keelektronegatifan dalam pemaksapisahan dan tunjukkan gerakan elektron dengan panah melengkung).
9. Gambarkan struktur untuk menunjukkan ikatan hidrogen (bila ada) dalam senyawa berikut ini
10. Tunjukkan semua jenis ikatan hidrogen dari (CH3)2NH dalam air. Yang mana merupakan ikatan hidrogen terkuat?
11. Senyawa mana yang diharapkan memiliki titik didih tertinggi? Jelaskan.
12. Dietil eter, CH3CH2OCH2CH3 dan 1-butanol CH3CH2CH2CH2OH, dua-duanya larut dalam air, tetapi titik didih 1-butanol adalah 83o lebih tinggi dari pada dietil eter. Jelaskan mengapa demikian.
3. Penutup 3.1. Rangkuman
Sifat-sifat fisika senyawa ditentukan oleh struktur molekul dan jenis ikatan kimianya. Untuk dapat menuliskan struktur molekul dapat dimulai dari konfigurasi elektron masing-masing atom penyusunnya.
3. 2. Test Mandiri
1. Gambarkan struktur titik elektron (struktur Lewis) untuk CCl2F2.
2. Gunakakan panah bersilang untuk menunjukkan arah momen ikatan senyawa berikut untuk struktur H3C-OH.
3. Hitung muatan formal semua atom kecuali H dalam struktur berikut ini.
a. amonia (NH3) b. CH3COO-
4. Untuk setiap rumus ini, tuliskan rumus yang lebih dimampatkan
5. Tuliskan rumus struktur lengkap untuk senyawa berikut ini (tunjukkan semua ikatan dengan garis dan pasangan elektron bebas jika ada) untuk senyawa: H2C=O
6. Tunjukkan semua jenis ikatan hidrogen (bila ada) yang ditemukan dalam senyawa berikut.
a. larutan CH3OH dalam H2O b. CH3CH2OCH2CH3 dalam air
7. Tulis rumus struktur lengkap untuk masing-masing senyawa berikut dan jenis orbital yang tumpang tindih membentuk masing-masing ikatan senyawa CH2=C(CH3)2.
4. Pustaka
a. Fessenden, R.J. dan J. S. Fessenden, 1986, Organic Chemistry 3rd edition. Wadsworth, Inc., Belmont, California. Alih bahasa : Pudjatmaka, A.H. 1999, Kimia Organik. Penerbit Erlangga, Jakarta, Jilid 1
b. Solomons, T.W.G., 1988, Organic Chemistry 3 rd edition, John Wiley & Sons, Inc., New York c. Hart, H., L.E. Craine dan D.J. Hart, 2003, Organic Chemistry 11th edition. Wadsworth, Inc.,
Belmont, California. Alih bahasa : Suminar S.A., 2003, Kimia Organik, edisi 11, Penerbit Erlangga, Jakarta
C C CH3 CH3 CH3
CH3 a. CH3CH2CH2CH2CHCH2Cl b.
Cl
BABII TATANAMA
1. Pendahuluan 1.1. Deskripsi
Bab kedua ini membahas tentang tata nama dan bagaimana cara memberi nama senyawa organik menggunakan sistem IUPAC dan sistem trivial (lazim).
1.2. Manfaat/ Relevansi
Mengingat semua reaksi kimia berhubungan dengan beberapa senyawa yang berbeda,maka mahasiswa memerlukan pemahaman tentang cara pemberian nama senyawa organik.
1.3. Tujuan Instruksional Khusus (TIK)
Setelah membaca bab II ini, mahasiswa mampu memberi nama senyawa organik menurut sistem IUPAC dan trivial dan sebaliknya mampu menuliskan rumus kimianya bila diketahui namanya.
1.4. Petunjuk Mempelajari
a. Baca dan pahami semua yang ada dalam bab ini dengan teliti.
b. Tingkatkan pemahaman dengan menambah bahan bacaan lain yang relevan.
c. Diskusi dengan teman untuk meningkatkan pemahaman.
d. Berlatih dengan tekun untuk meningkatkan pemahaman.
e. Jika ada kesulitan, bertanya kepada dosen atau narasumber lain yang relevan.
2. Penyajian
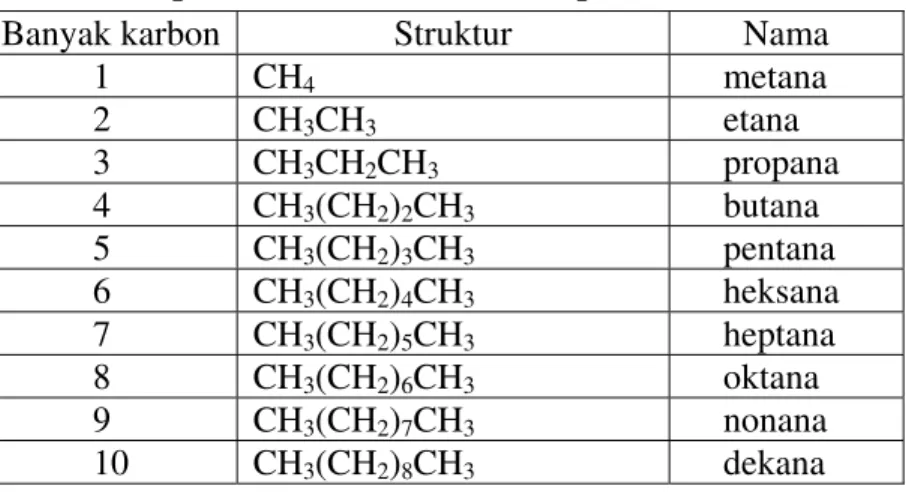
2.1Tata nama Alkana 2.1.1 Alkana Rantai Lurus
Dasar sistem IUPAC adalah nama alkana rantai lurus. Struktur dan nama sepuluh alkana rantai lurus yang pertama dicantumkan dalam Tabel 2.1. Senyawa dalam Tabel 2.1 ditata sedemikian sehingga mereka berbeda dari tetangga dekatnya hanya oleh suatu gugus metilena (CH2). Pengelompokan senyawa semacam itu disebut deret homolog.
Tabel 2.1 Sepuluh alkana rantai lurus pertama
Banyak karbon Struktur Nama
1 CH4 metana
2 CH3CH3 etana
3 CH3CH2CH3 propana
4 CH3(CH2)2CH3 butana
5 CH3(CH2)3CH3 pentana 6 CH3(CH2)4CH3 heksana 7 CH3(CH2)5CH3 heptana 8 CH3(CH2)6CH3 oktana 9 CH3(CH2)7CH3 nonana 10 CH3(CH2)8CH3 dekana 2.1.2 Alkana Bercabang
Suatu rantai samping atau cabang yang merupakan alkana rantai lurus, dinamai menurut nama alkana itu sendiri dengan mengubah akhiran –ana menjadi –il (CH4 adalah metana, maka gugus - CH3 adalah gugus metil; CH3CH3 adalah etana, maka gugus –CH2CH3 adalah gugus etil dan seterusnya).
Prosedur umum dalam menamai alkana bercabang, adalah sebagai berikut:
Cari rantai lurus terpanjang sebagai induk, namailah rantai ini.
Nomori rantai induk, dimulai dari ujung terdekat cabang
Kenali cabang dan posoisinya
Lekatkan nomor dan nama cabang pada nama induknya
CH3CH2CH2
propil (n-propil)
CH3CH2CH2CH2
butil (n-butil)
1 2 3
4 5 6 7 8
C C C C C C C C C C
CH3
CH3CH2CHCHCH2CH2CH3 CH2CH3
4-etil-3-metilheptana
2,2-dimetilpentana CH3CCH2CH2CH3
CH3
CH3
CH3CH CH3
isopropil
CH3 CH3CHCH2
isobutil
metil bercabang ujung
Contoh Soal
Beri nama senyawa berikut ini.
CH2CH2CH3 CH3CH2CHCHCH2CH2CH3
Penyelesaian:
rantai lurus terpanjang terdiri dari 8 atom. Jadi nama induk oktana. Penomoran:
gugus alkil: etil pada karbon no. 4
nama: 4-etiloktana
Soal latihan 2.1
a. Tulis struktur 3-metilpentana
b. Sebutkan nama dari struktur berikut ini. Dalam nama ini ternyata tidak diperlukan nomor awalan. Mengapa? (CH3)2CHCH2CH3
2.1.3 Alkana dengan Cabang Ganda
Rantai-rantai cabang merupakan nama awalan yang diurutkan secara alfabet (nama dalam bahasa Inggris). Contoh:
Bila 2 cabang atau lebih merupakan jumlah karbon yang sama, maka diberi awalan di, tri dan seterusnya.
Contoh Soal
Beri nama senyawa berikut ini
CH(CH3)2 CH3CH2CH2CHCHCH2CH3
CH(CH3)2
Penyelesaian:
Nama: 4,5-diisopropilheptana
2.1.4 Alkana dengan Rantai Samping Bercabang
Cabang 3 karbon
Awalan iso menyatakan suatu cabang metil pada ujung rantai alkil.
Cabang 4 karbon
Gugus isobutil mempunyai cabang metil pada ujung rantai